Структурные формулы кислот
реклама
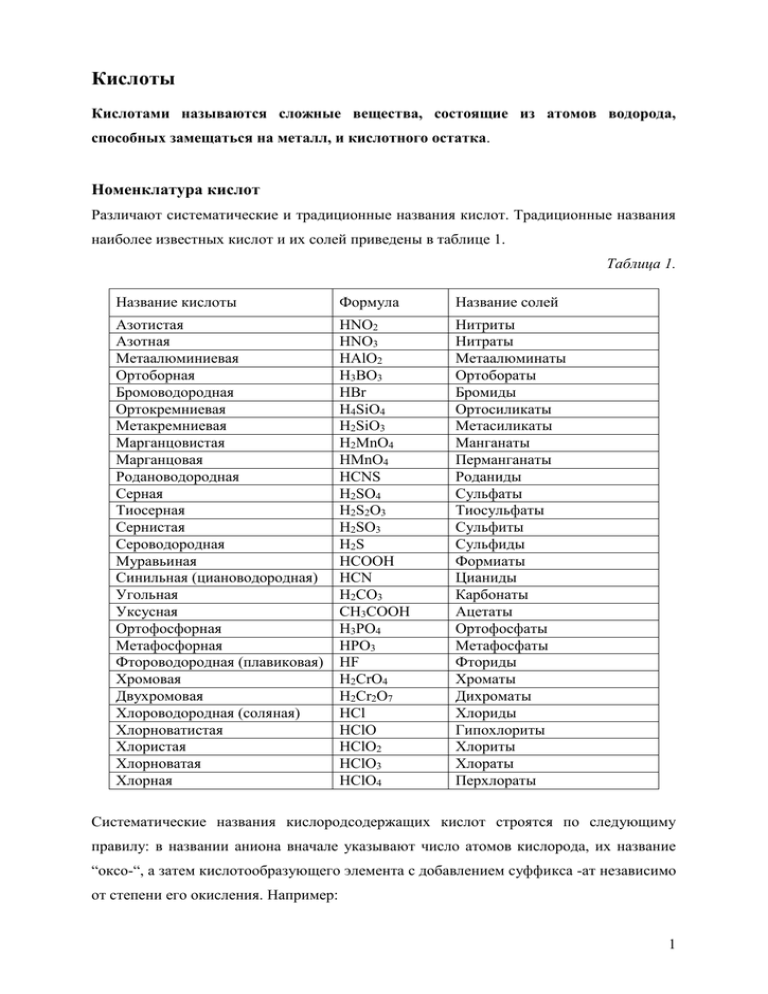
Кислоты Кислотами называются сложные вещества, состоящие из атомов водорода, способных замещаться на металл, и кислотного остатка. Номенклатура кислот Различают систематические и традиционные названия кислот. Традиционные названия наиболее известных кислот и их солей приведены в таблице 1. Таблица 1. Название кислоты Формула Название солей Азотистая Азотная Метаалюминиевая Ортоборная Бромоводородная Ортокремниевая Метакремниевая Марганцовистая Марганцовая Родановодородная Серная Тиосерная Сернистая Сероводородная Муравьиная Синильная (циановодородная) Угольная Уксусная Ортофосфорная Метафосфорная Фтороводородная (плавиковая) Хромовая Двухромовая Хлороводородная (соляная) Хлорноватистая Хлористая Хлорноватая Хлорная HNO2 HNO3 HAlO2 H3BO3 HBr H4SiO4 H2SiO3 H2MnO4 HMnO4 HCNS H2SO4 H2S2O3 H2SO3 H2S HCOOH HCN H2CO3 CH3COOH H3PO4 HPO3 HF H2CrO4 H2Cr2O7 HCl HClO HClO2 HClO3 HClO4 Нитриты Нитраты Метаалюминаты Ортобораты Бромиды Ортосиликаты Метасиликаты Манганаты Перманганаты Роданиды Сульфаты Тиосульфаты Сульфиты Сульфиды Формиаты Цианиды Карбонаты Ацетаты Ортофосфаты Метафосфаты Фториды Хроматы Дихроматы Хлориды Гипохлориты Хлориты Хлораты Перхлораты Систематические названия кислородсодержащих кислот строятся по следующиму правилу: в названии аниона вначале указывают число атомов кислорода, их название “оксо-“, а затем кислотообразующего элемента с добавлением суффикса -ат независимо от степени его окисления. Например: 1 H2SO4 - тетраоксосульфат (VI) водорода H2SO3 – триоксосульфат (IV) водорода H3PO4 – тетраоксофосфат (V) водорода При образовании названий кислот, содержащих в своем составе два или более атомов кислотообразующего элемента, употребляют приставки, обозначающие количество атомов кислотообразующего элемента: ди-, три-, тетра- и т.д. Например: H2S2O7 – дисерная кислота H2Cr2O7 – дихромовая кислота H2B4O7 – тетраборная кислота Названия бескислородных кислот образуют от названия кислотообразующего элемента, прибавляя окончание -водородная. Например: HCl – хлороводородная кислота H2S – сероводородная кислота Классификация кислот Кислоты классифицируют по ряду признаков. I. по составу По составу кислоты делятся на кислородсодержащие и бескислородные, а по числу содержащихся в них атомов водорода, способных замещаться на металл, - на одноосновные, двуосновные и трехосновные. Кислоты Бескислородные HF, HCl, HBr, HJ, H2S, HCN, HCNS и другие Кислородсодержащие H2SO4, H2SO3, HNO3, H3PO4, H2SiO3 и другие 2 II. по основности Основностью кислот называется число атомов водорода, способных замещаться на металл. Кислоты Одноосновные Двухосновные Трехосновные HF, HBr, HJ, HNO2, HNO3, HAlO2, HCN и другие Н2SO4, H2SO3, H2S, H2CO3 и другие H3PO4 III. по силе Кислоты Сильные НCl, HBr, HJ, H2SO4, HNO3, HMnO4, HClO4, HClO3, H2Cr2O7, H2S2O3 и другие Слабые HF, HNO2, H2SO3, H2CO3, H2SiO3, H2S, H3BO3, HCN и другие; все органические кислоты Структурные формулы кислот При составлении структурных формул бескислородных кислот следует учитывать, что в молекулах этих кислот атомы водорода связаны с атомом неметалла: H – Cl. При составлении структурных формул кислородсодержащих кислот нужно помнить, что водород с центральным атомом связан посредством атомов кислорода. Если, например, требуется составить структурные формулы серной и ортофосфорной кислот, то поступают так: 3 a) пишут один под другим атомы водорода данной кислоты. Затем через атомы кислорода черточками связывают их с центральным атомом: b) к центральному атому (с учетом валентности) присоединяют остальные атомы кислорода: Способы получения кислот показаны на схеме. Физические свойства Многие кислоты, например серная, азотная, соляная - это бесцветные жидкости. Известны также твердые кислоты: ортофосфорная H3PO4, метафосфорная HPO3. Почти все кислоты растворимы в воде. Пример нерастворимой кислоты – кремниевая H2SiO3. 4 Растворы кислот имеют кислый вкус. Так, например, многим плодам придают кислый вкус содержащиеся в них кислоты. Отсюда и название кислот: яблочная, лимонная и т.д. Химические свойства В обобщенном виде химические свойства кислот рассмотрены в таблице 2. В таблице приведены уравнения реакций, относящиеся к реакциям обмена. Следует учесть, что реакции обмена в растворах протекают до конца в следующих трех случаях: 1. если в результате реакции образуется вода, например в реакции нейтрализации; 2. если один из продуктов реакции – летучее вещество, например, серная кислота вытесняет из солей хлороводородную кислоту, потому что она более летуча; 3. если один из продуктов реакции выпадает в осадок, например, в реакции получения нерастворимых оснований. Таблица 2. Вещества, с которыми реагируют кислоты 1.С индикаторами 2. С металлами. Если металл находится в ряду активности металлов левее водорода, то выделяется водород и образуется соль. Исключение HNO3 и конц.H2SO4 3. С основными оксидами. Образуется соль и вода 4. С основаниями – реакция нейтрализации. Образуется соль и вода 5. С солями. В соответствии с рядом кислот (каждая предыдущая кислота может вытеснить из соли последующую: Примеры Лакмус становится красным Метиловый оранжевый становится розовым Фенолфталиновый становится бесцветным Zn + 2HCl → ZnCl2 + H2↑ t CuO + H2SO4 → CuSO4 + H2O основание + кислота → соль + вода NaOH + HCl → NaCl + H2O Na2CO3 + HCl → NaCl + H2O + CO2 ↑ t ZnCl2 (кр) + H2SO4(конц) → ZnSO4 + 2HCl↑ HNO3 H2SO4, HCl, H2SO3, H2CO3,H2S, H2SiO3 * H3PO4 t 6. При нагревании некоторые H2SiO3 → H2O + SiO2 кислоты разлагаются. Как правило, образуются кислотный оксид и вода * Этот ряд условный. Однако в большинстве случаев реакции между кислотами и солями протекают согласно этому ряду. 5 Вопросы и задания 1. Какие вещества называются кислотами? 2. Составьте структурные формулы следующих кислот: а) угольной; б) бромоводородной; в) сернистой; г) хлорной HClO4 3. Какими способами получают кислоты? 4. Какими двумя способами можно получить: а) ортофосфорную кислоту; б) сероводородную кислоту? Напишите уравнения соответствующих реакций. 5. Начертите нижеприведенную таблицу. В соответствующих графах запишите по три уравнения реакций, в которых участвуют и образуются кислоты. Реакции разложения соединения замещения обмена 6. Приведите по три примера уравнения химических реакций, характеризующих химические свойства кислот. Отметьте, к какому типу реакций они относятся. 7. Какие из веществ, формулы которых приведены, реагируют с соляной кислотой: а) CuO; б) Cu; в) Cu(OH)2; г) Ag; д) Al(OH)3? Напишите уравнения реакций, которые осуществимы. 8. Даны схемы: Напишите уравнения реакций, которые осуществимы. 9. Какие кислоты могут быть получены при взаимодействии оксидов P2O5, Cl2O, SO2, N2O3, SO3 с водой? 10. Напишите формулы и названия кислот, соответствующие следующим кислотным оксидам: CO2, P2O5, Mn2O7, CrO3, SiO2, V2O5, Cl2O7. 6