СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ РАЗЛИЧНЫХ СОРБЕНТОВ ДЛЯ ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ ЛИЗОЦИМА
реклама

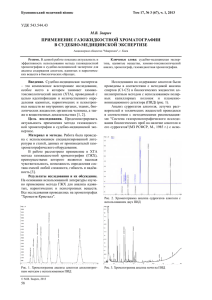
СРАВНИТЕЛЬНОЕ ИССЛЕДОВАНИЕ ЭФФЕКТИВНОСТИ РАЗЛИЧНЫХ СОРБЕНТОВ ДЛЯ ХРОМАТОГРАФИЧЕСКОГО ВЫДЕЛЕНИЯ И ОЧИСТКИ ЛИЗОЦИМА Карнаухова Ирина Владимировна канд. биол. наук, доцент ОГПУ, РФ, г. Оренбург Шукшина Светлана Сергеевна канд. биол. наук, доцент ОГПУ, РФ, г. Оренбург E-mail: Aelriel@yandex.ru Урманцева Альмира Нажиловна студент 5 курса факультета «Институт естествознания и экономики», ФГБОУ ВПО Оренбургский государственный педагогический университет, РФ, г. Оренбург E-mail: amiashka@mail.ru COMPARATIVE EFFECTIVENESS RESEARCH OF VARIOUS SORBING AGENTS FOR CHROMATOGRAPHICAL DISENGAGEMENT AND PURIFICATION OF LYSOZYME Karnauhova Irina candidate of biological sciences, associate professor of Orenburg State Pedagogical University, Russia, Orenburg Shukshina Svetlana candidate of biological sciences, associate professor of Orenburg State Pedagogical University, Russia, Orenburg Urmantseva Almira student 5 courses of the faculty of Science and Institute of Economics Orenburg State Pedagogical University, Russia, Orenburg АННОТАЦИЯ Работа была проведена с целью выявления более эффективного метода выделения и очистки лизоцима. Сравнение эффективности аффинной и катионообменной хроматографии осуществляли по следующим показателям: степень очистки, количество выделенного фермента, степень загрязненности солями. Метод хроматографии на хитине по сравнению с хроматографией на карбоксиметилцеллюлозе является более дешевым, позволяет получить большее количество фермента, при этом фермент получается незагрязненным солями. ABSTRACT The work is made in order to identify a more effective method for disengagement and purification of lysozyme. Comparison of effectiveness of affine and cation exchange chromatography is performed according to the following parameters: the degree of purification, the number of isolated enzyme, the degree of salt contamination. Chromatography method based on chitin is cheaper in comparison with chromatography based on carboxymethyl cellulose that allows resuming a larger amount of enzyme, wherein the enzyme is obtained by uncontaminated salts. Ключевые слова: лизоцим; хитин; карбоксиметилцеллюлоза. Keywords: lysozyme; chitin; carboxymethyl. Лизоцим является первым барьерным ферментом для бактерий, попадающих из окружающей среды различными путями в любой живой организм, в том числе и в организм двустворчатых моллюсков, являющихся фильтраторами придонных слоев воды в водоемах [1, с. 58]. Бактерии, попадающие в мантийную полость моллюсков должны своевременно элюминироваться. В случае если этого не происходит, снижается жизнеспособность двустворчатых моллюсков вследствие снижения лизоцимной активности. Такова же роль данного фермента и в организме человека. Лизоцим в разных концентрациях обнаружен в селезенке, сердце, печени, легком, в различных секреторных выделениях (слезы, слизь носа, слюна), в белке яйца, в соках некоторых растений, у микроорганизмов и бактериофагов [2, с. 35]. В настоящее время известно множество медицинских препаратов, действующим веществом которых является лизоцим. К таковым относятся, например, гексализ, бифилиз, лизобакт. Для выделения данного фермента в чистом виде активно применяют жидкостную ионно-обменную хроматографию. Из литературных данных известно о выделении лизоцима и последующей его очистки из разных биологических объектов (растений, бактерий, насекомых, грибов). Исторически более ранним методом является сорбция и последующая очистка лизоцима на хитине. Специфическая сорбция на хитине является эффективным методом очистки данного фермента [4, с. 114]. Также из литературы известно о способе выделения лизоцима на карбоксиметилцеллюлозе, которая является более эффективным сорбентом по сравнению с другими (агароза, декстранты) при катионообменной хроматографии [6, с. 652]. В связи с вышеприведенными данными представилось актуальным провести сравнительный анализ эффективности аффинной хроматографии на хитине и ионообменной хроматографии на карбоксиметилцеллюлозе для очистки лизоцима двустворчатых моллюсков Unio pictorum. Материалы и методы исследования Материалом для исследования послужили ткани U. pictorum, полученные при растирании на холоду с кварцевым песком в 0,1 М фосфатном буферном растворе (рН 6,2) [5, с. 42]. Для хроматографии использовали колонку (2,0×20 см), заполненную в случае катионообменной хроматографии карбоксиметилцеллюлозой, уравновешенную 0,1 М ацето-аммонийным буфером (рН 5,0), а в случае аффинной хроматографии — хитиновым сорбентом, суспензированным в 0,1 М фосфатном буфере (рН 8,5). При хроматографии на карбоксиметилцеллюлозе лизоцим десорбировали 0,8М ацетатом аммония (рН 4,5). Собирали фракции объемом по 2 мл (20 фракций). Во всех фракциях определяли содержание белка [5, c. 43]. При хроматографии на хитине колонку промывали тем же буфером объемом 200 мл, а затем дистиллированной водой. Лизоцим элюировали 5 %-ной уксусной кислотой. Собирали фракции объемом 5 мл. Во всех фракциях определяли содержание белка [4, c. 52]. Содержание белка в экстрактах определяли по методу Брэдфорда. В элюатах содержание белка определяли спектрофотометрическим методом по Варбургу и Кристиану на цифровом СФ PD — 303 UV. Исследуемые пробы фотометрировали при 260 и 280 нм. Расчет концентрации белка (мг/мл) производили по формуле [3, с. 362]: Cбелка = 1,55×D280 – 0,76×D260, где D280 — оптическая плотность при 280 нм; D260 — оптическая плотность при 260 нм. Результаты и их обсуждение Проводимые опыты показали хорошую воспроизводимость методов. Белок постоянно выходил одним пиком и на хитине — фракции 8—12(рис. 1.а.), и на карбоксиметилцеллюлозе — фракции 8—10 (рис. 1.б.). В этих же фракциях была локализована лизоцимная активность. На рисунке 1 отражены результаты хроматографии супернатанта тканей U. рictorum. Рисунок 1. Выделение лизоцима моллюсков U. pictorum на колонке с хитином (а) и на колонке с карбоксиметилцеллюлозой (б) Поскольку карбоксиметилцеллюлоза обратимо связывается только с лизоцимом — проявляется четкая специфичность данного соединения к анализируемому ферменту, следовательно, можно предположить, что в полученных фракциях содержится достаточно очищенный лизоцим. Максимальное содержание белка отмечено во фракциях № 8—№ 10, которое в среднем составляет 1200 мкг/мл. Учитывая, что содержание общего белка в экстрактах тканей моллюсков до очистки составляет 12000 мкг/мл, при использовании ионообменной хроматографии был получен препарат, очищенный в 10 раз. При хроматографии на хитине максимальная концентрация белка была отмечена во фракциях № 8—№ 12, которая в среднем составляет 1000 мкг/мл. Таким образом, с помощью аффинной хроматографии был получен препарат, очищенный в 12 раз. Метод аффинной хроматографии позволяет более полно выделить лизоцим из экстрактов двустворчатого моллюска U. pictorum, по сравнению с методом ионообменной хроматографии. При хроматографии на карбоксиметилцеллюлозе белок более концентрированный (200 мкг/мл), активность локализована в 6 мл. При хроматографии на хитине получаются менее концентрированные препараты (30—40 мкг/мл), активность локализована в 25 мл. Выделение и очистка фермента методом хроматографии на карбоксиметилцеллюлозе предполагает присутствие солей в элюатах, что не наблюдается при хроматографии на хитине. Следовательно, для выделения лизоцима моллюсков из данных сорбентов наиболее подходящим является хитин, т.к. лизоцим моллюсков чувствителен к ионной силе раствора. Выводы Метод хроматографии на хитине по сравнению с хроматографией на карбоксиметилцеллюлозе является более дешевым, позволяет получить большее количество фермента, при этом фермент получается незагрязненным солями. Список литературы: 1. Алехина Г.П., Мисетов И.А. Влияние поллютантов различной химической природы на микрофлору внутренних органов двустворчатого моллюска Unio pictorum // Вестник ОГУ. — № 10(146). — 2012. — с. 58—60. 2. Бухарин О.В., Васильев Н.В. Лизоцим и его роль в биологии и медицине. Томск: ТГУ, 1991. — 208 с. 3. Герхардт Ф. Методы общей бактериологии: в 3-х т. М.: Мир, — 1984. — Т. 2. — 472 с. 4. Карнаухова И.В. Лизоцимный фактор пресноводного двустворчатого моллюска Unio pictorum: выделение, характеристика, функции: дис. … канд. биол. наук. Пермь, 2000. — 110 с. 5. Минакова В.В. Двустворчатые моллюски родов Unio и Anadonta — компоненты биологических ресурсов р. Урал и участие их лизоцима в процессах регуляции бактериоценозов: автореф. дис. Оренбург, 2005. — 169 с. 6. Bachali S., Jager M., Jolles P. Philogenetic analysis of invertebrate lysozymes and the evolution of lysozyme function // J. Mol. Evol., — 2002. — v. 54. — р. 652— 664.