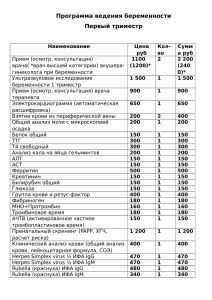
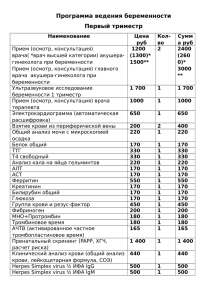
ПРИМЕНЕНИЕ ИММУНОФЕРМЕНТНОГО АНАЛИЗА ДЛЯ
реклама

УДК 619:616.981.42.636.0 ПРИМЕНЕНИЕ ИММУНОФЕРМЕНТНОГО АНАЛИЗА ДЛЯ ДИАГНОСТИКИ ХЛАМИДИОЗА КРС Евстифеев В.В., Хусаинов Ф.М., Барбарова Л.А., Хусаинова Г.И., Хисматова Д.Ю. ФГУ «Федеральный центр токсикологической и радиационной безопасности животных», г.Казань Ключевые слова: хламидиоз, иммуноферментный специфический антиген, РСК. Key words: Chlamydia, ELISA, specific antigen, RSK. анализ, Хламидиоз - инфекционное заболевание животных, которое в зависимости от локализации возбудителя может поражать все системы и органы, ввиду чего инфекция не имеет типичной клинической картины и зачастую может проходить под диагнозом сопутствующих заболеваний, при этом являясь основным этиологическим агентом (4). По этой причине разработка и внедрение в ветеринарную практику высокоспецифичных средств диагностики хламидиоза животных является актуальной задачей. В настоящее время на практике для ретроспективной диагностики хламидиоза животных, как правило, используют реакцию связывания комплемента (РСК), хотя известно, что иммуноферментный анализ (ИФА) превосходит РСК по чувствительности и специфичности в несколько раз. В разное время различными авторами были предложены тестсистемы для диагностики хламидиоза в ИФА (1,3,5,6), но по ряду причин они не нашли широкого применения при лабораторной диагностике хламидиоза. Ранее нами был усовершенствован способ изготовления специфического хламидийного антигена (2), который обладал большей специфичностью и чувствительностью, чем антиген традиционно применяемый в РСК. Исходя из этого, можно было предполагать, что этот антиген покажет хорошие результаты при использовании его для диагностики хламидиоза сельскохозяйственных животных в ИФА. Исходя из этого, целью наших дальнейших исследований явилось испытание предложенного антигена для диагностики хламидиоза КРС непрямым методом ИФА. Материалы и методы. Биомассу хламидий получали на 6-дневных развивающиеся эмбрионах кур, которые заражали производственным штаммом хламидий «Ростиново – 70» в желточный мешок в дозе 0,2 мл. Павшие на 6 - 8 дни куриные эмбрионы вскрывали, извлекали 69 желточные оболочки, замораживали при минус 18 – 200С. В дальнейшем биомассу использовали для изготовления антигена. Антиген получали путем дифференциального центрифугирования и обработки биомассы детергентами этилмеркаптаном, додецилсульфатом натрия и эфиром путем последующего удаления их диализом и испарением. Полученный антиген проверяли в РСК, стандартизировали по оптической плотности и использовали в ИФА. Для исследований использовали сыворотки крови КРС из 33 не благополучных по хламидиозу животноводческих хозяйств РТ и других регионов РФ. ИФА ставили в непрямом варианте по общепринятой методике. Для контроля использовали гипериммунную и заведомо отрицательную сыворотки крови КРС проверенные в РСК. Также для постановки ИФА использовали антивидовые конъюгаты производства ГУ НИИЭМ им. Н.Ф. Гамалеи РАМН. Результаты ИФА определяли инструментально на фотометре для микропланшет при длине волны 490 нм. Оценку проводили по разности оптической плотности опытных и контрольных лунок. За положительный результат ИФА принимали разницу в 2,0 и более раз (коэффициент специфичности). Для постановки РСК использовали «Набор антигенов и сывороток для серологической диагностики хламидиоза сельскохозяйственных животных» производства ФГУ «ФЦТРБ-ВНИВИ» (№ РОСС RU.ФВ01.В18712). Результаты оценивали визуально, по феномену гемолиза эритроцитов. Результаты. С целью оптимизации процесса постановки реакции, увеличения точности, чувствительности и уменьшения расходов реактивов на первоначальном этапе необходимо было подобрать концентрации (рабочие разведения) используемых компонентов реагентов. Для постановки реакции с предлагаемым специфическим хламидийным антигеном нами было использовано несколько промывочных растворов, но наиболее четкие результаты были получены с ФБР-Т на гипертоническом растворе NaCl (8,5%), с которым проводили дальнейшие исследования. Для определения рабочего разведения специфического антигена и антивидового конъюгата проводили «шахматное» титрование. Антиген в концентрации белка 1,0 мг/мл титровали с разведения 1:8 до 1:1024 используя двукратные разведения в объёме 100 мкл. Конъюгат разводили с 1:10000 до 1:20000 с шагом в 2000. Положительную и отрицательную сыворотки крови титровали с разведения 1:100 используя двукратные последовательные разведения. Каждый раз, одновременно, ставили контроль конъюгата с антигеном без сыворотки. В ходе исследований нами было установлено оптимальное рабочее 70 разведение антигена равное 1:512 (концентрация белка 1,9 мкг/мл) и конъюгата – 1:16000. При этом ОП490 хламидийной контрольной сыворотки в разведении 1:100 составляла 1.201, а аналогичный показатель отрицательной сыворотки был равен 0.105. Таким образом, коэффициент специфичности реакции был более 11 единиц. Оптимальное время адсорбции антигена, определенное в ходе исследований, составляло 18 часов при Т +40С, для сывороток – 1час при +370С и коньюгата – 40 мин при +370С. При исследовании сывороток крови КРС из хозяйств неблагополучных и подозрительных в отношении хламидийной инфекции испытуемый диагностикум показал хорошие результаты. Так исследованию на хламидиоз параллельно в ИФА и РСК было подвергнуто 495 сывороток крови КРС из которых в ИФА дали положительную реакцию 169 (34%) проб, со средним титром (М±м) специфических антител 605,1±2,2. В РСК реагировало 110 сывороток со средним титром (М±м) 8,2±0,3, что меньше в 1,7 раза. Заключение. В результате проведенных исследований установлено, что использованный нами антиген позволяет диагностировать хламидиоз крупного рогатого скота методом ИФА, при этом проявляя более высокую чувствительность и специфичность чем РСК. Полученные данные позволяют рекомендовать испытанный антиген для диагностики хламидиоза КРС в ИФА. ЛИТЕРАТУРА: 1. Герасимов В.В., Равилов Р.Х., Шамсутдинова Н.В. Иммуноферментная диагностика хламидиоза собак и кошек.// ветеринарный врач 2004 №4. С. 59-60. 2. Евстифеев В.В., Хусаинов Ф.М., Барбарова Л.А., Равилов А.З. Усовершенствование комплементсвязывающего антигена для диагностики хламидиоза животных.// Материалы международной научно-практической конференции, посвященной 80-летию ФГУП «Щелковский биокомбинат». Ветеринарная биотехнология: настоящее и будущее. 20-23 сентября 2004 года. 155-156. 3. Хусаинов Ф.М., Евстифеев В.В., Барбарова Л.А., Равилов А.З. Изучение набора диагностикумов для иммуноферментного анализа при хламидиозе свиней.// материалы международной научно-практической конференции, посвященной 80-летию ФГУП «Щелковский биокомбинат». «ветеринарная биотехнология: настоящее и будущее». 20-23 сентября 2004 года. С. 157-158. 4. Хамадеев Р.Х., Равилов А.З., Евстифеев В.В., Хусаинов Ф.М. Барбарова Л.А. Клинико-эпизоотологические особенности и разработка средств специфической профилактики хламидиоза сельскохозяйственных животных.// Ветеринарный врач 2005 №2. С 29-31. 5. Шафикова Н.В, ГаффаровХ.З., Равилов А.З. Выявление антител к возбудителю хламидийного аборта овец в РЭМА// Сборник научных трудов КГВИ. Казань 1987 г. С. 35-39. 6. Шафикова Н.В., Гаффаров Х.З., 71 Равилов А.З. Новое в диагностике хламидийного аборта овец и коз.// Тезисы докладов республиканской научно-практической конференции. 2527 мая 1989года. Казань 1989г. ПРИМЕНЕНИЕ ИММУНОФЕРМЕНТНОГО АНАЛИЗА ДЛЯ ДИАГНОСТИКИ ХЛАМИДИОЗА КРС Евстифеев В.В., Хусаинов Ф.М., Барбарова Л.А., Хусаинова Г.И., Хисматова Д.Ю. Резюме Установлено, что антиген, изготовленный по усовершенствованной технологии, позволяет диагностировать хламидиоз у КРС непрямым методом ИФА. Результаты ИФА показали хорошую корреляцию с данными РСК. При этом у КРС в ИФА выявлялось в 1,7 раза больше положительных результатов, что говорит о более высокой чувствительности ИФА. APPLICATION OF ELISA FOR DIAGNOSIS CHLAMYDIOSIS CATTLE Yevstifeyev V.V., Khousainov F.M., Barbarova L.A., Khusainova G.I., Hismatova D.Y. Summary It is established that the antigen maked with improved technology is allow to diagnose the chlamydios is in cattle by indirect method of IFA. The results of IFA were showed a good correlation with dates bonding complement reaction. At this conditions in IFA was reveal the more positive results: in cattle in 1,7 time. It shown that IFA has higer sensitive of bonding complement reaction. УДК:636.22/.28.87.72 ЭФФЕКТИВНОСТЬ ПРИМЕНЕНИЯ МАГНЕЗИТА В РАЦИОНЕ ДОЙНЫХ КОРОВ Ермолова Е. М. Уральская государственная академия ветеринарной медицины Ключевые слова: коровы дойные, магнезит, жир молока, рацион. Key words: dairy cows, magnesite, milk fat, diet. Основной причиной недостаточного 72 обеспечения организма