Спинальная сегментарная миоклония при рассеянном склерозе
реклама

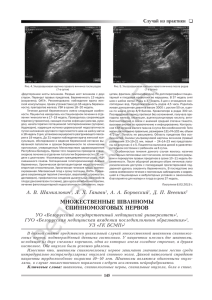
ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ И ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА Спинальная сегментарная миоклония при рассеянном склерозе (наблюдение из практики) И.Ф. ХАФИЗОВА1, З.А. ЗАЛЯЛОВА1, Е.А. БАРАНОВА2, А.Р. ХАКИМОВА1, Э.З. ЯКУПОВ1*, М.С. ГАФУРОВ3 1 ГБОУ ВПО Казанский государственный медицинский университет, Казань; 2Межрегиональный клинико-диагностический центр, Казань; 3Республиканская клиническая больница №2, Казань Spinal segmental myoclonus in multiple sclerosis (case report) I.F. KHAFIZOVA, Z.A. ZALYALOVA, E.A. BARANOVA, A.R. KHAKIMOVA, E.Z. YAKUPOV, M.S. GAFUROV Kazan State Medical University, Interregional Clinical Diagnostic Center, Kazan; Republic Clinical Hospital №2, Kazan Рассеянный склероз (РС) характеризуется развитием множества очагов демиелинизации в мозге, обусловливающих соответствующую клиническую симптоматику. Некоторые симптомы могут быть нетипичными и затруднять диагностику заболевания. Гиперкинезы в виде спинальных миоклоний — крайне редкое проявление РС. Причиной их возникновения служат очаговые поражения спинного мозга. Очаги демиелинизации также могут служить причиной развития спинальных подергиваний. В статье описан случай необычного проявления РС с клинической картиной спинальной сегментарной миоклонии. Высказано предположение, что причиной возникновения гиперкинезов послужили очаги в шейном отделе спинного мозга. Ключевые слова: рассеянный склероз, спинальная миоклония, магнитно-резонансная томография, электромиография. Multiple sclerosis (MS) is a disease with multicentric lesions of central nervous system. These numerous lesions can cause a lot of different symptoms. Sometimes these signs are atypical and make difficulties for MS diagnosing. Hyperkinesis is extremely rare manifestation of MS especially if it concerns spinal myoclonus. Spinal myoclonic jerks can be caused by various focal damages of neuraxis including demyelination lesions. This report describes the case of spinal segmental myoclonus as an unusual manifestation of MS. The patient was diagnosed definite MS according to the McDonald criteria (2010). The nature of movement disorders was defined by careful neurologic and neurophysiologic examination. These movement disorders were reliably caused by demyelinating type lesions in the cervical cord. Key words: multiple sclerosis, spinal myoclonus, magnetic resonance imaging, electromyography. Рассеянный склероз (РС) — это заболевание с многоочаговым поражением центральной нервной системы (ЦНС). Как известно, классическими проявлениями РС являются признаки поражения пирамидной, сенсорной и мозжечковой систем, вовлечение краниальных нервов и также тазовые расстройства [1—3]. Эта клиническая симптоматика встречается в различном сочетании, отражая локализацию очагов демиелинизации в головном и спинном мозге. Тем не менее выделяют «типичные» и «нетипичные» для РС симптомы [3]. Если типичные симптомы помогают клиницисту диагностировать РС, то нетипичные заставляют искать другие причины их возникновения, и РС становится диагнозом «исключения». Одним из «нетипичных» проявлений РС являются экстрапирамидные двигательные расстройства. В литературе имеются редкие описания спастической кривошеи [4, 5], хореи, дистонии [6], дрожательного гиперкинеза при РС [7]. Единичные статьи посвящены миоклониям [8—12]. В своей клинической практике мы столкнулись с таким необычным проявлением РС, как спинальная миоклония. Поскольку это весьма необычное проявление РС, оно может представлять интерес для специалистов. Больной А., 33 лет, работает инженером, левша. Из анамнеза жизни: наследственность пациента не отягощена. В 10-летнем возрасте отмечал развитие слабости и чувства онемения в левых конечностях, по поводу чего был госпитализирован в неврологическое отделение детской больницы с диагнозом «Острое нарушение спинномозгового кровообращения». На фоне проведенного лечения симптоматика в течение полугода полностью регрессировала, после чего больного ничего не беспокоило. Около 3 лет назад, в возрасте 30 лет, пациент обратил внимание на периодические «подергивания» в левых кисти, предплечье и плече. Такие подерги- © Коллектив авторов, 2014 *e-mail: ed_yakupov@mail.ru 48 ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2014; Вып. 2 вания отмечались 2—3 раза в неделю, при целенаправленных движениях, носили спонтанный характер и учащались при волнении. Пациент не мог сдержать или уменьшить эти насильственные движения какими-либо приемами или усилием воли. Яркий свет и громкие звуки также не оказывали на подергивания никакого влияния. Поскольку выраженность насильственных движений, по оценке пациента, не была значительной, то он не обращался за медицинской помощью. С течением времени подергивания в левой руке стали возникать чаще, иногда вне зависимости от активных движений, они уже беспокоили больного в покое и сохранялись во сне. Увеличение амплитуды насильственных движений заставило пациента оставить работу и обратиться за медицинской помощью. Подергивания усиливались при эмоциональных нагрузках и уменьшались после приема алкоголя. Другие внешние факторы влияния на них не оказывали. Приступов с потерей сознания у пациентов не было. При обследовании больного в соматическом статусе патологии обнаружено не было. При неврологическом осмотре регистрировалось легкое нарушение ассоциированных движений глазных яблок без двоения и нистагма, наблюдалась легкая сглаженность правой носогубной складки. Выявлялась гиперестезия стоп с двух сторон с уровня голеностопных суставов, гипестезия левого мизинца кисти и нижней трети внутренней поверхности левого предплечья, причем активных жалоб на изменение чувствительности пациент не предъявлял. Вибрационное и мышечно-суставное чувство было сохранно, мышечная сила — достаточной. Сухожильные рефлексы с верхних конечностей носили обычный характер, с нечетким преобладанием слева, коленные и ахилловы рефлексы были оживлены. Подошвенные рефлексы имели сгибательный тип, брюшные отсутствовали. Пальценосовую пробу слева пациент выполнял с кинетическим тремором, без интенционного компонента. Тандемная ходьба не была нарушена. Дисдиадохокинез, асинергия Бабинского и тазовые нарушения не выявлялись. В плечевом поясе слева и левой руке фиксировались насильственные движения — толчкообразные подергивания в виде резкого попеременного сокращения мышц плеча, предплечья, разгибателей кисти и сгибателей пальцев кисти, что приводило к периодическому возникновению то умеренного (на 20—25°) разгибания в плечевом, то сгибания в локтевом (на 10—15°), то к одновременному разгибанию в лучезапястном суставах и сгибанию пальцев кисти. Особенно ярко гиперкинез проявлял себя при вытягивании рук вперед и удержании их в данном положении, с частотой до 10 в минуту. В покое выявлялись редкие гиперкинезы вышеописанного характера, но значительно меньшей амплитуды. Гиперкинез мешал пациенту совершать точные движеЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2014; Вып. 2 ния — он не смог написать свою фамилию. Резкий шум (хлопанье в ладоши), постукивание (по мышцам, сухожилиям) и свет не вызывали усиления миоклоний. Лабораторные анализы крови и мочи были в норме. По результатам магнитно-резонансной томографии (МРТ) головного и спинного мозга были выявлены множественные очаги демиелинизации величиной 3—7 мм, гиперинтенсивные на Т2взвешенных изображениях (Т2-ВИ) и гипоинтенсивные на Т1-взвешенных изображениях (Т1-ВИ), локализующиеся в белом веществе больших полушарий мозга, перивентрикулярных и подкорковых отделах, мозолистом теле. Аналогичный единичный очаг наблюдался в правом полушарии мозжечка (рис. 1). На уровне сегмента С2 определялись 2 интрамедуллярных очага без четких контуров, слабогиперинтенсивные на Т2-ВИ и изоинтенсивные на Т1ВИ, размерами 4×6 и 4×7 мм. Не исключалось наличие аналогичного очага на уровне сегментов С4—С5 и С5—С6 шейного отдела спинного мозга (рис. 2). При электроэнцефалографии патологии выявлено не было. Во время непроизвольных сокращений мышц левой руки патологических изменений на ЭЭГ не регистрировалось. Игольчатая электромиограмма (ЭМГ) выявила разряды из нескольких двигательных единиц m. extensor dig. com. слева (сегмент С7), продолжительность разряда 70 мс и амплитуда 1400 мкВ. При проведении исследования в других мышцах, иннервируемых другими сегментами, ответы не были получены (рис. 3). При стимуляционной ЭМГ было выявлено нарушение проведения по моторным волокнам левой руки на уровне локтя (туннельный синдром), по нервам левой руки изменений обнаружено не было. Таким образом, больной был обследован в период эпизода ухудшения неврологического статуса. Этот эпизод развился у молодого мужчины (33 года) без предшествующей или сопутствующей инфекции/лихорадки. Обнаружение 2 и более признаков многоочагового поражения ЦНС при осмотре и выявление типичных для РС очагов при нейровизуализации (субкортикально, перивентрикулярно, инфратенториально и в спинном мозге) [13] позволили остановиться на диагнозе «вероятный рассеянный склероз». Эпизод, произошедший в детстве (слабость и онемение слева), мог быть первой атакой РС (хотя его документального подтверждения нет). Если это так, то мы имеем дело с началом РС в детском возрасте. Пациент получил стандартную пульс-терапию глюкокортикостероидами и на 3-й день лечения отметил уменьшение частоты подергиваний. Объективно при этом регистрировался миоклонический гиперкинез в левой руке, который носил больше постуральный характер и появлялся с частотой 8—10 в минуту, в покое подергивания не 49 ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ И ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА Рис. 1. МРТ головного мозга. Множественные очаги демиелинизации, гиперинтенсивные на Т2-ВИ. a — локализующиеся в белом веществе больших полушарий мозга, перивентрикулярных и подкорковых отделах; б — аналогичный единичный очаг регистрируется в правом полушарии мозжечка; в — очаги перивентрикулярно и в мозолистом теле; г — МРТ через 3 мес, по сравнению с предшествующими результатами выявлено появление новых очагов демиелинизации; очаг у заднего рога правого бокового желудочка накапливает контрастное вещество. выявлялись. Через 1 мес миоклонии купировались полностью. Для верификации диссеминации патологического процесса во времени и установления достоверного диагноза РС пациенту было проведено повторное МРТ-исследование головного мозга через 3 мес. По сравнению с предшествующими результатами МРТ отмечалось появление новых очагов демиелинизации слева в перивентрикулярном отделе и у заднего рога правого бокового желудочка; при вве50 дении контраста последний очаг накапливал контрастное вещество (омнискан) (см. рис. 1). Согласно критериям Макдональда [13], пациенту был выставлен диагноз: РС, ремиттирующее течение. Через 3 мес гиперкинезов в руке выявлено не было. Рассматривая представленное наблюдение, следует еще раз отметить, что спинальные миоклонии (СМ) — довольно редкие формы гиперкинезов. Они могут быть разделены на сегментарные и проприоспинальные [14—19]. Это разделение основывается ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2014; Вып. 2 на сегментарном строении спинного мозга и связях сегментов посредством проприоспинального пути. Спинальные сегментарные миоклонии (ССМ) представляют собой непроизвольные движения, вовлекающие в гиперкинез мышцы, которые иннервируются одним или несколькими соседними сегментами спинного мозга [17, 20—22]. Рис. 2. МРТ спинного мозга. На уровне сегмента С2 определяется 2 интрамедуллярных очага без четких контуров, слабо гиперинтенсивные на Т2-ВИ; не исключается наличие аналогичных очагов на уровне сегментов С4—С5 и С5—С6 шейного отдела спинного мозга (указано стрелками). В приведенном наблюдении миоклонии локализовались в одной руке. Если проанализировать всю кинетику имевшегося гиперкинеза, то движения, составлявшие гиперкинез, а именно разгибание плеча (m. deltoideus, m. supraspinatus); сгибание в локтевом суставе (m. biceps brachii, m. brachialis, m. brachiradialis); разгибание кисти (m. extensor carpi radialis longus, m. extensor carpi radialis brevis, m. extensor dig. com.); сгибание пальцев кисти (m. flexor digitorum superficialis) обеспечивались мышцами, иннервация которых осуществляется несколькими соседними сегментами С5—С7 [23]. Соответственно у пациента наблюдались ССМ. В большинстве случаев ССМ являются симптоматическими, и в их основе лежат очаги в спинном мозге, обусловленные каким-либо первичным заболеванием — инфекцией [24—26], опухолью [27], артериовенозной мальформацией [28], сирингомиелией [16], острым рассеянным энцефаломиелитом [29], вертебральной патологией [28], ятрогенией [125] и т.д. [10, 30—35]. Напомним, что у наблюдаемого больного обнаруживались очаги демиелинизации на уровне сегментов С2, С4, С5, С6 шейного отдела спинного мозга, и именно эти очаги могли служить причиной возникновения миоклонических подергиваний сегментарного характера (см. рис. 2). Клинически ССМ чаще всего нерегулярные или же могут быть ритмичными с частотой 0,2—8 Гц и интенсивностью 1—600 в минуту [10, 16, 22, 30, 32, 36]. Амплитуда также разнообразна — от едва замет- Рис. 3. Игольчатая ЭМГ. Разряд с m. extensor dig. сom. продолжительностью 70 мс и амплитудой 1400 мкВ (в других мышцах из других сегментов ответы не были получены). ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2014; Вып. 2 51 ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ И ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА ных сокращений отдельных мышц или группы мышц до интенсивных движений в суставах [8]. Тема сегментарных миоклоний при РС освещена в литературе очень скудно ввиду редкости данного состояния. J. Jankovic и R. Pardo [10] приводят описание 5 больных РС, у которых обнаруживался сегментарный гиперкинез стволового происхождения в виде небной миоклонии. Миоклонический гиперкинез у пациента с РС в наблюдаемом нами случае носил периодический, неритмичный характер, с интенсивностью до 10 раз в минуту и приводил к визуальному насильственному движению в суставах левой руки. Проприоспинальные миоклонии (ПСМ) — второй вид СМ, который отличается от ССМ вовлечением в гиперкинез большего количества мышечных групп — наряду с конечностями подергивания наблюдаются и в туловище [15—19, 32]. Происходит это ввиду распространения патологической импульсации по проприоспинальному пути, и в гиперкинез последовательно вовлекается множество сегментов спинного мозга [14, 19]. В отличие от СCМ проприоспинальные подергивания чаще не имеют определенной этиологии. Некоторые авторы [17] связывают их возникновение с травмой шеи, опухолью, вирусным миелитом и психогенными факторами. В литературе описан случай лайм-боррелиоза, проявившегося клинически в форме ПСМ [37]. При ПСМ наблюдаются ритмичные или неритмичные аксиальные сгибательные движения, вовлекающие в гиперкинез шею, тело, конечности, с частотой около 1—6 Гц. Гиперкинезы обычно возникают спонтанно, в горизонтальном положении на спине и могут провоцироваться кожной стимуляцией области живота или при вызывании сухожильных рефлексов [17, 19]. У описываемого пациента в гиперкинез была вовлечена только одна рука, туловище и нижние конечности оставались интактными, что говорит скорее о сегментарном характере поражения, без массивного вовлечения проприоспинального пути. Имеется единичное описание ПСМ при РС [11]. У больной РС периодически, после предшествующих чувствительных ощущений на шее (покалывание), развивались спонтанные нерегулярные подергивания в правых плече и руке. Насильственные подергивания распространялись на туловище и сгибатели бедра с правой стороны. На МРТ авторами были выявлены очаги в шейных сегментах С2, С3, С4. Развитие ПСМ авторы объясняли тем, что очаги в белом веществе могли привести к расторможению спинальной активности, но допускали, что причиной могла быть и гипервозбудимость демиелинизированного аксона, который в таком поврежденном состоянии способен спонтанно или рефлекторно генерировать импульсы патологической мышечной активности. 52 Для обеих разновидностей СМ характерны сохранение гиперкинезов во сне и относительная устойчивость к внешним стимулам — они не усиливаются под воздействием слуховых, зрительных, тактильных раздражителей и при двигательной активности [10, 14, 16, 27, 30], хотя в литературе и имеются описания случаев ССМ с исчезновением во сне и чувствительностью к внешним раздражителям [22, 31, 32]. Считается, что по мере прогрессирования заболевания может появиться реакция на внешние воздействия [15]. Для СМ более патогномоничен постуральный компонент — усиление гиперкинеза в определенном положении, а также усугубление подергиваний при утомлении и эмоциональных нагрузках [31, 32]. ССМ, наблюдавшиеся у изучаемого пациента, сохранялись во сне, не имели зависимости от слуховых и зрительных стимулов, однако усиливались от эмоциональных нагрузок и утомления, уменьшались на фоне приема алкоголя. Следующей важной отличительной чертой СМ является отсутствие патологической активности на ЭЭГ. Совместное выполнение ЭЭГ—ЭМГ должно исключить наличие предшествующей мышечному сокращению гипервозбудимости коры [10, 16, 30]. В рассматриваемом случае ЭЭГ не показала очагов гипервозбудимости, что позволило с большой вероятностью исключить корковый характер гиперкинезов. Поверхностная ЭМГ при СМ позволяет выявить ритмичные или полуритмичные разряды, которые обычно синхронны, со стереотипной продолжительностью и частотой. ЭМГ-исследование при ССМ демонстрирует разряды продолжительностью более 100 мс (до 1000 мс) и ограниченные одним или двумя соседними миотомами. При ПСМ миоклонические разряды могут длиться от 50 мс до 4 с, формируются они из абдоминальных и шейных сегментов и распространяются медленно рострально и каудально, при этом краниальные мышцы остаются интактными. Для ПСМ характерны задержка между разрядами и последовательное их распространение, что обусловлено медленным проведением импульса по проприоспинальному пути [17, 30]. В описываемом нами случае продолжительность разряда составляла 70 мс, что не очень соответствует представленному в литературе описанию сегментарных миоклоний, а больше характерно для проприоспинальных. Однако ни клинически, ни нейрофизиологически мы не наблюдали распространения насильственных сокращений мышц, что с большой вероятностью исключает проприоспинальный характер миоклоний. Описанное нами наблюдение демонстрирует яркую картину ССМ при РС. Отсутствие эпилептической активности на ЭЭГ, наличие разрядов в мышцах левой руки (сегмент С7), вовлечение в гиперкинез мышц левой верхней конечности, иннерЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2014; Вып. 2 вация которых обеспечивается 3—4 соседними сегментами, и, наконец, регистрация очагов демиелинизации в спинном мозге, а именно на уровне сегментов С2, С4, С5, С6 шейного отдела, — все это подтверждает спинальный сегментарный характер миоклоний. Причиной возникновения ССМ, скорее всего, послужили очаги демиелинизации в спинном мозге. Исчезновение гиперкинеза после терапии гормонами укрепляет наше предположение о генезе насильственных движений. Существуют различные гипотезы механизма развития СМ [8, 21, 26, 31, 32, 38—40]. Учитывая, что миоклонический гиперкинез у наблюдаемого пациента появлялся изредка в покое и ярче всего проявлял себя при удержании позы, наиболее вероятным является вариант механизма развития, в основе которого лежит разрыв межсегментарных связей очагами демиелинизации в спинном мозге [18]. Это могло привести к локальной дизрегуляции работы гамма-мотонейронной петли с последующим возникновением спонтанных нейрональных импульсов в сегментах спинного мозга и формированием миоклонического гиперкинеза. Возможно, важное значение имело расположение очагов относительно серого вещества спинного мозга. Таким образом, основными опорными пунктами диагностики ССМ в приведенном наблюдении могут служить: 1) вовлечение в гиперкинез ограниченной группы мышц, иннервируемых нескольки- ми соседними сегментами спинного мозга; 2) отсутствие влияния внешних раздражителей (слуховых, зрительных, тактильных) и активных движений на степень выраженности гиперкинеза; 3) сохранность гиперкинезов во сне, усиление их под влиянием утомления и эмоций, появление миоклоний в определенном положении; 4) отсутствие гипервозбудимости на ЭЭГ; 5) патологическая ЭМГ-активность мышц в ограниченных миотомах интенсивностью 70 мс. Лечение ССМ, в частности при РС, предусматривает терапию основного заболевания — купирование обострения применением глюкокортикостероидов. В случае отсутствия эффекта препаратом выбора считается клоназепам в дозе до 6 мг в сутки [10, 17, 18, 22, 30]. Терапия баклофеном может улучшить ночные миоклонии в ногах [10]. В литературе имеется упоминание об эффективности при СМ топирамата и леветирацетама. Тетрабеназин применяется при отсутствии эффекта от других препаратов [10, 30]. Возможно комплексное применение препаратов, например тизанидина, клоназепама и баклофена [38]. В литературе имеются описания позитивного эффекта ботулинотерапии при СМ [17, 18, 30]. В заключение отметим, что приведенное наблюдение демонстрирует ССМ, как одно из редчайших проявлений РС. Основу этого «нетипичного» симптома РС составлял очаг демиелинизации, расположенный в спинном мозге шейного отдела. ЛИТЕРАТУРА 1. Гусев Е.И. Рассеянный склероз и другие демиелинизирующие заболевания. М: Миклош 2004; 540. 2. Демина Т.Л., Попова Н.Ф. Симптоматическая терапия рассеянного склероза. Consilium Medicum 2002; 4: 2: 92—96. 3. Мазо Е.Б., Завалишин И.А., Кривобородов Г.Г., Шварц П.Г. Рассеянный склероз и нарушения мочеиспускания: клиника. Диагностика, лечение. Неврологический журнал 2002; 4: 4—12. 4. Milanov I., Georgiev D. Spasmodic torticollis and tremor due to multiple sclerosis: a case report. Funct Neurol 1995; 10: 6: 281—285. 5. extrapyramidal motor disturbances in multiple sclerosis. Confin Neurol 1975; 37: 1—3: 24—40. 13. Polman Chris H., Reingold Stephen C., Banwell B., Clanet M., Cohen J. A., Filippi M., Fujihara K., Havrdova E., Hutchinson M., Kappos L., Lublin F.D., Montalban X., O’Connor P., Sandberg-Wollheim M., Thompson A.J., Waubant E., Weinshenker B., Wolinsky J.S. Diagnostic criteria for multiple sclerosis: 2010 Revisions to the McDonald criteria. Annals of Neurology 2011; 69: 2: 292—302. 14. Calancie B. Spinal myoclonus after spinal cord injury. J Spinal Cord Med 2006; 29: 413—424. Plant G.T., Kermode A.G., du Boulay E.P., McDonald W.I. Spasmodic torticollis due to a midbrain lesion in a case of multiple sclerosis. Mov Disord 1989; 4: 4: 359—362. 15. Donaldson I., Marsden D.C., Schneider S., Bhatia K. Marsden’s Book of Movement Disorders. New York: Oxford University Press 2012; 1512: 935— 956. 6. Ярош А.А., Мачерет Е.Л., Ярош А.А., Прокопив М.М. К клинике и дифференциальной диагностике гиперкинетических форм рассеянного склероза и гепатоцеребральной дистрофии. Журн невропатол и психиат 1985; 85: 12: 1800—1802. 16. Gregoire S.M., Laloux P., Hanson P., Ossemann M., Decoene B. Segmental spinal myoclonus and syringomyelia: A Case Report. Acta Neurol Belg 2006; 106: 37—40. 17. 7. Черниговская Н.В. К клинической характеристике и дифференциальному диагнозу гиперкинетической формы рассеянного склероза. Журн невропатол и психиат 1970; 70: 1: 23—32. Kojovic M., Cordivari C., Bhatia K. Myoclonic disorders: a practical approach for diagnosis and treatment. Ther Adv Neurol Disord 2011; 4: 1: 47—62. 18. 8. Aigner R.B., Mulder D.W. Myoclonus clinical significance and an approach to classification. Arch Neurol 1960; 2: 6: 600—615. Kwan Su Song, Jae Gon Moon, Chang Hyun Kim, Ho Kook Lee. Propriospinal myoclonus induced by a herniated lumbar intervertebral disc at a yong age: a case report. Korean J Spine 2011; 8: 4: 300—303. 9. Hassler R., Bronisch F., Mundinger F., Riechert T. Intention myoclonus of multiple sclerosis, its pathoanatomical basis and its stereotactic relief. Neurochirurgia (Stuttg) 1975; 18: 3: 90—106. 19. Shibasaki H., Thompson P.D. Milestones in myoclonus. Movement Disorders 2011; 26: 6: 1142—1148. 20. 10. Jankovic J., Pardo R. Segmental myoclonus: clinical and pharmacologic study. Arch Neurol 1986; 43: 10: 1025—1031. Banks G., Nielsen V.K., Short M.P., Kowal C.D. Brachial plexus myoclonus. J Neurol Neurosurg Psychiatry 1985; 48: 6: 582—584. 21. 11. Kapoor R., Brown P., Miller D.H. Propriospinal myoclonus in multiple sclerosis. J Neurol Neurosurg Psychiatry 1992; 55: 1086—1088. Campos C.R., Limongi J.C.P., Machado F.C.N., Brotto M.W.I. A case of primary spinal myoclonus: Clinical presentation and possible mechanisms involved. Arq Neuro-Psiquiatr 2003; 61: 1: 112—114. 12. Riechert T., Hassler R., Mundinger F., Bronisch F., Schmidt K. Pathologicanatomical findings and cerebral localization in stereotactic treatment of 22. Jitendra K. Baruah spinal myoclonus: a case report. The Journal of Bone and Joint Surgery 1984; 66-A: 2: 304—306. ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2014; Вып. 2 53 ОСОБЕННОСТИ КЛИНИЧЕСКОГО ТЕЧЕНИЯ И ДИАГНОСТИКИ РАССЕЯННОГО СКЛЕРОЗА 23. Синельников Р.Д., Синельников Я.Р. Атлас анатомии человека: Учеб. пособие. 2-е изд., стереотипное. В 4 т. Т. 4. М: Медицина 1996; 320. 24. Berger J.R., Bender A., Resnick L., Perlmutter D. Spinal myoclonus associated with HTLV III/LAV Infection. Arch Neurol 1986; 43: 1203—1204. 25. Campbell A.M.G., Garland H. Subacute myoclonic spinal neuronitis. J Neurol Neurosurg Psychiat 1956; 19: 268—274. 26. De Mattos J.P., Rosso A.L.Z., Carneiro A.J.V., Novis S. Spinal myoclonus: Report of four cases. Arq Neuropsiquiatr 1993; 51: 4: 498—501. 27. Hopkins A.P., Michael W.F. Spinal myoclonus. J Neurol Neurosurg Psychiatry 1974; 37: 10: 1112—1115. 28. Levy R., Plassche W., Riggs J., Shoulson I. Spinal myoclonus related to an arteriovenous malformation response to clonazepam therapy. Arch Neurol 1983; 40: 254—255. 29. Kabakus N., Taskin E., Aydin M. Segmental myoclonus as the presenting symptom of an acute disseminated encephalomyelitis: a case report. Eur J Paediatr Neurol 2006; 10: 1: 45—48. 32. Davis S.M., Murray N.M.F., Diengdoh J.V., Galea-Debono A., Kocen R.S. Stimulus-sensitive spinal myoclonus. Journal of Neurology Neurosurgery and Psychiatry 1981; 44: 884—888. 33. Jack W. Tsao, Eduard C. Cooper. Reflex-sensitive spinal segmental myoclonus associated with vitamin B12 deficiency. Neurology 2003; 23: 61: 867— 868. 34. Sotaniemi K.A. Paraspinal myoclonus due to spinal root lesion. J Neurol Neurosurg Psychiatry 1985; 48: 7: 722—723. 35. Yerdelen D., Karatas M.E. Aslan, Giray S., Tan M. Spinal segmental myoclonus related to pregnancy. Acta Neurol Belg 2007; 107: 11—13. 36. Evidente V.G.H., Caviness J.N. Myoclonus of peripheral origin. J Neurol Neurosurg Psychiatry 1999; 66: 121—122. 37. De la Sayette V., Schaeffer S., Queruel C., Bertran F., Defer G., Hazera P., Gallet E. Lyme neuroborreliosis presenting with propriospinal myoclonus. J Neurol Neurosurg Psychiatry 1996; 61: 4: 420. 38. Ray B.K., Guha G., Misra A.K., Das S.K. Involuntary Jerking of Lower Half of the Body (Spinal Myoclonus). JAPI 2005; 53: 141—142. 30. Albanese A., Jankovic J. Hyperkinetic movement disorders, with desktop edition: differential diagnosis and treatment. Blackwell Publishing Ltd. 2012; 252: 221—228. 39. Roobol T.H., Kazzaz B.A., Vecht Ch.J. Segmental rigidity and spinal myoclonus as a paraneoplastic syndrome. Journal of Neurology Neurosurgery and Psychiatry 1987; 50: 628—631. 31. Daniel D.G., Webster D.L. Spinal segmental myoclonus successful treatment with cervical spinal decompression. Arch Neurol 1984; 41: 898—899. 40. Shivapour E., Teasdall R.D. Spinal myoclonus with vacuolar degeneration of anterior horn cells. Arch Neurol 1980; 37: 451—453. 54 ЖУРНАЛ НЕВРОЛОГИИ И ПСИХИАТРИИ, 2, 2014; Вып. 2