Задания школьного тура олимпиады по химии для 8 класса
реклама

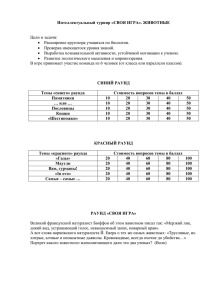
Задания школьного тура олимпиады по химии для 8 класса 1. Составить формулу вещества, состоящую из 2 атомов натрия, 1 атома углерода, 3 атомов кислорода и 10 молекул воды. Вычислить массовую долю кислорода в данном веществе. (15б) 2. Массовая доля халькозина Cu2S в медной руде составляет 6,25%. Какую массу меди можно получить из 25 кг. такой руды? (15б) 3. Объемная доля кислорода в воздухе равна 21%. Вычислите, сколько молекул кислорода находится в комнате, если её длина – 2м, ширина – 1,5м, высота – 2,5 м. (20б) 4. Хлорид 3-валентного металла содержит 69% атомов Cl(1). Хлорид 4валентного металла содержит 74,8% атомов хлора (1). Рассчитайте атомные массы металлов и составьте формулы хлоридов этих металлов. Может ли быть один металл в данной задаче? (20б) 5. Определите массы феррум (2) сульфата FeSO4 и воды, содержащихся в 1,2 моль железного купороса FeSO4*7H20 (30б) Задания школьного тура олимпиады по химии для 9 класса 1. Запишите формулы высших оксидов и гидроксидов Na,S,Cl,Al,Ca Классифицируйте эти соединения по способности реагировать с кислотами и основаниями. (15б) 2. При взаимодействии 1,84 г. Металла с водой выделяется 896мл. газа(н.у.) Найдите металл .Укажите валентные электроны и орбитали атома металла. Приведите электронное строение иона этого металла. (15б) 3. При смешении двух растворов с массовыми долями серной кислоты 50% и 70 % образовалось 300г раствора с массовой долей 65%.Определите массы исходных растворов. (20б) 4. Хлор имеет 2 изотопа с массами 35 и 37. Вычислите массовую долю в (% ) каждого изотопа ,если атомная масса хлора равна 35,453. Приведите основную причину ,объясняющую одинаковые химические свойства изотопов. (20б) 5. Составить формулу кристаллогидрата барий хлорида, если 24,4 его растворили в воде и обработали серной кислотой, получив при этом 23,3г. осадка. (30б) Задания школьного тура олимпиады по химии для 10 класса 1. При взаимодействии углерода с концентрированной сульфатной кислотой выделилось 13,44 л смеси газов. Найдите массу углерода. (10б) 2. Газ, образовавшийся при окислении 11,2 л аммиака в присутствии катализатора, окисляется далее, и полученное вещество растворяют в 73 мл воды в присутствии кислорода. Найдите массовую долю вещества в растворе. (20б) 3. При пропускании смеси этана и этина через склянку с бромной водой вес склянки увеличился на 1,3 г, а при сгорании такого же количества смеси углеводородов выделилось 14 л углекислого газа. Каков объем смеси и объемные доли газов? (20б) 4. При взаимодействии 11,2 л смеси изомерных углеводородов, имеющую плотность по водороду 21, с бромной водой получено 40,4 г дибромпроизводного. Определите строение этих углеводородов и объемное содержание в смеси. (20б) 5. Фосфин, полученный гидролизом 72,8 г кальция фосфида, сожгли. Образовавшийся фосфор (5) оксид растворили в 100 мл 34% - го раствора калий гидроксида с плотностью 1,32 г/мл. Определить состав образовавшейся соли и её массовую долю в растворе. (30б)