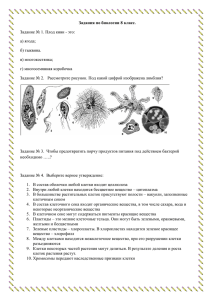
Ссылка - Рязанский государственный агротехнологический
реклама

ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ОБРАЗОВАНИЯ «РЯЗАНСКИЙ ГОСУДАРСТВЕННЫЙ АГРОТЕХНОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ П.А. КОСТЬШЕВА» Кафедра агрохимии, почвоведения и физиологии растений Л.А. Антипкина Рабочая тетрадь с методическими указаниями по дисциплине «Физиология и биохимия растений» для студентов технологического факультета. Направления подготовки: 35.03.04 Агрономия, 35.03.03 Агрохимия и агропочвоведение Рязань - 2015 г. Антипкина Л.А. Рабочая тетрадь с методическими указаниями по дисциплине «Физиология и биохимия растений» для студентов технологического факультета. Направления подготовки: 35.03.04 Агрономия, 35.03.03 Агрохимия и агропочвоведение. - Рязань: РГАТУ, 2015. - 112 с. В рабочей тетради с методическими указаниями, предназначенной для студентов очной и заочной форм обучения по направлениям 35.03.04 Агрономия, 35.03.03 Агрохимия и агропочвоведение, рассмотрены методы изучения физиологии и биохимии растительной клетки, водного обмена, фотосинтеза, дыхания, минерального питания, обмена и транспорта веществ в растении, роста и развития, приспособления и устойчивости растений, физиологии и биохимии формирования качества урожая, которые позволяют закрепить теоретические знания студентов по дисциплине «Физиология растений». Рабочая тетрадь с методическими указаниями содержит теорию, вопросы для самоконтроля и рекомендуемую основную и дополнительную литературу, а также краткий словарь терминов и понятий по физиологии растений. Рецензент: доктор сельскохозяйственных наук, зав. кафедрой лесного хозяйства, экологии и селекции растений, профессор В.И. Левин. Рабочая тетрадь с методическими указаниями рассмотрена и рекомендована к печати на заседании кафедры агрохимии, почвоведения и физиологии растений (протокол № 7 от 16 февраля 2015 г.). Зав.кафедрой агрохимии, почвоведения и физиологии растений Костин Я.В. Рабочая тетрадь с методическими указаниями утверждена учебнометодической комиссией технологического факультета, протокол № 6 от 26 февраля 2015 года. Председатель учебно-методической комиссии 2 Ступин А.С. ПРЕДИСЛОВИЕ Физиология растений изучает процессы жизнедеятельности и функции растительного организма на всем протяжении его онтогенеза при всех возможных условиях внешней среды. Объектом изучения физиологии растений служит растение. Предметом физиологии являются функции растений, функциональные системы, обеспечивающие реализацию генетической программы роста и развития. Функции зеленого автотрофного растения: питание (воздушное – фотосинтез, почвенное – минеральное и водное); дыхание; рост и развитие; размножение и др. Главная задача физиологии растений - раскрытие сущности процессов жизнедеятельности растительного организма в онтогенезе в различных условиях среды с целью управления ходом роста и развития растений, формирования урожая и его качества. Знание физиологии растений и ее законов имеет большое значение для человека, так как дает возможность управлять этими процессами и направлять их в желаемую сторону с целью повышения урожайности и качества сельскохозяйственных культур. Целью лабораторных занятий по физиологии растений является закрепление и расширение знаний студентов по теоретическому курсу. Отрабатывая практические задачи, анализируя химизм превращений и получая результаты, студенты всесторонне исследуют важнейшие физиологические функции растительного организма, сложный внутренний механизм его жизнедеятельности, систему взаимосвязи всех процессов и характер их зависимости от внешних факторов с целью повышения их продуктивности. Поэтому практические задачи, выполняемые на лабораторных занятиях по физиологии растений, требуют глубокого осмысления в плане их прикладного значения и последующего применения в профессиональной деятельности. Постановка опытов способствует тому, что студенты приобретают навыки экспериментальной работы, овладевают методами исследования в области физиологии растений. Кроме того, лабораторные занятия по физиологии растений прививают студентам навыки и интерес к самостоятельной работе вообще и, в частности, к научно-исследовательской работе. Процесс изучения дисциплины направлен на формирование следующих компетенций: - владением культурой мышления, способностью к обобщению, анализу, восприятию информации, постановке цели и выбору путей ее достижения (ОК-1); - умением критически оценивать свои достоинства и недостатки, наметить пути и выбрать средства развития достоинств и устранения недостатков (ОК-7); - владением основным методами, способами и средствами получения, хранения, переработки информации; навыками работы с компьютером как средством управления информацией (ОК-13); 3 - способностью распознавать по морфологическим признакам наиболее распространенные в регионах дикорастущие растения и сельскохозяйственные культуры, оценивать их физиологическое состояние, адаптационный потенциал и определять факторы улучшения роста, развития и качества продукции (ПК-3); - способностью к лабораторному анализу образцов почв, удобрений и растений (ПК-22); - способностью к лабораторному анализу образцов почв, растений и продукции растениеводства (ПК-25). В методическом пособии изучаемые разделы кратко описаны теоретически, указана цель каждого лабораторного занятия, дано описание выполняемых работ, вопросы для самоконтроля, рекомендуемая литература, краткий словарь терминов и понятий. Рабочая тетрадь с методическими указаниями по физиологии растений составлена для студентов по направлениям 35.03.04 Агрономия и 35.03.03 Агрохимия и агропочвоведение», обучающихся по очной и заочной формам обучения. 4 РАЗДЕЛ 1. ФИЗИОЛОГИЯ И БИОХИМИЯ РАСТИТЕЛЬНОЙ КЛЕТКИ Растительная клетка как клетка эукариотического организма представляет собой структурную и функциональную единицу всего живого. Это целостная открытая система, обменивающаяся с окружающей средой веществом, энергией и информацией. В отличие от других эукариотических организмов для растительной клетки характерны: 1) пластидная система, возникающая в связи с автотрофным способом питания, 2) полисахаридная клеточная стенка, окружающая клетку, 3) центральная вакуоль в зрелых клетках, играющая важную роль в поддержании тургора, 4) у делящейся растительной клетки нет центриолей. Основными частями любой клетки являются ядро и цитоплазма, составляющие протопласт. Продуктом жизнедеятельности протопласта является клеточная стенка, выполняющая опорную, формообразовательную, защитную, буферную, транспортную функции. Основой организации любой клетки являются мембраны, состоящие из двойного слоя фосфолипидов и белков, обеспечивающие принцип компартментации и взаимодействие ее отдельных частей. Эти пограничные структуры покрывают протопласт, отделяя его от клеточной стенки (плазмалемма), окружают вакуоль (тонопласт) и органоиды клетки (мезоплазма). Все органоиды клетки погружены в матрикс цитоплазмы – гиалоплазму. Важнейший компонент клетки – ядро, окружено двойной мембраной, хранит и передает наследственную информацию, заключенную в определенных нуклеотидных последовательностях молекулы ДНК, обеспечивая тотипотентность всех клеток организма и осуществляет регуляцию всей жизнедеятельности клетки. Важнейшие в функциональном отношении органеллы - митохондрии и пластиды – имеют общие особенности: покрыты двойной мембраной, являются полуавтономными органеллами, обладающими своей отличной от ядерной, наследственной информацией. Митохондрии – энергетические станции клетки, в них локализованы реакции аэробного дыхания. Пластиды делятся на лейкопласты (бесцветные), где откладываются запасные вещества – белки, жиры, углеводы; хлоропласты (содержат зеленый пигмент хлорофилл) осуществляют фотосинтез; хромопласты (содержат желтые и красные пигменты - каротиноиды), вспомогательные пигменты хлорофилла, окрашивают плоды, цветки. Рибосомы не имеют мембран, осуществляют синтез белков. Одномембранные органоиды: эндоплазматическая сеть переносит вещества и передает сигналы; аппарат Гольджи выполняет секреторную функцию, снабжая строительным материалом клеточную стенку (присущую только растениям) и плазмалемму; в сферосомах происходит синтез и 5 запасание липидов, в лизосомах – распад веществ с помощью гидролитических ферментов, в пероксисомах осуществляется фотодыхание. Взрослая растительная клетка имеет большую вакуоль с водным раствором органических и минеральных веществ. Концентрация этих веществ в клеточном соке и степень их диссоциации определяют потенциальное осмотическое давление клетки – ее способность всасывать воду. Вода поступает в клетку извне в результате разности химических потенциалов воды в клетке и окружающем растворе, т.е. от более высокого водного потенциала к более низкому. Компоненты цитоскелета растительной клетки – микротрубочки и микрофиламенты, не имеют мембран. Микротрубочки состоят из глобулярного кислого белка тубулина и при делении клетки составляют основу структуры веретена деления. Микрофиламенты состоят из белка актина, участвуют в пространственной организации метаболических процессов, протекающих в растворимой фазе цитоплазмы, и служат основой ее двигательной активности. Большую часть массы живых клеток составляет вода (около 80%). Химический состав активно функционирующих растительных клеток весьма сходен. Средний химический состав цитоплазмы и органелл составляют: белки (60 – 70% - в цитоплазме, 70% - в ядре, 60 – 70% - в хлоропластах, 55 – 60% - в митохондриях), липиды (15 – 20% - в цитоплазме, 8% - в ядре, 20 – 25% - в хлоропластах, 25 – 35% - в митохондриях), нуклеиновых кислот (5% - в цитоплазме, 20% - в ядре, 1 – 3% - в хлоропластах, 1 – 3% - в митохондриях). Оставшаяся доля в сухом веществе цитоплазмы принадлежит другим органическим веществам - углеводам, пигментам и пр., а также минеральному компоненту (около 5%). ТЕМА 1: СТРУКТУРА И СВОЙСТВА ЦИТОПЛАЗМЫ Цель: познакомиться со свойством живой цитоплазмы - плазмолизом. Работа 1. Влияние катионов и анионов солей на форму и время плазмолиза Объект исследования: эпидермис пигментированной чешуи репчатого лука. Материалы и оборудование: растворы солей: 0,7 M Ca(NО3)2, 1M KCNS, 1M KNО3. Микроскопы, предметные и покровные стекла, лезвия безопасной бритвы. Вводные пояснения. Наружная цитоплазматическая мембрана клетки (плазмалемма) отделяет клетку от окружающей среды, контролирует транспорт веществ в клетку и из клетки, первой воспринимает информа6 цию о внешней среде. Внутриклеточные мембраны обеспечивают пространственную упорядоченность многочисленных процессов, протекающих в клетке. Они создают изолированные пространства (компартменты), в которых одновременно могут протекать противоположно направленные процессы. В мембраны встроено большое количество мультиферментных комплексов, транспортных систем, рецепторных молекул, обеспечивающих протекание основных жизненных процессов. Важнейшая функция клеточных мембран - избирательная проницаемость (полупроницаемость), благодаря которой через них проходят молекулы только некоторых веществ. Это свойство может изменяться в зависимости от процессов, протекающих в клетке. Избирательная проницаемость сохраняется до тех пор, пока клетка остается живой. За счет избирательной проницаемости мембран обеспечивается прохождение через них молекул воды, оказывается препятствие проникновению растворенных в воде веществ, что и обусловливает явление плазмолиза при действии на клетку гипертонического раствора. Плазмолиз - это процесс отставания цитоплазмы от стенок клетки, помещенной в раствор с большей концентрацией солей, чем концентрация клеточного сока (гипертонический). В ходе плазмолиза очертания поверхности цитоплазмы меняются. Вначале цитоплазма отстает от клеточной стенки лишь в отдельных местах, чаще всего в уголках. Плазмолиз такой формы называют уголковым. Затем протопласт продолжает отставать от клеточных стенок, сохраняя связь с ними в отдельных местах, поверхность протопласта между этими точками имеет вогнутую форму. На этом этапе плазмолиз называется вогнутым. Постепенно протопласт отрывается от клеточных стенок по всей поверхности и принимает округлую форму. Такой плазмолиз носит название выпуклого. Прямым показателем физико-химического состояния протопласта является вязкость, чем она выше, тем медленнее наступает плазмолиз. Показателем, характеризующим ответную реакцию цитоплазмы на воздействие отдельных солей, служит время плазмолиза. Плазмолитик - вещество, вызывающее плазмолиз. Время плазмолиза - это время с момента погружения ткани в раствор соли до появления выпуклого плазмолиза (примерно у половины клеток в поле зрения микроскопа). Этот показатель может характеризовать вязкость цитоплазмы: чем больше время плазмолиза, тем выше вязкость цитоплазмы. Ход работы. Срез эпидермиса с выпуклой стороны чешуи цветного лука помещают в каплю раствора соли (по таблице 1) на предметном стекле, покрывают покровным стеклом и следят за сменой форм плазмолиза от вогнутого до выпуклого. Определяют время плазмолиза в каждой соли: период от момента погружения ткани в раствор до наступления выпуклого плазмолиза. Этот показатель характеризует вязкость цитоплазмы: чем больше время плазмолиза, тем выше вязкость. Результаты опыта записать в таблицу 1. 7 Таблица 1 - Влияние анионов и катионов солей на форму и время плазмолиза Соль Концентрация Время Время Время раствора, погружения наступления плазмолиза, М ткани в выпуклого мин. раствор плазмолиза Ca(NO3)2 0,7 KNO3 1,0 KCNS 1,0 Зарисовать отдельные клетки с разной формой плазмолиза: Вывод: Дата_________________ Подпись преподавателя_____________________ ТЕМА 2. ИЗБИРАТЕЛЬНАЯ ПРОНИЦАЕМОСТЬ ЦИТОПЛАЗМЫ И ОТВЕТНЫЕ РЕАКЦИИ КЛЕТКИ НА ПОВРЕЖДАЮЩИЕ ВОЗДЕЙСТВИЯ Цель: познакомиться со свойством живой цитоплазмы – избирательной проницаемостью (полупроницаемостью). Изучить: 1) метод определения жизнеспособности семян по окрашиванию цитоплазмы; 2) действие различных химических веществ и температуры на изменение проницаемости цитоплазматических мембран клетки. Работа 2. Определение жизнеспособности семян по окрашиванию цитоплазмы Объект исследования: семена гороха и зерновки пшеницы. Материалы и оборудование: 0,2%-ный раствор кислого фуксина или индигокармина. Бюксы, пипетки, лезвия безопасной бритвы, фильтровальная бумага, препаровальные иглы. Вводные пояснения. При повреждении растительной ткани увеличивается сродство цитоплазмы к красителям. На этом основаны методы определе8 ния жизнеспособности семян по окрашиванию их зародышей витальными (прижизненными) красителями. Для определения жизнеспособности семян гороха, фасоли, люпина, конопли и тыквенных применяют метод Нелюбова. Семена с неокрашенными корешками и слабо окрашенными семядолями относят к жизнеспособным. Семена с полностью окрашенными корешками и семядолями относят к нежизнеспособным. Для определения жизнеспособности семян злаковых культур применяют метод Иванова. По этому методу у жизнеспособных семян зародыши не окрашиваются красителем, у сильно поврежденных или мертвых семян зародыши окрашиваются. Ход работы. Метод Нелюбова. Берут 10 семян гороха, которые предварительно намачивают в течение 18 часов при 200С, освобождают их от семенной оболочки, помещают в 0,2%-ный раствор индигокармина или кислого фуксина на 2 – 3 часа при температуре 300С. Затем краску сливают, семена промывают водопроводной водой и устанавливают их жизнеспособность. Метод Иванова. Для определения берут 10 зерновок пшеницы, которые предварительно намачивают в воде в течение 10 часов при комнатной температуре, разрезают бритвой вдоль бороздки пополам так, чтобы был виден зародыш, и помещают на 10 минут в 0,2%-ный раствор индигокармина или кислого фуксина. Затем краску сливают, промывают зерновки водой и, разложив их пинцетом на фильтровальной бумаге, определяют жизнеспособность. Зарисовать: 1. Зародыши гороха Жизнеспособные Нежизнеспособные 2. Зерновки пшеницы Жизнеспособные Нежизнеспособные Вывод: Работа 3. Диагностика повреждения растительной ткани по увеличению проницаемости клеточных мембран Объект исследования: корнеплод красной столовой свеклы. 9 Материалы и оборудование: 30%-ный раствор уксусной кислоты, хлороформ, 50%-ный раствор спирта, 1М раствор КNО3. Штативы с пятью пробирками, сверла, ножи, линейки, градуированные пипетки на 10 мл, предметные и покровные стекла, микроскопы, спиртовка. Ход работы. Из очищенного корнеплода красной столовой свеклы сверлом диаметром 0,7 – 0,8 см вырезают кусочки толщиной 3 – 4 см. Их тщательно промывают под струей водопроводной воды и помещают по одному в пять пробирок, содержащих по 10 мл растворов (в соответствии со схемой опыта). Вторую пробирку с водой кипятят и в горячую воду помещают кусочек свеклы. Через 30 минут после начала опыта все пробирки интенсивно встряхивают и сравнивают (визуально) количество вышедшего из клеток пигмента в разных вариантах опыта по 5-ти балльной системе. Результаты наблюдений записать в таблицу 2. Таблица 2 - Выход антоциана из клеток корнеплода красной свеклы под действием повреждающих агентов Окраска Контроль Кипячение Водопроводная 30%-ный в (водопро- (водопро- вода + 6 капель раствор баллах водная водная хлороформа уксусной вода) вода) кислоты 1 2 3 4 5 Вывод: столовой 50% ный раствор спирта Дата__________________ Подпись преподавателя____________________ ТЕМА 3: РАСТИТЕЛЬНЫЕ БЕЛКИ И ИХ СВОЙСТВА Цель: познакомиться с методикой извлечения глобулина из растительного материала и изучить основные свойства этого белка: растворимость, денатурацию, высаливание; изучить качественные реакции на белки. Работа 4. Получение глобулина и изучение его свойств. Объект исследования: белок глобулин. 10 Материалы и оборудование: мука бобовых культур, 10%-ный раствор (NH4)2SO4 или NaCl, сухая соль (NH4)2SO4, концентрированные растворы кислот H2SO4 или HCl, HNO3, раствор NH4OH, 5%-ный раствор CuSO4, 20%-ный раствор NaOH, сухая соль Pb(CH3COO)2. Коническая колба на 100 мл, пробирки, воронки, фильтры бумажные, спиртовка, держатель для пробирок. Вводные пояснения. Белки представляют собой полимеры, мономерами которых являются аминокислоты. Отдельные аминокислоты соединяются друг с другом в молекуле белка с помощью пептидной связи (-CO-NH-). Белки разделяют на протеины - простые белки, построенные только из остатков аминокислот, протеиды – сложные белки, содержащие в своем составе кроме собственно молекулы белка связанный небелковый компонент (углевод, металл, пигмент, липид, нуклеиновая кислота и т.д.). Протеины по растворимости классифицируют на альбумины (растворяются в воде), находятся во всех растительных тканях; глобулины (растворяются в слабых растворах нейтральных солей), большое количество их найдено в семенах бобовых и масличных культур; проламины (растворяются в 70%-ном этиловом спирте), специфичны для злаковых культур; глютелины (растворяются в слабых растворах щелочей), находятся как в зеленых частях растений, так и в семенах. Структуры белков. Первичная структура представлена линейной последовательностью аминокислот, связанных между собой пептидными связями. Вторичная структура аминокислотная цепь закручивается в спираль, которая стабилизируется водородными мостиками. Третичная структура – представлена глобулой, в организации которой принимают участие дисульфидные мостики. Четвертичная структура – представлена несколькими глобулами, объединенными в единое целое и выполняющими одинаковую функцию. Белки выполняют функции: структурную, ферментативную, транспортную, запасную, иммунную (защитную). Ход работы. 3 - 5 г бобовой муки заливают 10%-ным раствором (NН4)2SО4. Взбалтывают в течение 3-х минут и оставляют стоять 30 минут. Затем отфильтровывают через плотный фильтр. Если фильтрат получается мутным, сливают его обратно на фильтр. В растворе находится солерастворимый белок - глобулин, с которым проделать следующие реакции. 1. Нерастворимость в воде. Налить в пробирку 2 – 3 мл раствора белка и прибавить избыток воды. В пробирке появляется муть вследствие выпадения глобулина в осадок. Однако этот осадок растворяется при добавлении слабого раствора соли (NH4)2SO4 или другой нейтральной соли. Вывод: 11 2. Высаливание белка. К 2 – 3 мл раствора белка прибавить концентрированный раствор нейтральной соли (или сухую соль). Когда концентрация раствора соли достигнет 50%, он помутнеет. Если затем прибавить воды, т.е. уменьшить концентрацию соли, муть исчезает, т.к. глобулин снова переходит в раствор – реакция высаливания обратима. Вывод: 3. Денатурация белка. В пробирку налить 2 – 3 мл раствора белка, добавить 2 - 3 капли концентрированной H2SO4 (или HCl, HNO3). Сразу же образуется осадок, который не растворяется в растворах солей. В пробирку налить 2 – 3 мл раствора белка и нагреть до кипения. Выпавший осадок также не растворяется в солях. В пробирку налить 2 - 3 мл раствора белка и добавить сухую соль тяжелых металлов (Pb(CH3COO)2). Выпавший осадок также не растворяется в солях. Вывод: 4. Биуретовая реакция. Обусловлена наличием пептидных (кислотамидных) связей в молекуле белка, благодаря которым в щелочной среде с солями меди белок образует цветную комплексную соль. К 2 - 3 мл раствора белка добавить 1 мл 20%-ного раствора щелочи и взболтать смесь. Затем добавить 1 - 2 капли 5%-ного раствора CuSO4. Появляется фиолетовое окрашивание. Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 4: РАСТИТЕЛЬНЫЕ УГЛЕВОДЫ, ЛИПИДЫ И ИХ СВОЙСТВА. Цель: познакомиться с основными свойствами углеводов и липидов. Работа 5. Получение растворов моно-, ди- и полисахаридов и изучение их свойств. Объект исследования: корнеплоды моркови и свеклы, клубень картофеля. 12 Материалы и оборудование: реактив Феллинга, концентрированная серная кислота в капельнице, 10%-ный раствор Na2CO3. Пробирки, воронки, фильтры, терка, спиртовка, держатель для пробирок. Вводные пояснения. Углеводы – наиболее распространенные вещества в растениях. Доля их в отдельных частях растений может достигать 90% и более сухого вещества. В зависимости от числа мономеров в строении углеводов их подразделяют на моно-, олиго- и полисахариды. К моносахаридам (монозам) относятся простые углеводы, имеющие 3 (триозы), 4 (тетрозы), 5 (пентозы), 6 (гексозы), 7 (гептозы) углеродных атомов. В молекулах моноз имеется либо альдегидная группа (альдозы), либо кетонная (кетозы). К ним относятся пентозы (рибоза, дезоксирибоза, ксилоза, арабиноза, рибулоза, ксилулоза) и гексозы (глюкоза, фруктоза, манноза, галактоза). Олигосахариды: дисахариды - сахароза, мальтоза; трисахарид раффиноза. Полисахариды: крахмал, клетчатка, целлюлоза, гемицеллюлоза, пектиновые вещества. Для определения моносахаридов используют реактив Феллинга, в состав которого входит окись меди. Сахар, отнимая от окиси меди кислород, окисляется за счет своей альдегидной группы в глюконовую кислоту, а окись меди восстанавливается в закись, которая выпадает в виде кирпично-красного осадка; иногда выпадает желтый гидрат закиси меди. Тот и другой указывают на присутствие в растворе глюкозы. Ход работы. 1. 1 - 2 г глюкозы помещают в пробирку, обливают 5 мл воды, встряхивают и приливают равный объем реактива Феллинга и нагревают на водяной бане. Выпадает кирпично-красный осадок. Вывод: 2. 1 - 2 г сахарозы помещают в пробирку, обливают 5 мл воды, встряхивают, делят на 2 порции по 2,5 мл. С одной порцией проделывают реакцию с реактивом Феллинга, а во вторую порцию прибавляют 2 капли концентрированной серной кислоты и в течение 3 мин. кипятят на водяной бане. После этого раствор нейтрализуют 10%-ым раствором соды (Na2CO3) и затем проделывают с ним реакцию с реактивом Феллинга. В присутствии восстанавливающих сахаров выпадает кирпично-красный осадок закиси меди (Cu2O). Сравнивают количество полученного осадка закиси меди в первой и второй порциях. Вывод: 13 3. Для получения крахмала берут 1 - 2 очищенных клубня картофеля и натирают на терке (можно использовать готовый крахмал). Полученную мезгу обливают небольшим количеством воды, отжимая через марлю в стакан, и дают вытяжке отстояться. Когда вся муть осядет на дно, сливают сверху жидкость и несколько раз, помешивая стеклянной палочкой, промывают холодной водой. При этом каждый раз дают жидкости отстояться и сливают воду. Затем полученный осадок высушивают сначала просто в стакане, оставляя в теплом месте, а потом высыпают на фильтровальную бумагу, распределяя тонким слоем. Полученный порошок будет не что иное, как крахмал (картофельная мука), с некоторыми свойствами которого можно ознакомиться следующим образом: а) 1 г крахмала высыпают в пробирку с 10 мл воды, встряхивают и дают отстояться. Замутившаяся вода очень быстро начнет просветляться, и крахмал постепенно осядет на дно. Вывод: б) к 50 мл нагретой воды прибавить 1 г крахмала, предварительно разбавленного в 10 мл воды, размешать палочкой и прокипятить (кипятить до тех пор, пока жидкость не станет более или менее прозрачной). Полученный раствор будет иметь вид жидкого студня. Вывод: в) при прибавлении к холодному крахмальному клейстеру нескольких капель раствора I в KI клейстер окрашивается в синий цвет. При нагревании эта окраска исчезнет, возвращаясь снова при охлаждении клейстера. Вывод: г) к 12 мл крахмального клейстера прибавить 1 - 2 капли концентрированной Н2SO4 и кипятить 2 минуты. При кипячении крахмала с минеральными кислотами происходит гидролитический распад его, причем конечным продуктом в данном случае будет глюкоза. Получение последней нужно проверить реактивом Феллинга: в пробирку приливают равный объем реактива Феллинга и нагревают на спиртовке до кипения. Выпадает кирпично-красный осадок закиси меди. Вывод: 14 Работа 6. Изучение свойств растительных масел. Объект исследования: подсолнечное масло. Материалы и оборудование: семена масличных культур, 20%-ный спиртовой раствор КОН, 10%-ный спиртовой раствор КОН или NaOH, пробирки, пипетки, спиртовка. Вводные пояснения. Липиды – сложные эфиры глицерина и высших жирных кислот. Липиды подразделяются на 2 класса: собственно жиры (или истинные липиды); псевдолипиды (липоиды или жироподобные соединения). К собственно жирам относятся: истинные липиды (соединения жирных кислот и глицерина); фосфолипиды (соединения жирных кислот, глицерина и остатков фосфорной кислоты); сульфолипиды (соединения жирных кислот, глицерина и остатков серы); глюколипиды (соединения жирных кислот, глицерина и углевода); воска (соединения высокомолекулярных спиртов и жирных кислот). К псевдолипидам относятся: хлорофилл; жирорастворимые витамины (А, Д, Е, К); стеролы; терпены. Растительные жиры (или масла) – главный запасной продукт семян большинства растений. Жиры в семенах растений могут накапливаться в большом количестве – до 30 - 40% общей массы. Ход работы. 1. В пробирку налить 0,5 - 1,0 мл подсолнечного масла, прибавить 5 - 10 мл воды, закрыв пробирку, встряхнуть в течение 3 минут. Масло разбивается на мелкие капли, образуя эмульсию. Эмульсия нестойкая, и очень скоро все капли масла собираются вместе в один слой на поверхности воды, что указывает на нерастворимость жира в воде. Вывод: 2. К капле масла прибавить 2 мл 20%-ного спиртового раствора едкого кали и осторожно нагреть до кипения. Липиды при этом распадаются в щелочной среде, присоединяя три молекулы воды, на глицерин и жирные кислоты. Последние немедленно вступают в реакцию со щелочью, образуя соли жирных кислот, называемые мылами, т.е. происходит реакция омыления. При избытке воды раствор делается прозрачным. Вывод: 3. 2 – 3 мл масла налить в плоскую чашечку и выставить ее на воздух и на свет на несколько дней. При доступе воздуха и на свету жир довольно ско15 ро начинает портиться, т.к. происходит так называемое прогоркание благодаря постепенному распаду жира на глицерин и жирные кислоты. Свободные жирные кислоты окисляются в летучие вещества, которые и издают неприятный запах. Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 5: ПОГЛОЩЕНИЕ ВОДЫ РАСТИТЕЛЬНОЙ КЛЕТКОЙ Цель: познакомиться с методами определения осмотического давления и водного потенциала. Работа 7. Определение осмотического давления клеточного сока методом плазмолиза Объект исследования: луковица репчатого лука с пигментированными чешуями. Материалы и оборудование: 1M раствор KNO3 или сахарозы. Микроскопы, предметные и покровные стекла, бюксы, лезвия, градуированные пипетки на 10 мл, препаровальные иглы, часы, фильтровальная бумага. Вводные пояснения. Растительную клетку можно рассматривать как осмотическую систему, в которой роль полупроницаемой мембраны выполняет цитоплазма, прежде всего, плазмалемма и тонопласт, а роль осмотически деятельного раствора - клеточный сок (водный раствор органических и неорганических веществ), находящийся в вакуоли. Потенциальное осмотическое давление выражает максимальную способность клетки всасывать воду. Величина этого показателя указывает на возможность растения произрастать на почвах различной водоудерживающей силы. Повышение осмотического давления при засухе служит критерием обезвоживания растений и необходимости полива. Потенциальное осмотическое давление зависит от числа частиц, находящихся в этом растворе, т.е. от концентрации и степени диссоциации растворенных молекул. Согласно теории электролитической диссоциации, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы, т.е. катионы, к которым относятся, например, 16 ионы водорода и металлов и анионы, к которым принадлежат ионы кислотных остатков и гидроксид-ионы. Данный метод основан на подборе такой концентрации наружного раствора, которая вызывает самый начальный (уголковый плазмолиз) в клетках исследуемой ткани. В этом случае осмотическое давление раствора примерно равно осмотическому давлению клеточного сока. Такой наружный раствор называют изотоническим. Ход работы. В бюксах готовят по 10 мл растворов согласно форме таблицы 3. Для опыта взять 1M раствор KNO3 (или сахарозы) и с помощью разбавления дистиллированной водой получить нужную концентрацию. Приготовленные растворы тщательно перемешивают и закрывают крышками, предохраняя от испарения. Бюксы (пробирки) с растворами ставят в ряд по убывающей концентрации, сделав на них соответствующие метки. Лезвием безопасной бритвы делают тонкие срезы с выпуклой поверхности пигментированной чешуи луковицы из среднего хорошо окрашенного участка. В каждый бюкс, начиная с высокой концентрации, опускают по 1 - 2 среза с интервалом 3 мин. Через 30 минут после погружения срезов в первый бюкс их исследуют под микроскопом. Затем через 3 мин. наблюдают срезы из последующих бюксов. Таким способом достигают равную продолжительность пребывания срезов в растворах плазмолитика. Рассматривать срезы под микроскопом следует в капле из того же бюкса, где находился срез. Определяют степень плазмолиза клеток в каждом растворе и находят изотоническую концентрацию как среднее арифметическое между концентрацией, при которой наблюдался плазмолиз, и концентрацией, которая его уже не вызывает. Результаты опыта записать в таблицу 4. Зная изотоническую концентрацию наружного раствора, вычисляют потенциальное осмотическое давление клеточного сока (Росм.) по формуле: P осм. = R T с i 101,3 = = КПа, где R - газовая постоянная, равная 0,0821 л атм/град моль; Т - абсолютная температура по Кельвину (273°С + комнатная); с - изотоническая концентрация, моль; i - изотонический коэффициент Вант-Гоффа, характеризующий ионизацию растворов и вычисляется по формуле: i = 1 + α (n - 1), где α - степень диссоциации раствора данной концентрации; n - число ионов, на которое диссоциирует соль (таблица 3). Так как неэлектролиты недиссоциируют, для сахарозы i = 1. 101,3 - множитель для перевода атмосфер в килопаскали. В зависимости от вязкости цитоплазмы в клетках чешуи репчатого лука осмотическое давление варьирует, как правило, от 300 до 1300 кПа. Таблица 3 - Степень диссоциации KNO3 разной концентрации Конц. 0,5 0,4 0,3 0,2 α (KNO3) 0,71 0,74 0,76 0,79 17 0,1 0,83 Таблица 4 - Определение осмотического давления клеточного дом плазмолиза КонНа 10 мл Продолжитель- Степень Изотоцентраствора ность пребывания плазмо- ничесрация, срезов в растворе лиза кая конмоль/л 1 М р-ра воды, время центвремя рация, сахамл погру- наблюдемоль/л розы, мл жения ния 0,7 7 3 0,6 6 4 0,5 5 5 0,4 4 6 0,3 3 7 0,2 2 8 0,1 1 9 Вывод: сока метоПотенциальное осмотическое давление, кПа Работа 8. Определение концентрации клеточного сока и осмотического давления рефрактометрическим методом Объект исследования: листья растений. Материалы и оборудование: ручной пресс, ножницы, пипетки, фильтровальная бумага, рефрактометр, марля. Вводные пояснения. Рефрактометрический метод позволяет быстро и точно определить концентрацию клеточного сока и потенциальное осмотическое давление. Метод основан на учете показателя преломления света клеточным соком. Ход работы. При помощи ручного пресса получают сок исследуемых растений, предварительно завернутых в кусочек марли. На нижнюю поверхность призмы рефрактометра наносят две капли исследуемого сока и прижимают верхней поверхностью призмы. Прибор направляют на свет и вращением винта на тубусе добиваются четкого изображения в окуляре вертикальной шкалы с делениями, обозначающими содержание сахара в растворе (в %). Деление шкалы, через которое проходит горизонтальная граница между светлым и темным полями, соответствует концентрации сахара в клеточном соке испытуемого растения. Делают не менее трех определений для каждого варианта. При переходе на другой вариант призму дважды протирают сначала сухой, а затем влажной фильтровальной бумагой. По специальным таблицам находят величину потенциального осмо18 тического давления в кПа, соответствующую найденной оптической плотности клеточного сока и его концентрации. Результаты опыта заносят в таблицу 5. Таблица 5 - Определение концентрации клеточного сока и осмотического давления рефрактометрическим методом Вариант Показатель рефКонцентрация Потенциальное опыта рактометра клеточного сока, осмотическое % давление, кПа Вывод: Работа 9. Определение водного потенциала листьев методом Шардакова Объект исследования: лист герани. Материалы и оборудование: 1 М раствор КNО3, метиленовая синяя. Штативы с двумя рядами пробирок, градуированные пипетки на 10 мл, мерные пипетки на 0,5 мл, сверла, пинцеты, стеклянные палочки. Вводные пояснения. Метод Шардакова основан на сравнении плотностей исходного (контрольного) раствора с этим же раствором после выдерживания в нем ткани. У раствора, не изменившего плотности водный потенциал равен водному потенциалу клеток листа. Ход работы. Из листа сверлом вырезают 10 дисков. В пять пробирок нижнего ряда опускают по 2 диска на 40 минут. Затем диски удаляют и подкрашивают опытные растворы в 5 пробирках нижнего ряда метиленовой синей (взятой в небольшом количестве). Пипеткой на 0,5 мл набирают подкрашенный опытный раствор. Конец пипетки опускают в исходный раствор в пробирки верхнего ряда. Медленно выпускают жидкость из пипетки, отмечая направление движения струйки. Если концентрация и, следовательно, плотность окрашенного раствора увеличились по сравнению с исходными, то струйка пойдет вниз; если концентрация уменьшилась - струйка пойдет вверх. При равенстве концентраций струйка равномерно распределяется внутри пробирки. Результаты опыта заносят в таблицу 6. Ψн2о = - Р осм. = - R Т С I 101,3 = = кПа 19 Таблица 6 - Определение водного потенциала методом Шардакова Концент- На 10 мл раствора Направление Концентрация, Водный рация расдвижения оставшаяся потенциал, 1 М р-ра воды, твора, струйки неизменной кПа КNО3, мл мл моль/л моль/л 0,5 5,0 5,0 0,4 4,0 6,0 0,3 3,0 7,0 0,2 2,0 8,0 0,1 1,0 9,0 Вывод: Дата__________________ Подпись преподавателя___________________ Вопросы для самоконтроля по разделу «Физиология и биохимия растительной клетки» 1. Предмет, задачи и методы физиологии растений. 2. Место физиологии растений в системе биологических знаний среди естественнонаучных и агрономических дисциплин. 3. Современные проблемы физиологии растений. 4. Изучение процессов жизнедеятельности на разных уровнях организации. 5. Строение и функционирование растительной клетки. 6. Клеточная оболочка: строение и функции. 7. Строение, свойства и функции протоплазмы. 8. Строение, свойства и функции биологических мембран. 9. Строение и функции органелл клетки. 10. Строение, свойства и функции белков. 11. Строение, свойства и функции нуклеиновых кислот. 12. Строение, свойства и функции липидов. 13. Строение, свойства и функции углеводов. 14. Строение, свойства и функции ферментов. 15. Регуляция процессов жизнедеятельности на клеточном уровне. 16. Реакции клетки на внешние воздействия и основанные на них методы диагностики состояния растительных тканей и растений. 17. Клетка как осмотическая система. 20 РАЗДЕЛ 2. ВОДНЫЙ ОБМЕН РАСТЕНИЙ Все физиологические процессы в растении нормально протекают лишь при полном обеспечении ее водой. Вода не только растворитель, но и активный структурный компонент клетки. Вода имеет определяющее значение для жизнедеятельности растения. Она составляет от 80 до 95% массы растущих тканей. В семенах в воздушно-сухом состоянии ее содержание резко снижается и составляет от 8 до 15%. Стволы деревьев содержат 40 – 55% воды, листья древесных и кустарниковых пород – 7 – 82% воды, листья травянистых растений – 83 – 86% воды, корни – 87 – 92% воды, сочные плоды, корне- и клубнеплоды – 80 -95% воды. Вода обладает высокой теплоемкостью и скрытой теплотой парообразования, поэтому способствует стабилизации температуры растения. Обеспечивает связь органов друг с другом, а также возможность передвижения по растению питательных веществ. Вода играет существенную роль в сохранении формы травянистых растений, поддерживая их клетки в состоянии тургора. Водный баланс растения определяется соотношением между поглощением и отдачей воды. Вода в растение поступает благодаря работе двух концевых двигателей: нагнетающего корневого и присасывающего листового. Деятельность нижнего концевого двигателя, состоящая в активном поглощении воды коневой системой, проявляется в плаче (вытекание пасоки на порезанных участках стебля) и гуттации (выделение влаги листьями в условиях затрудненного испарения) растений. Силу, поднимающую воду вверх по сосудам, называют корневым давлением. Величина его обычно составляет 100 кПа (1 атм.) у травянистых растений и 500 – 800 кПа у древесных. Корневое давление имеет большое значение в поглощении воды растением в весеннее время до распускания листьев и у проростков, особенно при подземном прорастании. Существенна роль корневого давления в поддержании непрерывности водных нитей в сосудах ксилемы (адгезия и когезия). Корневое давление ликвидирует в ночные часы возникший за день водный дефицит. Работа верхнего концевого двигателя обусловлена испарением воды с поверхности листа, называемым транспирацией. Присасывающее действие транспирации передается корням в форме гидродинамического натяжения, которое связывает между собой работу обоих двигателей. Основная масса воды поступает в растение через корневые волоски. Вода проходит через кору корня в ксилему, поднимается по ксилеме к листьям и испаряется с поверхности клеток мезофилла в межклетники, а затем диффундирует наружу через устьица. Этот процесс называется транспирацией, а поток воды из корня к транспирирующей поверхности транспирационным током. Транспирация - испарение воды с поверхности растения. Существует три основных структуры, участвующие в испарении: 1. Устьица - поры, через которые диффундирует вода, испарившаяся 21 с поверхности клеток. Такие поры есть в эпидермисе листьев и зеленых стеблях (через устьица теряется примерно 90% воды). Такая транспирация называется устьичной. Главным органом транспирации является лист. Транспирация может, прежде всего, регулироваться путем открывания и закрывания устьичных отверстий. Общая площадь устьичных отверстий составляет лишь 1 - 2% площади листа. Несмотря на это, транспирация листа достигает 50 - 70% испарения, равной по величине водной поверхности. Чем больше устьиц приходится на единицу поверхности листа, тем быстрее идет транспирация. У двудольных растений на нижней поверхности листа устьиц больше, чем на верхней, а у однодольных, листья которых обычно расположены вертикально, устьица распределяются в равном количестве и на верхней и на нижней поверхности. У растений, адаптированных к засушливым условиям, устьиц в среднем (на ед. поверхности) значительно меньше, по сравнению с растениями увлажненных мест обитания. 2. Кутикула - восковой слой, покрывающий эпидермис листьев и стеблей; через этот слой проходит вода, испаряющаяся с наружных стенок клеток эпидермиса (около 10% потерь воды). Такая транспирация называется кутикулярной. Транспирация через кутикулу обычно идет тем быстрее, чем тоньше кутикула, хотя важен и химический состав транспирируемой воды. Если кутикула тонкая (как, например, у папоротников), через нее может теряться до 30 - 45% всей транспирируемой воды. У двудольных растений кутикула на верхней поверхности листьев обычно толще, чем на нижней. 3. Чечевички - небольшие отверстия (участки рыхлой ткани) в опробковевшей коре деревьев и кустарников, служащие для газообмена (доля потерь воды минимальная), однако у листопадных деревьев после сбрасывания листвы через чечевички теряется основная масса воды. Такая транспирация называется перидермальной. При выращивании сельскохозяйственных культур большое значение имеет эффективность использования воды растениями, показателем которой служит транспирационный коэффициент – количество воды, расходуемое растением на создание единицы массы сухого вещества. Для большинства сельскохозяйственных растений транспирационный коэффициент составляет в среднем 300 – 500. Количество созданного сухого вещества на 1 л транспирированной воды характеризует продуктивность транспирации. В зависимости от условий выращивания и видовых особенностей растений она составляет 2 – 8, чаще 3 – 5 г/л. В агрономической практике обычно определяют коэффициент водопотребления (эвапотранспирационный коэффициент), который рассчитывают как отношение эвапотранспирации к созданной биомассе или хозяйственно-полезному урожаю. Под эвапотранспирацией понимают суммарный расход воды за вегетацию 1 га посева или насаждения, т.е. сюда включаются испарение с поверхности почвы (эвапорация), транспира22 ция культурных растений и сорняков. Эвапотранспирацию можно рассчитать балансовым способом. Она равняется разности содержания влаги в метровом слое почвы в начале и в конце вегетации плюс приход воды с осадками и с поливом. Степень использования воды растением можно повысить, создавая для него оптимальные условия водоснабжения и питания. Орошение – наиболее радикальный способ повышения урожайности сельскохозяйственных культур в засушливых условиях. В практике орошаемого земледелия наиболее эффективно поддерживать влажность почвы в пределах 50 – 80% НВ с учетом биологических особенностей сельскохозяйственных культур, фаз онтогенеза, уровня агротехники, почвенноклиматических условий. При разработке рациональных режимов орошения нужно определить оросительную норму – количество воды на 1 га, необходимое за вегетационный период. Ее можно рассчитать на планируемый урожай с использованием средних коэффициентов водопотребления данной культуры. Сезонное водопотребление полевых культур составляет 3000 – 4000 м3/га, яблони – 5000 – 6000 м3/га. Среднесуточный расход влаги полевыми культурами – 2,5 – 3,5мм (1 мм осадков – 10 м3/га). Поливная норма – количество воды, необходимое для текущего полива. ТЕМА 1: МЕТОДЫ ИЗУЧЕНИЯ КОРНЕВОГО ДАВЛЕНИЯ И ТРАНСПИРАЦИИ Цель: выяснить роль корневой системы в поступлении воды в растение. Ознакомиться с физиологией устьичной транспирации растений. Освоить методы определения интенсивности транспирации и относительной транспирации. Работа 10. Влияние внешних условий на процесс гуттации Объект исследования: 5 - 8-дневные проростки зерновых культур. Материалы и оборудование: выращенных в стаканах с песком. Стеклянные колпаки, лед или снег, термометр, плитка, фильтровальная бумага, стакан на 250 мл, кристаллизаторы. Вводные пояснения. Корневая система не только всасывает воду из почвы, но и активно нагнетает ее в стебель с определенной силой – корневым давлением. Корневое давление обнаруживается по «плачу» растений (выделение сока (пасоки) на порезанных участках стебля) и гуттации (выделение капель воды на кончиках листьев при высокой влажности воздуха). Ход работы. Для опыта нужно взять четыре сосуда с одинаковыми проростками 23 злаковых, обильно политыми теплой водой, и поместить в условия, согласно схеме, указанной в таблице 7. Таблица 7 - Определение гуттации в различных условиях внешней среды Вариант Условия опыта Наличие гуттации 1. Под колпаком при температуре 0°С (в кристаллизаторе со снегом) 2. Под колпаком при комнатной температуре 3. Под колпаком (в чашке с теплой водой, нагретой до 35°С) 4. Без колпака при комнатной температуре Вывод: Работа 11. Сравнение транспирации верхней и нижней сторон листа хлоркобальтовым методом (по Шталю) Объект исследования: растения различных экологических групп. Материалы и оборудование: хлоркобальтовые полоски, канцелярские скрепки, часы, микроскопы, стекла предметные и покровные, пинцеты, капельницы с водой, лезвия безопасной бритвы, препаровальные иглы. Вводные пояснения. Устьичная щель образуется между двумя замыкающими клетками полулунной или бобовидной формы с утолщенными внутренними (прилегающие к щели) стенками. При насыщении замыкающих клеток водой более тонкие наружные стенки их растягиваются, кривизна клеток увеличивается и щель раскрывается. Поэтому чем более клетки насыщены водой, тем шире раскрыты устьичные щели. При недостатке воды в растении, стенки замыкающих клеток лишены тургора, между ними не образуется устьичная щель. Следовательно, основным фактором, вызывающим движение замыкающих клеток устьиц, является содержание воды в листе. Ход работы. Хлоркобалътовую бумагу на полиэтиленовой подложке прикладывают к верхней и нижней сторонам листа и укрепляют канцелярской скрепкой. Наблюдают через сколько минут порозовеет бумага на обеих сторонах листа. По скорости порозовения определяют, с какой стороны листа испарение идет быстрее. Исследуют под микроскопом эпидермис верхней и нижней сторон 24 листа и подсчитывают количество устьиц в поле зрения микроскопа. Результаты опыта заносят в таблицу 8. Таблица 8 - Интенсивность транспирации листьев Сторона Период наблю- Время, за коЧисло устьиц в поле зрения листа дения торое порозомикроскопа начало конец веет бумага, отдельные среднее мин. подсчеты арифметическое Верхняя Нижняя Вывод: Работа 12. Определение состояния устьиц методом инфильтрации (по Молишу) Объект исследования: листья герани. Материалы и оборудование: капельницы, спирт, бензол, ксилол. Вводные пояснения. Скорость диффузии водяных паров из межклетников через устьица в атмосферу зависит как от степени насыщенности воздуха водяными парами, так и от степени открытия устьиц. Размеры устьичных щелей изменяются в течение суток. Состояние устьиц в дневные часы хорошо отражает обеспеченность растения влагой и служит простым методом диагностики состояния водообмена организма. За движением устьиц можно следить различными способами. Один из них является метод, основанный на том, что жидкости, обладающие различной вязкостью, поразному проникают через устьица в межклетники, вытесняя из них воздух. Этот метод называется инфильтрацией. На том месте листа, куда проникла жидкость, появляется прозрачное пятно. Спирт не проникает в межклетники, а оставаясь на поверхности листовой пластинки, быстро испаряется, ксилол менее вязкий и проникает в слабо открытые устьица, бензол занимает среднее положение. Если устьица закрыты, ни одна из жидкостей не поступает в межклетники. Ход работы. На соседние участки нижней стороны листа наносят спирт, бензол и ксилол. Держат лист в горизонтальном положении до исчезновения капель, которые могут либо испариться, либо проникнуть внутрь листа. Степень открытия устьиц (проникновение жидкости) в соответствующих графах отмечается «+», отсутствие инфильтрации «-». Результаты записывают в таблицу 9. 25 Таблица 9 - Определение степени раскрытия устьиц Условия Проникновение опыта спирта бензола ксилола Степень раскрытия устьиц Вывод: Работа 13. Определение интенсивности транспирации и относительной транспирации при помощи технических весов Объект исследования: листья герани. Материалы и оборудование: технические весы, кристаллизатор, часы, чашки Петри, ножницы, бумага, линейка, вата. Вводные пояснения. Интенсивность транспирации - количество воды, испарившейся с единицы листовой поверхности в единицу времени. Величина ее зависит от внешних факторов, времени суток и колеблется в пределах 15 - 250 (г/м2-ч). Основной метод определения интенсивности транспирации - весовой, основан на учете потери воды при испарении. Этим методом можно изучать транспирацию целого растения или отдельных его частей. Работа с интактными растениями значительно затруднена, поэтому чаще используют срезанные побеги или листья. Чтобы во время опыта оводненность тканей не снижалась, их помещают в колбу, заполненную водой. Относительная транспирация - отношение интенсивности транспирации к интенсивности испарения со свободной водной поверхности при тех же условиях. Этот показатель характеризует способность растений регулировать транспирацию и обычно составляет 0,1 - 0,5, поднимаясь иногда до 1 и опускаясь у некоторых хорошо защищенных от потери воды листьев до 0,01 и ниже. Ход работы. С растения герани срезают лист вместе с черешком. Нижний конец черешка подрезают наискось под водой примерно на 1 см для восстановления водных нитей в проводящих сосудах. Черешок укрепляют с помощью ваты в колбе, наполненной водой (черешок листа погружен в воду). Готовят две колбы, взвешивают их на технических весах, и, снабдив этикетками, помещают одну в темную камеру, другой - на прямой свет. Через 26 1 ч взвешивают повторно. По разнице с первоначальной массой устанавливают количество воды, которое испарил лист за время опыта. Из бумаги вырезают квадрат бумаги площадью 100 см2 (10х10), взвешивают. На другой лист такой же бумаги кладут исследуемый лист растения, обводят его контур карандашом, вырезаю по контуру и также взвешивают. Составляют пропорцию: если квадрат бумаги в 100 см2 имеет массу А (г), а кусочек бумаги, вырезанный по контуру листа, площадью S см2 – В (г), искомую площадь листа можно находят: S = 100 В/А (1) 2 Интенсивность транспирации (г/м -ч) рассчитывают по формуле: Т = 10000 С/ S t (2) 2 где С – убыль в массе за время опыта, г; S – площадь листа, см ; t – продолжительность опыта, ч. Параллельно в тех же условиях определяют испарение со свободной водной поверхности. Для этого учитывают количество воды, испарившейся за 1 ч с поверхности чашки Петри. Определив внутренний диаметр чашки Петри, вычисляют ее площадь: S = π r2 (3) Рассчитывают интенсивность испарения (Е) со свободной водной поверхности, пользуясь формулой (2), и вычисляют величину относительной транспирации (О): ОТ = Т/Е Результаты опыта записывают в таблицу 10 по приведенной форме. Вывод: 27 Относительная транспирация Продолжение таблицы 10 Условия Испарение с поверхности воды опыта масса чашки убыль Площадь ПродолПетри с водой, массы, испаряю- жительг г щей ность поверхопыта, в начав ности, ч ле конце 2 см опыта опыта Интенсивность испарении, г/м2ч Таблица 10 - Определение интенсивности транспирации и относительной транспирации Условия Транспирация Интенсивопыта масса прибора с убыль Пло- Продолжи- ность транспи-рации, листом, г массы, щадь тельность г/м2 ч г листа, опыта, в начале в конце см2 ч опыта опыта Работа 14. Определение интенсивности транспирации у срезанных листьев при помощи торзионных весов по Л.А. Иванову Объект исследования: листья растений различных экологических групп, десятидневные проростки ржи и пшеницы. Материалы и оборудование: торзионные весы, фены, ножницы, подставки для подвешивания растений. 3 4 5 6 Начальная Через 5 минут Вывод: 28 7 8 9 10 Интенсивность транспирации, мг/г ч 2 Потеря воды 10 листьями, мг 1 Суммарная масса 10 листьев, мг Вводные пояснения. Основным методом определения интенсивности транспирации является весовой метод. Метод основан на учете изменения массы срезанного транспирирующего листа за короткие промежутки времени. При этом у растений, выросших в естественных условиях, можно определить потерю в весе 15...250 г/м2 ч. Ход работы. Срезают лист, надевают на крючок торзионных весов. Быстро взвешивают. Таким образом взвешивают листья одного и того же яруса с пяти - десяти растений. Через 5 минут после взвешивания первого листа повторно взвешивают все листья в первоначальном порядке. Рассчитывают количество воды, испарившейся из 1 г сырых листьев за 1 ч. В качестве варианта можно использовать различные листья или создавать экстремальные условия: сухой ветер, жару. Результаты записывают в таблицу 11. Таблица 11 - Определение интенсивности транспирации срезанных листьев Вариант Масса Повторность опыта листьев, мг Дата__________________ Подпись преподавателя____________________ ТЕМА 2: ВЛИЯНИЕ НЕДОСТАТКА ВОДЫ НА РАСТЕНИЕ Цель: освоить методы определения водоудерживающей способности и водного дефицита растений. Работа 15. Определение водоудерживающей способности растений методом «завядания» по А. Арланду Объект исследования: пятнадцатидневные растения овса или пшеницы. Материалы и оборудование: парафин, подкрашенный Суданом-III. Штативы, технические весы, ножницы, водяная баня. Вводные пояснения. В регулировании водообмена растений значительную роль играют водоудерживающие силы, обусловленные в основном содержанием в клетках осмотически активных веществ и способностью коллоидов к набуханию. Водоудерживающая способность клеток зависит от условий выращивания растений. В частности, большое влияние оказывают условия питания. При оптимальных условиях водоудерживающая способность возрастает, водоотдача за 30 минут составляет 4 – 6% исходной величины. Определение водоудерживающей способности по А. Арланду основано на учете потери воды завядающими растениями. Ход работы. Берут пятнадцатидневные растения овса или пшеницы, выращенные на песке с внесением удобрений (опыт) и без удобрений (контроль). Из песка осторожно извлекают по 20 растений каждого варианта и отделяют надземную часть от корней. Часть стебля, находившуюся в песке, покрывают парафином, чтобы исключить ее участие в испарении воды. Для этого нижние этиолированные части стебля опускают в расплавленный парафин, подкрашенный Суданом-III с температурой не выше 50°С. Взвешивают все растения вместе на технических весах, расставляя их в штативы. Взвешивания повторяют через 30 минут, 1 час, 1 час 30 минут и 2 часа. Убыль в массе показывает абсолютное количество воды, которое теряют испытуемые растения за 30 минут. Для установления испаряющей массы взвешивают отчлененные парафинированные участки и вычитают из исходной массы растения. Используя поученные данные, вычисляют количество испарившейся воды в процентах испаряющей массы за последовательные интервалы в 30 минут. Результаты опыта записывают в таблицы 12 по приведенной форме. 29 Масса парафинированных участков, г через 2 ч через 1 ч 30 мин через 1 ч первоначальная через 30 минут Число растений Вариант Таблица 12 - Определение водоудерживающей способности растений Масса растеКол-во ИспаряюПотеря ний, испаривщая масса, воды за г шейся воды г 30 мин., за % каждые 30 мин., г 1 2 3 4 1 2 3 4 1 2 3 4 Вывод: Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Водный обмен растений» 1. Общая характеристика водного обмена растений. Свойства воды и ее значение в жизни растений. 2. Термодинамические основы поглощения, транспорта и выделения воды. 3. Корневое давление, его природа, зависимость от внутренних и внешних условий. 4. Биологическое значение транспирации. Лист как орган транспирации. 5. Строение и функционирование устьиц. 6. Зависимость транспирации от внешних условий, ее суточный ход. 7. Устьичное и внеустьичное регулирование транспирации. 8. Транспирационный коэффициент и его зависимость от внутренних и внешних условий. 9. Водный баланс растения и посева. 10. Коэффициент водопотребления сельскохозяйственных культур. 11. Физиологические основы орошения. 30 РАЗДЕЛ 3. ФОТОСИНТЕЗ Фотосинтез – процесс усвоения зелѐными растениями световой энергии и использования ее для образования органических веществ из диоксида углерода и воды. В ходе этого процесса в атмосферу выделяется кислород. В общем виде уравнение фотосинте hv, хлорофиллы 6СО2 + 6Н2О ------------------------------ С6Н12О6 + 6О2 ферменты Ежегодная первичная продуктивность фотосинтеза на планете составляет более 200 млрд. т сухой массы, в которой аккумулируется примерно 17 1021 Дж солнечной энергии. Т.о., фотосинтез – один из важнейших движущих факторов круговорота веществ и энергии на Земле. Фотосинтез протекает в хлоропластах, которые окружены двумя белково-липидными мембранами. В одной клетке листа в среднем присутствует 20 – 30 хлоропластов. Хлоропласт включает систему внутренних мембран - ламелл, образующих стопки тилакоидов - граны. В тилакоидах осуществляются световые реакции фотосинтеза и находятся все фотосинтетические пигменты и ферменты. В строме содержатся ферменты, участвующие в темновых превращениях диоксида углерода. В состав хлоропластов зелѐного листа входят пигменты - это вещества, избирательно поглощающие свет видимой части спектра. При освещении белым светом их окраска определяется теми лучами, которые они пропускают или отражают. Если вещество не поглощает свет, то к нам в глаз приходят все лучи видимого спектра, и для нас это вещество белое. Если вещество поглощает все лучи видимого спектра, то для нас оно черное. Способность пигментов поглощать свет связана с наличием в их молекулах правильно чередующихся двойных и одинарных связей. Это так называемые сопряженные двойные связи. Между двумя атомами, связанными двойной связью, находится 4 электрона. Если система состоит из сопряженных связей, то половина этих электронов может свободно перемещаться вдоль всей системы. Поглотив квант света, такой электрон способен оторваться от молекулы пигмента, т.е. пигмент становится донором электронов для восстановления вещества. Пигменты, участвующие в фотосинтезе высших растений, делятся на 2 группы: хлорофиллы - зеленые пигменты - и каротиноиды - желтые. Есть два хлорофилла — хлорофилл «а» (С55Н72О5N4Mg) и хлорофилл «b» (С55Н70О6N4Mg). Хлорофилл а - сине-зеленый, а хлорофилл b - желтозеленый. Хлорофиллы не растворяются в воде, но хорошо растворимы в органических растворителях и легко изменяются под действием кислот, солей и щелочей. В листе содержится примерно в три раза больше хлорофилла а по сравнению с хлорофиллом b. Хлорофиллы по своей химической природе являются сложными эфирами дикарбоновой кислоты хлорофиллина и двух спиртов - высокомолекулярного одноатомного спирта фитола С20Н39ОН и метилового спирта СН3ОН и представляют собой фетилметилхлорофиллиды. 31 Хлорофилл а отличается от хлорофилла b тем, что у третьего углеродного атома во втором пиррольном кольце его молекулы метильная группа заменена на альдегидную. Пигменты фотосинтеза находятся в мембранах тилакоидов хлоропластов. У высших растений это хлорофиллы а и b, каротиноиды (каротины, ксантофиллы) и феофитин. Хлорофилл а - главная функциональная часть пигментной системы растений. Он способен, поглотив квант света, передавать его энергию через цепь последовательных превращений на компоненты электронно-транспортной цепи. С их участием совершается преобразование энергии электронного возбуждения хлорофилла в химическую энергию АТФ и восстановленного НАДФ • Н2. СООСН3 СООСН3 Хлорофилл а MgN4OH30C32 СООС20Н39 Хлорофилл b MgN4O2H28C32 СООС20Н39 Каротиноиды - полиеновые углеводороды красного, желтого и оранжевого цветов, производные изопрена — СН2 = С(СН3) — СН = СН2 содержащие 40 атомов углерода. Каротиноиды представляют собой цепи, обладающие как и хлорофиллы сопряженными двойными связями. На обоих концах цепи находятся иононовые кольца. Каротиноиды присутствуют в хлоропластах всех растений. Они входят также в состав хромопластов. Свое название эти вещества получили от латинского названия моркови Dаисиs саrоtа в корнеплоде которой они содержатся в большом количестве. В зеленых листьях каротиноиды обычно незаметны из-за присутствия хлорофилла, но осенью, когда хлорофилл исчезает, окрашивают листья в желтый и оранжевый цвета. Каротиноиды подразделяются на каротины (ненасыщенные углеводороды с эмпирической формулой С40Н56), ксантофиллы, отличающиеся от каротиноидов присутствием кислорода (С40Н56О2) и каротиноидные кислоты. Обычно пигменты из растительной ткани извлекают полярными растворителями (этанолом, этиловым спиртом, ацетоном), которые нарушают связь хлорофиллов и каротиноидов с липопротеидами пластид и обеспечивают их полное экстрагирование из живых листьев. Фотосинтез осуществляется при участии многих ферментов и кофакторов. Условно в нем выделяют 2 стадии: световую, или фотохимическую, и темновую, или химическую. Первая включает реакции поглощения хлорофиллом и другими пигментами квантов света и последующую трансформацию световой энергии в химическую энергию связей аденозинтрифосфорной кислоты (АТФ) и восстановленного никотинамидадениндинуклеотидфосфата (НАДФ-Н). В темновой стадии запасная в форме АТФ и НАДФ-Н химическая энергия используется для восстановления акцептированного диоксида углерода до углеводов и других продуктов. Продукты фотосинтеза транспортируются во все органы растений и используются на процессы роста и развития, могут откладываться в запас. Продуктивность фотосинтеза зависит от внутренних факторов и 32 внешних факторов. Таким образом, значение фотосинтеза заключается в обеспечении клетки энергией АТФ. Другая роль фотосинтеза состоит в пополнении клетки строительным материалом в виде промежуточных продуктов цикла Кальвина. И, наконец, при фотосинтезе выделяется кислород и образуются запасные органические вещества. Фотосинтез посева представляется наиболее сложным уровнем регуляции ассимиляции СО2 в сравнении с молекулярным, органным и организменным уровнями. Для характеристики фотосинтетической деятельности посевов используют целый ряд показателей. Индекс листовой поверхности (ИЛП) – площадь листьев, приходящаяся на единицу площади посева. Оптимальный ИЛП, равный 4 – 7, характерен для посевов зерновых, зернобобовых, сахарной свеклы и др. культур, причем более высокие его значения отмечены у посевов с эректоидным (более вертикальным) расположением верхних листьев в благоприятных условиях выращивания. Фотосинтетический потенциал (ФП) – число «рабочих дней» листовой поверхности посева, рассчитываемое как произведение полусуммы площадей листьев за два последующих определения на длительность периода между этими определениями в днях. В Нечерноземной зоне в благоприятных условиях ФП составляет 2,5 – 3,0 млн. м2 дней/га для зерновых и 1,5 – 2,0 млн. м2 дней/га для картофеля. По некоторым данным каждые 1000 единиц ФП формируют 2 – 3 кг зерна, 5 – 7 кг картофеля, причем рост урожайности современных высокопродуктивных сортов в сравнении со стародавними обусловлен, главным образом, увеличением ИЛП и ФП. Чистая продуктивность фотосинтеза (ЧПФ) – накопление биомассы единицей площади листьев за единицу времени, измеряется в граммах сухой биомассы на 1 м2 за сутки, варьируя в зависимости от фазы развития и условий выращивания в широком диапазоне 7 – 15 г/м2 сут. Она максимальна при низких величинах ИЛП, когда листья хорошо освещены и заметно снижается с усилением загущенности и азотного питания. Коэффициент полезного действия (КПД) ФАР – отражает эффективность работы фотосинтетического аппарата в посеве. Посевы по их средним значениям КПД ФАР за период вегетации подразделяются на низкие (0,5 – 1,5%), средние (1,5 – 3,0%) и высокие (3,0 – 5,0), но за короткий период времени отмечены величины до 10%. КПД ФАР является основным показателем продуктивности и урожайности культур. ТЕМА 1: ХИМИЧЕСКИЕ И ОПТИЧЕСКИЕ СВОЙСТВА ПИГМЕНТОВ ЗЕЛЕНОГО ЛИСТА Цель занятия: познакомиться с двумя видами пигментов высших растений: хлорофиллами и каротиноидами. Освоить методы извлечения и обнаружения пигментов, изучить их основные химические свойства. Используя спектроскоп, который разлагает видимый луч света на спектр, определить 33 для каждого пигмента участки поглощения. Изучить явление флуоресценции хлорофилла и его роль в фотосинтезе как сенсибилизатора. Работа 16. Изучение химических свойств пигментов листа Объект исследования: свежие и сухие листья различных растений. Материалы и оборудование: этиловый спирт, бензин, 20%-ный раствор NaOH, 10%-ный раствор соляной кислоты в капельнице, уксуснокислый цинк или медь, спиртовка, водяная баня, штативы с пробирками, воронки, фильтровальная бумага, фарфоровая ступка, водяная баня, пипетки на 1 мл. 1. Получение спиртового раствора (вытяжки) пигментов. Ход работы. Листья мелко нарезают, растирают в фарфоровой ступке, добавив в неѐ 3 - 4 мл 96%-ного спирта. Можно добавить туда также немного кварцевого песка для того, чтобы удобнее было перетирать растительную ткань. В полученную массу прибавляют еще 8 - 10 мл спирта и продолжают растирать до появления интенсивного зелѐного окрашивания. Излишне много спирта брать не рекомендуется, чтобы не получилась слишком слабая вытяжка. Полученную массу фильтруют через складчатый фильтр в сухую пробирку и получают спиртовую вытяжку (экстракт) смеси пигментов листа, имеющую интенсивную зелѐную окраску, которую используют для выполнения всех последующих работ по данной теме. 2. Разделение пигментов по Краусу. Вводные пояснения. Один из первых методов разделения пигментов был предложен немецким ученым Краусом в 1860 г. Метод основан на различной растворимости пигментов в спирте и бензинее. Данные растворители в одном сосуде не смешиваются, а образуют две фазы - верхнюю бензиновую и нижнюю спиртовую. По мере расслоения эмульсии бензиновый слой будет окрашиваться в зеленый цвет из-за лучшей растворимости в нем хлорофиллов. В бензин переходит и каротин, но его окраска маскируется окраской хлорофилла. Ксантофилл остается в спиртовом слое, так как он лучше, чем каротин, растворим в спирте и придает ему золотисто-желтую окраску. Ход работы. В пробирку наливают 3 мл спиртовой вытяжки пигментов, прибавляют 4 мл бензина и 2 - 3 капли воды. Пробирку сильно встряхивают и дают отстояться. Зарисовывают картину распределения пигментов в системе спирт-бензин. Вывод: 34 3. Омыление хлорофилла щѐлочью. Вводные пояснения. Обработка хлорофилла щелочью может вызывать омыление эфирных связей, т.е. отщепление остатков метилового спирта и фитола. Образующаяся при этом соль хлорофиллиновой кислоты сохраняет зеленую окраску, но отличается от хлорофилла большей гидрофильностью. В данной работе образование щелочной соли обнаруживают по ее лучшей растворимости в спирте, чем в бензине. После омыления хлорофилла в верхний бензиновый слои переходят желтые пигменты каротин и ксантофилл, а в нижний спиртовой слой - соль хлорофиллина, которая окрасит его в зеленый цвет. Ход работы. В пробирку наливают 3 мл спиртовой вытяжки пигментах, Добавляют 1 мл 20%-ного раствора КОН и взбалтывают. Затем пробирку нагревают в кипящей водяной бане, к охлажденному раствору добавляют равный объем бензина, 2 - 3 капли воды, встряхивают и дают отстояться. Записать уравнение реакции омыления. СООСН3 MgN4OH30C32 + 2NaОН -------СООС20Н39 Вывод: 4. Получение феофитина и обратное замещение водорода атомом металла. Вводные пояснения. Феофитин присутствует в растениях в незначительных количествах, но выполняет важную функцию в цепи переноса электронов. При взаимодействии хлорофилла с кислотой атом магния в нем замещается атомами водорода, в результате образуется нестойкое соединение бурого цвета - феофитин. Если к его раствору добавить несколько кристалликов ацетата меди (СН3СОО)2Сu и осторожно подогреть, то можно наблюдать восстановление зеленой окраски раствора. В этом случае ионы металла вытесняют водород в молекуле феофитина и занимают центральное положение в его молекуле, образуя очень стойкое соединение металлозамещенный хлорофилл (хлорофиллоподобное замещение меди). Свойство металлозамещенного хлорофилла - долго сохранять зеленую окраску и не окисляться на воздухе - используют для приготовления постоянных препаратов из зеленых органов растений. Ход работы. В две сухие пробирки наливают по 2 - 3 мл спиртовой вытяжки пигментов, прибавляют по 1 - 2 капли 10%-ной соляной кислоты. Содержимое пробирок осторожно взбалтывают. При этом зелѐная окраска раствора, 35 обусловленная наличием хлорофилла, переходит в бурую. Это означает, что под действием кислоты из хлорофилла образуется феофитин. Оставив одну пробирку с феофитином для контроля, во вторую вносят несколько кристаллов уксуснокислого цинка и осторожно нагревают на спиртовке. После нагревания бурый цвет раствора меняется на зеленый в результате образования хлорофиллоподобного производного цинка. СООСН3 MgN4OH30C32 + 2НСl -------СООС20Н39 Вывод: Работа 17. Наблюдение оптических свойств пигментов Объект исследования: спиртовая вытяжка пигментов листа, раствор каротина и ксантофилла (бензиновый слой, полученный после омыления хлорофилла). Материалы и оборудование: спектроскоп, пипетки на 1 мл, пробирки, лампа на 300 Вт. Вводные пояснения. В процессе фотосинтеза световая энергия перед преобразованием в химическую должна быть поглощена пигментами (поглощают свет видимой части спектра З80...720нм, поэтому название излучения этой области спектра – ФАР или фотосинтетически активная радиация). Пигменты поглощают видимый свет избирательно, т.е. каждый пигмент имеет сой характерный спектр поглощения. К.А. Тимирязев доказал, что хлорофиллы а и b имеют два максимума поглощения в красной области – соответственно 660 и 640 нм и в сине-фиолетовой – 430 и 450 нм. Минимум поглощения лежит в зоне зеленых лучей. Этим и объясняется зеленая окраска пигментов. Каротиноиды (каротины и ксантофиллы) поглощают свет только сине-фиолетовой части спектра. Оптические свойства пигментов определяются особенностями их химической структуры. В молекулах хлорофиллов и каротиноидов существует система конъюгированных (сопряженных) двойных связей. Скелет системы составляют атомы углерода, соединенные между собой простыми (двухэлектронными) ковалентными связями – σ-электронами. В образовании двойных связей помимо σ-электронов участвуют два π-электрона. В подобных системах π-электроны не связаны с пределенными атомами углерода, поэтому могут перемещаться по всей молекуле, образуя делокализованное электронное облако. Возбуждение π36 электронов может осуществляться за счет квантов видимого света. В молекулах хлорофиллов и каротиноидов система конъюгированных двойных связей определяет поглощение сине-фиолетовых лучей. Присутствие атома магния в ядре обусловливает большее усиление поглощения в красной области и ослабление в зеленой и желтой областях спектра. Ход работы. Спектроскоп устанавливают по отношению к свету так, чтобы все области спектра имели одинаковую яркость. Пробирку со спиртовой вытяжкой пигментов помещают перед щелью спектроскопа и определяют положение темных полос, которые соответствуют лучам, поглощаемым, главным образом, хлорофиллом. Ширина полос зависит от концентрации пигмента, поэтому рекомендуется сравнить спектры поглощения концентрированных и разбавленных растворов хлорофилла. Втяжку хлорофилла разбавляют спиртом в отношении 1:1 и 1:3. Делают вывод о характере спектра поглощения хлорофилла и о зависимости качества спектра от концентрации хлорофилла. Затем изучают спектр поглощения выделенных из смеси каротиноидов. Для этого используют бензиновый слой, в который перешли каротин и ксантофилл, после омыления хлорофилла, переносят некоторое количество жидкости с помощью пипетки в сухую пробирку, рассматривают спектр поглощения, поместив пробирку перед щелью спектроскопа. Зарисовывают в таблице 14 все исследованные спектры поглощения пигментов. Таблица 14 - Спектры поглощения пигментов Пигменты Хлорофилл (конц.) Хлорофилл (1:3) Каротиноиды Вывод: Ф С Г З Ж О К Работа 18. Фотосенсибилизирующее действие хлорофилла на реакцию переноса водорода по Гуревичу Объект исследования: спиртовая вытяжка пигментов листа. Материалы и оборудование: метиловый красный (насыщенный раствор в этиловом спирте), аскорбиновая кислота (кристаллическая), градуированные пипетки на 1 и 10 мл, пробирки, штативы, электрическая лампа на 300 37 Вт. Вводные пояснения. Сущность световой стадии фотосинтеза заключается в окислении воды до молекулярного кислорода при помощи лучистой энергии, поглощенной хлорофиллом. Освобождающиеся при этом электроны передаются на НАДФ+, который восстанавливается до НАДФ-Н. В переносе электронов воды на НАДФ+ участвуют последовательно две фотосистемы: фотосистема II (ФС II) и фотосистема I (ФС I). Каждая фотосистема включает в себя светособирающие комплексы (ССК), которые содержат различные формы хлорофилла, каротиноиды и реакционные центры (РЦ), содержащие молекулы хлорофилла а с максимумами поглощения, соответственно, 700 (Р 700) и 680 (Р 680) нм и акцепторы электронов. ССК направляют энергию возбуждения к РЦ. Фотоокисление воды и выделение кислорода происходят в ходе реакций, протекающих в ФС II, тогда как НАДФ+ восстанавливается в ФС I. Фотосистемы связаны друг с другом последовательность переносчиков электронов, образующих между ними «мост», идущий как бы «под гору». В результате электроны от воды проделывают Z-образный путь. Синтезируется АТФ из АДФ и фосфата. Таким образом, конечный этап фотоокисления воды – выделение молекулярного кислорода и образование богатых энергией и восстановительной силой соединений – АТФ и НАДФ-Н. необходимых для последующего восстановления диоксида углерода. Схематично фотолиз воды можно представить следующим образом: свет, хлорофилл + Н2О + НАДФ + АДФ + Н3РО4 ----------------------- НАДФ-Н + Н+ + АТФ +1/2 О2 Из уравнения видно, что хлорофилл выполняет здесь функцию фотосенсибилизатора, способствующего переносу электрона к НАДФ+. Хлорофилл играет роль сенсибилизатора - переносчика электронов от донора к акцептору. Эту функцию хлорофилла легко наблюдать в лабораторных условиях, если в качестве донора электронов взять аскорбиновую кислоту, а акцептора - метиловый красный. В растворе вытяжки хлорофилла на свету происходит восстановление метилового красного (М) до МН2 (бесцветной лейкоформы) за счѐт присоединения водорода и электронов аскорбиновой кислоты (А-Н2), которая при этом окисляется (А+): h ν, хлорофилл * е А-Н2+М --------------------------→ Сhl → М Н2 + А Обесцвечивание (восстановление) метилового красного происходит только при наличии всех компонентов опыта. Ход работы. Взять 4 пробирки и налить в 1-ую, 2-ую и 3-ью по 5 мл спиртовой вытяжки хлорофилла, а в 4-ую – 5 мл спирта. В 1-ую, 2-ую и 4-ую пробирки добавить кристаллическую аскорбиновую кислоту до насыщения (избыток оседает на дно). Во все пробирки ввести по 2 - 3 капли 38 метилового красного. Раствор хлорофилла при этом окрашивается в красно-бурый цвет, в 4-ой пробирке - в ярко-розовый. Хорошо встряхнуть. Вторую пробирку обернуть чѐрной бумагой и все пробирки выставить на яркий свет. Через 20 мин отметить окраску растворов и заполнить таблицу 15. Таблица 15 - Фотосенсибилизирующее действие хлорофилла Вариант Состав смеси в пробирках Условия Резульопыта хлоро- этиловый аскорбиновая метиловый опыта таты филл,мл спирт, мл кислота, мг красный 1 5 50 добавляют свет до появления краснобурой окраски 2 5 50 тоже темнота 3 5 тоже свет 4 5 50 тоже свет В выводах объяснить роль хлорофилла и аскорбиновой кислоты в реакции восстановления метилового красного. Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 2: ОПРЕДЕЛЕНИЕ ФОТОСИНТЕТИЧЕСКОЙ АКТИВНОСТИ РАСТЕНИЙ Цель: освоить метод количественного определения пигментов. Работа 19. Количественное определение пигментов Объект исследования: листья растений. Материалы и оборудование: 96% раствор спирта, кварцевый, песок, порошок мела, вазелин. Весы, ножницы, ступки с пестиками, мерные колбы на 25 мл, воронки со стеклянным фильтром, воронки, стеклянные палочки, КФК-2, насос. 39 Вводные пояснения. Количественное определение пигментов в листья зависит от жизнедеятельности организма, его генетической природы. Поэтому оно может быть использовано как физиологический показатель, характеризующий онтогенетические, возрастные и генетические особенности растений. Количество пигментов отражает и реакцию растительного организма на условия произрастания. Поэтому при физиологических исследованиях часто возникает необходимость проследить за динамикой содержания хлорофилла и каротиноидов в отдельных органах. Ход работы. Получение спиртовой вытяжки. Навеску листьев определенного яруса (0,1...0,15 г) помещают в фарфоровую ступку, добавляют немного диоксида кальция, промытого кварцевого песка и растирают с 2...3 мл 96%-го раствора спирта. К растертой массе добавляют 4...5 мл спирта, снова растирают несколько минут. После отстаивания раствора нижнюю сторону носика ступки слегка смазывают вазелином, экстракт осторожно сливают по палочке в воронку со стеклянным фильтром и отсасывают насосом. Перед перенесением вытяжки воронку вставляют при помощи каучуковой пробки в колбу Бунзена, соединенную с насосом. Экстракцию небольшими порциями чистого растворителя повторяют до тех пор, пока пигменты не будут извлечены полностью. Затем фильтрат переливают через сухую стеклянную воронку в мерную колбочку на 25 мл. Колбу Бунзена дважды ополаскивают небольшой порцией спирта, каждый раз сливая жидкость в .мерную колбочку. Далее содержимое колбочки доводят до метки, закрывают каучуковой пробкой, тщательно взбалтывают и используют для определения концентрации пигментов. Анализ пигментов выполняют при комнатной температуре на рассеянном свету, так как при сильном освещении может произойти фотоокисление хлорофилла. Хранят вытяжку в темном холодном месте. Для установления концентрации окрашенных растворов на фотоэлектрокалориметре измеряют разность силы электрических токов, возникающих между двумя фотоэлементами в результате неодинаковой интенсивности световых потоков, прошедших через растворитель и раствор. Результаты определения записывают в таблицу 16. Таблица 16 – Определение концентрации хлорофилла Объект Вариант Навеска Объем Показания Кол-во Содержаопыта листьев, вытяжки, шкалы хлорофилла ние хломг мл барабана по калиб- рофилла, ровочной % массы кривой, мг сырых на 25 мл листьев 40 Чтобы вычислить концентрацию хлорофилла, на калибровочной кривой по оси ординат находят установленную величину оптической плотности и от нее проводят горизонтальную прямую до пересечения с кривой графика. Из точки пересечения опускают перпендикуляр на абсциссу и определяют концентрацию хлорофилла. Ее выражают в процентах массы сырых листьев. Расчет ведут по формуле: Х = 100 В / А, где В – количество хлорофилла в вытяжке, мг; А – масса сырых листьев, взятых для анализа, мг; 100 – коэффициент для выражения в процентах. Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 3: ПОКАЗАТЕЛИ ПРОДУКТИВНОСТИ ФОТОСИНТЕЗА Цель: познакомиться с наиболее распространѐнными методами определения площади листьев. Работа 20. Определение площади листьев Объект исследования: растения зерновых культур, листья герани. Материалы и оборудование: торзионные и аналитические весы, свѐрла, ножницы, бумага. Вводные пояснения. Понятие фотосинтетическая деятельность растений включает в себя нарастание площади листьев и биомассы растения за период вегетации культуры, расчѐты листового индекса, фотосинтетического потенциала и чистой продуктивности фотосинтеза. Ход работы. 1. Определение площади листьев методом высечек. Этот метод чаще всего используют в полевых опытах. Отбирают среднюю пробу растений (10 - 25 растений), быстро срезают листья и определяют отдельно массу листьев и стеблей. Из листьев выбирают сверлом определенного диаметра несколько высечек, стараясь исключить крупные жилки. Все высечки взвешивают, а также рассчитывают общую площадь высечек по формуле: С = лr2n, где: с 41 общая площадь высечек, см2; r - радиус сверла, см; n - число высечек. Площадь листьев определяют по формуле: S = ac/b, где: S - площадь листьев, см2; a - общая масса сырых листьев, г; b - общая масса сырых высечек, г. Чтобы от площади листьев пробы перейти к площади листьев на определѐнной делянке и на гектаре, необходимо определить частоту стояния растений несколько раз за вегетацию. Недостаток метода — относительно невысокая точность. 2. Определение площади листьев методом отпечатков. Лист растения накладывают на однородную бумагу и обводят контур остро отточенным карандашом. Получив тем или иным способом отпечаток листа, определяют его площадь весовым методом. Для этого вырезают бумагу по контуру листовой пластинки и взвешивают на торзионных или аналитических весах. Одновременно из такой же бумаги вырезают квадрат, например, площадью 100 см2 (10x10 см) и также определяют его массу. Площадь исследуемого листа находят по формуле: S=aC/b, а - масса контура листа, г; b - масса квадрата бумаги, мг; С - площадь квадрата бумаги, см2. Описанный метод прост и достаточно точен, но малопроизводителен. Кроме того, его практически нельзя использовать при исследовании гофрированных и сложных листьев. 3. Определение площади листа по его параметрам. Метод основан на сопоставлении формы листа с некоторой простой геометрической фигурой, достаточно хорошо совпадающей с конфигурацией данного листа. Лист вписывают в соответствующую фигуру так, чтобы основные параметры их были общими. Так, листья злаков легко вписываются в вытянутый прямоугольник. Измеряя ширину (а) и длину (b) такого прямоугольника, находят его площадь (S), которая равна S=ab. Однако листовая пластинка не занимает всю площадь прямоугольника, и действительная площадь листа (SЛ), определенная похожим методом отпечатков, будет меньше площади фигуры (S). Поэтому устанавливают поправочный коэффициент К, равный отношению S л /S. Отсюда фактическая площадь листа злака будет равна S л = abK. Аналогично находят поправочные коэффициенты для листьев других растений, моделируя их с соответствующими геометрическими фигурами. Причем коэффициент K получают на основании анализа многих листьев и несколько раз в течение вегетационного периода, так как нередко конфигурация листьев претерпевает значительные возрастные изменения. Кроме того, систематически проверяют ранее рассчитанные поправочные коэффициенты. Метод определения площади листьев по параметрам можно использовать только при работе с растениями, имеющими сравнительно простую и устойчивую форму. Метод характеризуется простотой, относительно высокой производительностью, возможностью определения листовой 42 поверхности без отделения листьев от растений. Одновременно следует отметить его невысокую точность. Вывод: Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Фотосинтез» 1. Значение и структурная организация фотосинтеза. Значение работ К.А. Тимирязева. 2. Лист - основной орган фотосинтеза. 3. Хлоропласты: химический состав, структура и функции. 4. Фотосинтетические пигменты (хлорофиллы, каротиноиды, фикобилины, флавоноидные): строение, свойства, функции. 5. Световая фаза фотосинтеза. Фотосинтетическое фосфорилирование, характеристика основных типов. Фотолиз воды (реакция Хилла). 6. Анатомо-физиологические особенности и фиксация диоксида углерода у С3-растений. 7. Анатомо-физиологические особенности и фиксация диоксида углерода у С4- растений. 8. Анатомо-физиологические особенности и фиксация диоксида углерода у CAM – растений. 9. Фотодыхание. 10. Зависимость интенсивности фотосинтеза от спектрального состава света, водного режима, минерального питания, режима ФАР, КПД использования ФАР, состояния растительного организма и т.д. 11. Светолюбивые и теневыносливые растения. 12. Параметры оценки фитоценозов: листовой индекс, фотосинтетический потенциал, чистая продуктивность фотосинтеза, КПД фотосинтеза. 13. Пути повышения продуктивности фотосинтеза в посевах (способы посева, направления рядков, густота стояния растений, удобрения, орошение). 14. Методы изучения фотосинтеза. 15. Физиологические основы выращивания растений при искусственном освещении. 43 РАЗДЕЛ 4. ДЫХАНИЕ РАСТЕНИЙ Дыханием называют процесс окисления органических веществ при участии кислорода до углекислого газа и воды, сопровождающихся выделением энергии. Суммарно выражают уравнением: С6Н12О6 + 6О2 = 6СО2 + 6Н2О + 2875 кДж Значительная часть энергии, освобождающаяся во время дыхания, фиксируется в макроэргических фосфатных связях АТФ и в этой форме используется на различные жизненные процессы клетки – биосинтез, активное поглощение и транспорт веществ, поддержание клеточной структуры и др. Дыхание – сложный многоступенчатый процесс, при котором образуются разнообразные промежуточные продукты – исходные соединения для синтеза белков, жиров, углеводов и других веществ. Таким образом, процессы обмена веществ и энергии, происходящие в клетках, оказываются тесно связными с дыханием. Окисление начинается с бескислородного расщепления глюкозы – гликолиза. При гликолизе происходит активация глюкозы за счет молекул АТФ и дальнейшее ступенчатое окисление ее до пировиноградной кислоты (ПВК). ПВК после окислительного декарбоксилирования включается в замкнутый цикл последовательных биохимических реакций (цикл Кребса). При этом образуются углекислый газ (СО2), водород и электроны (Н+ и е). СО2 выводится из клеток, а водород включается в дыхательную цепь (ЭТЦ), которая составлена из комплекса ферментов, расположенных на внутренней мембране митохондрий. Окисление органических веществ начинается с отнятия от них водорода ферментам дегидрогеназами, которые переносят его к промежуточным или конечным акцепторам водорода. В конечном итоге водород, отнятый от окисляемого вещества, передается кислороду воздуха. Основной путь окисления водорода до воды, ведущий к наиболее эффективному накоплению энергии в АТФ связан с участием цитохромной системы. В дыхательной цепи происходит три реакции фосфорилирования. Образование АТФ за счет энергии окисления называют окислительным фосфорилированием. Многоступенчатый перенос водорода и электрона способствует постепенному выделению энергии малыми порциями, что создает условия для эффективного ее использования. Окислительное фосфорилирование осуществляется в митохондриях, где возникает до 90% всего количества АТФ, синтезируемой в процессе дыхания. Поэтому митохондрии называют «силовыми станциями» клетки. В клетках наблюдаются и побочные пути окисления, связанные с участием других оксидазных систем (полифенолоксидазы, аскорбатоксидазы). Физиологическое значение этих путей в основном состоит в окислении избытка некоторых продуктов обмена веществ, например полифенолов и их производных, являющихся ингибиторами метаболизма. Часть образующихся в процессе дыхания восстановленных коферментов (НАДН2 и особенно НАДФН2) используется на восстановительные 44 процессы в клетке: восстановление нитратов до аммиака и т.д. Наиболее общий показатель скорости окисления – интенсивность дыхания, о которой можно судить по поглощению кислорода, количеству выделенного углекислого газа и окисленного органического вещества. Интенсивность дыхания и его энергетическая эффективность зависят от физиологического состояния растений и внешних условий. Субстратом для дыхания растений может служить не только глюкоза, но также жиры белки, которые предварительно должны быть подвергнуты гидролизу. Для характеристики дыхательного субстрата используется дыхательный коэффициент (ДК) – отношение объема выделившегося СО2 к объему поглощенного О2: ДК = V СО2/ V О2. При окислении глюкозы на 6 объемов СО2 поглощается 6 объемов О2, поэтому ДК = 1. При полном окислении жиров, белков и других соединений с более высокой степенью восстановленности, чем глюкоза на окисление требуется больше кислорода и ДК меньше единицы (ДК = 0,6). Если в качестве субстрата служат более окисленные, чем сахара соединения, например, органические кислоты, то ДК превышает единицу. ТЕМА 1: ОПРЕДЕЛЕНИЕ ДЫХАТЕЛЬНОГО ГАЗООБМЕНА Цель: Изучить методы определения интенсивность дыхания и дыхательного коэффициента. Работа 21. Определение интенсивности дыхания семян в закрытом сосуде Объект исследования: сухие и прорастающие семена пшеницы. Материалы и оборудование: 0,1 н. раствор барита, 0,1 н. раствор щавелевой кислоты, 1%-ный раствор фенолфталеина, весы технические, 3 конические колбы на 250 мл с притертыми пробками, снабженными трубкой с натронной известью, марлевые мешочки, бюретки. Вводные пояснения. Метод заключается в учете количества углекислого газа, выделяемого семенами при дыхании. Процесс поглощения СО2 баритом можно записать в виде уравнения: Ва(ОН)2 + СО2 → ВаСО3 + Н2О Избыток барита, не прореагировавшего с СО2, оттитровывают щавелевой кислотой: Ва(ОН)2 + Н2С2О4 → ВаС2О4 + 2Н2О Ход работы. В три конические колбы наливают по 5 мл 0,1 н. раствора барита. Колбы сразу закрывают притертыми пробками, чтобы исключить поступление углекислого газа из окружающего воздуха. Подготавливают 2 марлевых мешочка, в один из которых помещают 2,0 г сухих семян, а в другой 45 – 4,0 г прорастающих семян. Одна колба служит контролем, семена в нее не помещают. В другую колбу с помощью тонкого шпагата подвешивают мешочек с сухими семенами на расстоянии 2 – 3 см от поверхности раствора, в третью – подвешивают точно также мешочек с прорастающими семенами. Все три колбы оставляют на час при комнатной температуре. На протяжении опыта следует периодически осторожно покачивать колбы, чтобы разрушать пленку ВаСО3, образующуюся на поверхности барита и препятствующую полному поглощению СО2. Через 1 час вынимают мешочки с семенами из колб, вновь плотно прикрыв колбы пробками. Все три колбы, начиная с контрольной, титруют 0,1 н. раствором щавелевой кислоты в присутствии двух капель фенолфталеина до слабо-розового окрашивания, исчезающего от одной капли кислоты. Титрование следует проводить по возможности быстро. Интенсивность дыхания рассчитываю по формуле: (ak – b0) П 2,2 I = -------------------- мг СО2 / г ч, m где ak и b0 – количество 0,1 н. раствора щавелевой кислоты, израсходованного на титрование барита, соответственно, в контрольном и опытном вариантах, мл; П – поправка к титру 0,1н. раствора щавелевой кислоты; 2,2 – количество СО2, соответствующее 1 мл 0,1 н. раствора щавелевой кислоты, мг; m – масса сухих семян, г. Результаты опыта заносят в таблицу 17, сравнивают интенсивность дыхания сухих и проросших семян, делают выводы. Таблица 17 - Интенсивность дыхания сухих и проросших семян Объект Навеска семян, Объем Количество щавелевой Интенсивисследог барита, кислоты, пошедшей на ность вания мл титрование, дыхания, мл мг СО2 на сухие пророс1 г сухих шие контроль сухие пророссемян за 1 ч шие Вывод: Работа 22. Определение дыхательного коэффициента прорастающих семян Объект исследования: прорастающие семена подсолнечника, пшеницы, гороха. 46 Материалы и оборудование: 20%-ный раствор едкого натра, прибор для определения дыхательного коэффициента, пинцеты, полоски фильтровальной бумаги, песочные часы на 2 мин., пипетки, стеклянные палочки, конические колбы на 250 мл. Вводные пояснения. Органические вещества, разрушающиеся во время дыхания, называют дыхательными субстратами. Субстратами для дыхания служат углеводы, жиры и белки. Углеводы. При наличии углеводов большинство клеток использует в качестве субстратов именно их. Полисахариды (крахмал у растений) вовлекается в процесс дыхания лишь после того, как они будут гидролизованы до моносахаридов. Липиды (жиры или масла). Липиды составляют «главный резерв» и используются в основном тогда, когда запас углеводов исчерпан. Предварительно они должны быть гидролизованы до глицерина и жирных кислот. Жирные кислоты богаты энергией и некоторые клетки в норме получают именно от них часть необходимой им энергии. Белки. Поскольку белки выполняют ряд других важных функций, они используются для производства энергии лишь после того, как будут израсходованы все запасы углеводов и жиров. Чтобы стать субстратом дыхания, белки предварительно гидролизуются до аминокислот, а аминокислоты дезаминируются (лишаются своих аминогрупп). Образовавшаяся в результате дезаминирования карбоновая кислота вовлекается в цикл Кребса. Важный показатель химической природы дыхательного субстрата дыхательный коэффициент (ДК), т.е. отношение объема выделенного диоксида углерода (V СО2) к объему поглощенного кислорода (V 02). При окислении углеводов ДК = 1. При окислении жиров и белков (более восстановленных соединений) кислорода поглощается больше, чем выделяется диоксида углерода, и ДК < 1. При окислении органических кислот (менее восстановленных соединений, чем углеводы) ДК > 1. Величина ДК зависит также от количества кислорода, поступающего к тканям, от состояния организма и этапа его онтогенеза. Прибор для определения ДК состоит из пробирки, в которую плотно вставляется пробка с изогнутой под прямым углом тонкой трубкой. К трубке присоединена измерительная шкала из миллиметровой бумаги. В начале опыта в трубку вводится капля воды. Если объемы поглощенного О2 и выделенного СО2 равны (ДК = 1), то капля в трубке передвигаться не будет. При величине ДК не равной 1, т.е. объемы поглощенного О2 и выделенного СО2 не соответствуют друг другу, капля смещается. Она будет перемещаться в сторону пробирки, если объем выделенного СО2 будет меньше объема поглощенного О2 и давление в пробирке упадет (ДК<1). Капля передвинется от пробирки к концу трубки при объеме выделенного СО2 больше объема поглощенного О2, и давление в пробирке увеличится (ДК>1). Поэтому, описанный принцип прибора используется преимущест47 венно для определения дыхательного коэффициента масличных и зернобобовых культур. Ход работы. Пробирки заполняют проросшими семенами до половины объема и плотно закрывают пробкой с изогнутой трубкой. Пробирку ставят в коническую колбу, чтобы избежать нагревания прибора от рук. В трубку вводят каплю воды. Когда капля сдвинется от края трубки, отмечают положение внутреннего мениска капли. Определение проводят через каждые 2 минуты 3 раза по смещению, а затем вычисляют среднее расстояние, пройденное каплей за 2 минуты (А). Оно соответствует разности между объемами поглощенного кислорода и выделенного СО2. После этого пробирку открывают, проветривают и в верхней ее части над семенами помещают фильтровальную бумагу, слегка смоченную раствором щелочи. Вновь собирают прибор, вводят в трубку каплю воды. Отмечают смещение внутреннего мениска капли за 3 двухминутных интервала. Вычисляют среднюю величину смещения (В). Выделенный же при дыхании СО2 будет поглощаться щелочью, и второе смещение капли отразит только уменьшение объема О2, поглощенного при дыхании. Расчет величины ДК проводят следующим образом: ДК = VСО2/ VО2 = (В - А)/В Результаты опыта записывают в таблицу 18. Таблица 18 - Определение дыхательного коэффициента прорастающих семян Условия опы- Отсчеты, мм за 2 мин. ДК = (В - А)/В Вариант опыта та 1 2 3 среднее Без щелочи (А) Со щелочью (В) Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 2: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ФЕРМЕНТЫ Цель: изучить методы, характеризующие действие ферментов в растительном организме. 48 Работа 23. Обнаружение фермента дегидрогеназы в семенах гороха Объект исследования: набухшие семена гороха. Материалы и оборудование:, 2 пробирки, метиленовая синь, каучуковые пробки, термостат, термометр, спиртовка. Вводные пояснения. Окисления дыхательных субстратов в ходе дыхания осуществляется с участием ферментов. Поскольку окисление одного вещества (донора электронов и протонов) сопряжено с восстановлением другого соединения (акцептора), ферменты, катализирующие эти реакции, называются оксидоредуктазами. К оксидоредуктазам относятся дегидрогеназы (ферменты, активирующие водород), оксидазы (ферменты, активирующие кислород). Дегидрогеназы – ферменты, катализирующие дегидрирование дыхательного субстрата. Дыхательный субстрат является донором водорода. Активированный дегидрогеназами водород дыхательного субстрата передается ими на акцептор - переносчик водорода. Дегидрогеназы делятся на анаэробные и аэробные. Анаэробные дегидрогеназы переносят водород на какой-то промежуточный акцептор (переносчик), но не кислород. Это двухкомпонентные ферменты, коферментом которых может быть НАД+ (никотинамидадениндинуклеотид). Субстратная специфичность фермента зависит от его белковой части. Анаэробные дегидрогеназы передают водород, т.е. электроны и протоны, различным промежуточным переносчикам и аэробным дегидрогеназам. Аэробные дегидрогеназы переносят водород к различным акцепторам, в том числе кислороду. Это двухкомпонентные ферменты, получившие название флавиновых (флавопротеины – ФАДН2). Помимо белков, в их состав входит прочно связанная с ними простетическая группа - рибофлавин (витамин В2). Доноры электронов для аэробных дегидрогеназ - анаэробные дегидрогеназы, а акцепторы - хиноны, цитохромы, кислород. Метод определения основан на способности дегидрогеназ к дегидрированию (отщеплению водорода) от субстратов дыхания и восстановлению в анаэробных условиях индикатора, такого как метиленовая синяя: С – Н2 + С + М - Н2, где С – Н2 – восстановленный субстрат; М - метиленовая синяя; С – окисляемый субстрат; М - Н2 – восстановленная краска. Ход работы. Набухшие семена гороха (10 шт.) очищают от оболочки и помещают в 2 пробирки. Одну порцию семян заливают водой и кипятят 5 – 10 минут для разрушения фермента. Затем воду выливают и в обе пробирки заливают метиленовую синюю на 10 минут. После этого окрашенные семена промывают водой и обе пробирки заполняют водой до пробки (без пузырька воздуха) для создания анаэробных условий. Обе пробирки ставят в 49 термостат при температуре 25 – 30°С. Через 1 – 2 часа не кипяченые семена обесцвечиваются, т.к. дегидрогеназа активировала водород и передала его метиленовой сини, которая восстановилась и обесцветилась. Обесцвеченные семена вытряхивают из пробирки и на воздухе они синеют. У кипяченых семян дегидрогеназа разрушена, окраска их не изменяется. Вывод: Работа 24. Обнаружение пероксидазы в соке клубня картофеля Объект исследования: клубни картофеля. Материалы и оборудование: 1%-ный раствор гидрохинона, 3%-ный раствор перекиси водорода. Ножи, терки, марля, воронки, конические колбы на 50 мл, пробирки в штативе, пипетки на 2 и 10 мл. Вводные пояснения. Оксидазы – ферменты, способные передавать электроны от окисляемого субстрата только на кислород воздуха. При этом образуется вода, пероксид водорода или супероксидный анион кислорода. Оксидазы имеют в качестве кофермента атом металла (Fе, Сu, Мо), т.е. важную роль играют а) железосодержащие ферменты и переносчики, относящиеся к цитохромной системе; б) аскорбатоксидаза; в) пероксидаза и каталаза; г) полифенолоксидаза. В клетках широко представлены также оксигеназы, активирующие кислород, в результате чего он может присоединяться к органическим соединениям. Ряд оксигеназ имеет в своем составе атомы меди или гем, флавиновые ферменты. Пероксидаза - фермент, катализирующий окисление полифенолов и некоторых ароматических аминов при помощи кислорода, перекиси водорода или органических перекисей. Пероксидаза образует с перекисью водорода комплексное соединение, в результате чего перекись активируется и приобретает способность действовать как акцептор водорода. Особенно легко пероксидаза окисляет полифенолы. Поэтому для обнаружения ее удобно использовать гидрохинон, который под действием пероксидазы окисляется в хинон. При окислении гидрохинона в хинон раствор буреет. Наблюдается и некоторое побурение самого картофельного сока без добавления гидрохинона и перекиси водорода, что связано с действием полифенолоксидазы, окисляющей полифенолы тканей картофеля с участием молекулярного кислорода. Ход работы. Натирают на терке очищенный клубень картофеля. Из мезги отжимают через марлю сок и собирают его в колбочку. В четыре пробирки вно50 сят по 5 мл 1%-ного раствора гидрохинона. В первую добавляют, кроме того, 1 мл 3%-ного раствора перекиси водорода и 1 мл картофельного сока, во вторую - 1 мл 3%-ного раствора перекиси водорода, в третью - 1 мл картофельного сока, в четвертую - 1 мл предварительно прокипяченного в течение 1 мин. картофельного сока и 1 мл перекиси водорода. При окислении гидрохинона в хинон раствор буреет. Наблюдается некоторое побурение самого картофельного сока без добавления гидрохинона и перекиси водорода, что связано с действием полифенолоксидазы, окисляющей полифенолы тканей картофеля с участием молекулярного кислорода. Отмечают окраску в пробирках и делают выводы. Результаты опыта записывают в таблицу 19 по приведенной форме. Таблица 19 - Обнаружение пероксидазы в соке картофеля Состав смеси в пробирке Вариант картофельный перекись во- гидрохинон опыта сок (носитель дорода пероксидазы) 1 + + + 2 + + 3 + + 4 (прокипяченный + + сок) Вывод: Окраска раствора в пробирках Работа 25. Определение активности каталазы в листьях Объект исследования: листья герани разных ярусов. Материалы и оборудование: 3%-ная перекись водорода, предметные стекла, микроскоп. Вводные пояснения. В процессе дыхания в качестве побочного продукта окисления веществ образуется перекись водорода, оказывающая в высоких концентрациях токсичное действие на цитоплазму. Нейтрализация перекиси водорода при участии фермента каталазы идет до воды и молекулярного кислорода по уравнению: 51 каталаза 2Н2О2 --------------> 2Н2О + О2 Об активности каталазы судят по объему кислорода, выделяющегося в результате разложения перекиси водорода. Ход работы. На предметное стекло наносят каплю перекиси водорода. В каплю помещают кусочек ткани листа различного возраста и тот час наблюдают препараты под микроскопом при малом увеличении. При наличии активной каталазы перекись водорода будет расщепляться с выделением пузырьков кислорода. Заметить, в каких листьях активнее выделяются пузырьки. Вывод: Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Дыхание растений» 1. Роль дыхания в жизни растений. 2. Строение и функции митохондрий. 3. Химизм дыхания. Анаэробная фаза (гликолиз). Энергетика этой фазы. 4. Аэробная фаза дыхания. Цикл Кребса (цикл ди- и трикарбоновых кислот). Ферменты и энергетика этой фазы. 5. Глиоксилатный и пентозофосфатный пути окисления, значение. 6. Окислительное фосфорилирование в ЭТЦ. 7. Оксидоредуктазы, их химическая природа и функции. 8. Зависимость интенсивности дыхания от внутренних и внешних факторов. 9. Дыхательный коэффициент и его зависимость от внутренних и внешних условий. 10. Фотосинтез и дыхание как элементы продукционного процесса. 11. Регулирование дыхания при хранении сельскохозяйственной продукции. 52 РАЗДЕЛ 5. МИНЕРАЛЬНОЕ ПИТАНИЕ РАСТЕНИЙ Под минеральным питанием понимают совокупность процессов поглощения, передвижения и усвоения химических элементов, необходимых для жизни растительного организма, в форме ионов минеральных солей, которые могут быть извлечены из окружающей среды с помощью корней (корневое питание) или через листья при нанесении на них растворов солей (некорневое питание). Обеспечение растения необходимыми элементами минерального питания является обязательным условием его нормальной жизнедеятельности. Оно во многом определяет направленность биохимических превращений веществ, рост, развитие, продуктивность растений и качество урожая. Особенность минерального обмена растений заключается в: 1) накоплении элементов в тканях в концентрациях значительно более высоких, чем во внешней среде; 2) специфичность в потребности, накоплении и распределении по органам отдельных элементов у разных растений. Это касается и токсических элементов. В состав растений входят почти все известные в настоящее время элементы, однако многие из них не относятся к необходимым и незаменимым. Элемент считается необходимым, если его отсутствие исключает нормальный жизненный цикл растения; недостаток элемента вызывает специфические нарушения жизнедеятельности растения, предотвращаемые или устраняемые внесением этого элемента; элемент непосредственно участвует в процессах превращения веществ и энергии. Все это можно установить только при выращивании растений на искусственных питательных средах - в водных и песчаных культурах. Для этого используют дистиллированную воду и химически чистый кварцевый песок, химически чистые соли, химически стойкие сосуды и химически стойкую посуду для приготовления и хранения растворов. Такие опыты проводят в специальных стеклянных сооружениях (светлицах), называемых вегетационными домиками. В холодные сезоны домики оборудуют отопительными устройствами; такие домики называют теплицами или оранжереями. В последнее время для выращивания растений используют искусственные источники света: обычные лампы накаливания, люминесцентные лампы, ксеноновые лампы и др. Сооружения, в которых регулируются все факторы роста и развития растений, называются лабораториями, или станциями искусственного климата, а наиболее оборудованные из них - фитотронами. Растения способны поглощать из окружающей среды практически все элементы. Однако для нормальной жизнедеятельности растительного организма требуется лишь небольшая группа элементов. Вегетационными опытами установлено, что для высших растений необходимы: углерод и кислород - они усваиваются в процессе воздушного питания, а также элементы, содержание которых колеблется от десятых до сотых долей процента: N, Р, К, S, Са, Мg (макроэлементы) и элементы, содержание кото53 рых колеблется от тысячных до стотысячных долей процента: Fе, Мn, Сu, Zn, В, Мо (микроэлементы). Макро- и микроэлементы растения поглощают корнями из почвы в виде соответствующих солей. Для выращивания растений в водных и песчаных культурах используют смеси солей, содержащие все необходимые макро- и микроэлементы. В почвенных культурах вносят только соли недостающих элементов. Для выявления физиологических функций отдельных химических элементов, их концентрации и соотношения между собой в среде корнеобитания, а также для решения других задач широко используют питательные смеси, носящие имена их создателей – Кнопа, Гельригеля, Хогланда, Прянишникова, Белоусова и др. Каждая питательная смесь должна не только содержать все необходимые для растения элементы в нужных количествах и соотношениях, но и быть оптимальной по концентрации водородных ионов. Для большинства растений оптимальный рН раствора находится между 5,5 и 7,8. Начальный рН раствора зависит от химической и гидролитической кислотности или щелочности солей и от их буферной способности, а изменение рН раствора в процессе питания растений - от физиологической кислотности или щелочности солей. Нитраты калия, кальция и натрия называют физиологически щелочными солями. Усваивая анионы NO3-, корни выделяют анионы НСО3-, образующие с ионами Са2+ бикарбонат Са(НСО3)2, гидролиз которого дает сильное основание и слабую, распадающуюся кислоту: Са(НСО3)2 + 2Н2О = Са(ОН)2 + 2Н2СО3 -- 2Н2О + 2СО2 Аммонийные соли сильных кислот, включая и нитрат аммония (аммиачную селитру) -физиологически кислые соли, так как растения сильнее поглощают ионы аммония NH+, выделяя ионы водорода Н+ и подкисляя среду. Нормальные питательные растворы - физиологически уравновешенные (сбалансированные). Кратковременные опыты показали, что на растворах, содержащих только одну питательную соль, растения развиваются значительно хуже, чем на смеси солей. То же наблюдалось и в опытах с солями, в которых нет необходимых растениям элементов. Каждый ион в отдельности угнетает растение, но в смеси вредное влияние одних ионов нейтрализуется другими ионами. Это явление получило название антагонизма ионов. Он особенно присущ катионам; кальций играет роль главного антагониста всех других катионов, в том числе и ионов водорода. При достаточной концентрации кальция растения меньше страдают от кислотности питательного раствора. Но высокая концентрация этого элемента уменьшает усвоение растениями калия и магния. Природные пресные воды (речная, озерная, прудовая, колодезная) так же физиологически уравновешены, как и почвенный раствор нормальных почв. Дистиллированная вода содержит только ионы Н+ и непригодна для длительного нахождения в ней растений. 54 Первичное накопление и обменная адсорбция ионов происходят в кажущемся свободном пространстве клеточных стенок корней, затем ионы проникают через липидную фазу и ионные каналы плазмалеммы и цитоплазму. Ионы плохо проникают в живую клетку из-за их водной оболочки. Основные силы движения ионов через клеточные мембраны – диффузия, облегченная диффузия, массовый поток (присасывающее действие транспирации). Ион является одновременно и частицей, и зарядом, поэтому на его действуют две движущие силы, два градиента: химический (разность концентраций) и электрический (разность электрических потенциалов) по обе стороны клеточной мембраны. Их результирующая – это электрохимический градиент, который и является реальной движущей силой пассивного транспорта ионов через мембрану. Оба названных градиента всегда действуют на мембраны растительных клеток. Результирующая этих двух движущих сил (двух градиентов) показывает, что в общем случае все катионы (NH4+, Ca2+, Mg2+, Na+), пассивно «втекают» в клетки корней, а их избыток активно «выкачивается» обратно. С другой стороны, все анионы (NO3-, Cl-, H2PO4-, HSO4- и др.), наоборот, активно «накачиваются» в клетки, что сопровождается их пассивной «утечкой» в среду. В настоящее время наука о минеральном питании растений имеет три комплексных направления: 1) исследование поступления ионов из среды в интактное растение и их включение в обмен веществ, транспорт ионов в клетке, тканях, между органами; 2) изучение функций элементов и их ассимиляции; 3) выяснение систем регуляции минерального питания в ходе взаимодействия органов. ТЕМА 1: МИКРОХИМИЧЕСКИЙ АНАЛИЗ ЗОЛЫ РАСТЕНИЙ. ВЗАИМОДЕЙСТВИЕ ИОНОВ. Цель: познакомиться с методом обнаружения макроэлементов в золе. Изучить влияние антагонизма ионов калия и кальция на прорастание семян. Работа 26. Микрохимический анализ золы растений Объект исследования: зола печная или табачный пепел. Материалы и оборудование: вода дистиллированная, 10%-ная соляная кислота, 1%-ный раствор серной кислоты, 1%-ный раствор фосфорнокислого натрия, 1%-ный раствор молибденовокислого аммония в 1%-ном растворе азотной кислоты, 1%-ный раствор желтой кровяной соли, стеклянные палочки, фильтровальная бумага, микроскоп, предметные стекла, пробирки, воронки. 55 Ход работы. Материалом для работы может служить обыкновенная печная зола или табачный пепел. Приготовляют в пробирках растворы золы в 10% соляной кислоте. Полученный раствор отфильтровывают через маленькие фильтры. Все реакции производятся на предметном стекле. В месте соединения произойдет реакция, а по краям канальца - быстрая кристаллизация продуктов реакции. Кристаллический осадок рассматривают под микроскопом. Для обнаружения кальция берем 1 каплю 1%-ного раствора серной кислоты и соединяем ее с каплей вытяжки. В результате реакции выпадают пучки игольчатых кристаллов гипса. Чтобы открыть магний, капельку испытуемого раствора сначала нейтрализуют аммиаком, а затем уже соединяют с капелькой реактива, которым служит 1%-ный раствор фосфорнокислого натрия. Кристаллы фосфорно-аммиачно-магнезиальной соли имеют вид ящиков, крышек, звезд или крыльев. Для открытия фосфора капельку раствора соединяют с 1%-ным раствором молибденовокислого аммония в 1%-ной азотной кислоте. Получается красивый зеленовато-желтый скрыто-кристаллический осадок фосфорно-молибденового аммиака (или аммонийного фосфорного молибдата), принимающий все более и более интенсивную окраску. Присутствие серы обнаруживают прибавлением 1%-ного раствора азотнокислого стронция. Образуются мелкие закругленные кристаллы серно-кислого стронция. Для открытия железа пользуются обычной цветной реакцией с железистосинеродистым калием (1%-ным раствором желтой кровяной соли). Происходит образование берлинской лазури. Реакцию на железо следует проводить без микроскопа на фарфоровой пластинке или на предметном стекле, подложив под него лист белой бумаги. Зарисовать кристаллы солей макроэлементов: Вывод: Работа 27. Изучение взаимодействия ионов в ходе прорастания семян Объект исследования: наклюнувшиеся семена зерновых культур. Материалы и оборудование: растворы КС1 - 9 г/л, СаС12 - 6,7 г/л, дистиллированная вода, чашки Петри, фильтровальная бумага, пипетки на 10 мл, пинцет, ножницы, линейка, пинцет. 56 Вводные пояснения. Антагонизмом ионов называют такое явление, когда один ион уменьшает или устраняет вредное действие другого. Раствор с оптимальным соотношением ионов называется уравновешенным. Взаимодействие ионов может проявляться и в процессе их переноса через мембраны клетки при заполнении активных центров ферментов, а также в противоположном воздействии на гидратацию белков, на вязкость и проницаемость цитоплазмы. Ход работы. Взять 4 чашки Петри, ополоснуть дистиллированной водой, положить на дно фильтровальную бумагу, вырезанную по размеру нижней чашки. Чашки пронумеровать. 40 наклюнувшихся семян зерновых культур 3 - 4 раза ополоснуть дистиллированной водой и пинцетом разложить по 10 штук в каждую чашку и добавить по 10 мл: в первую чашку – дистиллированную воду (контроль); во вторую – раствор КС1, в третью - раствор СаС12, в четвертую – 8,6 мл раствора КС1 и 1,4 мл раствора СаС12. Чашки закрыть крышками и поставить на проращивание в термостат при температуре 26°C, через каждые 2 дня крышки приоткрывать для проветривания. Через неделю измерить длину колеоптилей и корней, вычислить средние величины в таблицу 20. Таблица 20 - Влияние антагонизма ионов калия и кальция на параметры проростков Вариант Длина колеоптиля Длина корней Число боковых корней опыта см % к контсм % к контшт. % к контролю ролю ролю Контроль 100 100 100 КСl СаС12 КС1 + СаС12 Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 2: ПОСТАНОВКА ОПЫТОВ В ВОДНОЙ КУЛЬТУРЕ: ИЗУЧЕНИЕ ВАЖНЕЙШИХ МАКРО- И МИКРОЭЛЕМЕНТОВ НА РОСТ РАСТЕНИЙ 57 Цель: освоить технику проведения вегетационных опытов в водной культуре. Работа 28. Изучение влияния элементов питания на рост растений Объект исследования: проростки пшеницы, гороха. Материалы и оборудование: литровые стеклянные банки, бумажные чехлы для банок, шпагат, деревянные пробки, бюретки на 50 мл, соли: КNO3, Са(NO3)2 (безводный), КН2РО4, MgSO4 7H2O, KCl, NaH2PO4, NaCl, приготовленные с таким расчетом, чтобы 5 – 10 мл этого раствора соответствовали концентрации соли в нормальной смеси Хогланда-Снайдерса; навески с CaSO4 7H2O, 0,5%-ный раствор цитрата железа, растворы борной кислоты и сульфата марганца. Литровые стеклянные банки, бумажные чехлы для банок, шпагат, деревянные пробки, бюретки на 50 мл. Вводные пояснения. Исключение любого из макроэлементов приводит к нарушению структур и обмена веществ растений, торможению их роста и в последующем – к гибели. Однако видимые повреждения проявляются не сразу и не одновременно. Наиболее быстро сказывается исключение азота и кальция: первого – из-за высокой потребности в нем растущих растений, второго – из-за неспособности к повторному использованию, или реутилизации. К нереутилизируемым минеральным элементам относятся также микроэлементы, кроме бора, хлора, йода. Высокой степенью реутилизации отличаются азот, фосфор, сера, калий, в меньшей степени – магний. Поэтому недостаток перечисленных элементов проявляется в длительных опытах (более 2 недель). Большинство питательных смесей имеет универсальный характер. Таковой является смесь Хогланда-Снайдерса. Суммарная концентрация макроэлементов в этой смеси составляет около 2000 мг/л, или 0,2% в водной культуре. Если в качестве субстрата для выращивания растений используют песок, то концентрация смеси повышается в 5 – 6 раз в связи с его малой влагоемкостью (250 мл на 1 кг песка). Кислотность (рН) свежеприготовленной питательной смеси Хогланда-Снайдерса составляет 5,5 – 5,6. В процессе роста и развития растений рН может сдвигаться в ту или иную сторону от исходного – среда корнеобитания закисляется или защелачивается. Данное обстоятельство зависит от катионо-анионного обмена между корнями растений и средой. В водных культурах сдвиг рН более заметен, чем в почвенных, где в катионо-анионном обмене участвует почвенный поглощающий комплекс (ППК). Ход работы. Готовят полную питательную смесь Хогланда-Снайдерса и питательные смеси с исключением азота, фосфора и калия. При исключении из питательной смеси любого элемента, связанные с им элементы вносят в 58 эквивалентных количествах в виде солей, не содержащих исключаемый элемент. В литровую банку наливают 700 мл водопроводной воды, поочередно вводят в нее в виде растворов все соли питательной смеси (CaSO4 2H2O вводят порошком) (таблица 21). Таблица 21 - Полная питательная смесь Хогланда-Снайдерса и с исключением N, Р и K Cоль Полная смесь, Без N, г/л Без Р, г/л Без К, г/л г/л КNO3 0,51 0,51 Са(NO3)2 0,82 0,82 0,82 КН2РО4 0,136 0,136 MgSO4 7H2O 0,49 0,49 0,49 0,49 KCl 0,38 0,07 NаNO3 0,42 NаН2РО4 0,138 CaSO4 2H2O 0,86 MnCl2 4H2O 0,00035 0,00035 0,00035 0,00035 H3BO3 0,00055 0,00055 0,00055 0,00055 ZnSO4 0,00005 0,00005 0,00005 0,00005 CuSO4 0,00005 0,00005 0,00005 0,00005 MoO2 0,000024 0,000024 0,000024 0,000024 FeSO4 7H2O 0,004 0,004 0,004 0,004 После прибавления очередного раствора содержимое сосуда помешивают стеклянной палочкой. После внесения всех солей доливают водой до метки 850 или 900 мл. Закрывают банку деревянной пробкой, служащей опорой для растения. Высаживают в отверстия пробки одинаковое число выровненных проростков и закрепляют их негигроскопичной ватой. Корни погружают в раствор, уровень которого должен быть ниже пробки в зависимости от длины корней на 1 – 5 см. Закрывают корни от света и предохраняют раствор от перегрева, для чего надевают на банку бумажный чехол. Прикрепляют этикетку, на которой простым карандашом обозначают факультет, номер группы, фамилию и вариант опыта. Питательные растворы ежедневно продувают воздухом при помощи резиновой груши в течение 15 – 20 минут. По мере убыли питательного раствора за счет транспирации сосуды доливают водой до исходного уровня. Длительность опыта 4 недели.После прибавления очередного раствора содержимое сосуда помешивают стеклянной палочкой, затем доливают водой до метки. Закрывают банку деревянной пробкой, служащей опорой для растения. Высаживают в отверстия пробки одинаковое число выравненных проростков растений и закрепляют их кусочком простой негигроскопической ваты. Корни погружают в раствор, который не должен касаться пробки, а 59 быть ниже ее в зависимости от длины корней на 1 – 5 см. Закрывают корни от света и предохраняют раствор от перегрева солнечным светом, для чего оборачивают банку бумажным чехлом или помещают ее в холщевый мешочек, желательно, чтобы внутренняя сторона была черная, наружная – белая. Прикрепляют этикетку, на которой простым карандашом обозначают № группы, фамилию и вариант опыта. Ежедневно раствор в банках продувают 3 – 5 минут с помощью резиновой груши. По мере надобности доливают воду до метки. Опыт длится 4 недели. Результаты опыта записывают в таблицу 22. Отношение массы надземной части к массе корней Внешний вид растений (окраска верхних и нижних листьев, характер повреждеЧисло устьиц ний) в поле зрения сухих сырых сухой сырой Число листьев, шт. Высота растений, см Таблица 22 - Влияния элементов питания на рост растений Состав Масса надМасса питательземной часкорней, ной смеси ти, г/сосуд г/сосуд Полная Без N Без Р Без К Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 3: ДИАГНОСТИКА ЭЛЕМЕНТОВ МИНЕРАЛЬНОГО ПИТАНИЯ. Цель: овладеть экспресс-методом определения степени обеспеченности растений азотом, фосфором и калием. Работа 22. Диагностика элементов минерального питания с помощью прибора ОП-2 Объект исследования: органы растений. Материалы и оборудование: 1%-ный раствор дифениламина, раствор бензидина, раствор уксуснокислого натрия, 5%-ный раствор кобальтинитрита 60 натрия, раствор дипикриламина магния, конц. раствор HCl, предметные стекла, лезвия безопасной бритвы, стеклянные палочки, белая бумага, Вводные пояснения. Экспресс метод позволяет контролировать содержание азота, фосфора и калия в растениях в период вегетации и делать соответствующие корректировки в системе удобрения культуры. Ход работы. Определение нитратов. На предметное стекло, под которое подложена белая бумага, с промежутками 1 - 2 см кладут срезы той или иной части растения, затем стеклянной палочкой выдавливается сок, отодвигают срез несколько в сторону от пятна выдавленного сока. На пятно сока и на срез наносят по 1 капле 1%-ного раствора дифениламина и следят за появлением синей окраски. Интенсивность этой окраски сравнивают с цветной шкалой и с таблицей 23. Содержимое нитратов в шкалах снижается с возрастом растений, а к цветению они почти исчезают. Таблица 23 - Шкала потребности растений в азотных удобрениях Балл Визуальные признаки окраски среза Содержание нитратов 1. Бледно-голубоватая, очень быстро настуНизкое пает обугливание 2. Синяя, постепенно исчезающая Среднее 3. Темно-синяя или темно-фиолетовая, быстВысокое ро наступающая, устойчивая Определение фосфатов. На предметное стекло, под которое подложена белая бумага, с промежутками 1 - 2 см кладут срезы той или иной части растения, затем с помощью стеклянной палочки выдавливается сок, отодвигают срез несколько в сторону от пятна выдавленного сока. На пятно сока и на срез наносят по одной капле молибденово-кислого аммония, затем последовательно по 1 капле растворов бензидина и уксуснокислого натрия. При наличии фосфатов в растении на стекле появляется синее окрашивание капли сока и ткани растения. Интенсивность окраски сравнивают цветной шкалой для определения фосфатов и с таблицей 24. Таблица 24 - Шкала потребности растений в фосфорных удобрениях Балл 1. 2. Визуальные признаки окраски среза Серо-голубой, пучки темные Светло-синяя, сосудистые пучки синие Содержание фосфора Низкое Среднее 3. Темно-синяя, сосудистые пучки иссиня-черные Высокое 61 Определение калия. На предметное стекло, под которое подложена белая бумага, с промежутками 1 - 2 см кладут срезы той или иной части растения, затем с помощью стеклянной палочки выдавливается сок, отодвигают срез несколько в сторону от пятна выдавленного сока. На пятно сока и на срез наносят последовательно по 1 капле раствора дипикриламина магния и соляной кислоты. Соляная кислота растворяет избыток реактива, образуя лимонножелтое окрашивание и не растворяет калийную соль дипикриламина. Поэтому лимонно-желтая окраска указывает на отсутствие калия, а оранжевокрасная на наличие калия. Интенсивность окраски сравнивают цветной шкалой для определения калия и с таблицей 25. Результаты записывают в баллах шкалы и устанавливают степень нуждаемости растения в калии. Таблица 25 - Шкала потребности растений в калии Балл Визуальные признаки окраски среза Содержание калия 1. Соломенно-оранжевая Низкое 2. Оранжевая Среднее 3. Красно-суриковая Высокое При отсутствии дипикриламина определение калия в растениях производят с применением кобальтинитрина натрия, для чего на пятно сока и на срез наносят 1 каплю 5%-ного раствора кобальтинитрита натрия и дают возможность образоваться осадку K2Na(Co(NO2)6). Через 1 мин. добавить 1 - 2 капли соляной кислоты (уд. вес 1,19), разбавленной 3:1 (3 ч. HCl и 1 ч. H2O) для растворения избытка реактива и перемешать содержимое стеклянной палочкой для ускорения реакции. Через 3 - 5 мин. сравнить интенсивность окраски осадка с цветной шкалой для определения калия. Результаты записывают в баллах шкалы, которые разграничены по степени нуждаемости растения в азотных, фосфорных и калийных удобрениях (таблица 26). Таблица 26 - Содержание основных элементов питания в растении Растение Содержание фосфора азота 62 калия Сделать выводы об обеспеченности растений элементами питания и о необходимости подкормок. Вывод: Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Минеральное питание растений» 1. Химический элементный состав растений. 2. Макроэлементы, их усвояемые формы и роль в жизни растений. 3. Микроэлементы, их усвояемые формы и роль в жизни растений. 4. Физиологические основы диагностики обеспеченности растений элементами минерального питания. 5. Поглощение, распределение по органам, накопление и вторичное использование (реутилизация) элементов минерального питания растений. 6. Потребность растений в элементах питания в течение вегетации. 7. Вегетационный и полевой методы исследования, их роль в изучении основных закономерностей жизнедеятельности растений и решении практических задач. 8. Антагонизм ионов, природа и значение в жизни растений. 9. Физиологически уравновешенные растворы и их практическое применение. 10. Физиологические основы выращивания растений без почвы, использование в практике защищенного грунта. 11. Физиологические основы применения удобрений. 63 РАЗДЕЛ 6. ОБМЕН И ТРАНСПОРТ ВЕЩЕСТВ В РАСТЕНИЙ В любом живом организме обмен веществ складывается из двух противоположно направленных процессов, идущих с поглощением или выделением энергии, - анаболизма и катаболизма. Анаболизм – ферментативный синтез клеточных компонентов из простых предшественников с затратой энергии АТФ. Катаболизм – ферментативное расщепление веществ, осуществляемое преимущественно за счет реакций окисления с запасанием энергии в форме АТФ. В процессе катаболизма происходит постепенный многоступенчатый распад сложных органических соединений. На первых этапах распада веществ происходят гидролитические процессы, в результате которых из полисахаридов образуются моносахариды, белки гидролизуются до аминокислот, жиры превращаются в глицерин и жирные кислоты. При гидролизе высвобождается небольшое количество энергии, которое организмом не запасается. Продукты гидролиза запасных веществ включаются в общее русло окислительных реакций. Аминокислоты в результате окислительного декарбоксилирования образуют кетокислоты, которые участвуют в цикле Кребса. Глицерин после окисления до фосфодиоксиацетона входит в анаэробную фазу дыхания. Жирные кислоты подвергаются β-окислению до ацетилкофермента А, который поступает в цикл Кребса. В результате окисления веществ образуются три важных метаболита, занимающих центральное положение в обмене веществ - ацетилкофермент А, щавелево-уксусная и кетоглутаровая кислоты. Через эти метаболиты осуществляются взаимопревращения многих органических веществ, в том числе липидов, углеводов и белков. Кроме того, образуются восстановленные НАДФ Н и ФАД Н2, которые могут быть использованы как для образования АТФ, так и в различных восстановительных реакциях. Наиболее полно вопрос об использовании растениями нитратного и аммонийного азота разработан академиком Д.Н. Прянишниковым (1955) и его сотрудниками. Растения поглощают соединения азота из почвы. Основными источниками азотного питания для растений являются нитраты и аммиак. Факторами, определяющими поглощение растениями нитратов и аммиака, является реакция питательной среды, ионный состав среды, наличие достаточного количества органических кислот и температура. В слабокислой среде (рН 5) лучше поглощаются нитраты, а в нейтральной – аммоний, но при условии достаточного количества ионов кальция. При недостатке органических кислот аммиак не успевает связываться и становится токсичным для растений. При пониженной температуре больше поглощается аммония, чем нитратов. Нитраты, поступая в корни растений, подвергаются ферментативному восстановлению до нитритов с помощью фермента нитратредуктазы (содержит в своем составе молибден) в цитозоле клеток корня и листа, а далее до аммиака с помощью фермента нитритредуктазы (содержит в своем составе железо) пластидах клеток листа. Источником углерода для корня служат продукты фотосинтеза, ко64 торые в основном синтезированы в закончивших рост листьях. Основная транспортная форма ассимилятов – сахароза. Она же является универсальным источником для синтеза всех органических соединений в корне. Под действием инвертазы сахароза расщепляется на глюкозу и фруктозу. Некоторые моносахара участвуют в образовании полимеров клеточных стенок – целлюлозы, гемицеллюлозы, пектиновых веществ; в синтезе крахмала и откладываются в запас. Другая часть моносахаров тратится на процесс дыхания, поставляющий энергию в виде АТФ и на органические кислоты, образующиеся в цикле Кребса. Часть органических кислот используется в корне в качестве акцепторов для первичной ассимиляции аммиака с образованием аминокислот. Интенсивность образования аминокислот максимальна в фазу цветения и в дневные часы. В ночные часы в пасоке накапливаются другие формы небелкового азота (аммиак, нитраты, амиды, азотистые основания). Аминокислоты и амиды – основные транспортные формы азота, поступающие в надземные органы растения и являющиеся исходным материалом для синтеза в корне всех азотсодержащих органических соединений (белков, пуриновых и пиримидиновых оснований, нуклеиновых кислот и др.). В корнях также синтезируются витамины (В1, В6, никотиновая и аскорбиновая кислоты), ростовые вещества (цитокинины, гиббереллины, АБК), алкалоиды и др. Часть их вовлекается в метаболические процессы корня и всего растения и в обменные процессы, другая часть выделяется в почву, формируя ризосферу и воздействуя на микроорганизмы почвы и другие виды растений. Различают 3 типа транспорта веществ в растении: 1) внутриклеточный; 2) ближний (внутри органа); 3) дальний (между органами). 1. Внутриклеточный транспорт. Передвижение веществ внутри клетки осуществляется в результате совместного действия кругового движения цитоплазмы и направленной поперек этого движения диффузии. Движение цитоплазмы осуществляется с помощью сократительных белков актинов. Скорость движения цитоплазмы 0,2 – 0,6 мм/мин. Также во внутриклеточном транспорте принимают участие каналы ЭПС и пузырьки Гольджи. 2. Ближний транспорт. Это перемещение ионов, метаболитов и воды между клетками и тканями внутри органа. Этот транспорт включает радиальный транспорт веществ по корню и стеблю, передвижение веществ в мезофилле листьев на небольшие расстояния в мм. Осуществляется он по апопласту – совокупности межклетников и полостей клеточных стенок и симпласту – совокупности протопластов соседних клеток, соединенных плазмодесмами. Сюда же относится и система вакуоли. (см. радиальный транспорт воды по корню). 3. Дальний транспорт. Это передвижение веществ между органами растения. Осуществляется по специализированной проводящей системе, 65 включающей сосуды и трахеиды ксилемы (восходящий ток) и ситовидные трубки флоэмы (нисходящий ток). ТЕМА 1: ФЕРМЕНТЫ ОБМЕНА ВЕЩЕСТВ Цель: изучить характер действия ферментов диастазы и липазы, их участие в превращении веществ и зависимость от внешних факторов. Работа 30. Образование диастазы при прорастании крахмалистых семян Объект исследования: проросшие семена гороха и ячменя. Материалы и оборудование: 10%-ный желатин, 2%-ный крахмальный клейстер, слабый раствор йода в йодистом калии, вода; пинцет. Вводные пояснения. Способность тех или иных растительных форм к синтезу и накоплению химических веществ определяется специфическим типом обмена веществ, который сформировался в процессе эволюции живых организмов и закреплен генетически. В процессе прорастания семян крахмал распадается на более простые соединения. Гидролитический распад запасного крахмала может протекать при участии гидролитических ферментов гидролаз – амилаз (диастаз). В период прорастания активность гидролитических ферментов возрастает, при этом содержание крахмала снижается, а сахаров возрастает. Ход работы. На желатиновую пластинку (крахмальный клейстер 2% + желатина 10%) разложить проросшие семена гороха, ячменя, предварительно разрезав их пополам и смочив поверхность среза водой. Через 20 – 30 мин. осторожно снять пинцетом семена и облить всю пластинку слабым раствором йода в йодистом калии (на 10 мл воды берут 10 капель исходного раствора). Светлыми останутся те места, где лежали семена, что указывает на превращение крахмала в сахар в этих местах под влиянием диастаза. Вывод: Работа 31. Определение активности липазы Объект исследования: семена подсолнечника. Материалы и оборудование: 1%-ный раствор уксусной кислоты, 0,1 н раствор NaOH, фарфоровая ступка с пестиком, конические колбы, воронки, пипетки, спирт, фенолфталеин, весы, фильтровальная бумага, вода дистиллированная. 66 Ход работы. Берут три равные навески семян подсолнечника по 2,0 г каждая (предварительно очистить от околоплодника). Тщательно перетереть каждую порцию семян в фарфоровой ступке. Растертые семена перенести в три колбы. В первую колбу прибавить 10 мл дистиллированной воды. Во вторую колбу – 10 мл воды и 2 мл 0,1 н раствора уксусной кислоты. В третью колбу – 10 мл воды. Затем содержимое этой колбы кипятить в течение 3 минут и охладить. Прибавить 2 мл 0,1 н раствора уксусной кислоты. Все три колбы убрать темный шкаф на 18 – 24 часа. На следующий день колбы вынимают и выравнивают в них условия среды. Для активации липазы требуется определенная рН среды, в данном случае меньше 7 (речь идет о кислой липазе). С этой целью в первую колбу прибавляют 2,0 мл 0,1 н раствора уксусной кислоты. Затем приступают к титрованию 0,1 н раствором NaOH в присутствии 1 – 2 капель фенолфталеина. Для того, чтобы предотвратить процесс гидролитической диссоциации мыла, которое образуется при титровании, прибавляют по 25,0 мл спирта в каждую колбу. По количеству 0,1 н раствора NaOH, израсходованного на титровании, судят об активности липазы. В первой колбе, не содержащей кислоты, фермент липаза находится в неактивном состоянии. В третьей колбе, содержимое которой было подвергнуто кипячению, процесс не идет, так как фермент разрушен. Вывод: Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Обмен и транспорт веществ в растений» 1. Специфика обмена веществ у растений. 2. Превращение азотистых веществ в растении. Значение работ Д.Н. Прянишникова в изучении азотного обмена растения. 3. Метаболические пути синтеза важнейших химических веществ. Вторичный метаболизм. 4. Роль дыхания в биосинтезах. 5. Биосинтетическая деятельность корня. 6. Ближний и дальний транспорт веществ в растении. 7. Состав флоэмного и ксилемного сока. Донорно-акцепторные отношения, аттрагирующие центры в растении. 8. Способы регулирования транспорта веществ с целью повышения урожайности сельскохозяйственных культур и качества продукции. 67 РАЗДЕЛ 7. РОСТ И РАЗВИТИЕ РАСТЕНИЙ Рост - необратимое увеличение размеров и массы клетки, органа или «всего организма, связанное с новообразованием элементов их структур. Понятие «рост» отражает количественные изменения, сопровождающие развитие организма или его частей. Рост - одно из основных свойств живой материи. «Рост - это процесс новообразования элементов структуры организма» (Д.А. Сабинин, 1955 г.). Рост происходит на разных уровнях: субклеточном, клеточном, органном и организменном, т.е. можно говорить о новообразовании органелл, клеток, органов, росте организма и популяции. Рост как процесс не прерывается в течение жизни растения, а меняются лишь его формы. Скорость роста зависит от вида растения и регулируется внешними и внутренними факторами. Скорость роста побега составляет в среднем в умеренной зоне около 0,01 мм/мин, в тропиках - до 0,07, а у побегов бамбука - 0,20. Еще быстрее растут ттычинки злаков - 1,18 мм/мин. Развитие - это качественные изменения в структуре и функциональной активности растения и его частей (органов, тканей и клеток) в процессе онтогенеза. В понятие «развитие» входят также и возрастные изменения. Внешним критерием развития растений служит их переход к размножению; для цветковых растений - это заложение цветков, а затем образование плодов. Развитие организма зависит от генетической программы развития и повторяется из поколения в поколение. Закодированы не только морфологические признаки, но и время их появления. Выделение отдельно процесса роста и процесса развития в определенной степени условно, т.к. почти любой процесс роста связан с развитием. Рост и развитие локализованы в одних и тех же тканях - меристемах. Растения растут в течение всей своей жизни, образуя новые ткани и органы, которые начинают формироваться в эмбриональных зонах – меристемах. Существование меристем поддерживается инициальными клетками (инициалями), длительное время способными приступить к делению. Апикальные (верхушечные) меристемы расположены на концах побегов и корней. Апикальные меристемы побега и корня представляют собой не только образовательные ткани, но и главные координирующие центры, влияющие на морфогенетические процессы в целом растении. Латеральные (боковые) меристемы образуют слои клеток вдоль побега и корня. В основании междоузлий и листьев локализованы интеркалярные (вставочные) меристемы. Онтогенез - индивидуальное развитие организма от зиготы (или вегетативного зачатка) до естественной смерти. В ходе онтогенеза реализуется наследственная информация организма (генотип) в конкретных условиях окружающей среды, в результате чего формируется фенотип (совокупность всех признаков и свойств индивидуального организма). В онтогенезе выделяют пять этапов: 1. Эмбриональный (семенной или почковый, или зародышевый) – от оп68 лодотворения яйцеклетки до начала прорастания зародыша; в него входит и период глубокого покоя семян. 2. Ювенилъный, или молодости, - от прорастания зародыша до появления на растении первичных зачатков цветков. 3. Зрелости (половой или вегетативной) - от закладки цветковых зачатков до появления новых зародышей. 4. Размножения (полового или вегетативного) - от возникновения эмбрионов до полного созревания плодов и семян. 5. Старости - от полного прекращения плодоношения до отмирания растения. Первый и второй периоды онтогенеза, характеризующиеся увеличением числа и размеров вегетативных органов, объединяют общим понятием вегетативного развития, а третий и четвертый - генеративного развития растения. Все процессы роста и развития растений осуществляются через деление, рост и дифференциацию клеток. Рост в длину и ветвление побегов и корней происходят благодаря деятельности апикальных меристем верхушек побегов и кончиков корней, рост в толщину - деятельности камбия. В период роста клетки меристем и камбия непрерывно делятся; наружная часть клеток остается в меристематическом состоянии, а все остальные растут и дифференцируются в ткани и органы. Следовательно, каждая клетка в своем росте проходит три фазы: 1) меристематическую, или эмбриональную, 2) роста, или растяжения, и 3) дифференциации. Меристематические клетки имеют тонкую пектоцеллюлозную оболочку, они заполнены густой цитоплазмой и, как правило, не имеют вакуолей. В фазе растяжения клетки сильно увеличиваются в размере, главным образом благодаря поглощению воды и образованию крупных вакуолей, но при этом также увеличивается масса клеточной оболочки и цитоплазмы. Зона растяжения у корней составляет около 1 см, у стеблей - около 5 - 10 см. Уже в зоне растяжения клетки начинают дифференцироваться в ткани, но полная дифференцировка и рост в толщину наблюдаются ниже этой зоны в стеблях и выше - в корнях. В зоне растяжения рост в длину незначительный. Общий закон роста - его неравномерность, или периодичность, обусловленная внутренними причинами. Вначале рост органа или всего растения происходит медленно, затем быстрее и потом замедляется. Нарастание общей массы органа или растения графически выражают в виде плавной S-образyой кривой, а скорость роста, или приросты массы, в виде плавной, более или менее симметричной кривой с одним максимумом. Процессам роста, как и другим физиологическим явлениям, свойственна периодичность, которая вызывается как особенностями самих процессов, так и факторами внешней среды. Наиболее распространены процессы с периодичностью около суток: изменения митотической активности в меристемах, фотосинтез, дыхание, открытие и закрытие цветков и так 69 далее. Суточные ритмы связаны с суточными колебаниями освещенности и температуры. Сложившаяся периодичность физиологических процессов сохраняется у растений некоторое время после изменения условий среды. Поэтому эти ритмы названы эндогенными. Кроме суточной для растений характерна сезонная периодичность. Ростовые корреляции – это зависимость роста и развития одних органов от других. Самый простой тип корреляции связан с питанием. Развитие побега зависит от корня, поставляющего минеральные вещества и воду. В свою очередь, побег поставляет в корень органические соединения. Основную роль играют гормональные взаимодействия между частями растения. Примером гормональной регуляции служит явление апикального доминирования – торможения верхушкой побега или корня развития соответственно пазушных почек или боковых корней. Апикальное доминирование обусловлено тем, что точка роста побега, содержащая большое количество ауксина, является мощным аттрагирующим центром, притягивающим питательные вещества и цитокинин, синтезированный в корне. Ростовые корреляции используются в растениеводстве для получения большего количества продукции. Например, пасынкование – удаление боковых побегов у томатов – способствует образованию более крупных плодов, пикировка – обрывание кончиков корней при пересадке рассады овощей – увеличивает число боковых корней. Полярность - физиологическая неравноценность противоположных полюсов (верхушка - основание) клетки, органа и целого растения. Регенерация – это восстановление организмом поврежденной или утраченной части тела, что является одним из способов вегетативного размножения и защиты растений от повреждений. Различают следующие виды регенерации. 1. Физиологическая регенерация. Части восстанавливаются при их естественном изнашивании, например, постоянное восполнение слущивающихся клеток корневого чехлика. 2. Травматическая регенерация. К важному внутреннему фактору роста и развития растений относятся вещества высокой физиологической активности, объединяемые под название регуляторов роста и развития - фитогормоны. Гормоны растений (греч. hormon - пробуждающий, вызывающий) называют фитогормонами. Фитогормоны - это химические соединения, которые вырабатываются в очень малом количестве в одной части растения, транспортируются в другую часть и там в незначительных концентрациях (10-6-10-12М) могут проявлять регулирующее действие на процессы роста и развития. Известно четыре класса фитогормонов, действующих преимущественно как активаторы или стимуляторы (ауксины, гиббереллины. цитокинины, брассины) и два класса фитогормонов, оказывающих, главным образом, тормозящее действие, т.е. ингибиторы (абсцизовая кислота, этилен). Однако исследования показали, что один и тот же гормон может стимулировать один процесс и ингибировать другой. Гормоны полифункциональны и включают (индуцируют) не одну какую-нибудь ре70 акцию, а целую физиологическую программу. После включения ответной реакции гормон должен быть разрушен или инактивирован. Ауксины (от греч. «аuхеim» - увеличиваться, расти) или βиндолилуксусная кислота (ИУК), являющаяся производным индола (С8Н7N). Она синтезируется в растении из аминокислоты триптофана. Образование ИУК зависит от снабжения растения питательными веществами, особенно водой и азотом. У высших растений ИУК синтезируется, прежде всего, в верхушечной меристеме и в прилегающих к ней молодых листочках, в растущих зародышах, семяпочках и семядолях. Меристемы верхушек корней образуют мало ауксина, а запасающие ткани семян и пыльца богаты ею. Из мест синтеза движение ауксина в стебле и корне полярно, т.е. он передвигается быстрее в одном направлении, чем в другом. Из верхушки стебля ИУК передвигается по ситовидным трубкам вниз в побеги, листья и почки, а из меристемы корня - вверх. ИУК стимулирует растяжение клеток. Под ее влиянием происходит вытягивание стеблей и колеоптилей. Ауксин стимулирует синтез ДНК, РНК, белка, образование микротрубочек и митотического веретена, участвует в дифференцировке сосудов в верхушке стебля и способствует образованию проводящей ткани при возобновлении роста весной. Обработка ауксином повышает содержание целлюлозы и гемицеллюлозы. Ускоряя деление клеток, ауксин стимулирует образование придаточных корней у черенков и листьев, а также боковых корней, возникающих из клеток перицикла главного корня, но тормозит образование клубней. Пыльца, попадающая на рыльце цветка при опылении, вызывает синтез ауксина в завязи, под влиянием которого начинает быстро расти околоплодник. ИУК влияет на поступление в клетки воды. При погружении молодых тканей в очень слабые растворы гормона (0,001 - 0,01 %) вода поступает в них в 2 - 3 раза быстрее, чем при их погружении в чистую воду, клетки быстро растягиваются, уменьшается вязкость цитоплазмы, изменяется скорость ее движения, что влияет на скорость химических реакций. ИУК влияет на энергетический обмен. У растений, получивших экзогенную ИУК, почти в 2 раза увеличивается интенсивность фотосинтеза, активируются дыхательные ферменты. ИУК обладает аттрагирующим действием. Это приводит к усиленному росту органов, ауксины определяют направление транспорта веществ в растении. Регулируя распределение и транспорт веществ, ауксины определяют полярность растения. ИУК обеспечивает взаимодействие между разными органами - корреляции. Например, ауксин из верхушки стебля перемещается вниз и подавляет рост пазушных почек (апикальное доминирование). Практическое применение ауксина и его синтетических аналогов. 1. Метод искусственного укоренения черенков. 2. Борьба с сорняками. 3. Предупреждение преждевременного опадания плодов. 4. Дефолиация растений. 71 5. Получение партенокарпических плодов. 6. Регуляция плодоношения. 7. Защита от весенних заморозков. 8. Увеличение периода покоя клубней. Гиббереллины. Известно около 80 гиббереллинов, 20 из которых естественные гормоны высших растений. Чтобы различать их, им присвоили определенные номера: ГК1, ГК2, ГК3 и так далее, имеющие одинаковый молекулярный скелет, но отличающиеся друг от друга по типу, числу и расположению функциональных групп. Наиболее распространен гиббереллин ГК3 - гибберелловая кислота С19Н22О6. По химической природе гиббереллины - это тетрациклические дитерпеноиды, состоящие из четырех остатков изопрена. Основное место синтеза гиббереллинов - молодые листья, а в клетке – пластиды, но они обнаружены во всех частях растения: побегах, корнях, листьях, бутонах, пестиках, тычинках, семенах. Транспорт гиббереллинов в растении не является полярным. Гиббереллины свободно передвигаются из листьев вверх и вниз. Наиболее типичное действие гиббереллинов - это стимуляция роста у карликовых сортов гороха, кукурузы и у розеточных растений. После обработки гормоном такие растения достигают высоты нормальных сортов. У злаков после обработки гиббереллином вытягиваются стебли и листья; у широколиственных растений резко усиливается рост стеблей; кустовая форма фасоли превращается во вьющуюся. Рост стеблей вызван только растяжением клеток. Гиббереллин действует и на эмбриональную фазу роста клетки, а также стимулирует рост столонов и задерживает образование клубней. Гиббереллины ингибируют образование и рост корней, но стимулируют разрастание завязей, что приводит к образованию партенокарпических плодов. Обработка гиббереллином может нарушить состояние покоя. Перед выходом из состояния покоя этот гормон накапливается в семенах, луковицах, почках, клубнях. Гиббереллины активизируют гидролитические ферменты (например, α-амилазу) и их синтез в зерновках злаков, что вызывает более быстрые превращения запасных веществ и прорастание семян. Гиббереллины ускоряют прорастание свежесобранных клубней картофеля. Практическое применение гиббереллинов. 1. При обработке гибберелловой кислотой волокнистых культур резко возрастает урожай и качество волокна. 2. С помощью гиббереллинов можно прервать покой клубней картофеля и семян некоторых растений. Обработка гиббереллином может заменить стратификацию у тех семян, которые в ней нуждаются. 3. Опрыскивание гибберелловой кислотой цветков винограда позволяет получать бессемянные, более сладкие плоды. 4. Обработка плодов апельсинов гиббереллинами предотвращает старение кожуры, удлиняет сроки сбора урожая, следовательно, увеличивает период продажи плодов. 72 Цитокинины - производные аденина, у которого аминогруппа в шестом положении замещена различными радикалами, синтезируются из мевалоновой кислоты и образуются главным образом в кончиках корней. Оттуда они передвигаются вместе с пасокой по сосудам и попадают в листья и другие органы. Цитокинины образуются также в почках, в основании листьев, в созревающих семенах, но эти цитокинины не передвигаются в другие органы. Это означает, что синтез цитокининов происходит в разных участках растения в зависимости от этапа онтогенеза. Экзогенные цитокинины не транспортируются по растению, а действуют в месте обработки. Цитокинины могут взаимопревращаться. Главные функции цитокининов - стимуляция клеточного деления и дифференцировки, задержка процессов старения. Цитокинины стимулируют деление клеток, усиливая синтез белка и нуклеиновых кислот, активируют рост клеток листьев у двудольных растений, образование клубней. Они нарушают апикальное доминирование, вызывая заложение и рост пазушных почек, стимулируют растяжение клеток у изолированных листьев и семядолей, отрезков стеблей или колеоптилей. Цитокинины обладают огромной аттрагирующей способностью, т.е. притягивают ассимиляты (аминокислоты, углеводы) и регуляторные вещества к клеткам и тканям, содержащим большое количество этого гормона. Цитокинины задерживают старение листьев. Цитокинины активируют открывание устьиц, а также работу нижнего концевого двигателя водного тока. Практическое применение цитокининов. 1. Цитокинины нарушают покой, например, свежеубранных клубней картофеля, активируют прорастание семян, так как растущие семядоли быстрее разрывают кожуру. 2. Цитокинины вызывают рост пазушных почек, заторможенных ауксинами, т.е. возможно их применение для нарушения апикального доминирования. 3. Используя кинетин, можно регулировать рост и образование органов в культуре изолированных тканей. Абсцизовая кислота (АБК) - соединение терпеноидной природы. Она синтезируется из мевалоновой кислоты, а также из продуктов распада ксантофиллов. Основными органами ее синтеза являются стареющие листья. Транспортируется АБК по сосудам и ситовидным трубкам вверх и вниз во все органы. АБК, синтезируемая в корневом чехлике, передвигается базипетально по проводящим тканям центрального цилиндра. Она может передвигаться и латерально по паренхимным клеткам под действием силы тяжести. АБК тормозит процессы роста: задерживает растяжение и деление клеток у молодых проростков и в культуре ткани; ингибирует распускание почек (антигиббереллиновое действие); тормозит вызванный ИУК рост колеоптилей овса, прорастание этиолированных зародышей пшеницы; подавляет индуцированный гиббереллином синтез (α-амилазы в алейроновом 73 слое ячменя). Накопление АБК вызывает покой у семян некоторых растений. Под влиянием короткого дня в листьях, например, березы синтезируется больше АБК, которая транспортируется в почки и вызывает переход их в покой. АБК играет роль антитранспиранта. Закрывание устьиц под действием абсцизовой кислоты вызывает уменьшение интенсивности фотосинтеза в 2 - 4 раза. АБК разобщает окисление и фосфорилирование, т.е. является антагонистом гиббереллина и цитокининов. Разобщение окисления и фосфорилирования приводит к уменьшению синтеза АТФ, к уменьшению интенсивности темновой фазы фотосинтеза, что и является в конечном счете причиной торможения ростовых процессов. АБК участвует в клубнеобразовании, стимулирует опадение семядолей, листьев у хлопчатника, опадение цветков и зрелых плодов у винограда, цитрусовых и яблок (антиауксиновое действие). АБК стимулирует созревание молодых плодов, увеличивает устойчивость растений умеренного климата к морозам, например яблонь. Этилен - это газ, отличается от других гормонов очень большой летучестью. Он хорошо растворим в воде, поэтому может транспортироваться в водном растворе. Однако считают, что он действует там, где образуется, поэтому не перемещается по растению на большие расстояния. Этилен образуется в плодах, цветках, листьях, облиственных стеблях, корнях и семенах. Однако в наибольшем количестве этилен образуется в стареющих или созревающих тканях, в тканях, которые быстро делятся или растягиваются. Зрелые ткани синтезируют его значительно меньше. Ткани всех возрастов способны продуцировать много этилена в ответ на ранение, дефицит воды, высокие и низкие температуры, ультрафиолетовое облучение. Этилен в норме необходим для созревания плодов, синтезируясь в клетках самого плода. Для начала созревания его концентрация должна увеличиться в три раза. Если уменьшить его биосинтез, то можно значительно удлинить сохранность плодов и избежать таким способом перезревания и загнивания фруктов и овощей. Этилен стимулирует увядание цветков, опадение листьев и плодов. Он ингибирует синтез и передвижение ауксина, подавляющего опадение. Он вызывает образование отделительного слоя в основании черешка или цветоножки. Под действием этилена расположенные здесь клетки увеличиваются в размерах, в них синтезируются целлюлоза и пектиназа, разрушающие клеточные стенки. В результате связь между клетками ослабевает и лист или цветок опадают. Этилен может вызвать прорастание в темноте семян, нуждающихся в свете для выхода из состояния покоя. Брассины или брассиностероиды обладают ростостимулирующим эффектом. Присутствуют в листьях, стеблях, незрелых семенах, галлах. Брассины входят в класс терпеноидов. Экзогенная обработка этим гормоном в низких концентрациях оказывает влияние не только на процессы роста и развития растений, она может повышать их устойчивость к стрес74 совым воздействиям, как резкие колебания температуры, засуха, засоление, аноксия и воздействие патогенов. Синтетические регуляторы роста. Изучение связи особенностей строения молекул с их физиологической активностью привело к синтезу искусственных аналогов ИУК: индолилмасляной кислоты (ИМК), дихлорфеноксиуксусной кислоты (2,4-Д), нафтилуксусной кислоты (НУК) и др. Некоторые синтетические соединения имеют большую физиологическую активность, чем природный ауксин. К синтетическим ингибиторам, используемым для обработки растений, относятся уничтожающие сорняки гербициды; задерживающие передвижение ИУК по растению антиауксины (трийодбензойная кислота, дихлоранизол и др.); ретарданты, уменьшающие длину и увеличивающие толщину стеблей (ССС, АМО-1618); морфактины (флуоренол), нарушающие процессы в точках роста и вызывающие таким способом появление уродливых органов; гидразид малеиновой кислоты, приостанавливающий рост всех органов. В отличие от природных синтетические ингибиторы более резко подавляют рост, медленнее инактивируются в тканях. Дефолианты ускоряют листопад у растений, что активирует созревание семян и плодов и облегчает механизированную уборку урожая. Десиканты вызывают ускоренное высушивание листьев и стеблей, что позволяет вести сбор семенников бобовых культур и уборку картофеля комбайнами. В жизни растения имеется период покоя. Различают вынужденный покой, обусловленный факторами внешней среды, препятствующими прорастанию, и физиологический или глубокий покой, который регулируется балансом стимуляторов и ингибиторов роста. При вступлении в период покоя происходят процессы, повышающие устойчивость клеток к неблагоприятным факторам среды: возрастает вязкость цитоплазмы, она отходит от клеточных стенок, что нарушает связь между клетками, снижается интенсивность процессов обмена. Сухие семена не прорастают до тех пор, пока не будет достаточного количества воды. Весной почки не распускаются, пока не поднимется до определенного уровня температура. Растения, находящиеся в физиологическом покое, не переходят к росту даже при благоприятных условиях среды. Регулирование состояния покоя имеет значение для растениеводства. Для выхода семян из глубокого покоя их подвергают стратификации – выдерживанию влажных семян при пониженной температуре. Ростовые движения. В процессе эволюции у растений возник специфический способ движения за счет необратимого роста клеток растяжением. Тропизмы - это движения растений, обусловленные односторонне действующими факторами среды. Они являются следствием более быстрого роста клеток растяжением на одной стороне побега, корня, листа. В зависимости от природы фактора различают гео-, фото-, тигмо-, термо-, электро- и хемотропизмы. При положительных тропизмах движение направлено в сторону раздражителя, при отрицательных – от него. 75 Настии - это движения растений, обусловленные диффузно действующими факторами среды и происходят в результате неравномерного роста клеток растяжением. При росте верхней стороны орган изгибается книзу (эпинастия), нижней стороны – кверху (гипонастия). Фотонастия вызвана сменой света и темноты. У многих растений цветки закрываются при наступлении темноты и открываются утром. Эти движения можно вызвать, искусственно затеняя и освещая растения. Движения цветков происходят из-за разной скорости роста верхней и нижней сторон лепестков при изменении освещенности. Тигмонастия характерна для лазящих растений, когда усик в ответ на прикосновение закручивается. Он реагирует только при создании эффекта трения. В темноте усик не закручивается, но освещение растения даже через 90 мин после прикосновения вызывает закручивание усика. Движение происходит при участии этилена и ауксина, так как обработка ими вызывает закручивание усика без механического раздражения. После прикосновения нижняя сторона усика теряет тургор и становится вогнутой. Затем начинает расти верхняя сторона усика, что приводит к его закручиванию. Круговые нутации - это круговые или колебательные движения органов растения, характерные, в основном, для растущих побегов и корней. Они происходят за счет идущих по кругу ускорений роста клеток в результате геотропической корректировки в гравитационном поле. ТЕМА 1: РОСТ И ЕГО ЗАКОНОМЕРНОСТИ Цель: 1) изучить основной закон роста - неравномерность или периодичность роста; 2) выяснить, что морфологические признаки метамерных органов (листьев, междоузлий стебля) закономерно изменяются в зависимости от яруса побега. Работа 32. Наблюдение периодичности роста побега Объект исследования: побеги травянистых и древесных растений Материалы и оборудование: линейки. Вводные пояснения. Побег растет неравномерно. Вначале наблюдается медленный рост, затем скорость роста увеличивается, достигает максимума, снова замедляется, и, наконец, рост прекращается. Таким образом, наблюдается периодичность роста побега, которая характеризуется законом большого периода роста. Периодичность роста проявляется в том, что междоузлия, образующиеся по мере нарастания побега, имеют неодинаковую длину. В большинстве случаев она увеличивается от основания к середине побега, где достигает максимума, а к верхушке побега опять уменьшается. 76 Ход работы. Измеряют линейкой длину междоузлий годичного побега какоголибо травянистого или древесного растения. На основании полученных данных строят графики прироста междоузлий и побега. По оси ординат откладывают длину междоузлий и длину побега, по оси абсцисс — номера междоузлий, считая от основания побега. Делают вывод о периодичности роста побега. Результаты измерений записывают в таблицу 27 по приведенной форме. Таблица 27 - Наблюдение за ростом древесных побегов Длина, Номер междоузлия от основания побега см 1 2 3 4 5 6 7 8 9 10 11 12 13 междоузлия 14 15 побега Зарисовать графики прироста междоузлий и побега: Вывод: Работа 33. Наблюдение ярусной изменчивости морфологических признаков Объект исследования: растения пшеницы (ячменя) в фазе колошения или цветения. Материалы и оборудование: линейки, миллиметровая бумага. Вводные пояснения. Морфологические признаки метамерных органов (листьев, междоузлий стебля) закономерно изменяются в зависимости от яруса побега. Это хорошо прослеживается при сравнении размеров и фор77 мы листьев или длины междоузлий разных ярусов. От нижних к верхним ярусам побега размеры листьев сначала увеличиваются, а затем, достигнув определенного максимума, начинают уменьшаться. У некоторых видов растений (хлопчатник, томат и др.) закономерно изменяется и рассеченность листовых пластинок. При графическом выражении ярусной изменчивости получается одновершинная кривая. Ход работы. У растений пшеницы или ячменя, находящихся в фазе колошения (или цветения) и, следовательно, сформировавших листья всех ярусов, определяют площадь листьев в качестве показателя метамерной изменчивости. Для этого у листа каждого яруса измерют ширину основания пластинки и ее длину. Затем рассчитывают площадь листьев (см2) по формуле S = 2/3 kx, где k – ширина основания листа, см; x – длина пластинки, см. На миллиметровой бумаге вычерчивают графики, на которых отражают изменение площади листьев в зависимости от яруса побега. По оси абсцисс откладывают номе яруса, считая снизу, а по оси ординат – площадь листьев. Зарисовать графики изменения площади листьев в зависимости от яруса побега: Вывод: Дата__________________ Подпись преподавателя____________________ 78 ТЕМА 2: ПРОРАСТАНИЕ СЕМЯН Цель: изучить зависимость силы роста от массы семян (зерновок), метеорологических условий года получения урожая, длительности хранения семян. Работа 34. Определение силы роста семян методом морфофизиологической оценки проростов Объект исследования: зерновки пшеницы разных лет уборки урожая (крупная, средняя и мелкая фракции семян). Материалы и оборудовании: полоски полиэтиленовой пленки и фильтровальной бумаги, шпагат, метеорологические данные трех последних лет. Вводные пояснения. Процесс прорастания семян, сопровождаемый образованием органов (корней, побегов) будущего взрослого растения зависит от комплекса внутренних (вид растения, количество запасных веществ, зрелость и выполненность семян) и внешних (температура, влажность среды, пораженность фитопатогенами) факторов. Кроме этого на процесс прорастания оказывают влияние сроки хранения семян. Морфофизиологическая оценка представляет собой измерение следующих параметров органов прорастающих семян: у корней: количество корней, длина, внешнее состояние, масса; у колеоптиля: длина, состояние, масса. Наиболее полно истинные посевные качества семян характеризуются силой роста, т.е. способностью проростков к быстрому, дружному прорастанию и интенсивному росту. Для посева используют семена с силой роста не менее 80%. Силу роста определяют путем проращивания семян в рулонах и выражают в процентах относительной доли сильных проростков к общему числу семян в пробе. Ход работы. Для каждого варианта берут полоску полиэтиленовой пленки размером 60х15 см, накрывают ее такой же полоской фильтровальной бумаги, смоченной в воде. Во всю длину проводят линию карандашом на расстоянии 5 см от верхнего края. На эту линию укладывают 50 семян зародышем вниз на расстоянии 1 см одно от другого. Накрывают семена по всей длине второй полоской фильтровальной бумаги, смоченной в воде, ширина которой 5 см, свертывают в рулон, связывают шпагатом, снабжают этикеткой и ставят вертикально в сосуд, на дно которого налита вода. Проращивают семена в темноте в течение 7 дней при температуре 200С. Затем разворачивают рулон, оценивают проростки по пятибалльной шкале, определяют сырую массу надземной части и корней для всех 50 проростков вместе. Качество проростков оценивают по следующей шкале. 79 Сильные проростки Балл Длина ростка превышает 5 см, лист вышел из колеоптиля или равен его длине, число зародышевых корешков пять и более 5 5 Длина ростка не менее 4 см, лист в колеоптиле превышает 3/4 его размера, число зародышевых корешков не менее 4 4 Длина ростка не менее 2,5 см, лист в колеоптиле более 1/2 его размера, число зародышевых корешков не менее 3 3 Слабые проростки Балл Длина ростка менее 2,5 см, лист в колеоптиле менее ½ длины колеоптиля, число зародышевых корешков два и более 2 2 Росток по длине менее двух длин зерновки, число зародышевых корешков два и более 1 1 Результаты наблюдений записывают в форме таблицы. Силу роста семян выражают в процентах сильных проростков к общему числу семян в пробе. Делают выводы о влиянии условий выращивания и длительности хранения семян на силу роста. Кроме того, учитывают количество ненормально проросших и непроросших (набухших, загнивших твердых) семян. Результаты наблюдений записать в таблицу 28 по приведенной форме. Таблица 28 - Морфофизиологическая оценка проростков Вариант Оценка в Сумма Сила Сырая масса, Отношение опыта баллах баллов роста, г массы над% 5 4 3 2 1 надзем- корней земной части к массе корной ней части Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 3: ВЛИЯНИЕ ФИТОГОРМОНОВ НА РОСТ РАСТЕНИЙ Цель: изучить физиологическое действие ИУК. 80 Работа 35. Изучение влияния индолилуксусной кислоты на укоренение черенков фасоли Объект исследования: десятидневные проростки фасоли. Материалы и оборудование: 0,01%-ный раствор ИУК. Конические колбы на 200 мл, химические стаканы на 200 мл, ножницы. Вводные пояснения. Индолилуксусная кислота (ИУК) вызывает усиленное образование корней у черенков травянистых (особенно фасоли) и древесных растений. На этом основано применение ее в сельском хозяйстве для размножения черенков трудно укореняющихся растений. (На практике чаще используют синтетические аналоги ИУК, такие как αнафтилуксусная и индолилмасляная кислоты). Ход работы. Берут 10-тидневные растения фасоли высотой 11 – 13 см. Срезают у основания четыре одинаковых по высоте и общему развитию проростка, подрезают их под водой примерно на 1 см. Два черенка помещают в стакан с водопроводной водой (контроль), два других - в стакан с 0,01%-ным раствором ИУК (опыт). Через 3 часа черенки вынимают из раствора ИУК. Ополаскивают основание черенка водопроводной водой и погружают в воду. Оставляют оба варианта на свету при комнатной температуре (200С) до образования корней. В конце опыта учитывают число появившихся корней у черенков (контроль и опыт). Делают вывод о физиологическом действии ИУК. Результаты записывают в таблицу 29 по приведенной форме. Таблица 29 - Влияние ИУК на укоренение черенков Вариант опыта Число образо- Стимулирование корнеобразовававшихся кония решков под действием гетероауксина, % к контролю Водопроводная вода 0,01%-ный раствор ИУК Вывод: Работа 36. Изучение действия гибберелловой кислоты на рост междоузлий стебля карликового гороха Объект исследования: сорта гороха с нормальным ростом побега и карликовые формы. 81 Материалы и оборудование: литровые сосуды с растениями карликового и нормального роста побега гороха (песчаная или водная культура), выращенными на длинном дне и естественном или искусственном освещении до двух-трехнедельного возраста, 0,01%-ный раствор ГК, 0,01%-ный раствор хлорхолинхлорида, смесь 0,01% ГК + 0,01% хлохолинхлорида. Пульверизаторы для воды и рабочих растворов препаратов, линейки. Вводные пояснения. Гибберелловая кислота (ГК) – естественный регулятор роста из класса гиббереллинов. Для обнаружения и испытания веществ этой группы используют их способность стимулировать рост растений. Наиболее распространенный объект таких испытаний – молодые растения карликового гороха, обладающие повышенной чувствительностью к ГК. Реакция междоузлий разных ярусов стебля на ГК может иметь количественные различия. Поэтому следует учитывать влияние обработки растений ГК по стимуляции роста не только всего стебля, но и отдельных его междоузлий. Поскольку скорость роста побега зависит от баланса гормонов, в эксперименте также используют варианты обработки растений ингибиторами синтеза эндогенных гиббереллинов, например, хлорхолинхлоридом (ХХХ, препарат ТУР). Ход работы. В опыте используют контрастные сорта гороха с нормальным ростом побега и карликовые формы (Пионер). Берут четыре сосуда с двухтрехнедельными растениями гороха одного сорта (часть студентов при постанове опыта используют растения другого сорта). У всех растений измеряют исходную длину междоузлий каждого яруса и суммарно всего стебля. Полученные данные записывают в таблицу 30 по приведенной форме. Таблица 30 - Изменение длины побега од действием ростовых веществ НоКонтрольные Обработанные ГК мер растения междлина, мм прирост длина, мм прирост доисход- конеч- мм % исход- конеч- мм % узлия ная ная контная ная контроля роля Продолжение таблицы 30 НоОбработанные ХХХ мер длина, мм прирост межисходкомм % доная нечконтузлия ная роля 82 Обработанные ГК + ХХХ длина, мм прирост исход- конеч- мм % ная ная контроля Растения одного сосуда опрыскивают водой, другого – 0,01%-ным раствором ГК, третьего - 0,01%-ным раствором хорхолинхлорида, четвертого – раствором 0,01%-ным ГК + 0,01%-ным хлорхолинхлорида до полного смачивания поверхности. Через семь дней (на следующем занятии) повторно измеряют длину всех междоузлий стебля, включая и вновь образовавшиеся. Данные вписывают в туже таблицу. На основании первого и второго измерений высчитывают приросты междоузлий всего стебля у контрольных и обработанных ГК и хлорхолинхлоридом растений. Прирост опытных растений выражают в процентах контроля. Для рсчта используют средние величины длин каждого ярса у всех растений одного сосуда. На основе анализа полученных данных делают заключение о том, какое из междоузлий стебля растения гороха сильнее растет в длину под влиянием обработок раствором ГК, как проявляется ингибирование роста под действием хлорхолнхлорида и какое влияние на чувствительность растений оказывает совместное применение ГК и хлорхолинхлорида. Сравнивают ротовые реакции карликовых и нормальных растений гороха. Вывод: Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Рост и развитие растений» 1. Определение понятий «рост» и «развитие». 2. Фазы роста клеток, их физиолого-биохимические особенности. 3. Фитогормоны, их роль в жизни растений (регуляторы и ингибиторы роста). 4. Применение синтетических регуляторов роста в растениеводстве и биотехнологии. 5. Основные закономерности роста (целостность растительного организма, рост на протяжении всей жизни, периодичность, ритмичность, корреляции, полярность, регенерация), их использование в растениеводстве. 6. Влияние внутренних и внешних факторов на рост растений. 7. Регулирование роста светом. Экологическая роль фитохрома. 8. Тропизмы и другие виды ростовых движений, их значение в жизни растений. 9. Развитие растений. Онтогенез и основные этапы развития растений. Возрастные изменения морфологических и физиологических признаков. 10. Значение работ Д.А. Сабинина в изучении онтогенеза. 11. Фотопериодизм и яровизация как механизмы синхронизации жизненного цикла с внешними условиями. 83 РАЗДЕЛ 8. ПРИСПОСОБЛЕНИЕ И УСТОЙЧИВОСТЬ Стресс - это интегральный (лат. integer - цельный, единый) неспецифический ответ растения на повреждающее действие, направленный на выживание организма за счет мобилизации и формирования защитных систем. Способность растения переносить действие неблагоприятных факторов и давать в таких условиях потомство называется устойчивостью или стресс-толерантностью (лат. tolerantia - терпение). Неблагоприятные факторы среды называют стрессорами, а реакцию организма на любые отклонения от нормы – стрессом. По Г. Селье стресс проходит 3 фазы: 1) тревоги; 2) резистентности (адаптации); 3) истощения (ресурсов надежности). Действию стрессорных факторов подвергаются не только дикие, но и культурные растения. Любой экстремальный фактор оказывает отрицательное влияние на рост, накопление биомассы и урожай. Поэтому иногда говорят еще об агрономической устойчивости. Агрономическая устойчивость — способность организмов давать высокий урожай в неблагоприятных условиях. Степень снижения урожая под влиянием стрессорных условий является показателем устойчивости растений к ним. Устойчивость является конечным результатом адаптации. Адаптация (позднелат. аdaptiо - приспособление, прилаживание) это генетически детерминированный процесс формирования защитных систем, обеспечивающих повышение устойчивости и протекание онтогенеза в ранее неблагоприятных для него условиях. Адаптация включает в себя все процессы (анатомические, морфологические, физиологические, поведенческие, популяционные и др.) от самой незначительной реакции организма на изменение внешних или внутренних условий, которая способствует повышению устойчивости, до выживания конкретного вида. Сохранение жизни на Земле является результатом непрерывной адаптации живых существ. Защита от неблагоприятных факторов среды у растений обеспечивается особенностями анатомического строения (кутикула, корка, механические ткани и т.д.), специальными органами защиты (жгучие волоски, колючки), двигательными и физиологическими реакциями, выработкой защитных веществ (смол, фитонцидов, токсинов, защитных белков). Урожайность сельскохозяйственных культур в природных условиях во многом определяется уровнем их устойчивости к действию абиотических и биотических стрессоров, адаптивным потенциалом. Оценка устойчивости растений к экстремальным факторам (холоду, морозу, засухе, жаре, засоленности) важна для селекционной и агрономической практики. Наиболее надежные методы оценки устойчивости растений к экстремальным факторам - прямые полевые и вегетационные методы. Однако большая трудоемкость и продолжительность этих методов вынуждает исследователей применять разнообразные ускоренные лабораторные или лабораторно-полевые методы диагностики устойчивости растений. 84 Зимостойкость. Низкие отрицательные температуры повреждают зимующие растения. Зимостойкость – устойчивость растений к комплексу неблагоприятных факторов перезимовки (выпревание, вымокание, действие ледяной корки и зимняя засуха (у древесных растений и к солнечным ожогам)). Особенно неблагоприятные воздействия испытывают травянистые многолетние и однолетние растения. Так, озимые растения могут погибать от слишком сильного снежного покрова (выпревание растений). Это связано с тем, что под снегом температура несколько повышается (около 0°С) и процесс дыхания идет довольно интенсивно. В результате происходит сильная трата сахаров и растения могут погибнуть от истощения. При образовании в почве льда корни растения разрываются, что приводит к их гибели. В весенний период растения погибают от возврата холодов. Растения, перенесшие в зимний период температуру -30°С, могут погибнуть весной при небольших заморозках. Кроме того, весной в пониженных местах в период таяния снега накапливается вода и растения могут пострадать от вымокания. В этом случае причиной гибели растений служит резкий недостаток кислорода, при этом в клетках растений начинается процесс брожения, что может вызвать прямое отравление организма продуктами брожения, в частности спиртом. Холодостойкость. Устойчивость теплолюбивых растений к низким положительным температурам называется холодостойкостью. Низкие положительные температуры оказывают неблагоприятное воздействие на ход физиологических процессов и формирование урожая теплолюбивых растений. Первичный эффект низких положительных температур связан с повреждением мембран, увеличением их проницаемости. Резко меняются свойства мембран митохондрий и хлоропластов. В связи с эти нарушаются процессы окислительного и фотосинтетического фосфорилирования. Благодаря нарушениям обменных процессов в организме накапливаются вредные промежуточные продукты метаболизма. При продолжительном воздействии низких положительных температур наступает гибель теплолюбивых растений. Морозоустойчивость. Способность растений переносить температуры ниже нуля, т.е. низкие отрицательные температуры, называется морозоустойчивостью. Основное повреждающее влияние на растительный организм оказывает льдообразование (Н.А. Максимов). При этом лед может образоваться как в самой клетке, так и вне клетки. Образование льда внутри клетки происходит при быстром понижении температуры и клетка погибает. При постепенном понижении температуры кристаллы льда образуются в первую очередь в межклетниках. Плазмалемма препятствует проникновению кристаллов льда внутрь клетки. Содержимое клетки находится в переохлажденном состоянии. Образовавшиеся в межклетниках кристаллы льда, оттягивая воду из клетки, вызывают ее обезвоживание и одновременно оказывают на цитоплазму механическое давление. Это приво85 дит к гибели клетки и организма в целом. И.И. Туманов выдел две фазы закаливания: - первая фаза протекает на свету при низких положительных температурах (днем около +10°С, в ночное время немного выше 0°С) и умеренной влажности почвы; - вторая фаза закаливания не требует света и протекает при постепенном нарастании отрицательных температур. Озимые злаки проходят первую фазу закаливания за 6 – 9 дней, древесные – за 30 дней. Вторая фаза длится около двух недель. Жароустойчивость. Это способность растений переносить действие высоких температур, перегрев. По жароустойчивости выделяют 3 группы растений: 1. Жаростойкие – сине-зеленые водоросли и бактерии горячих минеральных источников, переносят температуру до 75 - 100°С. У этих растений повышенный уровень метаболизма, специфические белки. 2. Жаровыносливые – растения пустынь и сухих мест обитания (суккуленты, кактусы), выдерживают температуру до 50 - 65°С. Эти растения имеют повышенную вязкость цитоплазмы и содержат в клетках связанную воду, у них пониженный обмен веществ. 3. Нежаростойкие – мезофитные и водные растения. Мезофиты открытых мест переносят переносят кратковременное действие температур 40 - 47°С, затененных мест - около 40 - 42°С, водные растения – до 38 - 42°С. Наиболее жаровыносливы с/х растения южных широт – сорго, рис, хлопчатник, клещевина и др. Высокая температура губительно действует на организм: повреждаются мембраны и белки, нарушается обмен веществ, накапливаются азотистые соединения и др. ядовитые промежуточные продукты обмена, что приводит к гибели клеток. Засухоустойчивость. Это способность растений переносить длительные засушливые периоды, значительный водный дефицит, обезвоживание клеток, тканей и органов. Засуха – это длительный бездождливый период, сопровождаемый снижением относительной влажности воздуха, влажности почвы и повышением температуры, когда не обеспечиваются нормальные потребности растений в воде. Недостаток воды в тканях растений возникает в результате превышения ее расхода на транспирацию, по сравнению с поступлением из почвы и растения завядают. Различают 2 вида завядания: временное и глубокое. Причина временного завядания – атмосферная засуха, характеризующаяся высокой температурой и низкой относительной влажностью воздуха (10 – 20%), когда при наличии доступной воды в почве эта вода не успевает поступать в растение и компенсировать ее расход, обычна весной. Тургор листьев восстанавливается в вечерние и ночные часы, снижается фотосинтез. Глубокое завядание наступает, когда в почве почти нет доступной для корней воды, что приводит к иссушению и гибели растений (почвенная засуха). Даже утром наблюдается дефицит воды в тканях растения. Снижается активность синтетических ферментов и активность гидролитических ферментов. 86 Наблюдается в середине или в конце лета. По отношению к воде выделяют следующие экологические группы растений: 1) ксерофиты – растения засушливых мест обитания (суккуленты – запасают воду (кактусы, алоэ, очитки и др.), тонколистные ксерофиты – имеют развитые приспособления для добывания воды (полынь, верблюжья колючка и др.), жестколистные ксерофиты – переносят засуху в состоянии анабиоза (ковыль, перекати-поле и др.), эфемеры (ложные ксерофиты) – избегают засуху благодаря короткому жизненному циклу); 2) мезофиты – растения умеренного климата, обитающие в среде со средним уровнем обеспеченности водой. К этой группе принадлежит большинство сельскохозяйственных растений умеренного климата; 3) гигрофиты – растения увлажненных мест обитания – неустойчивы к засухе. Солеустойчивость. Это способность растений переносить засоленность почв. Растения, приспособленные к существованию в условиях избыточного засоления, называют галофитами. Выделяют 3 группы галофитов: 1. Эвгалофиты (солянки). Растения, накапливающие в клетках соли, имеют мясистые стебли и листья (солерос). 2. Криптогалофиты (солевыделяющие). Растения, у которых соли поглощаются корнями, но не накапливаются в клеточном соке. Поглощенные соли выделяются через специальные клетки, находящиеся на всех надземных органах, поэтому их листья обычно покрыты сплошным слоем солей (лох, тамариск). 3. Гликогалофиты. Растения, клетки корня которых малопроницаемы для солей и поэтому они не поступают в растения. Высокая концентрация клеточного сока создается за счет интенсивности фотосинтеза и накопления углеводов. Ежегодно выброс газообразных загрязнителей атмосферы увеличивается, в почве и воде накапливаются химические соединения. В результате многие виды растений исчезают, урожайность сельскохозяйственных культур и их качество резко снижаются. Газочувствительность - это скорость и степень проявления патологических изменений при действии газов. А способность растений поддерживать свою жизнедеятельность в условиях загрязнения атмосферы без снижения функций, а также роста и развития называют газоустойчивостью. Основы газоустойчивости были разработаны Н. А. Красинским в виде теории фотоокисления. Согласно этой теории диоксид азота и другие токсичные газы нарушают фотосинтетическую активность растений. При этом на свету начинаются процессы фотоокисления белков, аминокислот и других веществ, что приводит к их разрушению, а в дальнейшем клетки отмирают. Радиоустойчивость. Различают прямое и косвенное действие радиации на живые организмы. Прямое действие энергии излучения на молекулу переводит ее в возбужденное или ионизированное состояние. Особенно опасны повреждения структуры ДНК: разрывы связей сахар-фосфат, 87 дезаминирование азотистых оснований, образование димеров пиримидиновых оснований. Косвенное действие радиации состоит в повреждениях молекул, мембран, органоидов клеток, вызываемых продуктами радиолиза воды. Заряженная частица излучения, взаимодействуя с молекулой воды, вызывает ее ионизацию. Ионы воды за время жизни 10-15 - 10-10 сек способны образовать химически активные свободные радикалы и пероксиды. Эти сильные окислители за время жизни 10-6 - 10-5 сек могут повредить нуклеиновые кислоты, белки-ферменты, липиды мембран. Первоначальные повреждения усиливаются при накоплении ошибок в процессах репликации ДНК, синтеза РНК и белков. Устойчивость растений к действию радиации определяется следующими факторами: 1. Постоянное присутствие ферментных систем репарации ДНК. Они отыскивают поврежденный участок, разрушают его и восстанавливают целостность молекулы ДНК. 2. Наличие в клетках веществ – радиопротекторов (сульфгидрильные соединения, аскорбиновая кислота, каталаза, пероксидаза, полифенолоксидаза). Они ликвидируют свободные радикалы и пероксиды, возникающие при облучении. 3. Восстановление на уровне организма обеспечивается у растений: а) неоднородностью популяции делящихся клеток меристем, которые содержат клетки на разных фазах митотического цикла с неодинаковой радиоустойчивостью, б) присутствием в апикальных меристемах покоящихся клеток, которые приступают к делению при остановке деления клеток основной меристемы, в) наличием спящих почек, которые после гибели апикальных меристем начинают активно функционировать и восстанавливают повреждение. Устойчивость к болезни – способность растения предотвращать, ограничивать или задерживать ее развитие. Выделяют понятие специфической и неспецифической устойчивости. Неспецифическая, или видовая (по Н.И. Вавилову) устойчивость – неспособность некоторых возбудителей вызывать заражение определенного вида растений (например, свекла не поражается возбудителями головневых заболеваний зерновых культур). Специфическая устойчивость проявляется на уровне сорта по отношению к специализированным возбудителям. Очень важна для сельскохозяйственных растений, т.к. именно специфические патогены обусловливают более 90% потерь от болезней сельскохозяйственных культур. Инфекционные болезни растений вызываются паразитическими грибами, бактериями, вирусами. Наибольшие потери урожая происходят от грибных заболеваний (более 1000 видов грибов-патогенов), несколько меньшие – от бактериальных (150 – 200 видов патогенных бактерий) и вирусных. Разнообразие форм устойчивости растений к насекомым можно свести к четырем основным типам. 88 Антиксеноз (непредпочтение). Растений с этим типом устойчивости насекомые избегают, реже заселяют их и меньше выбирают в качестве кормового объекта или места откладки яиц. Антибиоз (истинная устойчивость). Растения, обладающие этим типом устойчивости, оказывают неблагоприятное воздействие на жизнедеятельность питающихся ими насекомых, формируя разнообразные анатомо-морфологические и биохимические защитные барьеры. Толерантность (выносливость). К этому типу устойчивости относятся растения, способные успешно компенсировать повреждения, менее от них страдающие и меньше снижающие продуктивность. Факторы выносливости – высокая способность к заживлению и регенерации поврежденных органов и т.д. Уход от вредителя (псевдоустойчивость). Растения с измененными сроками развития, вследствие чего период развития уязвимой стадии культуры не совпадает с периодом массовой вредоносности насекомых. Устойчивость к недостатку кислорода. Кислородная недостаточность (гипоксия) возникает при временном или постоянном переувлажнении, при заболачивании почвы, при образовании ледяной корки на озимых посевах и хранении сельскохозяйственной продукции. У растений, корни которых постоянно испытывают недостаток кислорода, в процессе длительной эволюции появились изменения в морфолого-анатомическом строении тканей: разрастание основания стебля, образование дополнительной поверхностной корневой системы и вентиляционных систем межклетников, необходимых для транспорта кислорода из надземной части растения в корни. У некоторых растений для защиты от гипоксии активируется пентозофосфатный и гликолитический пути дыхания. В устойчивых к кислородному дефициту растениях не накапливаются токсичные продукты анаэробного распада. При недостатке кислорода как конечного акцептора электронов приспособительными оказываются процессы так называемого аноксического эндогенного окисления, в ходе которого электроны переносятся на такие вещества как нитраты, двойные связи ненасыщенных соединений (жирные кислоты, каротиноиды). Для повышения устойчивости к гипоксии замачивают семена в растворах хлорхолинхлорида, никотиновой кислоты или сульфата марганца. Полегание причиняет большой ущерб производству зерна. Оно наблюдается при нарушении оптимального соотношения между массой надземной части растения и прочностью нижней части его стебля. Различают стеблевое полегание, при котором происходит перегиб или перелом стебля, и прикорневое, когда узловые корни не удерживают соломину (стебель) в вертикальном положении и она полегает (наклоняется) без перегиба. Полегшие растения поднимаются под влиянием геотропизма и фототропизма, стимулирующих активность интеркалярной меристемы. Однако значительная часть урожая теряется. В полевых условиях полеганию способствуют следующие факторы: 89 избыточное увлажнение почвы и воздуха в дождливые годы и при орошении, загущенные посевы, избыточное азотное питание при недостатке фосфора и калия, сорт, сильный ветер с дождем. Способы предупреждения полегания - это устойчивый сорт, оптимальная технология возделывания, ретарданты. ТЕМА 1: ЗИМОСТОЙКОСТЬ РАСТЕНИЙ Цель: уяснить основные физиологические и биохимические свойства клетки, определяющие устойчивость растений к неблагоприятным факторам среды. Познакомиться с важнейшими видами устойчивости и методами диагностики. Работа 37. Выявление защитного действия сахаров на протоплазму Объект исследования: корнеплоды свеклы. Материалы и оборудование: 0,5 и 1 М растворы сахарозы, поваренная соль, лед колотый или снег. Термометр, нож, пробочные сверла диаметром 6 мм, бритвы, пробирки, микроскопы, предметные и покровные стекла, кисточки, карандаши по стеклу, фильтровальная бумага, лопатка для охладительной смеси, стакан. Вводные пояснения. При воздействии отрицательных температур на растительные ткани в межклетниках образуется лед, который, оттягивая воду из клеток, обезвоживает протоплазму. При определенной степени обезвоживания, индивидуальной для каждого организма, протоплазма коагулирует. Кристаллы льда, образующиеся непосредственно в клетках, оказывают механическое воздействие, в результате нарушается внутренняя структура протоплазмы, резко повышается ее проницаемость, а при длительной экспозиции на морозе наступает отмирание. Скорость отмирания протоплазмы клеток зависит как от температуры и времени экспозиции, так и от водоудерживающей способности самой клетки. Увеличение количества растворимых сахаров в зимующих органах растений повышает водоудерживающую способность тканей. Ход работы. Из поперечного среза столовой свеклы толщиной 0,5 см при помощи пробочного сверла диаметром 5 - 6 мм делают высечки. Тщательно промывают их под водопроводной водой и помещают в три пробирки по три высечки в каждую. В первую пробирку наливают 5 мл дистиллированной воды, во вторую - 0,5 мл 0,5 М раствора сахарозы, в третью — 0,5 мл 1 М раствора сахарозы. Пробирки этикетируют и на 20 мин. погружают в охладительную смесь, состоящую из трех частей льда или снега и одной части поваренной соли. Затем пробирки вынимают из охладительной смеси и 90 размораживают в стакане воды комнатной температуры. После оттаивания пробирки встряхивают. Отмечают различия в интенсивности окрашивания жидкости в пробирках и объясняют их. Из анализируемых высечек готовят тонкие срезы и рассматривают их под микроскопом при малом увеличении в капле раствора, в котором они находились. Подсчитывают общее число клеток в поле зрения и число обесцвеченных клеток, из которых вышел антоциан. Результаты опыта записывают в таблицу 31 по приведенной форме. Таблица 31 - Определение защитного действия сахаров на протоплазму Условия Степень окраски раствора в пробирке (по 5-балльной системе) Вода Сахароза 0,5 М Сахароза 1 М Вывод: Работа 38. Изучение действия сахарозы на белки протоплазмы при отрицательных температурах Объект исследования: клубни картофеля. Материалы и оборудовании: 0,5 М и 1 М растворы сахарозы, снег, поваренная соль; терка, марля, коническая колба, пробирки, пипетки на 5 мл, чашка для охладительной смеси, термометр, стакан. Вводные пояснения. При действии на растение экстремальных температур белки коагулируют. Выпадение хлопьевидного осадка белка из вытяжки растительной ткани - показатель ее повреждения. Сахароза стабилизирует нативную структуру белка, тем самым защищая ее от губительного действия отрицательных температур. Ход работы. Очищенный клубень картофеля натирают на терке. Полученную мезгу через двойной слой марли отжимают в коническую колбу и дают отстояться крахмалу. Надосадочную жидкость наливают в три пробирки по 2,5 мл в каждую. В первую пробирку добавляют 2,5 мл дистиллированной воды, во вторую - 2,5 мл 0,5 М раствора сахарозы, в третью - 2,5 мл 1 М раствора сахарозы. Содержимое в пробирках перемешивают, этикетируют и ставят в охладительную смесь на 20 мин. Оттаивают пробирки в стакане с водопроводной водой: в пробирке с 1 М сахарозой содержимое останется в 91 том же состоянии золя, а в пробирке с дистиллированной водой выпадет хлопьевидный осадок свернувшихся белковых веществ. Сделать вывод о защитном действии сахарозы при замерзании растительных тканей. Вывод: Дата__________________ Подпись преподавателя____________________ ТЕМА 2: СОЛЕУСТОЙЧИВОСТЬ РАСТЕНИЙ Работа 39. Определение солеустойчивости по ростовым процессам Объект исследования: семена овощных культур. Материалы и оборудование: раствор формалина, растворы NаС1 и NаHСO3 различной концентрации, фильтровальная бумага; чашки Петри, марлевые мешочки, термостат, шкаф для проращивания растений, линейки. Вводные пояснения. В условиях избыточной засоленности почвы всхожесть семян и интенсивность роста растений часто снижаются. При определении солеустойчивости растений данным методом показателем устойчивости служит количество проросших семян в растворах соли по сравнению с дистиллированной водой. Ход работы. Подбирают выполненные семена овощных культур одной репродукции. Семена каждого вида и сорта помещают в марлевые мешочки с этикетками внутри и обрабатывают раствором формалина (1 мл на 3000 мл воды) в течение 5 мин. Затем слегка просушивают и раскладывают в чашки Петри. Чашки Петри с фильтровальной бумагой предварительно прогревают в термостате при температуре 150°С. В чашки Петри наливают по 10 мл 0,4; 0,6, 0,8; 1,0 и 1,5%-ного NаС1 (с осмотическим давлением 290, 440, 570, 700 и 1070 кПа и 0,4; 0,6; 0,8 и 1,0%-ного NаНСО3 (240, 340, 440 и 580 кПа), а для контроля - 10 мл дистиллированной воды. Предлагаемые варианты позволяют оценить токсическое и осмотическое действие разных солей, а также видовые и сортовые отличия сельскохозяйственных культур. Для каждого образца берут по две чашки. На дно шкафа для проращивания семян ставят кювету с водой. По окончании проращивания (7 суток) по каждому варианту определяют число проросших семян (среднее из двух повторностей) и среднюю длину корней. Число семян, проросших в дистиллированной воде, принимают за 100%, а проросших в растворах солей вычисляют в процентах от контроля. Менее солеустойчивые растения характеризуются более резкими изменениями в прорастании семян при увеличении засоленности субстрата. Ре92 зультаты опыта записывают в таблицу 32. Таблица 32 - Определение солеустойчивости растений Вариант Количество про- Длина надземной росших семян части Вода NаС1 0,4% NаС1 0,6% NаС1 0,8% NаС1 1,0% NаHСO3 1,5% NаHСO3 0,2% NаHСO3 0,4% NаHСO3 0,6% NаHСO3 0,8% Вывод: Длина корней Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Приспособление и устойчивость» 1. Понятие физиологического стресса, устойчивости, адаптации. Значение работ Н.А. Максимова в изучении устойчивости. 2. Приспособление онтогенеза растений к условиям среды как результат их эволюционного развития. 3. Глубокий и вынужденный покой растений. Физиологические особенности растений, находящихся в состоянии покоя. 4. Холодостойкость. Закаливание растений. 5. Морозоустойчивость растений. Значение работ И.И. Туманова в изучении морозоустойчивости растений. 6. Зимостойкость как устойчивость ко всему комплексу неблагоприятных факторов в осенне-зимний период. 7. Методы определения жизнеспособности озимых и многолетних культур. 8. Засухоустойчивость растений. 9. Солеустойчивость растений. 10. Жароустойчивость растений. 11. Действие на растение загрязнения среды. 12. Полегание посевов, меры предотвращения. 13. Устойчивость растений к действию биотических факторов. Физиологические основы иммунитета. 14. Аллелопатические взаимодействия в ценозе. 15. Почвоутомление. 16. Проблема комплексной устойчивости сортов и гибридов сельскохозяйственных растений к биотическим и абиотическим факторам. 93 РАЗДЕЛ 9. ФИЗИОЛОГИЯ И БИОХИМИЯ ФОРМИРОВАНИЯ КАЧЕСТВА УРОЖАЯ В зависимости от целевого предназначения растительной продукции к ней предъявляется целый ряд стандартных требований, связанных в первую очередь с оценкой химического состава урожая, определением соотношения и технологических свойств различных химических веществ, синтезирующихся и накапливающихся в растениях в процессе их роста и развития. Зерновые злаковые культуры содержат запасные белки и углеводы, структурные и запасные липиды, витамины. Исходя из того, что зерновые культуры являются важными источниками пищевого и кормового белка, при их выращивании первостепенное значение уделяется созданию необходимых условий для накопления запасных белков, содержание и состав которых в первую очередь и будет определять качество зерна. Зернобобовые культуры отличаются от зерновых злаков более высоким содержанием азотистых веществ как в вегетативной массе, так и в семенах. Эти их особенности обусловлены тем, что они способны с помощью симбиотических микроорганизмов фиксировать молекулярный азот атмосферы и использовать его на синтез аминокислот и белков, в связи с чем бобовые культуры не испытывают дефицита азота даже при выращивании на сравнительно бедной почве. Кроме того, зернобобовые культуры обладают более интенсивной системой синтеза запасных белков, в результате чего в их зерне белков в 2 - 3 раза больше, чем у злаковых растений. Наряду с белками ценность зерна зерновых бобовых культур также определяют крахмал, липиды, витамины. Масличные культуры возделывают с целью получения растительных жиров, называемых маслами, которые синтезируются и накапливаются как запасные вещества в семенах. Кроме жиров ценность семян масличных растений также определяется содержанием в них белков, хорошо сбалансированных по аминокислотному составу, и растворимых в жирах витаминов. Исходя из особенностей химического состава семян масличных культур видно, что основное направление их хозяйственного использования получение растительных масел и жмыхов, которые образуются как побочные продукты после экстракции масла и характеризуются высоким содержанием белков (40 - 50 % сухой массы). Из жмыхов после дополнительной экстракции, сушки и измельчения получают высокобелковые шроты, используемые в животноводстве для приготовления комбикормов. У некоторых масличных культур в семенах синтезируются цианогенные гликозиды, алкалоиды, токсичные полифенольные вещества, поэтому при использовании жмыхов, полученных из семян этих растений, для кормления сельскохозяйственных животных необходимо удалять из них вредные токсичные вещества. Характерная особенность корнеплодов - способность накапливать в клетках запасающих тканей большое количество сахаров, которые глав94 ным образом и определяют их хозяйственную ценность. При оценке качества сахарной свеклы кроме сахаров учитывают также содержание небелковых азотистых веществ (вредный азот) и солей калия и натрия, снижающих выход сахара при переработке корнеплодов. Питательная ценность кормовых и столовых корнеплодов зависит также от содержания в них полисахаридов, белков и небелковых азотистых веществ, витаминов. У кормовых трав в отличие от других сельскохозяйственных культур используется вегетативная масса растений - стебли, соцветия, являющиеся источниками многих полезных веществ, определяющих их ценность как кормов или компонентов кормов для животных. Более того, из листьев некоторых травянистых растений (люцерна, клевер) промышленным способом получают биологически полноценные белки, витамины, легкоусвояемые углеводы, липиды и другие биохимические продукты. При использовании вегетативной массы трав на кормовые цели в них учитывается, прежде всего, содержание белков, легкоусвояемых форм углеводов, витаминов, биологически полноценных липидов, клетчатки и минеральных веществ, количество и соотношение которых в растительных тканях сильно варьирует в зависимости от возраста растений, условий выращивания и применяемых удобрений. Хозяйственная ценность картофеля определяется довольно высоким содержанием в его клубнях крахмала, белков, аскорбиновой кислоты и других веществ. На кулинарные свойства картофеля сильное влияние оказывают сахара и небелковые азотистые вещества. В связи с тем, что картофель дает высокий выход полезных веществ с 1 га, эта культура является важным источником возобновляемых природных ресурсов, используемых в качестве сырья для пищевой и биотехнологической промышленности. ТЕМА 1: СОДЕРЖАНИЕ НИТРАТОВ В ПРОДУКЦИИ РАСТЕНИЕВОДСТВА Цель: определить содержание нитратов в продукции растениеводства с помощью колориметрического метода с применением дисульфофеноловой кислоты. Работа 40. Определение нитратов в растительной продукции колориметрическим методом Объект исследования: клубни картофеля, плоды, овощи. Материалы и оборудование: ручной пресс; NaOH или KOH 10%-ный, дисульфофеноловая кислота, образцовый раствор нитрата; фарфоровые чашки, стеклянные палочки, пипетки, мерные колбы; фотоэлектрокалориметр. Вводные пояснения. Нитратов в растениях обычно мало. Эти вещества, как правило, уже в корнях восстанавливаются до аммиака. 95 Количество нитратного азота в тканях растений увеличивается при замедлении процессов редукции нитратов, а также при усиленном нитратном питании. Нитраты полностью извлекаются из растений водой, поэтому для анализа можно использовать водную вытяжку. Учитывая высокую подвижность этой формы азота в растениях, содержание нитратов определяют в свежем растительном материале. Для количественного определения часто используют колориметрический метод с применением дисульфофеноловой кислоты. Метод основан на образовании вследствие реакции нитратов с дисульфофеноловой кислотой нитрофенолов – соединений, дающих в нейтральной или слабощелочной среде характерное зеленовато-желтое окрашивание. Интенсивность окраски пропорциональна количеству нитратов в испытуемом образце. Ход работы. Объем водной вытяжки (соответствующий навеске около 50 мг сухого вещества) помещают в фарфоровую чашку и выпаривают досуха. При малом количестве нитратов навеску растительного материала увеличивают. Если при определении используют водные экстракты, не очищенные от органических веществ, вытяжку предварительно обрабатывают 30%ным раствором Н2О2 до полного их разрушения. Осадок в фарфоровой чашке охлаждают и смачивают из пипетки 1 мл дисульфофеноловой кислоты. Осадок полностью растворяют при помешивании стеклянной палочкой. Через 5 – 10 минут после растворения в чашку приливают 5 – 10 мл воды и нейтрализуют, добавляя по каплям раствор 10%-ной щелочи. Реакцию среды проверяют по лакмусовой бумажке. Раствор из чашки количественно переносят в мерную колбу на 100 мл и колориметрируют на фотоэлектрокалориметре с синим светофильтром. Количество нитратов в используемом растворе определяют по калибровочной кривой, построенной по результатам колориметрирования стандартных растворов с концентрацией нитратного азота от 0,1 до 5 мг на 1 л с различием в концентрациях 0,5 мг на 1 л. Образцовые растворы готовят из перекристаллизованного азотнокислого калия. Для приготовления раствора, содержащего 0,01 мг нитратов в 1 мл, навеску KNO3 0,1631 г растворяют в дистиллированной воде и объем раствора в мерной колбе доводят дистиллированной водой до 1 л. Вывод: Дата__________________ Подпись преподавателя____________________ Вопросы для самоконтроля по разделу «Физиология и биохимия формирования качества урожая» 1. Роль генетических и внешних факторов в направлении и интенсивности синтеза запасных веществ в продуктивных органах растения. 2. Основные физиолого-биохимические процессы, происходящие при 96 формировании урожая зерновых, зернобобовых, масличных, картофеля, корнеплодов, кормовых трав. 3. Влияние природно-климатических факторов, погодных условий и агротехники на качество урожая. 4. Формирование семян. Физиологические основы получения и хранения высококачественного семенного материала. 5. Физиолого-биохимические подходы в разработке приемов получения экологически безопасной продукции. 97 Список литературы Основная литература: 1. Третьяков, Н. Н. Физиология и биохимия сельскохозяйственных растений [Текст] / Н. Н. Третьяков. - М. : Колос, 2005. – 640 с. Дополнительная литература: 1. Кошкин, Е.И. Физиология устойчивости с/х культур [Текст] / Е.И. Кошкин. – М.: Дрофа, 2010. – 638 с. 2. Кузнецов, В.В. Физиология растений [Текст] / В.В. Кузнецов, Г.А. Дмитриева. – Москва, Высшая школа, 2005. – 736 с. 3. Якушкина Н.И. Физиология растений [Текст] / Н.И. Якушкина. – М.: ВЛАДОС, 2005. – 463 с. 98 КРАТКИЙ СЛОВАРЬ ОСНОВНЫХ ТЕРМИНОВ И ПОНЯТИЙ А Адгезия - явление притяжения между молекулами воды и твердой фазой, например, стенками капилляра. Если взаимодействие значительно, говорят о смачивании стенок и наоборот. Активный транспорт - энергозависимый транспорт растворенного вещества через мембрану против градиента концентраций. Аллелопатия - 1) взаимодействие растений, а также прокариот и грибов посредством выделения биологически активных веществ (колинов, фитонцидов, антибиотиков, маразминов); 2) взаимное влияние растений друг на друга через среду путем выделения в нее метаболитов. Иногда под А. понимают только как вредное влияние одних растений на другие, в более широком понимании под А. понимают как отрицательное, так и положительное взаимодействие растений друг с другом путем выделения химических веществ. Амилазы - ферменты класса гидролаз, расщепляющие крахмал до глюкозы. Анаболизм - созидательная часть обмена веществ, совокупность химических процессов в живом организме, направленная на образование и обновление структурных частей клеток и тканей. Антагонизм ионов - явление, когда один ион уменьшает или устраняет действие другого. Апопласт - свободное пространство клетки, состоящее из клеточных стенок и межклетников, по которым осуществляется свободная диффузия веществ. АТФ (аденозинтрифосфорная кислота) - нуклеотид, содержащий азотистое основание - аденин. 5-углеродный сахар - рибозу и три остатка фосфорной кислоты, универсальный переносчик и основной аккумулятор химической энергии в живых клетках, выделяющейся при переносе электронов в электронтранспортной цепи. Синтез АТФ из АДФ и неорганического фосфата сопровождается накоплением энергии, сопряжен с окислительным и фотосинтетическим фосфорилированием, или фосфорилированием на уровне субстрата. Аэропоника - выращивание растений без почвы во влажном воздухе путем периодического опрыскивания корней питательными растворами. Применяется в теплицах, оранжереях, космических кораблях и т.п. Б Биологические мембраны - структуры, ограничивающие клетки и внутриклеточные органоиды. Содержат в своем составе липиды, белки и гетерогенные молекулы (гликопротеины, гликолипиды), кальций, воду - до 30%. Живые, неповрежденные (нативные) мембраны обладают свойством избирательной проницаемости (полупроницаемости), т.е. способны обеспечивать диффузию различных, необходимых дня организма веществ с разной скоростью. БМ делят эукариотическую клетку на несколько автономных 99 отсеков (компартментов), что позволяет пространственно разделить прямые и обратные реакции метаболизма. «Биологичесий нуль» (БН) - температура, при которой прекращается активный рост растений. Понятие БН используется для характеристики холодоустойчивости растений. Для большей части сельскохозяйственных растений БН составляет 4 - 5°С. Разные органы одного растения различаются по значениям БН. Как правило, значения БН для генеративных органов выше, чем для вегетативных. Значения БН для вегетативных органов холодоустойчивых растений (пшеница, ячмень, овес) составляет 4 - 5°С, а для малоустойчивых (просо, кукуруза, соя, фасоль) -11 - 13°С. Биологические ритмы - периодически повторяющиеся изменения интенсивности и характера биологических процессов и явлений. Б.р. присущи всем живым организмам. Биоритмы у растений проявляются, например, в суточном движении листьев, лепестков, устьиц, и в ряде сезонных физиологических процессов (листопад, одревеснение зимующих побегов и т.д.). Брожение анаэробный, ферментативный окислительновосстановительный процесс превращения органических веществ, посредством которого организмы получают энергию, необходимую для жизнедеятельности. Б.- эволюционно более ранняя и энергетически менее выгодная форма извлечения энергии из питательных веществ. К Б. способны животные, растения и микроорганизмы. Б. могут подвергаться спирты, органические кислоты, аминокислоты, азотистые основания, но чаще всего углеводы. В Вакуоль - окруженное мембраной (тонопластом) пространство в цитоплазме, заполненное клеточным соком, содержащим соли, сахара, органические кислоты, танины, белки, пигменты и др. метаболиты. Водный баланс - соотношение между поступлением и расходованием воды растением. Водный дефицит - расходование воды растением превышает поступление воды в растение. Водный обмен - вся совокупность процессов поглощения, усвоения и выделения воды растением. Г Гелиофиты - растения солнечных местообитаний, не выносящие затенения, например, сосна обыкновенная, береза, многие растения степей и пустынь и т. д. Геотропизм (гравитропизм) - способность органов растений принимать определенное положение под влиянием земного притяжения. Г. определяет вертикальное положение осевых органов растения: главного корня - прямо вниз (положительный Г.), главного стебля - прямо вверх (отрицательный Г.). Гербициды - химические средства борьбы с сорняками. Гетерофиллия (разнолистность) - наличие у растений на одном побеге листьев, отличающихся по форме, размерам и структуре. 100 Гигрофиты - наземные растения, произрастающие в условиях повышенной влажности почвы и воздуха Гидатоды (водяные устьица) - комплекс клеток в листе растения, обеспечивающий выделение из растения капелъно-жидкой воды и солей. Г. расположены, чаще всего по краям листьев, на зубчиках, в отличие от устьиц Г. никогда не закрываются. Гидролазы - ферменты, осуществляющие гидролиз сложных органических соединений с участием воды. Гидрофиты - растения, растущие полностью или частично погруженными в воду. Гипоксия - пониженное содержание кислорода в тканях организма, наблюдаемое при недостатке кислорода в среде. Гликолиз - ферментативный анаэробный процесс негидролитического распада углеводов (гл. образом глюкозы) до двух молекул пировиноградной кислоты (ПВК) и двух молекул АТФ. Гомеостаз - свойство живых систем поддерживать постоянство своей внутренней среды, а также основные черты присущей им организации. Д Дефлоранты - вещества, используемые для уничтожения цветков растения с целью предотвращения их плодоношения. Д. относятся к группе гербицидов. Дефолианты - соединения, приводящие к потере растениями листьев (искусственный листопад). Процесс уничтожения листвы с помощью Д. - дефолиация. Д. относятся к группе гербицидов. Дифференцировка - возникновение различий между однородными клетками и тканями, изменения их в ходе развития особи, приводящие к формированию специализированных клеток, органов, тканей. Диффузия - процесс, ведущий к равномерному распределению веществ (молекул) по градиенту химического потенциала. Д. облегченная - Д. растворенного вещества по градиенту концентраций с участием переносчика. Длиннодневные растения (ДДР) - растения, которым для зацветания необходим световой период, превышающий определенное критическое значение. ДДР распространены в основном в умеренных и приполярных широтах, цветут весной или летом. К ДДР относятся хлебные злаки, многие крестоцветные, различные виды клевера, свекла, лен, укроп и др. Ж Жароустойчивость (жаростойкость) - 1) способность растений переносить действие высоких температур. Ж. основана на ряде физиологобиохимических особенностей организмов: высокой вязкости их цитоплазмы, снижении или повышении интенсивности обмена веществ, повышении содержания особых, т.н. белков теплового шока (БТШ) и др. веществ. З Засуха - длительный период (многодневный, многомесячный, многолетний), часто при повышенной температуре воздуха с отсутствием или крайне незначительным количеством атмосферных осадков, что приводит 101 к истощению запасов влаги в почве и резкому снижению относительной влажности воздуха. 3. атмосферная характеризуется низкой относительной влажностью воздуха, 3. почвенная - характеризуется отсутствием доступной для растений воды в почве. Засухоустойчивость - 1) способность растений переносить значительное обезвоживание за счет развития адаптивных морфофизиологических особенностей стебля, листьев, генеративных органов, корневых систем, повышающих их выносливость (толерантность) к действию длительной засухи; 2) способность растений переносить атмосферную и почвенную засуху благодаря наличию морфологических и физиологических механизмов, позволяющих добывать воду и экономно расходовать ее. Зимостойкость - комплексная устойчивость растений против неблагоприятных факторов зимы (морозов, чередующихся с оттепелями; ледяной корки, снеговалов, выпревания и вымокания и т.п.); обеспечивается вхождением в глубокий покой, размещением зимующих почек в защищенных местах, общей физиологической приспособленностью и т.д. Зимостойкость появляется в результате осенней закалки у озимых, сбрасывания листьев, «вызревания» древесины у деревьев. И Изомеразы - класс ферментов, катализирующих внутримолекулярные перестройки, в том числе взаимопревращения изомеров органических соединений. Ингибиторы роста растений - соединения, вызывающие кратковременное торможение роста растений или их переход в состояние покоя. К природным И. р. р. относятся абсцизовая кислота, этилен и некоторые фенольные вещества (кумаровая, коричная, салициловая кислоты), которые в больших количествах накапливаются в почках и семенах осенью в период приостановки процессов роста при переходе растения в состояние покоя. Инсектициды - химические средства борьбы с вредными насекомыми. К Кальвина цикл - цепь биохимических реакций темновой фазы фотосинтеза, в ходе которых СО2 восстанавливается до 3фосфоглицеринового альдегида и регенерируется акцептор СО2 - рибулезо1,5-бисфосфат. Катаболизм (диссимиляция) - совокупность ферментативных реакций в живом организме, направленных на расщепление сложных органических веществ - белков, жиров, углеводов, нуклеиновых кислот, поступающих извне или запасенных в самом организме; противоположная анаболизму сторона обмена веществ. В процессе К. энергия, заключенная в химических связях органических молекул, освобождается и запасается в форме богатых энергией фосфатных связей АТФ. Катаболические процессы клеточное дыхание, гликолиз, брожение - занимают центральное место в обмене веществ. Каталаза - фермент класса оксидоредуктаз, катализирует реакцию разло102 жения токсичного для организма пероксида водорода Н2О2 с образованием воды и кислорода. Когезия - взаимное притяжение молекул одного вещества. Колины - вещества, выделяемые высшими растениями и действующие на высшие растения. Корневое давление - давление в проводящих сосудах корней, обеспечивающее наряду с транспирацией снабжение водой надземных органов. К.д. возникает как следствие активного выделения клетками корня минеральных и органических веществ в сосуды ксилемы. Обратному току жидкости из сосудов под действием К. д. препятствует слой клеток эндодермы с суберинизированными стенками. Результатом высокого К.д. является «плач» растений и гуттация. Короткодневные растения (КДР) - растения, которым для зацветания необходим световой период короче определенной критической величины. КДР распространены в низких широтах (южнее и севернее экватора), обычно цветут осенью. К КДР относятся рис, соя, кукуруза, просо, хризантемы и др. Крахмал - основной резервный углевод растений, состоящий из амилозы линейного полимера, образованного остатками а-D-глюкопиранозы с 1-4связями (около 25%) и амилопектина - разветвленного полисахарида, состоящего из фрагментов амилозы, связанных а-1-6-связями (около 75%). Образуется в хлоропластах и амилопластах и откладывается в клетках в виде крахмальных зерен; накапливается в семенах, клубнях, корневищах, луковицах. Криопротекторы - вещества, способствующие перенесению растениями морозов. К ним относятся полимеры, способные связывать значительные количества воды (гидрофильные белки, моно- и олигосахариды, и др.) Ксероморфизм (ксероморфность) совокупность анатомоморфологических особенностей растений, приспособившихся к недостатку воды. К. выражается в уменьшении размера листьев и клеток, увеличении числа клеток, устьиц и сети жилок, что обусловливает повышение засухоустойчивости, а также в приспособлениях эпидермы к снижению транспирации (толстая кутикула, опушение). У листьев верхних ярусов в связи с затруднением водоснабжения К. выражен в большей степени. Ксерофиты - растения сухих местообитаний, способные благодаря ряду приспособительных признаков и свойств переносить перегрев и обезвоживание. Ксилема - сосудистая ткань растения, основной элемент проводящей системы, по которой передвигается вода и минеральные соли из корней в надземные органы. Культура водная (беспочвенная) - выращивание растений без почвы на водных растворах минеральных веществ. Корневая система растений развивается на твердых субстратах, не имеющих питательного значения (гравий и т.п.). То же, что и гидропоника. 103 Л Лейкопласты - 1) неокрашенные пластиды, обычно являющиеся центром образования крахмала; 2) бесцветные пластиды, различающиеся формой и функциями. В Л. имеются ДНК, рибосомы, а также ферменты, осуществляющие синтез и гидролиз запасных веществ. Л., в которых синтезируется и накапливается запасной (резервный, вторичный) крахмал, называются амилопластами, масла - элайопластами, белки - протеинопластами. Лиазы - класс ферментов, катализирующих реакции негидролитического отщепления от субстратов тех или иных групп атомов без участия воды или фосфорной кислоты, с образованием двойных связей, а также реакции присоединения атомов и групп атомов по двойственным связям, Лигазы (синтетазы) - ферменты, катализирующие синтез сложных органических соединений из более простых. Липазы - ферменты класса гидролаз; катализируют, гидролиз сложноэфирных связей в триацилглицеринах с образованием жирных кислот и глицерина. М Мезофиты - растения, обитающие в условиях с более или менее достаточным, но не избыточным количеством воды в почве; промежуточная группа между ксерофитами и гигрофитами. Мезофилл - основная ткань, или паренхима листа, включая палисадную и губчатую паренхиму. Мембранный потенциал (МП) - разность электрических потенциалов, существующая у живых клеток между их цитоплазмой и внеклеточной жидкостью, МП обусловлен неравномерным распределением ионов водорода, калия, натрия, хлора по обе стороны клеточной мембраны и неодинаковой проницаемостью мембраны дня этих ионов. Внутренняя сторона плазматической мембраны заряжена отрицательно по отношению к внешней стороне. У растений МП составляет в среднем -100 -150 мВ, может достигать - 200 - 250 мВ. Метаболизм - процесс обмена веществ в организме, совокупность процессов ассимиляции и диссимиляции. В более узком смысле М. - промежуточный обмен, охватывающий всю совокупность реакций, главным образом ферментативных, протекающих в клетках и обеспечивающих как расщепление, так и синтез сложных соединений, их взаимопревращения. Микориза (грибокорень) - симбиоз мицелия гриба и корней высшего растения. Различают М. эктотрофную, при которой мицелий гриба оплетает корень, оставаясь на его поверхности (у сосны, ели, лиственницы., березы, осины и др.), и эндотрофную, когда гриб проникает внутрь корня (у ятрышниковых, орхидных, вересковых). У ряда высших растений встречается смешанная - экзоэндотрофная микориза. Н Настии - обратимые движения (изгибы) органов растений в ответ на ненаправленные (диффузно действующие) изменения факторов внешней среды (света, тепла и др.). В зависимости от природы раздражения раз104 личают: термо (тепло)-, фото (свето)-, гидро (водо)-, хемо-, сейсмо (реакция на сотрясение - ветер, дождь)-, никти (реакция на смену дня и ночи)-, тигмо (движение в ответ на прикосновение, трение)- и электронастии. Н.исключительно быстрые тургорные движения, более совершенная форма реакций, чем тропизмы. Некорневая подкормка - опрыскивание листьев растений раствором, содержащим питательные вещества Нейтральные к длине дня растения (НДР) - 1) растения, зацветающие независимо от соотношения светлой и темной части суток. Обычно - это растения-космополиты; 2) растения, у которых инициация цветения происходит независимо от длины дня. Нутации - круговые или колебательные движения органов растений. Н. свойственны цветоносам, листьям, корням и др. органам высших растений, а также спорангиеносцам низших растений. Круговые Н. осуществляются за счет упорядоченных, идущих по кругу местных ускорений роста клеток в зоне растяжения и зависят, по-видимому, от присутствия гиббереллинов и флавоноидов. Колебательные, а также круговые Н. прекративших рост листьев или прилистников происходят в результате изменения тургора в клетках листовых сочленений. О Обмен веществ - метаболизм - совокупность протекающих в живых организмах химических превращений, обеспечивающих их рост, жизнедеятельность, воспроизведение, постоянный контакт и обмен с окружающей средой. Оксидоредуктазы - ферменты, катализирующие многочисленные окислительно-восстановительные реакции. Органогенез - формирование и развитие основных органов (корня, стебля, листьев, цветков) в процессе онтогенеза из меристемы. Осмос - диффузия молекул воды (или др. растворителя) через полупроницаемую мембрану из области с большим водным потенциалом в область с меньшим, т.е. по градиенту водного потенциала П Партенокарпия - образование на растении плодов без оплодотворения. Различают автономную П., когда плоды развиваются без опыления, и стимулятивную П., когда для образования плода требуется раздражение рыльца пестика пыльцой. Пассивный транспорт - движение веществ по физико-химическим градиентам без затраты клеткой метаболической энергии (путем простой или облегченной диффузии). Пестициды - химические средства борьбы с вредителями или болезнями растений (гербициды, фунгициды, инсектициды, акарициды). Плазмалемма - наружная клеточная мембрана, отделяющая протопласт от клеточной стенки. Плазмодесмы - цитоплазматические тяжи, соединяющие протопласты соседних растительных клеток. 105 Покой (состояние покоя) - резкое снижение скорости роста, интенсивности обмена веществ и развития растений, связанное с наступлением или угрозой возникновения неблагоприятных условий и направленное на переживание этих неблагоприятных условий. В состоянии П. у них повышается способность переносить засуху, высокие и низкие температуры. Органический покой семян - задержка прорастания, вызванная свойствами зародыша или тканей, его окружающих: эндосперма, семенной кожуры, а также околоплодника или его частей. Полярность - физиологическая неравноценность противоположных полюсов (верхушка - основание) клетки, органа и целого растения. Раздражимость - способность живых клеток или целого организма реагировать на внешние или внутренние воздействия - раздражители, лежит в основе их приспособления к изменяющимся условиям среды. Р. у растений обусловлена структурными и функциональными изменениями мембран и лежит в основе их регуляторной системы. Наиболее ярко она проявляется в реакциях на свет, гравитационное поле (гео- или гравитропизм), в двигательных реакциях (настии). Растения С3-типа усвоения СО2 - растения, у которых первичным акцептором СО2 является 5-углеродный сахар рибулезо-1,5-бисфосфат, а самым первым продуктом после включения СО2 является 3-углеродное соединение (С3) - фосфорглицериновая кислота. Растения С4-типа усвоения СО2 - растения, у которых первичным акцептором СО2 является 3-углеродное соединение фосфоенолпировиноградная кислота (ФЕП), а первичным продуктом после включения СО2 является 4углеродное соединение (С4 ) - оксалоацетат и др. Регенерация - развитие на размножаемом растительном материале недостающих элементов, в результате чего формируется целое нормальное растение. Ретарданты - синтетические вещества разной химической природы из группы ингибиторов роста растений, которые подавляют рост стеблей и побегов и придают растениям устойчивость к полеганию (хлорхолинхлорид (ССС), кампозан (2-хлорэтилфосфоновая кислота), гидрел и др.). Реутилизация - повторное использование растениями из стареющих и отмирающих листьев и стеблей низкомолекулярных органических соединений и элементов минерального питания, которые перемещаются по ситовидным трубкам флоэмы к молодым растущим органам. Ризосфера - слой почвы (2 - 3 мм), непосредственно примыкающий к корню растения и характеризующийся повышенным содержанием микроорганизмов. Состав микрофлоры Р. зависит главным образом от типа почвы, вида и возраста растений. С Сейсмонастии - быстрые движения органа растения, вызванные легким сотрясением или ударом. Особенно хорошо С. выражены у листьев мимозы и некоторых др. бобовых, у тычинок василька, барбариса. Симпласт - совокупность взаимосвязанных протопластов и их плазмо106 десм. Синергизм (синергия) - комбинированное воздействие двух или более факторов (химических или химических и физических); характеризуется тем, что их совместное действие превышает эффект каждого из компонентов в отдельности или их простой суммы. Скарификация - механическое поверхностное повреждение твердых оболочек семян для ускорения их прорастания, получения дружных и полноценных всходов. Стратификация семян - создание определенного индивидуального сочетания основных факторов прорастания (температура, влажность, свет, аэрация), при котором в семенах, находящихся в состоянии глубокого покоя происходят биохимические и морфофизиологические изменения. С.с. один из приемов предпосевной подготовки семян для ускорения прорастания. С.с. применяют главным образом для трудно прорастающих семян плодовых, лесных, декоративных и некоторых лекарственных растений. Семена переслаивают влажным песком, опилками, торфяной крошкой, мхом и выдерживают при 3...5°С и свободном доступе воздуха. Снегование - С.с. в снегу. Т Теневыносливые растения - растения, выносящие некоторое затенение, но хорошо развивающиеся и на прямом солнечном свету. Листья Т. р. со слабодифференцированной столбчатой и губчатой паренхимой, клетки с небольшим числом хлоропластов и относительно невысокой интенсивностью фотосинтеза. Световой компенсационный пункт Т. р. составляет около 0,5 - 3 от полного дневного освещения. К Т.р. относятся ель, пихта, кислица и др. многие травянистые растения лесов. Термотропизм - реакция растений на периодическую смену повышенных и пониженных температур, выражающаяся в изменении процессов роста и развития. Различают суточный и годичный Т. Тигмотропизм - ростовые изгибы растений в ответ на раздражение прикосновением или трением. Тонопласт - вакуолярная мембрана, ограничивающая вакуоль растительной клетки; обладает избирательной проницаемостью, способна к активному транспорту веществ. Тотипотентность - свойство тканей или клеток дифференцироваться в любую структуру зрелого организма. Т. обладают оплодотворенные яйцеклетки растений. Т. соматических клеток реализуется в культуре тканей растений. При этом индукторами начала развития обычно служат фитогормоны (ауксины, цитокинины). Трансферазы - ферменты, осуществляющие перенос отдельных радикалов, частей молекул или целых молекул от одних соединений на другие. Тропизмы - изгибы, ростовые движения, вызываемые односторонне действующим раздражителем, от которого зависит их направление; различают фото-, гео-(грави)-, хемо-, тигмо-, термо-, электротропизмы. 107 У Урожай - 1) суммарная масса всех органов растения, 2) У. биологический (общая продуктивность) - общее количество биомассы, произведенное фитоценозом (агроценозом) в целом за определенное время, включая потери (отмершие корни, опад, сброс цветков и т.д.). 3) У. хозяйственный - полезная продукция, получаемая в результате культивирования сельскохозяйственных растений, составляет долю У. биологического. 4) У. хозяйственный - количество полезной продукции, полученной с определенной площади фитоценоза (агроценоза) за единицу времени. Устойчивость (резистентность) - способность растений противостоять воздействию экстремальных факторов среды (почвенная и атмосферная засуха, засоление почвы, низкие температуры, фитопатогены, ксенобиотики и т.д.); 2)способность организма сохранять без изменения определенный показатель при увеличении дозы действующего, агента (фактора среды). Устьице - специализированное образование эпидермы растений листьев и молодых стеблей, состоящее из двух замыкающих клеток и межклетника (устьичной щели) между ними. Выполняет функции газо- и водообмена, связывая внутренние ткани растений с окружающей средой. Ширина устьичной щели регулируется замыкающими клетками. Устьичные движения (У.д.) - изменение степени открытости устьичной щели. Различают гидропассивные, гидроактивные и фотоактивные У.д. гидропассивные У.д. движение вследствие сдавливания замыкающих клеток соседними клетками эпидермы при очень высокой насыщенности эпидермальных клеток водой, например, во время продолжительных дождей. Гидроактивные У.д. закрывание устьиц в жаркое время в результате возникновения в листьях недостатка водного насыщения. Фотоактивные У.д. - открывание устьиц при переходе от темноты к свету; происходит благодаря усиленному поглощению воды замыкающими клетками, в которых на свету повышается концентрация сахаров и других осмотически активных веществ. Движения устьиц к синему свету чувствительнее в 200 раз, чем к красному, ультрафиолет не действует на открывание устьиц. Ф Фенологическая фаза (фенофаза) - этап в годичном цикле развития растения в целом или его отдельных органов, который характеризуется четко выраженными внешними морфологическими изменениями, например, появление всходов, распускание семядолей, набухание и распускание почек, появление первых листков, начало и окончание роста побегов, цветение и созревание плодов, расцвечивание и опадение листьев и др. Ферменты (энзимы) - специфические белки, присутствующие во всех живых клетках и играющие роль биологических катализаторов. Через их посредство реализуется генетическая информация и осуществляются все процессы обмена веществ и энергии в живых организмах. Физиологически сухие почвы - почвы с высоким содержанием влаги, которая недоступна растениям. К Ф.с.п. обычно относят засоленные почвы, а также холодные переувлажненные почвы тундры. 108 Фитохром - пигмент растений с сине-зеленой окраской из группы сложных белков-хромопротеинов. В основе функций Ф. лежит взаимопревращение двух его форм, поглощающих в красной (Ф660) и дальней красной (Ф730) областях. Под действием красного света неактивная форма Ф660 превращается в активную форму Ф730; обратный переход совершается в темноте или под действием света дальней красной области. Ф. участвует во многих физиологических процессах у растений - в фоторегуляции прорастания семян, цветения и др., контролирует синтез биополимеров, некоторых фотосинтетических пигментов и др. Фитоценоз - конкретное растительное сообщество на определенной территории, характеризуется своим составом, структурой и взаимодействием растений как между собой, так и с условиями местообитания, Флоэма - ткань растений, осуществляющая транспорт продуктов фотосинтеза от листьев к местам потребления и отложения в запас (подземным органам, точкам роста, зреющим плодам и семенам и т.д.), а также регуляторных соединений (гормонов). Ф. состоит из ситовидных трубок, клеток-спутниц, паренхимы, механических волокон. Фосфорилирование - включение в молекулу остатка фосфорной кислоты. Первостепенное значение в энергетике живой клетки имеет Ф. АДФ с образованием АТФ, осуществляемое мультиферментными системами за счет окисления низкомолекулярных соединений кислородом в дыхательной цепи (окислительное Ф.) или в анаэробных условиях (гликолитическое Ф.). У фотосинтезирующих организмов Ф. АДФ с образованием АТФ может также происходить при фотосинтезе (фотосинтетическое Ф). Фотодыхание (световое дыхание) - совокупность процессов, происходящих в растительных клетках под действием света, в результате которых поглощается кислород и выделяется углекислый газ. Фотонастии - движения органов растения, вызываемые изменением интенсивности света. Фотопериодизм - реакция растений на суточный ритм освещения, т.е. на соотношение длины дня и ночи (фотопериоды), выражающаяся в изменении процессов роста и развития, в том числе их зацветание служит реакцией проявления Ф. Фотосинтетически активная радиация (ФАР) - часть интегральной солнечной радиации, используемая в фотосинтезе (380 - 780 нм), КПД ФАР - величина, характеризующая долю ФАР, связываемой в виде чистой первичной продукции. В аграрных фитоценозах средних широт КПД использования ФАР составляет от 0,5 до 2% ФАР. Фототропизм - ростовые изгибы органов растений под влиянием одностороннего освещения. Стебли обычно обнаруживают положительный, корни некоторых растений - отрицательный, листья - поперечный Ф. Фунгициды - химические препараты для защиты растений от болезней, вызываемых фитопатоненными грибами; одна из групп пестицидов. X Хемонастии - движения органа растения в ответ на действие химического 109 раздражителя. Например, ростовые изгибы железистых волосков росянки под влиянием азот- и фосфорсодержащих веществ, тургорные движения замыкающих клеток устьиц в ответ на изменение концентрации СО2 и др. Хемотропизм - ростовая двигательная реакция органов растений (изгибание) на градиент каких-либо химических веществ, а также на градиент влажности (гидротропизм), кислорода (аэротропизм). Отчетливо проявляется у корней, пыльцевых трубок, гифов грибов. Хозяйственно-ценный урожай (хозяйственный урожай, продуктивность) - используемая человеком часть биологического урожая. Ц Циторриз - стягивание стенок клетки ее содержимым, уменьшающимся в объеме в результате потери воды; наблюдается при увядании клеток или при погружении их в гипертонический раствор, если протоплазма не отстает от стенок и не наступает плазмолиз. Ч Чистая продуктивность фотосинтеза (нетто-фотосинтез) - прирост сухой биомассы за определенный промежуток времени (сутки), отнесенный к единице листовой площади (м2). Э Электронтранспортная цепь (ЭТЦ) - структурно организованная в мембране цепь окислительно-восстановительных компонентов - переносчиков электронов. Большинство из них содержат металл (Fе, Сu), входящий в простетическую группу. Дыхательная ЭТЦ структурно организована во внутренней складчатой мембране митохондрий, включает четыре основных комплекса, осуществляющих реакции переноса электронов от электроотрицательных к электроположительным компонентам цепи (-0,32 В … +0,8 В). При функционировании митохондриальной ЭТЦ протоннный насос перекачивает протоны из внутреннего пространства (матрикса) в наружную камеру (межмембранное пространство). В результате на мембранах создается градиент электрохимического потенциала (н +) за счет которого осуществляется синтез АТФ из АДФ и Фн в активном центре АТФсинтетазного комплекса. Таким образом, энергия, освобождаемая в результате индуцированного потока электронов в ЭТЦ, может быть использована для синтеза АТФ в процессе фотосинтетического (в хлоропластах) и окислительного (в митохондриях) фосфорилирования. Ю Ювенильность - у растений возрастное состояние в период от появления проростка до начала цветения, в котором растения способны к усиленному образованию и росту вегетативных органов, но не генеративному развитию. Я Яровизация - индукция или стимуляция цветения при воздействии пониженных температур, т.е. температур ниже оптимальных для роста. Как правило, непосредственно во время действия яровизирующих температур не наблюдается заложения зачатков цветков. 110 СОДЕРЖАНИЕ Предисловие Раздел 1. Физиология и биохимия растительной клетки Работа 1. Влияние катионов и анионов солей на форму и время плазмолиза Работа 2. Определение жизнеспособности семян по окрашиванию цитоплазмы Работа 3. Диагностика повреждения растительной ткани по увеличению проницаемости клеточных мембран Работа 4. Получение глобулина и изучение его свойств Работа 5. Получение растворов моно-, ди- и полисахаридов и изучение их свойств Работа 6. Изучение свойств растительных масел Работа 7. Определение осмотического давления клеточного сока методом плазмолиза Работа 8. Определение концентрации клеточного сока и осмотического давления рефрактометрическим методом Работа 9. Определение водного потенциала листьев методом Шардакова Раздел 2. Водный обмен растений Работа 10. Влияние внешних условий на процесс гуттации Работа 11. Сравнение транспирации верхней и нижней сторон листа хлоркобальтовым методом (по Шталю) Работа 12. Определение состояния устьиц методом инфильтрации (по Молишу) Работа 13. Определение интенсивности транспирации и относительной транспирации при помощи технических весов Работа 14. Определение интенсивности транспирации у срезанных листьев при помощи торзионных весов по Л.А. Иванову Работа 15. Определение водоудерживающей способности растений методом «завядания» по А. Арланду Раздел 3. Фотосинтез Работа 16. Изучение химических свойств пигментов листа Работа 17. Наблюдение оптических свойств пигментов Работа 18. Фотосенсибилизирующее действие хлорофилла на реакцию переноса водорода по Гуревичу Работа 19. Количественное определение пигментов Работа 20. Определение площади листьев Раздел 4. Дыхание растений Работа 21. Определение интенсивности дыхания семян в закрытом сосуде Работа 22. Определение дыхательного коэффициента прорастающих семян Работа 23. Обнаружение фермента дегидрогеназы в семенах гороха Работа 24. Обнаружение пероксидазы в соке клубня картофеля 3 5 6 8 9 10 12 15 16 18 19 21 23 24 25 26 28 29 31 34 36 37 39 41 44 45 46 49 50 Работа 25. Определение активности каталазы в листьях Раздел 5. Минеральное питание растений Работа 26. Микрохимический анализ золы растений Работа 27. Изучение взаимодействия ионов в ходе прорастания семян Работа 28. Изучение влияния элементов питания на рост растений Работа 29. Диагностика элементов минерального питания с помощью прибора ОП-2 Раздел 6. Обмен и транспорт веществ в растении Работа 30. Образование диастазы при прорастании крахмалистых семян Работа 31. Определение активности липазы Раздел 7. Рост и развитие растений Работа 32. Наблюдение периодичности роста побега Работа 33. Наблюдение ярусной изменчивости морфологических признаков Работа 34. Определение силы роста семян методом морфофизиологической оценки проростов Работа 35. Изучение влияния индолилуксусной кислоты на укоренение черенков фасоли Работа 36. Изучение действия гибберелловой кислоты на рост междоузлий стебля карликового гороха Раздел 8. Приспособление и устойчивость Работа 37. Выявление защитного действия сахаров на протоплазму Работа 38. Изучение действия сахарозы на белки протоплазмы при отрицательных температурах Работа 39. Определение солеустойчивости по ростовым процессам Раздел 9. Физиология и биохимия формирования качества урожая Работа 40. Определение нитратов в растительной продукции колориметрическим методом Список литературы Краткий словарь основных терминов и понятий 2 51 53 55 56 58 60 64 66 66 68 76 77 79 81 81 84 90 91 92 94 95 98 99