ϕ ϕ ϕ ϕ ϕ ϕ
реклама

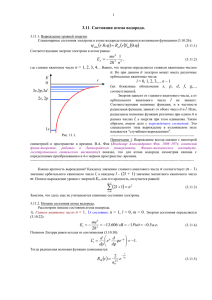
Лекция 6. Атомные орбитали. 6.1. Классификация атомных орбиталей. Таким образом, полная волновая функция водородоподобного атома определена и зависит от трех квантовых чисел: n, l, m. Целочисленные значения и их взаимосвязь обусловлены требованиями конечности и непрерывности волновой функции. Важно, что появление дискретных квантовых чисел автоматически следует из математических условий, налагаемых на волновую функцию, т.е. квантование физических величин естественным образом отражается в математическом аппарате квантовой механики. Волновую функцию, соответствующую определенному набору квантовых чисел n, l, m называют атомной орбиталью (АО). Каждая АО соответствует определенному электронному состоянию атома водорода. Классификацию АО проводят с помощью квантовых чисел n и l. Причем, как будет показано ниже, число n, называемое главным квантовым числом, определяет уровень энергии орбиталей. Эти уровни нумеруются в соответствии со значением n: первый уровень, второй и т.д. Обозначение орбиталей проводят в соответствии со значением квантового числа l, называемого орбитальным квантовым числом, по следующим правилам: l Обозначение 0 s 1 p 2 d 3 f 4 g 5 h Относительная ориентация орбитали в пространстве задается третьим квантовым числом m, называемым магнитным квантовым числом. Здесь следует сделать некоторое отступление. Из выражения для Φ(ϕ) очевидно, что волновые функции с ненулевым магнитным квантовым числом являются комплексными. Между тем, значительно удобнее работать с действительными функциями. Сферические гармоники Yl,m(θ, ϕ) и Yl,-m(θ, ϕ) отвечают вырожденному состоянию, поэтому можно воспользоваться свойством, согласно которому их линейная комбинация также является решением уравнения Шредингера с тем же собственным значением: Ylm′ = 1 (Yl ,m + Yl ,− m ) ; 2 Ylm′′ = 1 (Yl ,m − Yl ,− m ). 2 Коэффициенты выводятся из условия нормировки. Кроме того, примем во внимание формулу Эйлера для комплексных чисел: exp(imϕ ) − exp(−imϕ ) = sin mϕ ; 2i exp(imϕ ) + exp(−imϕ ) = cos mϕ . 2 2 Тогда вместо комплексных функций получим два действительных решения ⎧cos | m | ϕ Ylm (θ ,ϕ ) = Θ lm (θ )⎨ , ⎩sin | m | ϕ где l = 0, 1, 2, …, n – 1; m = 0, 1, 2, …. Для удобства условимся, что отрицательным значениям m соответствует функция синуса, а положительным – косинуса. Тогда, используемая нами в качестве примера волновая функция с n = 3, l = 2, m = ±1 превращается в две, соответствующие орбиталям 3dxz и 3dyz: 2 ⎛Z⎞ ⎜⎜ ⎟⎟ Ψ3, 2,1 (r ,θ ,ϕ ) = 81 π ⎝ a0 ⎠ 7/2 2 ⎛Z⎞ ⎜⎜ ⎟⎟ Ψ3, 2, −1 (r ,θ ,ϕ ) = 81 π ⎝ a0 ⎠ ⋅r2 ⋅e − 7/2 ⋅r2 ⋅e Zr 3 a0 − Zr 3 a0 ⋅ sin θ ⋅ cosθ ⋅ cos ϕ . ⋅ sin θ ⋅ cosθ ⋅ sin ϕ . Компактная форма представления атомной орбитали достигается при комбинировании декартовой и полярной систем координат. Учитывая приведенные выше формулы пересчета, нетрудно получить Ψ3,2,1 = N⋅x⋅z⋅exp(-Zr/3a0) = Ψ3d XZ , Ψ3,2,-1 = N⋅y⋅z⋅exp(-Zr/3a0) = Ψ3dYZ , N – нормировочный множитель. Вид волновых функций объясняет причину принятых обозначений соответствующих атомных орбиталей. 6.2. Пространственная структура атомных орбиталей. Что же представляет собой атомная орбиталь, как она выглядит? К сожалению, волновая функция зависит от трех переменных и ее изображение возможно лишь в четырехмерном пространстве. Поэтому рассмотрим некоторые проекции. 1. Важную информацию дает график зависимости радиальной части волновой функции от r. Для сферически симметричных s-орбиталей, угловые функции которых являются константой, данный график представляет собой характер изменения волновой функции при удалении от ядра. Изменение знака R(r) соответствует изменению знака волновой функции. Точки, в которых радиальная часть обращается в нуль, называются узловыми точками или узлами. Число узлов радиальной части равно n – l – 1. 3 0,5 0,8 0,4 0,6 1S 0,3 0,4 R R 3S 0,2 0,2 2P 3P 0,1 0,0 3D 0,0 2S -0,1 -0,2 0 5 10 15 20 25 0 5 r/a0 10 15 20 25 r/a0 2. Вероятность нахождения электрона в пространстве между значениями r и r + dr равна: π 2π ∫ ∫ | Ψnlm (r ,θ ,ϕ ) | 2 r 2 sin θ ⋅ dr ⋅ dθ ⋅ dϕ = [ Rnl (r )]2 r 2 dr × 0 0 π 2π × ∫ ∫ [Ylm (θ ,ϕ )]2 sin θ ⋅ dθ ⋅ dϕ = [ Rnl (r )]2 r 2 dr = Pnl (r )dr. 0 0 0,5 1S 0,4 P 0,3 2P 0,2 2S 0,1 0,0 0 5 10 15 20 25 20 25 0,12 0,10 3D P 0,08 3S 3P 0,06 0,04 0,02 0,00 0 5 10 15 r/a0 Функцию Pnl(r) называют радиальной функцией распределения. Эта функция обращается в нуль в узловых точках. Из рисунков видно, что наибольшая вероятность нахождения электрона на 1S-орбитали в точности соответствует боровскому радиусу a0. Для орбиталей с n = 2 наибольшая вероятность соответствует ~4 – 5 боровским радиусам и ~8 – 14 – для орбиталей с n = 3. Вместе с тем, существует конечная вероятность того, что электроны 2S и 3S (а также с еще большими значениями n) находятся в непосредственной близости от ядра, r < a0. Из сравнения двух графиков видно изменение наиболее вероятного рас- 4 стояния электрона от ядра для орбиталей с различными значениями главного и орбитального квантовых чисел. 3. Вероятность нахождения электрона в какой-либо точке пространства определяется не только значением r, но также величинами углов θ и ϕ, т.е. зависит как от радиальной, так и от угловой частей атомной орбитали. Графически сферические гармоники строят, соединяя в пространстве все точки, в которых Ylm имеет одно и тоже числовое значение. В результате получаются хорошо известные фигуры: шар для S-орбиталей, объемные вытянутые восьмерки (объемные косинусоиды) для P-орбиталей и т.д. Поскольку полная волновая функция является произведением радиальной и угловой частей, то графическое изображение Ψ комбинирует их особенности. Угловая часть задает распределение и знак волновой функции в пространстве, а радиальная часть определяет амплитуду волновой функции и изменение знака Ψ в соответствии с рассмотренными выше графиками. Так, волновая функция 3S-орбитали шарообразна, однако следует иметь в виду, что при удалении от ядра Ψ дважды меняет знак на противоположный. Угловая часть волновой функции 3P-орбитали имеет положительный знак в области положительных значений x и отрицательный – в области –x. Однако, учитывая, что радиальная функция имеет узловую точку в области ~5 боровских радиусов, определяем, что Ψ положительна при 0 < r < 5a0 и ∞ < r < -5a0. Наконец, радиальные части 3D-орбиталей не имеют узлов, поэтому и форма, и знак Ψ задается угловой частью, а радиальная определяет амплитуду волны. 5 8 8 2S 6 2Pz 0,00 6 -0,02 -0,02 2 -0,04 0,02 0,04 0,06 -0,02 0,00 0,10 0,12 0,08 0,06 0,04 0,02 -2 -0,06 -0,04 Z -0,02 -0,02 2 0,00 0 -0,02 -0,02 -0,02 Z 0,02 4 4 0 -0,02 -0,02 0,04 0,06 -2 0,00 -0,04 0,04 0,02 -0,02 -0,02 -4 -4 0,02 -0,02 -0,02 -6 0,06 0,04 -0,020,02 -0,04 0,02 -0,02 -0,02 0,04 -0,06 -0,02 0,00 0,02 0,00 -6 0,00 -8 -8 -8 -6 -4 -2 0 2 4 6 -8 8 -6 -4 -2 0 2 4 6 8 X X Лучшим способом представления полной волновой функции являются пространственные контурные карты Ψ и Ψ2 от двух переменных (при одной фиксированной). Линии на графиках соединяют точки пространства, в которых волновая функция орбитали имеет одно и то же значение. 20 -0,005 -0,005 0,004 20 3Px 0,008 -0,010 0,024 0,028 -0,010 0,000 0,000 -0,005 0,005 0,004 0,010 0,012 0,020 -0,004 -0,005 0,000 -0,012 0,008 -0,008 -0,016 0,030 0,015 0,020 0,025 0,010 0,005 -0,005 -0,010 -0,015 -0,030 -0,025 0,000 -0,020 0,005 0,000 0,000 -0,010 -0,005 0,005 0,005 -10 0,010 0,010 0,000 -0,004 0,012 0,016 0,028 -0,008 -0,012 0,024 -0,016 0,004 -0,008 0,0000,000 -0,020 -0,016 -0,020 -0,016 -0,008 -0,004 -0,008 0,012 0,024 -0,012 0,004 0,028 -0,012 0,020 -0,004 0,016 0,008 -0,004 0,008 0,004 0,016 0,000 0,000 0,020 0,020 0,028 0,012 0,024 0,016 0,004 0,004 0,012 0,008 0 -0,004 -0,008 0,010 -10 0,020 0,008 0,000 0,004 0,016 -0,010 Y -0,005 Z 0,016 0,020 10 10 0 3Dz2 0,004 0,008 0,012 0,005 0,008 0,005 -20 -20 0,004 -10 0 X 10 -10 0 Z 10