УДК 669.168 СОВМЕСТНОЕ ВОССТАНОВЛЕНИЕ КАДМИЯ И
реклама
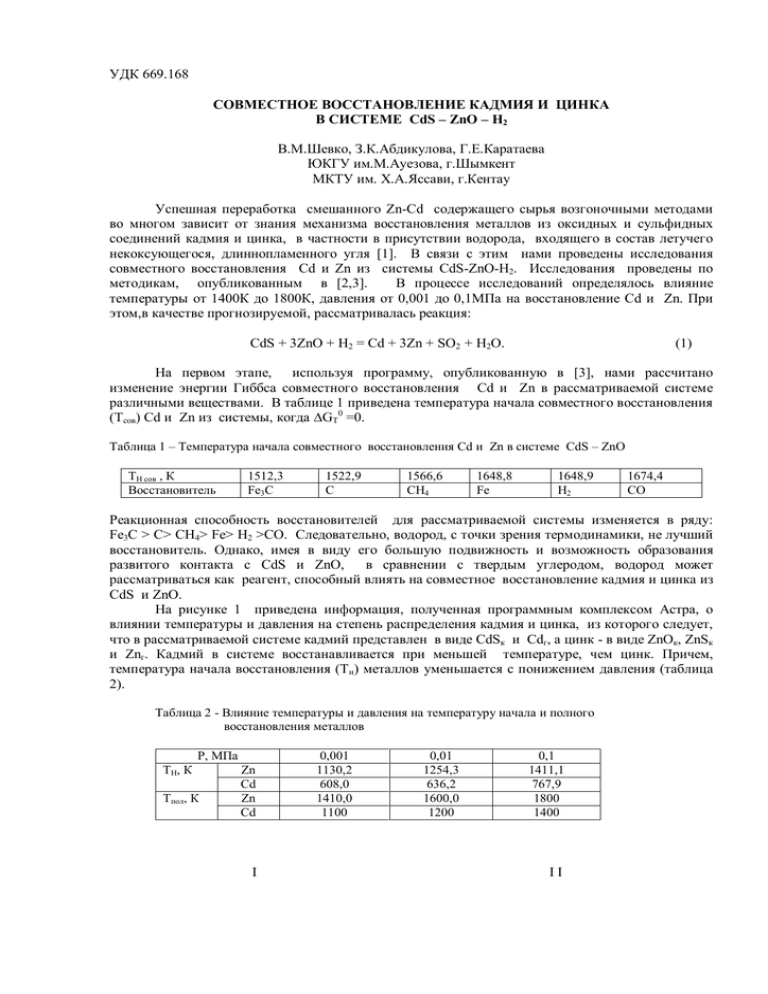
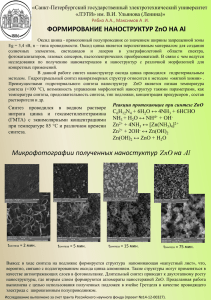
УДК 669.168 СОВМЕСТНОЕ ВОССТАНОВЛЕНИЕ КАДМИЯ И ЦИНКА В СИСТЕМЕ CdS – ZnO – H2 В.М.Шевко, З.К.Абдикулова, Г.Е.Каратаева ЮКГУ им.М.Ауезова, г.Шымкент МКТУ им. Х.А.Яссави, г.Кентау Успешная переработка смешанного Zn-Cd содержащего сырья возгоночными методами во многом зависит от знания механизма восстановления металлов из оксидных и сульфидных соединений кадмия и цинка, в частности в присутствии водорода, входящего в состав летучего некоксующегося, длиннопламенного угля [1]. В связи с этим нами проведены исследования совместного восстановления Cd и Zn из системы CdS-ZnO-H2. Исследования проведены по методикам, опубликованным в [2,3]. В процессе исследований определялось влияние температуры от 1400К до 1800К, давления от 0,001 до 0,1МПа на восстановление Cd и Zn. При этом,в качестве прогнозируемой, рассматривалась реакция: CdS + 3ZnO + H2 = Cd + 3Zn + SO2 + H2O. (1) На первом этапе, используя программу, опубликованную в [3], нами рассчитано изменение энергии Гиббса совместного восстановления Cd и Zn в рассматриваемой системе различными веществами. В таблице 1 приведена температура начала совместного восстановления (Тсов) Cd и Zn из системы, когда ∆GT0 =0. Таблица 1 – Температура начала совместного восстановления Cd и Zn в системе CdS – ZnO ТН сов , К Восстановитель 1512,3 Fe3C 1522,9 C 1566,6 CH4 1648,8 Fe 1648,9 H2 1674,4 CO Реакционная способность восстановителей для рассматриваемой системы изменяется в ряду: Fe3C > C> CH4> Fe> H2 >CO. Следовательно, водород, с точки зрения термодинамики, не лучший восстановитель. Однако, имея в виду его большую подвижность и возможность образования развитого контакта с CdS и ZnO, в сравнении с твердым углеродом, водород может рассматриваться как реагент, способный влиять на совместное восстановление кадмия и цинка из CdS и ZnO. На рисунке 1 приведена информация, полученная программным комплексом Астра, о влиянии температуры и давления на степень распределения кадмия и цинка, из которого следует, что в рассматриваемой системе кадмий представлен в виде CdSк и Cdг, а цинк - в виде ZnOк, ZnSк и Znг. Кадмий в системе восстанавливается при меньшей температуре, чем цинк. Причем, температура начала восстановления (Тн) металлов уменьшается с понижением давления (таблица 2). Таблица 2 - Влияние температуры и давления на температуру начала и полного восстановления металлов Р, МПа ТН, К Тпол, К Zn Cd Zn Cd I 0,001 1130,2 608,0 1410,0 1100 0,01 1254,3 636,2 1600,0 1200 0,1 1411,1 767,9 1800 1400 II 100 80 Cd ZnO 100 CdS Zn 80 а,% а,% 60 ZnS 40 20 0 600 Cd ZnO Zn CdS 60 ZnS 40 20 800 0 600 1000 1200 1400 1600 1800 800 1000 1200 1400 1600 1800 Т ,К Т ,К III 100 а,% 80 Cd ZnO Zn CdS 60 ZnS 40 I – P=0,1 МПа, II – P=0,01 МПа, III – P=0,001 МПа 20 0 600 800 1000 1200 1400 1600 1800 Рисунок 1 – Влияние температуры и давления на степень распределения кадмия и цинка в системе CdS – ZnO – H2 Т ,К При этом зависимости ТН = f(P) для кадмия и цинка имеют вид: THCd = 770,26 eхр[0,0831lgP]; (2) THZn = 1573,1 eхр[0,111lgP]. (3) Температура полного восстановления металлов (Тпол) также зависит от давления (таблица 2), уменьшаясь при снижении давления, в соответствии с уравнениями: TполCd = 1561,8 eхр[0,1206lgP]; (4) TполZn = 2112,5 eхр[0,1358lgP]. (5) Особенностью совместного восстановления кадмия и цинка в рассматриваемой системе является образование сульфида цинка. Температура начала формирования ZnS (температура 1% образования ZnS) зависит от давления (таблица 3). Давление влияет и на температуру максимального образования (ТМ) ZnS (таблица 3). Таблица 3 - Влияние давления на температуру начала формирования и максимального образования ZnS Р, МПа THZnS, К TМZnS, К (, %) 0,001 627,5 1100 (32,5) 0,01 701,4 1200 (32,9) 0,1 716,1 1300 (32,4) Из таблицы 3 следует, что при уменьшении давления температура начального и максимального образования ZnS снижается. Эти закономерности описываются уравнениями: TН ZnS = 768,95 eхр[0,0585lgP]; (6) TМ ZnS = 1414,9 eхр[0,0835lgP]. (7) Полученные данные по распределению Cd, Zn, а также по распределению S, C, H и O позволили нам определить, что в системе, например, при 0,1МПа первоначально происходит сульфидирование ZnO с образованием ZnS и CdО. Затем кадмий восстанавливается из CdО водородом. При Т1411К в системе начинается восстановление цинка с одновременным уменьшением количества ZnO и ZnS, т.е. восстановление происходит по схеме: ZnS + 2ZnO = 3Zn + SO2. (8) Затем, при Т1700К, когда весь ZnS прореагировал, дальнейшее восстановление Zn от 91,5% до 98,3% происходит по реакции: ZnО + Н2 = Zn + Н2О. (9) При Т=1800К уравнение взаимодействия в рассматриваемой системе имеет вид: CdS + 3ZnO + H2 = Cd + 2,95Zn + 0,0492ZnO + 0,987SO2+ + 0,9716H2O + 0,0268H2 + 0,001S2 + 0,0105SO (10) Проведенные исследования позволяют сделать следующие выводы: - температура начального и полного восстановления Cd и Zn экспоненциально уменьшается при снижении давления от 0,1 до 0,001МПа, при этом кадмий восстанавливается при меньшей температуре, чем цинк; - сульфид кадмия в системе CdS - ZnO - H2 первоначально взаимодействует с ZnO с образованием CdO, который затем начинает восстанавливаться водородом в температурном интервале от 608 (Р=0,001МПа) до 717,9К (Р=0,1МПа); - цинк в рассмотренной системе на первом этапе частично сульфидируется, затем при Т1400К (Р=0,1МПа) и Т1100К (Р=0,001МПа) происходит восстановление основного количества Zn по реакции (9) ZnS + 2ZnO = 3Zn + SO2; на последней стадии полное восстановление Zn происходит по реакции (10) ZnО + Н2 = Zn + Н2О. Литература 1 Нурмуханбетов Ж.У. Исследование и разработка технологии получения использования спецкокса для выплавки ферросплавов: дисс. канд. техн. наук. – Караганда, 2006. -126с. 2 Синярев Г.Б., Ватолин Н.А. и др. Применение ЭВМ для термодинамических расчетов металлургических процессов. -М.: Наука, 1982.-263с. 3 Шевко В.М., Айткулов Д.К. Построение диаграмм парциальных давлений систем Bi-O-Ce и Cd-O-Cl с учетом образования оксихлоридов висмута и кадмия с использованием ЭВМ. Рук.деп. в КазНИИТИ 25.06.85. №1010 Ка-85ю. -11с. Қорытынды CdS-ZnO-H2 жүйесіндегі Cd және Zn қайта қалпына келтірудегі тепе-теңдік химизміне температура мен қысымның әсері анықталды. Қысымның 0,1 ден 0,001МПа дейін төмендеуінде Cd және Zn бастапқы және толық температурадағы қалпына келуі экспоненциалды төмендейтіні және сол кезде кадмийдің мырышқа қарағанда төменгі температурада қалпына келетіні анықталынды. Кадмий сульфиді CdS-ZnO-H2 жүйесінде алдымен ZnO әсерлесіп CdO түзеді, содан соң сутегімен 608(Р=0,001МПа) ден 717,9К (Р=0,1МПа) температура арлаығында қалпына келе бастайды. Мырыш қарастырылып отырған жүйеде алдымен бөлшектеп сульфидтенеді, содан соң Т1400К (Р=0,1МПа) және Т1100К (Р=0,001МПа) температурада негізгі мырыштың ZnS -нің ZnO әсерлесуінен қалпына келетіні байқалады. Соңғы сатыда Zn мырыш тотығымен толық қалпына келетіні жүреді. Summary The influence of temperature and pressure on equilibrium chemical process of reduction of Cd and Zn in system CdS-ZnO-H2 was determined. It is found that the temperature of initial and complete reduction of Cd and Zn are exponentially decreased at reducing of pressure from 0,1 till 0,001MPa, at that Cd is reduced at lower temperature then Zn. Cadmium sulfide in system CdS-ZnO-H2 is primarily cooperated with ZnO forming CdO, than CdO is reduced by hydrogen in temperature interval from 608K (P = 0,001MPa) till 717,9K (P = 0,1MPa). Zinc in examined system on first stage is partly sulfided, than at temperature higher 1400K (P = 0,1MPa) and at temperature higher 1100K (P = 0,001K) the basic quantity of Zn is formed at interaction of ZnS with ZnO, on last stage at reduction of ZnO by hydrogen the additional quantity of Zn is formed.