Zn, Cd, Hg Э Å КЧ=6),
реклама
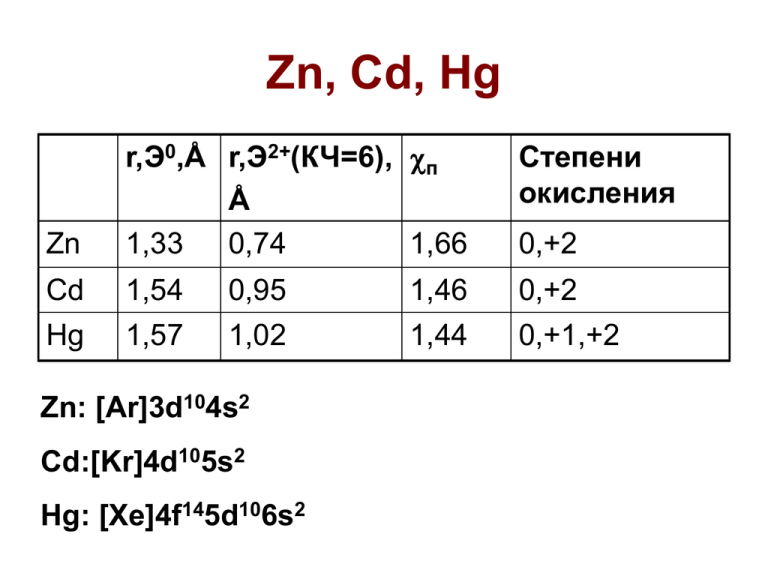
Zn, Cd, Hg Степени окисления Zn r,Э0,Å r,Э2+(КЧ=6), п Å 1,33 0,74 1,66 Cd 1,54 0,95 1,46 0,+2 Hg 1,57 1,02 1,44 0,+1,+2 Zn: [Ar]3d104s2 Cd:[Kr]4d105s2 Hg: [Xe]4f145d106s2 0,+2 Содержание в земной коре и минералы • Zn – 24 место, ZnS (сфалерит), ZnO (цинкит) • Cd – 48 место, CdS • Hg – 57 место, HgS (киноварь) и самородная ртуть Открытие элементов • Zn – производство в Индии с XII века; сплав с медью (латунь) до н.э.; возможно от нем. Zinn (олово) • Cd – 1817 г., нем. Штомейер; гр. «кадмия» цинковая руда • Hg – известна с 1500 г. до н.э.; Меркурий – ближайшая к Солнцу планета; лат. Hydrargirum – серебряная вода Получение • Zn и Cd: ZnS + 3/2O2 = ZnO +SO2 Пирометаллургия: ZnO + C =CO + Zn (1300oC), Cd отделяют перегонкой Гидрометаллургия: ZnO + H2SO4 = ZnSO4 + H2O Катод: Zn2+ +2e- = Zn0 Zn + Cd2+ = Cd + Zn2+ • Hg: HgS (киноварь) + O2 = Hg +SO2 HgO = Hg + 1/2O2 (500oC) Свойства простых веществ Zn Cd Hg Тпл,оС Ткип,оС Ео(М2+/M), В d, г/см3 420 321 -39 -0,76 -0,40 +0,85 7,13 8,65 13,55 906 770 357 +0,92 +0,79 Hg2+ --------> Hg22+ --------> Hg +0,85 Hg2+ ------------------> Hg Zn, Cd – активные металлы, мягкие, легкоплавкие Hg2+ - мягкий окислитель Свойства простых в-в Zn + H2O = ZnO + H2 (только при Т) M + H2SO4 разб. = MSO4 + H2 (M = Zn, Cd) Zn + 2NaOH +2H2O = Na2[Zn(OH)4] + H2 Сd + NaOH = нет реакции Кислоты окислители: 4Zn + 10HNO3 разб. = 4Zn(NO3)2 + NH4NO3 + 3H2O 4Cd + 10HNO3 разб. = 4Cd(NO3)2 +N2O + 5H2O 3Hg + 8HNO3 разб. = 3Hg(NO3)2 +2NO + 4H2O Сравнение соединений Zn и Cd Растворимые соли: MX2 (X = Cl, Br, NO3, 1/2SO4) Н/р соли: M(CN)2 (белые), ZnS (белый), CdS (желтый) Различие в поведении водных растворов : ZnCl2 = Zn2+ + 2Cl- (полная диссоциация) CdBr2 = CdBr+ + BrCdBr+ = Cd2+ + BrCdBr2 + Br- = [CdBr3][CdBr3]- + Br- = [CdBr4]2- Аутокомплексы Оксиды/гидрокcиды • ZnO и Zn(OH)2 – амфотерные св-ва: Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O Zn(OH)2 + 2NaOH = Na2[Zn(OH)4] (в твердофазном синтезе Na2ZnO2 цинкат) • CdO и Cd(OH)2 – основные св-ва: Как Zn, но реакции с конц. щелочами только при Т (тв. фазный синтез Na2CdO2 – кадмат) • HgO – основные св-ва: Реагирует с кислотами; при нагревании с BaO, образуя ВaHgO2- меркурат HgO + 4KI +H2O = K2[HgI4] + 2KOH Hg(OH)2 не существует M22+ MCl2 расплав + 2AlCl3 + 3M = M2[AlCl4]2 Zn22+ - только спектры Cd22+ = Cd2+ + Cd легко диспропорционирует в водных растворах Hg22+ - cтабилен, d(Hg-Hg) = 2,53 Å 2Hg + HgCl2 + 2AlCl3 = [Hg3][AlCl4]2 [Hg-Hg-Hg]2+ [Hg-Hg-Hg-Hg]2+ Амальгамы M = Na, Ag, Au, Al, Cu, Cd, Zn Na3Hg2: кластеры [Hg4]6Fe – не образует Соединения ртути сильно ядовиты CH3HgX, (CH3)2Hg – летучие 2+ Hg 2Hg(NO3)2 = 2HgO +4NO2 + O2 красный оксид – 300-400оС Hg + 1/2O2 = HgO красный оксид (300оС) Hg2+ + 2OH- = H2O + HgO желтый оксид Растворимые, электролиты Hg(NO3)2 HgF2 HgSO4 Hg(ClO4)2 Растворимые, слабые эл-ты HgCl2 HgBr2 Hg(CN)2 Н/р HgI2 красный Hg(SCN)2 бел. HgS черный и красный Соли 2+ Hg [Hg(H2O)6]2+ = [Hg(H2O)5(OH)]+ + H+ K = 2,6.10-4 Гидролиз сильных электролитов: Hg2+ + NO3- +H2O = (HgOH)NO3↓ + H+ Белый осадок растворим при доб. кислот Hg2+ + 2F- +H2O = HgO↓ + 2HF Полный гидролиз!!! Слабые электролиты: Сулема: HgCl2 = HgCl+ + Cl- ( ~ 1%) Hg(CN)2 – не гидролизуется, раствор практически не проводит эл. ток Соли Hg2+ HgF2 – полимер, нелетуч HgCl2 – сулема,молекулярная структура, линейная молекула, летуча и ядовита В некорорых орг. растворителях образуются димеры X-Hg(-X)2Hg-X Hg(CN)2 - молекулярная структура, линейная молекула, растворяется в растворах CN- с образованием [Hg(CN)3]-, [[Hg(CN)4]2- Соли Hg22+ [H2O-Hg-Hg-OH2]2+, [X-Hg-Hg-X] Растворимые соли: Hg2F2 , Hg2(NO3)2 Нерастворимые соли: Hg2X2 (X = Cl,Br,I), Hg2SO4 Hg22+ = Hg2+ + Hg K = 6.10-3 Hg22+ + 2CN- = Hg + Hg(CN)2 (прочный КС) Hg22+ + 2OH- = Hg + HgO↓ + H2O (черный осадок) Hg2(OH)2 , Hg2O, HgCN, Hg2S – НЕ СУЩЕСТВУЮТ Гидролиз растворимых солей: Hg2F2 + H2O = HgO + Hg + 2HF (полный) Hg2(NO3)2 + H2O = Hg2(OH)NO3 + HNO3 Сравнение Hg(NO3)2 и Hg2(NO3)2 Реагент Hg2+ Hg22+ Cl- Ионный обмен Hg2Cl2↓бел. I- (недост.) HgI2↓красн. Hg2I2 желт. I- (избыток) [HgI4]2- б/ц р-р [HgI4]2- + Hg↓ S2- HgS ↓ черный CN-(недост.) Hg(CN)2 p-p, не электролит HgS↓ + Hg↓ Избыток ->[HgS2]2Hg(CN)2 + Hg↓ CN-(избыток) [Hg(CN)4]2-, р-р [Hg(CN)4]2- +Hg↓ Ox-red реакции 1) 3Hg + 8HNO3 разб. = 3Hg(NO3)2 + 2NO +4H2O 6Hg (изб.) + 8HNO3 разб. = 3Hg2(NO3)2 + 2NO +4H2O Hg(NO3)2 + Hg = Hg2(NO3)2 K = 170 2) Окисление: Hg2(NO3)2+ 4HNO3 конц= 2Hg(NO3)2+2NO2+ 2H2O 3) Восстановление: 2HgCl2 + SnCl2(недост.) = Hg2Cl2↓ + SnCl4 HgCl2 + SnCl2(изб.) = Hg↓ + SnCl4 Hg2X2 + 2e = Hg + 2XX 1/2SO4 Cl E0, B +0,62 KL 10-6 Br I NO3 +0,27 +0,14 -0,04 +0,79 10-18 10-22 10-28 Р-р Реакции солей ртути с NH3 Неплавкий белый преципитат: HgCl2 + 2NH3 = [Cl-Hg-NH2]↓ + NH4Cl Плавкий белый преципитат: HgCl2 + 2NH3 = [Hg(NH3)2]Cl2 ↓ (реакция в избытке NH4Cl) • Hg2Cl2↓ + 2NH3 = Hg↓ + HgNH2Cl↓ + NH4Cl • HgO + NH3 = [Hg2N]OH основание Миллона (ОН группа может быть замещена) • Реактив Неслера на аммиак: 2K2[HgI4] + 3KOH + NH3 = [Hg2N]I↓ +7KI +3H2O Амино-, амидо- и имидокомплексы Hg(II) [Hg(NH3)2]Cl2 [Hg(NH2)Cl] Катионная подрешетка в [Hg2N](NO3) Основные реакции в химии Hg МОС подгруппы цинка Карбонгидраза CO2(aq) + H2O(l) = H2CO3(aq) Карбоксипептидаза



