Окислительно- восстановительные реакции
реклама

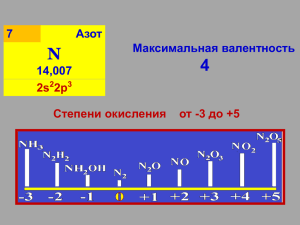
Окислительновосстановительные реакции доц. Сильвестрова И.Г. Каф.химии МГАВМиБ Окислительно-восстановительные реакции (ОВР)– это реакции, протекающие с изменением степеней окисления. Степень окисления – условный заряд атома в молекуле, исходя из предположения , что она состоит из ионов. Высшая положительная степень окисления = номеру группы. Возможна для металлов и неметаллов. Только окислительные свойства. Na+1, S+6, Mn+7, Cr+6 Минимальная (отрицательная) степень окисления = N группы – 8 Характерная только для неметаллов. Проявляют восстановительные свойства. N-3, S-2, Cl-, O-2 1.Неметаллы F2, O2, Cl2, N2 , Br2, I2,S, P, H2, C, Si 2. Кислоты – HNO3 H2SO4 (конц) HClO 3. Соли - K2Cr2O7 4. Cu2+ Ag+ K2CrO4 5. Электрический ток на аноде (+) Hg2+ KMnO4 KClO3 1.Металлы Li K Cs Ba Sr Na Mg Al Mn Zn Cr Fe Co Ni Pb -3 -2 2. NH3, - - H2S, HCl, HBr , HI +2 3. - +2 +3 FeCl2, MnSO4 . CrCl3 +4 4. Na2SO3, +3 NaNO2, 5. Электрический ток на катоде (-) +4 +2 SO2, CO Окислительно-восстановительные реакции межмолекулярные внутримолекулярные диспропорционирования N2 + 3 H2 = 2 NH3 2NaNO3 = 2 NaNO2 + O2 2 NO2 + H2O = HNO3 + HNO2 + -3 2× 2e = 4e 0 NH3 + O2 0 -2 N 2 + H 2O - 2 ×3e = 6e 2 N-3 - 6e → N2 O2 + 4e → 2 O-2 процесс окисления N-3 восстановитель процесс восстановления ×2 О2 окислитель × 3 4 N-3 + 3 O2 → 2 N2 + 6 O-2 4 N-3 + 3 O2 → 2 N2 + 6 O-2 4 NH3 + 3 O2 = 2 N2 + 6 H2O +5 0 +4 +6 HNO3 + S → NO2 + H2SO4 + H2O + 1e -6e N+5 + 1e → N+4 S0 - 6e →S+6 пр.восстановления N+5 – окислитель пр.окисления 1 S0 – восстановитель 6 6 HNO3 + S = 6 NO2 + H2SO4 + 2 H2O +5 -2 +3 0 2 NaNO3 = 2 NaNO2 + O2 + 2e - 4e N+5 + 2e → N+3 2 O-2 - 2·2e → O2 2 4 ·2 Реакции диспропорционирования 0 - +1 Cl2 + H2O = HCl + HClO 0 - +1 Cl2 + NaOH = NaCl + NaClO + H2O 0 - +5 3 Cl2 + 6 NaOH = 5 NaCl + NaClO3 + 3 H2O +5 - +7 4 KClO3 = KCl + 3 KClO4