циклопропан C H2 C CH2 H2 H2 C H2 C CH CH2 циклобутан H2
реклама
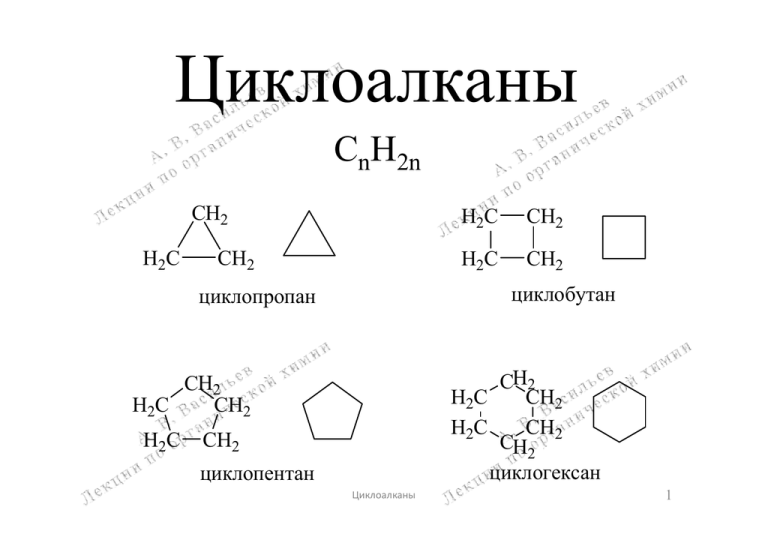
Циклоалканы СnH2n CH2 H2C CH2 CH2 H2C CH2 циклобутан циклопропан CH2 H2C CH2 H2C CH2 CH2 циклогексан CH2 H2C CH2 H2C H2C CH2 циклопентан Циклоалканы 1 Номенклатура и изомерия циклоалканов CH3 CH3 Br CH3 H2C бромциклобутан 1,2-диметилциклопропан CH3 1-метил-4-этилциклогексан Физические свойства циклоалканов Циклоалкан Циклопропан Циклобутан Т.пл., С -127 -80 Т.кип., С -33 13 Циклопентан Циклогексан -94 6.5 49 81 Циклоалканы 2 Строение циклоалканов Адольф Байер (1835-1917), Нобелевский лауреат (1905) немецкий химик Теория напряжения Байера (1885 г.) Байер считал, что молекулы циклоалканов – плоские. H циклопропан циклобутан 60o 90o 109o28' метан C H H H Циклоалкан Число атомов в цикле, n Угол между Отклоне- Следствия связями, ние угла из теории Байера β°=180(n-2)/n 109°28-β Реальное протекание раскрытия цикла циклопропан 3 60 49°28 сильное напряжение, цикл легко раскрыть легко циклобутан 4 90 19°28 среднее напряжение легко циклопентан 5 108 1°28 устойчивый цикл трудно циклогексан 6 120 -10°32 малое напряжение трудно циклогептан 7 128°34 -19°06 среднее напряжение трудно Вывод. Неверно предположение Байера, что молекулы циклоалканов – плоские! В действительности они обладают неплоскими, пространственными конформациями! Циклоалканы 3 Конформационный анализ циклоалканов Конформеры – структурные формы молекулы, переходящие друг в друга в результате вращения вокруг простых -связей Циклопропан – плоская молекула с углом связи 104° 104o 60o "банановые" () - связи, не чистая sp3-гибридизация, связь частично типа H Циклобутан – неплоская молекула, конформация “седло” H H H H 114o H H 154o H угол складчатости между двумя плоскостями Циклопентан – неплоская молекула, конформация “конверт” H H H H H H H H H H Циклоалканы 4 Циклогексан существует в виде нескольких конформаций "ванна" "кресло" "твист" Самая стабильная конформация “кресло” Ha He Ha He Ha Ha He He Ha He He Ha Неэквивалентность атомов водорода циклогексана: Hа – аксиальные водородные атомы, связи которых с атомами углерода параллельны оси; Hе – экваториальные водородные атомы, связи которых с атомами углерода перпендикулярны оси мысленная ось, проходящая через центр кольца Циклоалканы 5 Способы получения циклоалканов 1. Металлоорганический синтез H2 C Br H2C C Br H2 1,3-дибромпропан H2C H2 C Br H2C Br C H2 1,4-дибромбутан H 2C H2C H2C CH2 Zn CH2 Br Br CH2 -ZnBr2 H2C CH2 циклопропан Li(Hg) амальгама лития -2LiBr циклобутан Li(Hg) амальгама лития -2LiBr циклопентан 1,5-дибромпентан Циклоалканы 6 2. Пиролиз солей карбоновых кислот H2C H2C H2C H2 O C C O H2 C C H2 CH2 восстановление C O H2C C H2 циклопентан циклопентанон H2C O -CaO, - CO2 C C H2 O кальциевая соль адипиновой кислоты (C6) O C H2C H2C Ca2+ to C O Ba2+ O O to восстановление O -BaO, - CO2 циклогексанон циклогексан бариевая соль пимелиновой кислоты (C7) 3. Гидрирование производных бензола H H H + 3 H2 H H H бензол Ni H2C CH2 CH2 H2C CH2 CH2 циклогексан Циклоалканы 7 Химические свойства циклоалканов. Реакции раскрытия цикла 1. Гидрирование + H2 + H2 Ni, 80oC Ni, 200oC CH3CH2CH3 пропан CH3CH2CH2CH3 бутан + H2 Ni, 300oC CH3CH2CH2CH2CH3 пентан реакция не идет + H2 Циклоалканы 8 2. Галогенирование с раскрытием цикла разрыв старых связей H2 C Cl t + H2C H2C Cl o H2C Cl C H2 образование новых связей to + Cl2 и др. циклы H2C Cl CH2CH2CH2CH2 Cl Cl 1,2-дихлорпропан 1,4-дихлорбутан реакция раскрытия не идет + Hlg2 3. Свободнорадикальное галогенирование (замещение), как в алканах Br Cl + Cl2 h + HCl + Br2 хлорциклопропан to + HBr бромциклогексан Циклоалканы 9 4. Реакции циклопропана с кислотами H2 C CH3 H + H2C H2C Br C H2 H2C Br 1-бромпропан H2SO4-H2O CH3CH2CH2 OH пропанол-1 Реакция подчиняется правилу Марковникова более гидрогенезированный атом углерода 2 CH2 1 H3C CH 3 CH2 разрыв С1-С2 H+ (HBr) разрыв С2-С3 H3C CH CH2 CH3 втор.-бутильный катион вторичный катион (более устойчив) H3C CH CH2 CH3 Циклоалканы Br- H3C CH Br CH2 CH3 2-бромбутан изобутильный катион первичный катион (менее устойчив) 10 Терпены Терпены – непредельные углеводороды растительного происхождения состава (С5Н8)n (n2) формально построенные из изопреновых звеньев. В природе терпены и терпеноиды образуются из изопентилпирофосфата. CH3 H2C C HC CH2 изопрен (2-метилбутадиен-1,4) CH3 O O H2C C CH2 CH2 O P O P OH O O изопентилпирофосфат Классификация терпенов по составу: 1. С10Н16 – монотерпены; 2. С15Н28 – сесквитерпены; 3. С20Н32 – дитерпены; 4. С30Н48 – тритерпены; 5. политерпены – каучук, гуттаперча. Углеродный скелет терпенов построен из изопреновых звеньев связанных по типу «голова» к «хвосту» CH3 H2C C HC CH2 "хвост" "голова" CH3 H3C CH3 CH3 OH CH3 CH3 "хвост" "голова" скелетная формула изопрена Витамин А (четыре изопреновых звена) Циклоалканы 12 Классификация монотерпенов С10Н16 1. Ациклические терпены – линейные нециклические углеводороды "хвост" H3C "хвост" CH2 CH3 CH2 "голова" "голова" Мирцен (хмель, сосна) "хвост" H3C CH3 "хвост" CH3 CH2 "голова" "голова" Оцимен (базилик) 2. Моноциклические терпены CH3 H3C CH3 CH3 Лимонен (лимон, сосна) CH2 H3C Изолимонен (апельсин) CH2 CH3 H3C Терпинолен (апельсин) CH3 H3C CH2 Фелландрен (эвкалипт) CH3 H3C CH3 CH3 Терпинен (кардамон) H3C Фелландрен (сосна) CH3 CH3 Циклоалканы Терпинен (кориандр) H3C CH3 13 3. Бициклические терпены CH2 CH3 CH3 CH3 H3C H3 C CH3 CH3 CH2 CH3 H3C Карен (сосна) Пинен (сосна) Пинен (сосна) CH3 CH2 Камфен (пихта) 4. Трициклические терпены Трициклен (сосна) Терпеноиды – функциональные производные терпенов CH3 H3C OH CH3 H3C CH3 CH3 CH3 O C Гераниол (герань) CH3 O Цитронеллаль (лимон) H H3C Циклоалканы OH Ментол CH3 (мята) Камфора (камфорное дерево) 14 Химические свойства терпенов. Реакции -пинена Терпены сочетают в себе химические свойства алканов, циклоалканов, алкенов и алкадиенов. CH3 1. Гидрирование CH3 Pt + H2 Пинен 2. Гидрохлорирование Пинан присоединение по правилу Марковникова разрыв CH3 циклобутанового кольца + 2 HCl 3. Гидратация HO CH3 C H2C CH2 CH3 + 3 H2O H2C CH2 Cl CH3 C H2C CH2 H2C CH2 CH H3C C CH3 Дихлогидрат Cl дипентена Н2О CH H3C C CH3 Терпингидрат OH Циклоалканы 15 Синтез камфоры из -пинена H2C CH3 CH3 o H2TiO3 , t изомеризация CH2 CH3 O O C CH3 H3C CH3COOH H2SO4 CH2 Камфен Пинен CH3 Уксусный эфир камфенгидрата O C изомеризация Изоборнилацетат CH3 CH3 CH3 O OH NaOH-H2O - CH3CO2Na O [O] окисление Изоборнеол Камфора H3C CH3 CH3 O Пространственная структура камфоры Циклоалканы 16 Живица, скипидар, канифоль Хвойная древесина подсочка Живица (смола) Скипидар (в дистилляте) перегонка с паром Канифоль (в кубовом остатке) Состав живичного скипидара сосны: α-пинен (60-70%), β-пинен (6-8%), Канифоль состоит из смоляных кислот: 3-карен (13-20%), лимонен (3-4%), H3C COOH H C COOH 3 камфен (2%), мирцен (2%) H3C H C CH2 CH3 Пимаровая кислота H3C CH CH3 CH3 Абиетиновая кислота Большой вклад в химию терпенов внес русский химик Вячеслав Евгеньевич Тищенко (1861-1941) Циклоалканы 17 Нобелевские лауреаты по химии за исследования в области терпенов Отто Валлах (1847-1931), Нобелевский лауреат (1910) немецкий химик Рихард Кун (1900-1967), Нобелевский лауреат (1938) немецкий химик Леопольд Ружичка (1887-1976), Нобелевский лауреат (1939) швейцарский химик Циклоалканы 18








