d-элементы IV группы
реклама
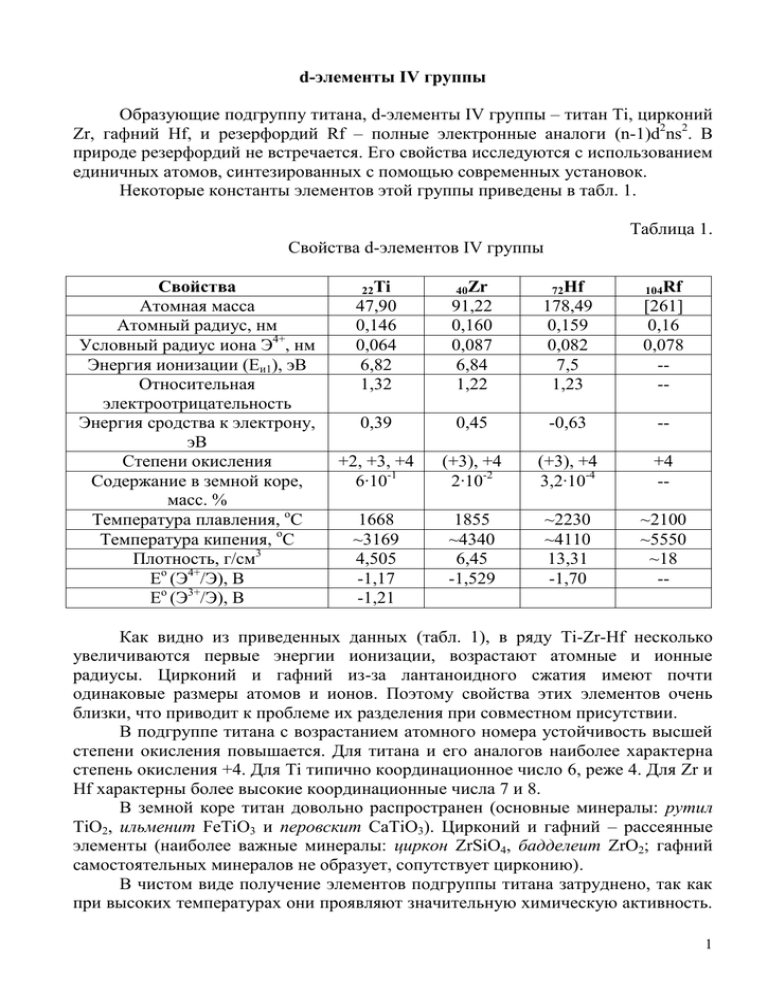
d-элементы IV группы Образующие подгруппу титана, d-элементы IV группы – титан Ti, цирконий Zr, гафний Hf, и резерфордий Rf – полные электронные аналоги (n-1)d2ns2. В природе резерфордий не встречается. Его свойства исследуются с использованием единичных атомов, синтезированных с помощью современных установок. Некоторые константы элементов этой группы приведены в табл. 1. Таблица 1. Свойства d-элементов IV группы Свойства Атомная масса Атомный радиус, нм Условный радиус иона Э4+, нм Энергия ионизации (Еи1), эВ Относительная электроотрицательность Энергия сродства к электрону, эВ Степени окисления Содержание в земной коре, масс. % Температура плавления, оС Температура кипения, оС Плотность, г/см3 Ео (Э4+/Э), В Ео (Э3+/Э), В 22Ti 40Zr 72Hf 104Rf 47,90 0,146 0,064 6,82 1,32 91,22 0,160 0,087 6,84 1,22 178,49 0,159 0,082 7,5 1,23 [261] 0,16 0,078 --- 0,39 0,45 -0,63 -- +2, +3, +4 6∙10-1 (+3), +4 2∙10-2 (+3), +4 3,2∙10-4 +4 -- 1668 ~3169 4,505 -1,17 -1,21 1855 ~4340 6,45 -1,529 ~2230 ~4110 13,31 -1,70 ~2100 ~5550 ~18 -- Как видно из приведенных данных (табл. 1), в ряду Ti-Zr-Hf несколько увеличиваются первые энергии ионизации, возрастают атомные и ионные радиусы. Цирконий и гафний из-за лантаноидного сжатия имеют почти одинаковые размеры атомов и ионов. Поэтому свойства этих элементов очень близки, что приводит к проблеме их разделения при совместном присутствии. В подгруппе титана с возрастанием атомного номера устойчивость высшей степени окисления повышается. Для титана и его аналогов наиболее характерна степень окисления +4. Для Ti типично координационное число 6, реже 4. Для Zr и Hf характерны более высокие координационные числа 7 и 8. В земной коре титан довольно распространен (основные минералы: рутил TiO2, ильменит FeTiO3 и перовскит CaTiO3). Цирконий и гафний – рассеянные элементы (наиболее важные минералы: циркон ZrSiO4, бадделеит ZrO2; гафний самостоятельных минералов не образует, сопутствует цирконию). В чистом виде получение элементов подгруппы титана затруднено, так как при высоких температурах они проявляют значительную химическую активность. 1 Эти металлы получают магний- или натрийтермическим восстановлением тетрагалогенидов в атмосфере аргона или гелия, либо термическим разложением тетраиодидов. Все представители данной группы – металлы серебристо-белого цвета. Титан относится к легким, а цирконий и гафний – к тяжелым металлам. Они тугоплавки, что свидетельствует о металлоковалентном характере связи в кристаллах, имеют один тип кристаллической решетки. Хорошо поддаются механической обработке, хотя присутствие примесей O, N, C, H резко меняет многие механические характеристики. В стандартных условиях в виде компактных металлов все элементы подгруппы титана химически устойчивы, что объясняется наличием на их поверхности защитной пленки ЭО2. Более реакционноспособны они в мелко раздробленном состоянии, но и тогда при обычных температурах из всех кислот легко взаимодействуют лишь с HF. Лучшим растворителем для них является смесь плавиковой и азотной кислот. При нагревании их химическая активность возрастает. В этих условиях они энергично взаимодействуют со многими окислителями. Химическая активность элементов иллюстрируется таблицей 2. Таблица 2. Нагревание Стандартные условия Продукты взаимодействия d-элементов IV группы Реагенты с конц. HF с конц. HCl с конц. H2SO4 с царской водкой с конц. HNO3 на воздухе или в кислороде с водой с галогенами с серой c азотом c углеродом c фосфором c водородом с конц. H2SO4 с расплавом NaOH с расплавом КНF2 Ti TiF4 H2[TiF6] TiCl3 Ti2(SO4)3 TiCl4 H2TiO3 (TiO) или TiO2 H4TiO4 TiX4 (X=F ,Cl-,Br-,I-) TiS2 TiN TiC ТiP ТiН2 Ti(SO4)2 титанаты Zr H2[ZrF6] Hf H2[HfF6] -H2[Zr(SO4)3] H2[ZrCl6] -ZrO2 -H2[Hf(SO4)3] H2[HfCl6] -HfO2 -ZrX4 (X=F ,Cl-,Br-,I-) ZrS2 ZrN ZrC ZrP ZrН2 Zr(SO4)2 цирконаты K2[ZrF6] -HfX4 (X=F-,Cl-,Br-,I-) HfS2 HfN HfC HfН2 Hf(SO4)2 гафнаты K2[HfF6] 2 Порошки титана, циркония и гафния способны поглощать большие количества водорода, кислород и азот. При этом растворенные неметаллы переходят в атомное состояние и принимают участие в образовании химических связей. Благодаря чему система приобретает повышенную твердость и хрупкость. Гидриды ЭН2 – хрупкие металлоподобные порошки серого или черного цвета. Они являются промежуточными между твердыми растворами и солеподобными (ионными) гидридами. d-элементы IV группы с металлами близкими им по свойствам образуют непрерывный ряд твердых растворов замещения, а со многими другими металлами – интерметаллические соединения. Галогениды ЭНаl4 чаще получают нагреванием ЭO2 с углем в атмосфере галогена. Хлориды, бромиды и иодиды в твердом состоянии имеют молекулярные решетки. Фториды полимерны. Тетрагалогениды элементов подгруппы титана молекулярной структуры летучи, химически активны. Иодиды Э(IV) при высоких температурах распадаются на йод и металл, что используется для получения особо чистых Ti, Zr и Hf. За исключением ZrF4 и HfF4 галогениды ЭНаl4 хорошо растворимы в воде. В воде гидролизуются нацело. Например: TiСl4 + 2Н2О = TiO2 + 4НСl. При недостатке воды можно получить TiОСl2. Исключением является TiF4, который в водном растворе дает достаточно устойчивые комплексные ионы состава [TiF6]2-. Сульфиды ЭS2 на воздухе при обычной температуре устойчивы, водой не разлагаются, при нагревании переходят в ЭO2. Сульфид титана(IV) в токе водорода или азота переходит в низшие сульфиды – Ti2S3 и TiS. При нагревании в атмосфере кислорода титан, цирконий, гафний сгорают с образованием диоксидов (табл. 3). Таблица 3. Кислородосодержащие соединения титана(IV), циркония(IV), гафния(IV) Эле мент Ti Zr Степень окисле ния +4 +4 Оксиды Фор- Харакмула тер TiO2 ZrO2 Гидроксиды Формула Название Амфотерный TiO2∙nH2O То же ZrO2∙nH2O H2TiO3 H2ZrO3 Hf +4 HfO2 -//- HfO2∙nH2O H2HfO3 Гидроксид титана(IV) Титановая кислота Гидроксид циркония(IV) Циркониевая кислота Гидроксид гафния(IV) Гафниевая кислота Соли ФормуНазвание ла иона TiO2+ Соли титанила 2TiO3 Титанаты ZrO2+ ZrO32HfO2+ HfO32- Соли цирконила цирконаты Соли гафнила Гафнаты 3 Диоксиды ЭO2 – тугоплавкие белые вещества с высокими значениями энтальпий образования и энергиями Гиббса. Химически они довольно инертны: практически не растворимы в воде и растворах кислот и щелочей. При нагревании с концентрированной серной кислотой они медленно переходят в раствор, но легко могут быть переведены в растворимое состояние действием HF или сплавлением со щелочами. Гидроксиды ЭO2∙nH2O – студенистые осадки переменного состава. Чаще всего получают щелочным гидролизом водных растворов солей соответствующего элемента. Они почти нерастворимы в воде (но легко образуют коллоидные растворы). Свежеполученные осадки (α-форма H4TiO4) имеют большее число ОН-групп, чем «состарившиеся» осадки (β-форма H2TiO3), в которых часть ОН-групп замещена на О-мостики (TiO(ОH)2). Поэтому α-форма более реакционноспособна (растворима в кислотах). Гидроксид титана(IV) амфотерен, причём и основные, и особенно кислотные свойства у него выражены слабо. При переходе к Zr и Hf кислотные свойства ещё более ослабевают, а основные усиливаются. В связи с преобладанием у гидроксидов Э(ОН) 4 основных свойств все они растворимы в сильных кислотах, тогда как разбавленные щёлочи почти не действуют даже на Ti(ОН)4. Соли – титанаты, цирконаты, гафнаты получают обычно сплавлением диоксидов с оксидами металлов или щелочами. Для образующихся солей наиболее характерны типы М2ЭО3 и М4ЭО4 (где М – одновалентный металл). Большинство их нерастворимо в воде, а растворимые подвергаются полному гидролизу. Так как основные свойства гидроксидов выражены сильнее кислотных, то по отношению к воде соли катионов Э4+ устойчивее титанатов, цирконатов и гафнатов. Тем не менее гидролиз этих солей значителен, вследствие большого заряда катиона, и идет с образованием устойчивых оксокатионов ЭО2+: Э4+ + Н2О = ЭO2+ + 2Н+. Поэтому при взаимодействии оксидов и гидроксидов с кислотами образуются не средние соли, а соответствующие оксо- и гидроксопроизводные. Только гафний существует в растворах в виде ионов Hf4+ вследствие значительного радиуса иона. Соединения простого состава получают лишь в неводных растворах. Все элементы данной подгруппы являются комплексообразователями. Наибольшая способность к комплексообразованию у титана. Основным типом комплексных соединений являются ацидокомплексы, в том числе и сложные пероксоацидокомплексы. Пероксотитанаты и пероксоцирконаты образуются при действии Н2О2 на соответствующие соединения, например: Э(SO4)2 + Н2О2 = Н2[Э(О2)(SO4)2]. 4 Растворы соединений Ti(IV) при взаимодействии с Н2О2 приобретают желто-оранжевую окраску. Эта реакция лежит в основе аналитических методов обнаружения соединений Ti(IV) и пероксида водорода. В своих наиболее характерных производных элементы подгруппы титана проявляют высшую степень окисления +4. Титан сравнительно легко образует малоустойчивые соединения со степенью окисления +3. Производные титана со степенью окисления +2 немногочисленны и очень неустойчивы. Таким образом, по ряду Ti - Zr – Hf идет понижение устойчивости низших степеней окисления, т.е. закономерность обратная, чем для подгруппы германия. При восстановлении титана(IV) в инертной среде образуются фиолетовые растворы иона Ti3+, которые в кислых растворах существуют в виде комплексов состава [Ti(H2O)6]3+. Ионы Ti(II) в водных растворах не существуют. Оксид Ti2O3 – темно-фиолетового цвета, в воде практически не растворим. Соответствующий ему гидроксид Ti2O3∙nH2O (Ti(ОН)3) проявляет основные свойства. Производные Ti(III) – восстановители. Например, они легко окисляются кислородом воздуха: 4TiСl3 + O2 + 2Н2О = 4TiOСl2 + 4НСl. Для соединений Ti(III) также характерны реакции диспропорционирования. Так, при нагревании до 400оС TiСl3 распадается: 2TiСl3 = TiСl2 + TiСl4 2TiСl2 = Ti + TiСl4 5







