Скорость химической реакции и химическое равновесие
реклама
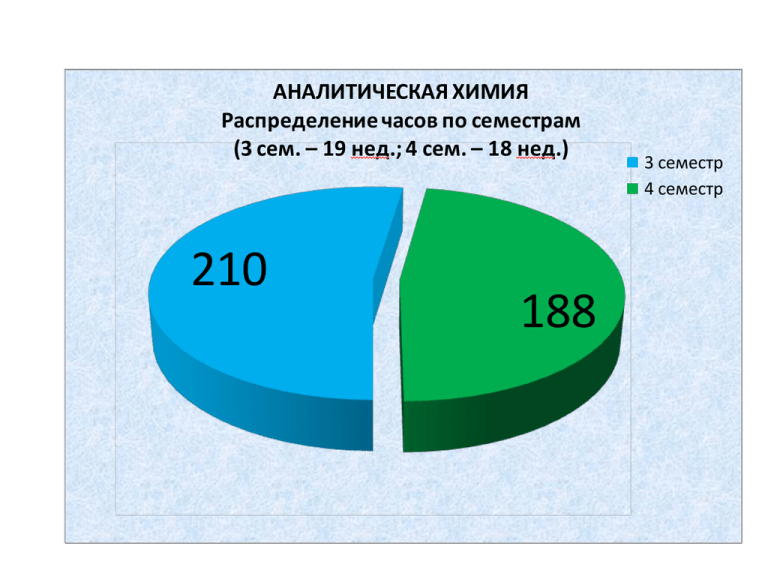
АНАЛИТИЧЕСКАЯ ХИМИЯ Распределение часов по семестрам (3 сем. – 19 нед.; 4 сем. – 18 нед.) 210 188 3 семестр 4 семестр АНАЛИТИЧЕСКАЯ ХИМИЯ (распределение часов по видам занятий) 95 100 50 0 38 77 36 90 35 27 часы Распределение часов по разделам химического анализа 141 94 126 качеств. ХА колич. ХА ФХМА АНАЛИТИЧЕСКАЯ ХИМИЯ ЛЕКЦИИ III СЕМЕСТР Лектор – доцент, кандидат химических наук Константин Иванович ЯКОВЛЕВ Литература: 1. Ю.Я.Харитонов. Аналитическая химия (Аналитика). М.:Высш.шк. Т.1. 2001. 615 с., Т.2. 2003. 559 с. 2. Качественный химический анализ катионов. Методические указания. С-Пб.:СПХФА. 2009. 84 с. 3. Анализ анионов. Методические указания. С-Пб.: СПХФА. 2002. 32 с. 4. В.П.Васильев. Аналитическая химия. Сборник вопросов, упражнений и задач. М.: Дрофа. 2003. 319 с. www.anchem.pro ГЛАВНАЯ Материалы для студентов Фармацевтический факультет III семестр (осень) Текст лекций по теоретическим основам Аналитическая химия и химический анализ Аналитическая химия (АХ) - это наука о методах определения химического состава и структуры химических систем Химическая система (вещество): - индивидуальное химическое соединение - смесь соединений - какой-либо материал (пластмасса, древесина, бумага и т.д.) Основные характеристики химической системы ХИМИЧЕСКАЯ СИСТЕМА (ВЕЩЕСТВО) Н2О СОСТАВ КАЧЕСТВЕННЫЙ Элементы: Н – водород О- кислород КОЛИЧЕСТВЕННЫЙ СТРУКТУРА ВНУТРИМОЛЕ КУЛЯРНАЯ МЕЖМОЛЕКУ ЛЯРНАЯ H (Н) = 11,1% (О) = 88,9% O H H O H H O H Цели аналитической химии как науки: - развитие теоретических основ различных методов анализа - создание новых методов и методик анализа - разработка и совершенствование аналитических приборов, реагентов, стандартных образцов, программ для компьютеров и т.д. Метод анализа – достаточно универсальный и теоретически обоснованный способ проведения анализа (принцип анализа) Методика анализа – подробное описание решения конкретной аналитической задачи Химический анализ (ХА) – получение информации о составе и структуре вещества Анализируемое вещество (проба, образец) – анализируют на содержание в нѐм одного или нескольких компонентов Определяемое вещество (аналит) – его содержание определяют в анализируемой пробе Таким образом, пробу анализируют, чтобы определить в ней содержание компонента - качественный анализ – служит для определения качественного химического состава и идентификации (установление идентичности с эталоном) вещества ЧТО? - количественный анализ – служит для определения количественных соотношений между компонентами химической системы СКОЛЬКО? - структурный анализ – служит для исследования внутри- и межмолекулярной структуры вещества КАК? Компоненты: - основные – > 1% - сопутствующие – 0,1 ÷ 1% - следовые – < 0,1% • По сложности проведения анализа различают: - элементный анализ - ионный анализ - молекулярный анализ - функциональный анализ - фазовый анализ • По размеру пробы различают: Вид анализа Макроанализ Полумикроанализ Микроанализ Ультрамикроанализ Масса вещества, г Объѐм раствора, мл > 0,1 10 -50 0,01 - 0,10 1 – 10 0,001 - 0,010 0,1 - 0,5 < 0,001 < 0,01 Основные стадии (этапы) химического анализа - постановка аналитической задачи - выбор метода и методики - получение представительной пробы (пробоотбор) - подготовка пробы к анализу (пробоподготовка) - измерение аналитического сигнала - вычисление результатов и составление отчѐта ПРОБА Газообразная Жидкая Твёрдая Представительность (репрезентативность) пробы – соответствие состава пробы среднему составу исследуемого объекта Генеральная (первичная) проба (десятки и сотни граммов) Гомогенизация: измельчение, просеивание и перемешивани е Лабораторная (средняя) проба (граммы и десятки граммов) Аналитическая проба (проба для анализа) Квартование (получение ЛП) Лаборатор ная проба Величина аналитической пробы зависит: - от метода определения - от ориентировочного содержания определяемого компонента в пробе Ошибки при отборе и хранении проб: - потери в виде пыли при измельчении твердых образцов - потеря летучих продуктов (разогрев при измельчении и изменение температуры при хранении) - загрязнение посторонними компонентами (посуда, атмосфера лабораторного помещения и т. д.) - изменение состава при взаимодействии с компонентами воздуха (кислород, углекислый газ, влага) - изменение состава при воздействии света Растворение пробы – без потерь: - вода - водные растворы кислот (или щелочей) CaCO3 + 2HCl CaCl2 + H2O + CO2 Al(OH)3↓ + KOH → K[Al(OH)4] - водные растворы комплексообразователей AgCl + 2NH3 [Ag(NH3)2]Cl - органические растворители (спирты, кетоны, эфиры, хлорорганика, углеводороды и др.) Озоление – медленное сожжение органических веществ с целью получения сухого остатка для его дальнейшего анализа (определение следов металлов) Минерализация – разложение органических соединений путем окисления в растворе кислотами-окислителями (смесь серной и азотной кислот) Маскирование – связывание ионов металлов в прочные комплексы, не мешающие определению компонента смеси Дериватизация – это получение производных анализируемого вещества, обладающих иными (лучшими с точки зрения используемого аналитического метода) аналитическими свойствами Разделение и концентрирование: • Цель: - разделение мешающих определению друг друга веществ - снижение предела обнаружения • Методы: - химические (осаждение и соосаждение) - физические (отгонка и выпаривание) - физико-химические (хроматография и экстракция) Kконц Сконц Сисх Vисх Vконц • Предел обнаружения (чувствительность) – наименьшее содержание определяемого иона (вещества), при котором можно его обнаружить действием данной реакции с достаточной достоверностью (вероятностью равной или стремящейся к единице). Различают: - концентрационный ПО (минимально определяемая концентрация Сmin, г/мл) - массовый ПО (открываемый минимум mmin, мкг) mmin = Cmin V 106 V – объём анализируемого раствора, мл - лимитирующий объём (предельное разбавление Vlim мл/г) Vlim = 1/Сmin мл/г Cmin = 10-4-10-5 г/мл (10-3-10-4 моль/л) При Cmin > 10-3 г/мл – концентрирование Аналитический сигнал как источник информации о качественном и количественном составе вещества • Аналитический сигнал (аналитические свойства) – определенные химические, физические или физикохимические свойства анализируемого вещества, позволяющие его обнаружить, измерить его количество и установить структуру этого вещества. • Аналитический сигнал (АС) зависит: - от природы вещества (качественный АС) - от содержания вещества в пробе (количественный АС) • АС характеризует качественный и количественный состав анализируемого вещества. В зависимости от характера аналитического сигнала методы химического анализа делят на 4 группы: 1) химические методы – используют химические реакции: В (вещество) + А (реагент) → С (продукт) • Качественный АС – внешний эффект реакции: - изменение окраски раствора - образование или растворение осадка - выделение газообразного продукта - характерная форма кристаллов • Количественный АС: - объём выделившегося газа: V(С) → n(C) = V(C)/VМ → n(B) - масса образовавшегося осадка: m(C) → n(C) = m(C)/М(С) → n(B) - объём раствора реагента с известной концентрацией: V(A) → n(A) = C(A)·V(A) → n(B) 2) физические методы и 3) физико-химические методы (инструментальные) используют физические и физико-химические свойства анализируемого вещества (спектральные, оптические, магнитные, электрохимические, сорбционные и др.) Метод анализа Качественный АС Количественный АС Фотометрия Длина волны поглощаемого ЭМИ (λ) Оптическая плотность (А = k∙C) Хроматография Время удерживания (tR) Площадь хроматографического пика (S = k∙C) Полярография Потенциал полуволны (E1/2) Диффузионный ток (Id = k∙C ) 4) биологические методы используют для анализа биологически активных веществ: - антибиотики анализируют по их способности останавливать рост микроорганизмов - сердечные гликозиды анализируют по их способности останавливать изолированное сердце лягушки. • Задачи АХ: - выявление АС (аналитических свойств вещества) - установление взаимосвязи АС с составом вещества - создание конкретной методики анализа • Аналитическая химия разрабатывает теоретические основы методов анализа. • Химический анализ является практическим применением аналитической химии. АХ ХА Скорость химической реакции и химическое равновесие • Скоростью химической реакции называется изменение концентрации веществ в ходе реакции в единицу времени: dC d A+ B C+D = k [A][B] - закон действующих масс (ЗДМ) k – константа скорости реакции – показывает скорость реакции при концентрации каждого реагента 1 моль/л k Ae Ea RT А – предэкспоненциальный множитель, зависящий от числа соударений реагирующих частиц Еа – энергия активации, Дж/моль R – универсальная газовая постоянная, 8,314 Дж/K моль Т – абсолютная температура, K k = 10-7 1011 • Для ускорения медленных реакций: - повышение температуры (нагревание) - катализаторы (уменьшение энергии активации Еа) A+ B C+D k [A][B] k [C][D] Тогда, в момент равновесия: и k[A][B] K k k k[C][D] [C][D] [A][B] • K – концентрационная константа равновесия зависит от: - температуры - природы реагирующих веществ - природы растворителя - ионной силы раствора K 0 aC aD C [C] D [D] aA aB A [A] B[B] [C][D] A B [A][B] C D K K0 - термодинамическая константа равновесия зависит от: - температуры - природы реагирующих веществ - природы растворителя не зависит от: - ионной силы раствора • Значения K0 – в химических справочниках • В разбавленных растворах при ci 0, I 0, γi K K0 1 ai = γi ci аi – активность иона , моль/л γi – коэффициент активности иона I n ci zi2 i 1 0,5 • Зная zi и I можно: - определить γi по специальным таблицам - рассчитать γi по уравнениям Дебая-Хюккеля (вода, 250С): lg i lg i 0,5 zi2 1 0,5zi2 • в разбавленных растворах c I при 0,01 I 0,1 I I при I 0, I 0,01 0, γ 1 иа=c • Если K 1, то реакция практически необратима. Если она протекает на 99,99%, то: [C][D] [A][B] K K • K 99,99 99,99 0,01 0,01 108 108 – реакция практически идет до конца 1 (K 10-8) – реакция практически не идет • В общем случае: аА + bB K0 c ad aC D a a ab A B или cC + dD K [C]c [D]d [A]a [B]b • Условная константа равновесия K [A] = (A) CA, [B] = (B) CB, [C] = (C) CC, [D] = (D) CD (А), (В), (С) и (D) – мольные доли реагентов (коэффициенты побочных реакций) CA, CB, CC и CD – их суммарные (общие) концентрации K [C]c [D]d [A]a [B]b K ' K CCc CDd αс (С)α d (D) CAa CBb α a (A)αb (B) CCc CDd CAa CBb K' K0 зависит от: - температуры, природы реагирующих веществ, природы растворителя, ионной силы раствора - других условий, приводящих к побочным реакциям (рН, комплексообразователи и др.) Cu2+ + S2CuS + H+ + Н+ HS H2S Суммарная (общая) концентрация сульфида в растворе: СS = [S2-] + [HS-] + [H2S] Мольная доля сульфид-иона: 22[S ] [S ] 2(S ) C [S2- ] [HS- ] [H S] S 2 [S2-] = CS (S2-) Тогда концентрационное произведение растворимости (KS): KS = [Cu2+][S2-] = [Cu2+] CS (S2-) = KS' (S2-) K S' KS α(S2- ) [Cu 2 ] CS - условное ПР