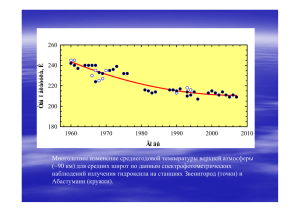
ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ЭКОЛОГИЮ Химия окружающей
реклама

ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ВОРОНЕЖСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ» ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ЭКОЛОГИЮ Часть I Химия окружающей среды Учебное пособие Составитель О.Н. Хохлова Издательско-полиграфический центр Воронежского государственного университета 2008 Утверждено научно-методическим советом химического факультета 6 марта 2008 г., протокол № 4 Рецензент В.Н. Попов Учебное пособие подготовлено на кафедре аналитической химии химического факультета Воронежского государственного университета. Рекомендуется для студентов 3–4 курсов химического факультета. Для специальности: 020101 – Химия 2 СОДЕРЖАНИЕ От составителя........................................................................................... 4 Введение ...................................................................................................... 5 1 Экосистема – основное понятие экологии ............................................. 8 2 Учение В.И. Вернадского о биосфере...................................................... 12 2.1 Строение биосферы.............................................................................. 13 2.2 Функции живого вещества в биосфере .............................................. 15 3 Основные законы экологии...................................................................... 16 3.1 Основные законы экологии Б. Коммонера ........................................ 16 3.2 Правила существования видов............................................................ 17 3.3 Реакции экосистем на внешнее воздействие ..................................... 18 4 Биогеохимические циклы химических элементов................................ 20 4.1 Цикл кислорода .................................................................................... 22 4.2 Цикл углерода....................................................................................... 24 4.3 Цикл азота ............................................................................................. 27 4.4 Цикл серы.............................................................................................. 32 4.5 Цикл фосфора ....................................................................................... 34 5 Химия атмосферы ...................................................................................... 36 5.1 Состав и строение атмосферы............................................................. 36 5.2 Функции атмосферы ............................................................................ 39 5.3 Некоторые химические реакции, протекающие в атмосфере .......... 39 6 Химия гидросферы...................................................................................... 48 6.1 Состав гидросферы ............................................................................... 48 6.2 Химия Мирового океана....................................................................... 50 6.3 Химия пресных вод ............................................................................... 53 7 Химия литосферы и почвы ....................................................................... 56 7.1 Строение и состав литосферы .............................................................. 56 7.2 Почва как внешний компонент литосферы......................................... 58 Заключение...................................................................................................... 66 Список литературы........................................................................................ 67 3 ОТ СОСТАВИТЕЛЯ Данная работа является первой в цикле учебных пособий под общим названием «Химическая экология». Изучение этой дисциплины студентами многопланово: на начальном этапе необходимо познание химии окружающей среды – качественного и количественного состава компонентов природной среды, естественных процессов превращения, накопления и транспорта веществ, протекающих в биосфере; на втором этапе необходимо познание антропогенного воздействия на окружающую среду – источников и результатов этого воздействия – нарушение экологической обстановки локального и глобального характера; на третьем этапе важно изучение основ мониторинга окружающей среды и методов ее охраны. Центральным моментом в этих разделах является химизм всех явлений и процессов в окружающей среде как в естественных условиях, так и под действием антропогенного фактора. Завершающим этапом изучения дисциплины является рассмотрение Человека не как источника воздействия на биосферу, а как вида, живущего в естественных условиях окружающей среды и подвергающегося воздействию неблагоприятной экологической обстановки. Каждому разделу посвящено отдельное учебное пособие. О.Н. Хохлова 4 ВВЕДЕНИЕ Экология (от гр. Оikos – дом, жилище, местопребывание и logos – слово, учение) – наука об отношениях организмов и образуемых ими сообществ между собой и окружающей средой. Экология – это раздел биологии, изучающий взаимосвязи между организмами и их средой обитания, о круговороте веществ в природе и потоках энергии, делающих возможной саму жизнь на Земле. Экология как наука сформировалась в середине ХIХ века, когда возникло понимание, что не только строение и развитие организмов, но и их взаимоотношения со средой обитания подчинены определенным закономерностям. Немецкий биолог Эрнст Геккель (1834–1919), который в 1866 г. в двухтомной монографии «Общая морфология организма», дал следующее определение этой науки: «Это познание экономики природы, одновременное исследование всех взаимоотношений живого с органическими и неорганическими компонентами среды, включая непременно неантагонистические и антагонистические взаимоотношения животных и растений, контактирующих друг с другом. Одним словом, экология – это наука, изучающая все сложные взаимосвязи и взаимоотношения в природе, рассматриваемые Дарвином как условия борьбы за существование». Э. Геккель относил экологию к биологическим наукам и наукам о природе, которые изучают все стороны жизни биологических организмов. В рамках биологии различают: – аутоэкологию, или собственную экологию, изучающую внутривидовые взаимосвязи; – синэкологию, которая рассматривает взаимоотношения организмов между собой (межвидовые взаимосвязи); – демэкологию, изучающую динамику популяций. Если в период своего возникновения экология изучала взаимоотношения организмов с окружающей средой и была составной частью биологии, то с середины ХХ века, в связи с усилившимся воздействием на природу, экология приобрела особое значение. Экология – наука об антропогенном воздействии на окружающую среду, научная основа рационального природопользования и охраны живых организмов. Главная задача современной экологии – изучение и прогнозирование антропогенных изменений в среде обитания, обоснование и разработка методов ее сохранения и улучшения в интересах человечества. Таким образом, говоря, например, об экологии Черного моря, можно подразумевать взаимосвязи живых организмов между собой и морской средой обитания, а можно подразумевать антропогенное воздействие (использование ресурсов моря, загрязнение и др.), его последствия, возможность избежания этих последствий (то есть охрана моря). 5 Современная экология охватывает чрезвычайно широкий круг вопросов и тесно переплетается с целым рядом смежных наук таких, как география, геология, физика, химия, генетика, математика, медицина, агрономия, архитектура. Приставка эко- появляется у многих естественных и общественных наук. Таким образом, современная экология – комплексная наука, имеющая большое практическое значение. Не будет преувеличением утверждение о том, что от прогресса этой науки, возможно, будет зависеть само существование человека. О месте химической экологии в иерархии экологических наук В рамках сочетания двух понятий «экология» и «химия», а также применимо к объектам исследования (особь, экосистема, биосфера) рассмотрим существующие научные дисциплины. Вещества, входящие в состав о р г а н и з м а , их структуру, распределение, превращение и функции изучает наука биохимия. С точки зрения биологии в рамках экосистемы существует понятие химической экологии – это наука о химических взаимоотношениях живых организмов между собой и с живой и неживой природой. Предмет химической экологии – это химизм и принципы взаимодействия животных и растительных организмов между собой и неорганической средой посредством взаимно перекрещивающегося действия различных молекул. Природные вещества в б и о с ф е р е , их превращение и транспорт в естественных условиях и под воздействием антропогенного фактора изучает экологическая химия. Однако иногда особо выделяют антропогенное химическое воздействие на процессы в биосфере посредством действия любых химических веществ – продуктов деятельности человека (например, СО2) и действия веществ не свойственных природе (например, пестициды) и называют этот раздел экологической химией, однако такое представление слишком узко. В настоящее время понятия «Химическая экология» и «Экологическая химия» в общественном и научном сознании отождествляются, но однозначного определения этой науки нет. Чаще всего биологическая составляющая химической экологии опускается, и под этими терминами подразумевается наука о процессах трансформации и миграции химических соединений природного и антропогенного происхождения в биосфере. На рисунке 1 схематически представлены области исследования химической, биологической и экологической наук и их взаимосвязь. 6 Рис. 1. Связь химических, биологических и экологических наук Роль химической экологии в общей системе экологических знаний и природоохранной деятельности возрастает по нескольким причинам: 1. Среди факторов, нарушающих природные равновесия, химические вещества различного происхождения имеют первостепенное значение. 2. Химические факторы более заметны и легче поддаются анализу, чем, например, изменения биологического или географического фактора. 3. Химическим методам и средствам (химической технологии) принадлежит ведущая роль в охране окружающей среды. Задачи химической экологии как любой науки – это описание, объяснение тех или иных процессов в системе и предсказание поведения системы в заданных условиях. В случае химической экологии объектом внимания является конкретная экосистема или биосфера в целом. Для этого необходимо: 1. Изучение естественных круговоротов веществ в природе и влияние на них антропогенного фактора. 2. Исследование закономерностей накопления, пространственновременного распределения и физико-химических превращений загрязнителей окружающей среды под действием различных природных факторов и антропогенного воздействия. 3. Разработка методов и средств анализа, мониторинга и защиты окружающей среды. 4. Создание научных основ для изменения старых и создания новых экологически чистых и ресурсосберегающих технологий. 5. Предсказание и предотвращение экологических кризисов на основе анализа человеческой деятельности в конкретном регионе или биосфере в целом. 7 В задачи химика-эколога, владеющего теоретическими основами экологической химии и методами анализа объектов окружающей среды, входит: 1. Выявление в результате химико-аналитического контроля конкретных действующих предприятий (технологических процессов), загрязняющих среду обитания. 2. Теоретическая оценка отрицательных последствий деятельности существующих производств и предсказание воздействия проектируемых предприятий на состояние окружающей среды. 3. Оптимизация технологических процессов с целью уменьшения вредного воздействия на окружающую среду за счет: – замены вредных веществ на менее вредные; – изменения отдельных этапов производства на более безопасные; – очистки от загрязняющих веществ выбросов в атмосферу, сточных вод и утилизации отходов производства. 1 ЭКОСИСТЕМА – ОСНОВНОЕ ПОНЯТИЕ ЭКОЛОГИИ Экология рассматривает взаимодействие живых организмов и неживой природы. Это взаимодействие, во-первых, происходит в рамках определенной системы (экологической системы), и, во-вторых, оно не хаотично, а определенным образом организовано, подчинено законам. Экосистема – единый природный комплекс, образованный живыми организмами и средой их обитания (атмосфера, почва, водоем и др.), в котором живые и косные компоненты связаны между собой обменом вещества и энергии. Термин «экосистема» ввел английский фитоцентолог А. Тенсли в 1935 г. Биотическая структура экосистемы – это совокупность организмов различных категорий, пути взаимодействия их между собой и окружающей средой. Схема биотической структуры экосистемы представлена на рисунке 2. Выделяют: Автотрофы – организмы, синтезирующие органические вещества из неорганических соединений с использованием энергии Солнца. Продуценты – комплексы автотрофных организмов, обеспечивающих органическими веществами, следовательно, и энергией все остальные организмы (растения и фотосинтезирующие бактерии). Гетеротрофы – организмы, питающиеся готовыми органическими веществами. Консументы – комплексы гетеротрофных организмов (животные, бесхлорофилльные растения). Первичные консументы – животные, которые питаются непосредственно продуцентами (например, кролик ест морковку) – растительноядные. Вторичные консументы – животные, которые питаются первичными консументами (лиса, питающаяся кроликом) – плотоядные. 8 Бывают консументы более высокого порядка, бывают виды животных, относящиеся к разным уровням (медведь ест малину – первичный консумент, медведь ест рыбу – вторичный консумент). Редуценты или деструкторы – комплексы организмов, разлагающих органические соединения до минерального состояния (бактерии, грибы, простейшие – редуценты, а также организмы, которые питаются мертвыми органическими веществами – грифы, раки, муравьи – детритофаги). Абиотическое окружение – весь комплекс неживой природы, откуда биоценоз черпает средства для существования и куда выделяет продукты обмена. Здесь же необходимо рассмотреть пищевые цепи. В биологической структуре экосистем к числу важнейших взаимоотношений между организмами относятся пищевые. Можно проследить бесчисленные пути вещества в экосистеме, при которых один организм поедается другим, тот третьим и т. д. Ряд таких звеньев называется пищевой цепью. Но в экологической системе практически все пищевые цепи соединены между собой и образуют сложную цепь пищевых взаимоотношений. Продуценты, первичные, вторичные и т. д. консументы и детритофаги – разные уровни этой общей сети. Эти уровни называют трофическими, что означает пищевые. Рис. 2. Биотическая структура экосистемы 9 Таким образом, экосистема – совокупность продуцентов, консументов и детритофагов, взаимодействующих друг с другом и с окружающей их средой посредством обмена веществом, энергией и информацией таким образом, что эта единая система сохраняет устойчивость в течение продолжительного времени. Таким образом, для естественной экосистемы характерны три признака: 1) экосистема обязательно представляет собой совокупность живых и неживых компонентов; 2) в рамках экосистемы осуществляется полный цикл, начиная с создания органического вещества и заканчивая его разложением на неорганические составляющие; 3) экосистема сохраняет устойчивость в течение некоторого времени, что обеспечивается определенной структурой биотических и абиотических компонентов. Понятие «экосистема» применяется к природным объектам различной сложности и размеров: океан или небольшой пруд, тайга или березовая роща, биосфера в целом. Более простые экосистемы входят в более сложно организованные. При этом реализуется иерархия организации систем, в данном случае экологических. Важным следствием иерархической организации экосистем является то, что по мере объединения компонентов в более крупные блоки, которые, в свою очередь, объединяются в системы, у этих новых функциональных единиц возникают новые свойства, отсутствовавшие на предыдущем уровне. Таким образом, устройство природы следует рассматривать как системное целое, состоящее из вложенных одна в другую экосистем, высшей из которых является уникальная глобальная экосистема – биосфера. В ее рамках происходит обмен энергией и веществом между всеми живыми и неживыми составляющими в масштабах планеты. В рамках экосистемы необходимо отметить влияние окружающей среды на организм, которое происходит в результате действия так называемых экологических факторов. Экологический фактор – любое условие среды, на которое живое реагирует приспособительными реакциями. Иначе – экологический фактор – это любой элемент среды, оказывающий прямое или косвенное влияние на живые организмы хотя бы на протяжении одной из фаз их развития. По своей природе экологические факторы делят по крайней мере на три группы: – абиотические факторы – влияния неживой природы; – биотические факторы – влияния живой природы. – антропогенные факторы – влияния, вызванные деятельностью человека. Нередко экологические факторы подвергают и более детальной классификации, когда надо указать на какую-то конкретную группу факторов. 10 Например, различают климатические (относящиеся к климату), эдафические (почвенные) факторы среды и др. Необходимо отметить, что все факторы действуют вместе. Экологические факторы определяют условия существования организмов. На рисунке 3 представлена общая схема экосистемы с биотической структурой, действующими экологическими факторами и потоками вещества, энергии и информации. Рис. 3. Структура экосистемы Часто термины «экосистема» и «биогеоценоз» употребляют как синонимы. Биогеоценоз – однородный участок земной поверхности с определенным составом живых (биоценоз) и косных (приземной слой атмосферы, солнечная энергия, почва и др.) компонентов и динамическим взаимодействием между ними (обмен веществом и энергией). Термин предложил В.Н. Сукачев в 1940 г. Биоценоз – совокупность растений, животных и микроорганизмов, населяющих данный участок суши или водоема, и характеризующийся определенными отношениями между собой и приспособленностью к условиям окружающей среды (например, биоценоз озера, леса). Биологический вид – совокупность популяций особей, способных к скрещиванию с образованием плодовитого потомства, обладающего рядом 11 общих морфофизиологических признаков, населяющих определенный ареал, обособленных от других нескрещиваемостью в природных условиях (например серый воробей). Популяция (от лат. populus – народ, население) – совокупность особей одного вида, длительно занимающих определенное пространство и воспроизводящая себя в течение большого числа поколений. Население одного вида на определенной территории. В современной биологии популяция рассматривается как элементарная единица процесса эволюции, способная реагировать на изменения среды перестройкой своего генофонда. Особь – наименьшая неделимая единица биологического вида. 2 УЧЕНИЕ В.И. ВЕРНАДСКОГО О БИОСФЕРЕ Биосфера – область активной жизни, охватывающая нижнюю часть атмосферы, гидросферу, и верхнюю часть литосферы. В биосфере живые организмы (живое вещество) и среда их обитания органически связаны и взаимодействуют друг с другом, образуя целостную динамическую систему. В 1803 г. Жан Батист Ламарк употребил этот термин, но его забыли. В 1875 г Эдуард Зюсс употребил и закрепил его в науке. В 1914 г. этот термин впервые использовал В.И. Вернадский. Учение о биосфере как об активной оболочке Земли, в которой совокупная деятельность живых организмов (в том числе и человека) проявляется как геохимический фактор планетарного масштаба и значения, создано В.И. Вернандским и изложено в книге «Биосфера» в 1926 г. Книга переведена на французский и английский языки. Существует множество определений Биосферы, отражающих по сути одно и тоже. Биосфера – сфера жизни всего живого и человека в том числе. Это лицо планеты, область существования живого вещества. Биосфера – область «жизни», пространство на поверхности земного шара, в котором обитают живые существа. Биосфера – это живая оболочка Земли, совокупность экосистем. Биосфера – тонкая оболочка Земли, состав, структура и энергетика которой в существенных чертах обусловлены прошлой или современной деятельностью живых организмов. Биосфера – глобальная единая система Земли, где весь основной ход геохимических и энергетических превращений определяется жизнью. Верхняя граница биосферы обусловливается лучистой энергией, убивающей все живое, то есть естественной верхней границей является озоновый экран, расположенный на расстоянии около 16 км от поверхности Земли на полюсах и 25 км над экватором. Но лишь тонкий слой тропосфе12 ры (менее 100 м над Землей) можно считать наполненным жизнью (Нет ни одного организма, который всегда бы жил в воздушной среде). Нижняя граница жизни в литосфере теоретически определяется высокой температуре. Температура 100 °С представляет непреодолимую преграду. Живые организмы в трещинах и нефтеносных скважинах могут встречаться на глубине до 3 км от земной поверхности. В морях предельная для жизни температура встречается на глубине около 10 км. До Вернадского большинство процессов, меняющих в течение геологического времени лик планеты, рассматривались как чисто физические, химические или физико-химические явления (размыв, растворение, осаждение, гидролиз и др.). Вернадский впервые создал учение о геологической роли живых организмов, показал, что деятельность живых существ является главным фактором преобразования земной коры. Участие каждого отдельного организма в геологической жизни Земли ничтожно мало. Однако живых существ на Земле бесконечно много (~107 видов и ~1030 индивидуумов (1979). Они, обладая высоким потенциалом размножения, активно взаимодействуют со средой обитания и, в конечном счете, представляют в совокупности особый глобальный фактор развития, преобразующий верхние оболочки Земли. В о з д у х , в о да, нефть, уголь, известняки, глины, сланцы, мрамор и гранит созданы живыми веществами планеты! С другой стороны, занимаясь созданной им биогеохимией, изучающей распределение химических элементов по поверхности планеты, Вернадский пришел к выводу, что нет практически ни одного элемента из таблицы Менделеева, который бы не включался бы в живое вещество. 2.1 Строение биосфеы Биосфера, являясь глобальной экосистемой (экосферой) как и любая экосистема, состоит из биотической и абиотической частей. Биотическая часть состоит из живых организмов таксонов, осуществляющих важнейшую функцию биосферы, без которой не может существовать сама жизнь: биогенный ток атомов. Абиотическая часть представлена: 1. Почвой и подстилающими ее породами до глубины, где еще есть живые организмы, вступающие в обмен с веществом этих пород, и физической средой порового пространства. 2. Атмосферным воздухом до высоты, на которой возможны еще проявления жизни. 3. Водной средой океанов, рек, озер и т. д. Биосферу слагают три категории субстанций: 1. Живое вещество – совокупность всех живых организмов: микроорганизмы, растения и животные, их активная биомасса. 13 Под живым веществом В.И. Вернадский понимает все количество живых организмов планеты как единое целое. Его химический состав подтверждает единство природы – он состоит из тех же элементов, что и неживая природа, только соотношение этих элементов различное и строение молекул другое. Общим свойством жизни является присутствие в живом веществе активных белковых молекул. С химической точки зрения, живое и биогенное вещество биосферы представлено спиртами, например, С2Н5ОН, жирными O кислотами СН3(CH2)nСООН, аминокислотами H2 N CH C OH , состав- R N N ляющими основу белка, пуринами , N H пиримидина- N CH2OH N ми H , сахарами H OH O . Последние являются составными H OH OH N H H OH частями нуклеиновых кислот, содержащихся в каждой клетке (дезоксирибонуклеиновые кислоты – ДНК – в ядре клетки и рибонуклеиновые – РНК – в цитоплазме). Из названных органических соединений образуются сложные молекулы углеводов, белков, жиров, и нуклеиновых кислот. 2. Биогенное вещество – мертвая органика, все формы детрита, а также биогенные горные породы, включая часть ископаемого топлива Биогенными элементами называют растворимые элементы, жизненно необходимые организмам. Макробиогенными элементами называют элементы, требующиеся организмам в сравнительно больших количествах. Микробиогенными элементами называют элементы и их соединения, которые хотя и необходимы для жизнедеятельности биосистем, но требуются в крайне малых количествах. Для растений, например, наиболее важны 10 микроэлементов: Fe, Mn, Cu, Zn, B, Si, Mo, Cl, Co, V. Для фотосинтеза необходимы: Fe, Mn, Cl, V. Для азотного обмена необходимы: Fe, Mо, В. Для других метаболических функций необходимы: Mn, В, Co, Cu, Si. Все эти элементы кроме бора необходимы и животным, кроме того им может требоваться Se, Cr, Ni, F, I, Sn. Между макро- и микроэлементами нельзя провести четкую границу, так же как и между различными группами организмов. 14 3. Биокосное вещество – смеси живого вещества и биогенных веществ с минеральными породами небиогенного происхождения (почва, илы, природные воды, газо- и нефтеносные сланцы, битумные пески, часть осадочных пород; сюда же можно отнести и земную атмосферу). Биогеохимические принципы Вернадского 1. Биогенная миграция химических элементов в биосфере всегда стремится к максимальному своему проявлению. Этот принцип в наши дни нарушен человеком. 2. Эволюция видов в ходе геологического времени, приводящая к созданию устойчивых в биосфере форм жизни, идет в направлении, усиливающем биогенную миграцию атомов. Этот принцип при антропогенном измельчении средних размеров особей биоты земли (лес сменяется лугом, крупные животные мелкими) начинает действовать аномально интенсивно. 3. Живое вещество находится в непрерывном химическом обмене с окружающей средой, создающейся и поддерживающейся не Земле космической энергией Солнца. Вследствие нарушения двух первых принципов космические воздействия из поддерживающих биосферу могут превратиться в разрушающие ее факторы. 2.2 Функции живого вещества в биосфере Газовая функция. Живые вещества постоянно обмениваются кислородом и углекислым газом с окружающей средой в процессе фотосинтеза и дыхания. Они строго контролируют концентрации О2 и СО2 оптимальные для всей современной биоты. Растения сыграли решающую роль в смене восстановительной среды на окислительную в геохимической эволюции планеты и формировании газового состава современной атмосферы. Концентрационная функция. Пропуская через свое тело большие объемы воздуха минеральных и органических веществ, живые организмы осуществляют биогенную миграцию и концентрирование химических элементов и их соединений. Это относится не только к биосинтезу органики, но и к таким явлениям, как строительство раковин и скелетов, образование коралловых островов, толщ осадочных известняков, месторождений серы, некоторых металлических руд и др. Ранние этапы биологической эволюции проходили в водной среде и организмы научились извлекать из разбавленного раствора необходимые для них вещества, многократно увеличивая их концентрацию в своем теле. Связывание и превращение солнечной энергии в энергию химических связей органических соединений. При сжигании, например, каменного угля высвобождается энергия, запасенная растительностью сотни миллионов лет назад. 15 Окислительно-восстановительная функция живого вещества тесно связана с биогенной миграцией элементов и концентрированием веществ. Многие вещества в природе устойчивы и не подвергаются окислению при обычных условиях, например, молекулярный азот – один из важнейших биогенных элементов. Но живые клетки располагают настолько эффективными катализаторами-ферментами, что способны осуществлять многие окислительно-восстановительные реакции в миллионы раз быстрее тех, что протекают в абиогенной среде. Таким образом, основные функции биосферы – средообразующая и средорегулирующая. Информационная функция живого вещества. Именно с появлением первых примитивных существ на планете появилась и активная («живая») информация, отличающаяся от той «мертвой» информации, которая является простым отражением структуры. Организмы оказались способными к получению информации путем соединения потока энергии с активной молекулярной структурой, играющей роль программы. Способность воспринимать, хранить и перерабатывать молекулярную информацию совершила опережающую эволюцию в природе и стала важнейшим экологическим системообразующим фактором (табл. 1). Таблица 1 Сравнительный анализ информационной функции живого вещества и научно-технического прогресса Информационная Скорость пеПериод Общий Носители скорость эволю- реработки инполной объем информации формации ции смены информаинфорции мации 15 Биота 10 бит 3.108 лет 0,1 бит/с 2,6.1034 бит/с или биосферы (пар ДНК) 1016 с Научно1015 бит 10 лет 3.106 бит/с 1016 бит/с технический или . прогресс 3 108 с 3 ОСНОВНЫЕ ЗАКОНЫ ЭКОЛОГИИ 3.1 Основные законы экологии Б. Коммонера (1971) 1. Все связано со всем. Вещество, энергия, информация и качество отдельных природных систем взаимосвязаны настолько, что любое изменение одного из этих факторов вызывает функциональные, структурные, качественные и количественные перемены всех систем и их иерархии. 16 2. Все должно куда-то деваться (следствие закона сохранения массы и энергии). Любая природная система может развиваться только за счет использования материально-энергетических и информационных возможностей окружающей среды. Абсолютно изолированное развитие не возможно. Теоретические и практические следствия: а) абсолютно безотходное производство невозможно (подобно созданию «вечного» двигателя). Реализуя это следствие, важно создавать малоотходные производства с малой ресурсоемкостью как на входе, так и на выходе. Идеальны циклические производства, когда отходы одних процессов служат сырьем для других, и организация захоронения неминуемых остатков, нейтрализация не устраняемых энергетических отходов; б) любая развитая биотическая система, используя и видоизменяя среду жизни, представляет потенциальную угрозу менее организованным системам. Поэтому в биосфере невозможно повторное зарождение жизни – она будет уничтожена существующими организмами. Следовательно, воздействуя на среду обитания, человек должен нейтрализовать эти воздействия, поскольку они могут оказаться разрушительными для природы и самого человека. 3. Природа «знает» лучше. Живая природа планеты несравненно совершеннее и умнее человеческой цивилизации, она более гармонична, эффективна и экономична, она гораздо лучше сбалансирована; потоки ее вещества и энергии регулируются с чрезвычайно высокой точностью. Пока мы не имеем абсолютно достоверной информации о механизмах и функциях природы, мы легко можем навредить природе, пытаясь ее улучшить. 4. Ничто не дается даром, или За все надо платить. Глобальная экосистема представляет собой единое целое, в рамках которого ничто не может быть объектом всеобщего улучшения; все, извлеченное в процессе человеческого труда, должно быть возмещено. 3.2 Правила существования видов – Правило взаимоприспособленности Мебиуса–Морозова. Виды в биоценозе приспособлены друг к другу настолько, что их сообщество составляет внутреннее устойчивое, но не единое и взаимно увязанное системное целое. – Закон соответствия условий среды генетической предопределенности организма. Вид организма может существовать до тех пор, пока окружающая его природная среда соответствует его генетическим возможностям приспособления этого вида к ее колебаниям и изменениям. 17 Резкое изменение среды жизни может привести к тому, что генетические возможности вида окажутся недостаточным и для приспособления к новым условиям жизни. – Принцип плотной упаковки Мак-Артура Виды в экосистеме используют возможности среды с минимальной конкуренцией между собой и с максимальной биологической продуктивностью, при этом пространство заполняется с максимальной полнотой. – Правило обязательности заполнения экологических ниш. Экологическая ниша – место в биогеоценозе, которое занимает вид, не конкурируя с другими видами за источник энергии. Экологическая ниша есть совокупность всех факторов среды, в пределах которых возможно существование вида в природе. Обычно экологические ниши заняты одним видом. Пустующая экологическая ниша всегда бывает естественно заполнена. Экологическая ниша как функциональное место вида в экосистеме позволяет форме, способной выработать новые приспособления, заполнить эту нишу. Некоторые ученые считают, что подтверждением этого правила служит появление СПИДа. За 10 лет до его появления было предсказано, что появится гриппоподобный вирус с высоким процентом летального исхода. Основанием для этого послужило то, что победа над многими инфекционными заболеваниями человека высвободила экологические ниши, которые обязательно должны быть заполнены. – Правило внутренней непротиворечивости. В естественных экосистемах деятельность входящих в них видов направлена на поддержание этих экосистем как среды собственного обитания. 3.3 Реакции экосистем на внешнее воздействие – При внешнем воздействии, выводящем систему из состояния устойчивого равновесия, это равновесие смещается в том направлении, при котором эффект внешнего воздействия ослабляется (Ле Шателье-Браун). – Слабые воздействия могут и не вызывать ответных реакций природной системы, но накопившись, они приведут к развитию бурного, непредсказуемого динамического процесса – кумулятивный эффект (Х. Боумен). – Явление, удаленное в пространстве и во времени, кажется (!) менее существенным (в природопользовании этот принцип особенно часто становится основой неверных практических действий). – Глобальный предел устойчивости биосферы по отношению к воздействиям, нарушающим ее равновесие, составляет 1 %. Закон лимитирующих факторов Ю. Либиха Жизненные возможности лимитируются экологическими факторами, количество и качество которых близко к необходимому экосистеме минимуму, снижение их ведет к гибели организма или деструкции экосистемы. 18 Даже единственный фактор за пределами зоны своего оптимума приводит к стрессовому состоянию организма, а в пределе – к его гибели. Такой фактор называют лимитирующим. Лимитирующий фактор – фактор среды, выходящий за пределы выносливости организма. Лимитирующий фактор ограничивает любое проявление жизнедеятельности организма. С помощью лимитирующих факторов регулируется состояние организмов и экосистем. Согласно закону минимума жизненные возможности организмов лимитируют те экологические факторы, количество и качество которых близки к необходимому организму или экосистеме минимуму. Ни один из факторов не действует в одиночку. Конечные состояния экосистемы – это всегда результат многочисленных взаимодействий различных биотических и абиотических условий. Графически закон лимитирующих факторов Либиха представлен на рисунке 4. Рис. 4. Графическое изображение Закона лимитирующих факторов Либиха Для каждого вида растений и животных существуют оптимум, стрессовые зоны и пределы устойчивости в отношении каждого фактора окружающей среды. Оптимум – диапазон, например температур, благоприятный для жизни вида – зона оптимума. Любой экологический фактор имеет определенные пределы положительного влияния на живые организмы. Зоны угнетения – стрессовые зоны – значение действующего фактора за пределами зоны оптимума до предела устойчивости, приводящее к стрессовому состоянию организма. 19 Предел толерантности (от лат. tolerantio – терпение) – предел устойчивости – диапазон экологического фактора между минимальным и максимальным значениями, в пределах которого возможна выживаемость организма. Закон толерантности Шелфорда. Существование вида определяется лимитирующими факторами, находящимися не только в минимуме, но и в максимуме. Закон толерантности расширяет закон минимума Либиха. Закон действия факторов Тинемана. Состав и структура экосистемы определяются тем фактором среды, который приближается к минимуму. Закон действия факторов расширяет закон минимума Либиха на всю экосистему. 4 БИОГЕОХИМИЧЕСКИЕ ЦИКЛЫ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Чтобы жизнь продолжала существовать, химические элементы должны постоянно циркулировать из внешней среды в живые организмы и обратно, переходя из протоплазмы одних организмов в усвояемую для других организмов форму. Таким образом, перемещения и превращения веществ и элементов в природе под действием биологических и геологических факторов, сопровождающиеся перераспределением энергии, поступающей от Солнца, образуют биогеохимические циклы. Существование биогеохимических циклов создает возможность для саморегуляции системы, что придает экосистеме устойчивость – постоянство процентного состава различных элементов в ней (гомеостаз). Механизмы, обеспечивающие восстановление равновесия в круговороте, возвращение элементов в круговорот, во многих случаях основаны на биологических процессах. Вещества в круговоротах постоянно трансформируются, перестраиваются, обмениваясь атомами, а сами атомы остаются неизменными. Выделяют большой или геологический (абиотический) круговорот веществ, в основе которого лежит процесс переноса минеральных соединений из одного места в другое в масштабах планеты. Около половины (!) падающей на Землю лучистой энергии расходуется на перемещение воздуха, выветривание горных пород, испарение воды, растворение минералов и т. д. Движение воды и ветра приводит к эрозии, транспорту, перераспределению, осаждению и накоплению механических и химических осадков на суше и в океане. В течение длительного времени образующиеся в море напластования могут возвращаться на сушу – и процессы возобновляются. 20 В основе малого или биологического (биотического) круговорота веществ в природе лежат процессы синтеза и разрушения органических соединений. Все организмы экосистемы связаны между собой и абиотическим окружением потоками вещества и энергии. В отличие от геологического, биологический круговорот характеризуется ничтожным количеством энергии. На создание органического вещества затрачивается всего около 1 % падающей на Землю лучистой энергии. Однако эта энергия, вовлеченная в биологический круговорот, совершает огромную работу по созиданию живого вещества. Большой и малый круговорот веществ составляют биогеохимические циклы элементов – это перемещения и превращения элементов через косную и органическую природу при активном участии живого вещества. Эти процессы обеспечивают жизнь и составляют одну из главных ее особенностей. Общая схема и взаимосвязь потоков в глобальном круговороте веществ представлена на рисунке 5. Атмосфера Геологический круговорот Биологический круговорот Растения Животные Микроорганизмы Литосфера Гидросфера Биосфера Рис. 5. Схема круговорота веществ в природе (биогеохимических циклов элементов) В каждом биогеохимическом цикле (то есть для каждого отдельного элемента) можно выделить два фонда: 1) резервный – большая масса медленно движущихся веществ, содержащих данный элемент, в основном в составе абиотического компонента; 2) обменный (подвижный) – меньший фонд, но более активный. Для него характерен быстрый обмен между организмами и их непосредственным окружением. Цикл представлен пищевой цепью и связан с резервным фондом. 21 Среди биогеохимических циклов элементов выделяют циклы двух типов: циклы газообразных веществ (I) и цикл осадочных веществ (II). Такое деление основано на проявлении склонности химических элементов образовывать газообразные соединения (С, О, N, S) и не газообразные вещества (Р, Са, Fe) в условиях Земли. Нарушения в циклах I типа могут быстро устраняться за счет крупных атмосферных или океанических (и тех и других) подвижных фондов. Циклы газообразных веществ с их громадными атмосферными фондами можно считать хорошо «забуференными», т. к. их способность возвращаться в исходное состояние велика. Самоконтроль циклов типа II затруднен, они легче нарушаются в результате местных перетрубаций, поскольку в этих циклах основная масса вещества сосредоточена в малоактивном резервном фонде. В связи с хозяйственной деятельностью человека и вовлечением в биосферный поток техногенных продуктов этой деятельности возникли проблемы, обусловленные нарушением природных биогеохимических циклов. Циклы некоторых элементов (например, азота, серы, фосфора, калия) стали природно-антропогенными, характеризующиеся значительной незамкнутостью. Некоторые же соединения и материалы, созданные человеком, например пластмассы, вообще не способны включаться в природные или природно-антропогенные циклы, т. к. не перерабатываются в экосистемах, загрязняя их. 4.1 Цикл кислорода Переоценить роль кислорода в природе сложно, поскольку это прежде всего, элемент, необходимый для дыхания всего живого, во-вторых, элемент, входящий в состав воды – вещества, необходимого для жизни на Земле, а в-третьих – элемент, активнейшим образом участвующий в процессах окисления на планете, и просто элемент, входящий в состав сложных веществ, в том числе живого органического вещества. Кислород в природе находится: – В а т м о с ф е р е в свободном (молекулярном и атомарном) виде, в виде озона, оксидов, кислородсодержащих анионов, растворенных в атмосферных осадках (например, СО32-). – Н а с у ш е в биомассе, в неживом веществе. – В в о д е – в Мировом океане – в составе воды, в растворенном виде (O2), в виде растворенных оксидов и кислородсодержащих анионов. – В г е о с ф е р е в гранитном слое и осадочной оболочке в виде оксидов и кислородсодержащих анионов. Необходимо отметить, что представить глобальный круговорот кислорода крайне сложно, поскольку, как указано выше, он входит в состав оксидов (вода, песок и др.), сложных неорганических (соли, минералы и др.) и органических (кислоты, альдегиды, спирты и др.) веществ, которые 22 включены в другие круговороты. Поэтому интересно проследить цикл образования и потребления молекулярного кислорода, который представлен на рисунке 6. Рис. 6. Схема образования и потребления молекулярного кислорода в биосфере Основной круговорот кислорода в природе осуществляется в результате жизнедеятельности живого вещества: с одной стороны, процесса фотосинтеза кислорода, с другой стороны, – дыхания, горения и других окислительных процессов. Лишь 25 % синтезируемого кислорода выделяется растительностью суши, а остальное количество – фотосинтезирующими организмами Мирового океана. 6СО2 + 6Н2О hn , хлорофилл ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ¾ ®6О2↑ + С6Н12О6 (1) Дыхание растений, животных, человека, выполнение микроорганизмами окислительных реакций расходует свободный кислород. Например, клеточное дыхание протекает согласно уравнению С6Н12О6 + 6О2 + 38 АДФ +38 Н3РО4 → 6СО2 + 6Н2О + 38АТФ (2) где АДФ – аденозиндифосфорная кислота, а АТФ – аденозинтрифосфорная кислота. Процессы окисления неорганических веществ представляются, например, реакцией 23 4Fe + 3O2 → 2Fe2O3, (3) а процесс горения, реакциями С + O2 → СО2, (4) С5Н12 + 8O2 → 5СО2 + 6Н2О (5) Процесс горения, как любая реакция окисления, потребляет кислород. Это происходит в результате природных пожаров, а особенно в результате антропогенной деятельности. Причем деятельность человека – сжигание топлива и др. окислительные процессы в промышленности и быту – являются неотъемлемой частью круговорота кислорода. Часть органического вещества, содержащего кислород, захоранивается, вследствие чего из годичного круговорота выводится часть кислорода в связанном виде. В 2000 г. с учетом всех видов расхода ежегодное потребление кислорода составило 210–230 млрд т (из них 2,6 млрд т в год на дыхание человечества, а 50 млрд т в год на промышленные, бытовые нужды и транспорт), тогда как вся фитосфера ежегодно продуцирует 240 млрд т этого газа. Влияние человека на круговорот кислорода в природе отражается в каждом пункте потребления кислорода, а из приведенных выше цифр виден масштаб использования кислорода в хозяйственной деятельности человека. Обращает на себя внимание тот факт, что процессов потребления кислорода много, а образования – только один – фотосинтез. 4.2 Цикл углерода Особенности углерода – способность образовывать одинарные, кратные связи, соединяться в цепи и циклы – сделали углерод основой органических соединений разнообразных по строению и свойствам. Углерод в природе находится: – В а т м о с ф е р е преимущественно в виде СО2, СО, растворенном в атмосферных осадках HCO3– . – Н а с у ш е преимущественно в виде живого органического вещества и органического вещества почв, карбонатов, гидрокарбонатов. – В в о д е – в Мировом океане – содержится «органический» углерод – в живых организмах, и «карбонатный» углерод – СО2, Н2СО3, HCO3– , CO32 – . – В г е о с ф е р е в виде ископаемого топлива (органический С), в кристаллических и вулканических породах (неорганический С, виде карбонатов, карбидов), сорбированного СО2, осадочных пород органического и неорганического происхождения. 24 Биологический круговорот углерода осуществляется благодаря четко отлаженному в ходе эволюции механизму функционирования двух фундаментальных процессов – фотосинтеза и клеточного дыхания. В процессе фотосинтеза (1) из углекислого газа и воды образуются органические вещества (прежде всего углеводы), а электромагнитная энергия Солнца переходит в энергию химических связей этих соединений. Ежегодный прирост биомассы в результате фотосинтеза составляет около 200 млрд т. Клеточное дыхание – противоположный фотосинтезу процесс (2), в котором расщепляются углеводы, и извлекается из них энергия, которая переводится в форму АТФ и далее используется на различные энергетические нужды клетки. В противоположность веществу, энергия не подчиняется закону цикличности. Для нормальной жизни и клетки, и отдельного организма, и экосистемы Солнце должно непрерывно поставлять на землю новые и новые порции энергии. Итак, солнечная энергия превращается в химическую энергию органических веществ растений, а от растений передается к животным. Глобальный круговорот углерода В глобальном круговороте углерода происходит: – растворение углекислого газа в Мировом океане и атмосферных осадках (над океаном (0,33 мг/л HCO3– ) и над сушей (10 мг/л HCO3– )); – водный сток углеродсодержащих веществ с суши в Мировой океан в виде HCO3– и органического вещества; – связывание углерода в виде карбонатов кальция (и магния) биохимически в живых организмах и химически с кальцием речных стоков. Особый интерес представляет движение масс углекислого газа в пределах биосферы. Содержание СО2 в различных резервуарах земного шара наглядно показывает роль каждого из них в глобальном цикле углерода: атмосфера / суша / океан / геосфера=1 / 3 / 50 / 10. Поскольку роль Мирового океана в круговороте углерода наибольшая (см. табл. 2), то ее следует рассмотреть особо. При этом необходимо учитывать: – что в пресной воде СО2 растворяется лучше, но на поверхности Земли пресных вод неизмеримо меньше, чем соленых; – растворимость СО2 уменьшается с возрастанием температуры; – при растворении углекислого газа в воде образуется слабая угольная кислота, которая диссоциирует ступенчато и образуется карбонатгидрокарбонатная система Н2О + СО2 ↔ Н2СО3, (6) Н2СО3 ↔ Н+ + HCO3– , (7) HCO3– ↔ Н+ + CO32 – . (8) 25 Схематичное движение масс СО2 следующее: углекислый газ активно растворяется в холодной воде приполярных районов океана; холодная вода имеет большую плотность, поэтому массы воды с повышенным содержанием СО2 опускаются на глубину Мирового океана и в виде мощных холодных течений перемещаются к экватору, они постепенно нагреваются, уменьшают плотность, поднимаются наверх и освобождаются от избытка углекислого газа. Таблица 2 Содержание углерода в Мировом океане в разных формах Содержание «Органический» Растворенный «Карбонатный» углерода углерод СО2 углерод Хим. форма (СН2О)n СО2 HCO3– Концентрация Содержание 1,5 мг/л растворенного 0,02 мг/л взвешенного 2,1.1012 т Сорг НСО3– 0,75 мл/л 143 мг/л 141.1012 т 38,6.1012 т Ск . 12 196 10 т НСО3– Таким образом, глобальная динамика масс углерода в биосфере определяется двумя крупными циклами массообмена. Первый из них обеспечивается ассимиляцией СО2 и Н2О путем фотосинтеза органического вещества и его последующего разложения с образованием СО2. Второй цикл обусловлен процессом поглощения и выделения углекислого газа природными водами при химическом взаимодействии СО2 и Н2О с образованием карбонат-гидрокарбонатной системы. Рис. 7. Схема превращения соединений углерода в океане 26 Оба цикла неразрывно связаны с деятельностью живого вещества. Характерной чертой двух главных циклов массообмена является их незамкнутость, и выведение из циклов некоторого количества углерода в форме неживого органического вещества и карбонатов металлов. Приведенная на рисунке 7 схема превращений соединений углерода в Океане лишь часть глобального круговорота углерода, левая часть этой схемы, в которой отражена роль живых организмов, характерна и для суши. Влияние человека на круговорот углерода в природе Масштабная добыча органического углеродного топлива приводит к уменьшению его запасов. Следствием сжигания органического углеродного топлива является выделение большого количества СО2 и СО в атмосферу. Синтез полимерных материалов, не перерабатываемых природой, приводит к выведению углерода из круговорота и загрязнение окружающей среды. Вырубка лесов и распахивание почв, строительство городов и т. д. ведет к изменению количества и нарушению кругооборота растительной биомассы суши и, как следствие, к нарушению баланса поглощаемого СО2 и выделяемого О2. 4.3 Цикл азота Азот в биосфере находится – В атмосфере в молекулярном виде, в виде оксидов, в составе сложных анионов. – На суше в живом веществе по разным оценкам 0,6–3 % сухой биомассы в составе белков и нуклеиновых кислот. – В воде – в Мировом океане – в растворенном виде, в составе ионов NH +4 , NO 2– , NO3– , в живых организмах, в мертвом органическом веществе. – В геосфере в гранитном слое и осадочной оболочке в виде солей + NH 4 , NO 2– , NO3– . Цикл азота служит примером сложного и хорошо забуференного круговорота газообразных веществ, способного к быстрой саморегуляции. Азот – важнейший компонент белков и нуклеиновых кислот, но растения не могут брать его непосредственно из атмосферы, т.к. способны усваивать лишь связанный с кислородом или водородом азот, то есть переведенный в ионы аммония или нитрат-ионы. На рисунке 8 схематически представлено превращение азота в результате биохимических превращений. 27 Рис. 8. Схема превращений азота в биотическом круговороте Азофиксация – биологическая фиксация азота – процесс связывания атмосферного азота некоторыми свободноживущими и симбиотическими бактериями-азофиксаторами. Азофиксирующей способностью обладают свободноживущие бактерии, например, рода Azotobacter, клубеньковые бактерии бобовых растений, например, род Rhizobium. Установлено, что сине-зеленые водоросли Anabena, Nostok, многие водные и почвенные бактерии, примитивные грибы (актиномицеты) в клубеньках ольхи и других деревьев также обладают этим свойством (всего около 160 видов). Биологическая фиксация азота идет в автотрофном и гетеротрофном ярусах экосистем, в аэробных и анаэробных условиях. Один квадратный метр, засеянный бобовыми (например, соей), обеспечивает фиксацию 10–30 г азота в год. Активность фермента нитрогеназы, «обслуживающей» у бактерий фиксацию азота, зависит от присутствия микроэлемента молибдена. Для расщепления молекулы азота бактериям необходимо большое количество энергии на разрыв тройной связи N≡N. Бактерии в клубеньках бобовых расходуют на фиксацию 1 г атмосферного азота около 10 г глюкозы (примерно 167,5 кДж), синтезируемой растениями на свету. При промышленной фиксации азота для получения NH3 также расходуется много энергии горючих ископаемых, поэтому азотные удобрения стоят дороже других. Фотосинтез – процесс образования растениями кислорода и органических соединений из углекислого газа и воды под действием солнечного излучения требует питательных веществ, в их числе и азота, для жизнедеятельности растений. Азот в виде ионов аммония или нитрат-ионов поглощается растениями, а затем проходит по всей пищевой цепи и в виде детрита и мочевины (NH2)2CO попадает к редуцентам. Часть редуцентов спо28 собна переводить этот азот в ионы аммония, которые вновь используют растения. Аммонификация – процесс разложения органических веществ, протекающий с участием специфических аммонифицирующих микроорганизмов и ведущий к образованию NH3, NH4+. Распад наиболее сложных высокомолекулярных азотсодержащих органических веществ – белков идет в несколько стадий. I. Расщепление белков до аминокислот микроорганизмами, вырабатывающими ферменты протеазы белки → пептоны → полипептиды → аминокислоты II. Разложение аминокислот бактериями, актиномицетами, грибами как в аэробных, так и в анаэробных условиях RCHNH2COOH + O2 → RCOOH + NH3 + CO2 RCHNH2COOH + H2O → RCНOHCOOH + NH3 (9) (10) Аммонификация – первая стадия минерализации азотосодержащих органических соединений. При аммонификации могут образовываться также сероводород H2S, индол C8H7N, скатол C9H9N, этилмеркаптан C2H5SH и др. Все эти вещества обладают неприятным резким запахом, поэтому распад белков часто называют гниением. В результате белкового обмена в организмах животных выделяется мочевина СО(NH2)2, которая тоже служит источником NH3: СО(NH2)2 + Н2О → 2NH3 + CO2 (11) Ион NH +4 усваивается растениями, вовлекается в процессы гумификации, частично фиксируется, а также подвергается нитрификации. Он может быть поглощен в почвенном комплексе или необменно фиксирован тройными глинистыми минералами. Содержание фиксированного аммония в почвах меняется от 1–2 до 10–12 ммоль-экв / 100 г почвы. Нитрификация – окисление аммиака до нитратов и нитритов при участии нитрифицирующих бактерий. Этот процесс протекает в два этапа: I. NH3 → NH2ОН → Н2N2О2 → НNО2 (аммиак → гидроксиламин → гипонитриты → нитриты) при участии бактерий Nitrosomonas суммарно: 2NH3 + 3O2 → 2HNO2 + 2H2O + Q 29 (12) II. При участии бактерий Nitrobacter 2HNO2 + О2 → 2HNO3+Q (13) Реакции нитрификации идут с выделением энергии, которую бактерии используют для своей жизнедеятельности, то есть они являются хемоавтотрофами. Образовавшиеся при нитрификации нитриты и нитраты могут быть потенциальным источником кислорода в анаэробных условиях. Нитрификация протекает в почвах в окислительных условиях при величине окислительно-восстановительного потенциала около 0,4–0,5 В. Нитрат-ион частично вымывается, поглощается растениями, подвергается денитрификации, замыкая биогеохимический цикл азота. Денитрификация – процесс восстановления нитрат-ионов до молекулярного азота, осуществляемый почвенными анаэробными бактериямиденитрофикаторами (например, род Pseudomonas или Micrococus) NO3 → NO2 → NO → N2O →N2. Денитрификация протекает с потреблением энергии за счет жизнедеятельности бактерий. Безазотистые органические вещества окисляются за счет нитратов и нитритов, которые при этом восстанавливаются до газообразного азота, вновь поступающего в атмосферу 5Сорг + 4КNО3 → 2N2 + 2К2СО3 + 3СО2 (14) или 5[CH2O] + 4NO3– + 4H+ → 2N2 + 5CO2 + 7H2O (15) где Сорг и [CH2O] означает органическое вещество. Реакция денитрификации, замыкающая цикл азота, показывает, как молекулярный азот возвращается в атмосферу. Необходимо отметить энергетические взаимоотношения между компонентами круговорота азота, необходимые для его осуществления. Ступенчатый процесс разложения белков до нитратов служит источником энергии для организмов, осуществляющих это разложение. А обратный процесс требует других источников энергии, таких как органическое вещество или солнечный свет. Следует подчеркнуть, что фиксация азота требует особо больших затрат энергии, т. к. много ее идет на разрыв тройной связи в молекуле N2, чтобы с добавлением водорода из воды произошло превращение в две молекулы аммиака. В процессах превращения: 30 выделение энергии -----------------------------------------------------------------------→ Протоплазма – аминокислоты – аммиак – нитрит – нитрат ←----------------------------------------------------------------------поглощение энергии справа налево требуются затраты энергии, слева направо выделяется энергия. Наибольший биологический круговорот азота происходит в Океане. Однако отличительной особенностью от круговорота на суше является то, что в воде уже имеются растворенные ионы NH +4 , NO 2– , NO3– , способные усваиваться организмами, поэтому не требуется предварительной азофиксации молекулярного азота. Ежегодно в глобальном круговороте биотическим сообществом усваивается около 109 т азота. При этом 80 % его поступает с суши и воды и лишь около 20 % добавляется «нового» азота из атмосферы. Глобальный круговорот азота Основные потоки азота в глобальном круговороте можно представить следующим образом: – Обмен азотом между атмосферой и почвой осуществляется в результате азофиксации и денитрификации, выпадения азотосодержащих атмосферных осадков и поступления с вулканическими газами. – В водоемы соединения азота поступают с суши – с поверхностным и дренажным стоком с городских и сельских территорий; с подземными водами; с городскими и промышленными стоками; со сточными водами сельскохозяйственных производств; из атмосферы – с кислотными осадками. – Количество азота, попадающего в донные осадки и выключающегося из круговорота, малое. Рис. 9. Схема превращений соединений азота в Океане 31 В масштабе биосферы, благодаря механизмам обратной связи и большому резервному фонду, круговорот азота относительно совершенен. На рисунке 9 схематически представлена часть круговорота азота – превращения в Океане однако, левая часть схемы, отражающая участие живых организмов, характерна и для суши. Влияние человека на круговорот азота в природе Наиболее значительное изменение в структуре глобального массобмена азота связано с индустриальной фиксацией молекулярного азота из атмосферы, производством на этой основе азотных удобрений и внесение их в почву. Кроме того, значительное количество оксидов азота поступает в атмосферу с выбросами промышленных предприятий и транспорта и в гидросферу с бытовыми и промышленными стоками. 4.4 Цикл серы Сера в природе находится в – В а т м о с ф е р е в виде оксидов, сероводорода, растворенного SO 2– 4 атмосферных осадках, летучих органических производных серы. – Н а с у ш е в биомассе 8,5.109 т S в составе серосодержащих белковых веществ, в неживом веществе – 0,5 % сухой биомассы. – В в о д е – в мировом океане – в растворенном виде (в виде сульфатов) 1,2.1015 т S, в фотосинтетиках океана 0,07.109т S, в консументах океана 0,05.109т S. – В г е о с ф е р е в гранитном слое (8,5.1015 т S) и осадочной оболочке (9,3.1015 т S) в виде сульфидов и сульфатов, причем сульфидов больше, чем сульфатов (0,064 и 0,04 %, соответственно, в гранитном слое). В биосфере серы имеется больше, чем ее могло быть извлечено из гранитного слоя континентального блока земной коры даже при полном его разрушении. Распределение масс серы в биосфере свидетельствует, что эти массы не выщелочены из гранитного слоя при его выветривании, а принесены в биосферу в результате дегазации мантии, то есть с вулканическими газами в виде SO2 и H2S. Основные черты биогеохимического круговорота серы: 1) обширный резервный фонд в почве и отложениях и меньший – в атмосфере; 2) ключевая роль в быстро обменивающемся фонде принадлежит специализированным микроорганизмам; 3) взаимодействие геохимических и метеорологических процессов (дождь, эрозия, осадкообразование, выщелачивание) с сугубо биологическими процессами (продукция и разложение). Геохимический круговорот серы Общая схема геохимического превращения серы представлена на рисунке 10. 32 Рис. 10. Схема превращений соединений серы в биогеохимическом цикле: химические реакции (16–20) – см. ниже Действие воды и углекислого газа на расположенные близко к поверхности земли сульфиды привело к постепенному превращению их в углекислые соли и выделению сероводорода, например, по реакции CaS + CO2 + H2O → CaCO3 + H2S + 19 ккал (16) Взаимодействуя с кислородом, а также под влиянием тиобактерий сероводород окисляется до свободной серы 2H2S + O2 → 2H2O + 2S + 126 ккал (17) При недостатке кислорода сера накапливалась, образуя залежи, а при избытке кислорода воздуха постепенно превращалась в серную кислоту: 2S + 3O2 + 2H2O → 2H2SO4 (18) Образованная серная кислота, реагируя с различными солями, содержащимися в почве или воде, превращалась в сульфаты CaCO3 + H2SO4 → CaSO4 + CO2 + H2O (19) Наряду с окислительными процессами, в цикле участвуют и восстановительные процессы, ведущие к переводу серной кислоты в сероводород. В частности, сульфаты, уносимые водами рек в моря, образовывали пласты, которые в результате геологических смещений земной коры попадали в более глубокие слои Земли. Здесь под влиянием повышенных температур они реагировали с увлеченными при осаждении органическими веществами, образуя сероводород по схеме CaSO4 + CH4 → CaS + CO2 + 2H2O → CaCO3 + H2S + H2O (20) Получившийся сероводород выходит на поверхность земли либо прямо в газообразном состоянии, либо предварительно растворившись в под33 земных водах. Восстановление сульфатов до сульфидов происходит под влиянием бактерий при разложении органических веществ под слоем воды. Другой восстановительный путь проходят сульфаты, содержащиеся в почве в результате вовлечения в биологический круговорот. Биологический круговорот серы Извлекаемые из почвы растениями сульфаты претерпевают сложные химические превращения, в результате которых образуются серосодержащие белковые вещества. Последние часто усваиваются животными, а после отмирания животных и растений разлагаются микроорганизмами, при этом сера в виде сероводорода возвращается в круговорот. Влияние человека на круговорот серы в природе В результате антропогенной деятельности дополнительно к природным процессам сульфиды переводятся в сульфаты при производстве серной кислоты и выплавки металлов из сульфидных руд. Основной техногенный поток серы в атмосферу связан с эмиссией сернистых газов при сжигании минерального топлива и выплавке металлов. Главными путями загрязнения природных вод растворимыми соединениями серы является смыв удобрений и сточные воды предприятий химической, горной и металлургической промышленности. Однако техногенные выбросы соединений серы в окружающую среду не нарушают баланса масс, мигрирующих в глобальном цикле серы. В то же время соединения серы в индустриальных и бытовых отходах оказывают губительное воздействие на биоту обширных регионов, создавая опасность для нормального функционирования этого самого главного звена биосферы. 4.5 Цикл фосфора Важное значение фосфора в биосфере обусловлено тем, что без этого элемента невозможен синтез белков. Экзотермическая реакция аденозинтрифосфата с фотосинтезированными углеводами обеспечивает энергией последующие биохимические реакции. Наряду с углеродом, кислородом, водородом, азотом и серой, фосфор является элементом, необходимым для существования живого вещества, а его количество часто определяет биомассу планеты и ее продуктивность. По различным оценкам ученых соотношение азота и фосфора равно 1,5 : 1 или 2 : 1, то есть фосфора меньше и именно он лимитирует массу живого вещества. В биосфере фосфор находится: – В а т м о с ф е р е – практически нет. – Н а с у ш е в биомассе 5 · 109 т, в неживом веществе 4,7 · 109 т в виде АТФ, АДФ, фосфатов, гидрофосфатов и др. – В воде – в мировом океане – в биомассе фотосинтетиков (0,03–0,04 · 109 т Р) и в других органических соединениях в виде АТФ, 2(15 · 109 т Р). АДФ, растворенные ионы – PO3– 4 , HPO 4 , и др. – В г е о с ф е р е в гранитном слое и осадочной оболочке (6,33.1015 т Р). 34 Таким образом, резервуаром фосфора служит не атмосфера, а горные породы и другие отложения, образовавшиеся в прошлые геологические эпохи. Круговорот фосфора – пример более простого осадочного цикла с менее совершенной саморегуляцией. Для глобального цикла фосфора определяющее значение имеет миграция элемента в тесно связанных системах биологического круговорота и континентального стока. Для биологического круговорота важно, что фосфор в почве находится в усваиваемой растениями форме – в виде фосфатов, поэтому он легко усваивается продуцентами и проходит по всей пищевой цепи. Образующееся мертвое органическое вещество разлагается бактериями, и фосфор возвращается в круговорот в виде фосфатов. Фосфор, как и азот, значительно активнее участвует в биологическом круговороте в океане, чем на суше. В океане в биологический круговорот фотосинтетиков ежегодно вовлекается 1210.106 т фосфора, а на суше, с учетом сельскохозяйственных культур, – 345.106 т. Причем, несмотря на низкую растворимость, фосфор долго задерживается в океане благодаря деятельности живых организмов, стремящихся не выпускать этот дефицитный элемент из пищевых цепей. Геохимический круговорот фосфора Поскольку резервуаром фосфора служат горные породы, то поступление фосфора в океан обеспечивается континентальным стоком. В нем фосфор находится в составе комплексных анионов, дисперсного органического вещества и минеральных взвесей. Необходимо отметить, что с веществом в океан выносится в 10 раз меньше фосфора, чем аналогичной формы азота. Несмотря на небольшие массы, эти формы обладают большой реакционной способностью и образуют основной резерв для использования в биологическом круговороте. Ветровой вынос фосфора с континентов существенного значения в балансе не имеет. Следует отметить, что эта масса представляет собой прочносвязанный фосфор. Перенос фосфора из океана на сушу через атмосферу в форме аэрозолей незначителен и не может компенсировать вынос элемента с водным стоком с суши в океан. Медленное, но непрекращающееся осаждение фосфора в океане неуклонно выводит его из миграционных циклов. Выведение масс фосфора в осадочные толщи ориентировочно составляет 2-10.106 т/год. Глобальный цикл фосфора является наименее замкнутым по сравнению со всеми ранее рассмотренными элементами. Характерная особенность глобального цикла фосфора – отсутствие постоянно действующего геохимического потока, возвращающего крупные массы элемента на сушу. Прогрессирующая потеря фосфора континентами может быть восполнена только поступлением в зону гипергенеза осадочных пород, в которых был аккумулирован элемент (гипергенез – совокупность процессов физикохимического преобразования пород в верхних частях земной коры и на ее 35 поверхности под действием атмосферы, гидросферы и живых организмов при низких температурах). Учитывая длительный период его выведения из океана (десятки миллионов лет), можно предполагать, что функционирование глобального цикла фосфора поддерживается тектоническими процессами, перемещающими обогащенные фосфором осадочные породы в зону выветривания. Влияние человека на круговорот фосфора в природе Влияние антропогенного фактора на цикл фосфора складывается: 1. Добычи 1– млн т/год фосфорсодержащих пород, причем, после использования в различных областях человеческой деятельности большая часть этого фосфора выключается из круговорота. 2. Внесения в почву фосфорных удобрений 14.106 тР/год, значительная часть которых смывается и служит главным источником эвтрофикации озер и мелководных прибрежных участков эпиконтинентальных морей. 3. Рыболовства, в результате которого на сушу возвращается около 6000 т/год элементарного фосфора. 4. Загрязнения окружающей природной среды соединениями фосфора в составе промышленных и бытовых стоков. 5 ХИМИЯ АТМОСФЕРЫ Атмосфера – газовая оболочка Земли, связанная с ней силой тяжести и принимающая участие в ее суточном и годовом вращении. Атмосфера – это смесь молекулярных, диссоциированных и ионизированных газов, находящихся на различных высотах, между которыми происходят постоянные реакции, обусловливающие возникновение как более легких, так и тяжелых частиц. Все это приводит к «перемешиванию» атмосферы и к постоянству ее основного состава. Параметры атмосферы: масса 5,15.1015 т, высота – 50–55 км – стратосфера, 2000–3000 км – экзосфера. Роль атмосферы на планете переоценить трудно: человек ежедневно потребляет 12–15 кг воздуха, вдыхая ежеминутно 5–100 л, может прожить без воздуха ~5 минут. 5.1 Состав и строение атмосферы О б щ и й с о с т а в атмосферы почти одинаков по всей Земле в результате высокой степени перемешивания в пределах атмосферы. В горизонтальном направлении перемешивание осуществляется благодаря вращению Земли. Вертикальное перемешивание в основном является результатом нагревания поверхности Земли приходящим солнечным излучением. Однако по х и м и ч е с к о м у с о с т а в у (табл. 3) вся атмосфера Земли подразделяется на нижнюю – гомосферу (до 100 км), имеющую состав, сходный с приземным воздухом, и верхнюю – гетеросферу, неоднородно36 го химического состава. Гетеросфера находится настолько высоко (сотни километров), что давление здесь крайне низкое. Граница, которая разделяет эти две части, называется турбопаузой. П о ф и з и ч е с к и м с в о й с т в а м атмосфера имеет ярко выраженное слоистое строение (рисунок 11) и подразделяется на несколько сфер: Рис.11. Строение атмосферы Тропосфера – это нижняя часть атмосферы, в которой сосредоточено более 75 % массы всей атмосферы (5.1018 кг). Ее высота определяется интенсивностью вертикальных (восходящих или нисходящих) потоков воздуха, вызванных нагреванием земной поверхности. Поэтому на экваторе она простирается до высоты 16–18 км, в умеренных широтах – до 10–11 км, а на полюсах – до 8 км. Отмечено закономерное понижение температуры воздуха с высотой – в среднем на 0,6 °С на каждые 100 м. Высота 11,8 км принимается за среднюю границу тропосферы, называемую тропопаузой, которая находится на экваторе на высоте 16–18 км, над умеренными широтами – до 10–12 км, а на полюсах – 8–10 км. 37 Стратосфера – располагается выше тропосферы до высоты 50–55 км. В стратосфере находится 20 % всей массы атмосферы. Температура у ее верхней границы повышается, что связано с наличием здесь пояса озона на высотах 20–30 км в зависимости от широты. Наличие озонового слоя имеет исключительное значение для живых организмов Земли. Мезосфера – верхняя граница этого слоя располагается до высоты 80 км. Главная ее особенность – резкое понижение температуры до – 75–90 °С у ее верхней границы. Здесь фиксируются серебристые облака, состоящие из ледяных кристаллов. Верхней границей мезосферы является мезопауза, в зоне которой температура достигает ~190 К (–83 °С). Ионосфера (термосфера) – располагается до высоты 800 км, для нее характерно значительное повышение температуры (более 1000 °С). Под действием ультрафиолетового излучения Солнца газы находятся в ионизированном состоянии. С ионизацией газов связано свечение газов и возникновение полярных сияний. Ионосфера обладает способностью многократно отражать радиоволны, что обеспечивает дальнюю радиосвязь на Земле. Экзосфера – располагается выше 800 км и простирается до 2000–3000 км. Здесь температура превышает 2000 °С. Скорость движения газов приближается к критической величине 11,2 км/с. Господствуют атомы водорода и гелия, которые образуют вокруг Земли корону, простирающуюся до высоты 20 тыс. км. Необходимо отметить следующее: во-первых, наиболее полно изучен сегодня нижний слой атмосферы – тропосфера. Во-вторых, совершенствование методов газового анализа может привести к обнаружению дополнительных, до сих пор неизвестных компонентов воздуха. В-третьих, основные составные части атмосферы следует разделить на группы: постоянные, переменные и случайные. К первой относят кислород, азот и инертные газы, содержание этих составных частей практически не зависит от того, в каком месте взята проба воздуха. Ко второй группе относят углекислый газ и водяной пар. К третьей группе относятся случайные ком38 поненты, определенные местными условиями (например, около металлургических комбинатов – диоксид серы, в местах разложения органических соединений – аммиак). 5.2 Функции атмосферы – Дыхательная функция – атмосфера содержит кислород, который необходим для дыхания всего живого на планете. – Теплорегулирующая функция – газовая оболочка предохраняет Землю от чрезмерного остывания и нагревания. Лучистая энергия Солнца частично поглощается атмосферой. Достигшая поверхности Земли энергия частично поглощается почвой и водоемами, а частично отражается в атмосферу. Если бы Земля не была окружена газовой оболочкой, то в течение одних суток амплитуда колебаний температуры достигла бы 200 °С (–100 – +100 °С). Еще больше была бы разница между зимними и летними температурами. Сейчас средняя температура на Земле составляет ~15 °С. – Распределение света – воздух атмосферы разбивает солнечные лучи на миллион мелких лучей, рассеивает их и создает то равномерное освещение, к которому мы привыкли. Наличие воздушной оболочки придает нашему небу голубой цвет, т. к. молекулы основных элементов и примесей воздуха рассеивают лучи с короткой длиной волны, то есть фиолетовые, синие и голубые. По мере удаления от Земли, а следовательно, и уменьшения плотности и загрязнения воздуха, цвет неба становится темнее, воздушная оболочка приобретает густо-синюю, а в стратосфере черно-фиолетовую окраску. – Защитная функция – газовая оболочка спасает все живое на Земле от губительных ультрафиолетовых, рентгеновских и космических лучей. Верхние слои атмосферы частично поглощают, частично рассеивают эти лучи. Атмосфера защищает нас от крупных и мелких метеоритов, которые под влиянием земного притяжения с огромной скоростью (от 11 до 64 км/с) врезаются в атмосферу планеты, раскаляются там в результате трения о воздух и на высоте около 60–70 км по большей части сгорают. – Обеспечивает звукопроводимость – наличие воздуха обеспечивает распространение звука. Без атмосферы не Земле царила бы тишина, не возможна была бы даже человеческая речь. 5.3 Некоторые химические реакции, протекающие в атмосфере Верхние слои атмосферы – мезосфера и стратосфера – служат первым барьером, защищающим нашу планету от потока лучей и частиц с высокой энергией. Защита основана на том, что молекулы и атомы этих зон как бы ловят губительные для живого космические, солнечные лучи и частицы. При этом они сами подвергаются химическим превращениям. 39 Реакции, обусловливающие защитные свойства атмосферы Фотодиссоциация – это диссоциация молекул с образованием свободных радикалов в результате поглощения фотона – нейтральной элементарной частицы, переносчика электромагнитного излучения. Фотон способен произвести химическое воздействие на встретивщуюся ему молекулу или атом только в том случае, если обладает достаточной энергией. Например, для фотодиссоциации молекул кислорода О2 + hυ → 2О* (21) требуется поглощение фотона с энергией больше 495 кДж/моль. Другой пример – фотодиссоциация воды Н2О+ hυ → Н* + *ОН (22) *ОН + hυ → Н* + О (23) Эти процессы очень важны, т. к. используют интенсивное ультрафиолетовое излучение Солнца, которое, достигая поверхности Земли, может губительно действовать на живые организмы. Хотя в верхних слоях воды очень мало, она, тем не менее, вносит свой вклад в защитные функции атмосферы. Образующийся гидроксильный радикал *ОН обладает высокой активностью и способствует очищению атмосферы, поскольку играет роль детергента, превращающего сложные органические и минеральные загрязнители в растворимые вещества, которые легко удаляются из атмосферы с осадками. Этот радикал взаимодействует практически со всеми соединениями в атмосфере. Правда, очищая атмосферу, он становится повинным в губительных для подстилающей поверхности кислотных дождях. Ионизация – образование ионов из молекул и атомов под действием солнечного излучения (фотоионизация), в меньшей мере – под действием потоков электронов и протонов, идущих от Солнца. N2 + hυ → N2+ + e– (24) O2 + hυ → O2+ + e– (25) O + hυ → O+ + e– (26) NO + hυ → NO+ + e– (27) Реакции ионов в атмосфере Диссоциативная рекомбинация – реакция иона с электроном с образованием нейтральной молекулы, которая в разреженных условиях верхней атмосферы быстро диссоциирует N2++e→N2→N+N 40 (28) O2++e→O2→O+O (29) NO++e→NO→N+O (30) Перенос заряда – реакции молекулярного иона с нейтральной частицей, сопровождающиеся переносом электрона. Такая реакция идет только в том случае, если энергия ионизации молекулы, теряющей электрон, меньше энергии ионизации молекулы, образующейся в результате переноса заряда, например: N +2 + O2 → N2 + O +2 (31) O+ + O2 → O + O +2 (32) Реакции обмена, которые в отличие от предыдущих процессов сопровождаются разрывом химической связи. N +2 + O → NO+ + N (33) O+ + N2 → NO+ + N (34) Химические процессы в тропосфере с участием свободных радикалов В химических превращениях различных веществ в тропосфере ключевое место занимает ОН-радикал, стимулирующий протекание химических реакций. Этот радикал (ОН·) образуется в результате фотохимически инициируемой реакции разложения озона. При фотолизе О3 образуется атомарный кислород в электронно-возбужденном состоянии по реакции О3 + hν → O2 + O* (35) Взаимодействие О* с молекулами воды, диффундирующими из тропосферы в стратосферу, происходит безактивационно с образованием радикалов ОН· : О* + Н2О → 2ОН· (36) ОН-радикал образуется в тропосфере и в результате реакций фотохимического разложения азотсодержащих соединений (HNО2, НNО3) и пероксида водорода (Н2О2): НNO2 + hν → NO + OH· (37) НNO3 + hν → NO2 + OH· (38) H2O2 + hν → 2OH· (39) Концентрация ОН· в тропосфере составляет (0,5–5,0).106 смЗ. 41 Несмотря на то что большинство газов, содержащихся в микроколичествах в атмосфере, пассивны в реакциях с основными компонентами воздуха, образующийся радикал ОН· может вступать в реакции со многими соединениями атмосферы. В тропосфере радикалы ОН· участвуют преимущественно в реакциях с оксидами азота, углерода и углеводородами. При взаимодействии радикалов ОН· с о к с и д а м и а з о т а образуются азотистая и азотная кислоты: NO + OH· → НNO2 (40) NO2 + OH· → НNO3 (41) Эти реакции являются важной составляющей образования кислотных дождей. Радикалы НО· обладают высокой реакционной способностью и в реакциях о к и с л е н и я у г л е в о д о р о д о в . Наибольшим по массе и наиболее типичным органическим загрязнителем атмосферы является метан. Окисление СН4 под действием ОН· радикалов сопряжено с окислением NO, который катализирует процесс окисления метана. Радикально-цепной механизм этого процесса включает общую для всех тропосферных процессов стадию инициирования ОН· и цикл экзотермических реакций продолжения цепи, характерных для окисления органических соединений: О· + Н2О → OH· + OH· (42) OH· + СН4 → Н2О + ·СН3 (43) ·СН3 + О2 → СН3О2 (44) СН3О2 + NO → CH3O + NO3· (45) CH3O + O2 → CH2O + НО2· (46) с последующим протеканием реакций NO2 + hν → NO + O (47) O + O2 + M → O3 + M (48) НО2· + NO → NO2 + OH· (49) В результате брутто-реакция окисления СН4 в присутствии NO как катализатора и при воздействии солнечного света с длиной волны 300–400 нм запишется в виде CH4 + 4O2 → CH2O + H2O + 2O3 (50) Окисление метана приводит к образованию тропосферного озона и формальдегида. Рост приземной концентрации озона представляет угрозу для растительного и животного мира Земли. 42 Образующийся при окислении метана формальдегид далее окисляется радикалами ОН· до оксида углерода (II): OH· + CH2O → H2O+НСО,· (51) НСО· + О2→ НО2· + СО. (52) Оксид углерода (II) является вторичным загрязнителем атмосферы и сравним по количеству с поступлением СО от процессов неполного сгорания природного углеводородного топлива. В тропосферных процессах гидроксильный радикал играет важную роль в окислении простых соединений серы, в частности H2S и (СН3)2S, а также в окислении серосодержащих органических соединений и аминов. Фотохимическое окисление серосодержащих органических соединений играет ведущую роль в образовании SО2 в районах, не подверженных антропогенному загрязнению. Оксид серы (IV) в тропосфере, подвергаясь фотохимическому превращению, трансформируется в возбужденные молекулы SO2* с временем жизни 8 мс: SO2 + hν → SO2* SОЗ (λ < 400 нм) (53) Дальнейшее окисление SO2* кислородом воздуха ведет к образованию SO2* + О2 → SO3 + О (54) К образованию SO3 приводит также окисление SO2 под действием НО2· радикалов: НО2· + SO2 → SO3 + ОН· (55) Наличие оксидов серы в атмосфере ведет к выпадению кислотных дождей. Другим радикалом, играющим значимую роль в атмосфере, является гидропероксидный радикал НО2·. Его образование наряду с приведенными выше промежуточными реакциями (46, 52) может проходить и другими путями, например, при взаимодействии атомарного водорода (который образуется при окислении СО до СО2) с кислородом СО + ОН· → СО2 + Н Н + О2 → НО2· (50) (51) Гидропероксидные радикалы образуются также при взаимодействии ОН· с озоном и пероксидом и играют важную роль в химии атмосферы 43 ОН· + О3 → НО2· + О2 (52) ОН· + Н2О2 → НО2· + Н2О (53) Установлено, что радикал НО2· эффективно взаимодействует с о к с и д о м а з о т а с образованием ОН· радикала: НО2· + NO → NO2 + OH· (54) П р о ц е с с р е к о м б и н а ц и и Н О 2 · радикалов является основным источником образования атмосферного пероксида водорода: НО2· + НО2· → Н2О2 + О2 (55) Как видно из приведенного, все атмосферные, в том числе и радикальные, процессы связаны между собой и зависят от содержания основных и примесных компонентов воздуха, интенсивности излучения Солнца в различных интервалах длин волн и т. д. Участие воды в химических процессах атмосферы Вода играет значительную роль в миграции и трансформации различных химических веществ в атмосфере. Вода в атмосфере находится в виде дымки, тумана, входит в состав облаков, а также в виде дождя. В частицах дымки вода присутствует в виде тонкой пленки жидкости на твердой поверхности, а в каплях дождя – в виде гомогенной жидкой фазы. Время жизни капель невелико – от нескольких минут в случае больших дождевых капель до часа в каплях облаков. В среднем около 10 % тропосферы Земли постоянно занято облаками. Облачный слой покрывает более половины поверхности Земли и имеет толщину от нескольких сотен до тысяч метров. Образование жидкой воды тесно связано с образованием в атмосфере аэрозолей – твердых и жидких частиц, обладающих малыми скоростями осаждения и находящихся во взвешенном состоянии. Каждая капелька влаги в атмосфере, возникающая при конденсации водяных паров, – это своего рода микроводоем с определенным химическим составом. На границе раздела воздух–вода этого микроводоема интенсивно протекают процессы газожидкостного обмена с окружающей воздушной средой. Помимо растворенных атмосферных газов, капли воды содержат растворенные и твердые минеральные и органические вещества, содержащиеся в атмосфере. Растворимость газов тесно связана с коэффициентом Генри, устанавливающим пропорциональную связь между молярной долей вещества в жидкой и газовой фазах в условиях термодинамического равновесия. Многие газы имеют малую величину растворимости в воде. Вещества, для которых эффективный коэффициент Генри превышает ве44 личину 4,104 моль/(л·атм), будут находиться в атмосфере преимущественно в растворенной форме; наиболее растворимыми газами являются оксид серы (IV), формальдегид и аммиак. В то же время вещества, участвующие в кислотно-основных и кето-енольных превращениях, обладают повышенной растворимостью за счет образования в растворе других химических форм. Например, растворимость SО2 будет повышаться вследствие взаимодействия его с водой с последующей диссоциацией сернистой кислоты SO2 + H2O → H2SO3 H2SO3 → HSO3– + H+ (56) (57) Аналогично повышенная растворимость NО2 связана с протеканием следующих реакций 2NO2 + H2O → HNO2 + HNO3 (58) HNO2 → NO 2– + H+ (59) HNO3 → NO3– + H+ (60) а повышенная растворимость формальдегида – с реакцией CH2O + H2O → CH2(OH)2 (61) В капле воды под действием солнечной энергии и электрических разрядов могут происходить различные химические превращения, главным образом окислительного характера, с участием кислорода и продуктов его активации. В химии облаков и капель дождя играют роль присутствующие в газовой фазе окислители О3, Н2О2 и образующиеся в результате фотохимических процессов свободные радикалы ОН· и НО2·, а также их органические аналоги – RО2·, ROOH· и др. Атмосферная влага содержит значительные концентрации пероксида водорода: в дожде содержание Н2О2 достигает 10–4 моль/л, в снеге – 10–5 моль/л. Содержание органических окислителей в облаках и дождевой воде достигает 4.10–5 моль/л, что сравнимо с содержанием в дождевой воде Н2О2. Пероксокислоты и органические пероксиды обладают высокой растворимостью и в водной фазе могут играть роль окислителей типа Н2О2. Органические окислители и Н2О2 ответственны за появление в атмосферной влаге и в дождевой воде органических кислот. Так, жидкофазное окисление SО2 под действием пероксида водорода, присутствии ионов железа и марганца протекает по реакции 45 SO2 + H2O2 → H2SO4 (62) с образованием серной кислоты. Фотокатализ и фотосорбция в земной атмосфере Гетерогенные фотокаталитические реакции и фотосорбция на поверхности твердых аэрозольных частиц в тропосфере вносят заметный вклад в глобальную химию атмосферы. Фотостимулированные процессы в тропосфере у поверхности Земли, пока мало принимаемые в расчет при обсуждении различных сценариев эволюции атмосферы, могут протекать на поверхности пылевых частиц под действием ближнего УФ, видимого и даже ИК света и играть существенную роль в инициировании многочисленных важных химических превращений. Основой для такой оценки послужили хорошо известные параметры атмосферы, позволяющие рассматривать ее как глобальный фотокаталитический реактор с хорошо известным фоновым распределением как потоков солнечного света, так и содержания фотокатализаторов, то есть твердых аэрозольных частиц. В качестве фотокатализаторов могут выступать катионы многих переходных металлов (Cu2+, Mn2+, Fe2+/3+), капельки водных аэрозолей с растворенными катионами этих же металлов, твердые аэрозоли, содержащие оксиды: ТiO2, Fe2O3, ZnO, СаО, МgО, находящиеся в частицах песка и сажи, сульфиды некоторых металлов и многое другое. Эти фотокатализаторы активны даже при воздействии относительно мягкого светового излучения, в том числе кванты видимого света. Для наиболее распространенных в природе оксидов-изоляторов таких, как SiO2, Al2O3, СаО, МgО, при облучении солнечным светом более типичны процессы фотоадсорбции. Фотокаталитические реакции компонентов атмосферы можно разделить на две группы: 1) реакции основных компонентов атмосферы, приводящие к образованию следовых соединений; 2) реакции следовых компонентов, приводящие к их удалению из атмосферы. Многие из этих реакций были зафиксированы и даже подробно изучены в лабораториях. Из ожидаемых фотокаталитических реакций основных компонентов атмосферы можно выделить следующие процессы: 1. Восстановление азота до аммиака и гидразина N2 + 3H2O hu ® 2NH3 + 3/2О2 TiO2 (63) N2 + 2H2O hu ® N2H4 + 3/2О2 TiO2 (64) 46 2. Окисление азота водой и кислородом воздуха hu ® 3H2 + 2HNO2 ZnO - Fe2O3 N2 + 1/2O2 + 4H2O (65) 3. Разложение воды на кислород и водород 2Н2О hu ® 2Н2 + О2 TiO2 (66) 4. Окисление воды кислородом с образованием перекиси водорода: 2Н2О + О2 hu ® 2Н2О2 TiO2 (67) 5. Восстановление СО2 с образованием различных органических соединений, например СО2 + Н2О hu ® НСООН, СН2О,СН3ОН + хО2 TiO2 СО2 + Н2О hu ® СН3ОН, С2Н5ОН + хО2 TiO2 (68) (69) Для следовых атмосферных соединений можно ожидать протекания фотокаталитических реакций следующих основных типов: 1. Реакции полного окисления (минерализации) углеводородов, например: С2Н6 + 7/2О2 hu ® 2СО2 + 3Н2О TiO2 С6Н6 + 15/2О2 hu ® 6СО2 + 3Н2О TiO2 (70) (71) 2. Реакции полного окисления (минерализации) галогенсодержащих углеводородов, например С6Н5Сl + 7О2 hu ® 6СО2 + HCl + 2Н2О TiO2 C2HCl3 + 3/2O2 + H2O hu ® 2СО2 + 3НCl TiO2 (72) (73) 3. Реакции полного окисления (минерализации) кислородсодержащих органических соединений, например, спиртов, фенолов, кислот, кетонов, альдегидов, ПАВ и др. С2Н5ОН + 3О2 hu ® 2СО2 + 3Н2О TiO2 47 (74) 4. Реакции разложения Н2S и NOx H2S 2NOx hu ® H2 + S CdS - ZnS hu ® N2+ xO2 галогениды металлов, алюмосиликаты (75) (76) 5. Реакция окисления SO2 SO2 + 1/2О2 + Н2О hu ® Н2SO4 пыль, Fe2O3 (77) 6. Другие более сложные реакции, например, селективное окисление некоторых летучих органических веществ: С6Н6 + 1/2О2 hu ® С6Н5ОН TiO2 , ZnO (78) Согласно современным представлениям, основной вклад в фотокатализ следует ожидать от оксидов железа, титана и цинка, присутствующих в природных аэрозолях в достаточном количестве. Основной вклад в фотосорбцию ожидается от оксидов магния и кальция. Поскольку основным результатом фотокаталитического превращения многих газов является полная их минерализация, то это играет огромную роль в процессах естественной очистки атмосферы. Основным генератором твердых материковых аэрозолей, работающих как «почки» атмосферы Земли являются огромные пустыни. То же можно сказать о лесных пожарах, выделяющих огромное количество оксидов щелочноземельных металлов, которые являются эффективными сорбентами для некоторых фреонов. 6 ХИМИЯ ГИДРОСФЕРЫ Гидросфера – это водная оболочка Земли, которая включает Мировой океан, воды суши (реки, озера, ледники), подземные воды. Гидросфера – составная часть биосферы, непрерывная оболочка Земли – система вода–пар, состоящая из соленой воды (моря, океаны), пресной воды (реки, озера, водохранилища) твердой воды (снежный покров, ледники), а так же пронизанной водой или парами воды литосферы и атмосферы. 6.1 Состав гидросферы Общая масса воды по оценкам составляет 2.1018 т. Большая часть нашей планеты покрыта Мировым океаном – 71 %. Объем Мирового океана составляет немногим больше 0,1 % объема Земно48 го шара, а по массе – 0,023 %. Толщина слоя океанической воды в среднем равна 0,03 % земного диаметра (табл. 4). Таблица 4 Содержание воды в различных объектах Часть гидросферы Объем воды, % от общего 3 3 10 км объема Мировой океан 1 370 000 94 Подземные воды 60 000 4,0 в т. ч. зоны активного водообмена 4000 0,3 Ледники 24 000 1,7 Озера 280 0,02 Почвенная влага 80 0,01 Пары атмосферы 14 0,001 Реки 1,2 0,0001 Вся гидросфера 1 454 000 100,0 Гидросфера находится в состоянии непрерывного движения, развития и обновления. Круговорот воды в гидросфере называется гидрологическим циклом. Хотя объем водяных паров, содержащихся в атмосфере мал, (около 0,013.106 км3), вода постоянно движется через этот резервуар. Она испаряется с поверхности океанов (0,423.106 км3/год) и суши (0,073.106 км3/год), то есть ежегодно с поверхности Земли испаряется 0,5 млн км3 воды, что составляет половину всех водоемов суши, и переносится с воздушными массами 0,037.106 км3/год. Несмотря на короткое время пребывания в атмосфере (10 дней), среднее расстояние водопереноса составляет около 1000 км. Водяные пары затем возвращаются либо в океаны (0,386.106 км3/год), либо на континенты (0,110.106 км3/год) в виде снега или дождя. Большая часть дождевых осадков, попадающих на континенты, просачивается через отложения и пористые или раздробленные породы, образуя подземные воды (9,5.106 км3), остальная вода течет по поверхности в виде рек (0,13.106 км3) или вновь испаряется в атмосферу. Поскольку общее количество воды в гидросфере постоянно, во времени, процессы испарения и осаждения сбалансированы для Земли в целом, несмотря на большие локальные различия между регионами. Водяные пары атмосферы обновляются в течение десяти суток, вода рек в результате стока меняется в течение 12 суток, вода озер обновляется каждые 10 лет, воды Мирового океана полностью сменяются каждые 3 тыс. лет, а в ледниках полный обмен происходит за 8,5 тыс. лет. Живые организмы играют огромную роль в круговороте воды: весь объем гидросферы проходит через живое вещество за 2 млн лет. Быстрый перенос воды в атмосфере обусловливается поступающим солнечным излучением. Значительная часть излучения, достигающая земной ко49 ры, идет на испарение жидкой воды и образование водяных паров (другая часть солнечного излучения поглощается земной поверхностью). Энергия, которая содержится в парах, называется скрытой теплотой испарения. Роль гидросферы на Земле переоценить сложно. Вода является: 1) средой, в которой произошло зарождение и развитие живого вещества; 2) обязательным компонентом в составе живых организмов, осуществляет транспорт внутри живых организмов; 3) переносчиком растворенных веществ между литосферой и гидросферой, атмосферой и гидросферой, между живыми организмами и окружающей средой; 4) универсальным растворителем – взаимодействует со всеми веществами, как правило, не вступая в реакции. 6.2 Химия Мирового океана Состав Мирового океана Все воды планеты, в том числе и Океана, представляют собой растворы разного состава и концентрации. Среди растворенных веществ можно выделить пять групп: 1) главные ионы – одиннадцать компонентов составляют 99,98 % по массе от всех растворенных в океанской воде солей (табл. 5) 2) биогенные элементы – С, Н, N, P, Si, Fe, Mn, из которых состоят организмы; 3) растворенные в морской воде газы – О2, N2, CO2, углеводороды и инертные газы; 4) микроэлементы; 5) органические вещества. Подавляющую часть ионов морской воды составляют хлориды, к тому же солевой состав морской воды (относительные концентрации ионов) на всей Земле постоянен (!) – это главная закономерность в химии океана (табл. 5). Таблица 5 Анионы CL– SO 2– 4 HCO3– Br I– – BO3– Главные ионы морской воды Концентрация, Катионы г/кг воды 12,3534 Na+ 2,7007 Mg2+ 0,1427 Ca2+ 0,0659 K+ 0,0013 Sr2+ 0,0265 50 Концентрация, г/кг воды 10,7638 1,2970 0,4080 0,3875 0,0083 Выявлены и изучены три типа распределения концентраций элементов в Мировом океане: 1. Консервативный – элементы имеют одинаковую и неизменную во времени и пространстве концентрацию, отнесенную к общей солености. Сокеан > Среки. Это элементы Ia, IIa, VIIa групп Периодической системы (ПС). 2. Биогенный – содержание элементов в воде уменьшается из глубины к поверхности вплоть до полного исчезновения в результате «выедания» растительными и животными организмами. Сокеан~ Среки. Связь характера распределения элемента с положением в Периодической системе более размыта и менее определена. Это элементы IVa, Va,VIIa, Ib, IIb, Vb, VIIIb групп ПС. 3. Литогенный – сложный характер распределения концентраций элементов, которые попадая в Океан с речным стоком и иловым материалом, выводятся практически полностью в осадок за счет гидролиза в океанской воде. Сокеан << Среки. Это следующие элементы: Al, Sr, Sn, Sc, Cr, Co, Cu, Ga, Ce, Hg, Pb. Формирование состава Мирового океана По существующим представлениям преобладающие в океане химические элементы поступают туда главным образом вместе с речными водами в количествах, значительно превышающих все остальные источники. Э л е м е н т н ы е составы речной и океанской воды имеют высокую корреляцию (К = 0,94). Другими источниками поступления химических элементов в океан являются высокотемпературные гидротермальные излияния в центрах спрединга – местах, где литосферные плиты наращиваются за счет вещества, поднимающегося из недр, и расходятся в стороны, в пределах срединноокеанических хребтов и т. д. Исследования океанологов и геохимиков показали, что на химический состав океана оказывают влияния глубинные источники, причем не разогретые, а в большей мере холодные. Приток магния из холодных вод в 3–10 раз больше, чем из разогретых. Изъятие же элементов идет путем осаждения из морской воды на дно и утечки в ходе испарения. Процесс формирования элементного состава океанской воды практически полностью определяется соотношением скоростей массопереноса и трансформации растворенного вещества. Химический состав морей и океанов является результатом процесса миграции и трансформации вещества на биогеохимических барьерах река–море и океан–атмосфера, то есть в местах «сгущения жизни». Стабильность и сбалансированность этих процессов – главное условие стабильности экосистемы гидросферы и относительного постоянства состава океанской воды (на протяжении последних 900 млн лет). 51 Глобальные поступления натрия в Мировой океан превышает его убыль примерно в 4 раза, магния и сульфатов – в 2–10 раз, калия – в 20 раз. Контрастирует с этим динамика содержания в морской воде кальция: поступление его вдвое меньше, чем вынос. Свойства вод Мирового океана Соленость – вес сухого остатка, содержащегося в 1 кг морской воды, когда карбонаты переведены в оксиды, бромиды и иодиды замещены эквивалентным количеством хлора, органические вещества сожжены при 480 °С. Единица измерения – г/кг или %. Поскольку соотношения ионов постоянны во всех океанах Земли, то на основании анализа одного иона можно по пропорции вычислить концентрации всех остальных ионов, а следовательно, и соленость. Поэтому часто соленость определяют по хлорности. Соленость можно определять через электропроводность или показатель преломления. Воды открытого океана имеют средние значения солености 35–37 г/кг, в дельтах значения падают до величины 1 г/кг по мере приближения к источнику пресной воды. В гиперсоленых водах соленость может достигать 300 г/кг. Водородный показатель (рН) Кислотность воды определяется растворением СО2 из атмосферы, участием в реакциях взаимодействия с водой, поглощением его в процессе фотосинтеза, связыванием и выпадением в виде карбонатов. Равновесие между исходными, промежуточными и конечными веществами обусловливает наличие буферных свойств воды с величиной рН 8,0–8,4. Н2О + СО2 ↔ Н2СО3 ↔ HCO3– +Н+ ↓↑ – 2+ 2HCO3 +Са ↔ СаСО3 + Н2СО3 (79) При этом не исключается, что активность органического вещества или другие локальные причины могут вызывать на некоторое время понижение или повышение рН до 6 и до 10 единиц рН, соответственно. Прозрачность – за условную прозрачность морской воды принята глубина моря, на которой белый диск диаметром 30 см становится невидимым. Эта характеристика особенно важна для нормального протекания фотосинтеза. Таким образом, основные особенности Мирового океана: 1. Высокая ионная сила морской воды – 35 г/л солей. 2. Химический состав морской воды с преобладанием Na+ и Cl–. 3. Постоянные относительные концентрации основных ионов морской воды во всех океанах Земли. 52 Ресурсы Мирового океана и их значение Мировой океан как среда обитания интересен тем, что по мнению многих ученых именно здесь зародилась жизнь. В.И. Вернадский утверждал, что состав морской воды определяется биохимическими процессами, то есть химический состав вод Мирового океана отражает химический состав живого вещества. В этом плане интересен тот факт, что содержание солей в крови человека близко по элементному составу к океанической воде. Между тем соки растений, живущих в Мировом океане, совершенно отличны от химического состава его вод. В океане обитает 300 000 видов живых организмов – фитопланктон (500 млрд т/год), бактерии, зоопланктон, рыбы, морские животные. Океан является легкими планеты и продуцирует своим фитопланктоном почти половину всего кислорода атмосферы (регулирует баланс СО2-О2). Океан является источником химических элементов для переноса их через атмосферу на континент. Ресурсы мирового океана можно разделить на две группы: 1. Ресурсы биохимического характера – живые организмы. Используется только 0,0001 % продуцентов; промыслы в океане дают 1/16 белков и 3–4 % жиров животного происхождения. 2. Ресурсы физического характера – полезные ископаемые: – сырье в недрах под океаном (нефть, газ, уголь, сера, железная руда). 90 % нефти и газа добывается из океана; – прибрежные россыпные месторождения (ильменит, монацит, циркон, магнетит, вольфрамий, золото, алмазы, платина); – полезные ископаемые морского дна (железно-марганцевые конкреции и фосфиты). 6.3 Химия пресных вод Пресной водой называется вода, в 1 кг которой содержится не более 1 г солей. На Земле не более 3 % всех вод являются пресными. Состав пресных вод – преобладают гидрокарбонаты кальция и магния (см. табл. 6). Таблица 6 Химический состав пресных вод Катионы Концентрация, Анионы Концентрация мг/л воды мг/л воды 2+ – Са 13,0 Сl 6,4 2+ Мg 3,3 12,0 SO 2– 4 Na+ 4,5 S2– 3,9 + – K 1,5 58,5 HCO3 Сорг 6,9 NO3– Скарб 53 1,0 11,5 Анализ данных таблицы 6 показывает: 1) что концентрация ионов в растворе низкая; 2) в растворенном состоянии в пресной воде преобладают четыре металла, присутствующие в виде простых катионов (Са2+, Nа+, К+, Мg2+) и гидрокарбонат-ионы. Формирование состава пресных вод Все катионы в речной воде, за исключением некоторого количества натрия и хлора, являются результатом п р о ц е с с а в ы в е т р и в а н и я . Состав речной и озерной воды зависит главным образом от типа почвы и горных пород, через которые она проходит, а также от типа источника питания в виде поверхностного стока или грунтовых вод. Необходимо отметить, что определение состава воды рек и озер зависит от точки отбора проб и изменяется со временем. Сравнение глобального химического состава речных вод со средним составом континентальной коры позволяет отметить: ионный состав растворенных веществ в пресной воде принципиально отличается от континентальной коры. Различие между составом земной коры и растворенных веществ особенно заметно для алюминия (80 мг/кг в земной коре, 0,05 мг/кг в речных водах) и железа (35 и 0,04 мг/кг в земной коре и речных водах, соответственно) по сравнению с другими металлами. Такое различие является результатом характера взаимодействия металла с водой. Общий характер растворимости элементов связывают с зарядом и ионным радиусом |z|/r: – ионы с низким значением |z|/r высокорастворимы, образуют в растворе простые ионы, ими обогащена фаза раствора по сравнению с фазой взвеси; – ионы со средним значением |z|/r относительно нерастворимы и имеют сравнительно большие отношения «частица–вода»; – ионы с большими значениями |z|/r образуют комплексные оксианионы и снова становятся растворимыми. Содержащиеся в пресной воде вещества преимущественно реками переносятся в Мировой океан. Масса переносимых рекой твердых частиц в течение года называется твердым стоком, а масса растворенных веществ – ионным стоком. В горных реках твердый сток преобладает над стоком растворенных веществ, а в равнинных реках наоборот. Общая масса твердых частиц, выносимых реками мира в Мировой океан, около 20 млрд т. в год, а растворенных соединений – около 4 млрд т. Свойства пресных вод Водородный показатель (рН). Для большинства рек и озер рН равен от 6 до 8 единиц рН. Формирование (см. «Свойства вод Мирового океана» с. 52). Жесткость – концентрация в воде (моль-экв/л) солей кальция и магния. По природе ионов, определяющих жесткость, различают: 54 – временную (карбонатную или устранимую) жесткость, обусловленную наличием в воде гидрокарбонатов кальция и магния; – постоянную жесткость, обусловленную наличием в воде сульфатов и хлоридов кальция и магния; – общую жесткость воды, определяемую суммой временной и постоянной жесткости. Временная жесткость может быть удалена кипячением или добавлением к воде Са(ОН)2 Са(НСО3)2 → СаСО3↓ + Н2О + СО2 (80) Са(НСО3)2 + Са(ОН)2 → 2СаСО3↓ + 2Н2О (81) Постоянная жесткость устранима при добавлении к воде Na2CO3 СаSO4 + Na2CO3 → СаСО3↓ + Na2SO4 (82) По величине жесткости вода делится: – на мягкую – менее 4 моль-экв/л; – среднюю – от 4 до 8 моль-экв/л; – жесткую – от 8 до 12 моль-экв/л. Роль пресных вод на Земле Пресная вода является веществом, необходимым для жизнедеятельности живых организмов. Однако подавляющая часть пресной воды на Земле находится в труднодоступном состоянии (табл. 7), а в пределах рек, например, содержится лишь 0,006 % всех пресных вод, поэтому, несмотря на то что человечество научилось опреснять соленые воды, проблема питьевой воды на планете остается актуальной (особенно в пустынных районах). Таблица 7 Распределение пресной воды по объектам Водный объект Содержание, тыс. км3 Ледники, подземные льды 24 364 (в пересчете на воду) Подземные воды 10 530 Влага в почве 17 Пресные озера 91 Болота 12 Вода рек 2 Вода в атмосфере 13 Биологические воды (в живых организмах) 1 Для хозяйственного назначения используются транспортные возможности рек и крупных озер, а также прибрежная и водная фауна. 55 7 ХИМИЯ ЛИТОСФЕРЫ И ПОЧВЫ Литосфера (от гр. литос – камень и сфера) – внешняя твердая сфера Земли, включающая земную кору и наружную часть подстилающей ее верхней мантии. Литосфера подстилает атмосферу и в значительной мере перекрывается гидросферой, которая в той или иной форме проникает в ее различные горизонты, нередко образуя там значительные скопления подземных вод. 7.1 Строение и состав литосферы Земная кора – это внешняя твердая оболочка Земли. Земная кора под океанами имеет мощность около 5–10 км. Мощность ее на материках под равнинами составляет 35–45 км, а в горных областях – около 70 км. Объем земной коры составляет приблизительно 10,2.1018 м3, масса – 28.1021 кг. В строении материковой земной коры выделяют три слоя: Верхний слой – осадочный – представлен осадочными породами - глубина до 20 км, объем – 1.1018 м3, масса 2,5.1021 кг. Средний слой – гранитный – представлен в основном магматическими породами кислого состава, глубина до 40 км, объем 3,6.1018 м3, масса 10.1021 кг. Нижний слой – базальтовый – состоит преимущественно из габбро, глубина до 60 км, объем 5,6.1018 м3, масса 16.1021 кг. В океанической земной коре отмечаются только базальтовый слой и сильно редуцированный осадочный чехол. Верхняя мантия – оболочка Земли, подстилающая земную кору до глубины около 900 км. Сложена преимущественно пиролитом, частично эклогитом (оливинпироксеновый состав). В верхней мантии развиваются процессы с которыми тесно связаны тектонические, магматические и метаморфические явления. Земную кору и верхнюю мантию разделяет поверхность Мохоровичича или сокращенно Мохо. При переходе этой границы раздела скорость сейсмических волн возрастает скачком с 6,7–7,6 до 7,9–8,2 км/с, что установлено в 1926 г. югославом А. Мохоровичичем. Состав литосферы Горные породы – это естественные минеральные агрегаты определенного состава и строения, сформировавшиеся в результате геологических процессов и залегающие в земной коре в виде самостоятельных тел. Состав, строение и условия залегания горных пород обусловлены особенностями формирующих их геологических процессов, которые происходят в определенной обстановке внутри земной коры или на земной поверхности. В зависимости от характера главных геологических процессов различают три генетических класса горных пород: 56 Магматические горные породы – базальты, граниты и др. – 70 % всех пород – это естественные минеральные агрегаты, возникающие при кристаллизации магм (силикатных, а иногда несиликатных расплавов) в недрах Земли или на ее поверхности. Классификация по условиям образования и залегания: плутонические – глубинные, и вулканические – формируются на поверхности и вблизи нее. Классификация по содержанию кремнезема: кислые (70–90 % SiO2), средние (около 60 % SiO2), основные (около 50 % SiO2), ультраосновные (менее 40 % SiO2). Метаморфические породы – 17 % – породы, состав, структура и текстура которых обусловлены процессами метаморфизма – преобразованием породы действием высокого давления или температуры, при этом признаки первичного осадочного или магматического происхождения частично или полностью утрачены. Метаморфические породы – сланцы, гранулиты, эклогиты и др. Типичные для них минералы – слюда, полевой шпат и гранит, соответственно. Осадочные породы – 12 % – характерны для поверхностной части земной коры, образуются в результате: – переотложения продуктов выветривания и разрушения различных горных пород; – химического и механического выпадения осадков из воды; – жизнедеятельности организмов; – всех процессов одновременно; – жизнедеятельности растений, создающих за счет фотосинтеза новое органическое вещество – горячую породу. Многие осадочные породы являются ценными полезными ископаемыми: песчаники – источники кварца SiO2, известняки – источники кальцита СаСО3, глины – источники каолинита Аl4SiO10(OH)8 и т. д. Х и м и ч е с к и й с о с т а в земной коры: SiO2 (57,6 %), NiO2, Al2O3 (15,3 %), Fe2O3, FeO (4,27 %), MnO, MgO, CaO (6,99 %), Na2O, K2O, P2O5, H2O, CO2, S (0,04 %), Cl (0,05 %), C. (Данные на 1971 год) Совокупность данных свидетельствует о том, что вещество земной коры сложено в основном легкими элементами (по Fe включительно), а элементы, последующие в ПС в сумме составляют лишь доли процента. Элементы, имеющие четное значение атомной массы, значительно преобладают: они образуют около 86 % общей массы земной коры. Таким образом Земная кора сложена: 1) в основном 8 элементами: О, Si, Al, Fe, Ca, Mg, Na, K; 2) на долю остальных элементов приходится менее 1 % массы земной коры; 3) среди важнейших по распространенности элементов особая роль в земной коре принадлежит кислороду – 47 % массы коры и почти 90 % объема важнейших породообразующих минералов. 57 7.2 Почва как важнейший компонент литосферы Почва – предосфера – природное образование, состоящее из генетически связанных горизонтов, формирующихся в результате преобразования поверхностных слоев литосферы под действием воды, воздуха и живых организмов, обладает плодородием. Состоит из твердой, жидкой (почвенный раствор), газообразной и живой (почвенная флора и фауна) частей. Почвообразовательный процесс – зарождение и эволюция почвы под влиянием факторов почвообразования – материнская порода, климат, растительный и животный мир, рельеф, геологический возраст территории, хозяйственная деятельность человека, изменчивость которых во времени и пространстве обусловила формирование разнообразных типов почв, например, подзолистые, черноземы и др. Состав и строение почвы Почва состоит из трех фаз: твердой, жидкой и газообразной. Около половины объема почвы составляет почвенный воздух и почвенный раствор. В твердой фазе преобладают минеральные образования – первичные (кварц, полевые шпаты, слюда) и вторичные (каолинит, гидрослюды и др.). Сюда же относятся различные органические вещества, в том числе и гумус (перегной), почвенные коллоиды, имеющие органическое, минеральное или органоминеральное происхождение. Почвенный раствор составляет вода с растворенными в ней минеральными веществами (простые, сложные и комплексные катионы и анионы), органическими веществами (например, моносахариды, фульфокислоты) и растворенными газами. Почвенный воздух включает газы, заполняющие свободные от воды поры, а также газы, адсорбированные коллоидными частицами и растворенные в почвенном растворе. Благодаря деятельности почвенных организмов состав атмосферного и почвенного воздуха сильно отличается. В почвенном воздухе в десятки и сотни раз больше углекислого газа, но меньше кислорода, содержание азота приблизительно одинаковое. Почвенный воздух сильно обогащен парами воды (близко к 100 %) а также разнообразными летучими органическими и неорганическими биогенными соединениями. Благодаря деятельности аэробных бактерий, которые окисляют водород, метан, соединения серы, не выпуская эти газы из почвы в атмосферу, в почве происходит почти замкнутый круговорот перечисленных выше газов, а в атмосферу выходит преимущественно СО2. Химический состав почвы Любые почвы содержат 92 элемента Периодической системы, а в случае химического загрязнения в почвах обнаруживаются некоторые элементы в значительно больших количествах, чем фоновые и дополнительно трансурановые элементы. 58 Органическое вещество почвы состоит из слабоизмененных остатков растений, продуктов их измельчения и преобразования микроорганизмами и мезофауной, а также из специфических почвенных органических веществ, которые представляют собой гумус. Гумус (от лат. humus – земля, почва) – перегной – органическое вещество почвы, образующееся в результате разложения растительных и животных остатков и продуктов жизнедеятельности организмов. Состав гумуса: гуминовые и фульвокислоты, их соли и гумин – своеобразный комплекс гумусовых кислот, связанных с высокодисперсными минеральными частицами. Резкой границы между ними нет, они связаны между собой постепенными переходами и характеризуются различным отношением к растворителям. Гуминовые кислоты (ГК) – темноокрашенная фракция органических веществ с переменным составом: С от 48 до 64 %, Н 3,4–5,6 %, N 2,7–5,3 %, не растворимые в воде, но растворимые в щелочах, осаждаются минеральными кислотами при рН 1–2. Благодаря высокой клеящей способности создают структуру почв, считаются активаторами роста растений. Основными структурными единицами сложной молекулы ГК являются: сконденсированная центральная часть, состоящая из ароматических и гетероциклических структур (ядро), боковые цепи (углеводородные, аминокислотные) и периферические функциональные группы (карбоксильные –СООН, метоксильные ОСН3, карбонильные С=О, фенолгидроксильные –С6Н4–ОН). В почве чаще всего присутствуют гуматы Са и Мg, образующиеся при замещении водорода у карбоксильных и фенолгидроксильных групп. Часть водорода может быть замещена комплексными катионами, например, на основе железа или алюминия. При этом образуются прочные внутрикомплексные соединения – хелаты. Фульвокислоты (ФК) – специфические органические кислоты, растворимые в воде и минеральных кислотах, имеют сходное строение с ГК, но боковые цепи преобладают над ядром, содержат углеводы, характеризуются пониженным по сравнению с ГК содержанием углерода и азота (С 40–45 %, N 3–4,5 %), содержание карбоксильных и фенолгидроксильных групп больше, чем у ГК (см. рис. 12). В высушенном состоянии имеют желтую окраску, активно воздействуют на различные минералы, разрушая их и образуя устойчивые комплексные соединения с катионами, причем активнее и лучше, чем ГК. Содержание и соотношение ГК и ФК в почве имеет очень важное значение. Например, селективное соединение рассеянных металлов с водорастворимыми компонентами гумуса (ФК) и неподвижными гелями ГК имеют очень большое значение для вовлечения металлов в миграционные циклы или, наоборот, выведение их из миграции и закрепления в почве. 59 Рис. 12. Приблизительная структурная формула фульвокислот Гумин – часть гумусовых веществ, которая не растворяется ни в одном растворителе. Это гумифицированное органическое вещество, остающееся в негидролизованном остатке после проведения всех последовательных экстракций гуминовых и фульвокислот на холоде. Гумин – наименее изученная часть гумуса, и его роль в природных процессах не ясна. Много неясностей остается и в исследованиях ГК и ФК. Так, молекулярную массу разные авторы оценивают от полутора тысяч до сотен тысяч. В природе ГК и ФК устойчивы (сотни и тысячи лет), что подтверждено прямым определением их возраста по радиоактивному изотопу углерода. В лабораторных условиях эти кислоты разлагаются достаточно быстро, что говорит о недостаточной идентичности выделенных и природных ГК и ФК, приводит к сложности их изучения и оценки роли в природе. Почвенно-поглощающий комплекс (ППК) – это совокупность минеральных, органических и органо-минеральных компонентов твердой части почвы, обладающих ионообменной способностью. 60 Химические свойства почв При характеристике почв наиболее характерны не отдельные индивидуальные вещества, а их группы, то есть совокупность соединений со сходным строением и свойствами. Такими группами могут быть моносахариды, аминокислоты (в почвах обнаруживается 17–22 различных аминокислот), гуминовые кислоты и т. д. Вещества, входящие в одну группу, примерно одинаково участвуют в почвенно-химических реакциях. В почвах может проходить более 30 различных химических реакций и процессов. Часть из них имеет общий характер для всех почв, часть присуща только отдельным почвенным типам. Общие для большинства почв реакции следующие: осаждениерастворение, катионный обмен, комплексообразование, синтез и минерализация органических соединений, образование гуминовых веществ. Почвам северных влажных районов свойственно накопление кислых продуктов, развитие восстановительных процессов (гелеобразование). В сухих южных районах нередко происходит накопление солей, а реакция почв зависит от карбонатов кальция и регулируется крбонатно-кальциевым равновесием. Буферность почв – это способность поддерживать постоянным состав почвенного раствора, откуда растения непосредственно черпают питательные вещества. Сложность состава почв, большой набор химических соединений обусловливают возможность одновременного протекания различных химических реакций и способность твердых фаз почвы поддерживать сравнительно постоянный состав раствора почв. При потреблении какоголибо элемента из почвенного раствора происходит частичное растворение твердых фаз, и концентрация раствора восстанавливается. Если в почвенный раствор извне попадают дополнительные количества каких-либо соединений, то твердые фазы почв связывают такие вещества, вновь поддерживая постоянство состава почвенного раствора. Катионный обмен Для почв наиболее характерны реакции катионного обмена между твердой частью почвы (ППК), которая поглощает катионы, и почвенным раствором, который можно рассматривать как раствор электролитов. Если твердую часть почвы обозначить как П, подвижные ионы – противоионы – обозначить К+, а ионы раствора Кn+ , то в общем виде протекает реакция nП – К+ + Кn+ ↔ Пn – Кn+ + n K+ (83) или в конкретном случае П2 – Са2+ + 2Na+ ↔ 2 П – Na+ + Са2+ (84) Обмен катионами между твердой частью почвы и раствором не приводит к каким-либо дополнительным изменениям. 61 Почва чаще всего находится в форме Ca2+, Mg2+, K+, H+, Al3+. В черноземах и каштановых почвах преобладают Ca2+, Mg2+, K+. В солонцах и некоторых солончаках есть еще Na+. Емкость катионного обмена (ЕКО) – количественное выражение способности ППК стехиометрически обменивать одни катионы на другие (моль-экв/100 г почвы). Эти реакции очень важны, поскольку от состава обменных катионов и их количества зависят почвенное плодородие, многие физические и химические свойства почв и способность почв противостоять химическому загрязнению. Кислотность почв Природная кислотность почв может быть вызвана органическими кислотами, попадающими в почву с растительными остатками или корневыми выделениями, диоксидом углерода в почвенном воздухе и поступлением азотной и серной кислот с кислыми дождями. Потенциальная кислотность почв обусловлена реакцией катионного обмена при обмене Н+ и Аl3+. Такая кислотность встречается в кислых дерново-подзолистых, серых лесных, красноземных почвах. П – Н+ + К+Сl– ↔ П – К+ +Н+Cl– (85) П3 – Аl3+ +3 К+Сl– + 3H2O↔ 3П – К+ +3Н+Cl– + Al(OH)3 (86) В растворе появляется некоторое количество соляной кислоты, которая и обусловливает кислую среду. Устраняют потенциальную кислотность добавлением карбоната кальция (или извести), который нейтрализует различные формы кислотности П – Н2+ + СаСО3 ↔П – Са2+ + Н2СО3↔ П – Са2+ + Н2О + СО2 (87) Щелочность почв Щелочными считают почвы, водная суспензия которых имеет рН 7,5–8,0 и выше. Щелочность вызывается различными солями: карбонатами, фосфатами, боратами, гуматами, силикатами. Но главную роль играют Na2CO3 и CaCO3, Последний создает кислотно-основную буферность и сравнительно высокую щелочность. Регулирование реакции осуществляется в этом случае за счет карбонатно-кальциевой системы: Ca2CO3 присутствует в твердой части почвы, вода в почве имеется практически всегда, за исключением сильных засух, а СО2 всегда есть в почвенном воздухе, в результате почвенный раствор такой системы содержит разные количества Са2+, CO32– , Н+, HCO3– . При этом величина рН регулируется, по сути, только парциальным давлением СО2. Эта система работает до тех пор, пока в твердой части почвы присутствует Ca2CO3 и обусловливает величины 62 рН почвенных суспензий до 7,5–10,0 в зависимости от парциального давления СО2 в почвенном воздухе. Щелочность почв неблагоприятно сказывается на их физических и химических свойствах. Под действием щелочной среды почвы расплываются, теряют структурность, а затем при высыхании сливаются в очень плотные, прочные глыбы, которые часто не поддаются действию плуга. Таковы солонцы в зонах черноземных, каштановых и бурых почв. Окислительно-восстановительные режимы Практически в каждой почве происходят реакции окислениявосстановления химических соединений или элементов. Окислительные процессы идут за счет кислорода воздуха, при этом органические вещества почвы окисляются или частично, или полностью до конечных продуктов распада – Н2О и СО2. При высоких окислительно-восстановительных потенциалах порядка 0,5–0,7 В практически все элементы с переменной валентностью приобретают высшие степени окисления, многие из них становятся малоподвижными и малодоступными растениям (Fe, Cu, Co, S, N). В переувлажненных почвах, особенно затопляемых рисовых полях, развиваются восстановительные процессы, потенциалы снижаются до ± 0,2 В, что обусловлено деятельностью микроорганизмов, способных развиваться без доступа свободного О2 и выделяющих в почву органические восстановительные соединения и свободный водород. В таких почвах элементы с переменной валентностью в состоянии низших степеней окисления, становятся подвижными, выделяется метан и другие углеводороды. Когда длительно развиваются восстановительные процессы, в почвах появляется сизоватая окраска, железо и марганец восстанавливаются до + 2. Такие почвы называют оглеенными или глеевыми. Плодородие почвы – способность почвы удовлетворять потребности растений в элементах питания, воде, обеспечивать их корневые системы достаточным количеством воздуха и тепла, благоприятной физикохимической средой для нормальной деятельности. Различают естественное плодородие и приобретенное плодородие (под действием обработки, внесенных удобрений, мелиорации и т. д.). Современное почвоведение рассматривает почву не только как особое естественноисторическое тело, обладающее плодородием, но и как полифункциональную природную систему, обеспечивающую циклический характер воспроизводства жизни на суше. Функции почвы Экосистемные (биогеоценотические) функции почвы обусловлены плодородием почв и определяются почвенными свойствами, процессами и режимами (физическими свойствами и химическим составом, почвенной биотой и информацией в ДНК и др.). Биосферные (глобальные) функции почвы: а) взаимосвязанные с литосферой: 63 – биохимическое и биофизическое преобразование верхних слоев литосферы, – источник для формирования предогенных минералов, осадочных пород и полезных ископаемых, – передача аккумулированной солнечной энергии в глубокие слои литосферы, – защита верхних слоев литосферы от эрозии и денудации; б) взаимосвязанные с атмосферой: – поглощение и отражение солнечной радиации, – регулирование влагооборота атмосферы, – регулирование газового состава и режима атмосферы, – источник твердого вещества и микроорганизмов, поступающих в атмосферу; в) взаимосвязанные с гидросферой: – трансформация атмосферных и поверхностных вод в грунтовые и подземные, – регулирование и формирование состава и режима поверхностных вод и речного стока, – фактор биологической продуктивности рек и водоемов, – биохимический барьер на пути миграции веществ с суши в гидросферу; г) общебиосферные: – основная среда обитания организмов суши Земли, аккумуляция энергии и биофильных веществ, – связующее звено биологического и геологического круговорота веществ, – фактор биологического разнообразия и эволюции организмов, – фактор устойчивости функционирования биосферы. Экологические функции почвы обусловлены их физико-химическими свойствами: – сорбция минеральных, органических веществ и микроорганизмов; – деструкция и минерализация органических остатков растений и животных; – ресинтез минеральных и органических компонентов почвы; – аккумуляция биофильных элементов и ферментов. Почва как среда обитания С почвой непосредственно связана жизнь наземной растительности, беспозвоночных и микроорганизмов. Особо рассматривается количество и роль микроорганизмов. 1 г почвы содержит до нескольких десятков миллиардов микробных клеток, что соответствует 65 т микробной массы на гектар. Доля углерода в этой биомассе может составлять 50–70 % всего углерода в почве. 64 Бактерии Автотропные бактерии нитрификаторы осуществляют биохимическое окисление аммиака в нитраты. Азофиксирующие бактерии осуществляют связывание молекулярного азота атмосферы в нитраты. Гетеротрофные бактерии участвуют в трансформации органического вещества вплоть до конечного продукта его биохимического окисления – углекислого газа. Аэробные бактерии окисляют водород, метан, соединения серы, не выпуская эти газы из почвы в атмосферу. Актиномицеты и грибы разрушают наиболее устойчивые компоненты растительных остатков – клетчатку и лигнин. Таким образом, в предосфере действует своеобразный биогеохимический фильтр – бактериальная система, защищающая атмосферу от поступления углеводородов. В предосфере смыкаются ветви грандиозного углерод-кислородного цикла массообмена, функционирование которого является главным условием существования биосферы. С одной стороны, почва обеспечивает продуктивность фотосинтезирующих растений суши, связывающих углекислый газ в органическое вещество и при этом выделяющих кислород. С другой стороны, в почве происходит разрушение отмершего органического вещества, его биохимическое окисление до углекислого газа и возвращение последнего в атмосферу. Благодаря этим процессам предосфера играет роль центрального звена в глобальном углеродкислородном цикле и наряду с Океаном выполняет функции регулятора геохимического режима атмосферы. 65 ЗАКЛЮЧЕНИЕ Окружающий человека мир огромен и многообразен. Живое и неживое вещество планеты формировалось миллионы лет при постоянном поступлении солнечной энергии и под действием многих (био)геохимических факторов. На сегодняшний день это единое целое под названием «Биосфера». Биосфера живет и развивается по определенным правилам и законам, осуществляя многие связи и взаимодействия. Всестороннее познание окружающего мира – процесс многоплановый и сложный. Выявление химического состава, законов превращения и распределения веществ в природе – только часть знаний о Биосфере. Однако эти знания очень важны, поскольку даже незначительные изменения в качественном и количественном составе компонентов окружающей среды может привести к серьезным последствиям для других составляющих системы. Изложенные сведения о составе, свойствах и функциях атмосферы, гидросферы и почвы, потоках элементов, роли живого вещества на планете и законах существования Биосферы в целом позволят оценить отклонения от естественных условий под действием антропогенного фактора и объяснить устойчивость Биосферы при загрязнении как результат самоочищения и самовосстановления ее составляющих. Данное учебное пособие позволит студентам систематизировать знания и подготовиться к зачету и экзамену по курсу «Введение в химическую экологию». 66 СПИСОК ЛИТЕРАТУРЫ 1. Одум Ю.П. Экология : в 2 т. Т. 1, 2 / Ю. Одум. – М. : Мир, 1986. – 327 с. 2. Панин М.С. Химическая экология / под ред. С.Е. Кугайбергенова. – Семипалатинск : Семипалатинский гос. ун-т им. Шакарима, 2002. – 852 с. 3. Барбье М. Введение в химическую экологию / М. Барбье. – М. : Мир, 1978. – 229 с. 4. Садовникова Л.К. Экология и охрана окружающей среды при химическом загрязнении / Л.К. Садовникова, Д.С. Орлов, И.Н. Лозановская. – М. : Высш. шк., 2006. – 333 с. 5. Скурлатов Ю.И. Введение в экологическую химию / Ю.И. Скурлатов, Г.Г. Дука, А. Мизити. – М. : Высш. шк., 1994. – 399 с. 6. Лозановская И.Н. Экология и охрана биосферы при химическом загрязнении / И.Н. Лозановская, Д.С. Орлов, Л.К. Садовникова. – М. : Высш. шк., 1998. – 287 с. 7. Реймерс Н.Ф. Экология: Теории, законы, правила, принципы и гипотезы / Н.Ф. Реймерс. – М. : Россия молодая, 1994. – 364 с. 8. Гусакова Н.В. Химия окружающей среды / Н.В. Гусакова. – Ростов н/Д : Феникс, 2004. – 192 с. 9. Голдовская Л.Ф. Химия окружающей среды / Л.Ф. Голдовская. – М. : Мир, 2005. – 294 с. 10. Новиков Ю.В. Экология, окружающая среда и человек / Ю.В. Новиков. – М. : ФАИР-ПРЕСС, 2005. – 736 с. 11. Введение в химию окружающей среды / Дж. Андруз, П. Бримблекумб, Т. Джикелз, П. Лисс. – М. : Мир, 1999. – 270 с. 12. Экологическая химия / под ред. Ф. Корте. – М. : Мир, 1997. – 396 с. 67 Учебное издание ВВЕДЕНИЕ В ХИМИЧЕСКУЮ ЭКОЛОГИЮ Часть I Химия окружающей среды Учебное пособие Составитель Хохлова Оксана Николаевна Редактор Л.М. Носилова Подписано в печать 23.05.08. Формат 60×84/16. Усл. печ. л. 4,2. Тираж 50 экз. Заказ 1052. Издательско-полиграфический центр Воронежского государственного университета. 394000, г. Воронеж, пл. им. Ленина, 10. Тел. 208-298, 598-026 (факс) http://www.ppc.vsu.ru; e-mail: pp_center@ppc.vsu.ru Отпечатано в типографии Издательско-полиграфического центра Воронежского государственного университета. 394000, г. Воронеж, ул. Пушкинская, 3. Тел. 204-133 68