УДК: 577.114:581.192:574.917:633.88 ХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ВОДОРАСТВОРИМЫХ ПОЛИСАХАРИДОВ КАЛЛУСНОЙ ТКАНИ ШИПОВНИКА МОРЩИНИСТОГО
реклама

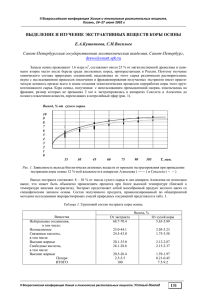
ХИМИЯ РАСТИТЕЛЬНОГО СЫРЬЯ. 2008. №1. С. 51–55. УДК: 577.114:581.192:574.917:633.88 ХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ВОДОРАСТВОРИМЫХ ПОЛИСАХАРИДОВ КАЛЛУСНОЙ ТКАНИ ШИПОВНИКА МОРЩИНИСТОГО ROSA RUGOSA THUNB А.А. Злобин1*, Н.А. Жуков1, Р.Г. Оводова2 1 Вятский государственный университет, ул. Московская, 36, Киров, 610601 (Россия) E-mail: biotech@vgu.ru 2 Институт физиологии Коми научного центра Уральского отделения РАН, ул. Первомайская, 50, Сыктывкар, 167982 (Россия) E-mail: ovois@physiol.komisc.ru Из каллусной ткани околоплодников шиповника морщинистого Rosa rugosa Thunb последовательной экстракцией водой и 0,7% раствором оксалата аммония при 68 °С выделены водорастворимые полисахаридные фракции RRKI и RRKII, которые очищены гельфильрацией на сефакриле S-500 и ионообменной хроматографией на DEAE-целлюлозе. Показано, что RRKI представлена резервными полисахаридами с высоким содержанием остатков галактозы (до 28,6%) и глюкозы (до 44,2%), а фракция RRKII представляет собой пектиновые полисахариды. В качестве главных компонентов в состав фракции RRKII входят остатки галактуроновой кислоты (45%), галактозы (5,2%), арабинозы (2,6%), глюкозы (1,8%) и рамнозы (1,4%). В меньших количествах в ней содержатся остатки маннозы и ксилозы. Методом хромато-массспектрометрии метилированных производных в составе RRKII идентифицированы 1,4-связанные остатки ксилопиранозы и глюкопиранозы, 1,5-связанные остатки арабинофуранозы, 1,6-связанные остатки маннопиранозы и галактопиранозы. На нередуцирующих концах углеводных цепей находятся остатки глюкопиранозы и ксилопиранозы. Введение Последние 20–25 лет характеризуются большим объемом исследований структуры, физико-химических свойств, биологических функций и физиологической активности водорастворимых полисахаридов растений, а также поиском их возможных продуцентов. Это связано с тем, что, являясь элементами питания, они оказывают многоплановое влияние на метаболизм человека и животных [1]. В средней полосе России распространено более 80 видов шиповника (Rosa L.). Несмотря на многолетнюю практику применения препаратов из плодов шиповника (косметология, профилактика и лечение некоторых заболеваний, пищевые продукты и добавки) состав, структура и свойства их водорастворимых полисахаридов практически не изучены. Ранее нами были выделены фракции водорастворимых полисахаридов мякоти плодов шиповника морщинистого, названные «розолинанами», а также исследован их состав и свойства. Было показано, что они представлены пектиновыми веществами, которые проявляют гиполипидемическую активность и влияют на адгезивную способность перитонеальных макрофагов мышей [2]. Целью данной работы является химическая характеристика водорастворимых полисахаридов каллусной ткани околоплодников шиповника морщинистого Rosa rugosa Thunb, которая может служить модельной системой для исследования химического строения пектиновых полисахаридов шиповника и закономерностей их биосинтеза в интактном растении. * Автор, с которым следует вести переписку. 52 А.А. ЗЛОБИН, Н.А. ЖУКОВ, Р.Г. ОВОДОВА Экспериментальная часть Растительный материал. Каллусную ткань околоплодников R. rugosa культивировали в чашках Петри в темноте при 26 °С на питательной среде с минеральной основой Мурасиге-Скуга, содержащей: сахарозу – 15 г/л; глюкозу – 15 г/л; витамины по Стабу; мио-инозит – 100 мг/л; глицин – 2 мг/л и фитогормоны (2,4дихлорфеноксиуксусную кислоту 4 мг/л и 6-бензиламинопурин – 0,2 мг/л). Время культивирования – 21 сутки. Общие аналитические методы. Количественное содержание галактуроновой кислоты определяли спектрофотометрическим методом реакцией с 3,5-диметилфенолом в присутствии концентрированной серной кислоты, по калибровочному графику для D-галактопиранозилуроновой кислоты [4], содержание метоксильных групп – по реакции с пентан-2,4-дионом и калибровочному графику для метанола [5], белка – по методу Лоури с использованием калибровочного графика для бычьего сывороточного альбумина [6]. Спектрофотометрические определения проводили на спектрофотометре Ultrospec 3000 (Швеция). Оптическое вращение водных растворов полисахаридов (с. 0,05) определяли на поляриметре Polartronic MHZ (Германия). Обзорные ИК-спектры образцов снимали в таблетках на КBr на ИК-Фурье спектрометре Scimitar FTS 2000 (Австралия) в диапазоне волновых чисел 4000–400 см-1. Идентификацию галактуроновой кислоты и нейтральных моносахаридов в гидролизатах полисахаридных фракций проводили методом ГЖХ-МС в виде ТМС-производных [3,7] на газовом хроматографе G2589A (Agilent Tech., США) с масс-селективным детектором 5973 INERT (Agilent Tech., США). Разделение ТМС-производных проводили на капиллярной колонке HP-5MS (0,2 мм Ø 30 м, Hewlett-Packard, США). Температура термостата колонки 180→250 ºС со скоростью подъема температуры – 4 ºС/мин. Температура испарителя – 260 ºС, интерфейса – 230 ºС. Газ-носитель – гелий (скорость потока 1 мл/мин, деление потока 20 : 1). Развертка – от m/z 44 до m/z 500; энергия ионизирующих электронов – 70 eV; частота сканирования – 1 скан/сек. Количество вводимой пробы – 1 мкл. Количественное содержание нейтральных моносахаридов определяли методом газожидкостной хроматографии (ГЖХ) в виде соответствующих ацетатов полиолов на хроматографе Hewlett-Packard 4890А (США) с пламенно-ионизационным детектором и интегратором HP 3395A (США) [2]. ГЖХ-МС метилированных производных моносахаридов [3,8] проводили на газовом хроматографе G2589A (Agilent Tech., США) на капиллярной колонке HP-5MS (0,2 мм Ø 30 м, Hewlett-Packard, США). Газноситель – гелий. Температура термостата колонки 150→280 ºС со скоростью подъема температуры – 5 ºС/мин. Температура испарителя – 290 ºС, интерфейса – 250 ºС. Масс-спектрометр: 5973 INERT (Agilent Tech., США); развертка – от m/z 44 до m/z 500; энергия ионизирующих электронов – 70 eV; частота сканирования – 1 скан/сек. Количество вводимой пробы – 1 мкл. Кислотный гидролиз полисахаридов для анализа их моносахаридного состава проводили 2 М раствором трифторуксусной кислоты (TFA), содержащей в качестве внутреннего стандарта мио-инозит (0,125–0,250 мг/мл), при 100 °С в течение 3 ч. Моносахариды переводили в ацетаты полиолов и анализировали методом ГЖХ [2]. Метилирование пектиновых полисахаридов. 30–50 мг полисахарида растворяли в дистиллированной воде, диализовали против 1% водного раствора гидрохлорида триэтиламина и лиофильно высушивали. Полученные соли обезвоживали под вакуумом над Р2О5. К сухому образцу (2–5 мг) добавляли 1 мл тетрагидрофурана, 5 мг LiAlD4 и нагревали с обратным холодильником при 70 °С в течение 1 ч. Раствор нейтрализовали 10% раствором уксусной кислоты в метаноле, диализовали и лиофильно высушивали. Восстановленный образец обезвоживали под вакуумом над Р2О5, добавляли к нему 1 мл диметилсульфоксида и перемешивали в атмосфере азота при комнатной температуре до полного растворения. К раствору приливали 0,5–1,0 мл 2М раствора метилсульфинилкарбаниона (CH3SOCH2-Na+) и перемешивали в токе азота при комнатной температуре в течение 5 ч. Реакционную смесь замораживали, добавляли 1 мл йодистого метила (CH3I) и перемешивали в атмосфере азота в течение 6 ч. Смесь диализовали и лиофильно высушивали. Полученные частично метилированные полисахариды повторно обрабатывали CH3SOCH2-Na+ и CH3I, как описано выше. К полностью метилированным образцам приливали 1 мл 2 М раствора TFA и проводили гидролиз при 100 °С в течение 5 ч. Избыток кислоты отгоняли с метанолом и переводили метилированные моносахариды в соответствующие ацетаты [2]. Все водные растворы и пробы для ГЖХ и ГЖХ/МС-анализа выпаривали под вакуумом при 40–45 °С. Центрифугирование растворов проводили в течение 10 мин при 3000–6000 об/мин. Выделение полисахаридов. Каллусную ткань (162 г) разрушали замораживанием-оттаиванием и обрабатывали в течение 1 ч кипящей смесью метанола с хлороформом (1 : 1). Обезжиренный материал экстрагировали ХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ВОДОРАСТВОРИМЫХ … 53 горячей водой (2 л, 68 ºС) до отрицательной качественной реакции на углеводы [8]. Остаток сырья обрабатывали водой, подкисленной разбавленным (1 : 10) раствором HCl (0,5 л, 2 ч, 50 ºС, рН 4,0), и выделяли полисахариды 0,7% водным раствором оксалата аммония (2 л, 68 ºС). Контроль полноты экстракции определяли фенол-сернокислотным методом [8]. Экстракты концентрировали под вакуумом, осаждали свободный белок [2] и выделяли полисахариды добавлением четырехкратного объема 96% этанола. Полисахариды растворяли в дистиллированной воде и лиофильно высушивали. Выход и состав фракций приведены в таблице 1. Гельфильтрация полисахаридов. Образцы полисахаридов RRКI и RRКII (30-40 мг) растворяли в 1,5 мл 0,01 М раствора NaCl и наносили на колонку (41×1,6 см) с сефакрилом S-500 (Fluka). Свободный объем колонки − 32 мл. Элюирование полисахаридов проводили 0,01 М раствором NaCl со скоростью 20 мл/ч. Отбирали фракции объемом 3 мл. Выход полисахаридов из колонки контролировали фенол-сернокислотным методом [8]. Фракции, соответствующие отдельным пикам, объединяли, концентрировали до минимального объема, диализовали и лиофильно высушивали. Характеристики фракций представлены в таблице 2. Ионообменная хроматография. Образцы полисахарида RRКII (30–35 мг) растворяли в 5 мл 0,01 М раствора NaCl и наносили на колонку (37×1,5 см) с DEAE-целлюлозой (Fluka) в Cl–-форме. Элюирование полисахаридов проводили последовательно 0,01; 0,1; 0,2; 0,3 и 0,5 М растворами NaCl со скоростью 30 мл/ч. Отбирали фракции объемом по 10 мл. Выход полисахаридов из колонки контролировали фенолсернокислотным методом [8]. Фракции, соответствующие отдельным пикам, объединяли, концентрировали, диализовали и лиофильно высушивали. Характеристики фракций представлены в таблице 3. Таблица 1. Состав полисахаридных фракций каллусной ткани R. rugosa Содержание, % GalA Ara Gal Rha Xyl RRКI 2,3 … 4 5,0 19,0 0,5 3,7 RRКII 5,1 11 45 2,6 5,2 1,4 0,8 Примечание. * выход в пересчете на сухую массу обезжиренного материала. Фракция Выход,%* DM Man 0,8 0,4 Glc 16,5 1,8 Белок 48 8 Таблица 2. Состав полисахаридов каллусной ткани после разделения на сефакриле S-500 Содержание, % GalA Ara Gal Rha Xyl Man RRХI-1s 31 +12,9 6 9,4 28,9 1,0 5,3 0,7 RRХII-1s 57 +149,5 63 3,6 6,5 1,9 1,0 сл Примечания. * − выход от количества материала нанесенного на колонку; сл – следовые количества Фракция Выход, %* [α]20D Glc 16,3 1,7 Белок 9 2 Таблица 3. Характеристика полисахаридов после разделения фракции RRKII на DEAE-целлюлозе Фракция Выход, %* [α]20D RRКII-1 16 +172,6 RRКII-2 40 +188,7 Примечание. * – см. примечание к табл. 2. GalA 67 71 Ara 5,3 2,3 Gal 4,6 2,1 Содержание, % Rha Xyl 2,5 0,3 1,6 сл Man сл сл Glc 2,9 1,2 Белок 4 3 Обсуждение результатов Для выделения полисахаридов из каллусной ткани был использован метод последовательной экстракции растительного материала водой и после предварительного гидролиза протопектина разбавленным водным раствором соляной кислоты (рН 4,0; 50 °С), 0,7% водным раствором оксалата аммония при 68 °С [2]. В результате были получены две фракции полисахаридов RRKI и RRKII соответственно. Характеристика фракций приведена в таблице 1. Суммарное содержание водорастворимых полисахаридов в каллусной ткани составляет 7,4%, что значительно ниже их содержания в мякоти плодов данного вида шиповника (13,4%) [2]. Методом хромато-масс-спектрометрии (ГЖХ/МС) триметилсилильных (ТМС) производных [3] в составе полисахаридных фракций RRKI и RRKII идентифицирована галактуроновая кислота (GalA). Количественное определение ее реакцией с 3,5-диметилфенолом [4] показало, что, в отличие от розолинанов плодов шиповника [2], содержание галактуроновой кислоты во фракции RRK-I составляет всего 6%, а главными нейтральными моносахаридными остатками, входящими в ее состав, являются остатки галактозы (Gal), глюкозы (Glc), ксилозы (Xyl) и арабинозы (Ara). В минорных количествах содержатся остатки маннозы (Man) и рамнозы (Rha). Это может свидетельствовать о переключении биосинтеза углеводов в клетках каллусной ткани на образова- 54 А.А. ЗЛОБИН, Н.А. ЖУКОВ, Р.Г. ОВОДОВА ние нейтральных (резервных) полисахаридов. Содержание данной фракции в каллусной ткани существенно ниже, чем содержание соответствующих фракций розолинанов в плодах шиповника морщинистого [2]. Полисахаридная фракция RRK-II характеризуется высоким содержанием галактуроновой кислоты и имеет состав нейтральных моносахаридов типичный для розолинанов, которые ранее были выделены из протопектинового комплекса клеточных стенок мякоти плодов шиповника. Можно отметить более низкое, по сравнению с розолинанами плодов, содержание в ней остатков арабинозы (Ara) и небольшую степень метоксилирования остатков галактуроновой кислоты (DM). Содержание данной фракции в составе протопектина каллусной ткани практически совпадает с содержанием розолинанов, выделенных из протопектина мякоти плодов шиповника [2]. Для очистки полученных фракций от сопутствующих примесей (белка и фенольных соединений) и разделения их по величине молекулярных масс фрагментов полисахаридов, входящих в их состав, был использован метод гельфильтрации. В результате гельфильтрации RRKI и RRKII на сефакриле S-500 были выделены две основные фракции RRKI-1s и RRKII-1s с Kav, равными 0,75 и 0,79 соответственно (табл. 2). Высокое содержание остатков галактозы и глюкозы в RRKI-1s указывает на то, что она образована галактанами и глюканами. В составе глюканов отсутствует крахмал, о чем свидетельствует отрицательный йод-крахмальный тест и отсутствие образования заметного количества глюкозы при воздействии на нее α-амилазы. Можно отметить достаточно высокое, по сравнению с RRKII-1s, содержание в данной фракции остатков ксилозы (табл. 2). Фракция RRKII-1s отличается повышенным (63%) содержанием остатков галактуроновой кислоты. Высокое положительное значение угла удельного оптического вращения водного раствора RRKII-1s указывает на то, что остатки галактуроновой кислоты в составе углеводных цепей полисахарида связаны между собой α-1,4-связями и находятся в D-конфигурации. Кроме того, наличие в ИК-спектре фракции RRKII-1s полос поглощения при 890 см-1, 834 см-1 и 763 см-1 также свидетельствует о том, что остатки галактуроновой кислоты в углеводных цепях полисахаридов находятся в 4С1-α-конформации (для 4С1-β-конформации характерны полосы поглощения при 927 см-1, 880 см-1 и 780 см-1). По составу и содержанию нейтральных моносахаридных остатков RRKII-1s близка к исходной фракции и розолинанам мякоти плодов шиповника [2]. Обе фракции (RRKI-1s и RRKII-1s) содержат определенное количество белка. Это может указывать на то, что соединения белковой природы имеют близкую к полисахаридам молекулярную массу или образуют с ними достаточно прочные соединения. Ионообменной хроматографией фракции RRKII на DEAE-целлюлозе водными растворами NaCl возрастающей концентрации были получены фракции полисахаридов, которые элюировались 0,2 М (RRKII-1) и 0,3 М (RRKII-2) растворами NaCl (табл. 3). Содержание галактуроновой кислоты в полисахаридах RRКII-1 и RRКII-2, полученных при разделении фракции RRKII на DEAE-целлюлозе, составляет 67–71% (табл. 4). По качественному составу и содержанию нейтральных моносахаридов данные полисахариды идентичны исходной фракции и розолинанам плодов шиповника [2]. Преобладающими нейтральными моносахаридными остатками в них являются остатки арабинозы, галактозы, рамнозы и глюкозы, а остатки ксилозы и маннозы содержатся в следовых количествах. Можно отметить, что несмотря на некоторую гетерогенность полученных фракций RRКII-1 и RRКII-2 они, скорее всего, являются полимергомологами или фрагментами одного пектинового полисахарида. Анализ фракций RRKII, RRKII-1s, RRКII-1 и RRКII-2 методом метилирования показал, что в состав их углеводных цепей входят 1,4-связанные остатки ксилопиранозы, 1,5-связанные остатки арабинофуранозы, 1,4-связанные остатки глюкопиранозы, 1,6-связанные остатки маннопиранозы и 1,6-связанные остатки галактопиранозы. На нередуцирующих концах углеводных цепей находятся остатки глюкопиранозы и ксилопиранозы (табл. 4). Таблица 4. Результаты метилирования полисахаридной фракции RRKII Положение метильных групп 2,3-О-Ме2-Araf 2,3,4-О-Ме3-Xylр 2,3-О-Ме3-Xylр 2,3,4-О-Me3-Manр 2,3,4,6-О-Me4-Glср 2,3,6-О-Me3-Glср 2,3,4-О-Me3-Galр Связь →5)-Araf-(1→ Xyl-(1→ →4)-Xyl-(1→ →6)-Manр-(1→ Glср-(1→ →4)-Glср-(1→ →6)-Galр-(1→ ХИМИЧЕСКАЯ ХАРАКТЕРИСТИКА ВОДОРАСТВОРИМЫХ … 55 Таким образом, основываясь на данных моносахаридного состава исходных фракций RRKI и RRKII и полисахаридов, очищенных с помощью гельфильтрации и ионообменной хроматографии, а также результатах метилирования, полисахаридную фракцию RRKI можно отнести к резервным полисахаридам, а фракцию RRKII – к пектиновым полисахаридам, которые близки по составу к розолинанам мякоти плодов шиповника морщинистого. Выводы 1. Впервые из каллусной ткани околоплодников шиповника морщинистого выделены с суммарным выходом 7,4% фракции нейтральных (резервных) и пектиновых полисахаридов. 2. Показано, что резервные полисахариды состоят главным образом из остатков галактозы, глюкозы и арабинозы. 3. Найдено, что углеводные цепи пектиновых полисахаридов, входящих в состав протопектинового комплекса клеточных стенок каллусной ткани, преимущественно состоят из α-1,4-связанных остатков галактуроновой кислоты, а также нейтральных моносахаридов: галактозы, арабинозы, глюкозы и рамнозы; в качестве минорных присутствуют остатки ксилозы и маннозы. 4. С помощью метода метилирования определены размеры окисных циклов нейтральных моносахаридных остатков, входящих в состав пектиновых полисахаридов каллусной ткани. Показано, что их углеводные цепи содержат 1,5-связанные остатки арабинофуранозы, 1,4-связанные остатки ксилопиранозы и глюкопиранозы, а также 1,6-связанные остатки маннопиранозы и галактопиранозы. На нередуцирующих концах углеводных цепей находятся остатки глюкопиранозы и ксилопиранозы. Список литературы 1. 2. 3. 4. 5. 6. 7. 8. Оводов Ю.С. Полисахариды цветковых растений: cтруктура и физиологическая активность // Биоорган. хим. 1998. Т. 24. №7. С. 483–501. Злобин А.А., Оводова Р.Г., Попов С.В. Общая химическая характеристика водорастворимых полисахаридов плодов шиповника морщинистого Rosa rugosa // Химия растительного сырья. 2003. №2. С. 39–44. Костенко В.Г. Хроматографический анализ сахаров, получаемых в процессе переработки растительного сырья. М., 1984. 44 с. Dubois M., Gilles K.A., Hamilton J.K., Rebers P.A., Smith F. Colorimetric method for determination of sugars and related substances // Analyt. Chem. 1956. V. 28. P. 350–356. Wood P.J., Siddiqui I.R. Determination of methanol and its application to measurement of pectin ester content and pectin methyl esterase activity // Analyt. Biochem. 1971. V. 39. P. 418–428. Lowry O.H., Rosebrough N.J., Farr A.L., Randall R.J. Protein measurement with the Pholin phenol reagent // J. Biol. Chem. 1951. V. 193. P. 265–275. York W.S., Darvill A.G., McNeil M., Stevenson T.T., Albersheim P. Isolation and characterisation of plant cell walls and cell-wall components // Meth. Enzymol. 1985. V. 118. P. 3-40. Захарова И.Я., Косенко Л.В. Методы изучения микробных полисахаридов. Киев, 1982. 189 с. Поступило в редакцию 20 сентября 2007 г.