13. Производные карбоновых кислот 13.1. Расположите кислоты
реклама
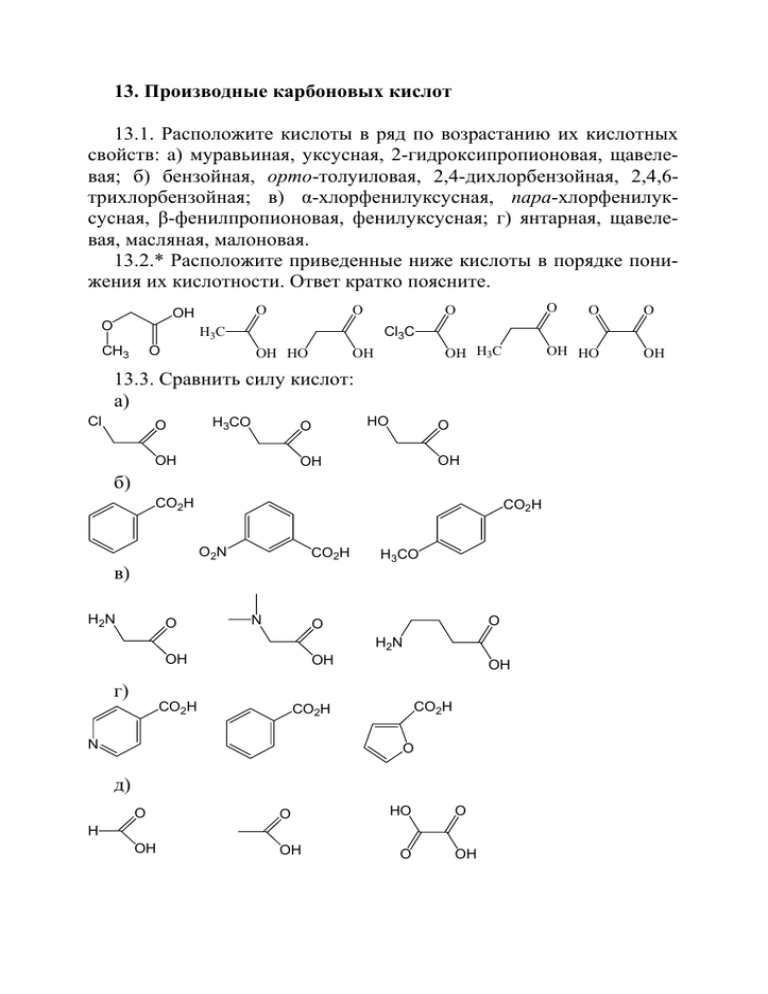
13. Производные карбоновых кислот 13.1. Расположите кислоты в ряд по возрастанию их кислотных свойств: а) муравьиная, уксусная, 2-гидроксипропионовая, щавелевая; б) бензойная, орто-толуиловая, 2,4-дихлорбензойная, 2,4,6трихлорбензойная; в) α-хлорфенилуксусная, пара-хлорфенилуксусная, β-фенилпропионовая, фенилуксусная; г) янтарная, щавелевая, масляная, малоновая. 13.2.* Расположите приведенные ниже кислоты в порядке понижения их кислотности. Ответ кратко поясните. O OH O O O O OH H3C OH HO OH HO OH 13.3. Сравнить силу кислот: а) Cl O H3CO HO O OH O OH OH б) CO2H CO2H O2N CO2H в) H2N O O O Cl3C H3C CH3 O N H3CO O O H2N OH OH OH г) CO2H CO2H CO2H N O д) O O OH OH HO O H O OH OH е) HO3S HO Cl CO2H CO2H CO2H ж) HO O O OH O OH з) CO2H HO2C HO2C HO O CO2H O OH CO2H CO2H 13.4. Расположите следующие соединения в порядке увеличения их кислотности: α-хлорфенилуксусная кислота, пара-хлорфенилуксусная кислота, фенилуксусная кислота, фенол, пара-нитрофенол, бензиловый спирт. 13.5. С какими из следующих реагентов может взаимодействовать хлорангидрид масляной кислоты: этанол; толуол и AlCl3; глицин; пара-нитрофенол; нитробензол и AlCl3; фенилмагнийбромид? Напишите уравнения реакций. 13.6. Предложите не менее четырех различных механизмов гидролиза сложных эфиров. В каком случае скорость гидролиза практически не зависит от рН среды? 13.7. Предложите механизм гидролиза трет-бутоксикарбонильной защитной группы в составе молекулы аминокислоты, защищенной по атому азота. С чем связана легкость гидролиза? 13.8. Скорость гидролиза этилового эфира уксусной кислоты зависит от рН (каким образом?), а бензилового эфира – нет, объясните. 13.9. Как зависит легкость реакции декарбоксиCO2H лирования β,γ-ненасыщенных циклоалкенилкарбоновых кислот от размера цикла? Каков механизм этой реакции? 13.10. Предложите механизм внутримолекулярной этерификации γ-оксикарбоновой кислоты до γ-лактона. 13.11.* Укажите строение всех продуктов полного кислотного гидролиза соединений, представленных ниже: а) H N H3CO O O O OCH3 O N H б) O H3C H N S N H O N H O O O в)* O O CH3 H3C O O N H CH3 N H O O 13.12.* Напишите структуры всех продуктов полного кислотного гидролиза противоракового препарата широкого спектра действия – Dolastatin и охарактеризуйте их с точки зрения оптической активности. N O H N H O H N N O H N O H H O Ph O S N 13.13. Напишите все продукты гидролиза ацетилкофермента А в кислой среде. O O P O O O S O O NH N H O P OH O O P O O O O N N OH O NH2 N N 13.14. Напишите продукты реакции, образующиеся при гидролизе данного соединения в щелочных условиях. O H3C O O O H N O N H CH3 O CH3 O O CH3 CH3 13.15. Определите строение продуктов полного гидролиза приведенных ниже соединений: а) в кислой среде и б) в щелочной среде. O O H N O H N N H O O Br O CH3 CH3 O O O O O O O N H H3C O N O 13.16. Приведите структуры продуктов кислотного гидролиза ампициллина (ранее широко используемого антибиотика) и артикаина (анестетика, используемого в стоматологической практике), триметина – вещества, обладающего противосудорожным действием, и дульцина – вещества, которое в 200 раз слаще сахара. C6H5 S H N H2N COOCH3 O S HN O N NH O HCl C3H7 COOH Ампициллин Артикаин O O NH N O O Триметин N H NH2 Дульцин 13.17. Напишите уравнения реакций, при помощи которых указанные ниже соединения можно превратить в масляную кислоту: а) бутиловый спирт; б) пропиловый спирт (два способа); в) метилпропилкетон. Какой из перечисленных методов можно использовать для получения триметилуксусной кислоты? 13.18. Укажите, с какими из перечисленных ниже веществами будет реагировать бензойная кислота, напишите уравнения реакций: а) Na2CO3; з) PCl3; б) NH3 (aq.); и) SOCl2; в) продукт (д) + нагрев; к) Br2/Fe; л) Br2 + P; г) H2/Ni, 20 °C, 1 атм.; д) LiAlH4; м) HNO3/H2SO4; е) горячий водный раствор KMnO4; н) дымящая H2SO4; ж) PCl5; о) CH3Cl/AlCl3; п) пропиловый спирт, H+. 13.19. Укажите все стадии возможных лабораторных синтезов следующих кислот с использованием любых необходимых алифатических и неорганических реагентов: а) фенилуксусной; б) паратолуиловой; в) мета-хлорбензойной. 13.20. Напишите полные уравнения реакций (если они происходят) и назовите все органические продукты, образующиеся при взаимодействии бутирилхлорида со следующими реагентами: а) H2O; з) спирт. раствор AgNO3; б) изопропиловый спирт; и) CH3NH2; в) п-нитрофенол; к) (CH3)2NH; г) аммиак; л) (CH3)3N д) толуол, AlCl3; м) продукт (к) + LiAlH4; е) нитробензолом, AlCl3; н) (C6H5)2Cd; ж) водным раствором NaHCO3; о) C6H5MgBr; п) продукт (к) + Li[HAl(OEt)3]. 13.21. Напишите полные уравнения реакций метилбутирата (если они происходят) с указанными ниже реагентами и назовите все образующиеся органические продукты: а) горячий водный раствор H2SO4; е) фенилмагнийбромид; б) горячий водный раствор KOH; ж) изобутилмагнийбромид; в) изопропиловый спирт + H2SO4; з) аммиак; г) бензиловый спирт + и) H2, CuO CuCr2O4, нагреваC6H5CH2ONa; ние, давление; д) LiAlH4, затем кислота; к) Na, C2H5OH. 13.22. Предскажите, какие соединения образуются при взаимодействии глицина со следующими реагентами: а) aq. NaOH; д) NaNO2 + HCl; б) aq. HCl; е) C2H5OH + H2SO4; в) бензоилхлорид + aq. NaOH; ж) продукт (е) + NaNO2 + HCl; г) уксусный ангидрид; з) бензилхлоркарбонат (C6H5CH2OCOCl). 13.23. Укажите структуры соединений, которые образуются при нагревании следующих аминокислот: а) глицин → C4H6N2O2 (дикетопиперазин); б) CH3CH(NH2)CH2COOH → C4H6O2; в) CH3CH(NH2)CH2CH2COOH → C5H9NO (лактам); г) H2NCH2CH2CH2CH2COOH → C5H9NO (лактам). Дайте объяснения различному поведению этих соединений при нагревании. 13.24. Напишите уравнения реакций, при помощи которых можно превратить в аланин следующие соединения: а) α-бромпропионовая кислота; б) ацетальдегид; в) 2-оксопропановая кислота. 13.25. Напишите структуры всех промежуточных и конечного продуктов, образующихся в приведенной цепи превращений, ведущей к транквилизатору – мепробамату. • CO2Et CO2Et 1. EtONa LiAlH4 1. EtONa ? ? 2. CH3I 2. n-C3H7Br ? COCl2 (изб.) ? NH3 (изб.) мепробомат 13.26. При окислении перманганатом калия одного из изомеров метилциклогексена образуется вещество состава С7Н12О3, растворимое в щелочи и реагирующее с гидроксиламином и фенилгидразином. Окисление С7Н12О3 сильными окислителями приводит к смеси кислот, среди которых присутствует глутаровая и адипиновая. Напишите структурную формулу исходного соединения и уравнения всех упомянутых реакций. 13.27. Нарисуйте проекцию Фишера природной глутаминовой кислоты. Какое строение будет иметь эта кислота в изоэлектрической точке (рН ~ 3,2)? Как изменится строение при увеличении ки- слотности среды? При добавлении щелочи? Какое превращение произойдет при нагревании этой аминокислоты? 13.28. Реакция бромирования алифатических карбоновых кислот бромом по α-углеродному атому может катализироваться не только фосфором, но и, например, хлористым бензоилом. Предложите схему этой реакции. 13.29. С какими из следующих реагентов может взаимодействовать бензамид: а) метанол в кислой среде; б) алюмогидрид лития; бром в щелочной среде; в) триэтиламин; г) хлористый тионил; д) метилмагнийиодид (1 М)? Напишите уравнения реакций. 13.30. Какие из перечисленных ниже соединений могут быть получены перекрестной конденсацией? Напишите соответствующие пары реагентов-предшественников. а) O C2H5O O O O O O Ph O2N Ph OCH3 A CN C B D Ph E б) O O O Ph CN O B A O O OC2H5 D C NO2 13.31. Предложите метод синтеза указанного ниже соединения с использованием циклогексанона, диэтилкарбоната и (или) метилвинилкетона. O 13.32.* Синтезировать (если это возможно): O * O * O O * OCH 3 OCH3 OH * OH 13.33.* Что вы можете сказать об оптической активности продуктов гидролиза оптически активных эфиров уксусной кислоты, изображенных ниже? O O O O O O H H Ph 13.34. Расшифруйте цепочку превращений; А – альдегид, В – карбоновая кислота. O HCl (газ) Ph3P ? ? (C9H14O) H2O2 AcOH ? HO-/H2O -B ? Cu t Na (изб.) 1. O3 ? ? NH3 (ж) 2. H2O/Zn -А A 13.35.* Определите структуру соединения А и укажите продукты его превращений после стандартной обработки реакционных смесей. а)* ? 1.NaN3, t 2. H2O ? KMnO4 ? SOCl2 t EtMgBr (изб.) A H2 A CO2H Pd/BaSO4 LiAlH4 ? ? б) ? LiAlH4 PhNO2 Sn H+ ? 1. HNO2 2. CuCN 1. BuLi A A 1. LiAlH(OEt)3 2. H3O+ ? ? 2. H2O HO? H2O2 CH3OH H+ ? ? в) ? ? CH3Li (изб.) C6H6 CH3COCl AlCl3 ? PhCO3H NHEt2 A A C2H5OH (изб.) OEt- ? NEt3, H2O H+ ? ? 13.36. Укажите строение продуктов следующих превращений: а) ? 2. H3O+ ? CH3COCH3 1. CH3MgI (2M) EtONa Ph CO2Et HN(CH3)2 LiAlH4 ? ? б) ? Br2 Na2CO3 HO2C Ph ? Ag2O SOCl2 NH3 t ? ? в) ? H+ ? 1. NH3 (CH3)2CHOH CO2Et 2. NaOBr NaNH2 ? H2 хромит меди ? 13.37.* Предложите метод синтеза соединений, структуры которых приведены ниже, из неорганических реагентов: Ph O O O а) б) Ph в) O CO2H CO2H г) CO2H д) CO2H O Ph Ph е) CO2H HN ж)* Ph O H N O O H2 N NH2 NH з)* O HO2C O H N и) O Ph к) H2N COOH O Ph O O N NH2 л) м) O н) O O O HO O H N O O о)* H п) ± O O O H3CO OPh O р) ± F Указание: прежде чем приступать к построению последовательности реакций, приводящей к соединению п, изобразите строение продуктов гидролиза этого соединения. 13.38.* Предложите метод синтеза этилового эфира 2-метил-3оксо-2,3-дифенилпропановой кислоты из неорганических соединений и изобразите структуры продуктов, образующихся при взаимодействии этого соединения с водными растворами кислоты и щелочи при нагревании. Приведите механизм этих превращений. 13.39.* Предложите метод синтеза из неорганических соединений практолола – β-адреноблокатора. H2N O NH O H NHCH3 H OH Ph Эфедрин Прокталол Охарактеризуйте с помощью структур Фишера и R,S-номенклатуры стереоизомерный состав синтезированного вами проктолола. Как можно выделить энантиомерно чистый препарат с использованием набора оптически индивидуальных кислот и оснований, например, L(-)яблочной кислоты HСOOCH2CHOHCOOH и (-)эфедрина? Все реакции напишите для конкретных соединений. 13.40. Приведите строение всех соединений в следующих превращениях: H3CO CH3COCl AlCl3 A PhCO2Et - OEt B I2 (0,5 M) - OEt C OH t -E D CH3NH2 F t Соединение E, образующееся наряду с D, является солью карбоновой кислоты. Объясните направление реакции, приводящей к этим продуктам. 13.41. Изобразите строение всех возможных продуктов, образующихся при взаимодействии этилацетата с этилизобутиратом в присутствии этилата натрия. Укажите, какой (какие) из них является основным и почему. 13.42. Приведите примеры реакций конденсации следующих пар реагентов, которые могут быть проведены с приемлемым выходом: а) альдегид + альдегид; б) альдегид + кетон; в) альдегид + сложный эфир; г) кетон + сложный эфир; д) сложный эфир + сложный эфир. 13.43.* Укажите строение продуктов в следующих цепочках превращений: а) CO2H PCl5 ? 1. (CH3)2Cd Cl2 (1M) ? H+ 2. H2O ? 1. KCN ? 2. H3O+, t б) 1. NaCN Br2 (1M) ? hν 2. H3O+ H3CO ? 1. CH3OH ? PBr3 2. LiAlH4 ? 1. Mg (эфир) 2. CO2 3. H2O в) 1. CH3OH O O ? 2. SOCl2 O 1. PhNH2, H+ H2 ? ? Pd/BaSO4 2. LiAlH4 г) CO2Et 1. OEtCO2Et 2. CH3I (1 M) ? OH- (конц.) 1. OEt? ? 2. CH3ONO2 д) O NR N2H4 t RNH2 + ? HNO2 O е) Na ? EtOH PhCO2Et Na 1. HCN KCN ? толуол ? PhCHO ? 2. H3O+ ж) OHFe 3+ ? Na CO2Et Et2O CO2Et - OEt ? H 3O+ t з)* 1. O3 2. H2O A EtOH, H+ t Б 1. EtONa 2. H3O+, t Г 1. NH2OH 2. H2SO4, t Д ? и) CO2Et CO2Et NaNO2 A H3O+ H2/Pd Ac2O Б 1. EtONa B 2. EtBr H3O+ t CH3OH Г H Na2CO3 Д t + E к) KMnO4 H3O A EtOH, H+ Б t + 1. EtONa 1. PhCO3H Г 2. H3O+, t Д 2. H2O, OH- л)* O NK CO2Et PhCHO O A Б CO2Et H3O+, t - CO2 B 1. SOCl2 2. CH2N2 3. Ag2O Г N H OH-, t Д SOCl2 пиридин CO2- E _ CO2- м) PhOK CO2 t A CH3I (изб.) - Б OH 1. H3O+ 2. SOCl2 3. (CH3)2Cd В Б OEt- Г 1. PhNH2 Д 2. H+, t н) H2N CO2H t A 1. PhCHO (2M), OH2. HI, P 3. H3O+, t Б 1. CH3OH, H+ 2. CH3ONO В 1. CH3CO2H 2. H3O+ 3. t о) CO2Et CH3NO2 CH2O + H A CO2Et EtONa Б H2/Pd H3O+ Г CH2N2 B Ac2O t t = 20o Д NaH t E Г п) O SO2Cl NK 1. O HBr CH3COCl A Б 1 экв. t O Г 2. OH , t 3. H2O р) PhCO2H (2 M) В - (CH3O)2SO2 (изб.) 1. HNO2 1. HNO3/H2SO4 В Б A 2. N2H4/Ni Na2CO3 2. H3O+, t 1. LiAlH4 2. SOCl2 3. KCN 4. LiAlH4 (изб.) Г CH3CHO H+ Д с) PhCHO 1. Ac2O, NaOAc, t A CH3NO2 OEt 2. H2O 3. CH2N2 Б - 1. NaH 1. Zn/H+ В Г 2. t 2. PhCH2Cl т) CO2Et CO2Et 1. OEt- A 2. 1. H3O+, t + 2. Zn/H Б LiAlH4 (изб.) 1. CH3OH, H+ В Г 2. Na2CO3, t CO2Et 3. PhN2+ у) CO2H Br2 / CCl4 HgO A PhCO2-Na+ Na Б Et2O В+Г Na / EtOH Г+Д ф) CN CH3CN 1. EtMgBr 2. H3O+ A CO2Et Б 1. H3O+, t 2. H2 / Ni 20o, 1 атм. N H В PCl5 Г 1. NH3 Д 2. PCl5 NaH Д t х) O O OEt 1. LiAlH4 CO2CH3 2. PBr3 Na+ A H3O+ В t Б NaOH конц. Г+Д ц) PhCH2CO2H ч) CO2Et 1. LDA (2 M) 2. CO2 3. H2O I2 (0.5 экв.) OEt - O 1. SOCl2 2. EtOH AmONO Б B OEt- 1. OEt- (2 экв.) A CO2Et O A Б 2. PhCOCl (2 экв.) Zn AcOH Ac2O Г H3O+ Д t H3PO4/P2O5 H3O+ Г В t O Д H3O+ Е t ш) O 1. CH3CO2H Cl2 (2 M) P (0.3 M) А EtOH Б NK O В 2. OH-, t 3. H+ t Г 1. PhCHO (2M) Д 2. HI, P + 3. H3O ы)* O CH3CHO Ph OH - 1. A O MgCl O Cu+ Б Ag2O 2. H3O+ В NaBH4 э) O CO2Et 1. OEt2. PhCH2Cl 1. H2 / Pt (20o, 1 атм.) Г 2. to (-2C2H5OH) А CH3ONO2 NaH 1. NaH (2 экв.) 2. CH3I (2 экв.) 3. H3O+ Б Д OEtto В Г NH3 H+ Д t C H O 12 14 2 Е ю) O CO2C2H5 Br CO2C2H5 NK 1. EtO- А Br H3O+ глутаминовая t кислота - CO2 Б CO2C2H5 2. O 13.44.* Укажите строение продуктов в следующих цепочках превращений: а) CO2C2H5 O Br CO2C2H5 NK 1. EtO- А Б NH3 H3O+ В t - CO2 Br O 2. лизин Br 1 моль б) O CH3CO2Et NaOEt Ph 1. NaOEt 1. NaOEt OHA B C D t 2. I2 (0.5 M) 2. C2H5Br NH3 t CH3NHNH2 E G в) Ph2CHCl г) + NaCN ? 1. EtOH, H ? 1. EtONa 2. H3O+ 2. H2O CH3COCH3 O OH-, t 1. NaOBr ? 2. H3O+ ? ? H3 O + ? t SOCl2 ? 1. CH3MgI 2. CH3I 1. NH2OH 2. H+, t NH2CH3 ? ? LiAlH4 H2, Pt ? 20o, 1 атм. д) O NaOBr е) O O 1. NaH 2. CH3I ? EtOH ? 1. NaOEt H+ 2. H3O+, t CH2O t ? (CH3)2NH+Cl- ? 1. LiAlH4 2. H2O ? ? 1. NaOCl 2. H3O+ ? NaOEt ? (C3H6O3) ? 1. Na2CO3 2. EtBr F Ag2O ? ? ? ж) O EtBr EtBr 1. Mg (эфир) ? 2. CO2 1. NaOEt ? 2. PhCO2Et з)* Ac2O H3O+ ? ? NaOAc, t (C7H14O3) 1. CH3Li (изб.) ? ? 2. H2O CHO ? ? H3O+ NaOEt 1. Na2CO3 2. EtI ? ? t 1. EtONa 2. CH3I ? H3O+ и) CO2Et 1. OEt- к) CO2Et H3O+, t ? 2. CH3I ? NH2OH ? H2SO4 (к.) ? HNO2 ? O 1. OEt? CO2Et Br H3O+, t ? CH2N2 (изб.) ? Br (0.5 M) 1. OEt? LiI ? 2. PhCH2Cl л) PhCH2CO2H м) 1. LDA (2 M) 2. CO2 3. H2O 1. O3 2. H2O А EtOH ? 1. SOCl2 2. EtOH Б + H ? Zn H O+ AmONO ? ? 3 ? OEt CH3CO2H t (CH3CO)2O 1. H+(1 экв.) 1. N2H4 (2 M) В 2. HNO2 (изб.), 3. t 2. t Г н) Br (1 M) CO2Et LiAlH4 (изб.) PBr3 (изб.) Br Б В А OEt (изб.) CO2Et CO2Et (1 M) CO2Et OEt-(изб.) о) ? NH4OH, H2O 5oC O2 V2O5 ? NH3 ? 1.KOH, EtOH 2.Cl(CH2)5OMe 2PhOH ZnCl2 ? ? KOH ? t Г H3O+ t Д п) O CO2Et ? CO2Et 1. PBr3 изб. 1. LiAlH4 H3O+ ? ? 2. H2O t 2. CH2(COOEt)2 (2 M) NH 1.EtOH / H+ ? - 2. EtO ? /NaH (2 M) H3O+ t ? р) Br2 (2 M) EtCO2H ? EtOH ? P (0.3 M) H O+ NEt3 A ? ? 3 ? t NEt3 t = 100o NaCN + A H3O EtOH ? ? t = 30o H+ с) Br2 (2 M) CH3CO2H H3O+ o ? EtOH A P (0.3 M) + KCN ? 1. EtOH, H ? 1. EtO 2. A 2. H2O ? NH3 P2 O 5 NaOBr ? ? t t ? t = 100 т)* Li+ 1. PhCH3 SOCl2 Br2 hν ? ? 1. Mg (эфир) 2. CO2 EtOH ? ? EtBr -78o N ? ? 2. CO2 3. H3O+ Br2 (0.5 M) EtO- ? H3O+ ? t 13.45.* Установите структуру соединения А. Укажите условия, в которых А превращается в В и С. Предложите соединения, из которых А может быть получено в одну стадию (сборка углеродного скелета!). а)* CO2O O B - ? A ? O2C CO2- C CO2- б) O ? HO2C ? A CH3CO2- + C B - O2C(CH2)3CO2D в) O ? Ph Ph A ? PhCO2- + Ph(CH2)2CO2- O B C D 13.46. Напишите все необходимые уравнения реакций и условия их проведения (не обязательно в одну стадию): а) ? O ? б а ? ? CN NH2 в ? CH2N2 ? Ag+ ? Cl д г O ? ? Условия реакций: а) (CH3)3COK; б) SnCl2, H3O+; в) 1. EtMgBr; 2. H2O; г) 1. LiAlH4 (недост.); 2. H2O; д) EtOH (изб.), H+. б) ? ? а б O NCO CH3OH CN OH в ? г ? ? HO ? H2O д ? Условия реакций: а) 1. CH3Li (изб.), t; 2. H2O; б) CaO, t; в) SOCl2; г) Ag(OH), Br2; д) CH2N2. в) ? CO2Et ? б а ? O CO2Et CH3COCl ? NHOH -HCl ? CH3ONa ? CO2Et в д г ? Условия реакций: а) EtONa (0.1 M), CH3(CH2)3OH (изб.); б) 1. CH3MgBr (изб.); 2. H2O; в) EtONa (1 M), t; г) Na, C2H5OH; д) NH2NH2. ? ? 13.47. Предложите ряд превращений, позволяющих последовательно отделить атомы углерода от молекулы соединения А. O HOOC O COOH NH2 A A а) б) 13.48.* Предложите метод синтеза соединения А из бензола и любых органических соединений С1–С2. Укажите строение продукта реакции А с гидразином в указанных условиях. CO2H HO2C F N2H4, 1 M H+ O F O A 13.49. Предложите метод синтеза диэтилового эфира α,α'диметиладипиновой кислоты из малонового эфира и любых других реагентов. Какое соединение образуется из этого эфира при нагревании его с натрием в толуоле (с последующей обработкой водой)? Напишите уравнение реакции. 13.50. Предложите метод синтеза диэтилового эфира α-метилянтарной кислоты из малонового эфира и любых других реагентов. Какое соединение образуется из этого эфира в условиях реакции сложноэфирной конденсации? Напишите уравнение реакций. 13.51.* Исходя из Ca14CO3 и любых органических и неорганических реактивов, предложите метод синтезапропионовых кислот с изотопной меткой в различных положениях. CH3CH2*COOH CH3*CH2COOH * CH3CH2COOH 13.52. Предложите метод синтеза из пропионовой кислоты, меченой изотопом 14С (положение метки неизвестно), минимум трех соединений, включающих в каждом случае только один из углеродных атомов исходной пропионовой кислоты. 3 CH32CH21COOH A(1C) B(2C) C(3C) 13.53. Предложите метод синтеза 2,5-дикарбэтоксициклогександиона-1,4 исходя из этанола с использованием необходимых неорганических реагентов и напишите реакцию его взаимодействия с водной кислотой при нагревании. 13.54. Предложите метод синтеза 2-карбэтоксицикло-пентанона исходя из бензола и этанола с использованием неорганических реагентов и напишите реакцию его взаимодействия с водной кислотой при нагревании. 13.55.* Предложите метод синтеза из бензола и этанола диэтилового эфира α,α`-диэтил-α,α`-дибензоилянтарной кислоты и напишите реакцию его с концентрированной щелочью и разбавленной кислотой при нагревании. 13.56. Предложите метод синтеза 2-карбэтоксициклогептанона исходя из малонового эфира с использованием необходимых неорганических реагентов и напишите реакцию его с водной кислотой при нагревании. 13.57. Предложите метод синтеза этилового эфира 2-ацетилциклогексанон-2-карбоновой кислоты с использованием этанола и напишите реакцию его с концентрированной щелочью и разбавленной кислотой при нагревании. 13.58. Предложите метод синтеза с использованием бензола и этанола этилового эфира α-ацетил-α-бензоилмасляной кислоты и напишите реакцию его с концентрированной щелочью и разбавленной кислотой при нагревании. 13.59. Предложите метод синтеза метилциклобутилкетона из ацетоуксусного эфира и любых других доступных реагентов. Какие продукты образуются в реакции этого кетона с этилацетатом в присутствии натрия в диэтиловом эфире (с последующей обработкой водой)? Напишите уравнение реакции. 13.60. Предложите метод синтеза с использованием в качестве исходных соединений простых альдегидов и / или кетонов С1 – С4, этилмалоновой кислоты, адипиновой кислоты. 13.61. Приведите схему синтеза следующих кислот из малонового эфира и любых других реагентов: а) α,β-диметилмасляной кислоты; б) α,β-диметилянтарной кислоты; в) 2-этилбутановой кислоты; г) циклобутанкарбоновой кислоты. 13.62.* Предложите метод синтеза α,α'-диметиладипиновой кислоты с использованием простейших органических и любых неорганических реагентов двумя способами – с использованием и без использования малонового эфира. 13.63. Предложите метод синтеза 1,2-бис(карбоксиметил)циклогексана с использованием простейших органических и любых неорганических реагентов двумя способами - с использованием и без использования малонового эфира. 13.64. Предложите метод синтеза β,β’-диметиладипиновой кислоты с использованием только простейших органических и любых неорганических реагентов двумя способами – с использованием и без использования малонового эфира. 13.65. Приведите уравнения реакций в том случае, когда они происходят, отметьте случаи, когда превращения не происходят. а) ? ? H2 NHN C 6H 5 PCl5 O ? HOCH2CH2OH, H+ H NH2CONH2 OH LiAlH4 HCN O ? ? б) A Zn (Hg) H3O+ HO ClCH2OCH3 B NH2OH HO NaHCO3 O C CH3 O CH3COCl NEt3 D ? 13.66.* 1,3-Индандион используют в синтезе алифатических нитросоединений. Ниже приведен пример реализации такого синтеза: O 1. OEt1. OEtOHB A t 2. PhCH2Cl 2. CH3ONO2 Ph NO2 + C O а) Укажите строение всех продуктов приведенной цепи превращений. б) Предложите метод синтеза 1,3-индандиона, используя соединение С (на схеме), этанол и этилацетат. в) 1,3-Индандион может быть превращен с использованием двухстадийного синтеза в нингидрин – реагент для определения α-аминокислот. Первая стадия – взаимодействие с NaNO2 в кислой среде, а вторая – кислотно-катализируемый гидролиз. Первая стадия происходит по механизму, аналогичному реакции сложноэфирной конденсации. Нингидрид – трикетон, существующий в виде моногидрата. Изобразите структурную формулу этого моногидрата и объясните, почему устойчива именно гидратная форма. 13.67. Простейшая аминокислота глицин может быть использована в синтезе других аминокислот в соответствии со следующей схемой: H 2N 1. H2 (1 M) 1. OEtPhCOCl A H+ B C H O Pd 2 (C9H7NO2) 2. PhCHO CO2H NH2 H3O+ D - PhCO2H Ph CO2H а) Укажите строение всех продуктов в приведенной цепи превращений. б) Циклическое соединение В называется азлактоном, и его молекула может выступать в качестве активной метиленовой компоненты. Объясните, почему, и приведите механизм реакции, приводящей к образованию соединения С. в) Одним из процессов, в котором участвуют α-аминокислоты в организме, является их взаимопревращение с участием пиридоксаля (одного из соединений, входящих в группу витаминов В6) и фермента трансаминазы. Это превращение на примере аланина и фенилаланина можно описать следующей схемой: NH2 RCHO CO2H A' A гидролиз B + пиридоксамин изомеризация CHO OH NH2 O HO гидролиз пиридоксамин C C' изомеризация - RCHO CO2H CO2H N пиридоксаль (RCHO) Ph Ph Укажите строение всех участвующих в приведенной схеме соединений. 13.68. В результате окисления кетокислоты A состава С5H8O3 KMnO4 в кислой среде при нагревании была получена смесь уксусной, янтарной и малоновой кислот. При восстановлении кетокислоты А NaBH4 получено соединение, которое при нагревании (160 °С) образует циклический продукт. Напишите упомянутые в задаче вещества и реакции. 13.69.* Предложите методы и реагенты, необходимые для проведения указанных превращений (не обязательно в одну стадию). а)* O CH3 O OH OH O O CH3 O б) OH OEt O HN NH O O O EtO OH в) O COOH CH3 NH2 CH3 O 13.70. Предложите метод синтеза: а) бромбензола-1-С13; б) фторбензола-2-С13; в) анилина-3-С13. В качестве источника изотопа углерода использовать карбонат (С13). 13.71. В приведенных схемах каждой букве соответствует один из типов производных карбоновых кислот, причем каждой букве – свой тип. Предложите значение для каждой из букв, если А – бензойная кислота, а каждая из линий обозначает, что соединенные ею буквы (вещества) могут быть получены одно из другого. Укажите условия, в которых могут происходить эти превращения. C B A B C A а) D А E В F D б) F Б Б E В А в) Г Д г) Д Г 13.72. Определите, что скрывается за каждым знаком вопроса в приведенных схемах. а) ? PhCO2H ? ? PhCONH2 ? ? ? ? ? ? PhCOCl б) ? PhCO2H ? ? PhCN ? ? ? ? ? PhCO2CH3 ? 13.73. Определите структуру соединения А и укажите продукты его превращений после стандартной обработки реакционных смесей. а) ? t O2 ? V2O5 EtOH, H+ Cl2, NaOH NH3 t Br2, NaOH A t 1. KOH 2. EtBr ? охлаждение LiAlH4 ? ? ? б) ? 1. PhMgBr 2. EtOH CH2O HCl, ZnCl2 NaCN ? ? EtOH H+ 1. SnCl2, H+ A ? 2. H2O 1.EtONa LiAlH4 2. EtBr ? ? в) ? 2. NHEt2 OCH3 1. ДМФА, POCl3 + 2. H3O ? HCO2H/H2O2 1. SOCl2 NH3 ? t A 1. EtOH, H+ ? 2. EtOAc, EtONa 1. SOCl2 OCH3 ? 2. CH2N2 3. Ag2O HNO3 H2SO4 ? 13.74. Предложите способ синтеза указанных ниже соединений исходя из бензола, метилового и этилового спиртов и необходимых неорганических реагентов. O N O а) O б) N 13.75. Предложите метод синтеза соединений, структура которых представлена ниже, из неорганических соединений. Напишите реакции этих соединений: а) с концентрированной водной щелочью; б) с водным раствором кислоты при нагревании. CO2Et CN O а) Cl Cl б) CO2Et 13.76. Предложите метод синтеза этилового эфира 2-бензил-3оксо-2-фенилбутановой кислоты из простых органических соединений (бензол, С2). 13.77.* Предложите метод синтеза из неорганических реагентов соединений, структура которых представлена ниже: O O O O а) б)* в) O2N O д) O O O O е) NH O O ж) O г) з)* O O и) 13.78.* Предложите способ получения указанного ниже соединения исходя из бензола и любых неорганических реагентов. Ph Ph CO2H Ph CO2H а)* O б) HO2C O HO2C в) F HO2C CO2H COOH г) Ph O2NHC COOC2H5 EtOOC CH3 д)* NH2 HO е)* O HOOC HOOC Ph Ph Ph ж) COOH з) COOH и) COOH COOH NOH COOH NC HOOC к) л) Ph Решения некоторых задач 13.2. Положение кислотно-основного равновесия определяется в случае диссоциации кислот стабильностью карбоксилат-аниона – чем он устойчивее, тем сильнее кислота. Акцепторные (по индуктивному эффекту) заместители стабилизируют анион, донорные – напротив, дестабилизируют. O O O O OH O Cl3C OH (1) > HO OH (2) > HO O O H3C OH (5) > H3C OH (6) OH (3) > CH3 O (4) > Гидроксиуксусная кислота (3) заметно сильнее, чем метоксиуксусная (4), потому что, помимо стабилизирующего анион акцепторного влияния атома кислорода, существенное влияние на его стабилизацию оказывает внутримолекулярная водородная связь. Важно отметить, что и в недепротонированной форме водородная связь также существует, но она более слабая, чем в анионе, поскольку в последнем случае донорно-акцепторное взаимодействие атома водорода происходит с отрицательно заряженным атомом кислорода. O O OH O ±H + O O H H 13.11. в. O OH O CH3 H3C N H O N H O H3O+ O H3C O NH3 + + O O CH3 CH3OH + CO2 + CH3 H3N OH OH + O OH 13.12. На рисунке приведены продукты гидролиза с указанием абсолютной конфигурации асимметрических центров. Гидролиз простых эфиров требует очень жестких условий и в данном случае не происходит. В процессе гидролиза возможна рацемизация α-аминокислот а и б. Гидролиз ароматического гетероцикла тиазола в молекуле соединения д также маловероятен. S H H N б R S N д H3CHN O CO2H а H2 N NH2 CO2H CO2H Ph S C3H7 R H R H в HN H S R O CO2H H г 13.32. Синтез соединений а и б возможен, синтезировать индивидуальные соединения в и г невозможно, поскольку между ними существует быстрое равновесие. O * O * O O * OCH 3 OCH3 OH * OH (б) (в) (а) * CH3OH H+ (г) CH3OH H+ O * O * OH * OH 13.33. В случае соединения А гидролиз как в щелочной, так и в кислой среде происходит по типу присоединения-отщепления по карбонильной группе сложноэфирной группировки. Поэтому в щелочной среде рацемизация не происходит вовсе, в кислой она возможна в незначительной степени вследствие дегидратациии и последующей гидратации образующегося спирта. O O H OH- O H H HO O - CH3CO2H HO A В случае гидролиза соединения Б в кислой среде реакция может происходить по механизму SN1 с образованием устойчивого третичного катиона, в результате чего образуется рацемический спирт. В щелочной среде реакция может проходить как по типу присоединения отщепления, так и по механизму SN1, вследствие чего будет наблюдаться частичная рацемизация продукта. O - HO OH - CH3CO2H O H3O+ O HO Б OH - CH3CO2H SN 1 H 2O - H+ Рацемат Гидролиз соединения В может происходить тремя путями: в кислой среде реализуется механизм SN1 (образуется устойчивый бензильный катион), т. е. происходит рацемизация. В щелочной среде возможна реакция как по типу присоединения-отщепления, так и нуклеофильное замещение по бимолекулярному механизму (бензильное положение!), приводящее к обращению конфигурации. Соотношение этих процессов зависит от растворителя – при проведении реакции в воде вклад механизма SN2 меньше (вода – протонный растворитель), при взаимодействии же эфира В со щелочью в апротонном диполярном растворителе бимолекулярный процесс будет преобладающим. OH O H HO Ph HO- H H3O+ H S N2 O O Обращение конфигурации Ph HOВ - CH3CO2H H HO Ph SN1 H2 O - H+ Ph - CH3CO2H H HO Ph OH Рацемат O 13.35. а) Et Ph OH PhNH2 Et 1. NaN3, t 2. H2O EtMgBr PhCH3 KMnO4 t PhCO2H SOCl2 Ph PhCOCl H2 Pd/BaSO4 PhCHO LiAlH4 CO2H PhCH2OH COCl + PhCO2H Ph 13.37. ж) Ретросинтетическая схема: CO2H HO2C O O O CO2H HO OH O CO2Et C6H6 CO2Et Полная схема синтеза: O O O2 C6H6 CO2Et EtOH O H+ V2O5 CO2Et H2 Pd CO2Et CO2Et EtO- CO2Et EtO2C O O O CO2Et Br CO2H HO-, t H+ HO2C Br2 (1M) P EtO2C O CO2H EtO- HO2C CO2H HO2C CO2H NCS HO2C Cl Br HO2C H2, Ni 20o, 1 атм. CO2H CO2H 1.HO2. H+ Cl O O з) Ретросинтетическая схема: CO2Et O HN H N H N CO2Et EtO OEt O EtO O CO2Et Полная схема синтеза: 1. EtOH 2. NaCN Br2 BrCH2COBr CH3CO2H P (0,3 M) 3. EtOH, H+ 4. H3O+ CO2Et 1. EtO- 2. CH3Br CO2Et 3. H O+, t 3 Br 1. EtOH COBr 2. EtO- Br2 P (0,3 M) CO2H CO2Et O O EtO CO2Et EtO CO2Et CO2Et EtO- CO2Et 1. H3O+, t CO2Et 2. EtOH, H+ CO2Et EtO EtO O O HN HN 1. CH3NH2 2. LiAlH4 3. H2O HN о) Ретросинтетическая схема: O O O O CN H O EtO HO HO + CH3CO2Et Полная схема синтеза: C6H6 CH3CO2H H2SO4 SO3 H2 HOC6H5SO3H PhOH Pd/C t Br2 P (0.3 M) BrCH2COBr EtOH BrCH2CO2Et OH CrO3 H2SO4 Zn O 2.H3O+ O HO2C O OH HO2C CN HO2C t HO2C 1. LiAlH(OEt)3 (2 экв.) KCN H 2. H3O+ 13.38. C6H6 Br2 / Fe C6H5Br 1. Mg / (эфир) 2. CO2 3. EtBr CaC2 H2O C2H2 C t C6H6 C6H5CO2Et CH2O, HCl NaCN PhCH2Cl ZnCl2 PhCH2CN Ph Ph + 1. EtOH, H PhCH2CO2Et 2. H3O+ C6H5CO2Et EtO- CH3I O O CO2Et CO2Et Ph Ph Схема кислотного а и кетонного б расщепления β-кетоэфира: Ph O CO2Et O HO CO2- t а) Ph Ph Ph HO- CO2O- Ph Ph - PhCO2- Ph H3O+ t б) Ph Ph O O Ph Ph O Ph Ph - CO2 O O H H 13.39. Полная схема синтеза: Mg2C3 H2 H2O O2 Ag Pd/BaSO4 H3O+ Hg2+ O H2, NH3 CuO, Cr2O3 NH2 O CO2- OH O NH2 HO NH TsO p-TsCl NEt3 Ts EtO2C N Na2CO3 Ts H N N O O O * H N 1. CH2N2 HO- 2. NH3 CO2Et CONH2 CO2H В молекуле присутствует один асимметрический центр (отмечен «*»), образуется рацемическая смесь, разделить которую можно с использованием оптически активной кислоты, например L(-)-яблочной. При взаимодействии с этой кислотой образуются две соли, являющиеся диастереомерами. Эта смесь может быть разделена обычными физико-химическими методами (например, перекристаллизацией). После гидролиза каждого из диастереомера регенерируется исходная оптически активная кислота, которую можно отделить от основания промыванием водным раствором соды, в результате чего можно выделить энантиомерночистый амин. 13.43. з) EtOH, H+ 1. O3 CO2H CO2H 2. H2O 1. NH2OH 1. EtONa + 2. H3O , t 2. H2SO4, t O t CO2Et CO2Et + N O H Основной продукт NH O л) O O NK Ph CO2Et Ph PhCHO O CO2Et EtO2C N H N CO2Et CO2Et O O O Ph Ph H3O+, t - CO2 1. SOCl2 N 2. CH2N2 3. Ag2O CO2H CO2H O CO2H SOCl2 пиридин NH2 O N H Ph ы) O O 1. CH3CHO OH- Ph OH-, t N O Ph CO2Et O MgCl O Cu+ 2. H3O+ Ph CHO Ag2O O Ph O CO2H O NaBH4 Ph OH O CO2H O H+ t Ph Ph HN NH3 Ph 13.44. з) OH CHO Ac2O CO2H H3O+ CO2H 1. Na2CO3 NaOAc, t OH 2. EtI OCH3 CO2Et 1. EtONa 2. CH3I OCH3 O 1. CH3Li (изб.) ? 2. H2O OCH3 CO2Et H 3O + CO2H т) PhCH3 Br2 hν PhCH2Br Li+ 1. -78o N 1. Mg (эфир) Ph Ph Ph CO2H SOCl 2 2. CO2 3. H3O+ PhCH2CO2Et COCl EtOH COCl CO2H CO2Et EtBr PhCH2CO2- 2. CO2 Ph Ph Ph Br2 (0,5 M) EtO- CO2Et + EtO2C EtO2C Ph H3O t CO2Et CO2H CO2Et CO2H 13.45. а. O EtO2C CO2Et O + H 3O O - t O HO- CO2- t A O2C CO2- C B CO2- O Br CO2Et Br EtO2C EtO- CO2Et CO2Et (0,5 M) CO2Et O O A 13.48. Ретросинтетическая схема: CO2H CO2Et HO2C CO2Et F EtO2C O O F O O F CO2Et F EtO2C CO2Et O F EtO2C O CO2H O F F F Полная схема синтеза: CO2H MnO4- EtBr AlCl3 C6H6 t CO2H PhCO2H 1. HNO3/H2SO4 CO2CH3 CH2N2 1. HNO2 2. HBF4 NH2 3. t 2. H2, Pd/C EtO2C I2 (0,5 M) CH3CO2Et EtO- Na F O F F EtO2C EtO2C CO2Et CO2Et EtO2C CO2Et F 2M O O EtO - CO2Et O O F F F CO2H CO2H HO2C HO2C F F H3O+ t N2H4 (1 M) O N O F Br 1. CO2 PrMgBr Et 2. H3O+ N F Br2 CO2H P (0,3 M) Et CO2Et 1. EtOH COBr 2. EtO- 13.51. Ca*CO3 1. Mg (эфир) C2H5Br 2. *CO2 3. H3O+ CH3CH2*COOH HCl *CO2 1. SOCl2 2. CH2N2 3. Ag 1. Mg (эфир) CH3*CO2H 2. *CO2 3. H3O+ CH3I 1. EtOH, H+ 2. LiAlH4 3. SOCl2 CH3*CH2CO2H *CO2 + H2 *CH3OH NaI H 1. Mg (эфир) *CH3I + CH3*CH2Cl 2. *CO2 3. H3O+ 1. Mg (эфир) 2. CO2 3. H3O+ 1. Mg (эфир) 1. EtOH, H+ *CH3CH2Cl 2. LiAlH4 2. CO2 3. SOCl2 3. H3O+ *CH3CO2H *CH3CH2CO2H 13.55. Схема синтеза: EtBr NaBr [O] EtOH H2SO4 CH3CO2H SOCl2 CH3COCl C 6H 6 Ph AlCl3 O O COCl2 O Ph Ph CO(OEt)2 CO2Et EtONa O 2. EtBr CO2Et Ph 1. EtONa 2. EtBr Ph CO2Et O I2 (0,5 M) EtONa Ph CO2Et O O O 1. EtONa CO2Et Ph CO2Et Ph Ph CO2Et O «Кислотное расщепление»: O O CO2Et Ph Ph CO2Et - OH Ph H2O HO CO2 - OH Ph O CO2 Ph - PhCO2H H2O CO2 O Ph CO2 O O2C CO2 O2C CO2 - PhCO2H O OH Ph O «Кетонное расщепление»: H O CO2Et Ph Ph O H3O+ Ph CO2Et O O O Ph CO2H O Ph t - CO2 Ph O O O O H O O Ph Ph 13.62. Способ 1: 2 CO2Et CO2Et 1. EtONa (2 M) Br CO2Et CO2Et EtO2C 2. CH3I (2 M) CO2Et 2. Br CO2Et EtO2C CO2H CO2Et H3O+ t CO2Et 1. EtONa (2 M) CO2H t - CO2 Способ 2: O O 2 1. EtONa (2 M) Br CO2Et 2. 1. EtONa (2 M) O Br CO2Et 2. CH3I (2 M) CO2Et O CO2H O HOt CO2Et CO2Et CO2H Способ 3: H2 NBS . RO Pd/BaSO4 Br Mg Br CN HBr (2 M) H3O+ t KCN Br CO2H CN CO2H 13.66. а) O O O 1. OEt2. PhCH2Cl Ph NO2 1. OEt2. CH3ONO2 OHt B O O A O Ph CO2Ph NO2 + CO2C б, в) O CO2EtBr (2 M) CO2C CO2Et CH3CO2Et EtOCO2Et CO2Et O H3O+ t O O O HNO2 NOH EtOH H 3O + O O O O H 2O O OH OH O Нингидрин Положение равновесия смещено в сторону гидратной формы вследствие акцепторного влияния двух карбонильных групп. Именно поэтому присоединение воды происходит по средней карбонильной группе. 13.69. а) CH3 CO2H O2 2. H2/Pd/BaSO4 Co2+ CH3 CHO 1. SOCl2 CHO CO2H KOH 1. HO2. H3O+ t CO2-K+ COCl OH 1. H3O+ 2. SOCl2 OH CO2-K+ COCl COCl O O PhCO3H Cd(CH3)2 O O O O COCl O 13.77. а) 1. Mg (эфир) C6H5Br 2. CO2 3. H3O Br2 Fe 1. SOCl2 2. H2O2 PhCO2H PhCO3H O CaC2 H 2O C t C 2H 2 1. H2SO4, SO3, t C 6H 6 Si(CH3)3 O C6H5OH 2. NaOH, t 3. H3O+ O 1. H2/Ni 2. H2Cr2O7 Si(CH3)3 (CH3)3SiCl 1. CH3I (CH3)3SiCl 1. CH3I NaH 2. H2O NaH 2. H2O O O O PhCO3H з) EtOH 1. H2/Pd/BaSO4 2. H3O+ CaC2 H2O O C2H2 C t C6H6 1. H2SO4, SO3, t 2. NaOH, t 3. H3O+ C6H5OH 1. H2/Ni 2. H2Cr2O7 CH3Cl HO2C AlCl3 H+ t 1. EtOH, H+ 2. LiAlH4 3. PBr3 2. KCN 3. H3O+, t Br Br C2H4 1. Br2 (1 M), hν Br2 CN LiAlH4 (изб.) KCN Br CN NH2 NH2 H+ t N H O O N H H 1. N + Br 1. NH2OH 2. H+ + 2. H3O HN N H O 13.78. а) PhCO2Et EtOH H+ PhH 1. Br2/Fe 2. Mg (эфир) 3. CO2 4. H3O+ PhCO2H 1. SOCl2 PhCH2CO2H 2. CH2N2 3. Ag+ EtOH H+ PhCH2CO2Et Ph PhCO2Et EtO- Ph EtO2C O O O PhH CH3COCl AlCl3 CH2O 1. CH3I + Ph (CH3)2NH Cl - Ph N 2. HO-, t Ph Ph Ph O O Ph Ph EtO2C Ph O - EtO O CO2Et O Ph Ph H3O+ t O Ph д) O OH 1. Br2 2. H3O+, t CO2Et 3. пиридин, t 1. HNO3 (разб.), t 2. EtOH, H+ 3. EtONa O 1. H2SO4, SO3, t 2. HO-, t 3. H2/Ni-Re, t, p C6H5 CH2O HCl ZnCl2 CH3CO2H PhCH2Cl 1. Br2/P 2. NaCN 3. EtOH, H+ 4. H3O+ (разб.) LiAlH4 PhCH3 CO2Et Cl CH2O HCl ZnCl2 + орто-изомер 1. EtONa Cl CO2Et CO2Et 2. CO2Et O O CH3 1. H3O+, t 2. CH3NO2/HO3. EtOH, H+ EtONa CO2Et EtO2C EtO2C H 3C CHNO2 е) PhCHO CH3NO2 HO- Ph NO2 EtOH CO, HCl AlCl3, Cu 1. H2/Pd/BaSO4 2. H3O+ CaC2 H 2O C2H2 C t C6H6 1. H2SO4, SO3, t 2. NaOH, t 3. H3O+ C6H5OH 1. H2/Ni CO2Et 2. HNO3 3. EtOH, H+ CO2Et O Ph O EtO- CO2Et Ph 1. H2/Pd EtO- Ph EtO2C HO NH2 NO2 NO2 CO2Et 2. NaBH4

