17. Задачи повышенной сложности 17.1. Ниже приведены
реклама
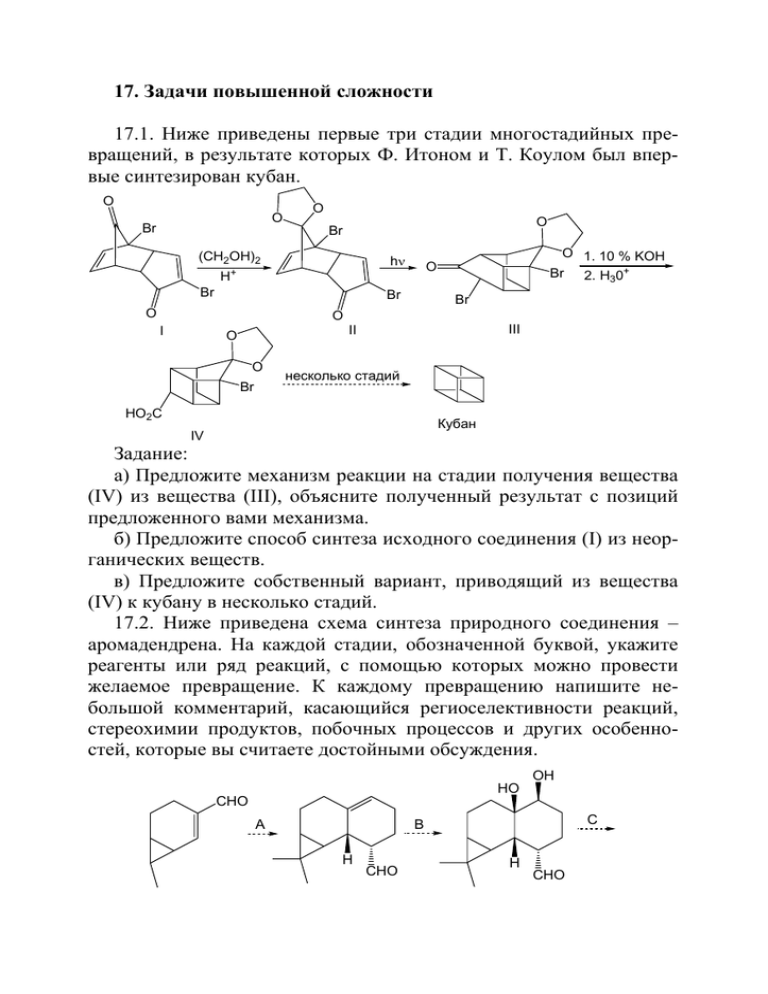
17. Задачи повышенной сложности 17.1. Ниже приведены первые три стадии многостадийных превращений, в результате которых Ф. Итоном и Т. Коулом был впервые синтезирован кубан. O O Br O O Br (CH2OH)2 hν H Br Br O O 1. 10 % KOH 2. H30+ O + Br Br O I III II O O Br несколько стадий HO2C Кубан IV Задание: а) Предложите механизм реакции на стадии получения вещества (IV) из вещества (III), объясните полученный результат с позиций предложенного вами механизма. б) Предложите способ синтеза исходного соединения (I) из неорганических веществ. в) Предложите собственный вариант, приводящий из вещества (IV) к кубану в несколько стадий. 17.2. Ниже приведена схема синтеза природного соединения – аромадендрена. На каждой стадии, обозначенной буквой, укажите реагенты или ряд реакций, с помощью которых можно провести желаемое превращение. К каждому превращению напишите небольшой комментарий, касающийся региоселективности реакций, стереохимии продуктов, побочных процессов и других особенностей, которые вы считаете достойными обсуждения. OH HO CHO C B A H CHO H CHO O H H D H H Аромадендрен 17.3. Весной 1931 г. И. Л. Кнунянц и Н. Н. Ворожцов (впоследствии – академики) приступили к расшифровке состава противомалярийного препарата «Plasmochin Bayer» (Германия) с целью создания отечественного аналога этого лекарства. Обработка щелочью и последующий анализ позволили выяснить, что плазмохин является солью азотистого основания A и карбоновой кислоты B. HO2C CO2H OH HO N H N Et N Et A OCH3 B Плазмохин Синтез кислоты B был описан в литературе, а синтез азотистого основания A можно осуществить с использованием ацетопропилового спирта C. Для синтеза соединения С И. Л. Кнунянц подействовал окисью этилена на натриевое производное ацетоуксусного эфира, причем использовал для проведения реакции не этилат натрия в абсолютном спирте, а 20 %-й водный раствор щелочи (коллеги были уверены, что ничего не получится!). Результат превзошел все ожидания: с высоким выходом был выделен лактон (до сих пор называемый «лактоном Кнунянца»), из которого при гидролизе с очень хорошим выходом получился кетоспирт C. O CO2Et O NaOH O лактон H2O Кнунянца HO- OH C Задания: а) Напишите структуру лактона Кнунянца и механизм его образования из ацетоуксусного эфира. Опишите механизм гидролиза этого лактона до кетоспирта C. б) Исходя из бензола, спиртов C1 – C3, кетоспирта C и неорганических реактивов, предложите способ синтеза соединения A. в) Предложите приемлемый лабораторный синтез кислоты B из нафталина и неорганических регентов. Примечание: результатом описанной здесь работы явилось создание отечественного препарата «акрихин», действующее начало которого имеет несколько иное строение. В 1934 г. под Москвой был пущен завод «Акрихин», который существует до сих пор. Если в начале 30-х гг в СССР были больны малярией сотни тысяч человек, то в 1941 г. заболеваемость упала по сравнению с 1934 вчетверо, а к 1952 – более чем в 50 раз. К моменту начала работы Н. Н. Ворожцову и И. Л. Кнунянцу было по 25 лет. 17.4. Соединение А может быть разделено на оптические изомеры. При окислении одного из энантиомеров образуется кетон B, который также является оптически активным соединением с удельным вращением [α]D = –439°. При нагревании кетон В рацемизуется. [O] OH A O B Объясните причину оптической активности кетона B. Что вы можете сказать о стереоизомерах спирта, образующегося при восстановлении оптически активного кетона B боргидридом натрия? Сколько оптических изомеров теоретически может быть у спирта A? Как можно определить, что величина удельного оптического вращения кетона В составляет именно –439°, а не величину – 439±360°? Предложите метод синтеза соединения А. 17.5. В марте 1998 г. FDA официально одобрило одну из последних разработок фармацевтического гиганта Pfizer Inc. – таблетки с коммерческим названием «Виагра». Маленькая синяя таблетка ста- ла очередным даром научно-технической революции, возложенным на алтарь Потребления – ведь за открытия, лежащие в основе разработки «Виагры» трое американских ученых (Р. Ферчготт, Л. Игнарро и Ф. Мюрад) в этом же 1998 г. получили Нобелевскую премию по медицине и физиологии! Два слова в защиту ученых. Премия получена за многолетнее и успешное изучение роли оксида азота (NO) в деятельности кровеносной системы, а не за разработку самой «Виагры», как утверждали некоторые отечественные журналы. При всей актуальности проблемы импотенции – на Нобелевский приз «Виагра» все же «не тянет». Ниже приведена схема синтеза действующего вещества этого препарата, которое используется в виде соли – цитрата. HO2C EtO2C O O N NH N N CO2Et O EtO H2NOC H2N N HN N N O N NH N N OEt CONH2 N O HN N N N N O N OEt S O Виагра Задание: укажите условия, в которых происходит каждое из указанных превращений (имейте в виду, что одна стрелка не обязательно означает одну стадию) и предложите методы синтеза всех необходимых органических реагентов. 17.6. Ювабион – сесквитерпеновый кетоэфир – был впервые выделен из канадской пихты Abies grandis. Это соединение проявляет ювенильную гормональную активность, т. е. модифицирует метаморфозы определенных видов насекомых. Существует несколько методов синтеза ювабиона, одним из принципиальных различий в которых является использование природных хиральных предшественников либо синтез из ахиральных исходных соединений, приводящий к рацемическому продукту. В последнем случае на одной из стадий синтеза приходится разделять образующуюся смесь энантиомеров, поскольку только один из них обладает ювенильной активностью. Ниже приведена одна из схем синтеза ювабиона. Ваша задача – указать реагенты для приведенных превращений, имея в виду, что одна стрелка не обязательно обозначает одну стадию. Укажите, на какой стадии и каким образом вы бы разделяли смесь энантиомеров. OCH3 OCH3 OCH3 OH EtO2C O O OH O CN H3COCO H CO2CH3 H Ювабион Предложенная схема синтеза вам может по какой-то причине не приглянуться (все-таки разделение смеси энантиомеров!). В таком случае можете предложить свой вариант асимметрического Лимонен синтеза ювабиона из доступного хирального предшественника – лимонена (оптически активный лимонен содержится в скипидаре, апельсиновом масле, других эфирных маслах). Источником хиральности в ювабионе должен быть лимонен, а дру- гие органические и неорганические реактивы можно использовать любые (не выходя за рамки разумного). 17.7. Какого рода стереоизомерами по отношению друг к другу являются соединения А и В, структура которых приведена ниже? Каковы перспективы выделить каждое из них в оптически активной форме? Предложите стереоселективный синтез этих соединений из доступных исходных веществ и реактивов, полагая, что фотоизомеризацию по ряду причин использовать не удается. Изобразите наиболее устойчивые конформации соединений А и В. H H A B 17.8. Алкалоид хинин имеет сложное строение. Началом работы по установлению его структуры можно считать 1820 г., когда Пеллетье и Кавенту выделили хинин в кристаллическом виде. В 1854 г. Штрекер установил его брутто-формулу. Затем последовал более чем полувековой период работы многих химиков (включая Бутлерова), который привел к предположительной структуре (впоследствии оказавшейся верной). Окончательную точку в установлении структуры хинина поставил американский химик Роберт Вудворд, который вместе с Дерингом в 1944 г. осуществил его синтез. В этот момент Вудворд, которому было 27 лет, работал в Гарвардском университете. Полный синтез хинина произвел переворот в синтетической органической химии и в значительной мере предопределил пути ее развития на десятки лет вперед. ? ? N A ? B N O HO O C+D COOEt HON выделение цис-изомера C EtONa ? ? C5H11ONO F N O E G HN COOEt COOEt O H3CO H3CO ? N N EtONa H NaOBr I K ? N H Y N HO H3CO N Хинин Реконструируйте синтез Вудворда. Предложите структуры A – K, условия проведения реакций (там, где их нет в схеме) и возможные побочные продукты. Предложите механизм превращения вещества С в вещество Е. Нарисуйте стереоизомеры С и D (например, в виде проекций Ньюмена) и объясните, почему один из них не подходит для дальнейшей работы. Предложите метод синтеза 4-карбэтокси-6-метоксихинолина, используемого при получении вещества I из бензола и соединений С1-С2. 17.9. Предложите метод синтеза индивидуальных диастереомеров А и В, используя любые катализаторы, растворители, неорганические соединения, а также бензол и другие органические соединения до С2. Предложите механизм превращения соединения А (или В) в соединение С. Объясните, почему пинаколиновая перегруппировка не конкурирует с этим превращением. Et HO Et Et O H+ O HO Et A и B O O C 17.10. Для синтеза простагландина D в качестве исходного соединения было взято производное норборнена A: HOOC Ph O Ph O O O O O Ph OH I O O Ph A С B O Ph O O O O D Восстановите все стадии синтеза (с указанием реагентов и продуктов во всех реакциях). Учтите, что каждая стрелка в приведенной выше схеме может включать более одной стадии. Предложите способ синтеза исходного вещества A из адипиновой кислоты, бензола и других органических соединений С1 – С2. Сколько асимметрических центров в молекуле D? Если у вас есть соображения по поводу конфигурации каждого центра, преимущественно формирующейся в ходе синтеза, – изложите их. 17.11. Несколько лет тому назад существенный прогресс в медицине обеспечили фторхинолоновые антибиотики. Они эффективны как против граммположительных, так и граммотрицательных бактерий, имеют широкий спектр действия, не токсичны и выводятся из организма в неизменном виде. Некоторые заболевания, требовавшие ранее госпитализации, теперь излечиваются приемом одной таблетки фторхинолона. Синтез наиболее известного из них – ципролета (ципрофлоксацина) – осуществляется по следующей схеме: C6H6 1. 2 HNO3 / H2SO4 + 2. изб. Zn/H3O Br2 1. NaNO2 / HCl D Fe 2. HBF4 3. t A 1. HNO3 / H2SO4 1. 2 NaNO2 / HCl B 2. изб. Zn/HCl 2. изб. HBF4 3. t ? F CN E F F F ? ? C F COCl G F F H O CO2Et CO2 F 2Li+ I (соль C12H8F3LiO5) THF COOEt CH(OEt)3 Ac2O F F OEt J O NH2 COOH F t-BuOH HN 6M HCl K ( C15 H14 F3NO3 ) t-BuOK L t-BuOH t NH N F M ципролет C17H18FN3O3 Восстановите всю схему: расшифруйте знаки вопроса над стрелками, а также не приведенные здесь структуры (из числа A – M) и структуру самого ципролета. Объясните результат реакции на стадии получения соединения K на основании представлений об электронном строении соединения J и механизме реакции. 17.12. При хлорировании пентафторфенола образуется смесь соединений A и B одинакового состава C6ClF5O. Спектр ЯМР 19F одного из них содержит пять сигналов одинаковой интенсивности, а другого – три сигнала с соотношением интенсивностей 2 : 2 : 1. При введении стирола в раствор этой смеси в CCl4 при комнатной температуре гладко образуется только один продукт C, молекулярная формула которого является простой суммой молекулярных формул реагирующих веществ. A B Ph CCl4 20 o C реакция не происходит Приведите структурные формулы соединений A и B. Изобразите структурную формулу продукта C (без учета стереоизомерии), ответ мотивируйте. Реакция между соединением А и стиролом происходит с образованием только одного диастереомера соединения C. Сколько всего стереоизомеров может теоретически существовать для этого соединения? Ответ мотивируйте. Сырой слякотной осенью ампула с раствором соединения C в ацетоне некоторое время стояла при контакте с атмосферой. Запи- санный затем спектр ЯМР 19F показал присутствие нового соединения D, также содержащего пять атомов фтора. Было установлено, что его образование обратимо: при замене растворителя на неполярный смесь C и D вновь превращалась в раствор чистого соединения C. Дайте объяснение наблюдаемому явлению (уравнение реакции, причины ее протекания). 17.13. Леворфанол С – функционализированное производное частично гидрированного фенантрена, является мощным анальгетиком. Его получают в несколько стадий из нитрила А по следующей схеме: CH3 N CH2CN N CH3 H3PO4 t A H3CO C C17H23NO H3CO B Напишите структурную формулу леворфанола С, сколько стереоизомеров этого соединения образуется при его синтезе? Предложите всю цепочку превращений А в С. Опишите механизм реакций на пути от В к С. Предложите рациональный способ получения соединения А из бензола, любых органических соединений С1-С2 и неорганических реагентов. 17.14. Основными компонентами скипидара – продукта перегонки с паром живицы деревьев хвойных пород – являются изомерные монотерпены – пинен, лимонен и сильвестрен – ценное сырье в синтезе различных полезных органических соединений. Пинен Лимонен Сильвестрен Так, первой стадией одного из промышленных способов получения камфоры является изомеризация α-пинена (основного компонента скипидара), катализируемая гидратированной окисью титана при высокой температуре, которая приводит к образованию камфе- на (содержится в масле можжевельника). Предложите механизм этой изомеризации с указанием, почему каждая из стадий процесса является энергетически выгодной, с вашей точки зрения, и способ превращения камфена в камфору. TiO2xH2O ? 180o O Камфора Камфен Пинен В составе живицы присутствует еще один компонент, не упомянутый выше – также монотерпен (изомер, например, лимонена), при взаимодействии которого с избытком НСl образуется два соединения, идентичные соответственно продуктам взаимодействия избытка HСl с лимоненом и сильвестреном. На основании этих данных предложите структуру этого монотерпена (может быть, вы знаете его название?). Реакцией этого монотерпена с формальдегидом в уксусной кислоте получают душистое вещество – вальтерилацетат (C13H20O2), используемый в парфюмерии, изобразите его строение (скелетные перегруппировки в этой реакции не происходят). 17.15. Аспиранту его научным руководителем было предложено провести превращение, указанное ниже, поскольку ему понадобилось соединение А. Аспирант провел реакцию и предъявил своему руководителю синтезированное им соединение, которое, как оказалось, имело структуру В. Руководитель, естественно, предположил, что нерадивый аспирант просто перепутал исходные соединения. Повторные эксперименты показали, что оба они были, отчасти, не правы. Предложите состав продуктов изучаемой реакции и ее механизм. Ph O O O Cl O Ph NaCN DMSO, 20o NC NC O O Ph Ph A B



