Сборник медодических материалов по курсу "Органическая химия"
реклама

Государственное бюджетное образовательное учреждение
высшего профессионального образования
«Российский национальный исследовательский медицинский университет
имени Н. И. Пирогова»
МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ И СОЦИАЛЬНОГО РАЗВИТИЯ
РОССИЙСКОЙ ФЕДЕРАЦИИ
Кафедра Химии лечебного факультета
Сборник методических материалов по курсу
"Органическая химия"
для студентов фармацевтического факультета
Ч а с т ь
1
Подготовлено в соответствии с ФГОС -3
в рамках реализации программы развития РНИМУ
М о с к в а
1
2 0 1 3
Сборник методических материалов по курсу «Органическая химия» для студентов фармацевтических факультетов медицинских Вузов, обучающихся по
специальности 060301 — Фармация. Часть 1, 1-е издание, РНИМУ 2013. 62 с.
Данный сборник включает темы и задания для самостоятельной проработки,
содержание занятий и домашние задания по каждой теме, примеры заданий для
самостоятельной аудиторной работы студента (САРС), примеры билетов
тестовых заданий и текущих контрольных работ, содержание и примеры
билетов модульного контроля. В пособии представлены также некоторые
дополнительные справочные материалы (таблицы) и описания некоторых
лабораторных работ.
Пособие составлено в соответствии с ФГОС-3 по специальности 060301 —
Фармация
Методические указания подготовлены профессором кафедры химии РНИМУ
Белавиным И. Ю., ст. преподавателем Сергеевой В. П. и преподавателем
Чистяковой Н. М.
Общая редакция — профессор Бауков Ю.И.
Информацию о кафедре Химии РНИМУ им. Н. И. Пирогова, расписание
занятий, и другую информацию можно найти на сайте кафедры по адресу:
http://www.rsmu.ru/ → кафедры → кафедра химии → сайт кафедры →
обучение.
Список литературы и ее условные обозначения
ОХ-1 Органическая химия. Кн. 1: Основной курс. Под ред. Н. А.Тюкавкиной.
М.: Дрофа, 2003.
РУК Руководство к лабораторным занятиям по органической химии. Под ред.
Н. А.Тюкавкиной. М.: Дрофа, 2003.
СБ
Настоящий сборник.
2
СОДЕРЖАНИЕ ДИСЦИПЛИНЫ
Органическая химия — фундаментальная дисциплина, входящая в учебный
план подготовки студентов, обучающихся по специальности 060301 Фармация. Она принадлежит к учебному циклу химических дисциплин,
изучается параллельно с аналитической и физической и коллоидной химией и
предваряет изучение фармацевтической и токсикологической химии.
Курс изучается в течение года (III и IV семестры) и завершается экзаменом.
Программа курса включает 4 крупных раздела, называемых модулями:
III семестр
1-й модуль — строение органических соединений, физико-химические
методы их исследования, химия углеводородов.
2-й модуль — химия соединений с одной функциональной группой.
IV семестр
3-й модуль — химия поли- и гетерофункциональных соединений.
4-й модуль — химия биополимеров, их структурных компонентов,
природных биологически важных соединений.
Настоящее пособие включает методические материалы по первому и
второму модулям.
На кафедре Химии используется рейтинговая оценка знаний, умений и
навыков студентов, которая предполагает, что повседневная работа студента
над предметом находит свое отражение в конечной суммарной оценке. Цель
введения этой системы:
1) стимулировать регулярную систематическую работу;
2) повысить состязательность в учебе путем замены усредненных категорий
студентов (отличники, хорошисты, троечники) точной оценкой того места,
которое конкретный студент занимает среди своих сокурсников;
3) исключить возможность любой предвзятости к студентам.
По первому требованию студента преподаватель сообщает ему его текущий
рейтинг. Положения рейтинговой системы приведены на сайте кафедры.
Программы модулей приведены на сайте кафедры.
3
УКАЗАНИЯ К ОФОРМЛЕНИЮ ОТЧЕТОВ
О ВЫПОЛНЕНИИ ЛАБОРАТОРНЫХ РАБОТ
Студент допускается к выполнению лабораторной работы только при
наличии подписи преподавателя в лабораторном журнале с указанием числа.
1.
Для записи отчетов о выполнении лабораторных работ необходимо
завести отдельную тетрадь, на которой должны быть указаны фамилия
учащегося и номер группы.
2.
В отчете должны быть указаны дата выполнения работы, ее
название и цель. В конце отчета следует сделать вывод, в котором, помимо
прочего, отмечается успешность выполнения поставленной задачи и
достижения цели.
3.
Все наблюдения, сделанные в ходе лабораторной работы, сразу же
записываются в рабочую тетрадь. Необходимо отмечать изменение всех
наблюдаемых характеристик исследуемых систем (агрегатного состояния,
температуры, цвета, прозрачности, вязкости и т. д.). Там, где это уместно,
записывайте результаты в виде таблицы. Если это возможно, лучше
заготовить форму для таблицы еще до начала лабораторной работы.
Ошибочные записи не следует замазывать корректором — их просто
перечеркивают одной линией. Делайте все записи разборчиво.
4.
Уравнения химических реакций следует приводить в начале отчета,
если проводится исследование одной реакции в серии экспериментов. Если
изучается несколько реакций, то уравнения приводятся перед описанием
каждого опыта (или серии опытов).
5.
Указывайте, какие арифметические операции использованы при
проведении расчетов, иллюстрируя их на одном подробно выписанном
примере. Не загромождайте расчетную часть отчета деталями вычислений.
Указывайте, в каких единицах определены данные измерений. Как правило,
во время выполнения лабораторной работы вычисления не делают.
6.
На включенные в лабораторную работу пронумерованные вопросы
следует дать письменный ответ в отчете. Отвечайте на вопросы кратко.
7.
Не вносите в отчет ответы на вопросы, содержащиеся в вводной и
описательной частях инструкций к лабораторным работам. Некоторые из
этих вопросов предназначены для того, чтобы обратить внимание на
проблемы, которые будут исследованы в работе. Другие — позволяют
выяснить смысл некоторых особенностей выполнения работы или введены
для самоконтроля и более осмысленного выполнения лабораторной работы.
4
1-й модуль
Строение органических соединений, химия углеводородов
В первом модуле изучаются: номенклатура органических соединений, их
электронное строение, его влияние на кислотно-основные свойства,
пространственное строение органических соединений, стереохимическая
номенклатура, основные закономерности протекания химических реакций,
способы получения и химические свойства углеводородов.
Пример билета тестового контроля исходного уровня
1. К простым эфирам относится вещество, формула которого:
1) СН3СООН
2) НОСН2–СН2ОН
3) С2Н5ОС2Н5
4) С6Н5СООС2Н5
2. В ходе реакции этанола с соляной кислотой в присутствии H2SO4 образуется:
1) этилен
2) 1,2-дихлороэтан
3) хлороэтан
4) винилхлорид
3. Красно-фиолетовое окрашивание наблюдается при действии на белок
1) сульфата меди(II)
2) азотной кислоты (конц)
3) гидроксида меди(II)
4) гидроксида натрия
4. Установите соответствие между названием органического соединения и
классом (группой), к которому(-ой) оно относится.
НАЗВАНИЕ СОЕДИНЕНИЯ
А) аланин
Б) бутин
В) метанол
Г) изопрен
КЛАСС (ГРУППА)
1) альдегиды
2) спирты
3) аминокислоты
4) алкины
5) диены
6) арены
Тема 1. Классификация, структурная изомерия и номенклатура
органических соединений
Содержание темы. Принципы классификации органических соединений.
Основные классы органических соединений. Структурная изомерия (изомерия
углеродного скелета, изомерия положения, межклассовая изомерия).
Гомология. Гомологические ряды основных классов соединений. Номенклатура
органических соединений. Систематические и тривиальные названия.
Функциональные группы. Органические радикалы. Заместительная и
радикально-функциональная номенклатура.
5
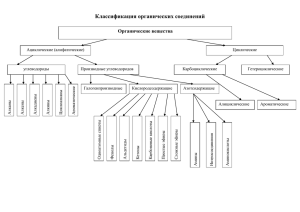
Классификация органических соединений
По строению скелета молекулы
ациклические
карбоциклические
гетероциклические
СН3-СН2-СН2-СН3
бутан
O
циклобутан
тетрагидрофуран
По степени насыщенности
насыщенные:
алканы,
циклоалканы
ненасыщенные:
алкены, алкины,
диены
ароматические:
арены
По наличию функциональной группы
Функциональная группа — атом или группа атомов, определяющих
химические свойства и принадлежность вещества к определенному классу
соединений.
Органический радикал — остаток молекулы органического соединения,
из которого удалили один или несколько атомов водорода, оставив
соответствующее число свободных валентностей (R–, –R– и т. д.).
Углеводороды — функциональная группа отсутствует (R–H).
Галогенопроизводные углеводородов — (R–F, R–Cl, R–Br, R–I).
Спирты — гидроксильная группа (ОН) связана с sp3-гибридизованным
атомом углерода (R–OH).
Фенолы — гидроксильная группа связана с ароматическим кольцом (Ar–OH).
Простые эфиры — алкокси- (OR) или ароксигруппа (OAr) связана с
органическим радикалом (R–O–R, R–O–Ar или Ar–О–Ar).
Тиолы — содержат группу –SH, связанную с органическим радикалом (R–SH).
Cульфиды — содержат атом серы, связанный с двумя органическими
радикалами (R–S–R).
Дисульфиды — содержат два атома серы, связанные между собой (R–S–S–R).
Амины — производные аммиака, в котором один, два или три атома
водорода замещены на органический радикал (R–NH2, R2NH или R3N).
Нитросоединения — содержат группу NO2, связанную с органическим
радикалом (R–NO2).
6
Альдегиды — содержат карбонильную группу (С=О), связанную с атомом
водорода ( R C
O
H
).
Кетоны — содержат карбонильную группу (С=О), связанную с двумя
органическими радикалами ( R C R ).
O
Карбоновые кислоты — содержат карбоксильную группу (СООН),
связанную с органическим радикалом (R–COOH).
Сульфоновые кислоты — содержат сульфогруппу (SO3H), связаннную с
органическим радикалом (R–SO3H).
Номенклатура органических соединений
Совокупность названий органических веществ и правил, по которым эти
названия составляются.
Тривиальное название — исторически сложившееся название соединения,
обычно не связанное с его химическим строением.
Новые и наиболее важные термины: родовое название, родоначальное
название, родоначальная структура, заместитель, характеристическая группа,
старшая характеристическая группа, умножающий префикс, локант.
Родовое название — название класса соединения.
Родоначальное название — часть названия соединения, от которой
строится по определенным правилам все название.
Родоначальная структура — органическое соединение, соответствующее
родоначальному названию.
Заместитель — атом или группа атомов, замещающие атомы водорода в
родоначальной структуре.
Функциональная группа — атом или группа атомов, определяющие
принадлежность вещества к определенному классу соединений.
Характеристическая группа — номенклатурный термин, соответствующий понятию заместитель (углеводородные заместители обычно не
считают характеристическими группами).
Старшая характеристическая группа — характеристическая группа,
название которой отражается суффиксом в названии соединения.
Умножающий префикс — приставки ди-, три-, тетра- и т.д., указывающие
число одинаковых заместителей.
Локант — цифра или буква, указывающая положение заместителя в
родоначальной структуре.
Органический радикал — остаток молекулы органического соединения,
из которого удалили один или несколько атомов водорода, оставив
соответствующее число свободных валентностей.
7
Названия некоторых органических соединений и органических радикалов
Соединение
CH4
CH3–CH3
Название
метан
этан
CH3–CH2–CH3
пропан
CH3-CH2-CH2-CH3
CH3-CH-CH3
CH3
Органический радикал
CH3–
CH3–CH2–
3C
CH3-CH2-CH2- H
H3C CH
CH3-CH2-CH2-CH2CH3-CH2-CHCH3-CH-CH2-CH3
CH3
CH3
H3C-CCH3
бутан
изобутан
Название
метил
этил
пропил, изопропил
бутил,
втор-бутил,
изобутил,
трет-бутил
C5H12 пентан, C6H14 гексан, C7H16 гептан, C8H18 октан, C9H20 нонан, C10H22 декан
CH2=CH2
этилен
CH2=CH–
винил
CH2=CH–CH2–
аллил
СН
–СН=СН–
3
CH CH=CH
пропилен
пропенил
3
2
CHCH
СН3–С≡СН
CH3
ацетилен
пропин
бензол
C CH2
изопропенил
этинил
пропаргил
фенил
бензил
CHC–
НС≡С–СН2–
CH2CH3
CH3
орто-толил
толуол
H 3C
мета-толил
пара-толил
H3C
Ароматические соединения:
O
O
HC H HC OH
O
O
H3CC H H3CC OH
O
C OH
O
CH2-C OH
O
H3CC CH
3
OH
фенол
формальдегид,
муравьиная
кислота
HC
NH2
анилин
O
C H
бензальдегид
O
OСН3
анизол
формил
ацетальдегид,
O
уксусная кислота H3CC
ацетил
O
бензоил
бензойная кислота
фенилуксусная
кислота
C
CH2-C
O
O
H3CC CH 2
ацетон
фенилацетил
ацетонил
Кислоты: C2H5COOH пропионовая, СН3СН2СН2COOH масляная,
СН3СН2СН2СН2COOH валериановая, СН3(СН2)4COOH капроновая
Гетероциклические соединения:
O
S
NH
N
фуран тиофен пиррол пиридин
8
Первичный атом углерода — атом, связанный только с одним другим
углеродным атомом, вторичный атом углерода — атом, связанный с двумя
другими углеродными атомами, третичный — с тремя, четвертичный — с
четырьмя.
1
CH3
CH3
2
4
3
C CH2
CH3
CH3
CH
5
CH3
1 и 5 — первичные, 3 — вторичный, 4 — третичный, 2 — четвертичный
атом углерода.
Для спиртов, галогенопроизводных, нитросоединений понятия
первичный, вторичный и третичный используются в зависимости от того, у
какого атома углерода находится функциональная группа:
CH3
CH3CHCH2OH
первичный
спирт
Первичный спирт
изобутиловый спирт
OH
CH3CH2CHCH3
(CH3)3COH
вторичный спирт
Вторичный спирт
втор-бутиловый спирт
третичный
Третичныйспирт
спирт
трет-бутиловый спирт
Для аминов — в зависимости от того, сколько атомов водорода в аммиаке
замещено на органический радикал:
CH3
CH3 C NH2
CH3
трет-бутиламин
первичный
амин
трет-бутиламин
Первичный амин
CH3 NH C2H5
метилэтиламин
вторичный
амин
метилэтиламин
Вторичный амин
CH3 N CH3
CH3
триметиламин
третичный
амин
триметиламин
Третичный амин
Радикально-функциональная номенклатура
1. Использует названия органических радикалов, функциональных групп,
классов соединений, тривиальные названия.
2. В качестве локантов использует греческие буквы (α, β, γ, δ, ε, ω) или
префиксы орто-, мета-, пара-.
3. При наличии нескольких разных заместителей, они приводятся в
алфавитном порядке.
4. Локанты ставятся,
функциональной группе.
начиная
с
атома
углерода,
ближайшего
Построение названия возможно по следующим схемам
1. Для симметричных углеводородов — как удвоенный радикал:
СН2=СН–СН=СН2
дивинил
СН2=СН–СН2–СН2–СН=СН2
диаллил
9
дифенил
к
2. Для соединений с одной функциональной группой (галогенопроизводные,
спирты, тиолы, амины, кетоны, простые эфиры, сульфиды, дисульфиды)
название радикала соединяют с названием класса:
(СН3)2СНCl
изопропилхлорид
CH3
CH3 C NH2
CH3
трет-бутиламин
трет-бутиламин
Первичный амин
C2H5OH
этиловый
спирт
CH3C(O)C2H5
(CH3)2CH2CHOCH=CH2
метилэтилкетон
винилизобутиловый
эфир
CH–СН=СН
N CH3
CH
C2H5 2–S–СН
3 2NH
СН
=СН–СН
23
2
CH3
триметиламин
метилэтиламин
диаллилсульфид
Третичный амин
Вторичный амин
C2H5–S–SCH3
метилэтилдисульфид
3. Для более сложных соединений, например, включающих две функциональные группы, за основу (родоначальную структуру) берут вещество,
имеющее тривиальное название, положение заместителей указывают либо
греческими буквами, либо префиксами орто-, мета-, пара-:
O
СH3 CH CH2 C
OH
NH2
β-аминомасляная
кислота
Br
C
O
H
HO
мета-гидроксибензальдегид
N
γ-бромопиридин
Заместительная номенклатура
Структура названия
РОДОНАЧАЛЬНАЯ
СТАРШАЯ
СТРУКТУРА
ХАРАКТЕРИС- главная цепь,
ТИЧЕСКАЯ
основная циклическая
или гетероциклическая
ГРУППА
структура
АН
СУФФИКС
А
КОРЕНЬ
ЕН
Б
В
Г
И Т. Д.
ИН
ПРЕФИКСЫ
СУФФИКС,
- все заместители (кроме СТАРШЕЙ
обозначающий
насыщенность
ХАРАКТЕРИСТИЧЕСКОЙ ГРУППЫ)
родоначальной структуры
по алфавиту
Порядок составления названия
1.
Выявить все имеющиеся в соединении характеристические группы.
2. Установить, какая группа является старшей. Название этой группы
отражается в виде суффикса и ставится в конце названия соединения с
указанием соответствующего (соответствующих) локанта (локантов). Если
одинаковых характеристических групп несколько, перед суффиксом ставится
умножающий префикс (ди-, три- тетра- и т. д). Все остальные группы войдут в
название соединения в виде префиксов.
10
Классы органических соединений и старшинство характеристических групп
В заместительной
номенклатуре
Функциональная группа
префиксы
суффиксы
I тип – характеристические группы и углеводородные радикалы, указываемые только в
префиксах (не имеют старшинства, перечисляются по алфавиту)
Алканы
R–H
–R
алкильная группа
алкил
–
–F,
фтор,
фторо,
Галогено–Cl
хлор
R–Hal
хлоро
–
алканы
–Br,
бром,
бромо, иодо
–I
иод
Нитроалканы
R–NO2
–NO2
нитрогруппа
нитро
–
Простые
R–O–R'
–O–R'
алкоксигруппа
алкокси
–
эфиры
Сульфиды
R–S–R'
–S–R'
алкилтиогруппа
алкилтио
–
R N R
Вторичные
монозамещенная
RNH
алкиламино
–
амины
аминогруппа
H
Название
класса
Третичные
амины
Формула
класса
R N
R
R
R
R
N
дизамещенная
аминогруппа
диалкиламино
–
II тип – характеристические группы, указываемые
в префиксах (перечисляются по алфавиту наряду с группами I типа) или в суффиксах
(самая старшая группа). При наличии одной из этих групп суффикс обязателен.
Расположены в порядке убывания старшинства
1
овая кислота
-C O
Карбоновые
карбоксильная
O
OH
карбокси
(карбоновая
RC OH
кислоты
группа
-C O
кислота)2
OH
O
O
Сульфоновые
сульфоновая
RS OH
-S OH
сульфогруппа
сульфо
*
кислоты
кислота
O
O
оат
-C O
Сложные
O
OR' алкоксикарбониль алкокси- (алкилкарбокси
RC OR'
эфиры
ная группа
карбонил
-C O
лат)
OR'
O
-C H
карбонильная
оксо
аль
O
Альдегиды
RC H
группа
(формил) карбальдегид
-C O
H
карбонильная
O
C O
Кетоны
оксо
он
RC R'
группа
Спирты,
гидроксильная
R–OH
–OH
гидрокси
ол
фенолы
группа
тиольная
сульфанил
Тиолы**
R–SH
–SH
тиол
(меркаптогруппа) (меркапто)
Первичные
R–NH2
–NH2
аминогруппа
амино
амин
амины
*
1
сульфокислоты, ** тиоспирты, меркаптаны (альтернативные названия).
В скобках указан атом углерода, входящий в родоначальную структуру.
В скобках указаны суффиксы, применяемые в тех случаях, когда атом углерода
функциональной группы не входит в главную цепь.
11
2
Выбрать родоначальную структуру:
3.
Для нециклических соединений — углеводород, соответствующий самой
длинной углеродной цепи, обязательно включающей старшую характеристическую группу (группы). При наличии нескольких характеристических
групп, имеющих порядок старшинства, максимальное число их должно входить
в главную цепь.
Для циклических и гетероциклических соединений за родоначальную
структуру обычно принимают цикл или гетероцикл.
В ряде случаев за родоначальную структуру принимают соединение,
имеющее распространенное тривиальное название (например, фенол,
пенициллин и т.п.).
4. Пронумеровать главную цепь, чтобы старшая характеристическая
группа получила наименьший номер. Если этот критерий не позволяет выбрать
нумерацию, то нумерацию производят так, чтобы сумма всех локантов была
минимальной. В гетероциклических соединениях нумерацию атомов в цикле
всегда начинают с гетероатома.
5. Перечислить префиксы в алфавитном порядке с указанием локантов и
использованием умножающих префиксов, причем умножающие префиксы не
влияют на алфавитную последовательность.
Для сложных заместителей, в которых уже использованы умножающие
префиксы, применяются дополнительные умножающие префиксы (бис-, трис-,
тетракис- и т. д.).
6. Составить полное название соединения (локанты перечисляются через
запятую, между локантами и префиксами и суффиксами ставится дефис.
Локанты ставятся перед префиксами и после суффиксов.
Примеры названий по заместительной номенклатуре
CH3
CH3
8
7
CH3
6
5
4
Cl CH3
3
2
1
CH3 C C C C C C C
O CH=CH2
O
О
CH
3
4
HO
Cl NH2 H
2-амино-6-винил-2,6-диметил-7-оксо-3,3-дихлорооктин-4-аль
2
5
С
1
6
ОН
OH
CH3
SH
5
6
4 3
N
1 2
N
OH
4-гидрокси-3-изопропил- 2,4-дигидрокси-5-5-меркаптоциклогексен- -метилпиримидин
-2-карбоновая кислота
Домашнее задание по теме 1
1. Проработайте учебник ОХ-1, разделы 1.1–1.3.7 (с. 10–27).
2. Выучите формулы веществ, приведенных в таблице на с. 8, Сб.
12
3. Напишите общие формулы гомологических рядов насыщенных спиртов,
аминов, тиолов и сульфидов, альдегидов и кетонов, карбоновых кислот и
сложных эфиров, сульфокислот и нитросоединений.
4. Напишите формулы структурных изомеров: а) циклических спиртов
С5Н10О; б) кетонов С5Н10О; в) тиолов С4Н10S; в) сложных эфиров С4Н8О2;
г) аминов С3Н9N.
В п. а) укажите первичные, вторичные и третичные спирты; в п. в) укажите
первичные, вторичные и третичные атомы углерода; в п. г) укажите первичные,
вторичные и третичные амины.
3. Напишите структурные формулы следующих углеводородов:
а) 2-метилпентан; б) 3-метилпентен-1; в) 3-изопропилгексин-1; г) гептадиен1,3-ин-5;
д) 2,2,3,3-тетраметилпентан;
е) 3-винилгексадиен-1,4;
ж) 3этинилгексадиен-1,5.
4. Подготовьтесь к формульному диктанту (см. ниже).
Задания для самостоятельной аудиторной работы студента (САРСа)
1. К каким классам органических соединений относятся вещества, формулы
которых приведены ниже:
O
а) CH2=CH-O-CH3; б) H3CCH CH3; в)
OH; г)
C H; д) H3CC O ;
OH
OH
O
CH
е) CH2=CH-S-CH3; ж)
;
C CH ; з) H3CN CH3; и) HC O
CH2OH;
OC H к)
3
O
C OH;
3
2 5
п) H3CCH CH3 .
OCH3
2. Назовите по заместительной номенклатуре следующие ациклические
углеводороды:
л)CH3-S-S-CH3;
SO3H; н)
м)
а) СН3 СН2 СН СН СН3 ;
СН3 СН3
о)
NH2;
б) СН3 СН2 СН С СН
;
СН2 СН2 СН3
в) СН2 СН СН2 СН СН2 СН СН2; г) СН2 СН СН СН С СН2.
С СН
СН3 СН СН3
3. Назовите по заместительной номенклатуре следующие циклические
углеводороды:
CH3
а)
;
СН3
б)
; в)
СН3
СН
СН3 ; г)
СН3
C2H5
4. Назовите по заместительной номенклатуре следующие вещества:
а) CH3CH2CH2NH2;
б) CH3CH2CH2CH2OH;
в) CH3CH2CH2C(O)H;
г) HO-CH2CH2–NH2; д) HO–CH2CH2CH2C(O)OH; е) HC(O)CH2CH(OH)CH2NH2.
13
5. Напишите
структурные
углеводородов:
формулы
следующих
циклических
а) 3,4-диметилциклогексен; б) 2,3,4-триметилстирол; в) 2-метилнафталин; г) 1аллилнафталин.
6. Напишите структурные формулы следующих соединений:
а) 2-меркаптопентандиовая кислота;
б) 2-хлорометилбутен-2-ол-1;
в) 2-гидрокси-3-метилгептен-3-овая кислота;
г) 1,4-дигидрокси-3-этилбутанон.
7. Назовите соединения по радикально-функциональной номенклатуре,
используя названия радикалов, классов соединений и функциональных групп:
1) CH3CH2CH(NH2)CH3;
2) CH3CH(Cl)CH3;
3) CH2=CHCH2OCH2C6H5;
4) CH3CH(SH)CH3;
5) CH2=CHCH=CH2;
6) CH3CH2CH2CH2OH;
7) CH2=CHC(O)CH=CH2;
8) CH3CH2CH2Br;
9) CH2=CHCH2OC6H5;
10) CH3C(O)CH2OH;
11) H2NCH2CH2CH2COOH;
12) CH3CH(OH)COOH;
13) CH3CH(NH2)COOH;.14) ClCH2CH2COOH; 15) орто-NH2–C6H4–COOH.
8. Напишите структурные формулы следующих соединений:
1) метилбромид;
2) этиловый
спирт;
3) метилэтиловый
эфир;
4) дибензилсульфид;
5) изобутиламин;
6) изопропилфенилкетон;
7) винилэтилкетон; 8) фенилаллиловый эфир; 9) дивинил; 10) гидроксиацетон;
11) мета-аминобензальдегид; 12) пара-нитроанилин; 13) -гидроксимасляная
кислота; 14) -аминопиррол; 15) -метилпиридин; 16) -нитрофуран; 17) метилтиофен.
9. Систематическое название лекарственного средства терпина — 4-(1гидрокси-1-метилэтил)-1-метилциклогексанол. Приведите его структуру и
отметьте первичный; вторичный и третичный атомы углерода. К какому классу
относится терпин? (РУК, п. 7.15, с. 207).
10. Основу биологически активных простагландинов составляет простановая кислота, систематическое название которой 7-(2-октилциклопентил)гептановая кислота. Приведите ее структуру. (РУК, п. 7.16, с. 207).
11. Лекарственное средство димедрол имеет систематическое название —
N,N-диметил-2-(дифенилметокси)этанамин. Приведите его структуру. Какие
функциональные группы содержатся в молекуле димедрола? (РУК, п. 7.17, с.
207).
12. Противоопухолевое средство сарколизин имеет систематическое
название 2-амино-3-{3-гидрокси-4-[бис(2-хлороэтил)амино]фенил}пропановая
кислота. Приведите его структуру. Отметьте в молекуле сарколизина
функциональные группы. (РУК, п. 7.14, с. 207).
14
13. В алкалоиде атропине в виде сложного эфира содержится троповая
кислота:
СН
СООН
СН2ОН
Выделите в ее молекуле родоначальную структуру и назовите троповую
кислоту по заместительной номенклатуре. Какие функциональные группы
содержатся в ее молекуле? (РУК, п. 7.6, с. 205).
14. В молекуле алкалоида эфедрина выделите родоначальную структуру,
функциональные группы и назовите это соединение по заместительной
номенклатуре. (РУК, п. 7.17, с. 206).
СН
СНNHCH3
ОН CH3
15. Хинная кислота входит в состав коры хинного дерева. Выделите в ее
молекуле родоначальную структуру и функциональные группы. Назовите
хинную кислоту по заместительной номенклатуре. (РУК, п. 7.8, с. 206).
COOH
HO
OH
HO
OH
16. В молекуле стимулятора ЦНС фенамина выделите родоначальную
структуру и назовите соединение по заместительной номенклатуре. (РУК, п.
7.9, с. 206).
СН2
СНNH2
CH3
17. Тирозин — одна из α-аминокислот, входящих в состав белков. Выделите
в его молекуле родоначальную структуру, функциональные группы и назовите
эту аминокислоту по заместительной номенклатуре. (РУК, п. 7.10, с. 206).
HO
СН2
СН COOH
NH2
18. В молекуле ванилина выделите функциональные группы и назовите это
соединение по заместительной номенклатуре. (РУК, п. 7.11, с. 206).
O
HO
C
H3CO
15
H
19. Назовите
цитраль
(СН3)2С=СНСН2СН2С(СН3)=СН—СН=О
по
заместительной номенклатуре. К какому классу относится это соединение?
(РУК, п. 7.12, с. 207).
20. Ацетилацетон представляет собой равновесную смесь двух изомеров:
СН3–С(О)–СН2–С(О)–СН3
СН3–С(ОН)=СН–С(О)–СН3
Выделите в них функциональные группы и назовите каждый изомер по
заместительной номенклатуре. (РУК, п. 7.13, с. 207).
21. Сульфаниловая кислота составляет основу сульфаниламидных препаратов. Назовите ее по заместительной номенклатуре. (РУК, п. 7.18, с. 207).
H2N
SO3H
22. Лекарственное средство унитиол представляет собой натриевую соль
соединения, имеющего строение HS–СН2–СН(SН)–СН2SO3Н. Выделите в этом
соединении функциональные группы и назовите его по заместительной
номенклатуре. (РУК, п. 7.19, с. 207).
Практикум. Техника безопасности в лаборатории органического синтеза.
Использование средств пожаротушения.
Формульный диктант
Напишите формулы следующих веществ и радикалов: ацетон, нафталин,
пентан, изобутил, нонан, толуол, втор-бутил, бензальдегид, масляная кислота,
гептан, аллил, формальдегид, пропан, орто-ксилол, изопропил, уксусная
кислота, пиррол, ацетальдегид, анилин, бензил, валериановая кислота, пиридин,
октан, трет-бутил, муравьиная кислота, ацетил, фуран, этинил, капроновая
кислота, бутан, тиофен, бензойная кислота.
Пример билета контрольной работы
«Номенклатура органических соединений»
1. Напишите структурные формулы:
а) диаллиламина; б) бензилового спирта; в) винилуксусной кислоты; г)
диизопропилового эфира; д) 3-гидроксибутаналя.
2. Назовите по заместительной номенклатуре:
а)
СН2
NH2
СН2
ОН
; б)
СН3
СН СН СН C
СН3 ОН NH2
О
ОН ;
в)
НООС СН СН СООН
3. Назовите по радикально-функциональной номенклатуре:
а) CH2 CH O CH CH2 ;
б) CH3CH2CH COOH
NH2
16
ОН ОН
.
Тема 2. Электронное строение органических соединений
Содержание темы. Типы химических связей в органических соединениях и их
характеристика. Концепция гибридизации атомных орбиталей. Связь типа
гибридизации атома с пространственным строением. Сопряжение и
ароматичность. Электронные эффекты заместителей. Электронодонорные и
электроноакцепторные заместители.
Домашнее задание по теме 2
1. Проработайте материал лекций и ОХ-1, глава 2 (с. 39–74).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
-связь, π-связь, водородная связь, делокализованная химическая связь, p,- и
,-сопряжение, ароматичность (правило Хюккеля), индуктивный эффект,
мезомерный эффект, эффект поля, электронодонорный заместитель, электроноакцепторный заместитель, поляризуемость связи.
3. Определите виды гибридизации атомов углерода в молекуле пентен-3ина-1 и расположите эти атомы в ряд по уменьшению их относительной
электроотрицательности.
4. Учитывая форму и пространственную направленность орбиталей атомов
углерода, графически изобразите схему электронного строения - и π-связей в
молекуле пропена.
5. Определите вид сопряжения в молекуле простейшего ненасыщенного
альдегида пропеналя (акролеина) и дивинилового эфира. Схематически
изобразите перекрывание р-орбиталей в сопряженных системах.
6. Многие природные соединения, используемые в фармации, являются
производными фенантрена. Определите, является ли фенантрен ароматическим
соединением.
Задания для САРСа
1. Используя шкалу электроотрицательности, стрелками укажите направление поляризации обозначенных одинарных связей в соединениях:
CH3–Cl; CH3–O–H; CH3–CH=CH2; CH2=CH–CCH; CH3–S–H.
2. Укажите электронные эффекты (I, M) выделенных кружками
заместителей, обозначьте их соответствующими стрелками (прямыми вдоль
связи – индуктивный, изогнутыми – мезомерный):
CH3CH2 NH2 ; CH3 CH CH2 ; CH2 CH OC2H5 ;
O
NH2 ; ClCH2C H ; CH2=CHC O
OH
3. В нижеприведенных частицах:
а) CH2 CH CH CH2; б)CH3 CH2 CH3; в) CH2 CH O CH3;
.
; д)
ж)
NH;
г)
е)
CH
CH3; з)
CH CH3
NH2;
17
а) выделите систему сопряжения (если она имеется); б) укажите тип
сопряжения (,- или p,-); в) укажите число атомов и число электронов в
сопряженных системах; г) определите, какие структуры являются ароматическими; д) укажите, в каких частицах все атомы углерода лежат в одной
плоскости.
4. Бициклический углеводород азулен (бицикло[5,3,0]декапентаен-1,3,5,7,9)
содержится в эфирных маслах некоторых растений (полыни, ромашки).
Напишите формулу азулена и объясните причину его повышенной термодинамической устойчивости. (РУК, п. 8.6, с. 208).
5. Органические ионы, как правило, неустойчивы. Однако катион тропилия
(циклогептатриенил-катион) и циклопентадиенид-анион составляют исключение. Объясните причину относительно высокой стабильности этих ионов.
6. Сравните
СН2
устойчивость
двух
карбокатионов
СН2
СН СН СН3
и
СН СН2 СН2 . Покажите перекрывание р-орбиталей в сопряженном
фрагменте. (РУК, п. 8.22, с. 209).
7. В каком из карбанионов, СН3СН2 СН СН О или СН3 СН СН2 СН О ,
более эффективно делокализуется отрицательный заряд под влиянием
заместителей, связанных с анионным центром? (РУК, п. 8.17, с. 209).
8. Обозначьте графически электронные эффекты функциональных групп в
молекуле 4-гидроксибутановой кислоты. Укажите вид и знак этих эффектов.
(РУК, п. 8.9, с. 208).
9. Покажите графически как распределена электронная плотность в
молекуле кротоновой (транс-бутен-2-овой) кислоты. Укажите виды
сопряжения и сравните электроотрицательность атомов в сопряженном
фрагменте. (РУК, п. 8.8, с. 208).
10. Коричная (3-фенилпропеновая) кислота участвует в биосинтезе
фенолокислот. Графически покажите распределение электронной плотности в
молекуле коричной кислоты и изобразите перекрывание р-орбиталей в
сопряженной системе. (РУК, п. 8.10, с. 208).
11. Сравните электронные эффекты диметиламиногруппы N(СН3)2 в
молекулах третичных аминов — диметилэтиламина и винилдиметиламина.
(РУК, п. 8.13, с. 208).
12. Какие электронные эффекты проявляют одинаковые функциональные
группы в пара–хлорофеноле и 2-метил-1,1,1-трихлоропропаноле-2? (РУК, п.
8.24, с. 210).
13. Как различаются по электронной плотности бензольные кольца в
молекулах тирозина [2-амино-3-(4-гидроксифенил)пропановой кислоты] и
фенилаланина (2-амино-3-фенилпропановой кислоты)? (РУК, п. 8.15, с. 208).
18
14. Какое влияние — электронодонорное или электроноакцепторное —
оказывает на электронную плотность бензольного кольца каждая из функциональных групп в молекуле ванилина (4-гидрокси-3-метоксибензальдегида)?
(РУК, п. 8.20, с. 209).
15. Какое влияние — электронодонорное или электроноакцепторное —
оказывают функциональные группы в молекуле норадреналина 2-амино-1-(3,4дигидроксифенил)этанола? Обозначьте электронные эффекты. (РУК, п. 8.23, с.
209).
16. Сравните электронные эффекты различных гидроксильных групп в
молекуле адреналина 2-метиламино-1-(3,4-дигидроксифенил)этаноле? (РУК, п.
8.26, с. 209).
Шкала электроотрицательности элементов Полинга
Li < H < S = Csp3 < I < Br = Csp2 < Cl = N < Csp < O < F
1 2.2 2.5
2.6
2.8
3.0
3.2 3.5 4
Электронные эффекты заместителей
Заместители
Индуктивный
эффект
Мезомерный
эффект
Суммарный
электронный эффект
в сопряженной
системе
+I
—
Электронодонор
+I
–I
+М
+M
–I
+M
–F; –Cl; –Br; –I
–I
+M
СН2=СН–
–I
М
Электронодонор
Электронодонор
–I << +M
Электронодонор
–I < +M
Электронодонор или
электроноакцептор
Электронодонор или
электроноакцептор
Электронодонор или
электроноакцептор
Электроноакцептор
Электроноакцептор
Электроноакцептор
Электроноакцептор
Насыщенные
углеводородные
радикалы
–О–
–NH2; –NHR;
–NR2
–OH; –OR
М
–I
–СООН
–С(О)–
–SO3H
–NO2
–I
–I
–I
–I
–М
–М
–М
–М
Практикум. Работа со стеклом.
19
Пример билета тестового контроля
«Электронное строение органических соединений»
1. Определите тип гибризидации выделенного атома углерода в следующем
соединении:
СН3–СН2–С≡СН
2
3
2
1) sp; 2) s p; 3) sp ; 4) sp ; 5) sp4
2. Какой тип сопряжения реализуется в следующей молекуле?
O
CH2 CH C H
1) s,p-; 2) р,p-; 3) р,π-; 4) π,π-; 5) π,π- и р,π3. Какой атом в нижеследующей
электроотрицательностью?
молекуле
обладает
наибольшей
H
Cl
C
F
Br
1) Cl; 2) C; 3) H; 4) F; 5) Br
4. Сколько атомов входит в систему сопряжения в следующей молекуле?
CH3
O
1) 3; 2) 7; 3) 6; 4) 5; 5) 4
5. Каким (какими) электронным эффектом обладает выделенная группа атомов
в нижеприведенном соединении?
COOH
1) – М; 2) – I; 3) + I; 4) – I и – М; 5) – I и + М
Тема 3. Кислотно-основные свойства органических соединений
Содержание темы. Кислоты и основания Бренстеда, кислоты и основания
Льюиса, зависимость кислотных и основных свойств органических соединений
от природы кислотного и основного центра и электронных эффектов
заместителей.
Разделы, выносимые на самостоятельную проработку
Эффект сольватации (ОХ-1, с. 146–147), слабые кислоты и основания в
биологических системах (ОХ-1, с. 150–154), кислоты и основания Льюиса,
принцип ЖМКО (ОХ-1, с. 154–156).
Домашнее задание по теме 3
1. Проработайте материал лекций и ОХ-1, глава 5 (с. 138–156).
20
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
кислота Бренстеда, основание Бренстеда, ОН-кислоты, NH-кислоты, SHкислоты, СН-кислоты, -основания, n-основания, центр кислотности, центр
основности, кислота Льюиса, основание Льюиса.
3. Расположите нижеследующие соединения в порядке возрастания их
кислотности: C2H5OH, СН3С(О)Н, C2H5SH, C2H5NH2. Напишите формулы
оснований, сопряженных этим кислотам.
4. Расположите нижеследующие соединения в порядке возрастания их
основности: диэтиловый эфир, триэтиламин, диэтилсульфид, этилхлорид.
Напишите формулы кислот, сопряженных этим основаниям.
5. Расположите соединения каждой группы в ряд по уменьшению
кислотности:
1) фенол, пара-метилфенол и пара-нитрофенол; 2) бензиловый спирт
С6Н5СН2ОН, бензиламин С6Н5СН2NН2 и фенилметантиол С6Н5СН2SН; 3) этан,
этилен и ацетилен.
6. Повторите формулы для расчета рН слабых кислот и оснований.
7. Оформите лабораторный журнал, опыты 10.1–10.4. (РУК, с. 216–218).
Опыт 10.1. Получение этоксида натрия и его гидролиз
В сухую пробирку поместите 10 капель абсолютного этанола и пинцетом
внесите маленький кусочек металлического натрия, предварительно досуха
отжатого от керосина между листами фильтровальной бумаги. Прикрыв
пробирку пробкой, соберите выделяющийся водород. Поднесите пробирку к
пламени горелки и уберите пробку. Смесь водорода с воздухом сгорает с
характерным «лающим» звуком.
Белый осадок этоксида натрия растворите в двух-трех каплях этанола и
добавьте 1 каплю 1%-ного спиртового раствора фенолфталеина. Индикатор
остается бесцветным. После добавьте в пробирку одну-две капли воды.
Появляется малиновое окрашивание.
Вопросы и задания
1. Напишите схемы реакций получения этоксида натрия и его гидролиза.
Почему вода разлагает этоксид натрия?
2. Какое свойство спиртов проявляется в их реакции с металлическим
натрием? Вступает ли этанол во взаимодействие с гидроксидом натрия?
3. Можно ли с помощью индикаторов обнаружить кислотные свойства
этанола?
4. Почему спирты взаимодействуют с натрием медленнее, чем вода?
21
Опыт 10.2. Получение феноксида натрия и разложение его кислотой
В пробирку поместите 3 капли «жидкого» фенола, 3 капли воды и
встряхните. К возникшей мутной эмульсии добавьте по каплям 10%-ный
раствор гидроксида натрия до образования прозрачного раствора. При
подкислении этого раствора несколькими каплями 10%-ной хлороводородной
кислоты наблюдается помутнение.
Вопросы и задания
1. Напишите схему реакции получения феноксида натрия. Почему в отличие
от спиртов фенол способен взаимодействовать с гидроксидом натрия?
2. Почему при добавлении хлороводородной кислоты к раствору феноксида
натрия наблюдается помутнение? Напишите схему происходящей реакции.
3. Почему в отличие от этоксида натрия феноксид натрия не разлагается
водой?
Опыт 10.3. Обнаружение кислотных свойств стеариновой кислоты
Окислительно-восстановительная реакция между иодидом и иодатом,
протекающая с выделением иода в слабокислой среде, используется для
открытия таких слабых органических кислот, как высшие жирные кислоты
(пальмитиновая, стеариновая и другие). Эти кислоты нельзя обнаружить с
помощью кислотно-основных индикаторов.
В каждую из двух пробирок внесите по 2 капли 10%-ного раствора иодида
калия и 4%-ного раствора иодата калия. Затем в одну из них добавьте 2 капли
10%-ного спиртового раствора стеариновой кислоты. Нагрейте обе пробирки в
течение 1 мин на кипящей водяной бане. После охлаждения внесите в каждую
пробирку по 2 капли раствора крахмального клейстера. Сравните окраску
растворов в обеих пробирках.
Вопросы и задания
1. Напишите схему окислительно-восстановительной
иодидом калия и иодатом калия.
реакции
между
2. Какую роль играет в этой окислительно-восстановительной реакции
стеариновая кислота?
3. Можно ли обнаружить протекание реакции без использования раствора
крахмального клейстера?
Опыт 10.4. Основные свойства алифатических и ароматических аминов
В две пробирки внесите по 2 капли воды. В первую пробирку поместите 1
каплю анилина, во вторую — 1 каплю диэтиламина и взболтайте. С помощью
универсальной индикаторной бумаги или красного лакмуса определите
приблизительное значение рН растворов в обеих пробирках.
22
В первую пробирку к эмульсии анилина в воде добавьте 1 каплю 10%-ной
хлороводородной кислоты. Содержимое пробирки становится прозрачным. Во
вторую пробирку к раствору диэтиламина прибавьте 3 капли насыщенного
водного раствора пикриновой кислоты, перемешайте и поместите пробирку в
стакан с холодной водой. Через некоторое время выпадает осадок пикрата
диэтиламина.
Вопросы и задания
1. Сравните основность диэтиламина и анилина и их растворимость в воде.
2. Почему при добавлении хлороводородной кислоты к эмульсии анилина
исчезает помутнение? Напишите схему происходящей реакции.
3. Напишите схему реакции диэтиламина с пикриновой кислотой (2,4,6тринитрофенолом).
Задания для САРСа
1. Сравните устойчивость анионов в приведенных группах, показав
стрелками и символами электронные эффекты. Напишите формулы соответствующих сопряженных кислот и сравните их силу.
O
O
O
O
а)CH3 C O CH3 O
O ; б) CH3 C O ClCH2 C O H C O
2. Сравните кислотность следующих соединений: уксусная, хлороуксусная
кислота, этиловый спирт, фенол. Не прибегая к таблицам, определите какое из
значений рKа (9.9, 2.8, 18.0, 4.8) соответствует каждому из этих соединений.
Ответ обоснуйте, показав распределение электронной плотности в молекулах.
3. Какое соединение в каждой из приведенных пар — RОН и RОН2+, RNН2 и
RNН3+ — является более сильной кислотой?
4. Объясните почему, в отличие от фенола, 2,4-динитрофенол растворяется
в водном растворе гидрокарбоната натрия. Напишите схему реакции. (РУК, п.
10.4, с. 214).
5. Можно ли с помощью экстракции 10%-ным раствором гидроксида натрия
разделить смесь гексанола-1 и гексантиола-1? Для обоснования ответа
напишите схемы соответствующих реакций. (РУК, п. 10.7, с. 214).
6. В смеси метилового спирта, диэтилового и диизопропилового эфиров
выберите наиболее сильный донор протона и акцептор протона и определите,
между какими соединениями образуется наиболее прочная водородная связь.
(РУК, п. 10.5, с. 214).
7. Определите наиболее прочную из возможных водородных связей,
возникающих в этанольном растворе фенола. (РУК, п. 10.9, с. 214).
8. Определите тип гибридизации атома азота в следующих соединениях. На
какой орбитали находится неподеленная электронная пара атома азота?
23
а) CH3–NH2; б) CH3–CN; в)
NH ; г)
N
9. Сравните основность соединений в приведенных группах:
а) NH3, CH3–NH–CH3, CH3–CN; б)
NH ,
N,
NH
10. Сравните основность атомов азота в следующих парах: фенамин (1фенилпропанамин-2) и анилин; дофамин [2-(3,4-дигидроксифенил)этанамин] и
адреналин [2-метиламино-1-(3,4-дигидроксифенил)этанол]. (РУК, п. 10.23, с.
216).
11. Оценив основность следующих соединений: анилин, пара-нитроанилин,
этиламин, соотнесите их со значениями рKBH+ (10.8, 4.6, 1.1). Ответ поясните,
указав распределение электронной плотности.
12. В медицинской практике 2-(диэтиламино)этиламид пара-аминобензойной кислоты (новокаинамид) применяется в виде гидрохлорида. Определите
место протонирования в молекуле новокаинамида. (РУК, п. 10.13, с. 214).
13. Алкалоид эфедрин (2-метиламино-1-фенилпропанол-1) экстрагируют из
эфедры разбавленной хлороводородной кислотой. Определите в молекуле
эфедрина основный центр, который протонируется в этих условиях. (РУК, п.
10.14, с. 214).
14. Кислотный гидролиз амидов карбоновых кислот начинается с их
протонирования. Укажите центр основности в молекуле и определите, какое из
соединений
—
пара-нитробензамид
или
пара-этоксибензамид
—
протонируется легче. (РУК, п. 10.16, с. 215).
15. Для повышения растворимости в воде 2-(диэтиламино)этиловый эфир
пара-аминобензойной кислоты при действии хлороводородной кислоты
превращают в моногидрохлорид, который известен в медицинской практике
под названием новокаин. Определите наиболее основный центр в молекуле 2(диэтиламино)этилового эфира пара-аминобензойной кислоты. (РУК, п. 10.18,
с. 215).
Практикум. Выполнение опытов 10.1–10.4. (РУК, с. 216-218).
Пример билета тестового контроля
«Электронное строение. Кислотность и основность»
1. Укажите соединение, в котором все атомы углерода имеют sp2-гибридизацию:
а) СН3–СН=СН–СН3; б) СН2=СН–СН=СН2;
в)
С
О
ОСН3
; г)
СН3 .
2. В акролеине СН2=СН–С(О)Н осуществляется следующий тип сопряжения:
а) π,π-; б) р,π-; в) d,π-; г) нет системы сопряжения.
24
3. Каким (какими) электронным эффектом (эффектами) обладает выделенный
заместитель в феноле
ОН
?
а) +M; +I; б) +I; в) –I; г) +M; –I.
4. Кислотные свойства веществ в ряду:
СН3СООН → НСООН → НООС–СООН
а) уменьшаются;
б) увеличиваются;
в) изменяются немонотонно; г) не изменяются
5. Основные свойства веществ в ряду:
NH3 → CH3–NH2 → CH3–NH–CH3
а) уменьшаются;
б) увеличиваются;
в) изменяются немонотонно; г) не изменяются
Пример билета контрольной работы
«Кислотно-основные свойства органических соединений»
1. Какое соединение обладает более сильными кислотными свойствами:
пропановая или 2-гидроксипропановая кислота? Объясните ваш ответ,
обозначив электронные эффекты, напишите формулы сопряженных оснований.
Не прибегая к таблицам, определите, какое из двух значений pKa (4.9 и 3.9)
относится к пропановой, а какое — к 2-гидроксипропановой кислоте?
Рассчитайте pH 0.01M водного раствора 2-гидроксипропановой кислоты.
2. Какое соединение обладает более сильными основными свойствами:
аммиак или диметиламин? Объясните ваш ответ, обозначив электронные
эффекты, напишите формулы сопряженных кислот. Не прибегая к таблицам,
определите, какое из двух значений pKBH+ (10.71 и 9.2) относится к аммиаку, а
какое — к диметиламину? Рассчитайте pH 0.1M водного раствора аммиака.
Тема 4. Пространственное строение органических соединений
Содержание темы. Конформации. Конфигурационные стереоизомеры: энантиомеры, диастереомеры. Стереохимическая номенклатура. Элементы динамической стереохимии. Топизм.
Разделы, выносимые на самостоятельную проработку
Поляриметрия (ОХ-1, с. 98–100), пространственное строение молекул и их
биологическая активность (ОХ-1, с. 118–138).
Домашнее задание по теме 4
1. Проработайте материал лекций и ОХ-1, глава 4 (с. 88–118).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
хиральность, асимметрический атом углерода, конформации, конфигурация,
энантиомеры, диастереомеры, прохиральные молекулы, эритро- и треоконфигурации.
25
3. Изобразите в виде проекционных формул Ньюмена и назовите: а) наименее
и наиболее устойчивые конформации бутана (по связи C2–C3); б) бутанола-1 (по
связи С1–С2); в) наиболее устойчивые конформации 2-аминоэтанола и
этандиола-1,2, учитывая возможность образования внутримолекулярной
водородной связи.
4. Назовите изображенное ниже в виде проекционной формулы Ньюмена
соединение по заместительной номенклатуре. Хиральна ли его молекула?
(РУК, п. 9.4, с. 211).
5. Приведите структуры изомерных кислот СН3СН=С(СН3)СООН и дайте
им систематические названия с учетом пространственного строения. Различаются ли эти стереоизомеры по физическим свойствам? (РУК, п. 9.6, с. 211).
6. Напишите структурные формулы цис- и транс-изомеров 1-бромо-2хлороэтена и 1,3-диметилциклобутана. К какому типу пространственных
изомеров они относятся?
углеродного скелета
положения кратной связи
Структурные
(изомеры строения)
положения функциональной группы
межклассовые (функциональных групп)
заслоненная
*
Конформации
гош
заторможенная
анти
D, L
Энантиомеры
(или R, S)
-диастереомеры
(цис-транс или Z, E относительно
плоскости -связи)
Конфигурацис-транс или Z, E
ционные
Диастереомеры
относительно плоскости
цикла
-диастереомеры
соединения, имеющие
более 1-го асимметрического атома
Пространственные стереоизомеры
Изомеры
Различные виды изомерии
*
Конформации можно считать изомерами (конформерами) если они достаточно
медленно превращаются друг в друга и могут быть разделены.
26
Задания для САРСа
1. Из следующих соединений — глицерин, глицериновый альдегид,
пропандиол-1,2, глицин, аланин, циклогексанол, циклогексен-2-ол, цис- и
транс-циклогександиолы-1,2, выберите такие, молекулы которых хиральны. В
хиральных молекулах определите число асимметрических атомов углерода.
(РУК, п. 9.7, с. 211).
2. Определите, имеются ли центры хиральности в молекуле транс1,4-дихлороциклогексана. Существуют ли стереоизомеры этого соединения
(конформации в расчет не принимать)? (РУК, п. 9.8, с. 211).
3. Напишите структурную формулу 2-аминопропановой кислоты (-аланина). Укажите звездочкой асимметрический атом углерода (центр хиральности) и обведите кружочками четыре разных заместителя у этого атома.
4. Используя модель, определите, какие изомеры (D или L) изображены
ниже:
CH3
а) H2N
C
H
COOH б)
H3C
COOH
C
H
NH2
H
в)
H2N
COOH
C
CH3
NH2
г)
HOOC
C
H
CH3
5. Используя правила обращения с проекционными формулами Фишера,
определите, каким изомерам (D или L) соответствуют изображенные ниже
структуры. Учтите, что поворот формулы на 90 или перестановка местами
двух любых заместителей меняет формулу вещества на формулу его
зеркального изомера.
а) H
CH2COOH
O
OH
б) C
H
COOH
H
CH2OH
OH
в) H
COOH
CH2SH
NH2
г) H
NH2
CH2OH
COOH
5. Можно ли, исходя из направления оптического вращения, определить
конфигурацию асимметрического центра в следующих соединениях: (+)глицериновом альдегиде, (–)-яблочной кислоте, (±)-молочной кислоте?
6. Напишите формулу 2,3-дигидроксибутановой кислоты. Укажите асимметрические атомы углерода. Изобразите проекционные формулы Фишера всех
возможных пространственных изомеров этого соединения. Для каждого
изомера укажите принадлежность к D- или L-ряду каждого хирального центра.
Покажите, какие из изображенных вами изомеров являются энантиомерами по
отношению друг к другу, а какие — диастереомерами.
7. Расположите следующие заместители в порядке убывания старшинства в
R,S-системе:
–CH3; –OH; –NH2; –H; –COOH; –CH2OH; -C O
H; –CH2SH; –CH2SCH3.
27
8. Расположите следующие группы — бутил, изобутил, втор-бутил, третбутил, 2-гидроксибутил, 3-хлоробутил, 4-хлоробутил в порядке уменьшения
старшинства в R,S-системе. (РУК, п. 9.12, с. 211).
9. Определите R- или S-изомеры изображены ниже:
COOH
а)
H3C
C
H
CH3
Cl
C
Br
H
б)
NH2
в) H
NH2
COOH
CH2SCH3
г) H
CH3
C2H5
CH2CH2OH
10. Определите Z- или E-изомеры изображены ниже:
Cl
а)
COOH
CH3
HOCH2 C C CH2COOH
б)
I
Br
CH3
11. Напишите проекционные формулы Фишера (R)-серина [(R)-2-амино-3гидроксипропановой кислоты] и (S)-цистеина [(S)-2-амино-3-меркаптопропановой кислоты], отнесите их к D- или L-ряду.
12. Лимонная и изолимонная кислоты являются 2- и 1-гидроксипропан1,2,3-трикарбоновыми кислотами, соответственно. Возможны ли стереоизомеры у этих кислот? Если да, то приведите их структуры в виде
проекционных формул Фишера, указав конфигурации центров хиральности.
(РУК, п. 9.14, с. 212).
13. В проекционной формуле Фишера мезовинной кислоты обе гидроксильные группы изображаются по одну сторону углеродной цепи. Означает ли
это, что эти группы сближены в пространстве? (РУК, п. 9.15, с. 212).
14. Приведите стереохимическую формулу (S)-пролина. (РУК, п. 9.16, с.
212).
N H
COOH
15. В состав алкалоида гиосциамина входит левовращающая троповая
(3-гидрокси-2-фенилпропановая) кислота. Определите, в виде каких конфигурационных изомеров существует троповая кислота и назовите их по R,Sсистеме. Какими физическими константами обладает (+)-троповая кислота,
если известно, что ее оптический антипод имеет т. пл. 128 °С и [α]D –81°?
(РУК, п. 9.18, с. 212).
16. Треонин (2-амино-3-гидроксибутановая кислота), входящий в состав
белков, имеет трео-конфигурацию асимметрических центров. Укажите
конфигурации этих центров по R,S-системе. (РУК, п. 9.19, с. 212).
17. Определите, в виде каких оптически активных изомеров существует
моносахарид 2,3,4-тригидроксибутаналь и назовите его эритро-изомеры по R,Sсистеме. (РУК, п. 9.20, с. 213).
28
18. Антибиотик левомицетин представляет собой R,R-изомер этого
соединения. Приведите проекционную формулу Фишера названного стереоизомера. (РУК, п. 9.21, с. 213).
O 2N
CH CH NH C
OH CH2OH
CHCl2
O
19. Назовите (–)-ментол, формула которого приведена ниже, по заместительной номенклатуре с учетом пространственного строения. Предложите
структуру (+)-ментола. Сколько стереоизомеров существует у (–)-ментола? Как
можно различить (+)- и (–)-ментолы? (РУК, п. 9.22, с. 213).
CH3
CH
CH3
CH3
HO
20. В молекуле 3-бромопентана укажите атомы углерода, содержащие гомотопные, энантиотопные и диастереотопные лиганды.
21. Какие из приведенных молекул — пропан, бутан, ацетальдегид, ацетон
— являются прохиральными?
Практикум. Работа с моделями.
Пример билета тестового контроля
«Номенклатура и стереоизомерия»
1. Определите, к какому классу относится приведенное ниже соединение:
C2H5
C
O
1) кетон; 2) сложный эфир; 3) амин; 4) альдегид
2. Выберите правильное название для следующего соединения:
СН3СН2СН2СН2СН2СООН
1) пропионовая кислота; 3) масляная кислота;
2) валериановая кислота; 4) капроновая кислота.
3. Выберите правильное название орто-бромотолуола по систематической
номенклатуре:
1) 2-бромотолуол; 2) 3-бромотолуол; 3) 2-метилбромобензол; 4) 4-бромотолуол.
4. Сколько асимметрических атомов углерода содержит данное соединение?
OH
CH3 CH
OCH3
1) 0; 2) 1; 3) 2; 4) 3; 5) 4
29
5. Какое из приведенных ниже веществ может существовать в виде диастереомеров?
OH
1) CH3 CH
2)
OCH3
CH2CH2CHCH2CH2
NH2
OH
3) CH3CHCHCHCH2Cl 4) CH3C CC2H5
NH2
OHOHOH
Пример билета контрольной работы
«Номенклатура и стереоизомерия»
1. Напишите
структурные
формулы:
а) изобутилфенилового
эфира;
б) бензилового спирта; в) винилуксусной кислоты; г) 2-метоксипропана;
д) 3-гидроксиметилциклогексанкарбоновой кислоты; е) 3-(N-метил-N-этиламино)пропанола-1.
2. Назовите приведенные ниже соединения по радикально-функциональной
номенклатуре:
а) CH2 CH O CH CH2 б)CH3CH2CH
COOH
в) CH3
NH2
NHCH3
3. Напишите проекционные формулы Ньюмена для наиболее устойчивого
конформера этилендиамина.
4. Определите конфигурацию асимметрического центра и назовите соединение,
C2H5
используя соответствующие номенклатуры: H
COOH.
NH2
5. Назовите приведенные ниже соединения по заместительной номенклатуре.
Выберите одно соединение, существующее в виде σ-диастереомеров, и одно,
существующее в виде π-диастереомеров. Напишите формулы этих
диастереомеров и назовите их, используя различные стереохимические
номенклатуры:
C2H5
а) O2N
г) CH3
б) CH3 C CH COOH в) H2N (CH2)2 CH COH
OH
O
CH CH CH2CH3 д) CH2 CH CCH2COOH
OH
Cl
Cl C6H5
CH3
Тема 5. Классификация реакций и реагентов. Факторы, определяющие
реакционную способность органических соединений
Содержание темы. Основные принципы классификации органических реакций
и реагентов, факторы, определяющие реакционную способность. Энергетические диаграммы химических реакций. Связь строения активной промежуточной органической частицы с ее стабильностью и легкостью образования.
Домашнее задание по теме 5
1. Проработайте материал лекций и ОХ-1, глава 3 (с. 74–88).
2. Повторите материал по электронным эффектам заместителей.
30
3. Выпишите в тетрадь определения новых и наиболее важных терминов:
субстрат, реагент, реакционный центр, гомолитический и гетеролитический
разрыв ковалентной связи, электрофил, нуклеофил, свободный радикал, статический и динамический факторы, карбокатионы, карбоанионы, переходное
состояние, резонансные (мезомерные) структуры, термодинамически и
кинетически контролируемые реакции.
4. Из приведенных ниже реагентов выберите те, которые могут проявлять:
а) электрофильные; б) нуклеофильные; в) основные; г) кислотные свойства
NH3; H+; Cl–; Cl+; OH–; NO2+; BF3.
4. Какие свойства (нуклеофильные, электрофильные, основные или
кислотные) проявляет органический субстрат в следующих элементарных
стадиях реакций?
CH3COO– + H3O+;
а) CH3COOH + H2O
в)
CH3NH3+ + Cl–;
б) CH3Cl + NH3
+
Br
+ Br+
г) CH3CH=CH2 + H+
;
CH3–+CH–CH3
5. Расположите приведенные ниже частицы в ряды по увеличению их
устойчивости:
СН2 СН2, CH3, CH2=CHCH2, (CH3)3C;
а)
+
+
+
+
+
O
O
б) CH3CH2CH2, CH2=CHCH2, CH3CHCH3, CH2CH2C OH
, CH3CHC OH
Задания для САРСа
1. Расположите приведенные карбоанионы в ряд по увеличению их
устойчивости:
O
O
CH3CH2CH2, CH2=CHCH2, CH3CHCH3, CH2CH2C OH
, CH3CHC OH
Укажите тип гибридизации атомов углерода и объясните свой выбор.
2. В приведенных ниже частицах укажите возможные реакционные центры
и
определите
их
тип
(свободно-радикальный,
электрофильный,
нуклеофильный, основный, кислотный).
Предложите тип реагента, способного реагировать с этими частицами.
Изобразите наиболее вероятные для частиц резонансные структуры:
O
H
H
C=O
CH2
CH C
O
CH3CHC OH
H
O
C
CH CH2
O
N
H
CH2
NH2
O
CH2
CH CH CH CH2
CH3
H
Cl
H
3. Выберите наиболее вероятное направление элементарной стадии реакции:
а) СН3 СН СН2 + Н+
СН3 СН СН3 или СН3 СН2 СН2
31
СН2 СН2 С СН2 или СН3 СН С СН2 или
СН3
СН3
СН2 СН С СН3 или СН2 СН СН СН2
СН3
СН3
+
б) СН2 СН С СН2 + Н
СН3
в) CH2 CH Cl + Н+
г) CH2 CH C
O
H
CH2 CH2 Cl или CH3 CH Cl
+
CH2 CH2 C
+ Н
д) CH2 CH CH2 CH3 + X
е)
CH2 CH3 + X
- HX
з) CH3 CH2 C
O
OC2H5
- HX
-
+ OН - H O
2
H
или CH3 CH C
O
H
CH2 CH CH2 CH2 или CH2 CH CH CH3
CH CH3
- HX
ж) C2H5 O CH2 CH3 + X
O
или
CH2 CH2
C2H5 O CH2 CH2 или C2H5 O CH CH3
CH2 CH2 C
O
OC2H5
или CH3 CH C
O
OC2H5
Практикум. Методы очистки и идентификации органических соединений.
Тема 6. Алканы
Содержание темы. Номенклатура, изомерия, способы получения, физические
и химические свойства алканов. Реакции радикального замещения, окисления,
изомеризации, гидрирования.
Домашнее задание по теме 6
1. Проработайте материал лекций и ОХ-1, глава 6 (с. 157–168).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
реакция Вюрца, реакция Вюрца-Фиттига, реакция Коновалова, региоселективность, сульфохлорирование, сульфоокисление, гидропероксиды, пероксиды.
3. Напишите уравнения следующих реакций:
1) последовательного гидрирования бутина-2;
2) изопропилиодида с иодоводородной кислотой;
3) 2-бромобутана с натрием;
4) электролиза пропионата калия;
5) бромирования и нитрования изобутана;
6) сульфохлорирования и сульфоокисления этана;
7) окисления пентана в присутствии перекисей;
8) изомеризации пентана в присутствии хлорида алюминия;
9) дегидрирования метилбутана;
10) дегидроциклизации 2-метилпентана и гексана.
4. Подготовьтесь к формульному диктанту (см. ниже).
32
Задания для САРСа
1. Сколько различных монохлоропроизводных может образоваться при
высокотемпературном хлорировании изооктана (2,2,4-триметилпентана)?
Напишите их структурные формулы. Определите их приблизительный
процентный состав в полученной смеси продуктов, учитывая, что эта реакция
практически нерегиоселективна.
2. При фотохимическом бромировании алкана с молекулярной массой 72,
содержащего третичный атом углерода, образуется практически одно
монобромопроизводное. Напишите уравнение соответствующей реакции,
предложите схему механизма.
3. В зависимости от условий проведения реакции нитрования пропана,
получают либо только одно мононитропроизводное, либо смесь четырех
нитроалканов. Напишите формулы соответствующих продуктов и укажите
различие в условиях реакций.
4. Дегидроциклизацией каких алканов может быть получен толуол?
5. Выполните задания по РУК, п.п. 1.2, 1.6 и 1.7 (с. 218–219).
Формульный диктант
Алканы и насыщенные радикалы: метан, метил, метилен, метин, этан, этил,
этилен, этилиден, пропан, пропил, изопропил, пропилиден, бутан, изобутан,
бутил, втор-бутил, изобутил, трет-бутил, пентан изопентан, неопентан, амил
(пентил) изоамил (изопентил), неопентил, гексан, гептан, нонан, декан,
ундекан, додекан, эйкозан.
Практикум. Методы очистки и идентификации органических соединений.
Тема 7. Циклоалканы
Содержание темы. Номенклатура, конформации, изомерия, способы получения, физические и химические свойства циклоалканов. Реакции радикального
замещения, окисления, изомеризации, гидрирования.
Домашнее задание по теме 7
1. Проработайте материал лекций и ОХ-1, разделы 1.3.2 (с. 18–21), 4.3.2. (с.
113–116) и глава 7 (с. 171–180).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
конформации «кресло», «ванна», «твист», аксиальные и экваториальные связи,
циклоприсоединение, карбены, гидрогенолиз.
3. Напишите уравнения следующих реакций:
1) 1,3-дибромопентана с цинком в спирте;
2) 2,5-дибромогексана с амальгамой лития;
3) циклоприсоединения дихлорокарбена к циклогексену;
4) присоединения хлороводорода к этилциклопропану в водной среде;
5) бромирования 1,1-диметилциклопропана на свету;
33
6) фотохимического хлорирования 1,1-диметилциклопропана при высокой и
при низкой температурах;
7) хлорирования метилциклобутана на свету;
8) гидрогенолиза 1-винил-2-метилциклопропана на платиновом катализаторе;
9) нитрования метилциклогексана;
10) окисления циклопентана в жестких условиях.
Задания для САРСа
1. Соединение, изображенное в виде проекционной формулы Ньюмена,
назовите с учетом его пространственного строения:
Для этого соединения изобразите конформацию «кресло» с экваториальным и
аксиальным расположением алкильных заместителей и конформацию «ванна».
Какая из конформаций энергетически наиболее выгодна, а какая — наименее?
2. Назовите приведенные ниже соединения по заместительной номенклатуре:
а) ментол
; б) α-пинен
О
; в) камфора
ОН
3. Напишите формулы следующих циклоалканов: 2,3-диметилбицикло[3,2,1]октан; 1-этилбицикло[4,1,0]гептан, спиро[4,4]октан.
4. Выполните задания по РУК, п.п. 11.1, 11.10, 11.11, 11.13–11.18 (с. 219–
220).
Практикум. Методы очистки и идентификации органических соединений.
Пример билета контрольной работы
«Реакционная способность. Алканы и циклоалканы»
1. Назовите по заместительной номенклатуре следующее соединение:
H3C CH CH NH2
HO
COOH
2. Расположите в ряд по увеличению устойчивости следующие частицы:
+
а) CH2 CH CH2 CH2
+
б) CH2 CH CH CH CH2
34
в) CH2
+
CH CH CH3
3. Дайте определение нуклеофильности и выберите частицы, обладающие
нуклеофильными свойствами:
а) С2Н5О– ;
б) Cl– ;
в) H+ ;
г) Br–
4. Допишите уравнения реакций, назовите образующиеся продукты:
а) (CH3)3CH
в) CH3
HNO 3 разб.
to
CH CH2
CH3
CH3
б) CH3
o
CH2 CH CH CH2
CH3
Ni, t
дегидрирование
CH3 CH3
O2/X
to
5. Напишите соответствующие уравнения реакций:
o
пропионат натрия электролиз A AlCl3, t B Br2 /h C Na
D
SO2 / O2
E
Тема 8. Алкены
Содержание темы. Номенклатура и изомерия. Физические свойства. Способы
получения. Реакции электрофильного присоединения: присоединение галогенов, гидрогалогенирование, гидратация. Роль кислотного катализа в реакциях
АE. Эмпирическое правило Марковникова, его современная интерпретация.
Реакции радикального и нуклеофильного присоединения в ряду алкенов.
Реакции радикального аллильного замещения. Окисление алкенов: мягкое
(гидроксилирование, эпоксидирование) и жесткое, озонирование. Каталитическое гидрирование.
Домашнее задание по теме 8
1. Проработайте материал лекций и ОХ-1, глава 8 (с. 182–205).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
элиминирование, оксониевые и галогенониевые ионы, галогенгидрины,
гидроксимеркурирование, гидроборирование, цианоэтилирование, пероксидный эффект, N-бромосукцинимид, эпоксидирование, гидроксилирование,
озонолиз, эпоксиды, озониды.
3. Напишите уравнения следующих реакций:
1) получения пропена, по меньшей мере, пятью различными способами;
2) присоединения бромоводорода к бутену-1 в присутствии и в отсутствие
перекиси;
3) присоединения хлора к этилену в газовой фазе и в водном растворе;
4) эпоксидирования, гидроксилирования, озонолиза и жесткого окисления
пентена-2.
Задания для САРСа
1. Напишите уравнения реакций гидратации пропена, 3,3-дифторопропена,
1-метилциклопентена, стирола (винилбензола), акриловой (пропеновой)
кислоты, кротонового альдегида (бутен-2-аля), 2-метил-3-фенилпропена-2. К
какому типу относятся эти реакции? Объясните причины региоселективности
этих реакций.
35
2. Выполните задания по РУК, п.п. 11.19 (а–в), 11.23, 11.28, 11.30 (с. 223–
226).
3. Предложите способ получения 2-метил-2-хлоропентана из 4-метил-1хлоропентана.
4. Предложите способ получения пентанола-1 из пентена-1, используя
реакцию гидроборирования.
5. Напишите реакцию пропена с тетрахлоридом углерода в присутствии
пероксида бензоила.
6. Предложите способ получения 3-бромо-4-метилпентена-1 из 4-метилпентанола с использованием на одной из стадий N-бромосукцинимида.
7. В результате жесткого окисления алкенов образовались: а) изомасляная
кислота и СО2; б) уксусная кислота и ацетон; в) ацетон и метилэтилкетон.
Предложите формулы исходных алкенов.
Практикум. Методы очистки и идентификации органических соединений.
Тема 9. Алкадиены
Содержание темы. Классификация и электронное строение диеновых углеводородов. Способы получения диенов. Реакции электрофильного присоединения
(гидрогалогенирование, присоединение галогенов). Особенности реакций
присоединения в ряду сопряженных диенов. Реакции свободнорадикального
присоединения. Реакции циклоприсоединения (диеновый синтез).
Домашнее задание по теме 9
1. Проработайте материал лекций и ОХ-1, глава 9 (с. 205–214).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
кумулированные, сопряженные и изолированные диены, 1;2- и 1,4-присоединение, реакция Дильса-Альдера, диен, диенофил, s-цис-конформация и s-трансконформация, син-присоединение, эндо-присоединение и экзо-присоединение.
3. Напишите уравнения следующих реакций:
1) получения пентадиена-1,3, пентадиена-2,4 и пентадиена-1,4 из соответствующих дигалогенопроизводных;
2) пероксидного окисления пентадиена-1,4;
3) восстановления циклогексадиена-1,3 натрием в жидком аммиаке;
4) присоединения избытка бромоводорода к гексадиену-1,4.
4. Сколько пространственных изомеров образуется в результате присоединения избытка брома к пентадиену-1,3? Напишите формулы и назовите
изомеры.
36
Задания для САРСа
1. Напишите схему механизма присоединения одного моль брома к
бутадиену-1,3. Какой продукт получается преимущественно при низких
температурах, а какой – при высоких? Чем объясняются эти результаты?
2. Напишите уравнения реакций постадийного присоединения избытка
хлороводорода к изопрену (2-метилбутадиену-1,3).
3. Выполните задания по РУК, п.п. 11.19 (д) (с. 224), 11.34 и 11.37 (с. 227).
4. Напишите реакцию Дильса-Альдера между бутадиеном-1,3 и акролеином
(пропеналем); циклопентадиеном и тетрацианоэтиленом.
5. Сравните способность вступать в реакцию диенового синтеза бутадиена1,3 и 2,3-ди(трет-бутил)бутадиена-1,3. Как можно объяснить различие в их
реакционной способности?
6. Каково различие в продуктах циклоприсоединения бутадиена-1,3 к цис- и
транс-α,β-дицианоэтилену?
Практикум. Методы очистки и идентификации органических соединений.
Тема 10. Алкины
Содержание темы. Номенклатура. Способы получения. Реакции электрофильного присоединения (гидрогалогенирование, присоединение галогенов).
Реакции нуклеофильного присоединения (гидратация). Винилирование, карбонилирование, олигомеризация, ацетилениды.
Домашнее задание по теме 10
1. Проработайте материал лекций и ОХ-1, глава 10 (с. 214–232).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
енолы, винилирование, карбонилирование, ацетилениды, димеризация, циклоолигомеризация.
3. Выполните задания по РУК, п. 11.19 (г, е, ж) (с. 224).
4. Напишите уравнения следующих реакций:
1) винилирования этилового спирта, метантиола, диэтиламина, уксусной
кислоты и циановодородной кислоты метилацетиленом;
2) гидратации бутина-1 в присутствии солей ртути;
3) окисления бутина-2 перманганатом калия в кислой среде и диоксидом
селена.
5. Оформите лабораторный журнал, опыты 11.4 и 11.5 (РУК, с.227–229).
Задания для САРСа
1. Напишите схему механизма гидратации пропина в присутствии солей
ртути.
2. Напишите уравнения реакции постадийного присоединения избытка
бромоводорода к бутину-1 в отсутствие и в присутствии пероксидов.
37
3. Напишите уравнения реакций пропина с амидом натрия и этилмагнийбромидом. Чем обусловлена возможность протекания этих реакций?
4. Напишите уравнение реакции циклотримеризации пропина.
5. Выполните задания по РУК, п.п. 11.36 и 11.38 (с. 227).
Практикум. Выполнение опытов 11.4 и 11.5 (РУК, с. 227–229).
Тест-контрольная работа
«Ненасыщенные углеводороды»
1. При окислении этилена водным раствором KMnO4 образуется:
а) этан;
б) этанол;
в) глицерин;
г) этиленгликоль
2. К какому из приведенных ниже веществ вода присоединяется по правилу
Марковникова?
а)
О
СН2
СН С
Н
б)
СН2
СН3
СН СН
СН3
в)
СН2
СН СН2F
г)
СН2
СН СH2NO2
3. Продуктом гидратации бутена-1 является:
а) первичный спирт; б) вторичный спирт; в) третичный спирт; г) бутанол-1.
4. Допишите уравнения следующих реакций:
а) CH3 CH CH2 + HBr пероксид б) СH3 CH
в)
СН3
С СН + Н2О
CH CH CH2 + Br2(1 моль)
HgSO4
5. Напишите последовательность следующих уравнений реакций:
CH3
CH CH2 CH3
Br2/h
KOH
A спирт
CH3
B
Br2
CCl4
C
Zn
D
HCl
Е
Тема 11. Реакционная способность ароматических углеводородов (аренов)
Содержание темы. Классификация, номенклатура, физические свойства
аренов. Их способы получения. Реакции электрофильного замещения (SE). Роль
катализаторов в реакциях SE. Влияние заместителей на реакционную способность и ориентацию электрофильного замещения, согласованная и несогласованная ориентация. Реакции бензола с нарушение ароматической системы.
Реакции боковых цепей в алкилбензолах. Особенности реакционной способности многоядерных аренов с изолированными и конденсированными
кольцами. Небензоидные ароматические системы.
Домашнее задание по теме 11
1. Проработайте материал лекций и ОХ-1, глава 12 (с. 249–297).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
ароматичность, моноядерные и многоядерные арены (изолированные и конденсированные), небензоидные ароматические соединения (азулен, циклопента38
диенид-ион, тропилий-катион), акилирование и ацилирование по ФриделюКрафтсу, реакция Ульмана, реакция Вюрца-Фиттига, нитрование, сульфирование, формилирование, π-комплексы, σ-комплексы (аренониевые ионы),
ацилиевые ионы. Активирующие и дезактивирующие заместители. Тритилрадикал и тритил-катион. Ферроцен. Фуллерены.
3. Выполните задание по РУК, п. 11.54 (с. 233).
4. Подготовьтесь к формульному диктанту (см. ниже).
5. Оформите лабораторный журнал, опыты 11.7–11.10 (РУК, с. 235–237).
Влияние заместителей в ароматическом кольце на реакционную
способность и ориентацию электрофильного замещения
Заместители
орто- и пара-ориентанты (заместители 1 рода)
–NH2; –NHR; –NR2; –OH
–O–
–NHC(O)CH3; (–NHCOR); –OCH3; (–OR)
–CH3 и другие алкильные группы
– C6H5; –CH=CH2
–F; –Cl; – B; –I
мета-ориентанты (заместители 2 рода)
–C≡N; –CHO; –COR; –COOH; –COOR; –SO3H
–NR3+; –CF3; –CCl3
–NO2; –N2+
Тип
эффекта
Влияние на
реакционную
способность
+M >> –I
+M; +I
+M > –I
+I
+M > –I
–I > + M
+++
+++
++
+
+
–
–I; –M
–I
–I; –M
––
–––
–––
Задания для САРСа
1. Выполните задание по РУК, п. 11.40 (с. 230), без анализа масс-спектрометрических данных. По какому механизму протекают эти реакции? Напишите
схемы их механизмов, объясните роль катализатора.
2. Напишите уравнение реакции пероксидного
Приведите схему механизма этой реакции.
окисления
кумола.
3. Выполните задания по РУК в следующей последовательности: 11.43,
11.49, 11.56, 11.42, 11.51, 11.48, 11.50, 11.53, 11.45 (с. 230–234).
Формульный диктант
Ненасыщенные и ароматические углеводороды и органические радикалы:
винил, этинил, ацетилен, изобутилен, аллил, пропенил, изопропенил,
пропаргил, аллен, дивинил, изопрен, толуол, орто-ксилол, мета-ксилол, параксилол, мезитилен, кумол, стирол, фенил, бензил, орто-толил, мета-толил,
пара-толил, пара-цимол, дифенил, нафталин, антрацен, фенантрен, азулен.
Практикум. Выполнение опытов 11.7–11.10 (РУК, с. 235–237).
39
Тест-контрольная работа
«Ароматические углеводороды»
1. Бензол в определенных условиях взаимодействует с:
а) азотом; б) бромоэтаном; в) бромоводородом; г) бромной водой
2. Заместитель –NO2 в ароматическом кольце в реакциях электрофильного
замещения является:
а) электронодонором;
в) мета-ориентантом;
б) активирующим заместителем;
г) орто- и пара-ориентантом.
3. Согласованная ориентация в реакциях SE наблюдается в:
COH
OH
COOH
а)
NO2
; б)
; в)
; г)
C 2H 5
.
ОН
NO2
COOH
4. Допишите уравнения следующих реакций:
а)
СН2
СН3
+
Br2
FeBr3
CH3
CH
CH3
б)
O2,X
в)
+ HNO3
H2SO4
Модульная контрольная работа №1
Пример билета тестового контроля
1. Выберите правильное название для следующего соединения по заместительной номенклатуре:
СН2 СН C
SH
NH2
О
ОН
а) 2-аминопропановая кислота; б) 1-меркапто-2-аминопропановая кислота;
в) 3-меркапто-2-аминопропановая кислота; г) 2-амино-3-меркаптопропановая
кислота.
2. Какие типы пространственных изомеров возможны для нижеследующего
соединения (возможно несколько ответов)?
CH3–CHCl–CHCl–COOH
а) цис-, транс-изомеры; б) π-диастереомеры; в) -диастереомеры; г) нет
изомеров.
40
3. Определите конфигурацию нижеследующего соединения (два ответа):
H
а) D; б) L; в) R; г) S.
C2H5
COOH
NH2
4. Укажите, какими электронными
заместитель в следующем соединении:
эффектами
обладает
выделенный
O
CH2 CH C OH
а) только – I; б) только + I; в) – М и – I; г) – М и + I.
5. Какой из приведенных ниже свободных радикалов является наиболее
устойчивым?
CH
а) CH3 C CH3 ; б) CH2 CH CH CH CH2 ; в) CH3 ; г) CH2 CH CH2 .
3
6. Выберите наиболее сильную кислоту из приведенных ниже:
а) HCOOH ; б) CH3COOH; в)
OH ; г) ClCH2COOH.
7. Для какого из нижеприведенных соединений реакция гидратации проходит
по правилу Марковникова?
O
CH3
CH3 ; в)
CH C CH
CH2 CH C OH
а) CH2 CH CF3; б)
3 ; г)
8. В каком из нижеприведенных соединений имеет место несогласованная
ориентация в реакциях SЕ?
а)
NH2
NO2
б)
C 2H 5
OH
в)
OH
NH2
NH2
г)
NO2
Пример основного билета
1. Допишите уравнения реакций, назовите образующиеся продукты:
а) CH3 CH CH CH2 CH3
Cl
б) O2N
Zn
OH + HNO3
Cl
CH3
o
г) CH3 C OH H2SO4/t
в) CH2 C CH CH2 + CH2 CH C N
CH3
CH3
д) CH3 C CH CH2 CH3 KMnO4/H2O
е) CH3 CH CH C N + NH3
CH3
ж) CH3 CH2 CH CH2
N _ бромсукцинимид
(C6H5COO)2
и) CH3CH2C CH + [Ag(NH3)2]OH
з) CH3CH2C CH 2 HBr
к) CH3 CH CH COOH + HCl
41
to
2. Для реакции к) укажите субстрат и реагент. Является ли данная реакция
региоселективной? Обоснуйте свой ответ, написав механизм реакции по
стадиям. Укажите тип реакции в соответствии с ее механизмом.
3. Напишите соответствующие уравнения реакций:
H2
Ni, to
циклопропан
o
KOH (спирт), t
F
A Br2 /h B
/ AlCl3
C
Br2 / AlBr3
D
Br2 /h
E
KMnO4/H+
G
to
2-й модуль
Органические соединения с одной функциональной группой
Во втором модуле изучаются основные классы производных углеводородов
с одной функциональной группой: галогенопроизводные, спирты, фенолы,
простые эфиры и их тиоаналоги, амины, альдегиды, кетоны и их производные,
карбоновые кислоты, угольная кислота, сульфокислоты и их функциональные
производные. Рассматриваются способы их получения, химические свойства,
механизмы наиболее важных реакций, применение их в органическом синтезе.
Тема 12. Галогенопроизводные углеводородов
Содержание темы. Способы получения галогеноуглеводородов. Реакционные
центры в молекулах галогенопроизводных. Реакции нуклеофильного
замещения галогена, их механизмы. Стереохимия реакций нуклеофильного
замещения. Реакции элиминирования, их механизмы и стереоспецифичность.
Сравнительная реакционная способность различных типов галогенопроизводных.
Домашнее задание по теме 12
1. Проработайте материал лекций и ОХ-1, глава 13 (с. 298–336).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
нуклеофильность, нуклеофильное замещение, нуклеофил, нуклеофуг, элиминирование, третичные сульфониевые и четвертичные аммониевые ионы, амбидентные нуклеофилы. Тионилхлорид. Реакция Вильямсона, реакция Финкельштейна, перегруппировка Вагнера-Меервейна, правило Зайцева, комплекс
Мейзенгеймера, ионные пары. Обращение конфигурации, рацемизация.
3. Напишите уравнения следующих реакций:
1) изобутилхлорида с иодидом натрия в ацетоне;
2) бутена-1 с бромоводородом в отсутствие и в присутствии пероксидов;
3) 2-фенилэтанола-1 с тионилхлоридом;
4) ацетона с хлоридом фосфора(V);
5) 3-фенилпропионата серебра с бромом;
6) этилбромида с водным раствором гидроксида натрия, с трет-бутоксидом
натрия, с пропионатом натрия, с гидросульфидом натрия, с метилтиолятом
42
натрия, с диметилсульфидом, с нитритом натрия, с азидом натрия, с аммиаком,
с анилином, с триметиламином;
7) 2,2-диметил-3-хлоробутана с водой при нагревании;
8) гидролиза 3-хлоропентена-1;
9) 2,4-динитрофторобензола с этиловым эфиром аминоуксусной кислоты;
10) хлоробензола с амидом калия в жидком аммиаке.
4. Оформите лабораторный журнал, опыты 12.1–12.5 (РУК, с. 242–245).
Задания для САРСа
1. Выполните задание по РУК, п. 12.3 (с. 238). Предложите схемы
механизмов протекающих реакций.
2. Выполните задания по РУК в следующей последовательности: 12.3, 12.8,
12.1, 12.2, 12.5–12.7, 12.11, 12.13, 12.14, 12.16, 12.18–12.20 (с. 238–241).
Практикум. Выполнение опытов 12.1–12.5 (РУК, с. 242–245).
Тема 13. Спирты
Содержание темы. Общая характеристика спиртов. Классификация, способы
получения и физические свойства. Кислотно-основные свойства спиртов.
Реакции с участием нуклеофильного центра. Сложные эфиры неорганических
кислот. Реакции с участием электрофильного центра. Реакции элиминирования.
Окисление спиртов.
Домашнее задание по теме 13
1. Проработайте материал лекций и ОХ-1, глава 14 (с. 340–363).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
вицинальное
и
геминальное
положения,
алкилоксониевые
ионы,
сульфурилхлорид, хлорсульфоновая кислота, фосфорилхлорид, проба Лукаса,
нуклеофильная 1,2-перегруппировка, аллильная перегруппировка, тозилхлорид,
тозилаты, пинаколиновая перегруппировка, гликольное расщепление.
3. Напишите уравнения следующих реакций:
1) алюминия с трет-бутиловым спиртом;
2) глицерина с гидроксидом меди в щелочной среде;
3) этоксида натрия с диметилсульфатом;
4) изопропилата натрия с этилтозилатом;
5) этиленгликоля с избытком азотной кислоты;
6) цис-циклогександиола-1,2 с борной кислотой;
7) 2,2-диметилбутанола-1 с бромоводородной кислотой;
8) бутен-2-ола с бромоводородной кислотой;
9) окисления 2-метилбутандиола-2,3 перманганатом калия в кислой среде;
10) окисления 2-метилбутандиола-2,3 иодной кислотой.
43
4. Выполните задания по РУК, п.п. 13.6 (а–г) (с. 247–248).
5. Оформите лабораторный журнал, опыты 13.1–13.6 (РУК, с. 250–253).
Задания для САРСа
1.Выполните задания по РУК, п.п. 13.1–13.4, 13.7, 13.14, 13.17 (с. 246–250).
Практикум. Выполнение опытов 13.1–13.6 (РУК, с. 250–253).
Тема 14. Фенолы
Содержание темы. Общая характеристика фенолов, способы их получения и
физические свойства. Кислотно-основные свойства фенолов. Реакции с
участием нуклеофильного центра. Реакции с участием электрофильного центра.
Реакции электрофильного замещения в ароматическом ядре. Окисление и
восстановление фенолов.
Домашнее задание по теме 14
1. Проработайте материал лекций и ОХ-1, глава 15 (с. 363–385).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
реакция Бухерера, конденсация Ульмана, гидроксиметилирование, перегруппировка Фриса, нитрозирование, реакция Кольбе-Шмидта (карбоксилирование), реакция Раймера-Тимана (формилирование), фенолфталеин, хиноны.
3. Напишите уравнения следующих реакций:
1) получения гидрохинона из бензолсульфокислоты;
2) получения мета-крезола из мета-цимола;
3) получения β-нафтола из β-нафтиламина;
4) пирокатехина с ацетатом свинца и с избытком уксусного ангидрида;
5) пара-крезола с диметилсульфатом и этилтозилатом;
6) мета-крезола с уксусным ангидридом и последующего превращения
продукта при нагревании с хлоридом алюминия;
7) нитрозирования β-нафтола;
8) получения салициловой кислоты из фенола;
9) окисления орто-крезола хромовой смесью.
4. Подготовьтесь к формульному диктанту (см. ниже).
5. Оформите лабораторный журнал, опыты 13.5 и 13.6 (РУК, с. 258–259).
Задания для САРСа
1. Выполните задания по РУК, п.п. 13.19, 13.20 (с. 253), 13.23, 13.25 (с. 254),
13.28–13.30, 13.32 (с. 256–257).
Практикум. Выполнение опытов 13.5 и 13.6 (РУК, с. 258–259).
44
Формульный диктант
Изопропиловый спирт, втор-бутиловый спирт, изобутиловый спирт, третбутиловый спирт, аллиловый спирт, бензиловый спирт, фенэтиловый спирт,
этиленгликоль, глицерин, пинакон, орто-крезол, мета-крезол, пара-крезол,
тимол, α-нафтол, β-нафтол, пирокатехин, резорцин, гидрохинон, пирогаллол,
флороглюцин, пикриновая кислота.
Тема 15. Простые эфиры
Содержание темы. Общая характеристика простых эфиров. Способы их
получения и физические свойства. Основные свойства простых эфиров.
Расщепление простых эфиров, галогенирование, окисление. Реакции электрофильного замещения в простых эфирах. 1,2-Эпоксиды, их химические свойства.
Домашнее задание по теме 15
1. Проработайте материал лекций и ОХ-1, глава 16 (с. 390–405).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
оксиран, оксолан, диоксан, анизол, гваякол, фенетол, диалкилоксониевые соли,
эфираты, краун-эфиры, ацидолиз, метод Цейзеля, перегруппировка Кляйзена.
3. Выполните задание по РУК, п. 13.49 (с. 262–263).
4. Оформите лабораторный журнал, опыты 13.7–13.10 (РУК, с. 263–264).
Задания для САРСа
1. Выполните задания по РУК, п.п. 13.26 (с. 254), 13.34, 13.42, 13.47 (с.260–
262).
Практикум. Выполнение опытов 13.7–13.10 (РУК, с. 263–264).
Тема 16. Органические соединения серы
Содержание темы. Тиолы и сульфиды. Их общая характеристика, способы
получения и физические свойства. Кислотно-основные свойства тиолов и
сульфидов. Нуклеофильные свойства. Окисление и восстановление.
Домашнее задание по теме 16
1. Проработайте материал лекций и ОХ-1, глава 17 (с. 408–419).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
тииран, изотиомочевина, S-алкилизотиурониевые соли, тиоляты, унитиол,
сульфониевые
соли,
сульфоны,
сульфоксиды,
диметилсульфоксид,
сульфиновые кислоты.
3. Напишите уравнения следующих химических реакций:
1) электрофильного и радикального присоединения сероводорода и тиофенола
к пропену;
2) гидросульфида калия с 1-хлоропропаном и пикрилхлоридом;
45
3) сульфида калия и этантиолята натрия с бензилхлоридом;
4) получения бутантиола-2 с использованием изотиомочевины;
5) восстановления тозилхлорида цинком в серной кислоте;
6) этантиола с уксусным ангидридом в щелочной среде;
7) метилпропилсульфида с этилбромидом и диметилсульфатом;
8) окисления пропантиола иодом, азотной кислотой;
9) окисления диэтилсульфида эквимолярным количеством и избытком
пероксида водорода;
10) восстановления гексантиола-1 водородом над никелем.
Задания для САРСа
1. Выполните задания по РУК, п.п. 13.6 (д) (с. 248), 13.11 (с. 249), 13.13
(с.250), 13.40 (с. 260), 13.44 (с.262).
Тема 17. Амины
Содержание темы. Классификация аминов. Их общая характеристика, способы
получения и физические свойства. Кислотно-основные свойства аминов.
Нуклеофильные свойства. Реакции аминов с азотистой кислотой.
Электрофильное замещение в ароматических аминах.
Домашнее задание по теме 17
1. Проработайте материал лекций и ОХ-1, глава 21 (с. 514–531).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
анилин, орто-, мета- и пара-толуидины, карбиламинная (изонитрильная
реакция), диазотирование, соли диазония, нитрозоамины, ацильная защита
аминогруппы.
3. Напишите уравнения следующих химических реакций:
1) метиламина с соляной кислотой и с водой;
2) пара-толуидина с серной кислотой;
3) диэтиламина с бутиллитием;
4) бутиламина с эквимолярным количеством этилбромида;
5) пропиламина с избытком метилиодида;
6) метиламина с пропиленоксидом;
7) изонитрильной реакции для анилина;
8) мета-толуидина, бутиламина, диэтиламина, N,N-диэтиланилина и
триметиламина с азотистой кислотой;
9) анилина с иодом в присутствии гидрокарбоната натрия;
10) сульфирования анилина эквивалентным количеством серной кислоты и ее
большим избытком.
46
4. Оформите лабораторный журнал, опыты 17.1–17.7 (РУК, с. 291–295).
Задания для САРСа
1. Выполните задания по РУК, п.п. 17.3, 17.5–17.7,17.10–17.16 (с. 289–290).
Практикум. Выполнение опытов 17.1–17.7 (РУК, с. 291–295).
Пример билета контрольной работы
«Реакционная способность соединений с -связью углерод-гетероатом»
1. Допишите уравнения следующих реакций:
а) CH2=CH CH2Cl + H2O
б)
в) CH3CH2NHCH3 + CH3Cl
г) (CH3)2CHNH2 +
CH3CH2Cl +
SNa
+
3
H3C S CH
CH3 Cl
H+/t
3
е) (CH3)2CHCH CH
OH H2O
2. Для реакции (г) укажите тип реакции, нуклеофильный реагент, уходящую
группу, электрофильный центр, алкилирующий реагент.
д) (CH3)2CHCH2NH2 + HNO2
3. Напишите соответствующие уравнения реакций:
2 NH
CH3CH2OH HCl A NH Cl3
4
B
HNO2
C
C2H5OH /H+/t
D
Пример билета тестового контроля
«Свойства соединений с -связью углерод-гетероатом»
1. В реакции бутанола-2 с HBr образуется:
а) бутен-2;
б) 1-бромобутан;
в) бутен-1;
г) втор-бутилбромид.
2. Продуктом реакции дезаминирования изопропиламина азотистой кислотой
является:
а) 2-нитропропан;
б) пропанол-1;
в) пропанол-2;
г) пропен.
3. Дегидратация спиртов происходит под действием:
а) галогенов;
б) галогеноводородов;
в) азотной кислоты; г) серной кислоты.
4. Наиболее слабые нуклеофилы:
а) спирты;
б) тиолы;
в) фенолы;
г) амины.
5. Реакция алкилирования аминов реагентами R–X быстрее всего идет, если:
а) Х = ОН;
в) X = Br;
б) Х = Cl;
г) X = I.
47
Тема 18. Альдегиды и кетоны
Содержание темы. Способы получения альдегидов и кетонов. Электронное
строение карбонильной группы. Наиболее важные реакционные центры.
Реакции нуклеофильного присоединения по карбонильной группе (воды,
спиртов, тиолов, гидросульфита натрия, циановодородной кислоты,
металлорганических соединений). Образование ацеталей и тиоацеталей.
Реакции альдегидов и кетонов с азотсодержащими нуклеофилами (первичными
аминами, гидроксиламином, гидразином, семикарбазидом). Реакции с участием
СН-кислотного центра (альдольное присоединение и кротоновая конденсация).
Роль кислотного и основного катализа в реакциях карбонильных соединений.
Реакция Перкина. Реакция Кневенагеля. Реакции восстановления и окисления.
Галоформная реакция. Особенности реакций присоединения к α,β-ненасыщенным карбонильным соединениям. Хиноны, их получение и свойства.
Домашнее задание по теме 18
1. Проработайте материал лекции и ОХ-1, глава 18 (с. 420–450).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
гидроформилирование, окисление по Оппенауэру, реакция Гриньяра, гемдиолы, полуацетали, ацетали, тиоцетали, дитиоацетали, имины (основания
Шиффа), гидразоны, оксимы, семикарбазоны, гидроксинитрилы, реактивы
Гриньяра, метиленовая компонента, карбонильная компонента, алюмогидрид
лития, боргидрид натрия, реактив Толленса, реактив Фелинга, галоформы,
семихинон, хингидрон.
3. Выполните задание по РУК, п. 14.11 (с. 267).
4. Подготовьтесь к формульному диктанту (см. ниже).
5. Оформите лабораторный журнал, опыты 14.1–14.9 (РУК, с. 268–273).
Задания для САРСа
1. Выполните задания по РУК, п.п. 14.1–14.3, 14.5–14.10, 14.12 – 14.14,
14.16–14.22 (с.265-268).
Формульный диктант
Формальдегид, ацетальдегид, пропионовый альдегид, масляный альдегид,
изомасляный альдегид, валериановый альдегид, изовалериановый альдегид,
бензальдегид, хлораль, акролеин, кротоновый альдегид, коричный альдегид,
фталевый альдегид, ацетон, ацетофенон, пропиофенон, бензофенон, гидразин,
гидроксиламин, семикарбазид, орто-бензохинон, пара-бензохинон, 1,4-нафтохинон, антрахинон, гидрохинон, бутиллитий, этилмагнийбромид.
Практикум. Выполнение опытов 14.1–14.9 (РУК с. 268–273).
48
Тема 19. Карбоновые кислоты
Содержание темы. Общая характеристика, номенклатура, классификация и
физические свойства карбоновых кислот. Способы их получения. Строение
карбоксильной группы. Образование водородных связей. Наиболее важные
реакционные центры. Кислотные свойства карбоновых кислот. Реакции
нуклеофильного замещения у sp2-гибридизованного атома углерода карбоксильной группы. Декарбоксилирование. Галогенирование.
Домашнее задание по теме 19
1. Проработайте материал лекций и ОХ-1, глава 19 (с. 453–471).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
гидрокарбонилирование, этерификация, ацилгалогениды, ангидриды кислот,
амиды кислот, декарбоксилирование, реакция Бородина, реакция ГелляФольгарда-Зелинского.
3. Напишите уравнения следующих химических реакций:
1) пропионовой кислоты с тионилхлоридом;
2) масляной кислоты с бромидом фосфора(III);
3) изовалериановой кислоты с хлоридом фосфора(V);
4) дегидратации фталевой кислоты;
5) валериановой кислоты с аммиаком с последующим нагреванием;
6) получения диэтилкетона из бариевой соли соответствующей кислоты;
7) деканоата серебра с бромом в четыреххлористом углероде;
8) хлорирования гептановой кислоты в присутствии фосфора;
9) малонового эфира с этоксидом натрия;
10) получения адипиновой кислоты из циклогексанола.
4. Выполните задание по РУК, п. 15.19 (с. 275).
5. Оформите лабораторный журнал, опыты 15.1 – 15.8 (РУК, с. 276–279).
Задания для САРСа
1. Выполните задания по РУК, п.п. 15.1, 15.2, 15.13 15.16 (с. 273–274).
Практикум. Выполнение опытов 15.1–15.8 (РУК, с. 276–279).
Тема 20. Функциональные производные карбоновых кислот
Содержание темы. Общая характеристика функциональных производных
карбоновых кислот. Галогенангидриды, ангидриды, кетены, сложные эфиры,
ортоэфиры, амиды, гидразиды, гидроксамовые кислоты, нитрилы кислот.
Способы получения и химические свойства функциональных производных
карбоновых кислот. Реакции ацилирования. Гидролиз функциональных
49
производных карбоновых кислот. Реакции конденсации. Восстановление и
реакции с магнийорганическими соединениями.
Домашнее задание по теме 20
1. Проработайте материал лекций и ОХ-1, глава 20 (с. 471–494).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
галогенангидриды, ангидриды, кетены, ортоэфиры, тиоэфиры, амиды, гидразиды, ацилазиды, иминоэфиры (имидаты), нитрилы кислот, гидроксамовые
кислоты, ацил (ацетил, формил, бензоил), переэтерификация, сложноэфирная
конденсация, аммонолиз, синтез Габриеля, малоновый эфир, янтарная кислота
(сукцинаты), малеиновая и фумаровая кислоты, фталевая и терефталевая
кислоты, фталимид.
3. Выполните задание по РУК, п. 15.20 (с. 275).
4. Подготовьтесь к формульному диктанту (см. ниже).
5. Оформите лабораторный журнал, опыты 15.9 – 15.11 (РУК с. 279 – 281).
Задания для САРСа
1. Выполните задания по РУК, п.п. 15.5, 15.8, 15.9, 15.11, 15.14 - 15.18 (с.
273 – 275).
Формульный диктант
Муравьиная, уксусная, бензойная, щавелевая, малоновая, янтарная,
глутаровая, адипиновая, малеиновая, фумаровая, фталевая, терефталевая
кислоты, метилформиат, этилацетат, диэтилоксалат, уксусный ангидрид,
янтарный ангидрид, фталевый ангидрид, малеиновый ангидрид, ацетилхлорид,
бензоилхлорид, оксалилхлорид, ацетамид, ацетанилид, диметилформамид,
сукцинимид, фталимид, парацетамол, фенацетин, кетен, ацетоуксусный эфир,
ацетонитрил, бензонитрил, акрилонитрирл, N-бромосукцинимид.
Практикум. Выполнение опытов 15.9–15.11 (РУК, с. 279–281).
Пример билета тестового контроля
«Карбонильные соединения»
1. Соединение строения
CH3
O
C
OCH3
а) этилацетат;
в) метилформиат;
имеет название:
б) метилэтиловый эфир;
г) метилацетат.
2. При восстановлении бутаналя образуется:
а) бутанол-1;
в) бутан;
3. Продуктом реакции
б) бутанол-2;
г) бутановая кислота.
O
CCl3
C
H
+ H2O
является:
50
а) гидрат;
в) полуацеталь;
б) альдегидокислота;
г) двухосновная кислота.
4. Сложный тиоэфир не реагирует с:
а) гидроксидом натрия;
в) спиртом;
5. В схеме реакции Х + СО2 →
CH3
б) метиламином;
г) бензолом.
O
веществом Х является:
CH C
COOH
а) β-кетоэфир;
в) тиол;
SCoA
б) пропионовая кислота;
г) сложный тиоэфир пропионовой кислоты.
Пример билета контрольной работы
«Карбонильные соединения»
1. Напишите уравнения следующих реакций и назовите продукты или класс
полученных соединений:
O
O
OH
CH3CH2 C H + H C H альдольное
присоединение
O
NH2
CH3 C H +
O
C OCH CH3 NaOH
CH3 +
2.
Напишите соответствующие уравнения реакций:
NH2
C2H5OH/H+
CH3 C O
A
OH
B
H2O/H+
C
Модульная контрольная работа №2
Материалы для подготовки ко 2-му модулю
1. Примеры химических реакций, которые необходимо знать
эфир
P + Br2
CH2Cl + KF
(CH3)2CHCH2OH
; СН3СН2Br + Mg
;
CH3CH2Br + CH3CH2C CNa
CH2Cl + KI
ацетон
;
; CH2 CHCH2Br
CH3CH2Cl + (CH3)2CH NHCH3
Na
Br + Mg
CH2Cl + CH3SNa →;
эфир
;
CH2Br + (CH3)2CH NH2
;
CH2Cl + (CH3)2CHONa
;
CH3CH2Cl + (C2H5)3N
;
(CH3)2C CHCH3 + HIO4
;
;
;
ацетон
;
OH OH
CH3CH2C
Cl
CH3
CH3
+ NaOH
спирт
2 CH2CH2 + Cu(OH)2 + 2NaOH
;
OH OH
51
;
H+
2 CH3CH2CH2OH t
CH3
;
to
CH3 C CH2 OH + HBr
/ to
CH3CHC CH + CH3CH2OH KOH(тв.)
;
p
CH3
;
CH3
H+
2 CH2CH2 t ;
OH OH
CH3
KMnO4/H+
ОН
H+
CH2CHCH2CH2 t ;
OH
OH
;
K2Cr2O7
ОН
CH2 CH CH2 + 3HNO3
H2SO4
CHCH3 KMnO4 /H
t
OH OH
+
OH H2SO4/t ;
;
ONa + CO2
;
+ NH3
;
K2Cr2O7/H+
SO3Na
NaHSO3
to, p
1) NaOH/сплавление
2) H2O/H+
;
Br2aq(изб.)
OH
;
H2SO4, 20oC
OH
;
S OC2H5
С6H5OH +
;
CrO3
;
O
;
;
70oC
OH
OH
NaHSO3
кипячение
NaOH
C6H5ONa + NaNO2 + H2SO4
NH2
+ H2O
;
OH + CHCl3
NaOH ;
OH + 2(CH3O)2SO2
C6H5OH
C2H5OH + SOCl2
;
OH OH OH
(CH3)2 C
HO
; (CH3)2CHCH2OH H2SO4/t ;
;
O
ONa
OH
HNO3(изб.)
;
H2SO4
+ NaNO2 + H2SO4
H+
OH + HCH=O
; C6H5CH2 O CH3 + HBr
CH3CHOCH2CH3 + KCN
;
CH3
;
Cl
СH3CH2
СH3CH2
O CH2CH3
O CH2CH3
R , O2
О
Cl2, h
R , O2
o
-20 C
;
гидропероксид;
ОСH3
Br2, 0oC
H+
;
;
AlCl3
;
KOH(спирт)
CH3CHOCH2CH3
;
Cl
; (CH3)3C O CH3 + HBr
;
OCH3 + HI
;
; C6H5 O CH3 + HI
C6H5CH2 O CH3 + HBr
гидропероксид ;
+
CH CH2 + H2O H
O
O CH2CH=CH2
гидропероксид ; C2H5 O C2H5 + H2SO4
CH3CH CH O CH3 + H2O
O
R , O2
;
;
SH
;
KMnO4
;
O
CH3CH2Br +
SCH3
;
CH3SH + CH2=CHCH=O
52
;
CH3SCH3
H2O2
;
CH3CH2CHCH3 + NaSH
o
; CH3CH2CH=CH2 + H2S h, 0 C ;
; CH3CH2Br + CH3SC2H5
Cl
CH3(CH2)5
CH CH2 + C6H5SH
(СH3)C=CH2 + H2S
H2SO4
CH3CHCH3 +
; (C2H5O)2SO2 + K2S
; ClCH2CH2CH2CH2Cl + Na2S
C6H5SNa + C2H5Br
;
;
; 2C2H5SH + HgO
SCH3
;
I
CH3CCH2CH3 + 2C2H5SH
_
+
[H
NOH]Cl
CCH3 + 3
;
;
CCH3 + NaHSO3
;
;
O + NaHSO3
;
O
+ HCN
H
;
; CH3CH2C
CH3CH2CCH(CH3)2 + C6H5NHNH2
O
H+
;
NO2
CH3CCH3 + H2N NH
O
H+
;
O H+
H
2C2H5OH + H C
O
CH2 H
CH3CC2H5 + CH2
O
OH
+
;
;
NHNH2
+
CH3CH2C
_
2 CH3CH2CH2C
;
O
O
C CH3 OH
;
2 (CH3)2CHC
60% KOH
;
C
H
CH3CCH2CH3 + I2 KOH/H2O
;
_
(C2H5O)3Al
CCH3 + Br2 OH
;
O
_
OH
C2H5CHO + [Ag(NH3)2]OH
;
O
основание ;
+ (CH3CO)2O
H
(CH3)2CHC
O
+
H
C
O OH _
H
;
2CH3CH2C
2
основание
; (CH3CO)2O + HSC6H5
; СH3CH2CHCH3
CH3CH2C
SCH3
O
OCH3
;
+ CH3OH
+ NH3
COOH + (CH3)2CHOH
;
COOH + CH3CHCH2CH3
OH
+
COOC2H5 + CH3CHCH2CH3 H
O
_
OH ;
O
+ H
OH
O
C
OH
H+ (CH CO) O + H NC H
;
3
2
2
6 5
H+
;
CH3CH2COOCH3 + CH3CHCH3
NH2
(CH3CO)2O + CH3CHCH2CH3
;
OH
OH
53
;
H
H
O
CH3CH2C
;
O H+, to
CH2C
O
CCH3 + CH2(CN)2
;
O
H
O
_
O OH
;
2 CH3CH2CH2C
H
;
+ C2H5OH
H
_
O
;
CH3CH2CH2CHO + HCN
O
H
CH3CCH3 + Br2 OH
C
;
OH
H
+ CH3
;
O + C2H5MgBr
O
CH3CH2C
H
;
O
O
+ C2H5MgBr
H
CH2C
O
C6H5SH + I2
O
CH3CH2COH + CH3CHCH3
OH
HC
;
H+
;
;
;
;
O
NH + K2CO3
СONH CH3 + NaOH
;
t
C N
;
H2O, H+
;
O
O
CH2C
O
P2O5
NH2
t
СONH C2H5 + H2O + HCl
;
;
NH + Br2
NaOH
0oC
;
O
2 CH3COOC2H5
основание
CH2C
;
O
HNO2
NH2
;
2CH3COOH
P2O5
;
O
O
+ NH3
O
;
C
NH2
+ Cl2
NaOH
to
;
CH3CH2CH2COOH + Cl2
PCl5
;
O
MgBr + CO2
;
С6H5C
O
LiAlH4
OC2H5
;
CH3CH2COOCH3 + CH3CHMgBr
.
2. Примеры теоретических вопросов
Сравните реакционную способность бензилового и этилового спиртов в
реакции с соляной кислотой в присутствии хлорида цинка (проба Лукаса).
Объясните ваш ответ.
Какой алкоголят и какое галогенопроизводное следует использовать для
получения трет-бутилметилового эфира по реакции Вильямсона? Объясните
ваш ответ.
Сравните реакционную способность алифатических альдегидов и кетонов в
реакциях AN. Приведите примеры, поясняющие ваш ответ.
Является ли региоселективной реакция бензилметилового эфира с
галогеноводородной кислотой? Ответ поясните, написав механизм соответствующей реакции.
Сравните реакционную способность сложных эфиров и амидов в реакции
гидролиза. Поясните ваш ответ, написав механизмы соответствующих реакций.
Гидролиз ацеталей легко проходит в кислой среде, однако к щелочному
гидролизу они устойчивы. Объясните этот факт, написав механизм реакции
гидролиза.
Сравните реакционную способность алифатических альдегидов и кетонов в
реакциях AN. Приведите примеры, поясняющие ваш ответ.
Сравните реакционную способность сложных эфиров и хлорангидридов
карбоновых кислот в реакциях SN. Приведите примеры, поясняющие ваш ответ.
54
Можно ли использовать бензальдегид и ацетон в качестве метиленовых
компонентов в реакциях конденсации? Приведите примеры соответствующих
реакций и поясните ваш ответ.
Почему образование полуацеталя из хлороуксусного альдегида происходит
быстрее, чем из уксусного, а соотношение скоростей образования ацеталей из
соответствующих полуацеталей — обратное. Приведите примеры соответствующих реакций и поясните ваш ответ.
Сравните легкость замещения галогена на гидроксигруппу в винил-, аллил- и
алкилгалогенидах. Приведите примеры соответствующих реакций и поясните
ваш ответ.
Сравните реакционную способность хлорангидридов, ангидридов и сложных
эфиров в реакциях ацилирования аминов. Приведите примеры соответствующих реакций и поясните ваш ответ.
Какие продукты можно получить окислением одноатомных спиртов в
различных условиях? Приведите примеры соответствующих реакций.
Какие продукты можно получить окислением многоатомных спиртов в
различных условиях? Приведите примеры соответствующих реакций.
Почему в результате сульфирования фенола при различных температурах
образуются различные продукты? Приведите примеры соответствующих
реакций.
3. Примеры цепочек превращений
+
+
Уксусная кислота Br2/PCl3 A NaCN B H2O/H C 2 C2H5OH/H D C2H5ONa
E C2H5Br F NH2CH3 G
Толуол 2 Br2 /h
1) Ag(NH3)2OH
A 2 H2O B 2) H+
C SOCl2 D NH3 E Br2/NaOH
F CH3COH G.
Этаналь
_
OH
альдольная
конденсация
+
A 2 C2H5OH/H B (CH3O)2SO2
+
1) Ag(NH3)2OH
C H2O/H D
+
2) H
E SOCl2 F NH2CH3/t G
+
Формальдегид C2H5MgBr A H2O B KMnO 4/H C Cl2/PCl3
D KCN
+
+
E H2O/H F 2 CH3OH/H G
H2O/H+
SOCl
Mg
CH
COH
LiAlH
2
3
4
Этилацетат
A
B
C
D
E KMnO4
F NH2CH3 G
+
Уксусная кислота SOCl2 A CH3OH/H B CH3MgBr C C6H6/AlCl3 D H2SO4
E NaOH/t F (CH3CO)2O G
2-метилпропановая кислота Br2 A KOH/спирт. B HBr (изб.) C KCN D
H2O/H+ E NH3 F
t
G
55
+
E H2O/H F
+
Пропен HBr A KCN B H2O/H C Br2 D KCN
2 C2H5OH
G
+
H
NaOH
A водн
HCl
Бутен-1
PCl5
F
(C2H5)2NH
CuO
Метанол
C6H5CH2Cl
- LiCl
A
Br2, NaOH
- CHBr3
C
HCl
D
E
G
2CH3OH, HCl
o
B HSCH2CH2CH2SH C C4H9Li, -78 C
-C4H10
- 2CH3OH
Хлороуксусная кислота
C6H5CH2Cl
B
HgCl2, H2O
E
Na2Cr2O7, H+
C2H5NH2
F
KCN
G.
+
+
A H2O/H B 2 C2H5OH/H C C2H5ONa
D
-C2H5OH
+
E H2O/H F
G
- CO2
1,4-дихлоробутан 2NaOH A
D
KMnO4(изб.), H+
водн
B
NH3
C
-H2O
Br2,NaOH
D
0oC
O
C6H5CH2C
Cl
- сукцинимид
Толуол
K2CO3
Бензол
H2SO4
(C2H5)2NH
A
C2H5COCl, AlCl3
E
2Cl2, h
NaOH
F водн
CH3Cl, AlCl3
C6H5CH2Cl
F
KMnO4, H2O
Толуол
E
2HCl
A
2H2O
G
H2O, to
B
C
KMnO4(изб.), H+
NH3
D
-H2O
G
+
A CH3MgBr B H2O/H C
F
2NaCN
B
NaOH(спирт.)
D
G
HCN
+
C2H5OH, H+
H
O/H
2
C
D
E
HCl
NH3(изб.)
F
G
Пример билета контрольной работы 2-го модуля
1. Допишите уравнения реакций, назовите образующиеся продукты:
O
_
а) CH3CCH3 + Br2 OH ;
б)
O
NH + K2CO3
O
56
;
E
в)
COOH + (CH3)2CHOH
д)
CH2Cl + CH3SNa
ж)
OH + CHCl3
и)
SH
KMnO4
H+
Cl
г)
;
Cl
NaOH
o
70 C
C O + C2H5OH
;
;
е) (CH3)2C CHCH3 + HIO4
OH OH
;
з) CH3CHOCH2CH3 + KCN
;
Cl
к) CH3CH2COH + CH3CHCH3
OH
;
;
2. Сравните реакционную способность сложных эфиров и хлорангидридов
карбоновых кислот в реакциях SN. Приведите примеры, поясняющие ваш ответ.
3. Напишите соответствующие уравнения реакций:
+
+
уксусная кислота Br2/PCl3 A NaCN B H2O/H C 2 C2H5OH/H D C2H5ONa
E C2H5Br F NH2CH3 G
Зачет
Пример билета зачетного теста по органической химии
1. Соотнесите название класса соединения с приведенной ниже формулой:
CH NH
а) кетон; б) полуацеталь; в) имин; г) сложный эфир; д) амид; е) ацеталь.
2. Какие типы пространственных изомеров возможны для нижеследующего
соединения?
BrCH=CH(Cl)CH3
а) энантиомеры;
в) -диастереомеры;
б) π-диастереомеры;
г) нет изомеров.
3. Сколько асимметрических атомов углерода содержится в приведенном
соединении?
CH2 CH CH CH C O
H
OH OH OH OH
а) 0; б) 1; в) 2; г) 3; д) 4; е) 5.
4. Определите конфигурацию нижеследующего соединения по двум стереохимическим номенклатурам:
C2H5
H
COOH
NH2
а) D; б) L; в) R; г) S.
57
5. Укажите, какими электронными
заместитель в следующем соединении?
эффектами
обладает
выделенный
OCH3
а) –М; б) +М; в) –I; г) +I; д) –М, –I; е) –М, +I; ж) +М, –I.
6. Какой тип сопряжения осуществляется в приведенной ниже частице?
OH
а) π,π-; б) р,π-; в) π,π- и р,π-; г) нет сопряжения.
7. Какой из приведенных ниже свободных радикалов является наиболее
устойчивым?
а) CH3 C CH3 , б) CH2 CH CH CH CH2, в)CH3, г) CH2 CH CH2
CH3
а); б); в); г).
8. Выберите наиболее сильную кислоту из приведенных ниже:
а) HCOOH ; б) CH3COOH; в) Cl3CCOOH; г) ClCH2COOH; д) Cl2CHCOOH.
9. Какие из нижеследующих суждений верны?
1) R–OH более сильная кислота, чем R–NH2 (R — одинаковы); 2) pKa = – lgKa;
3) чем слабее кислота, тем меньше основность сопряженного основания; 4) чем
сильнее кислота, тем больше значение Ka; 5) электроноакцепторные
заместители способствуют делокализации отрицательного заряда и
стабилизируют анионы.
а) 1, 2, 3, 4, 5;
б) 1, 2, 4, 5;
в) 2, 4, 5;
г) 1, 2, 5;
д) 1, 4, 5.
10. Для алканов наиболее характерны реакции типа:
а) AN;
б) AE;
в) SN;
г) SE; д) SR;
е) E.
11. Валентные колебания С=С связей в ИК-спектре проявляются в области:
а) 600–800 см–1; б) 2500–3500 см–1; в) 1600–1680 см–1; г) 1200–1400 см–1;
12. В спектре ЯМР 1Н сигналы ароматических протонов имеют химический
сдвиг в области:
а) 0–2 м. д.; б) 10–12 м. д.; в) 3–5 м. д.; г) 6,5–7,5 м. д.
13. В спектре ЯМР 1Н сигнал выделенного протона в соединении:
CH3CH2Cl проявляется в виде:
а) синглета; б) дублета; в) триплета; г) квадруплета; д) квинтета.
14. Для каких из нижеприведенных соединений реакция гидратации проходит
по правилу Марковникова?
58
CH3
CH C CH
; 3)
3
1) CH2 CH CH3 ; 2)
O
5) CH2 CH C OH
CH3 ; 4)
CH CH2 ;
а) 1, 2, 3; б) 2, 4, 5; в) 1, 3, 4; г) 2, 3, 5; д) 1, 2, 5.
15. В каких из нижеприведенных соединений имеет место согласованная
ориентация в реакциях SЕ?
COOH
OH
1)
; 2)
NO2
; 3)
NO2
CH3
NH3+
Cl
; 4)
NH2
; 5)
Cl
SO3H
Варианты ответа: а) 1, 2, 3; б) 2, 4, 5; в) 1, 3, 4; г) 2, 3, 5; д) 1, 4, 5.
59
Тема 21. Угольная кислота и ее функциональные производные 3
Содержание темы. Общая характеристика угольной кислоты. Хлорангидриды,
сложные эфиры и амиды угольной кислоты.
Домашнее задание по теме 21
1. Проработайте материал лекции и ОХ-1, раздел 20.7 (с. 494–507).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
фосген, фосгенирование, хлороугольные эфиры (хлороформиаты), органические карбонаты, изоцианаты, карбамоилхлориды, уретаны, карбаминовая
кислота, мочевина, изоциановая кислота, циануровая кислота, биурет, уреиды
кислот, гуанидин.
3. Напишите уравнения следующих реакций:
1) фосгена с одним и двумя молями метанола в присутствии триэтиламина;
2) пропандиола-1,2 с фосгеном в присутствии щелочи;
3) фосгена с одним и двумя молями этиламина;
4) фосгена с диизопропиламином;
5) этилхлороформиата с пропиламином и метанолом;
6) этилизоцианата с бензиловым спиртом;
7) мочевины с уксусным ангидридом;
8) биуретовой реакции;
9) этилортокарбоната с аммиаком;
10) гуанидина с соляной кислотой.
4. Оформите лабораторный журнал, опыты 16.1–16.4 (РУК, с. 286–287).
Задания для САРСа
1. Выполните задания по РУК, п.п. 16.1, 16.2, 16.4–16.7, 16.9, 16.10 (с. 281–
284).
Тема 22. Сульфокислоты и их функциональные производные
Содержание темы. Общая характеристика сульфоновых кислот, их строение,
способы получения, физические и химические свойства. Сульфонилхлориды;
сульфонамиды, эфиры сульфоновых кислот. Метод Хинсберга.
Домашнее задание по теме 22
1. Проработайте материал лекции и ОХ-1, раздел 20.8 (с. 501–507).
2. Выпишите в тетрадь определения новых и наиболее важных терминов:
десульфирование, сульфонаты, тозилаты, мезилаты, трифлаты, сульфонилхлориды, тозилхлорид, хлорсульфоновая кислота, сульфонамиды, проба
Хинсберга, хлорамины, монохлорамин-Т, монохлорамин-Б, пантоцид.
3
Темы 21 и 22 рассматриваются на первых двух занятиях во втором семестре.
60
3. Напишите уравнения следующих реакций:
1) бензилхлорида с сульфитом аммония;
2) десульфирования мета-бромобензолсульфокислоты;
3) тозилата калия с хлоридом фосфора(V);
4) тозилхлорида с глицерином;
5) бензолсульфохлорида с аммиаком;
6) этилмезилата с феноксидом натрия;
7) пара-толуолсульфонамида с гидроксидом натрия и образующегося продукта
с хлором.
4. Подготовьтесь к формульному диктанту (см. ниже).
5. Оформите лабораторный журнал, опыт 16.5 (РУК с. 287).
Задания для САРСа
1. Выполните задания по РУК, п.п. 16.11–16.20 (с. 284–285).
2. Предложите способ разделения бутиламина, метилпропиламина и
диметилэтиламина методом Хинсберга.
Формульный диктант
Угольная кислота, фосген, этилхлороформиат, этилкарбонат, бензилизоцианат, N,N-диметилкарбамоилхлорид, карбаминовая кислота, этилуретан,
метил-N-этилкарбамат, изопропилэтилкарбонат, мочевина, изоциановая
кислота, циануровая кислота, биурет, уреид α-бромоизовалериановой кислоты,
гуанидин, сульгин, тозилхлорид, бензолсульфонамид, этилмезилат, метилтрифлат, монохлорамин-Б, монохлорамин-Т, пантоцид.
Практикум. Выполнение опыта 16.5 (РУК, с. 287).
61
Содержание
Список литературы и ее условные обозначения……………………………….
Содержание дисциплины………………………………………………………..
Указания к оформлению отчетов о выполнении лабораторных работ……….
1-й модуль. Строение органических соединений, химия углеводородов……
Тема 1. Классификация, структурная изомерия и номенклатура
органических соединений……………………………………………………….
Тема 2. Электронное строение органических соединений……………………
Тема 3. Кислотно-основные свойства органических соединений……………
Тема 4. Пространственное строение органических соединений……………...
Тема 5. Классификация реакций и реагентов. Факторы, определяющие
реакционную способность органических соединений………………………...
Тема 6. Алканы …………………………………………………………………..
Тема 7. Циклоалканы ……………………………………………………………
Тема 8. Алкены…………………………………………………………………...
Тема 9. Алкадиены……………………………………………………………….
Тема 10. Алкины…………………………………………………………………
Тема 11. Реакционная способность ароматических углеводородов (аренов)..
Модульная контрольная работа №1…………………………………………….
2-й модуль. Органические соединения с одной функциональной группой….
Тема 12. Галогенопроизводные углеводородов………………………………..
Тема 13. Спирты………………………………………………………………….
Тема 14. Фенолы…………………………………………………………………
Тема 15. Простые эфиры………………………………………………………...
Тема 16. Органические соединения серы………………………………………
Тема 17. Амины…………………………………………………………………..
Тема 18. Альдегиды и кетоны…………………………………………………...
Тема 19. Карбоновые кислоты…………………………………………………..
Тема 20. Функциональные производные карбоновых кислот………………...
Модульная контрольная работа №2…………………………………………….
Зачет. 3ачетный тест……………………………………………………………..
Тема 21. Угольная кислота и ее функциональные производные……………..
Тема 22. Сульфокислоты и их функциональные производные……………….
62
2
3
4
5
5
17
20
25
30
32
33
35
36
37
38
40
42
42
43
44
45
45
46
48
49
49
51
57
60
60