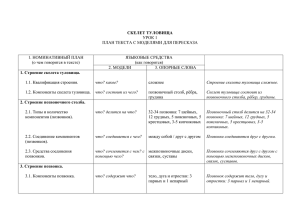
ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ «РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ НАУЧНЫЙ ЦЕНТР имени Н.Н. БЛОХИНА»
реклама

ФЕДЕРАЛЬНОЕ ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ «РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ НАУЧНЫЙ ЦЕНТР имени Н.Н. БЛОХИНА» РОССИЙСКАЯ АКАДЕМИЯ МЕДИЦИНСКИХ НАУК На правах рукописи НЕРЕД Анастасия Сергеевна СОВРЕМЕННЫЙ КОМПЛЕКС ДИФФЕРЕНЦИАЛЬНОЙ ЛУЧЕВОЙ ДИАГНОСТИКИ ПАТОЛОГИЧЕСКИХ ПЕРЕЛОМОВ ПОЗВОНКОВ 14.01.12 – онкология, 14.01.13 – лучевая диагностика, лучевая терапия. ДИССЕРТАЦИЯ на соискание ученой степени кандидата медицинских наук Научные руководители: доктор медицинских наук КОЧЕРГИНА Наталия Васильевна доктор медицинских наук МУСАЕВ Эльмар Расимович Москва 2013 2 СПИСОК СОКРАЩЕНИЙ ВИ – взвешенное изображение ВКИ – весовой коэффициент информативности ДВ-МРТ – диффузионно-взвешенная магнитно-резонансная томография КВ – контрастное вещество МРТ – магнитно-резонансная томография МРТ-ДК – магнитно-резонансная томография с динамическим контрастированием ОСГ - остеосцинтиграфия ОФЕКТ – однофотонная эмиссионная компьютерная томография ОФЕКТ/КТ - однофотонная эмиссионная компьютерная томография, совмещенная с рентгеновской компьютерной томографией ПЭТ – позитронно-эмиссионная томография ПЭТ/КТ – позитронно-эмиссионная томография, совмещенная с рентгеновской компьютерной томографией РКТ – рентгеновская компьютерная томография РИД – радиоизотопная диагностика РФП – радиофармпрепарат ТОСГ – трехфазная остеосцинтиграфия 18 F-ФДГ – 18-фтор-деоксиглюкоза 99m Тс-MDP - технеций-99-метилендифосфонат 99m Тс-MIBI - технеций-99-гекса-2-метоксиизобутилизонитрил 201 Tl-хлорид – таллий-201-хлорид 3 ОГЛАВЛЕНИЕ СПИСОК СОКРАЩЕНИЙ _______________________________________________________________ 2 ВВЕДЕНИЕ _____________________________________________________________________________ 4 Глава 1. ЛУЧЕВЫЕ МЕТОДЫ В ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ ПАТОЛОГИЧЕСКИХ ПЕРЕЛОМОВ ПОЗВОНКОВ. __________________________________________ 10 Глава 2. ОБЩАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ, МЕТОДОВ ОБЛЕДОВАНИЯ И СТАТИСТИЧЕСКОГО АНАЛИЗА__________________________________________________________38 Глава 3. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА «ОПУХОЛЕВЫХ» И «ОСТЕОПОРОЗНЫХ» ПАТОЛОГИЧЕСКИХ ПЕРЕЛОМОВ ПОЗВОНКОВ. РЕЗУЛЬТАТЫ, ОБСУЖДЕНИЕ И РАЗРАБОТКА АЛГОРИТМА ОБСЛЕДОВАНИЯ____________________________________________ 59 3.1. Информативность клинико-анамнестических данных в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков. _________________________ 59 3.2. Информативность рентгенографии в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков. _________________________ 63 3.3. Информативность рентгеновской компьютерной томографии в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков. ______________ 71 3.4. Информативность стандартной магнитно-резонансной томографии в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков. ______________ 86 3.5. Информативность методики магнитно-резонансной томографии с динамическим контрастированием (МРТ-ДК) в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков _______________________________________________________ 94 3.6. Диагностическая ценность методики диффузионно-взвешенной магнитно-резонансной томографии (ДВ-МРТ) в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков. _____________________________________________________ 102 3.7. Диагностическая ценность методов ядерной медицины в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков __________________________103 3.8. Сравнительная характеристика лучевых методов и разработка алгоритма обследования для дифференциальной диагностики «опухолевых» и «остеопорозных» патологических переломов позвонков._______________________________________________________________________________ 106 Глава 4. ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПАТОЛОГИЧЕСКИХ ПЕРЕЛОМОВ ПОЗВОНКОВ ПО НОЗОЛОГИЧЕСКИМ ФОРМАМ. РЕЗУЛЬТАТЫ, ОБСУЖДЕНИЕ И РАЗРАБОТКА АЛГОРИТМА ОБСЛЕДОВАНИЯ _______________________________________ 112 4.1. Информативность клинико-анамнестических данных в дифференциальной диагностике патологических переломов позвонков по нозологическим формам .____________________________113 4.2. Информативность рентгенографии в дифференциальной диагностике патологических переломов позвонков по нозологическим формам.__________________________________________ 116 4.3. Информативность рентгеновской компьютерной томографии в дифференциальной диагностике патологических переломов позвонков по нозологическим формам._________________ 121 4.4. Информативность стандартной магнитно-резонансной томографии в дифференциальной диагностике патологических переломов позвонков по нозологическим формам. _________________133 4.5. Сравнительная характеристика лучевых методов и разработка алгоритма обследования для дифференциальной диагностики патологических переломов позвонков по нозологическим формам.____139 ЗАКЛЮЧЕНИЕ_________________________________________________________________________ 153 ВЫВОДЫ_______________________________________________________________________________164 СПИСОК ЛИТЕРАТУРЫ ________________________________________________________________ 166 4 ВВЕДЕНИЕ Актуальность темы Наиболее частой причиной компрессионных переломов позвонков является остеопороз [1]. По данным различных исследований у 40% женщин и 20% мужчин в возрасте 80 лет диагностируют патологические переломы позвонков. Несколько более редкой, но более прогностически неблагоприятной причиной развития патологических переломов позвонков является опухолевое поражение. Более 80% злокачественных опухолей метастазируют в кости [12, 13]. Наибольшей склонностью к метастазированию в осевой скелет обладают рак молочной железы и рак предстательной железы [14]. Особую группу составляют пациенты с подтвержденным онкологическим диагнозом, которым необходимо исключить вторичное поражение костной системы. Прогноз и качество жизни больных с патологическими переломами позвонков вне зависимости от этиологии их возникновения во многом зависит от своевременного и правильно установленного диагноза. «Золотым стандартом» для выбора тактики лечения в онкологии является гистологическое исследование. При этом такой подход не лишен ряда недостатков за счет длительности его проведения. Это особенно важно у пациентов с быстро нарастающим неврологическим дефицитом, когда для получения хороших функциональных результатов необходимо начать лечение в максимально короткие сроки. На сегодняшний день с развитием различных видов хирургического и терапевтического контроля онкологических заболеваний дифференциальная диагностика патологических переломов позвонков на основании лучевых методов становится актуальной. Заключение врача-рентгенолога об этиологии патологического перелома позвонка, особенно с указанием на возможный тип опухоли, позволит клиницисту оптимизировать план обследования и сократить 5 его длительность. В ряде случаев можно полностью отказаться от морфологической верификации диагноза. Необходимо учитывать, что терапевтическое воздействие, такое как лучевая терапия или гормонотерапия в плане комплексного лечения онкологических больных, может стать причиной развития патологических переломов позвонков на фоне вторичного остеопороза [6]. На сегодняшний день в мире активно занимаются как усовершенствованием методов лучевой диагностики, так и разработкой дифференциально- диагностических критериев патологических переломов позвонков опухолевой и остеопорозной этиологии. Наряду с традиционными методами лучевой диагностики, такими как рентгенография, РКТ и МРТ-исследования, с этой целью стали применять динамическую МРТ с контрастным усилением, ПЭТ и ПЭТ/КТ. Некоторыми авторами было предложено применение сцинтиграфии с 99mТсMIBI и диффузно-взвешенной МРТ в качестве метода определения этиологии переломов позвонков. Помимо ПЭТ с 18F-ФДГ и диффузионно-взвешенной МРТ, большое внимание привлекает динамическая МРТ с контрастным усилением и последующим построением кривых накопления/выведения контрастного вещества (КВ), которые отражают наличие высоковаскуляризованных участков в зоне патологического перелома позвонка, коррелирующих с наличием «живой» опухолевой ткани. Обширность и противоречивость публикуемых данных о возможностях различных методов визуализации в дифференциальной диагностике патологических переломов позвонков свидетельствует об актуальности и нерешенности этой проблемы. Сохраняется необходимость продолжения поиска методов лучевой диагностики, способствующих улучшению этих возможностей. 6 Цель и задачи исследования Цель исследования. Повышение эффективности дифференциальной лучевой диагностики патологических переломов позвонков. Для решения поставленной цели были определены следующие задачи: 1. Разработать методику магнитно-резонансной томографии с динамическим контрастированием для дифференциальной диагностики патологических переломов позвонков. 2. Определить признаки различных лучевых методов для дифференциальной диагностики патологических переломов позвонков. 3. Определить показатели информативности лучевых методов для дифференциальной диагностики патологических переломов позвонков. 4. Провести сравнительный анализ информативности лучевых методов для дифференциальной диагностики патологических переломов позвонков. 5. Разработать алгоритм применения лучевых методов для дифференциальной диагностики патологических переломов позвонков. Научная новизна и практическая значимость исследования Впервые в России разработана и внедрена методика магнитно-резонансной томографии с динамическим контрастированием с использованием ультрабыстрых (не более 1,5 с) протоколов исследования для дифференциальной диагностики патологических переломов позвонков. Впервые на основании многофакторного анализа разработаны «решающие правила», основанные на совокупности признаков с их весовыми коэффициентами информативности (ВКИ), полученных с использованием различных лучевых методов для дифференциальной диагностики патологических переломов позвонков. Впервые проведен сравнительный анализ информативности различных лучевых методов с использованием разработанных «решающих правил» для дифференциальной 7 диагностики патологических переломов позвонков. Впервые на основании разработанных «решающих правил» обоснованы оптимальные алгоритмы обследования больных с патологическими переломами позвонков. Разработанные «решающие правила», основанные на совокупности ВКИ признаков различных лучевых методов, повысят качество дифференциальной диагностики патологических переломов позвонков, так как могут быть использованы как в обучающем процессе последипломного образования, так и в практической деятельности врачей. Разработанные оптимальные алгоритмы обследования больных с патологическими переломами позвонков улучшат качество дифференциальной диагностики, сократят время исследования и уменьшат его стоимость. Основные положения, выносимые на защиту 1. На применении основании лучевых проведенного методов анализа для данных, полученных дифференциальной при диагностики патологических переломов позвонков, разработаны «решающие правила», при помощи которых возможно разграничить не только группы с «опухолевыми» и «остеопорозными» переломами, но и более точно определить тип новообразования, вызвавшего компрессию позвонка. 2. Разработанные «решающие правила» представлены совокупностью различных признаков с их весовыми коэффициентами информативности (ВКИ). Совокупность признаков с их ВКИ позволяют отнести каждый патологический перелом в конкретную нозологическую группу. 3. Сравнительный анализ информативности «решающих правил» различных лучевых методов позволяет обосновать алгоритм обследования больных с патологическими переломами позвонков. В алгоритме обследования больных с патологическими переломами позвонков для дифференциальной диагностики «остеопорозных» и «опухолевых» переломов наивысшей информативностью 8 обладает сочетание анатомо-топографического и функционального метода, а именно стандартной МРТ и методики МРТ с динамическим контрастированием, отражающее как качественные, так и количественные признаки. Внедрение результатов исследования Фрагменты работы неоднократно докладывались: на съездах лучевых диагностов и научно-практических конференциях. Разработанные алгоритмы обследования и признаки для дифференциальной диагностики патологических переломов позвонков используются при обследовании впервые обратившихся больных и пациентов с онкологическим анамнезом в НИИ КО «РОНЦ им. Н.Н. Блохина» РАМН. Результаты исследования внедрены в учебный процесс кафедры лучевой диагностики, лучевой терапии и медицинской физики РМАПО. Публикации По теме диссертации опубликовано 5 печатных работ в журналах рекомендованных ВАК РФ, 1 тезис, сделано 5 устных докладов на научных конференциях. Личный вклад автора Дизайн исследования, постановка цели и задач диссертационной работы, а также методический подход для их осуществления разработаны автором лично. Весь проспективный материал (80%) с 2011 по 2013 годы, представленный в диссертации, кроме данных трехфазной сцинтиграфии, получен, обработан и проанализирован лично автором. Ретроспективный материал с 2009 по 2010 годы и данные трехфазной сцинтиграфии проанализированы автором лично. 9 Объем и структура работы Диссертационная работа изложена на 179 страницах машинописного текста, иллюстрирована 38 таблицами и 18 рисунками. Состоит из введения, четырех глав, заключения, выводов и списка литературы, включающего 2 отечественных и 129 зарубежных источников. 10 Глава 1 ЛУЧЕВЫЕ МЕТОДЫ В ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКЕ ПАТОЛОГИЧЕСКИХ ПЕРЕЛОМОВ ПОЗВОНКОВ 1.1 Эпидемиология Большинство патологических компрессионных переломов позвонков имеют доброкачественную природу и обусловлены остеопорозом [1]. При этом их распространенность увеличивается с возрастом и коррелирует со снижением минеральной плотности костной ткани. Считается, что к 80-летнему возрасту у 40% женщин и 20% мужчин выявляются патологические переломы позвонков. Наличие одной вертебральной деформации увеличивает риск последующих переломов в 5 раз [2]. По данным некоторых авторов, несмотря на то, что частота патологических переломов на фоне остеопороза у женщин выше, смертность, связанная с их возникновением и последующими осложнениями, превалирует у мужчин. Как правило, к компрессионной деформации приводит неадекватная травма (например, падение с высоты собственного роста), однако в случаях выраженного остеопороза переломы могут возникнуть на фоне нормальной физиологической активности (сгибании, разгибании, кашле), а в ряде случаев и спонтанно [3]. Выделяют два типа остеопороза: первичный (85%) и вторичный (15%). К первичному остеопорозу, который обусловлен снижением минеральной плотности костной ткани за счет возраста и физиологических гормональных изменений, относятся две основных формы: постменопаузальный и сенильный. Ряд авторов в первичном остеопорозе выделяют еще 3 дополнительных формы: постандропаузальный, ювенильный и идиопатический [4]. Вторичный остеопороз развивается вследствие различных заболеваний или имеет ятрогенный характер. По степени распространенности остеопороза в скелете выделяют генерализованную и локализованную формы. Последняя форма более характерна для костей конечностей. Его причиной могут быть длительная иммобилизация, 11 дистонический синдром [5] или в ряде случаев терапевтическое воздействие, такое как лучевая терапия [6]. Около 60% переломов позвонков при остеопорозе не сопровождаются клиническими симптомами [7]. Однако, как клинически проявляющиеся, так и бессимптомные деформации тел позвонков сопряжены с осложнениями и повышенной смертностью, которая увеличивается на 15% по сравнению с группой больных без патологических переломов [8]. Снижение физической функциональной активности и социальная изоляция отражаются на качестве жизни пациентов и значительно усложняют период реабилитации [9]. Второй по частоте причиной развития патологических переломов позвонков является опухолевое поражение. По данным некоторых авторов наиболее часто в кости метастазирует рак молочной железы (72%), предстательной железы (87%), щитовидной железы (50%), легкого (31%) и почки (37%). Таким образом, более 80% злокачественных опухолей метастазируют в кости [10, 11]. При этом до 39% метастазов в скелет локализуются в позвоночнике, и они могут также приводить к патологическим переломам [7]. Наибольшей склонностью к метастазированию в осевой скелет обладают рак молочной железы и рак предстательной железы [12]. Поражение костной системы при миеломной болезни встречается в 70-95% случаев [13]. При этом нередко данное заболевание манифестирует патологическими переломами, и частота их встречаемости достигает 60% [14]. Первичная неходжкинская лимфома (НХЛ) кости встречается в клинической практике крайне редко, составляя от 3% до 27,1% [15-20] всех первичных НХЛ кости и приблизительно от 0,1% до 6,5% [21-25] всех НХЛ. Метастатическая лимфома позвоночника более распространена, однако, четких данных о ее распространенности в литературе не представлено. По данным одних авторов частота развития компрессии спинного мозга при НХЛ позвоночника чрезвычайно мала [16], в то время как другие исследователи представили данные о 50% встречаемости этого осложнения [23]. Компрессия спинного мозга обусловлена метастазами рака молочной железы, предстательной железы, легкого в 15-20% случаев (для каждой нозологии), а 12 метастазами рака почки и поражением позвоночника при лимфоме и миеломной болезни в 5-10% [26]. У 20% больных онкологическое заболевание манифестировало неврологическим дефицитом вследствие метастатического поражения позвоночника. Стоит отметить, что частота параплегии, вызванной опухолевым поражением, составляет 8,5 на 100 000 населения и превышает таковую при травме позвоночника (3-5 на 100 000) [27]. У 2,5% больных, умирающих ежегодно от злокачественных новообразований, имеется клиника компрессии спинного мозга или его элементов [28]. 1.2 Классификации переломов позвонков и шкалы оценки нестабильности позвоночного столба Первые попытки разработать классификацию патологических переломов позвонков были предприняты более 80 лет назад, что стало возможно только с появлением рентгенографии. Основная трудность в создании исчерпывающей классификации заключалась в том, что, в отличие от переломов длинных трубчатых костей, поражение позвоночника имеет тенденцию прогрессировать, приводя к нарастанию деформации. Bohler в 1929 году выделил 5 типов повреждений: позвонка, флексионно- повреждения, повреждения вызванные напряжением сдвига, торсионные повреждения [29]. Дальнейшие дистракционные попытки компрессионный повреждения, классификации были перелом тела экстензионные направлены на оценку нестабильности позвоночного столба. Так возникла концепция двух колонн, предложенная Holdsword [30], согласно которой к передней колонне относятся тело позвонка и межпозвонковые диски, вторая же именовалась «задним лигаментозным комплексом». По его теории именно рентгенологическая оценка состояния задней колонны определяла стабильность или нестабильность позвоночного столба. Активное развитие компьютерной томографии и ее применение при переломах позвонков, начиная со второй половины 1970-х годов, привело к новым взглядам 13 на данные повреждения. Возможность получения изображения позвоночника в аксиальной проекции позволила выявлять сужение позвоночного канала костными отломками, в тех случаях, когда при стандартной рентгенографии он представлялся неизмененным. Использование КТ привело к пересмотру ранее созданной классификации, и в 1980-ых годах Denis разработал концепцию 3-х колонн [31]. Он выделил 4 типа переломов: компрессионные (компрессия передней колонны, средняя интактна), взрывные переломы (переломы передней и средней колонн под действием аксиальной нагрузки), переломы от ремня безопасности (повреждение средней и задней колонн под действием сгибания или растяжения), переломовывихи (повреждение всех трех колонн под действием компрессии, растяжения, ротации или сдвига). Denis выделил следующие степени нестабильности повреждения: I степень – механическая нестабильность с высоким риском прогрессирующего кифоза; II степень – неврологическая нестабильность, III – механическая и неврологическая нестабильность (переломовывихи и взрывные переломы). Данная классификация не оценивала состояние внекостных структур позвоночного столба и сводилась к тому, что повреждение 2 или 3 колонн приводило к нестабильности. Тем не менее, несмотря на множество недостатков, данная концепция оставалась доминирующей на протяжении 20 лет. Следующая классификация - классификация Ассоциации Ортопедов (АО) является результатом 10-летней работы, которая заключалась в анализе 1445 случаев переломов позвонков [32]. Данная классификация основана на патоморфологических характеристиках повреждений и механической модели подъемного крана. Таким образом, исходя из направления силы воздействия выделено три основных типа повреждения: тип А – компрессия тела позвонка, тип В – повреждение передних и задних элементов за счет растяжения, тип С – повреждение передних и задних элементов за счет ротации и поступательного движения. Более детальная морфологическая оценка относит каждое конкретное 14 повреждение в группу и далее в подгруппу, что позволяет классифицировать практически любой перелом. Стоит отметить, что данная классификация предназначена для оценки повреждений с уровня Th1 по L5. Повреждения шейных позвонков по ней не классифицируются. Исходя из выделенных типов переломов, можно сделать вывод, что данная классификация нацелена преимущественно на оценку травматических переломов. Деформациям другой этиологии уделено мало внимания. Существует более упрощенная классификация переломов, которая охватывает повреждения тел позвонков при интактном заднем комплексе и оценивает только вид деформации. В нее включены: передняя, задняя, боковая клиновидная деформации (высота одного из краев ниже противоположного), двояковогнутая деформация или «рыбий позвонок» (высота центральной части снижена по сравнению с краевыми отделами), уплощение или «crush» - деформация (равномерное снижение высоты всех отделов тела позвонка). Возможно сочетание каких-либо вышеперечисленных видов деформаций. Значительное снижение высоты тела позвонка именуется «vertebrae plana». В норме высота задних отделов каждого нижележащего позвонка больше предыдущего на 1-3 мм, и снижение высоты более 4 мм по сравнению со смежным позвонков считается переломом [33,34]. Genant с соавторами была предложена еще одна классификация патологических деформаций, которая оценивает степень снижения высоты тел Th4-L4 позвонков по сравнению со смежными уровнями [35]. Согласно ей выделяют 4 степени: Степень 0 – перелома нет Степень 1 – «слабый» перелом (снижение высота тела на 20-25% по сравнению со смежным неизмененным позвонком) Степень 2 – «средний» перелом (снижение высоты тела на 25-40% по сравнению со смежным неизмененным позвонком) 15 Степень 3 – «тяжелый» перелом (снижение высоты тела более 40% по сравнению со смежным неизмененным позвонком). Рис 1 Классификация переломов по Genant et al. «Спинальный индекс переломов» рассчитывается как отношение суммы всех степеней деформаций тел позвонков к общему количеству выявленных деформаций. Данный индекс признан более достоверным, чем стандартное морфометрическое занимающимися исследование, остеопорозом. и широко Необходимо используется отметить, что клиницистами, и в данной классификации повреждения шейных позвонков не учитываются. Вероятнее всего это связано с ориентированием данной системы на оценку «остеопорозных» переломов, возникающих преимущественно в грудном и поясничном отделах позвоночника. Ни одна из вышеприведенных классификаций не характеризует особенности патологических переломов позвонков при опухолевой патологии. В 2010 году международным коллективом авторов (SOSG – Spine Oncology Study Group) предложена система оценки нестабильности для решения вопроса о хирургическом лечении при неопластическом поражении позвоночника [36]. По результатам данного исследования выделено 6 наиболее значимых критериев, 16 влияющих на стабильность позвоночного столба. Каждый критерий имеет 3-4 градации с соответствующим балльным значением. SINS (Spinal Instability Neoplastic Score) 1. Локализация Переходный отдел (затылок – С2, С7-Th2, Th11-L2, L5-S1) 3 Подвижный отдел (С3-С6, L2-L4) 2 Полуригидный (Th3-Th10) 1 Ригидный (S2-S5) 0 2. Облегчение боли в покое и/или возникновение боли при движении Да 3 Нет (периодическая боль, не связанная с движением) 1 Безболевое повреждение 0 3. Тип деструкции костной структуры Литический 2 Смешанный 1 Пластический 0 4. Рентгенологическое нарушение статики Подвывих/смещение 4 Вновь сформированный кифоз/сколиоз 2 Нет нарушения статики 0 5. Снижение высоты тела позвонка Более 50% 3 Менее 50% 2 Поражение более 50% тела позвонка без снижения высоты 1 Ни одно из вышеперечисленных 0 6. Повреждение заднего комплекса позвонка Двустороннее 3 Одностороннее 1 17 Интактный задний комплекс 0 Итог рассчитывается как сумма баллов для всех 6 критериев: 0-6 баллов - стабильное повреждение 7-12 баллов – повреждение промежуточной стабильности 13- 18 баллов – нестабильное повреждение Несмотря на то, что 5 из 6 критериев определяются рентгенологически, данная шкала предназначена исключительно для решения вопроса о необходимости хирургической стабилизации у больных с опухолевым поражением позвоночника. 1.3 Патофизиологические основы метастазов в костях В норме костная ткань подвергается постоянному ремоделированию в ответ на механическую нагрузку, путем динамического взаимодействия остеобластов, ответственных за продукцию костной ткани, и остеокластов, ответственных за ее резорбцию. Остеокласты происходят из моноцитарно-макрофагальных клетокпредшественниц, которые дифференцируются в неактивные остеокласты. Активация и функционирование остеокластов осуществляется под действием как местно продуцируемых цитокинов, так и системных гормонов. Костное микроокружение играет основную роль в образовании активных остеокластов за счет продукции преимущественно стромальными клетками макрофагального колониестимулирующего фактора (M-CSF) и лиганда рецепторного белка RANK (receptor activator of nuclear factor-κβ) – RANK-L. RANK-L относится к семейству туморонекротических факторов, который экспрессирован на поверхности остеобластов и стромальных клеток. Большинство остеотропных факторов, таких как паратиреоид-подобный пептид (ПТПГ), 1,25-дигидроксивитамин D3 и простагландины, индуцируют образование и дальнейшую активацию остеокластов именно путем повышения экспрессии RANK-L на поверхности костномозговых стромальных клеток, а не за счет прямого стимулирующего влияния на клетки-предшественницы остеокластов. RANK-L связывается с RANK 18 на поверхности клетки-предшественницы остеокласта и стимулирует ее превращение в активный остеокласт. В противовес деструктивному влиянию комплекса RANK/RANK-L действует остеопротегерин (osteoprotegerin, OPG), продуцируемый остеобластами, а также другими клетками в сердечной мышце, почках, печени и селезенке. Связываясь с RANK-L, OPG подавляет образование и функциональную активность остеокластов, препятствуя, таким образом, резорбции кости. Соотношение RANK-L и OPG регулирует образование и активность остеокластов [37] Метастазирование в кости начинается с отделения опухолевых клеток от первичного узла и их попадания в системный кровоток через вновь сформированные патологические сосуды. Эти опухолевые клетки формируют конгломераты и в конечном итоге прикрепляются к клеткам сосудистого эндотелия костных капилляров. В дальнейшем они покидают сосудистое русло, оседают на эндостальной поверхности кости на границе с костным мозгом и начинают пролиферировать. Помимо имеющихся различных факторов роста в костном матриксе, часть факторов роста и цитокинов высвобождается из костного мозга [38]. Это благоприятное микроокружение способствует быстрому росту опухолевых клеток и колонизации ими костного матрикса. Остеолитические очаги являются в большей степени результатом деятельности остеокластов, чем самих опухолевых клеток. Таким образом, при развитии метастазов в костях запускается замкнутый круг, при котором опухолевые клетки выделяют факторы роста, основным из которых является ПТПГ. Его продукция стимулирует выработку M-CSF и RANKL остеобластами. Под воздействием M-CSF и RANKL активизируется созревание, дифференцировка и активность остеокластов, что приводит к усилению резорбции кости. В процессе разрушения костного матрикса высвобождается ряд факторов роста, которые вновь стимулируют рост опухолевых клеток, и цикл начинается заново. 19 1.4 Методы лучевой диагностики Активное применение методов визуализации переломов позвонков началось с появлением рентгенографии еще в 1929 году. Это было обусловлено в первую очередь необходимостью выбора тактики лечения. При этом кандидатами на хирургическое лечение рассматривались преимущественно пациенты с травматическим характером переломов. Больные с патологическими переломами на фоне опухолевого поражения позвоночника или остеопороза в большинстве своем считались бесперспективными из-за отсутствия эффективных методов лечения. В этот период проблемам дифференциальной диагностики патологических переломов позвонков уделялось недостаточно внимания. С развитием как хирургических, так и консервативных методов лечения онкологических заболеваний и появлением возможности продления жизни пациентов даже с IV стадией болезни, возросла необходимость в дифференциальной диагностике патологических переломов позвонков. Основным толчком к этому послужило появление магнитно-резонансной томографии и ее активное освоение для решения различных диагностических задач. Первые работы, посвященные дифференциальной диагностике патологических переломов позвонков, опубликованы, преимущественно, в конце 80-ых годов [39]. Бесспорно, «золотым стандартом» для выбора метода лечения онкологического заболевания является морфологическое подтверждение диагноза, и в настоящее время разработано множество методик получения гистологического материала. Однако с помощью методов лучевой диагностики можно не только предположить злокачественный или доброкачественный характер перелома, но и высказаться о типе опухоли. Это позволяет клиницисту оптимизировать план обследования пациента для ускорения постановки правильного диагноза и начала лечения. Основным недостатком патоморфологического исследования, особенно при биопсии костной ткани, является длительность его проведения, и у больных с патологическими переломами позвонков и компрессией спинного мозга 20 приходится начинать лечение без морфологической верификации диагноза. В ряде случаев методы лучевой диагностики позволяют отказаться от выполнения трепанбиопсии позвонка в пользу динамического наблюдения. С учетом вышесказанного методы лучевой диагностики приобретают высокую значимость для определения этиологии патологического перелома. Лучевая диагностика с использованием таких методов как рентгенография, рентгеновская компьютерная томография, магнитно-резонансная томография с применением контрастного усиления и других дополнительных методик может отражать структуру опухоли, костного мозга и их васкуляризацию, изменения структуры кости. Методы ядерной медицины, такие как планарная остеосцинтиграфия и позитронно-эмиссионная томография, помимо васкуляризации, позволяют оценивать еще и метаболические процессы в пораженном позвонке. 1.4.1 Рентгенография Рентгенография была первым методом лучевой диагностики, с помощью которого выявляли патологические переломы позвонков. Именно на основании данных рентгенологического метода формировались и развивались первые классификации переломов позвонков. С учетом современных требований информативность этого метода для дифференциальной диагностики патологических переломов позвонков существенно ограничена. Очаг литической деструкции может быть выявлен при рентгенологическом исследовании, если его размер более 1 см в диаметре, а плотность костной ткани в указанном очаге снижена не менее, чем на 50%. В связи с этим ложноотрицательные результаты наблюдаются в 40% случаев [40]. Риск развития патологического перелома возникает при поражении 50% и более тела позвонка [41]. Наличие перелома еще больше затрудняет выявление «истинной» костной деструкции. Поскольку рентгенологический метод не во всех случаях способен четко определить перестройку костной структуры, были выработаны косвенные признаки 21 «злокачественного» перелома. Локализация перелома выше Th7 позвонка в большей степени свидетельствует об опухолевом характере перелома [42]. Ряд других авторов считает уровень патологического перелома ненадежным критерием его этиологии [43]. Другим признаком злокачественного характера перелома является тип деформации позвонка. Считается, что для «опухолевого» перелома характерна задняя клиновидная деформация, в то время как для «остеопорозного» - передняя клиновидная или деформация по типу «рыбьего» позвонка [42]. Еще один симптом, предполагающий доброкачественную этиологию перелома, предложен Maldague с соавторами в 1978 году [44]. Он характеризуется скоплением («внутрипозвонковый газа внутри вакуум-симптом») и тела поломанного коррелирует с позвонка ишемическими нарушениями, которые препятствуют репаративным процессам. В 1986 году группой авторов проведена работа, в которой проанализированы данные рентгенографии 99 аутопсийных позвоночных столбов, в которых имелись позвонки с патологическими переломами. Из них 69 были с переломами остеопорозного характера злокачественным исследования и поражением выявлено, что 30 с гистологически позвоночника. основным По подтвержденным результатам данного дифференциально-диагностическим критерием этиологии перелома являлся вид деформации замыкательных пластин тел позвонков. Для «остеопорозных» переломов характерен диффузно-вогнутый вид деформации как верхней, так и нижней замыкательной пластин. Это обусловлено равномерным снижением минеральной плотности костной ткани всего позвонка и распределением осевой нагрузки. Для переломов на фоне опухолевого поражения характерен как диффузно-, так и фокально-угловой вид деформации замыкательных пластин. Такой вид деформации, вероятнее всего, связан с локальным субхондральным обеднением костной ткани за счет метастатического поражения. Как отмечают сами авторы, проведенное исследование имело ряд недостатков, связанных с анализом рентгенологического 22 исследования трупных позвоночных столбов, которое не в полной мере соответствует данным, получаемым в повседневной клинической практике [43]. Ряд опухолевых процессов, например миелома, могут сопровождаться остеопорозом, а некоторые виды противоопухолевого лечения (гормонотерапия) способны приводить к его развитию. В связи с этим метод рентгеновской абсорбциометрии, активно используемый для определения степени остеопороза, нельзя считать пригодным для дифференциальной диагностики патологических переломов позвонков. Он отражает только снижение минеральной плотности костной ткани у конкретного пациента по сравнению с его возрастной группой, но не позволяет выявить причину этого процесса. Таким образом, стандартную рентгенографию следует в большей степени рассматривать как метод скрининга для выявления переломов позвонков с последующей уточняющей диагностикой с помощью более информативных методов исследования. 1.4.2 Рентгеновская компьютерная томография Диагностические возможности рентгеновской компьютерной томографии (РКТ) значительно превосходят стандартную рентгенографию в первую очередь за счет отсутствия суммации изображения. Как показывали сравнительные исследования, рентгенография чаще ошибочно выявляет разрушение коркового слоя передней, задней стенок и ножек позвонка, чем компьютерная томография (73%, 67%, 85% против 15%, 46%, 15% соответственно). Авторы связывают полученные при рентгенографии результаты с ошибочной интерпретацией костных отломков как проявление костной деструкции, в то время как при КТисследовании оба данных признака четко дифференцируются между собой [45]. По данным Laredo et al. нарушение структуры губчатой кости тел позвонков выявляется с помощью РКТ при «доброкачественных» переломах в 29% случаев и является менее характерным симптомом злокачественности, чем разрушение 23 кортикального слоя [46]. В исследовании Sattari et al. частота деструкции губчатой кости при «остеопорозных» переломах достигает 100% [45]. Наличие внекостного компонента считается характерным признаком опухолевого поражения кости. Однако, Laredo отмечает, что наличие паравертебрального внекостного компонента не является абсолютным симптомом злокачественности процесса и может наблюдаться при «доброкачественных» переломах, однако в этом случае его толщина не должна превышать 1 см [46]. В подтверждение этим результатам, Sattari с соавторами приводят данные о частоте встречаемости внекостного компонента при «остеопорозных» переломах, распространяющегося преимущественно внутриканально, в 23% случаев [45]. Другими важными критериями доброкачественности процесса являются линии перелома как губчатой, так и кортикальной кости, а так же смещение костных отломков в позвоночный канал [45,46]. Также как при стандартной рентгенографии, «внутрипозвонковый вакуум-симптом» в большей степени свидетельствует о доброкачественном характере перелома с развитием остеонекроза тела поломанного позвонка [47]. Проведение РКТ только в аксиальной проекции без выполнения мультипланарных реконструкций имеет ряд ограничений для выявления переломов позвонков [48,49]. По данным Chan с соавторами [50] последующая мультипланарная реконструкция позволяет выявить переломы позвонков, не диагностированные при аксиальной РКТ грудной и брюшной полостей, в 45% случаев. При этом компьютерная томография не всегда способна ответить на вопрос об этиологии перелома, так как не отражает состояние костного мозга. Подобные сложности могут возникнуть в случае сочетанных процессов, например, таких как диффузно-поротическая форма миеломной болезни, при которой остеопороз обусловлен самим опухолевым процессом. 24 1.4.3 Магнитно-резонансная томография, методика магнитно-резонансной томографии с динамическим контрастированием, методика диффузионновзвешенной магнитно-резонансной томографии Возможности определения этиологии патологических переломов позвонков существенно расширились с появлением в арсенале лучевых диагностов магнитно-резонансной томографии. Активное ее освоение шло параллельно с развитием хирургического и консервативного методов лечения, позволяющих повысить выживаемость больных с опухолевым поражением позвонков. В 1989 году Yuh W. et al. представили первые данные об информативности МРТ для дифференциальной диагностики патологических переломов позвонков [39]. Авторы выделили три категории изменения МР-сигнала в Т1ВИ. Они отметили, что для «остеопорозных» переломов характерно либо отсутствие изменения сигнала, либо неполное замещение нормального МР-сигнала тела позвонка пониженным с четкими ровными контурами. При травматических переломах могут встречаться как две вышеописанные категории изменения сигнала, так и тотальное замещение нормального МР-сигнала костного мозга пониженным в Т1 ВИ. Что касается переломов на фоне метастатического поражения, то в их случае отмечается тотальное замещение нормального МРсигнала костного мозга тела позвонка пониженным в Т1 ВИ. При этом точность МРТ в дифференциальной диагностике «доброкачественных» и «метастатических» переломов достигала 94%. Сложности возникали в случаях травматических переломов с тотальным замещением нормального МР-сигнала костного мозга тела поломанного позвонка пониженным в Т1 ВИ. Авторы исследования не смогли найти объяснения отграниченному понижению МРсигнала в Т1 ВИ при «доброкачественных» переломах. Также к критериям злокачественности перелома авторы отнесли наличие метастазов в других позвонках и вовлечение заднего комплекса в патологических процесс. По мнению авторов паравертебральные массы не являлись убедительным признаком 25 злокачественности. При злокачественных переломах не встречались формирование костных отломков тела позвонка и вовлечение межпозвонкового диска, которые характерны для доброкачественных переломов. В 1990 году группа исследователей во главе с Baker LL впервые проанализировала возможности режима подавления сигнала от жировой ткани STIR (short time inversion recovery) для дифференциальной диагностики патологических переломов позвонков [51]. Авторы отметили важность данного протокола исследования не только для дифференциальной диагностики этиологии перелома, но и для определения его давности. В течение последующего десятилетия параллельно с развитием технической базы МРТ разрабатывались и систематизировались признаки дифференциальной диагностики переломов позвонков. Обобщая полученные данные, можно выделить следующие характеристики: «Доброкачественный перелом» Характер изменения МР-сигнала зависит от давности перелома. При «свежем» переломе линейная зона пониженного МР-сигнала в Т1 ВИ, смежная с поломанной замыкательной пластиной [52, 53]. (Рис 2) Фокальное Диффузное Рис 2. Схематическое изображение различных форм изменения МР-сигнала в Т1 ВИ при «доброкачественных» переломах В Т2 ВИ при «свежем» переломе позвонок, изоинтенсивен прилежащему неизмененному позвонку [52]. Может определяться линия перелома [54]. как правило, 26 При постконтрастном Т1 ВИ отмечается контрастирование тела поломанного позвонка, таким образом, что он становится изоинтенсивным смежному неизмененному позвонку – симптом «возвращения к нормальной интенсивности» [52]. Внутрипозвонковый вакуум-симптом и внутрипозвонковое скопление жидкости – признаки остеонекроза тела позвонка, развитие которого коррелирует со степенью снижения его высоты. [55,56]. Смещение костных отломков в позвоночный канал – компонента и чувствительность - 100%, специфичность – 16% [52]. Отсутствие паравертебрального внекостного вовлечения в процесс заднего комплекса. При «старом» переломе МР-сигнал костного мозга не изменен [39,51,57]. «Злокачественный перелом» Полное замещение нормального МР-сигнала костного мозга диффузно пониженным МР-сигналом в Т1 ВИ в 77-88% случаев [39,52,53,57,58]. Отмечается негомогенное повышенное накопление контрастного вещества в пораженной зоне, особенно в режимах с подавлением сигнала от жировой ткани [52,59]. Наличие внекостного компонента – чувствительность - 80%, специфичность - 100% [52]. Выпуклая задняя стенка тела позвонка – чувствительность – 70%, специфичность – 100% [52]. Вовлечение в процесс ножек позвонка – чувствительность – 80%, специфичность – 94% [52]. Множественность патологических переломов не всегда свидетельствует о характере перелома, так как у одного пациента могут встречаться как 27 доброкачественные, так и злокачественные переломы. По данным Токарь Т.Ю. [60] чувствительность и специфичность МРТ с использованием вышеописанных признаков составляла 97% и 94% соответственно. Несмотря на то, что стандартная магнитно-резонансная томография позволяет определять этиологию перелома в большинстве случаев, диагностические ошибки, отмеченные многими авторами, возникали при острых и подострых переломах с тотальным замещением нормального МР-сигнала костного мозга пониженным в Т1 ВИ [61, 62] и повышенным в Т2 ВИ с подавлением сигнала от жировой ткани. Это подвигло исследователей на поиск дополнительных путей уточняющей диагностики. Такой методикой стала магнитно-резонансная томография с динамическим контрастированием (МРТ-ДК). Данная методика позволяет оценить характер васкуляризации в различных участках опухоли, что коррелирует с наличием «живой» опухолевой ткани при патоморфологическом исследовании [63, 64]. МРТ-ДК предусматривает применение быстрых и ультрабыстрых протоколов непосредственно после болюсного внутривенного введения контрастного вещества (КВ). Это дает возможность оценить его первичное распределение в сосудистом русле и в межклеточном пространстве. В физиологических основах динамического контрастирования лежит характер кровоснабжения опухоли, количество и проницаемость стенки капилляров, а также объем и состав межклеточного пространства [65]. В динамике обмена КВ между сосудами и тканью опухоли условно выделяют несколько фаз, которые можно представить в виде «кривой» накопления/выведения КВ на графике, где ось Х отражает время исследования, а ось Y – интенсивность получаемого сигнала. С помощью подобных графических кривых можно оценить интенсивность контрастирования по времени не только самой опухоли и различных ее участков, но и любых других тканей (мышечной, костной и т.п.) в зоне исследования. Особый интерес представляет анализ быстро и интенсивно контрастируемых участков опухоли по сравнению с магистральной артерией. При введении КВ в 28 сосудистое русло и его диффузии через сосудистую стенку в межклеточное пространство («перфузионная» фаза) форма кривых зависит от степени васкуляризации ткани, а так же от структурных особенностей капилляров. Раннее и интенсивное контрастирование будет отмечаться в тканях с более выраженной васкуляризацией и высокой проницаемостью капилляров. В данную фазу в нормальных тканях из капилляров в межклеточное пространство в среднем на единицу объема перераспределяется до 50% контрастного препарата, в то время как в опухолевой ткани аналогичного объема этот показатель выше и может приближаться к 100% [66]. Подобная интенсивность обмена связана, прежде всего, с высокой степенью васкуляризации опухоли, и в меньшей степени с повышенной проницаемостью сосудов [64]. При построении графика накопления/выведения КВ этот процесс отображается быстрым прогрессивным подъемом «кривой» с достижением пика, где наклон или «крутизна кривой» отражает скорость накопления КВ. Чем больше объем интерстициального пространства, тем дольше будет продолжаться диффузия КВ, что так же отражается на «крутизне» кривой и на максимальном уровне накопления. В дальнейшем концентрация КВ сначала выравнивается во внутрисосудистом и в интерстициальном пространствах (фаза «равенства»), а затем начинается его возвращение в сосудистое русло (фаза «вымывания»). Графически фаза «равенства» отображается в виде появления «плато», либо в виде постепенного дальнейшего накопления контрастного вещества [67]. В фазах «равенства» и «вымывания» на форму кривой влияют объем и состав межклеточного пространства. Короткие фазы «перфузии» и «равенства» с быстрым наступлением фазы «вымывания» характерны для высоко васкуляризованных тканей с повышенной проницаемостью сосудов, а также с малым объемом межклеточного пространства. Впервые в клинической практике эту методику применил Erlemann et al. в 1989 году [70]. Он выявил, что зоны неопухолевой ткани в процессе динамического исследования контрастируются значительно медленнее и менее интенсивно, чем 29 высоковаскуляризованная опухолевая ткань. Критерием оценки стала «крутизна» кривой при первичном распределении КВ. В 1995-2000 годах группа исследователей во главе с Van der Woude [68, 69, 7172] стали применять ультрабыстрые протоколы при проведении МРТ-ДК. Ими была разработана методика качественного и количественного анализа получаемых данных. Исследователи разделили процесс накопления и выведения КВ опухолью на три последовательные фазы: фазу первого «прохождения» (washin), фазу «равенства» или «эквилибриума» (equilibration) и фазу «вымывания» (wash-out). При сопоставлении данных МРТ-ДК и гистотопографических срезов было выявлено, что «живая» опухолевая ткань начинает контрастироваться в пределах 3-6 секунд (не позднее 6 секунды) от начала появления КВ в рядом расположенной магистральной артерии. Благодаря этому критерию можно дифференцировать «живую» опухолевую ткань от грануляционной ткани, зон отека, некроза и кровоизлияний. Данная методика, а также выявленные критерии, характеризующие опухолевую ткань, впоследствии стали широко использоваться в диагностике и оценке эффекта лечения не только первичных костных опухолей, но и сарком мягких тканей [64,65,73-77]. Применение МРТ-ДК при опухолевом поражении позвоночника несколько запоздало. В первую очередь это объясняется невозможностью провести адекватное гистотопографическое исследование выявленных патологических процессов в позвоночнике. Другая причина, ограничивающая использование данной методики, заключается в структурных особенностях костной ткани в зависимости от пола и возраста. Позвоночник является одной из основных локализаций костного мозга. Он в большей степени, чем остальные кости подвержен возрастным изменениям за счет осевой нагрузки, и атеросклероз и другие возраст-ассоциированные факторы влияют на перфузию костного мозга, следовательно и на ремоделирование костной ткани. В своем исследовании Chen с соавторами показал достоверное снижение перфузии костного мозга нижнегрудных и поясничных позвонков на 62,4 % у людей старше 50 лет. При 30 этом еще более значима зависимость снижения перфузии от пола: у мужчин старше 50% лет – 33,5%, у женщин старше 50 лет – 79,4% [78]. Savvopoulou et al. выявили влияние на перфузию костного мозга не только возраста и пола, но и уровня сегмента позвоночника [79]. Чем выше уровень зоны интереса, тем выше параметры перфузии. Shih et al. отметили уменьшение перфузионных параметров по мере снижения минеральной плотности костной ткани [80]. Учитывая множество факторов, влияющих на перфузию костного мозга, правильная оценка патологических изменений в позвоночнике существенно усложняется. Впервые попытку дифференциальной диагностики патологических переломов позвонков с помощью МРТ-ДК предпринял Chen с соавторами в 2002 году, однако его результаты были неоднозначны и основывались преимущественно на типе кривой накопления/выведения КВ [81]. В 2005 году группой авторов во главе с Tokuda проведен анализ 34 пациентов с 48 патологическими переломами позвонков. В отличие от результатов Chen, выявлены достоверные различия в количественных значениях перфузионных параметров (максимального накопления и «крутизны» кривой) между «остеопорозным» и «опухолевым» переломами, в то время как графический тип кривой оказался не достаточно специфичен [82]. Противоречивость данных Chen и Tokuda может быть связана с различной «давностью» переломов позвонков в этих исследованиях. Важным аспектом применения МРТ-ДК является возможность прогнозирования развития и дальнейшего течения переломов позвонков. В 2002 году Scherer с соавторами были представлены данные о способности МРТ-ДК выявлять позвонки с высоким риском компрессии при миеломной болезни [83]. Чем выше интенсивность накопления КВ, тем выше риск перелома. Как предполагают исследователи, это обусловлено прямой зависимостью между степенью васкуляризации опухоли и активной продукцией остеокласт- индуцирующих факторов патологическими плазматическими клетками. В работе Kanchiku et al. представлены данные о возможности предсказывать дальнейшее снижение высоты тела компримированного позвонка при остеопорозе. В этом 31 случае наоборот, чем больше площадь слабо или неваскуляризированного участка, тем выше риск дальнейшей компрессии тела позвонка [84]. Поскольку при опухолевом поражении позвоночника нередко отсутствует возможность проведения полноценного морфологического исследования, возрастает актуальность адекватной оценки эффективности проведенного лечения методами лучевой диагностики. В связи с этим МРТ-ДК приобретает еще большую значимость, особенно при опухолях гематологической природы, где основным критерием является состояние кроветворного костного мозга. В период с 2002 по 2010 года [85-88] проведены ряд исследований, выявивших достоверное снижение параметров перфузии костного мозга при ответе на лечение. Таким образом, за последние пятнадцать лет множество исследований доказали эффективность МРТ-ДК для решения различных диагностических задач. Преимущество этой методики заключается в том, что она позволяет одновременно оценивать структурные и функциональные изменения в опухоли, используя как качественные, так и количественные параметры. На сегодняшний день это одна из самых эффективной методик в определении «живой» опухолевой ткани. Другой многообещающей методикой в дифференциальной диагностике патологических переломов позвонков по данным литературы является диффузионно-взвешенная МРТ (ДВ-МРТ). Физические принципы данной методики были описаны в 1965 году Е.О. Stejskal и J.E. Tanner [89]. Они основаны на регистрации изменения характера броуновского движения молекул воды при различных патологических процессах. Регистрируемый МР-сигнал при проведении ДВ-МРТ формируется из движения молекул воды во внеклеточном, внутриклеточном и внутрисосудистом пространствах [90]. ДВ-МРТ позволяет косвенно судить о выраженности клеточного компонента ткани и целостности клеточных мембран, поскольку было выявлено, что ограниченная диффузия свойственна опухолевой ткани с высокой клеточностью, ограничивающей движение молекул воды [91, 92]. Первоначально ДВ-МРТ применялась для 32 диагностики ишемических нарушений головного мозга, однако впоследствии данная методика нашла свое применение и при патологии опухолей опорнодвигательного аппарата. Причем основной целью являлось выявление зон некроза для оценки эффективности проведенного лечения [92-97]. Степень диффузии молекул воды определяется параметром b (b value), который зависит от длительности и амплитуды диффузионных градиентов, а также временными промежутками между этими градиентами. Единицей измерения b является с/мм2. Чем выше клеточность ткани, тем на более высоких значениях параметра b продолжает регистрироваться повышенный МР-сигнал. Для более адекватной характеристики диффузионного движения молекул воды и для количественного анализа ДВ-МРТ строятся карты истинного коэффициента диффузии (ИКД, apparent diffusion coefficient – ADC). Данный параметр представляет собой градиент кривой, которая строится при сопоставлении значений параметра b по оси Х и логарифма относительной интенсивности сигнала ткани по оси У. Современное программное обеспечение позволяет определить значение ИКД автоматически, обведя на ИКД-карте область интереса. Для построения ИКД-карт требуется как минимум два показателя параметра b. Поскольку ИКД-карты отражают изменение интенсивности сигнала тканей при различных параметрах b, то чем выше клеточность ткани тем ниже ИДК, и наоборот. О роли этой методики в дифференциальной диагностике патологических переломов позвонков в литературе представлены достаточно противоречивые сведения. В 1998 и 2001 годах Baur et al. продемонстрировал первые данные о возможности определения этиологии переломов позвонков с помощью ДВ-МРТ [98,99] Однако, в то же время были опубликованы результаты исследования, в котором авторы не выявили значимого преимущества данной методики перед стандартной МРТ [100]. Другие исследователи отмечают, что при доброкачественных переломах ИКД имеет высокие значения, что позволяет дифференцировать их от злокачественных [101-103]. В противовес этим результатам, Maeda et al. в своей работе высказал сомнения в возможности 33 дифференциальной диагностики патологических переломов позвонков, даже с помощью количественной обработки полученных данных [104]. На сегодняшний день не существует однозначного мнения о роли данной методики в дифференциальной диагностике патологических переломов позвонков и ее преимуществе перед стандартной МРТ. 1.4.4 Методы ядерной медицины Планарная остеосцинтиграфия (ОСГ) является признанным методом скрининга метастазов в кости [105], что обусловлено его относительной дешевизной и широкой доступностью. В основе метода лежит включение тропного к костной ткани РФП в минеральный обмен с последующей регистрацией его распределения и накопления в скелете за счет гамма-излучения изотопа, входящего в состав препарата. Несмотря на высокую (95%) чувствительность ОСГ, позволяющую выявлять изменения в минеральном обмене, специфичность метода составляет всего 40% [106]. Это связано с тем, что повышение активности остеобластов может быть вызвано не только метастатическим поражением, но и травмой, воспалительным процессом или грубыми дистрофическими изменениями. В литературе представлены крайне скудные сведения о роли ОСГ в дифференциальной диагностике патологических переломов позвонков. Ряд авторов высказывались о возможности выявления «остеопорозных» переломов, а также определения их давности с помощью с ОСГ с 99m Тс-MDP [107-110]. В дальнейшем стали проводить исследования других РФП для дифференциальной диагностики патологических переломов позвонков. Так, Buyukdereli G et al. в 2006 году представил результаты сравнительного анализа 99mТс-MDP и показал, что при использовании 99m Тс-MIBI. Он 99m Тс-MDP определялась его аккумуляция в 92% травматических переломов и 100% метастатических очагов, в то время как 99m Тс- MIBI не накапливался в позвонках с травматическими переломами, но избирательно аккумулировался в 73% метастазов [111]. Применение 201 Т1- 34 хлорида не давало преимуществ в дифференциальной диагностике патологических переломов позвонков из-за низкой чувствительности – 28,6% [112]. Более перспективным методом для дифференциальной диагностики доброкачественных и злокачественных переломов представляется однофотонная эмиссионная компьютерная томография (ОФЭКТ) и однофотонная эмиссионная компьютерная томография, совмещенная с компьютерной томографией (ОФЭКТ/КТ). Анализ, проведенный Tokuda et al., не выявил достоверных различий в значениях чувствительности (85%) и специфичности (58%) ОФЭКТ и МРТ в дифференциальной диагностике патологических переломов позвонков в тех случаях, когда отмечалось полное замещение нормального МР-сигнала костного мозга патологическим [113]. В настоящее время большой интерес вызывает метод позитронно-эмиссионной томографии (ПЭТ). Он основан на использовании различных агентов (моносахаридов, жирных кислот, аминокислот, гормонов, антител, пептидов, и т.д.), меченных позитрон-излучающими радиоизотопами, тропных к тем или иным органам, системам или процессам. Наиболее широко для дифференциальной ПЭТ-диагностики доброкачественных и злокачественных опухолей в целом и опухолей опорно-двигательного аппарата в частности применяется 18F-фтордеоксиглюкоза (18F-ФДГ). Это связано с усиленным, в отличие от нормальных клеток, метаболизмом глюкозы пролиферирующими опухолевыми клетками [114]. Возможность дифференциальной диагностики этиологии переломов позвонков основывается на том предположении, что, в отличие от «опухолевых», доброкачественные переломы не будут значительно накапливать 18F-ФДГ [115-118]. Группа авторов во главе с Bredella определили значения стандартизированного уровня накопления (standardized uptake value – SUV) 18F-ФДГ для доброкачественных и злокачественных переломов: 3.99±1.52 – для злокачественных и 1.94±0.97 для доброкачественных. При этом 35 чувствительность и специфичность метода в данном исследовании составили 83% и 86%, соответственно [119]. Отдельно следует отметить методику ПЭТ/КТ в режиме исследования всего тела, которая представляет тандем двух методов: анатомо-топографического и функционального, что позволяет не только оценить метаболическую активность процесса, но и выявить структурные особенности патологических изменений. В литературе нами найдены лишь единичные работы, посвященные данной методике для дифференциальной диагностики патологических переломов позвонков. Так Cho et al. предлагает использовать данную методику только как уточняющую, в тех случаях, когда данных МРТ с контрастированием недостаточно для постановки правильного диагноза, поскольку диагностическая точность ПЭТ/КТ и МРТ сопоставимы между собой [120]. В заключение обзора литературы, следует отметить, что с развитием возможностей хирургического и терапевтического лечения опухолевого поражения позвоночника, возросла необходимость в своевременной и правильной дифференциальной диагностике патологических переломов позвонков, имеющих различную этиологию. Особое место занимают пациенты с уже подтвержденным онкологическим диагнозом, у которых необходимо исключить метастатическое поражение костной системы. Активное применение лучевой терапии, гормональной терапии в плане комплексного лечения таких больных может в свою очередь приводить к развитию вторичного остеопороза и, как следствие, патологическим переломам на его фоне. В связи с этим методы лучевой диагностики приобретают особую актуальность в решении вопроса о дальнейшей тактике лечения. Проведенный анализ данных литературы заставляет обратить внимание на ряд вопросов. Во-первых, очевидны недостаток работ, посвященных оценке информативности стандартной рентгенографии, компьютерной томографии в дифференциальной диагностике патологических переломов позвонков, и полное 36 отсутствие работ, изучающих с той же целью, возможности трехфазной остеосцинтиграфии. Во-вторых, следует отметить отсутствие общепризнанных алгоритмов и стандартов обследования при четких патологических переломах позвонков, как впервые обратившихся больных, так и больных с подтвержденным онкологическим диагнозом. В-третьих, встречаются лишь единичные статьи, в которых проводится сравнительный анализ возможностей различных методов лучевой диагностики и ядерной медицины для определения этиологии патологического перелома, в то время как большинство статей посвящены какому-либо одному методу. Наибольшее количество наблюдений приведено в статьях, посвященных методикам МРТ. Стандартная рентгенография представляет собой в большей степени скриннинговый метод, поскольку выявляемые ею основные критерии дифференциальной диагностики имеют чаще лишь косвенный характер. Для РКТ разработаны более четкие патологических переломов реконструкций эффективность дифференциально позвонков, их диагностические однако, выявления без признаки мультипланарных существенно снижается. В публикациях, посвященных методам ядерной медицины, превалируют данные об информативности ПЭТ, однако в сравнении с МРТ существенного преимущества этого метода не выявлено. Анализ информативности сцинтиграфии с использованием различных РФП не выявил решающей роли данного метода в дифференциальной диагностике переломов позвонков. Среди последних работ уделяется внимание позитронно-эмиссионной томографии, особенно совмещенной с РКТ (ПЭТ-РКТ). Однако в учетом небольшого количества проведенных исследований однозначно высказаться о преимуществах или недостатках данного метода в сравнении с вышеописанными на настоящий момент затруднительно. С появлением в клинической практике МРТ диагностические возможности определения этиологии переломов позвонков существенно возросли, разработаны четкие дифференциально-диагностические критерии, что в большинстве случаев 37 позволяет высказаться о характере перелома. Однако трудности возникают, если наличие этих критериев неоднозначно. Для выявления «живой» опухолевой ткани и оценки эффективности лечения различных опухолей в настоящее время разработана методика МРТ-ДК. Эта методика представляется перспективной для дифференциальной диагностики переломов позвонков, однако этому направлению посвящены лишь единичные работы и многие аспекты ее применения изучены недостаточно. Другой перспективной методикой является ДВ-МРТ, однако результаты исследований с ее использованием оказались весьма противоречивы. Следует отметить, что ни один из современных методов лучевой диагностики не способен во всех случаях правильно оценить этиологию патологических переломов позвонков. Для наиболее точной дифференциальной диагностики этиологии патологических переломов позвонков необходимо применять комплексный подход, сочетая методы лучевой диагностики и ядерной медицины. Бесспорным остается тот факт, что оценка характера патологического перелома на сегодняшний день остается актуальной и не до конца решенной задачей, требующей дальнейшего изучения. 38 Глава 2 ОБЩАЯ ХАРАКТЕРИСТИКА БОЛЬНЫХ, МЕТОДОВ ОБЛЕДОВАНИЯ И СТАТИСТИЧЕСКОГО АНАЛИЗА 2.1. Общая характеристика больных В базу данных были включены сведения о 87 больных, из которых 70 пациентов (80%) представлены проспективным материалом за 2011-2013 гг., и 17 пациентов (20%) ретроспективным с 2009-2010 гг. Все пациенты обследованы в отделе лучевой диагностики и интервенционной радиологии, а также в лаборатории радиоизотопной диагностики НИИ КО «РОНЦ им. Н.Н.Блохина» РАМН. Значительно преобладали пациенты женского пола в соотношении 2,1:1 их количество составило 59 пациентов, мужского пола–28 пациентов (Рис 3). РАСПРЕДЕЛЕНИЕ БОЛЬНЫХ ПО ПОЛУ 32% 68% Рис. 3. Распределение больных по полу. Мужчины Женщины 39 Возраст больных варьировал в пределах от 19 до 81 года. В изучаемой группе преобладали больные в возрасте 48-69 лет (Рис.2). Средний возраст составил 56 лет. Рис. 4. Распределение больных по возрасту. (По оси Х – возрастные группы, по оси Y – количество наблюдений). 40 В общей сложности у 87 больных выявлялось 154 позвонка с патологическими переломами. Наиболее часто переломы позвонков локализовались в грудном отделе позвоночника – 83 перелома (54%), затем следовали поясничный отдел – 62 перелома (40%), шейный отдел – 7 (5%), крестцовый отдел – 2 (1%). 23 перелома (15%) локализовались выше Th7 позвонка, 131 (85%) – c уровня Th7 позвонка и ниже. (Рис. 5). С-отдел 5% 15% Th-отдел 54% L-отдел 40% S-Co-отдел Th7 85% 1% Рис. 5. Распределение больных по локализации перелома в позвоночнике. По количеству переломов: у 54 (62%) больных определялось по одному позвонку с патологическим переломом, у 18 (21%) – по 2 позвонка, у 6 (7%) –по 3 позвонка, у 4 (5%) – по 4 позвонка, у 3 (3%) – по 6 позвонков, у 1 (1%) – 5 позвонков, у 1 (1%) – 7 позвонков. У 83 пациентов (95%) в анамнезе имелось онкологическое заболевание. Среди них у 32 (39%) больных – рак молочной железы, у 19 (23%) - гематологическое заболевание, у 17 (20 %) – группа редко поражающих костную систему опухолей (рак желудка – 3, саркома Юинга – 3, меланома кожи – 2, рак предстательной железы – 2, по одному пациенту с хордомой, раком шейки матки, раком сигмовидной кишки, раком легкого, раком яичника, герминогенной опухолью яичка и нейроэндокринной опухолью тонкой кишки), у 12 (14%) – рак почки, у 3 (4%) – гемангиомы позвонков, 4 (5%) пациента были без онкологического анамнеза. 41 У 38 (44%) пациентов причиной обследования был локальный болевой синдром на уровне перелома позвонка без признаков иррадиации (вертебралгии). У 48 (55%) больных – сочетание локальной болезненности поломанного позвонка с иррадиацией болевого синдрома по соответствующим дерматомам (радикулопатия). У одного пациента (1%) с неврологическим дефицитом болевой синдром не определялся. У 18 (21%) пациентов наблюдался разной степени выраженности неврологический дефицит. У 69 (79%) больных признаков неврологических нарушений не выявлено. У 24 (28%) больных в анамнезе имелась неадекватная травма (падение с высоты собственного роста, повышенная осевая нагрузка), у 63 (72%) пациентов анамнестических указаний на травму не выявлено. При этом из 83 пациентов с онкологическим анамнезом у 25 (30%) онкологическое заболевание манифестировало патологическим переломом. Из 87 больных 8 (9%) пациентам проводилась химиотерапия, 3 (4%) пациентам - лучевая терапия, 22 (25%) больным – комплексное лечение, 54 (62%) больным лечение не проводилось. 2.2. Нозологические формы С целью верификации диагноза 51 (59%) больному проведена трепанбиопсия позвонка или паравертебрального внекостного компонента. 36 (41%) пациентам диагноз подтвержден динамическим наблюдением в течение не менее 6 месяцев. При множественных переломах позвонков проведение биопсии каждого позвонка технически не представлялось возможным. В связи с этим 29 больным (из 33) с множественными переломами позвонков характер перелома, гистологически определяемый в одном позвонке, экстраполировался на остальные. У 4 пациентов по данным динамического наблюдения выявлялись множественные переломы как «опухолевого», так и «остеопорозного» характера. 42 По результатам проведенного гистологического исследования и динамического наблюдения самой частой причиной патологических переломов позвонков был остеопороз – 49 позвонков с патологическими переломами (32%). Затем следовали: метастазы рака молочной железы – 41 позвонок (27%), опухоли гематологической природы с поражением костной системы – 28 позвонков (18%), другие опухоли с поражением костной системы – 20 позвонков (13%), метастазы рака почки – 12 позвонков (7%), гемангиомы – 4 позвонка (3%). Среди опухолей гематологической природы выделялись следующие нозологические формы: миеломная болезнь – 13 позвонков (46%), В-крупноклеточная лимфома – 7 позвонков (25%), другие неходжкинские лимфомы – 6 позвонков (21%), острый лейкоз – 1 позвонок (4%), лимфома Ходжкина – 1 позвонок (4%). Среди других опухолей с поражением костной системы: метастазы рака желудка – 6 позвонков (30%), саркома Юинга – 3 позвонка (15%), метастазы рака предстательной железы, рака шейки матки, меланомы – по 2 позвонка в каждом случае (по 10%), хордома, метастазы нейроэндокринной опухоли тонкой кишки, рака легкого, рака сигмовидной кишки, герминогенной опухоли яичка – по 1 позвонку в каждом случае (по 5%). (Таблица 1.) 43 Таблица 1. Количество переломов позвонков с учетом их этиологии Диагноз Количество позвонков Остеопороз 49 (32%) Метастазы рака молочной железы 41 (27%) Опухоли гематологической природы: 28 (18%) - Миеломная болезнь 13 (46%) - В-клеточная лимфома 7 (25%) - Др. неходжкинские лимфомы 6 (21%) - Острый лейкоз 1 (4%) - Лимфома Ходжкина 1 (4%) Другие опухоли: 20 (13%) - Метастазы рака желудка 6 (30%) - Саркома Юинга 3 (15%) - Метастазы рака предстательной 2 (10%) железы - Метастазы рака шейки матки 2 (10%) - Метастазы меланомы 2 (10%) - Метастазы нейроэндокринной 1 (5%) опухоли тонкой кишки - Метастазы рака легкого 1 (5%) - Метастазы рака сигмовидной 1 (5%) кишки 1 (5%) - Метастазы герминогенной опухоли яичка 1 (5%) - Хордома Метастазы рака почки 12 (7%) Гемангиомы 4 (3%) ИТОГО 154 (100%) Исходя из количественного распределения позвонков с патологическими переломами по гистологическим формам, дальнейшие статистические расчеты проводились в 6 группах (таблица 2). Таблица 2. № группы Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Количество переломов позвонков в анализируемых группах Диагноз Количество позвонков Остеопороз 49 (32%) Метастазы рака молочной железы 41 (27%) Опухоли гематологической природы 28 (18%) Другие опухоли 20 (13%) Метастазы рака почки 12 (7%) Гемангиомы 4 (3%) ИТОГО 154 (100%) 44 2.3 Рентгенография Исследования проводились на аппаратах SIEMENS SIREGRAPH с выполнением планарной рентгенографии в двух проекциях, в ряде случаев дополненной линейной томографией. В исследование были включены данные 106 позвонков с патологическими переломами. Основную группу составили переломы позвонков на фоне остеопороза 37 из 106 (35%). Далее по частоте следовала группа с переломами позвонков на фоне метастазов рака молочной железы – 33 (31%), опухолей гематологической природы – 15 (14%), других опухолей – 11 (10%), метастазов рака почки – 7 (7%), гемангиом – 3(3%). В общей сложности позвонков с переломами на фоне опухолевого поражения было 69 (65%) (таблица 3). Таблица 3. № группы Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Распределение количества рентгенологических исследований по анализируемым группам Диагноз Количество позвонков Остеопороз 37 (35%) Метастазы рака молочной железы 33 (31%) Опухоли гематологической природы 15 (14%) Другие опухоли 11 (10%) Метастазы рака почки 7 (7%) Гемангиомы 3 (3%) ИТОГО 106 (100%) Для анализа были отобраны следующие рентгенологические признаки: Влияние позвонка с патологическим переломом на общую статику позвоночника Степень снижения высоты тела позвонка по Genant Вид деформации тела позвонка Вертикальная исчерченность тела позвонка («рубашка регбиста», симптом «вельвета») Распространенность вертикальной исчерченности по позвоночнику 45 Симптом «горошка» в поломанном позвонке Распространенность симптома горошка по позвоночнику Снижение плотности во всех позвонках Уплотнение костной структуры под замыкательной пластиной поломанного позвонка Внутрипозвонковый «вакуум»-феномен тела поломанного позвонка «Вакуум»-феномен смежных межпозвонковых дисков Истончение коркового слоя тела позвонка Разрушение коркового слоя тела позвонка Вздутие коркового слоя тела позвонка Литическая деструкция в пораженном позвонке Смешанная деструкция в пораженном позвонке Пластическая деструкция в пораженном позвонке Ячеистая деструкция в пораженном позвонке Распространение деструкции на задний комплекс позвонка Очаги деструкции в других позвонках (без переломов) Состояние позвоночного канала Состояние межпозвонковых отверстий Линия перелома тела позвонка Наличие внекостного компонента Наличие костных отломков Характер границ деструкции Размеры деструкции (литической, смешанной) Распространение опухоли на смежные позвонки 46 2.4 Рентгеновская компьютерная томография (РКТ) Для анализа использовались данные рентгеновской компьютерной томографии, которая проводилась на различных мультидетекторных аппаратах SIEMENS SOMATOM. Исследования проводились в костном и мягкотканом режимах в аксиальной проекции с толщиною среза 1,25-5 мм. В исследовании были включены данные 120 позвонков с патологическими переломами. Основную группу составили позвонки с патологическими переломами на фоне остеопороза – 38 позвонков (32%). Далее следовали: переломы на фоне метастазов рака молочной железы – 30 позвонка (25%), на фоне опухолей гематологической природы – 20 позвонков (16%), на фоне других опухолей – 16 позвонков (13%), на фоне метастазов рака почки – 12 позвонков (10%), на фоне гемангиом – 4 позвонка (4%) (таблица 4). В общей сложности позвонков с переломами на фоне опухолевого поражения было 82 (68%). Таблица 4. Распределение количества РКТ-исследований в аксиальной проекции по анализируемым группам № группы Диагноз Количество позвонков Группа 1 Остеопороз 38 (32%) Группа 2 Метастазы рака молочной железы 30 (25%) Группа 3 Опухоли гематологической природы 20 (16%) Группа 4 Другие опухоли 16 (13%) Группа 5 Метастазы рака почки 12 (10%) Группа 6 Гемангиомы 4 (4%) ИТОГО 120 (100%) Для 109 (91%) из 120 случаев переломов позвонков, в которых была выполнена РКТ, дополнительно проводилась мультипланарная реконструкция в коронарной и сагиттальной проекциях. Основную группу также составили позвонки с патологическими переломами на фоне остеопороза – 35 позвонков (32%). Далее следовали: переломы на фоне метастазов рака молочной железы – 22 позвонка (20%), на фоне опухолей гематологической природы – 20 позвонков (18%), на фоне других опухолей – 16 позвонков (15%), на фоне метастазов рака 47 почки – 12 позвонков (11%), на фоне гемангиом – 4 позвонка (4%) (таблица 5). В общей сложности позвонков с переломами на фоне опухолевого поражения было 74 (68%). Таблица 5. Распределение количества РКТ-исследований с мультипланарной реконструкцией по анализируемым группам № группы Диагноз Количество позвонков Группа 1 Остеопороз 35 (32%) Группа 2 Метастазы рака молочной железы 22 (20%) Группа 3 Опухоли гематологической природы 20 (18%) Группа 4 Другие опухоли 16 (15%) Группа 5 Метастазы рака почки 12 (11%) Группа 6 Гемангиомы 4 (4%) ИТОГО 109 (100%) Совокупность признаков РКТ-исследования не отличалась от рентгенографических, за исключением дополнительного признака наличия включений жировой плотности в позвонке с патологическим переломом. 2.5 Магнитно-резонансная томография В исследовании были использованы данные стандартной магнитно- резонансной томографии, а также методики магнитно-резонансной томографии с динамическим контрастированием (МРТ-ДК) и диффузионно-взвешенной МРТ (ДВ-МРТ). Все исследования проводились на магнитно-резонансном томографе SIEMENS MAGNETOМ спинальных катушек AVANTO (spinal coil). использованием 1,5T c При исследовании встроенных шейного отдела позвоночника использовалась двухсегментная шейная катушка (neck coil). Стандартная методика предусматривала применение импульсной последовательности спин-эхо (spin-echo – SE) с взвешенными изображениями (ВИ) Т1, Т2 и в режиме с подавлением сигнала от жировой ткани (FS) в Т2. В ряде случаев при неудовлетворительном качестве Т2FS использовался протокол STIR (short time inversion recovery). Стандартно выполнялись пять типов протоколов: в 48 сагиттальной проекции – Т1 ВИ, T2 ВИ и один из режимов с подавлением сигнала от жировой ткани (FS или STIR), в аксиальной проекции – T2 ВИ, в коронарной проекции – Т2 ВИ. Толщина среза составляла 3-4 мм в зависимости от сегмента позвоночника, разрешение от 384х384 до 512х512. Поле зрения от 260 до 350 мм2 в зависимости от исследуемого сегмента позвоночника. В исследование включены данные 147 позвонков с патологическими переломами. Основную группу также составили позвонки с патологическими переломам на фоне остеопороза – 49 позвонков (33%), далее по частоте следовали позвонки с переломами на фоне метастазов рака молочной железы – 39 (26%), на фоне опухолей гематологической природы – 23 позвонка (16%), на фоне других опухолей – 20 (14%), на фоне метастазов рака почки – 12 позвонков (8%) и на фоне гемангиом – 4 позвонка (3%). В общей сложности позвонков с патологическими переломами на фоне опухолевого поражения было 98 (67%) (Таблица 6). Таблица 6. № группы Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Распределение количества стандартного МР-исследования по анализируемым группам Диагноз Количество позвонков Остеопороз 49 (33%) Метастазы рака молочной железы 39 (26%) Опухоли гематологической природы 23 (16%) Другие опухоли 20 (14%) Метастазы рака почки 12 (8%) Гемангиомы 4 (3%) ИТОГО 147 (100%) Для анализа были отобраны следующие МР-признаки: Влияние позвонка с патологическим переломом на общую статику позвоночника Степень снижения высоты тела позвонка по Genant Вид деформации тела позвонка Отек костного мозга тела поломанного позвонка Размеры опухолевого очага 49 Опухолевые очаги в других позвонках Солидная структура очагов Кистозная структура очагов Кистозно-солидная структура очагов Жировые включения в теле поломанного позвонка Кровоизлияния в теле поломанного позвонка Некроз в теле поломанного позвонка Патологические сосуды в теле поломанного позвонка Включения пониженного МР-сигнала в позвонке Включения пониженного МР-сигнала в смежных межпозвонковых дисках (вакуум- феномен) Включения жидкости в смежных межпозвонковых дисках Состояние заднего комплекса Состояние позвоночного канала Состояние межпозвонковых отверстий Внекостный компонент Состояние дурального мешка Структура спинного мозга Костные отломки Распространение опухоли на смежные позвонки Жировая конверсия костного мозга (позвоночника в целом) Симптом «географического рисунка» Характер границ опухоли Линия перелома Перифокальный отек в теле поломанного позвонка 50 2.6 Методика магнитно-резонансной томографии с динамическим контрастированием (МРТ-ДК) В 52 случаях переломов позвонков после проведения стандартного МРисследования дополнительно проводилась методика МРТ-ДК с применением водорастворимого контрастного вещества на основе хелата гадолиния (Gd), что позволяло оценивать перфузию в позвонке с патологическим переломом. В качестве протокола МРТ-ДК применялся односрезовый протокол импульсной последовательности градиентного эха (GRE – gradient echo) двумерный FLASH 2D (fast low-angle shot) в T1 ВИ со 100 повторяющимися ультрабыстрыми сериями. Продолжительность каждой серии - 1,5 сек. Толщина среза составляла 15 мм, разрешение – 256х256 при поле зрения 400-450 мм2. Как правило, применялась сагиттальная проекция, точное расположение которой определялось при преконтрастном МР-исследовании таким образом, чтобы можно было оценивать наибольший участок зоны перелома тела позвонка и участок аорты. В качестве КВ применялся препарат «Омнискан» 0,5 (Nycomed) в дозировке 15 мл. КВ вводилось внутривенно болюсно через три серии от начала исследования со скоростью 3-5 мл/с. Введение КВ осуществлялось инжекторной системой MEDRAD SPECTRIS SOLARISE или ручным способом с использованием 20-мл шприца и системы проводников, которое дополнялось инфузией 15-20 мл физиологического раствора после основного болюса. Это позволяло направить в венозную систему остающийся объем КВ в системе проводников. После завершения исследования проводилась постпроцессинговая обработка полученных данных в приложении «Mean Curve» программного обеспечения консоли аппарата SIEMENS MAGNETOМ AVANTO 1,5T. Выбиралась наиболее показательная серия динамического контрастирования, на которой выделялись для сравнения различные зоны интереса (ROI-region of interest): аорта (ROI1), наиболее интенсивно контрастируемый участок позвонка с патологическим переломом (ROI2), весь позвонок с патологическим переломом (ROI3) и, если 51 имелась возможность, смежный неизмененный позвонок (ROI4). Для каждого ROI автоматически определялись четыре параметра: площадь в мм2, показатель наибольшей (Max), наименьшей (Min) и средней (Mean) интенсивности сигнала. Таким образом, на первом этапе постпроцессинга проводился качественный анализ получаемых изображений, т.е. характер и интенсивность распределения КВ в теле позвонка с патологическим переломом. На втором этапе полуколичественного анализа определялось изменение интенсивности сигнала в зависимости от времени с построением графических кривых накопления/выведения КВ в выбранных ROI. В процессе анализа полученного материала нами, помимо общепринятых пяти типов кривых накопления/выведения КВ (Рис. 6), был выделен дополнительный тип кривой, схожий с «артериальным» (IVа тип), но отличающийся от него более медленной фазой вымывания КВ (фазой wash-out) (Рис.7). Рис. 6. Типы графических кривых накопления/выведения КВ по данным Verstraete et al.[65]. Рис. 7. Различные типы графических кривых накопления/выведения КВ. Ось X - время исследования (Т), ось Y – интенсивность сигнала (SI – signal intensity). Тип I – отсутствие накопления и выведения КВ; Тип II – «мышечный тип»; Тип IVа, IVb– «артериальный тип»; Тип III и V – характерны для различных тканей. На последнем этапе, на основании изменения интенсивности сигнала по времени, проводился количественный анализ полученных данных с определением ряда параметров. Первым параметром являлось время начала контрастирования 52 интересующей зоны (Tstart) в теле позвонка в сравнении со временем появления контрастного препарата в аорте. Второй параметр заключался в определении скорости нарастания интенсивности сигнала по времени в начальной «перфузионной» фазе. Данный параметр графически отображается в виде степени наклона («крутизны») кривой Steepest Slope (SS) и рассчитывается в %/с по формуле (Рис 8). Третий параметр заключался в определении максимальной интенсивности накопления КВ Peak Enhancement (PE) и рассчитывался по формуле (Рис. 8). Peak enhancement : [(SImax – SIbase)/SIbase] x 100% Steepest slope : [(SIend –SIprior)/SIbase x T] x 100%/sec Рис. 8. Графическое изображение крутизны кривой (Steepest Slope) накопления/выведения КВ, максимальной интенсивности накопления (Peak Enhancement) и формулы их расчета. SImax – максимальная интенсивность сигнала в зоне интереса. SIbase – интенсивность сигнала до начала введения контрастного вещества, рассчитывается как среднее значение интенсивности сигнала трех первых серий. SIprior – интенсивность сигнала в момент наиболее «резкого» изменения показателя интенсивности сигнала на начальных этапах контрастирования в момент Тprior. SIend – интенсивность сигнала в момент прекращения резкого прогрессирующего накопления КВ в момент Tend.T – абсолютная величина, отражающая разницу между Тprior и Tend. Для анализа методики МРТ-ДК были отобраны следующие качественные, полуколичественные и количественные признаки: Характер распределения контрастного вещества в теле позвонка Зоны накопления в других позвонках 53 Тип кривой накопления/выведения КВ всего тела позвонка Тип кривой накопления/выведения КВ в наиболее контрастируемой точке Время начала контрастирования всего тела позвонка в сравнении с аортой Время начала контрастирования наиболее контрастируемой точке в сравнении с аортой Максимальная интенсивность накопления КВ всего тела позвонка Максимальная интенсивность накопления КВ в наиболее контрастируемой точке «Крутизна» кривой накопления/выведения КВ в теле всего позвонка «Крутизна» кривой накопления/выведения КВ в наиболее контрастируемой точке Значение средней интенсивности в теле всего позвонка Значение средней интенсивности в наиболее контрастируемой точке В исследование были включены данные 51 позвонка с патологическими переломами. В нашем исследовании методика МРТ-ДК рассматривалась как дополнительная в дифференциальной диагностике переломов на фоне остеопороза и опухолевого поражения. В связи с этим были выделены две группы. Первую группу составили позвонки с переломами на фоне остеопороза – 22 позвонка (42%). Во вторую группу переломов позвонков на фоне опухолевого поражения (29 позвонков – 58%) вошли: метастазы рака молочной железы – 15 позвонков (31%), метастазы рака почки – 7 позвонков (13%), другие опухоли – 5 позвонков (10%), опухоли гематологической природы – 1 позвонок (2%), гемангиома – 1 позвонок (2%) (таблица 7). 54 Таблица 7. Распределение количества МР-исследования с динамическим контрастированием по анализируемым группам № группы Диагноз Количество позвонков Группа 1 Остеопороз 22 (42%) Группа 2 Метастазы рака молочной железы 15 (31%) Метастазы рака почки 7 (13%) Другие опухоли 5 (10%) Опухоли гематологической природы 1 (2%) Гемангиомы 1 (2%) ИТОГО 51 (100%) 2.7. Методика диффузионно-взвешенной МРТ (ДВ-МРТ) В 17 случаях переломов позвонков, которым проводилась стандартное МРисследование, дополнительно выполнялась методика ДВ-МРТ. Применялся многосрезовый протокол сверхбыстрой эхопланарной импульсной последовательности спин-эхо (SE-EPI – spin-echo echo-planar) в сагиттальной проекции с использованием трех значений параметра b (b value), равных 50, 400 и 600 с/мм2. Толщина среза составляла 6 мм, разрешение 192х192 при поле зрения 400 мм2. Значение TE (echo time) составляло 90, TR (repetition time) – 5000. После проведения исследования для количественного анализа диффузионно-взвешенных изображений (ДВИ) автоматически строились ИКД-карты для истинного коэффициента диффузии (ИКД, ADC – apparent diffusion coefficient), который определялся выделением на карте области интереса (ROI) в мм2/с. В исследование были включены данные 17 позвонков с патологическими переломами. В нашем исследовании данная методика рассматривалась как дополнительная для дифференциальной диагностики патологических переломов позвонков на фоне остеопороза и на фоне опухолевого поражения. В связи с этим были выделены две группы. В первую группу вошли 7 позвонков (41%) с переломами на фоне остеопороза. Вторую группу позвонков с патологическими переломами на фоне опухолевого поражения (10 позвонков – 59%) составили: метастазы рака молочной железы – 5 позвонков (50%), метастазы рака почки – 3 55 позвонка (30%), опухоли гематологической природы – 1 позвонок (10%), гемангиома – 1 позвонок (10%) (таблица 8). Таблица 8. Распределение количества диффузионно-взвешенных МР-исследований по анализируемым группам № группы Диагноз Количество позвонков Группа 1 Остеопороз 7 (41%) Группа 2 Метастазы рака молочной железы 5 (50%) Метастазы рака почки 3 (30%) Опухоли гематологической природы 1 (10%) Гемангиомы 1 (10%) ИТОГО 17 (100%) 2.8 Методы ядерной медицины В исследовании применялись два радиоизотопных метода: планарная и трехфазная (динамическая) остеосцинтиграфия. В качестве радиофармпрепарата использовался зависимости 99m от Tc-технефор. Активность массы пациента. тела составляла Исследования 370-555 МБк проводились в на двухдетекторных гамма-камерах фирмы SIEMENS ZLC-75, E.CAM и SYMBIAB c использованием программы 3 PHASE BONE. Радиофармпрепарат вводили внутривенно под наложенным жгутом при положении больного в аппарате. В момент снятия жгута начинали регистрацию. Первая фаза исследования (ранняя сосудистая), с разрешением 64х64, включала 40 последовательных серий длительностью в 1 сек. Далее без перерыва, начиная с 41 сек., следовала вторая фаза (отсроченная сосудистая) с аналогичным разрешением 64х64 и длительностью 30 серий по 10 сек. Третья фаза (костная) с последующей планарной остеосцинтиграфией в режиме всего тела с разрешением 128х128 проводилась в течение 2-5 мин через 3 часа после введения РФП. В кривых накопления РФП выделялись три фазы: ранняя сосудистая фаза (0-40 секунд после внутривенного введения), отсроченная сосудистая фаза (41-341 сек.), костная фаза (через 3 часа). При анализе изображений зоне интереса (позвонка с 56 патологическим переломом) противопоставлялся позвонок с неизмененным уровнем накопления РФП. Анализировались следующие количественные признаки: максимальный процент накопления РФП в сосудистую фазу в позвонке с патологическим переломом, максимальный процент накопления РФП в костную фазу в позвонке с патологическим переломом. Помимо количественных параметров, анализировались качественные признаки костной фазы: характер накопления РФП в пораженном позвонке очаги измененного накопления РФП в других костях Проанализированы данные планарной остеосцинтиграфии 116 позвонков с патологическими переломами. В нашем исследовании данный метод расценивался только как дополнительный для дифференциальной диагностики патологических переломов на фоне остеопороза и опухолевого поражения. В связи с этим было выделено две группы. В первую группу вошли 36 позвонков (31%) с «остеопорозными» переломами. Вторую группу с переломами позвонков на фоне опухолевого поражения (80 позвонков – 69%) составили: метастазы рака молочной железы – 31 позвонок (27%), опухоли гематологической природы – 19 позвонков (16%), другие опухоли – 15 позвонков (13%), метастазы рака почки – 11 позвонков (9%), гемангиомы – 4 позвонка (3%). Во всех случаях имелись данные костной фазы, данные сосудистой фазы – у 15 пациентов (таблица 9). 57 № группы Группа 1 Группа 2 Таблица 9 Распределение количества исследований ядерной медицины по анализируемым группам Диагноз Количество Количество позвонков в позвонков в костной фазе сосудистой фазе Остеопороз 36 (31%) 5 (33%) Метастазы рака молочной 31 (27%) 4 (27%) железы Опухоли гематологической 19 (16%) природы Другие опухоли 15 (13%) 3 (20%) Метастазы рака почки 11 (9%) 3 (20%) Гемангиомы 4 (3%) ИТОГО 116 (100%) 15 (100%) 2.9 Методы статистического анализа При обработке клинических и признаков лучевой диагностики патологических переломов позвонков был применен пакет программ «АСТА», созданный в лаборатории медицинской кибернетики РОНЦ для оценки медико-биологических данных. С помощью этих программ были проведены: бинарная статистика с вычислением коэффициентов Стьюдента, анализ на основании тестов хи-квадрат и точного критерия Фишера. Вычислялись коэффициенты информативности Вапника-Червоненкиса. Многофакторный анализ клинико-лучевых признаков состоял в построении решающих правил (по методу Байеса), использующих различные наборы признаков. При многофакторном анализе каждый признак приобретал «весовой коэффициент информативности», который определялся частотой встречаемости данного признака в группах «остеопорозных» и «опухолевых» переломов позвонков и в выделенных 6 группах нозологических форм. В последующем на основании совокупности признаков с их ВКИ создавалось «решающее правило» для каждого метода исследования в группах «остеопорозных» и «опухолевых» переломов позвонков и в выделенных 6 58 группах нозологических форм. Таким образом, «решающие правила» (по методу Байеса) создавались с использованием различных наборов признаков с их ВКИ. Диагностическую точность метода в группах с переломами позвонков на фоне остеопороза и на фоне опухолевого поражения оценивали с помощью чувствительности, специфичности и точности, прогностической ценности положительного (ПЦПР) и отрицательного (ПЦОР) результатов. Чувствительность в контексте данного исследования – это способность метода выявлять группу с «остеопорозными» переломами позвонков. Специфичность в контексте данного исследования – это способность метода выявлять группу с «опухолевыми» переломами позвонков. Прогностическая ценность положительного результата (ПЦПР): Прогностическая ценность отрицательного результата (ПЦОР): Точность - степень близости полученного результата к принятому опорному значению (в данном исследовании - к 100%). Диагностическую информативность метода в 6 группах нозологических форм определялась с помощью параметра точности отнесения объекта в каждую конкретную группу 59 Глава 3 ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА «ОПУХОЛЕВЫХ» И «ОСТЕОПОРОЗНЫХ» ПАТОЛОГИЧЕСКИХ ПЕРЕЛОМОВ ПОЗВОНКОВ. РЕЗУЛЬТАТЫ, ОБСУЖДЕНИЕ И РАЗРАБОТКА АЛГОРИТМОВ ОБСЛЕДОВАНИЯ 3.1 Информативность клинико-анамнестических данных в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков Проанализированы клинико-анамнестические данные для 154 случаев патологических переломов позвонков. Среди них: 49 позвонков (32%) с «остеопорозной» деформацией, 105 позвонков (68%) с переломами на фоне опухолевого поражения. Подход к анализу каждого конкретного случая перелома был обусловлен выявлением у ряда больных множественных деформаций позвонков различной этиологии. Для создания «решающего правила» в «обучающую выборку» были включены данные 103 позвонков с патологическими переломами. Из них: 34 остеопорозного характера и 69 – опухолевого. Из 12 разработанных признаков для создания «решающего правила», нами отобраны 8 наиболее информативных, на основе которых было сформировано «решающее правило». Пороговое значение разграничения групп позвонков с «опухолевыми» и «неопухолевыми» переломами составило 0. Признаки, характерные для группы позвонков с «опухолевыми» переломами, имеют значение меньше порогового (0), а для группы позвонков с «неопухолевыми» переломами больше или равное пороговому (≥0). 60 Позвонки с «опухолевыми» переломами -119 -191 -12 -176 -179 -40 -125 -44 -52 -52 -61 -24 Таблица 10. Клинико-анамнестические признаки с их ВКИ Признак Позвонки с «неопухолевыми» переломами Пол Мужской +43 Женский Характер болевого синдрома +110 Вертебралгия Вертебралгия+радикулопатия +58 Радикулопатия Отсутствие болевого синдрома Неврологический дефицит Да +31 Нет Наличие травмы в анамнезе +58 Да, адекватная Да, неадекватная +244 Нет Онкологический анамнез Да +316 Нет Сопутствующие заболевания +63 Да Нет Направительный диагноз +86 Метастатическое поражение позвоночника из НПО Метастатическое поражение позвоночника из опухоли известной локализации Первичная опухоль позвоночника Поражение костной системы при гематологических опухолях Количество переломов позвонков Солитарное (1 позвонок) Единичное (2-3) позвонка +99 Множественное (4 и более позвонков) Как показано в таблице 10 наиболее информативным признаком для группы позвонков с патологическими переломами на фоне остеопороза является отсутствие онкологического анамнеза с ВКИ (+316). Далее в порядке убывания 61 информативности следовали: неадекватная травма в анамнезе (+244), болевой синдром по типу вертебралгии (+110), множественные (более 4) переломы позвонков (+99). Наименее информативным признаком оказалось отсутствие неврологического дефицита (+31). Для группы позвонков с патологическими переломами на фоне опухолевого поражения наиболее информативным признаком оказался сочетанный (вертебралгия+радикулопатия) болевой синдром с ВКИ (-191). Далее в порядке убывания информативности следовали: отсутствие травмы в анамнезе (-179), наличие неврологического дефицита (-176), отсутствие сопутствующих заболеваний (-125), мужской пол (-119). Наименее информативным признаком оказалось отсутствие болевого синдрома (-12). Для уточнения информативности «решающего правила» сформирована «экзаменационная» выборка, которая включала в себя данные 51 позвонка с патологическими переломами. Из них – 15 позвонков с переломами остеопорозного характера и 38 - опухолевого. Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 11. Таблица 11. Показатели информативности клинико-анамнестических признаков ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 91,8% 93,3% ПЦПР 83,3% 73,6% СПЕЦИФИЧНОСТЬ 91% 86,1% ПЦОР 96,0% 96,8% ТОЧНОСТЬ 97,0% 93,9% Как показано в таблице 11 показатель чувствительности клиникоанамнестических признаков, т.е. способность определять группу позвонков с патологическими переломами на фоне остеопороза как в «обучающей», так и в «экзаменационной» выборках высокая и составляет 92-93%. Все 62 ложноотрицательные результаты отмечались в случаях, когда имелся онкологический анамнез, но причиной деформации являлся остеопороз. Специфичность же, т.е. способность на основании совокупности данных признаков выявлять группу позвонков с опухолевыми переломами несколько ниже и составляет 86-91%. Все ложноположительные результаты наблюдались в тех случаях, когда имелся онкологический анамнез, но отсутствовали сочетанный болевой синдром и неврологический дефицит. С учетом высокой зависимости показателей информативности от наличия онкологического анамнеза и связанных с ним факторов, решено исключить все данные критерии и проанализировать следующие признаки: пол, характер болевого синдрома, неврологический статус, наличие сопутствующих заболеваний и травм в анамнезе. Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 12. Таблица 12. Показатели информативности клинико-анамнестических признаков без онкологических критериев ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 91,8% 93,3% ПЦПР 68,1% 63,6% СПЕЦИФИЧНОСТЬ 80,0% 77,8% ПЦОР 95,4% 96,5% ТОЧНОСТЬ 85,7% 83,8% Как показано в таблице 12 показатели чувствительности в обеих выборках не изменились по сравнению с чувствительностью «решающего правила» с учетом «онкологических признаков» и составляют 92-93%, однако специфичность снизилась до 83-86%. Это можно объяснить влиянием наличия онкологического анамнеза и сопутствующих ему факторов при минимальных клинических проявлениях. По данным Ensrud с соавторами, только 1 из 4 переломов позвонков на фоне остеопороза проявляется клинически [121]. При этом клиническая картина 63 неспецифична, характеризуется болевым синдромом, зачастую диффузного характера [122]. По нашим данным во всех случаях «остеопорозных» переломов определялся болевой синдром по типу вертебралгии. Боль радикулярного характера, как изолированная, так и в сочетании с вертебралгией за счет развития перелома является одним из признаков опухолевого поражения позвоночника [123]. Неврологический дефицит также характерен для данной патологии [124]. В нашем исследовании оба этих признака были высокоинформативными для группы позвонков с патологическими переломами на фоне опухолевого поражения. 3.2 Информативность рентгенографии в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков Для разработки семиотики стандартной рентгенографии для дифференциальной диагностики «опухолевых» и «неопухолевых» деформаций проанализированы данные 106 позвонков с патологическими переломами. Из них - 37 остеопорозного характера (35%) и 69 опухолевого (65%). Для создания «решающего правила» в «обучающую выборку» были включены данные 71 позвонка с патологическими переломами. Из них – 24 остеопорозного характера и 47 опухолевого. Из 30 разработанных признаков, нами отобраны 13 наиболее информативных, на основе которых было сформировано «решающее правило». Пороговое значение разграничения групп позвонков с «опухолевыми» и «неопухолевыми» переломами составило 0. Признаки, характерные для группы позвонков с «опухолевыми» переломами, имеют значение меньше порогового (0), а для группы позвонков с «неопухолевыми» переломами больше или равное пороговому (≥0). 64 Позвонки с «опухолевыми» переломами -121 -40 -11 -182 -136 -55 -95 -201 -22 -224 -107 -236 -143 -115 -115 Таблица 13. Признаки стандартной рентгенографии с их ВКИ Признак Позвонки с «неопухолевыми» переломами Степень снижения высоты тела позвонка по Genant et al. 1 степень +49 2 степень +13 3 степень Невозможно оценить Вид деформации тела позвонка +66 Передняя клиновидная +3 Задняя клиновидная +72 «Рыбий» позвонок +65 «Crush» - деформация Смешанная Боковая «Vertebra plana» Невозможно оценить Вертикальная исчерченность («рубашка регбиста», «симптом» вельвета) выявляется +61 Во всех позвонках +46 Только в пораженном позвонке Не выявляется +6 Невозможно оценить Снижение плотности (во всех позвонках) +71 Да Нет Невозможно оценить Разрушение коркового слоя пораженного позвонка Да 45 Нет Невозможно оценить Литическая деструкция в пораженном позвонке Да +67 Нет Невозможно оценить Смешанная деструкция в пораженном позвонке С преобладанием пластического компонента С преобладанием литического компонента 65 -64 -93 -253 -115 -161 -271 -161 -217 -106 -114 -143 -47 -56 -238 -149 -127 -195 -232 -134 -65 -98 В равной степени Нет Невозможно оценить Распространение деструкции на задний комплекс позвонка Одностороннее Двухстороннее Не изменен Невозможно оценить Очаги деструкции в других позвонках (без переломов) Да Нет Невозможно оценить Состояние позвоночного канала на уровне перелома Интактен Сужен Невозможно оценить Состояние межпозвонковых отверстий на уровне перелома Интактны Сужены Невозможно оценить Наличие костных отломков Да Нет Невозможно оценить Характер границы деструкции Границы не определяются Определяются нечетко Четкие Склерозированные «Фестончатые» Невозможно оценить Размеры деструкции Все тело позвонка ½ тела позвонка 2/3 тела позвонка Множественные очаги в одном позвонке Не определяется Нельзя оценить +61 +108 +58 +61 +55 +30 +206 +45 +45 +206 66 Как показано в таблице 13 для группы позвонков с патологическими переломами на фоне остеопороза наибольшей информативностью обладал признак отсутствие деструкции в теле позвонка с патологическим переломом с ВКИ (+206). Далее в порядке убывания информативности следовали: неизмененный задний комплекс позвонка с патологическим переломом (+108), деформация по типу «рыбьего позвонка» (+72), снижение плотности костной ткани во всех позвонках зоны исследования (+71), отсутствие литической деструкции в теле позвонка с патологическим переломом (+67), передняя клиновидная (+66) и «crush» - деформация (+65) тела позвонка с патологическим переломом. Одинаковыми ВКИ (+61) обладали признаки: вертикальная исчерченность во всех позвонках зоны исследования, интактный позвоночный канал, отсутствие смешанной деструкции. Наименее информативным признаком оказался задний клиновидный вид деформации с ВКИ (+3). Для группы позвонков с патологическими переломами на фоне опухолевого поражения наибольшей информативностью обладал признак наличия очагов деструкции в других позвонках с ВКИ (-271). Далее в порядке убывания информативности следовали: одностороннее распространение деструкции на задний комплекс позвонка (-253), нечеткие границы деструкции (-238), выявление литической деструкции в позвонке с патологическим переломом (-236), размеры деструкции более половины тела позвонка (-232), разрушение коркового слоя позвонка (-224), сужение позвоночного канала (-217), отсутствие снижения плотности костной ткани всех позвонков в зоне исследования (-201). Наименее информативным признаком оказался смешанный тип деформации (-11). Обращает на себя внимание тот факт, что практически во всех случаях, когда невозможно оценить признак за счет объективных ограничений, данная градация принимает отрицательное значение ВКИ и может достигать (-161), что способствует отнесению объекта в группу «опухолевых» переломов. Для уточнения информативности «решающего правила» сформирована «экзаменационная выборка», которая включала в себя данные 35 позвонков с 67 патологическими переломами. Из них – 13 позвонков с переломами остеопорозного характера и 22 - опухолевого. Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 14. Таблица 14. Показатели информативности стандартной рентгенографии ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 92,9% 92,8% ПЦПР 74,5% 76,5% СПЕЦИФИЧНОСТЬ 81% 80,9% ПЦОР 96,3% 94,4% ТОЧНОСТЬ 85,7% 85,7% Как показано в таблице 14 показатели чувствительности, специфичности, прогностической ценности положительного и отрицательного результатов в «обучающей» и «экзаменационной» выборках сопоставимы между собой. Чувствительность метода составляет 92,9%, специфичность 81%. Следует отметить, что показатель чувствительности выше показателя специфичности, что указывает на более высокую информативность рентгенографии в выявлении группы позвонков с патологическими переломами на фоне остеопороза. Более низкий показатель специфичности, т.е. недостаточная способность данного метода выявлять группу позвонков с патологическими переломами на фоне опухолевого поражения, можно объяснить рядом причин. Необходимо учитывать ограничение рентгенографии за счет суммации изображения: наложения легочного рисунка при исследовании грудного отдела позвоночника, наложения кишечного содержимого и газа при исследовании поясничного отдела позвоночника. В связи с этим возможность выявления очагов менее 1 см в диаметре значительно затруднена. Также необходимо учитывать, что на фоне общего снижения плотности костной ткани, рентгенологически выявить литическую деструкцию крайне сложно из-за отсутствия элемента сравнения. В нашем исследовании гиподиагностика позвонков с патологическими переломами 68 на фоне опухолевого поражения наблюдалась в случаях либо с множественными мелкими очагами, локализующимися в позвонке с патологическим переломом, либо при тотальном поражении тела позвонка на фоне генерализованного остеопороза. Вторая группа ошибок связана с отнесением позвонков с переломами на фоне гемангиом в группу «неопухолевых» деформацией. Это обусловлено отсутствием при данной патологии высокоинформативных признаков «опухолевого» характера перелома, таких как наличие очагов деструкции в других позвонках, распространения поражения на задний комплекс позвонка, нечеткой границы деструкции и литического ее характера. При сравнении полученных результатов с данными литературы стоит отметить, что нами не было найдено работ с полноценным исследованием данного метода для определения его информативности в дифференциальной диагностике патологических переломов позвонков. При анализе отдельно взятых признаков выявлен ряд особенностей. В соответствии с Sartoris et al. [44] нами также не было выявлено достоверных различий в локализации «опухолевых» и «остеопорозных» переломов позвонков. И в том и в другом случае наиболее часто поражается грудной отдел позвоночника, что связано как с особенностями кровоснабжения, так и с распределением осевой нагрузки. По нашим данным, так же как и по результатам Link et al. [42], для «остеопорозного» перелома характерна передняя клиновидная деформация либо деформация по типу «рыбьего» позвонка. При «опухолевом» переломе в настоящем исследовании наиболее часто наблюдается боковая клиновидная деформация либо «vertebra plana», в то время как по данным литературы для него характерна задняя клиновидная деформация [42]. По результатам нашей работы симптом «внутрипозвонкового вакуум-феномена» оказался малоинформативным, что также не соответствует данным литературных источников [43]. 69 а б Рис. 9 Стандартная рентгенография. а. Больная И., 75 лет. Рак молочной железы. Направительный диагноз: Метастатическое поражение L2 позвонка? Патологический перелом. Заключение «решающего правила»: Патологический перелом тела L2 позвонка на фоне остеопороза. Тело L2 позвонка с патологическим переломом 2 степени (+13) и деформацией по типу «рыбьего позвонка» (+72). Признаков разрушения коркового слоя (+45), наличия литической (+67) или смешанной (+61) деструкции не выявлено. Поражения заднего комплекса (+108) и очагов деструкции в других позвонках зоны исследования (+58) не выявлено. Позвоночный канал (+61) и межпозвонковые отверстия (+55) интактны. Определяется диффузное снижение плотности всех позвонков в зоне исследования (+71). Сумма ВКИ «решающего правила» составила (+611). Сумма ВКИ «решающего правила» больше порогового значения, что позволяет отнести его в группу переломов на фоне остеопороза. Данный случай является истиноположительным результатом. б. Больной К.,66 лет. Рак почки. Направительный диагноз: Метастатическое поражение Th11 позвонка? Патологический перелом. Заключение «решающего правила»: Патологический перелом на фоне опухолевого поражения. 70 Тело Th11 позвонка с патологическим переломом 2 степени (+13) и передней клиновидной деформацией (+66). В теле указанного позвонка определяется зона литической деструкции (-236) с разрушением коркового слоя (-224), которая имеет четкие контуры (-149) и занимает половину тела позвонка (-232). Состояние позвоночного канала оценить затруднительно (-106), межпозвонковые отверстия интактны (+55). Очаги деструкции в других позвонках зоны исследования не определяются (+58). Сумма ВКИ «решающего правила» составила (-755). Сумма ВКИ «решающего правила» меньше порогового значения, что позволяет отнести его в группу переломов на фоне опухолевого поражения. Данный случай является истиноотрицательным результатом. 71 3.3 Информативность рентгеновской компьютерной томографии в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков 3.3.1 Информативность аксиальной рентгеновской компьютерной томографии Для разработки томографии для семиотики стандартной дифференциальной рентгеновской диагностики компьютерной «опухолевых» и «неопухолевых» деформаций проанализированы данные 120 позвонков с патологическими переломами. Из них - 38 остеопорозного характера (32%) и 82 опухолевого (68%). Необходимо отметить, что наличие перелома позвонка выявлялось либо по данным предварительно проведенного рентгенологического исследования, либо на основании мультипланарной реконструкции. Для создания «решающего правила» в «обучающую выборку» были включены данные 79 позвонков с патологическими переломами. Из них – 18 остеопорозного характера и 61 опухолевого. Из 31 разработанного признака, нами отобраны 13 наиболее информативных, на основе которых было сформировано «решающее правило». Пороговое значение разграничения групп позвонков с «опухолевыми» и «неопухолевыми» переломами составило 0. Признаки, характерные для группы позвонков с «опухолевыми» переломами, имеют значение меньше порогового (0), а для группы позвонков с неопухолевыми переломами больше или равное пороговому (≥0). 72 Таблица 15. Признаки аксиальной рентгеновской компьютерной томографии с их ВКИ Позвонки с Признак Позвонки с «опухолевыми» «неопухолевыми» переломами переломами Снижение плотности (во всех позвонках) +76 Да -184 Нет Внутрипозвонковый «вакуум»-феномен +117 Да -16 Нет +130 Невозможно оценить «Вакуум»-феномен смежного межпозвонкового диска +143 Да -42 Нет Истончение коркового слоя -187 Да +192 Нет +130 Невозможно оценить Вздутие коркового слоя -132 Да +10 Нет +130 Невозможно оценить Смешанная деструкция в пораженном позвонке -26 С преобладанием пластического компонента -313 С преобладанием литического компонента -79 В равной степени +93 Нет +129 Невозможно оценить Очаги деструкции в других позвонках (без переломов) -129 Да +87 Нет Состояние позвоночного канала на уровне перелома +94 Интактен -147 Сужен +130 Невозможно оценить Состояние межпозвонковых отверстий на уровне перелома +73 Интактны -192 Сужены 73 Невозможно оценить Наличие костных отломков Да Нет Характер границы деструкции Границы не определяются Определяются нечетко Четкие Склерозированные «Фестончатые» Невозможно оценить Размеры деструкции Все тело позвонка ½ тела позвонка 2/3 тела позвонка Множественные очаги в одном позвонке Не определяется Нельзя оценить Жировые включения в теле поломанного позвонка Да Нет Невозможно оценить -82 -248 -81 -13 -161 -198 -57 -242 -81 -12 +222 +76 +304 +58 +304 +128 +61 +222 Как показано в таблице 15 для группы позвонков с патологическими переломами на фоне остеопороза наибольшей информативностью обладал признак отсутствие деструкции в теле позвонка с патологическим переломом с ВКИ (+304). Далее в порядке убывания информативности следовали: отсутствие истончения коркового межпозвонкового диска слоя (+143), (+192), «вакуум-феномен» внутрипозвонковый смежного «вакуум-феномен» поломанного позвонка (+117), интактный позвоночный канал на уровне перелома (+94), отсутствие очагов деструкции в других позвонках (+87), снижение плотности костной ткани во всех позвонках зоны исследования и отсутствие костных отломков по (+76), интактные межпозвонковые отверстия на уровне перелома (+73). Наименее информативным признаком оказалось вздутие коркового слоя (+10). 74 Для группы позвонков с патологическими переломами на фоне опухолевого поражения наибольшей информативностью обладал признак смешанной деструкции с преобладанием литического компонента с ВКИ (-313). Далее в порядке убывания информативности следовали: нечеткие границы деструкции (248), размеры очага 2/3 тела позвонка (-242), либо все тело позвонка (-198), сужение межпозвонковых отверстий на уровне перелома (-191), истончение коркового слоя (-187), снижение плотности костной ткани всех позвонков в зоне исследования (-184), сужение позвоночного канала на уровне перелома (-147). Наименее информативным признаком оказалось отсутствие жировых включений в теле поломанного позвонка (-12). Обращает на себя внимание тот факт, что практически во всех случаях, когда невозможно оценить признак за счет объективных ограничений, данная градация принимает положительное значение ВКИ и может достигать (+222), что способствует отнесению объекта в группу «остеопорозных» переломов. Для уточнения информативности «решающего правила» сформирована «экзаменационная выборка», которая включала в себя данные 41 позвонка с патологическими переломами. Из них – 16 позвонков с переломами остеопорозного характера и 25 - опухолевого. Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 16. Таблица 16. Показатели информативности аксиальной рентгеновской компьютерной томографии ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 100,0% 100% ПЦПР 87,5% 94% СПЕЦИФИЧНОСТЬ 92,3% 96% ПЦОР 100,0% 100,0% ТОЧНОСТЬ 95,0% 97,6% Как видно из таблицы 16 чувствительность метода и прогностическая ценность отрицательного результата в «обучающей» и «экзаменационной» выборках 75 сопоставима и составляют 100%. Это указывает на высокую точность стандартной РКТ в определении группы позвонков с переломами на фоне остеопороза. Показатель специфичности в обеих выборках ниже и составляет 9296%, что свидетельствует об ограничениях данного метода в определении группы с переломами на фоне опухолевого поражения. 3.3.2 Информативность рентгеновской компьютерной томографии с мультипланарной реконструкцией Для разработки семиотики рентгеновской компьютерной томографии с мультипланарной реконструкцией для дифференциальной диагностики «опухолевых» и «неопухолевых» деформаций проанализированы данные 109 позвонков с патологическими переломами. Из них - 35 остеопорозного характера (32%) и 74 опухолевого (68%). Для создания «решающего правила» в «обучающую выборку» включены данные 72 позвонков с патологическими переломами. Из них – 23 остеопорозного характера и 49 опухолевого. Из 31 разработанного признака, нами отобраны 18 наиболее информативных, на основе которых было сформировано «решающее правило». Пороговое значение разграничения групп позвонков с «опухолевыми» и «неопухолевыми» переломами составило 0. Признаки, характерные для группы позвонков с «опухолевыми» переломами, имеют значение меньше порогового (0), а для группы позвонков с «неопухолевыми» переломами больше или равное пороговому (≥0). 76 Таблица 17. Признаки рентгеновской компьютерной томографии с мультипланарной реконструкцией с их ВКИ Позвонки с Признак Позвонки с «опухолевыми» «неопухолевыми» переломами переломами Вид деформации тела позвонка +148 Передняя клиновидная -17 Задняя клиновидная +136 «Рыбий» позвонок +36 «Crush» - деформация -68 Смешанная -262 Боковая -79 «Vertebra plana» Вертикальная исчерченность («рубашка регбиста», «симптом» вельвета) выявляется +97 Во всех позвонках +124 Только в пораженном позвонке -215 Не выявляется -107 Невозможно оценить Снижение плотности (во всех позвонках) +80 Да -181 Нет Субкортикальное уплотнение костной структуры тела поломанного позвонка +170 Да -91 Нет -65 Невозможно оценить «Вакуум»-феномен смежного межпозвонкового диска +151 Да -47 Нет Истончение коркового слоя -224 Да +238 Нет Разрушение коркового слоя пораженного позвонка -287 Да +191 Нет -14 Невозможно оценить Вздутие коркового слоя -150 Да +20 Нет Смешанная деструкция в пораженном 77 -305 -72 -90 -129 -117 -154 -86 -297 -142 -13 -162 -240 -108 -225 -86 позвонке С преобладанием пластического компонента С преобладанием литического компонента В равной степени Нет Невозможно оценить Ячеистая деструкция в пораженном позвонке Да Нет Очаги деструкции в других позвонках (без переломов) Да Нет Состояние позвоночного канала на уровне перелома Интактен Сужен Невозможно оценить Состояние межпозвонковых отверстий на уровне перелома Интактны Сужены Невозможно оценить Наличие костных отломков Да Нет Характер границы деструкции Границы не определяются Определяются нечетко Четкие Склерозированные «Фестончатые» Невозможно оценить Размеры деструкции Все тело позвонка ½ тела позвонка 2/3 тела позвонка Множественные очаги в одном позвонке Не определяется Нельзя оценить Распространение опухоли на смежные позвонки +53 +78 +122 +12 +80 +99 +130 +99 +222 +84 +298 +53 +301 +122 78 Да Нет Жировые включения в теле поломанного позвонка Да Нет Невозможно оценить -152 -13 9 +56 +217 Как показано в таблице 17 для группы позвонков с патологическими переломами на фоне остеопороза наибольшей информативностью обладал признак отсутствие деструкции в теле позвонка с патологическим переломом с ВКИ (+301). Далее в порядке убывания информативности следовали: отсутствие истончения коркового слоя (+238), отсутствие разрушения коркового слоя (+191), субкортикальное уплотнение костной структур тела поломанного позвонка (+170), «вакуум-феномен» смежного межпозвонкового диска (+151), передняя клиновидная (-148) деформация или деформация по типу «рыбьего позвонка» (+136). Наименее информативным признаком оказалось отсутствие распространения опухоли на смежные позвонки (+9). Для группы позвонков с патологическими переломами на фоне опухолевого поражения наибольшей информативностью обладал признак смешанной деструкции с преобладанием литического компонента с ВКИ (-305). Далее в порядке убывания информативности следовали: нечеткие границы деструкции (295), разрушение коркового слоя (-287), боковая клиновидная деформация тела поломанного позвонка (-262), поражение всего тела позвонка (-240), либо 2/3 тела позвонка (-225), истончение коркового слоя (-224), отсутствие вертикальной исчерченности тела как поломанного позвонка, так и других позвонков в зоне исследования (-215). Наименее информативным признаком оказалось отсутствие жировых включений в теле поломанного позвонка (-13). Обращает на себя внимание тот факт, что практически во всех случаях, когда невозможно оценить признак за счет объективных ограничений, данная градация 79 принимает положительное значение ВКИ и может достигать (+222), что способствует отнесению объекта в группу «остеопорозных» переломов. Для уточнения информативности «решающего правила» сформирована «экзаменационная выборка», которая включала в себя данные 37 позвонков с патологическими переломами. Из них – 12 позвонков с переломами остеопорозного характера и 25 - опухолевого. Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 18. Таблица 18. Показатели информативности рентгеновской компьютерной томографии с мультипланарной реконструкцией ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 100,0% 100% ПЦПР 79,3% 75% СПЕЦИФИЧНОСТЬ 87,7% 85% ПЦОР 100,0% 100,0% ТОЧНОСТЬ 92,7% 91,9% Как видно из таблицы 18 чувствительность метода и прогностическая ценность отрицательного результата в «обучающей» и «экзаменационной» выборках сопоставима и составляют 100%. Это указывает на высокую точность РКТ с мультипланарной реконструкцией в определении группы с переломами позвонков на фоне остеопороза. Показатель специфичности в обеих выборках ниже и составляет 85-88%, что свидетельствует об ограничениях данного метода в определении группы с переломами на фоне опухолевого поражения. Ошибочное отнесение объектов в группу с неопухолевыми переломами наблюдалось в тех же случаях, что и при стандартном РКТ-исследовании. 80 3.3.3 Обсуждение результатов для рентгеновской компьютерной томографии Ниже представлены сводные данные об информативности стандартной РКТ и РКТ с мультипланарной реконструкцией в дифференциальной диагностике патологических переломов позвонков. Таблица 19. Сводные данные показателей информативности стандартной РКТ и РКТ с мультипланарной реконструкцией ПОКАЗАТЕЛЬ Стандартная РКТ РКТ с N - 120 мультипланарной реконструкцией N - 109 ЧУВСТВИТЕЛЬНОСТЬ 100,0% 100,0% СПЕЦИФИЧНОСТЬ ОБУЧАЮЩАЯ ВЫБОРКА 92,3% 87,5% ТОЧНОСТЬ 95,0% 92,7% ЧУВСТВИТЕЛЬНОСТЬ 100,0% ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА 100,0% СПЕЦИФИЧНОСТЬ 96,0% 85% ТОЧНОСТЬ 97,6% 91,9% Как видно из таблицы 19 показатели чувствительности, как стандартной РКТ, так и РКТ с мультипланарной реконструкцией сопоставимы между собой. Оба метода имеют высокую точность в определении группы позвонков с патологическими переломами на фоне остеопороза. В определении группы позвонков с патологическими переломами на фоне опухолевого поражения в данных методах выявляется ряд ограничений, а именно их гиподиагностика. Ошибочное отнесение объектов в группу с «неопухолевыми» переломами наблюдалось в тех случаях, когда при РКТ-исследовании либо костная деструкция четко не определялась вследствие морфологических особенностей поражения костной системы, либо когда отсутствовали такие высокоинформативные признаки как смешанная деструкция с преобладанием литического компонента, истончение, вздутие и разрушение коркового слоя, 81 сужение позвоночного канала и межпозвонковых отверстий. При этом признаки, характерные для гемангиом, такие как симптом «горошка», вертикальная исчерченность, ячеистая деструкция, фестончатые контуры и жировые включения, имели низкие весовые коэффициенты, что вероятнее всего связано с малым количеством наблюдений. В доступной нам литературе полноценных исследований с определением информативности РКТ в дифференциальной диагностике патологических переломов позвонков найдено не было. При анализе информативности отдельно взятых признаков следует отметить следующее. В нашем исследовании в соответствии с данными Sattari et al. [45] разрушение коркового слоя и в соответствии с данными Laredo et al. [46] деструкция губчатой кости позвонка являются высокоинформативными признаками опухолевого характера перелома. При этом в противовес результатам вышеупомянутых авторов в настоящем исследовании внекостный компонент оказался малоинформативным признаком для дифференциальной диагностики патологических переломов позвонков, что вероятнее всего связано с несколько большей встречаемостью «опухолевых» переломов без формирования паравертебральных масс в нашем исследовании. В отличие от литературных источников [46] костные отломки по нашим данным в большей степени являются признаком «опухолевого» перелома, что вероятнее всего связано с большим количеством переломов позвонков с выраженным снижением высоты тела. Линия перелома, которая по данным Sattari et al. относится к характерным признакам «остеопорозной» деформации, в нашем исследовании является неинформативным критерием. «Внутрипозвонковый вакуум-феномен», также как и в результатах Stabler et al., характерен для «неопухолевых» переломов с достаточно высоким ВКИ. Как видно из таблицы 19 сама по себе мультипланарная реконструкция не повышает точность дифференциальной диагностики патологических переломов позвонков. Специфичность РКТ с мультипланарной реконструкцией ниже таковой аксиальной РКТ, что связано с разным количеством наблюдений и 82 повторением одних и тех же «ошибок» классификации объекта для обоих методов. При исключении из сравнительного анализа 11 позвонков с патологическими переломами, которым не выполнена мультипланарная реконструкция, показатели специфичности выравниваются и составляют 85-88% для обоих методов (таблица 20). Таблица 20. Сводные данные показателей информативности стандартной РКТ и РКТ с мультипланарной реконструкцией ПОКАЗАТЕЛЬ Стандартная РКТ РКТ с N - 109 мультипланарной реконструкцией N - 109 ЧУВСТВИТЕЛЬНОСТЬ 100,0% ОБУЧАЮЩАЯ ВЫБОРКА 100,0% СПЕЦИФИЧНОСТЬ 87,5% 87,5% ТОЧНОСТЬ 92,7% 92,7% ЧУВСТВИТЕЛЬНОСТЬ 100,0% ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА 100,0% СПЕЦИФИЧНОСТЬ 85% 85% ТОЧНОСТЬ 91,9% 91,9% Однако мультипланарная реконструкция способствует выявлению снижения высоты тела позвонка как такового, что при стандартной РКТ крайне затруднено. По нашим данным перелом тела позвонка при выполнении РКТ только в аксиальной проекции можно предположить в случае увеличения его площади за счет паравертебрального распространения костных отломков. В проведенном исследовании из 120 позвонков с патологическими переломами данный симптом выявлялся в 66 случаях (55%). Из этого следует, что при выполнении РКТ только в аксиальной проекции в 54 случаях (45%) снижение высоты тел позвонков осталось бы не диагностированным. Полученные результаты соответствуют данным литературы [50]. 83 а б в а г б д в е г д е Рис. 10 Рентгеновская компьютерная томография а-в. Больная И., 73 лет. Без онкологического анамнеза. Направительный диагноз: Патологические переломы позвонков на фоне опухолевого поражения? Заключение «решающего правила»: Патологические переломы тела Th11-L4 позвонков на фоне остеопороза. Тело Th11 позвонка со смешанной деформацией (-68) с признаками субкортикального уплотнения костной структуры (+170). Признаков истончения (+238), вздутия (+20), разрушения коркового слоя (+191), наличия смешанной (+78) деструкции не выявлено. Очагов деструкции в других позвонках зоны исследования (+80) не выявлено. Позвоночный канал сужен (-117) за счет костных отломков (-86). Межпозвонковые отверстия интактны (+99). Определяется диффузное снижение плотности всех позвонков в зоне исследования (+80) и симптом «вертикальной исчерченности» во всех позвонках зоны исследования (+97). Сумма ВКИ «решающего правила» составила (+782). Тело Th12 позвонка со смешанной деформацией (-68) с признаками субкортикального уплотнения костной структуры (+170). Признаков истончения (+238), вздутия (+20), разрушения коркового слоя (+191), наличия смешанной (+78) деструкции не выявлено. Очагов деструкции в других позвонках зоны исследования (+80) не выявлено. Позвоночный канал сужен (-117) за счет костных отломков (-86). Межпозвонковые отверстия интактны (+99). Определяется диффузное снижение плотности всех позвонков в зоне 84 исследования (+80) и симптом «вертикальной исчерченности» во всех позвонках зоны исследования (+97). Сумма ВКИ «решающего правила» составила (+782). Тело L1 позвонка со смешанной деформацией (-68) с признаками субкортикального уплотнения костной структуры (+170). Признаков истончения (+238), вздутия (+20), разрушения коркового слоя (+191), наличия смешанной (+78) деструкции не выявлено. Очагов деструкции в других позвонках зоны исследования (+80) не выявлено. Позвоночный канал сужен (-117) за счет костных отломков (-86). Межпозвонковые отверстия интактны (+99). Определяется диффузное снижение плотности всех позвонков в зоне исследования (+80) и симптом «вертикальной исчерченности» во всех позвонках зоны исследования (+97). Сумма ВКИ «решающего правила» составила (+782). Тело L2 позвонка с деформацией по типу «рыбьего позвонка» (+136) с признаками субкортикального уплотнения костной структуры (+170). Признаков истончения (+238), вздутия (+20), разрушения коркового слоя (+191), наличия смешанной (+78) деструкции не выявлено. Очагов деструкции в других позвонках зоны исследования (+80) не выявлено. Позвоночный канал (+99) и межпозвонковые отверстия интактны (+99). Определяется диффузное снижение плотности всех позвонков в зоне исследования (+80) и симптом «вертикальной исчерченности» во всех позвонках зоны исследования (+97). Сумма ВКИ «решающего правила» составила (+1288). Тело L3 позвонка с деформацией по типу «рыбьего позвонка» (+136) с признаками субкортикального уплотнения костной структуры (+170). Признаков истончения (+238), вздутия (+20), разрушения коркового слоя (+191), наличия смешанной (+78) деструкции не выявлено. Очагов деструкции в других позвонках зоны исследования (+80) не выявлено. Позвоночный канал (+99) и межпозвонковые отверстия интактны (+99). Определяется диффузное снижение плотности всех позвонков в зоне исследования (+80) и симптом «вертикальной исчерченности» во всех позвонках зоны исследования (+97). Сумма ВКИ «решающего правила» составила (+1288). Тело L4 позвонка с деформацией по типу «рыбьего позвонка» (+136) без признаков субкортикального уплотнения костной структуры (-81). Признаков истончения (+238), вздутия (+20), разрушения коркового слоя (+191), наличия смешанной (+78) деструкции не выявлено. Очагов деструкции в других позвонках зоны исследования (+80) не выявлено. Позвоночный канал (+99) и межпозвонковые отверстия интактны (+99). Определяется диффузное снижение плотности всех позвонков в зоне исследования (+80) и симптом «вертикальной исчерченности» во всех позвонках зоны исследования (+97). Сумма ВКИ «решающего правила» составила (+1037). Сумма ВКИ «решающего правила» всех позвонков больше порогового значения, что позволяет отнести их в группу переломов на фоне остеопороза. Данный случай является истиноположительным результатом. 85 г-е. Больной К.,41 год. Рак почки. Направительный диагноз: Метастатическое поражение L1 позвонка? Патологический перелом. Заключение «решающего правила»: Патологический перелом на фоне опухолевого поражения. Тело L1 позвонка с боковой клиновидной деформацией (-262). В теле указанного позвонка определяется зона литической деструкции с истончением (224) и разрушением коркового слоя (-287), которая имеет нечеткие контуры (297) и занимает 2/3 тела позвонка (-225). Позвоночный канал (-117) и межпозвонковые отверстия (-154) сужены. Вертикальной исчерченности (-215), снижения плотности тел позвонков в зоне исследования (-181), субкортикального уплотнения костной структуры (-91) не выявлено. Очаги деструкции в других позвонках зоны исследования не определяются (+80). Сумма ВКИ «решающего правила» составила (-1973). Сумма ВКИ «решающего правила» меньше порогового значения, что позволяет отнести его в группу переломов на фоне опухолевого поражения. Данный случай является истиноотрицательным результатом. 86 3.4 Информативность стандартной магнитно-резонансной томографии в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков Для разработки семиотики стандартной магнитно-резонансной томографии для дифференциальной диагностики «опухолевых» и «неопухолевых» деформаций проанализированы данные 147 позвонков с патологическими переломами. Из них - 49 остеопорозного характера (33%) и 98 опухолевого (67%). Для создания «решающего правила» в «обучающую выборку» были включены данные 97 позвонков с патологическими переломами позвонков. Из них – 32 остеопорозного характера и 65 опухолевого. Из 31 разработанного признака, нами отобраны 21 наиболее информативные, на основе которых было сформировано «решающее правило». Пороговое значение разграничения групп позвонков с «опухолевыми» и «неопухолевыми» переломами составило 0. Признаки, характерные для группы позвонков с «опухолевыми» переломами, имеют значение меньше порогового (0), а для группы позвонков с «неопухолевыми» переломами больше или равное пороговому (≥0). 87 Таблица 21. Признаки стандартной магнитно-резонансной томографии с их ВКИ Позвонки с Признак Позвонки с «опухолевыми» «неопухолевыми» переломами переломами Статика позвоночника -84 Подвывих/смещение +48 Вновь сформированный кифоз/сколиоз -19 Нет нарушения статики Вид деформации тела позвонка +137 Передняя клиновидная -58 Задняя клиновидная +87 «Рыбий» позвонок +11 «Crush» - деформация -58 Смешанная -212 Боковая -89 «Vertebra plana» Отек/инфильтрация костного мозга тела поломанного позвонка -127 Тотальный +413 «Линейный» -116 Очаговый +215 Не определяется Размеры опухолевого очага -323 Все тело позвонка -166 ½ тела позвонка -97 2/3 тела позвонка -154 Множественные очаги в одном позвонке +304 Не определяется Опухолевые очаги в других позвонках -38 Да, единичные -194 Да, множественные -194 Инфильтрация костного мозга +123 Нет Солидная структура очагов -234 Да +286 Нет Некроз в теле поломанного позвонка -2 Отграниченный -264 Диффузный -141 Отграниченный + диффузный +38 Нет Патологические сосуды 88 -193 -56 -292 -173 -127 -191 -357 -185 -119 -84 -202 -62 -259 -239 -94 -170 -165 Да Нет Включения пониженного МР-сигнала в смежных межпозвонковых дисках Да Нет Невозможно оценить Состояние заднего комплекса позвонка Одностороннее поражение Двустороннее поражение Не изменен Состояние позвоночного канала Интактен Сужен Состояние межпозвонковых отверстий Интактны Сужены Внекостный компонент Да Нет Состояние дурального мешка Врастание опухоли Сдавление Не вовлечен Структура спинного мозга Гидромиелия Ишемия Не изменена Наличие костных отломков Да Нет Невозможно оценить Распространение опухоли на смежные позвонки Да Нет Жировая конверсия костного мозга «Жировые островки» Тотальная Не определяется Невозможно оценить Географический рисунок Только в пораженном позвонке +12 +21 +165 +169 +83 +86 +102 +99 +16 +89 +21 +34 +63 89 -106 -155 -300 -15 -57 -194 -234 Тотальный Нет Границы опухоли Четкие Нечеткие Фестончатые Не определяются Невозможно оценить Перифокальный отек Да Нет Невозможно оценить +12 +374 +89 Как показано в таблице 21 для группы позвонков с патологическими переломами на фоне остеопороза наибольшей информативностью обладал признак «линейный» отек костного мозга тела поломанного позвонка с ВКИ (+413). Далее в порядке убывания информативности следовали: отсутствие опухоли в теле поломанного позвонка при оценке границ предполагаемого очага с ВКИ (+374), отсутствие опухоли при оценке размеров предполагаемого очага (+304), отсутствие опухоли при оценке солидной структуры предполагаемого очага (+286), неизмененный задний комплекс позвонка (+169), передняя клиновидная деформация тела поломанного позвонка (+137), отсутствие очагов в других позвонках (+123), отсутствие внекостного компонента (-102). Наименее информативным признаком оказалась «crush»-деформация тела поломанного позвонка (+11). Для группы позвонков с патологическими переломами на фоне опухолевого поражения наибольшей информативностью обладал признак наличия внекостного компонента с ВКИ (-357). Далее в порядке убывания информативности следовали: поражение всего тела позвонка (-323), нечеткие границы опухоли (-300), одностороннее поражение заднего комплекса позвонка (-293), диффузный характер некроза в теле поломанного позвонка (-264), распространение опухоли на смежные позвонки (-239), солидная структура очагов (-234), боковая 90 клиновидная деформация тела позвонка (-212), ишемические нарушения спинного мозга (-202). Наименее информативным признаком оказался отграниченный характер некроза в теле поломанного позвонка (-2). Для уточнения информативности «решающего правила» сформирована «экзаменационная выборка», которая включала в себя данные 50 позвонков с патологическими переломами. Из них – 17 позвонков с переломами остеопорозного характера и 33 - опухолевого. Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 22. Таблица 22. Показатели информативности стандартной магнитно-резонансной томографии ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 98,1% 100% ПЦПР СПЕЦИФИЧНОСТЬ ПЦОР ТОЧНОСТЬ 87,2% 89,5% 92,8% 93,4% 98,9% 97,3% 100,0% 98,0% Как показано в таблице 22 показатели чувствительности и специфичности в «обучающей» и «экзаменационной» выборках сопоставимы между собой и составляют 98%-100% и 92%-94% соответственно. При этом, также как и в других методах исследования, отмечаются более высокие показатели чувствительности, что свидетельствует о более высокой точности МРТ в определении группы позвонков с переломами на фоне остеопороза. Ошибка отнесения объекта возникла в «обучающей выборке», когда определялась тотальная инфильтрация костного мозга всех позвонков в зоне исследования и единичные мелкие очаги в деформированном позвонке, которые сами по себе не могли привести к перелому. Это было расценено «решающим правилом» как развитие метастатического поражения в ранее деформированном на фоне остеопороза позвонке. Специфичность данного метода, т.е. возможность определять группу позвонков с патологическими переломами на фоне опухолевого поражения, несколько ниже. Причиной ошибочного отнесения объектов в группу «остеопорозных» переломов 91 являлось отсутствие высокоинформативных признаков опухолевого характера переломов, таких как наличие внекостного компонента, нечеткие границы деструкции, поражение заднего комплекса, диффузный характер некроза в теле поломанного позвонка. В случаях деформаций позвонков на фоне гемангиом, помимо отсутствия вышеописанных критериев, признак наличия жировых включений патогномоничных для данной патологии, оказался малоинформативным. Это вероятнее всего связано с малым количеством наблюдений. В доступной нам литературе только в одном исследовании приведены показатели чувствительности и специфичности МРТ в дифференциальной диагностике патологических переломов позвонков, которые составляют 97% и 94% соответственно [60]. В нашем исследовании показатель чувствительности несколько выше и достигает 100%, в то время как специфичность сопоставима с результатами вышеупомянутого исследования. При анализе информативности отдельно взятых признаков следует отметить следующее. В соответствии с данными Lori et al. [51], Cuenod et al. [52], Moulopoulos et al. [53], по нашим результатам признак «линейного» отека костного мозга оказался высокоинформативным для «остеопорозных» переломов, в то время как наличие костных отломков, напротив, более характерно для «опухолевых» переломов. Это, вероятнее всего, связано с большим количеством деформаций 3 степени в анализируемых нами группах. Внутрипозвонковый вакуум-симптом, патогномоничный для «остеопорозных» переломов [55,56], в нашем исследовании оказался неинформативным. Как по результатам проведенной нами работы, так и по данным Cuenod et al. [52], наличие внекостного компонента и поражение заднего комплекса позвонка являются высокоинформативными признаками «опухолевого» перелома. 92 T2 cor T1 sag T2 sag а б в T1 sag T2 sag T2 FS sag д е а ж T2 tra C4 T2 tra Th 9 з и T2 FS sag г Рис. 11 Стандартная магнитно-резонансная томография а-г. Больная Л., 74 года. Без онкологического анамнеза. Направительный диагноз: Патологические переломы позвонков на фоне опухолевого поражения? Заключение «решающего правила»: Патологические переломы тела L1, L5 позвонков на фоне остеопороза. Тело L1 позвонка с передней клиновидной деформацией (+137) с формированием вторичного сколиоза (+48) в сегментах Th12-L2. Отек костного мозга тела поломанного позвонка не определяется (+215). Опухолевые очаги в теле поломанного позвонка (+304) и в других позвонках зоны исследования не определяются (+123). Задний комплекс указанного позвонка не изменен (+169) Сумма ВКИ «решающего правила» составила (+996). 93 Тело L5 позвонка с деформацией по типу «рыбьего позвонка» (+87). Определяется тотальный отек тела поломанного позвонка (-127), при этом признаков очагового поражения (+304) как в теле поломанного позвонка, так и в других позвонках зоны исследования (+123) не выявлено. Задний комплекс тела позвонка не изменен (+169). Позвоночный канал (-127) и межпозвонковые отверстия (-191) сужены за счет костных отломков (-62), при этом внекостного компонента не выявлено (+102). Сумма ВКИ «решающего правила» составила (+278). Сумма ВКИ «решающего правила» всех позвонков больше порогового значения, что позволяет отнести их в группу переломов на фоне остеопороза. Данный случай является истиноположительным результатом. д-и. Больная К.,55 год. Рак тела матки. Направительный диагноз: Метастатическое поражение С4, Th1, Th9 позвонков? Патологические переломы С4, Th9 позвонков. Заключение «решающего правила»: Патологические переломы на фоне опухолевого поражения. Тело С4 позвонка с деформацией по типу «vertebra plana» (-89) с ретролистезом С4 (-84). Определяется тотальное поражение тела позвонка (-323) опухолью солидой структуры (-234) с распространением на задний комплекс тела позвонка (-292) и формированием внекостного компонента (-357). Внекостный компонент суживает позвоночный канал (-127), межпозвонковые отверстия (-191) и распространяется на смежные уровни (-239). Сумма ВКИ «решающего правила» составила (-1936). Тело Th9 позвонка с боковой клиновидной деформацией (-212). В теле указанного позвонка определяется опухоль солидной структуры (-234) с признаками диффузного некроза (-264), которая занимает все тело позвонка (-323) и распространяется на задний комплекс (-292) с формированием внекостного компонента (-357). Внекостный компонент суживает позвоночный канал (-127) и межпозвонковые отверстия (-191). Сумма ВКИ «решающего правила» составила (-2000). Сумма ВКИ «решающего правила» всех позвонков меньше порогового значения, что позволяет отнести их в группу переломов на фоне опухолевого поражения. Данный случай является истиноотрицательным результатом. 94 3.5 Информативность методики магнитно-резонансной томографии с динамическим контрастированием (МРТ-ДК) в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков Для разработки семиотики магнитно-резонансной томографии с динамическим контрастированием «неопухолевых» для дифференциальной деформаций диагностики проанализированы данные «опухолевых» и 51 с позвонка патологическими переломами. Из них - 22 остеопорозного характера (43%) и 29 опухолевого (57%). Для создания «решающего правила» в «обучающую выборку» были включены данные 34 позвонков с патологическими переломами. Из них – 19 остеопорозного характера и 15 опухолевого. Из 12 разработанных признаков, нами отобраны 9 наиболее информативных, на основе которых было сформировано «решающее правило». Пороговое значение разграничения групп позвонков с «опухолевыми» и «неопухолевыми» переломами составило 0. Признаки, характерные для группы позвонков с «опухолевыми» переломами, имеют значение меньше порогового (0), а для группы позвонков с «неопухолевыми» переломами больше или равное пороговому (≥0). 95 Позвонки с «опухолевыми» переломами -108 -113 -52 -118 -84 -90 -193 -145 -94 -225 -105 -70 -150 Таблица 23. Признаки магнитно-резонансной томографии с динамическим контрастированием с их ВКИ Признак Позвонки с «неопухолевыми» переломами Характер контрастирования позвонка с патологическим переломом Диффузное однородное Диффузное неоднородное Очаговое +306 Субкортикальное Характер контрастирования других позвонков Диффузное Очаговое По периферии очага +130 Не определяется Тип кривой всего позвонка с патологическим переломом +210 I тип +56 II тип +84 III тип IVa тип IVб тип V тип Тип кривой наиболее контрастируемого участка +195 I тип +15 II тип +147 III тип IVа тип IVб тип V тип Время начала контрастирования наиболее контрастируемого участка по сравнению с аортой 1-3 сек +43 4-6 сек +94 7-9 сек +204 10 сек и более +65 Нет контрастирования Максимальное накопление всего позвонка (E max%) 96 -124 -15 -35 -145 -89 -153 -40 -44 +82 1-150 151-300 301 и более Нет контрастирования «Крутизна» кривой всего позвонка (Steepest Slope %/сек) 1-10 11-20 21 и более Нет контрастирования Средняя интенсивность контрастирования всего позвонка (Mean) 1-25 26-40 41 и более Средняя интенсивность контрастирования наиболее контрастируемого участка (Mean) 1-30 31-60 61 и более +60 +36 +107 +141 +135 Как показано в таблице 23 для группы позвонков с патологическими переломами на фоне остеопороза наибольшей информативностью обладал признак субкортикальное контрастирование позвонка с патологическим переломом с ВКИ (+306). Далее в порядке убывания информативности следовали: I тип всего позвонка с ВКИ (+210), начала контрастирования позвонка более 10 секунд от начала контрастирования аорты (+204), I тип кривой наиболее контрастируемого участка (+195), III тип кривой наиболее контрастируемого участка (+147), средняя интенсивность контрастирования 25%/сек (+141), средняя интенсивность всего позвонка 1- контрастирования наиболее контрастируемого участка 1-30%/сек (+135), отсутствие контрастирования в других позвонках (+130). Наименее информативным признаком оказался II тип кривой наиболее контрастируемого участка (+15). Для группы позвонков с патологическими переломами на фоне опухолевого поражения наибольшей информативностью обладал признак IVа тип кривой 97 наиболее контрастируемого участка с ВКИ (-225). Далее в порядке убывания информативности следовали: IVа тип кривой всего позвонка (-193), средняя интенсивность контрастирования всего позвонка больше 41 (-153), время начала контрастирования наиболее контрастируемого участка по сравнению с аортой в пределах 3 секунд (-150), «крутизна» кривой всего позвонка более 21%/сек и IVб тип кривой всего позвонка (-145), максимальное накопление Emax всего позвонка от 151 до 300% (-124). Наименее информативным признаком оказалась максимальная интенсивность (Emax) всего позвонка более 301% (-15). Для уточнения информативности «решающего правила» сформирована «экзаменационная выборка», которая включала в себя данные 17 позвонков с патологическими переломами. Из них – 3 позвонка с переломами остеопорозного характера и 14 - опухолевого. Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 24. Таблица 24. Показатели информативности магнитно-резонансной томографии с динамическим контрастированием ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 95,0% 100% ПЦПР СПЕЦИФИЧНОСТЬ ПЦОР ТОЧНОСТЬ 100,0% 60,0% 100,0% 85,7% 93,7% 97,1% 100,0% 88,2% Как показано в таблице 24 в «обучающей» выборке показатель специфичности превышает показатель чувствительности и составляет 100%, что свидетельствует о преимуществе данной методики в выявлении группы позвонков с переломами на фоне опухолевого поражения. Более низкую специфичность (85,7%) в «экзаменационной» выборке можно объяснить небольшим количеством наблюдений (3 позвонка) в группе позвонков с переломами на фоне остеопороза и их правильной классификацией во всех случаях. Тем не менее, МРТ-ДК показало высокую информативность в выявлении позвонков с деформациями на фоне 98 опухолевого поражения, когда анатомо-топографических методов оказалось недостаточно для установления этиологии перелома. Особенно следует отметить те случаи, в которых опухолевое поражение развилось на фоне ранее существующей деформации позвонка, и те, в которых очаговое поражение позвонка сопровождается тотальной инфильтрацией костного мозга всех позвонков в зоне исследования. В нашем исследовании все признаки МРТ-ДК (качественные, полуколичественные и количественные) оказались информативными для определения этиологии перелома позвонка. Таким образом, результаты настоящей работы расходятся с литературными данными [81, 82], в которых наиболее информативными оказывались либо тип кривой, либо «крутизна» кривой Steepest Slope (SS). Это, вероятнее всего, связано с включением в наше исследование дополнительных признаков, таких как качественное распределение КВ в теле позвонка с патологическим переломом и других позвонках зоны исследования, время начала контрастирования позвонка по сравнению с аортой и средняя интенсивность накопления КВ в теле позвонка с патологическим переломом, которые показали высокую информативность. В работах упомянутых авторов данные критерии не проанализированы. 99 0с сек T2FS sag а б 10 с сек 5с в г 15 с сек д е L2 ж L3 з и 0с к 1с 3с 6с T2FS sag л м н о п р L4 Th9 с т у ф 100 Рис. 12. Магнитно-резонансная томография с динамическим контрастированием а-к. Больная И., 75 лет. Рак молочной железы. Направительный диагноз: Метастатическое поражение? L2, L3 позвонков Патологический перелом L2. Заключение «решающего правила»: Патологический перелом тела L2 позвонка и нарастающая компрессия тела L3 позвонка на фоне остеопороза. а. МР-исследование поясничного отдела позвоночника в сагиттальной проекции, Т2 FS. Определяется деформация 3 степени по типу «рыбьего позвонка» тела L2 позвонка с признаками слабовыраженного диффузного отека костного мозга. Признаков очагового поражения указанного позвонка не выявлено. В передних отделах тела L3 позвонка определяется зона повышенного МР-сигнала в Т2 FS с нечеткими контурами и горизонтальная линия пониженного МР-сигнала (перелом?). б-е. Повторяющиеся серии динамического исследования с субтракцией (вычитание первой серии из последующих), Т1 ВИ. Представлено пять последовательных субтракционных серий динамической магнитно-резонансной томографии, где отображаются только те структуры, которые накапливают контрастное вещество. Исследование выполнено в сагиттальной проекции с длительностью каждой серии по 1,5 с. Отмечается отсроченное контрастирование опухоли в пределах до 10 с от начала появления контрастного вещества (КВ) в аорте. Опухоль характеризуется слабоинтенсивным неравномерным накоплением КВ субкортикально как в L2, так и в L3 позвонках. ж-к. Графические кривые накопления/выведения КВ. В поле зрения отмечены 3 интересующие зоны накопления/выведения КВ для двух позвонков: красным цветов выделена аорта (IVa тип кривой), желтым – наиболее контрастируемый участок L2 позвонка (III тип кривой) и L3 позвонка (V тип кривой), зеленым – весь L2 позвонок (III тип кривой) и весь L3 позвонок (II тип кривой). Сумма ВКИ «решающего правила» составила для L2 позвонка (+825), для L3 позвонка (+475), что позволяет отнести оба позвонка в группу переломов на фоне остеопороза. Данный случай является истиноположительным результатом. л-ф. Больная Ф.,32 год. Рак молочной железы. Направительный диагноз: Метастатическое поражение грудного и поясничного отделов позвоночника. Патологические переломы Th9, L4 позвонков. Заключение «решающего правила»: Патологические переломы на фоне опухолевого поражения. л. МР-исследование поясничного отдела позвоночника в сагиттальной проекции, Т2 FS. Определяются переломы 3 степени со смешанной деформацией тел Th9, L4 позвонков на фоне опухоли неоднородной солидной структуры с разрушением коркового слоя и формированием небольших размеров внекостного 101 компонента. Определяются множественные очаги в остальных позвонках зоны исследования. м-р. Повторяющиеся серии динамического исследования с субтракцией (вычитание первой серии из последующих), Т1 ВИ. Представлено пять последовательных субтракционных серий динамической магнитно-резонансной томографии, где отображаются только те структуры, которые накапливают контрастное вещество. Исследование выполнено в сагиттальной проекции с длительностью каждой серии по 1,5 с. Отмечается ранее контрастирование пораженных позвонков в том числе с патологическими переломами в пределах до 1 с от начала появления контрастного вещества (КВ) в аорте. Очаги характеризуется высокоинтенсивным неравномерным накоплением КВ. с-ф. Графические кривые накопления/выведения КВ. В поле зрения отмечены 3 интересующие зоны накопления/выведения КВ для двух позвонков с патологическими переломами: красным цветов выделена аорта (IVa тип кривой), желтым – наиболее контрастируемый участок Th9 позвонка (IVa тип кривой) и L4 позвонка (IVb тип кривой), зеленым – весь Th9 позвонок (IVa тип кривой) и весь L4 позвонок (IVb тип кривой). Сумма ВКИ «решающего правила» составила для Th9 позвонка (-1115), для L4 позвонка (-885), что позволяет отнести оба позвонка в группу переломов на фоне опухолевого поражения. Данный случай является истиноотрицательным результатом. 102 3.6 Диагностическая ценность методики диффузионно-взвешенной магнитно-резонансной томографии (ДВ-МРТ) в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков Проанализированы данные 17 позвонков с патологическими переломами. Из них: 7 переломов на фоне остеопороза, и 10 переломов на фоне опухолевого поражения. Нами не выявлено статистически достоверных различий между показателями ИКД для групп позвонков с «остеопорозными» переломами и групп позвонков с «опухолевыми» переломами. Общие данные по анализируемым объектам представлены в таблице 25. Таблица 25. № 1 Значение параметров ИКД Группа* 2 ИКД мм2/с 965 2 1 1338 3 1 1380 4 5 6 7 8 9 10 11 12 13 14 15 16 17 2 1 1 1 2 2 2 2 2 2 1 2 2 1 1621 1117 1347 970 943 835 1424 1324 1692 1466 1961 866 1233 880 * группа 1 – позвонки с «остеопорозными» переломами группа 2 – позвонки с «опухолевыми» переломами Как видно из таблицы 25 определяется широкий разброс показателей ИКД как для группы позвонков с переломами на фоне остеопороза, так и для группы «опухолевых» переломов. Для группы «остеопорозных» переломов данный параметр имел значения 880-1961 мм2/с, для «опухолевых» переломов – 835-1692 103 мм2/с. Подобный разброс показателей ИКД в случае «остеопорозных» деформаций можно объяснить разной «давностью» их возникновения и как следствие разной интенсивностью реактивного отека костного мозга и выраженностью грануляционной ткани. Чем более «свежий» перелом, тем выше значение ИКД. В одном случае со значением ИКД 1961 мм2/с в теле поломанного позвонка определялось развитие вторичного некроза в результате ишемических нарушений. Разброс показателей ИКД во второй группе можно объяснить разнородностью гистологических типов опухоли и, соответственно, разными степенями васкуляризации очага, соотношением клеточного состава и межклеточной жидкости. Полученные результаты несколько расходятся с данными литературы. Zhou et al., Chan et al., Herneth et al. выявили, что при доброкачественных переломах ИКД имеет высокие значения, в то время как опухолевые переломы наоборот более низкие [101-103]. Подобные различия можно объяснить, тем, что в данных работах анализировались преимущественно «свежие» «остеопорозные» переломы позвонков давностью не более 4 недель. 3.7 Диагностическая ценность методов ядерной медицины в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков Проанализированы данные планарной остеосцинтиграфии 116 позвонков с патологическими переломами. Из них: 36 (31%) переломов на фоне остеопороза, и 80 (69%) переломов на фоне опухолевого поражения. Для данной методики проанализированы следующие качественные признаки: характер распределения РФП в теле поломанного позвонка и наличие очагов накопления в других костях. Нами не выявлено статистически достоверных различий в частоте встречаемости данных признаков для группы позвонков с «остеопорозными» переломами и группы позвонков с «опухолевыми» переломами. 104 Таблица 26. Распределение встречаемости качественных признаков по группам Признак Позвонки с Позвонки с «остеопорозными» «опухолевыми» переломами переломами 1.Характер распределения РФП в позвонке с патологическим переломом 8 (22%) 17 (21%) нормальное распределение 28 (78%) 63 (79%) гиперфиксация 2. Очаги гиперфиксации РФП в других костях 20 (55%) 54 (67%) да 16 (45%) 26 (33%) нет При анализе полученных результатов необходимо отметить следующее. В обеих группах отмечалась одинаковая частота встречаемости нормального распределения и гиперфиксации РФП в позвонках с патологическими переломами. В группе позвонков с «остеопорозными» переломами это можно объяснить разной «давностью» перелома и, следовательно, выраженностью репаративных процессов. В группе позвонков с переломами на фоне опухолевого поражения выраженность фиксации РФП зависит от гистологической формы опухоли и, так же как и в первой группе, выраженностью репаративных процессов. Наличие очагов гиперфиксации РФП в других костях наблюдалось несколько чаще при «опухолевых» переломах позвонков. Однако, необходимо учитывать, что в большинстве случаев «остеопорозные» переломы имеют множественных характер. В 15 случаях патологических переломов позвонков выполнена трехфазная остеосцинтиграфия. Из них: 5 позвонков с «остеопорозными» деформациями и 10 позвонков с переломами на фоне опухолевого поражения. Сводные данные по каждому случаю перелома представлены в таблице 27. 105 № 1 Таблица 27. Значение параметров трехфазной остеосцинтиграфии Группа* % фиксации РФП в % фиксации РФП сосудистую фазу в костную фазу 2 147 257 2 2 169 459 3 1 105 128 4 5 6 7 8 9 10 11 12 13 14 15 1 1 1 2 2 2 2 1 2 2 2 2 107 137 111 130 127 90 141 126 94 100 125 125 141 198 163 180 179 163 195 150 114 122 182 182 * группа 1 – позвонки с «остеопорозными» переломами группа 2 – позвонки с «опухолевыми» переломами Как видно из таблицы 27 определяется разброс показателей фиксации РФП в сосудистую и костную фазы как для группы позвонков с переломами на фоне остеопороза, так и для группы «опухолевых» деформаций. Для группы «остеопорозных» переломов фиксация РФП в сосудистую фазу варьировала в переделах 105%-137%, в костную – 128%-198%. Для «опухолевых» переломов: в сосудистую фазу – 90%-169%, в костную – 114%-459%. Параметры количественного распределения РФП при трехфазной остеосцинтиграфии зависят: в группе «остеопорозных» переломов – от «давности» перелома и выраженности репаративных процессов в теле деформированного позвонка, в группе «опухолевых» переломов – от гистологического типа опухоли, степени ее васкуляризации (в сосудистую фазу) и способности влиять на активность ремоделирования костной ткани (в костную фазу). Необходимо отметить значимое ограничение данной методики, которое заключается в невозможности ее использования при локализации переломов в грудном и верхнепоясничном отделах позвоночника. Это обусловлено наложением сердца, аорты и высоко 106 васкуляризированных органов грудной и брюшной полостей на область интереса, что не позволяет адекватно оценивать фиксацию РФП. Другим ограничением является отсутствие полноценного элемента сравнения, поскольку и при остеопорозе множественные переломы позвонков, и при опухолевом поражении метастатические очаги в других костях достаточно распространены. В доступных нам исследованиях [107-110] отмечалась значимость этой методики как для диагностики «остеопорозных» переломов, так и для определения их давности. В противовес Buyukdereli et al., который отмечал повышение накопления РФП в 100% метастатических переломов [111], в нашей работе гиперфиксация РФП определялась только в 78% «опухолевых» деформаций. Исследований с использованием трехфазной остеосцинтиграфии в доступной нам литературе найдено не было. 3.8 Сравнительная характеристика лучевых методов и разработка алгоритма обследования для дифференциальной диагностики «опухолевых» и «остеопорозных» патологических переломов позвонков Для разработки алгоритма обследования больных с патологическими переломами анализировались данные 154 деформированных позвонков, основную долю среди которых составляли переломы на фоне остеопороза (32%) и переломы на фоне метастатического поражения при раке молочной железы – 27%. Самая многочисленная группа представлена клиническими данными – 154 наблюдения из 154 (100%). Далее по многочисленности групп в порядке убывания следовали: стандартная МРТ – 147 позвонков из 154 (95%), аксиальная РКТ – 120 позвонков (78%), РКТ с мультипланарной реконструкцией – 109 позвонков (71%), рентгенография – 106 позвонков (69%), МРТ с динамическим контрастированием – 52 позвонков (34%). Вычислялась информативность клинических данных и каждого метода лучевой диагностики на основании таких показателей как чувствительность, специфичность, точность, прогностическая ценность 107 положительного и отрицательного результатов. Чувствительность определялась как критерий определения группы позвонков с «остеопорозными» переломами, специфичность – группы позвонков с «опухолевыми» переломами. Показатели информативности различных методов лучевой диагностики вычислены на основании разработанных «решающих правил», представленных совокупностью признаков с их ВКИ, которые были получены на основании многофакторного анализа этих признаков. Для разработки алгоритма обследования больных с патологическими переломами позвонков с помощью клинической оценки, методов и методик лучевой диагностики или их сочетаний проведена сравнительная характеристика чувствительности, специфичности и точности. (Таблица 28). Таблица 28. Сравнительная характеристика показателей информативности клинических данных и лучевых методов для дифференциальной диагностики патологических переломов позвонков Методы диагностики Информативность метода Чувствительность Специфичность Точность Клинические данные без учета онкологического анамнеза Рентгенография Аксиальная РКТ N - 109 РКТ с мультипланарной реконструкцией N - 109 Стандартная МРТ Методика МРТ-ДК (качественные + количественные признаки) 93,3% 77,8% 83,8% 92,8% 100,0% 80,9% 85% 85,7% 92,7% 100,0% 85% 92,7% 100% 93,4% 98,0% 95% 100% 97,1% Сравнительная характеристика методов диагностики, представленная в таблице 28, выявила следующую закономерность. Клинические данные, рентгенография, РКТ аксиальная и с мультипланарной реконструкцией и стандартная МРТ имеют показатели чувствительности выше показателей специфичности, а следовательно в лучшей степени определяют «остеопорозные» переломы позвонков. При этом показатели чувствительности РКТ и стандартной МРТ достигают 100%. 108 Показатель специфичности стандартной МРТ имеет максимальное значение среди всех анатомо-топографических методов и составляет 93,4%. Обратная закономерность выявлена при характеристике информативности метода, отражающего функциональные изменения в опухоли. В нашем исследовании к данному методу относится методика МРТ-ДК, которая определяет характер и степень васкуляризации опухоли. Методика МРТ-ДК имеет высокий показатель специфичности по сравнению с показателем чувствительности, который достигает 100%. Поскольку МРТ-ДК является малодоступным методом в общеклинической практике, решено проанализировать два возможных алгоритма. Первый заключался в комплексном применении нескольких анатомо-топографических методов в сочетании с клинической оценкой. С этой целью проанализированы данные 65 позвонков с патологическими переломами. Из них: 26 с «остеопорозными» деформациями, 39 – с «опухолевыми» переломами. Во всех случаях проводилась клиническая оценка, выполнялись рентгенография, аксиальная РКТ, РКТ с мультипланарной реконструкцией, стандартная МРТ. На основании наиболее информативных признаков для каждого метода диагностики сформировано «общее» «решающее правило», в которое вошли 33 признака. Из них: 7 клинических, 2 рентгенологических, 5 признаков аксиальной РКТ, 10 - РКТ с мультипланарной реконструкцией, 11 МРТ признаков. В «обучающую выборку» были включены 42 позвонка с патологическими переломами: 16 с «остеопорозными» переломами и 26 – с «опухолевыми». Для уточнения информативности «решающего правила» сформирована «экзаменационная выборка», которая включала в себя данные 23 позвонков с патологическими переломами. Из них – 10 позвонков с переломами «остеопорозного» характера и 13 – «опухолевого». Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 29. 109 Таблица 29. Показатели информативности комплексного обследования с применением анатомо-топографических методов и клинической оценки при патологических переломах позвонков ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 100% 100% ПЦПР 86,7% 76,9% СПЕЦИФИЧНОСТЬ 89,7% 76,9% ПЦОР 100% 100,0% ТОЧНОСТЬ 93,7% 87,0% Как показано в таблице 29, значения чувствительности комплексного обследования, т.е. способность определять группу позвонков с патологическими переломами на фоне остеопороза сопоставима со значениями чувствительности РКТ и МРТ при их применении в отдельности и составляет 100%. Однако показатели специфичности сопоставимы с таковыми рентгенографии и компьютерной томографии, и даже незначительно ниже и составляют 77%-90%. Полученные результаты можно объяснить несколькими факторами. Во-первых, меньшее количество наблюдений в группах, анализируемых комплексно. Вовторых, при анализе ложноположительных результатов каждого метода в отдельности и их сочетанного применения обращает на себя внимание, повторение одних и тех же «ошибок» отнесения объекта, что свидетельствует об ограничении анатомо-топографических методов в определении группы позвонков с переломами на фоне опухолевого поражения. Таким образом, комплексное применение анатомо-топографических методов визуализации не повышает показатели информативности в определении групп позвонков с «остеопорозными» и «опухолевыми» переломами. Полученные результаты объясняют целесообразность анализа второго возможного алгоритма обследования. Он основан на применении наиболее информативного анатомо-топографического метода (МРТ) с высоким показателем чувствительности и функциональной методики (МРТ-ДК) с высоким показателем специфичности. Проанализированы данные 51 позвонка с 110 патологическими переломами. Из них: 22 с «остеопорозными» деформациями, 29 – с «опухолевыми» переломами. Во всех случаях проводилась стандартная МРТ и методика МРТ-ДК. На основании наиболее информативных признаков для каждого метода сформировано «общее» «решающее правило», в которое вошли 29 признаков. Из них: 20 признаков стандартной МРТ и 9 признаков МРТ-ДК. В «обучающую выборку» были включены 34 позвонка с патологическими переломами: 19 с «остеопорозными» переломами и 15 – с «опухолевыми». Для уточнения информативности «решающего правила» сформирована «экзаменационная выборка», которая включала в себя данные 17 позвонков с патологическими переломами. Из них – 3 позвонка с переломами «остеопорозного» характера и 14 – «опухолевого». Параметры информативности «обучающей» и «экзаменационной» выборок представлены в таблице 30. Таблица 30. Показатели информативности комплексного обследования с применением стандартной МРТ и методики МРТ-ДК при патологических переломах позвонков ПОКАЗАТЕЛЬ ОБУЧАЮЩАЯ ЭКЗАМЕНАЦИОННАЯ ВЫБОРКА ВЫБОРКА ЧУВСТВИТЕЛЬНОСТЬ 100% 66,7% ПЦПР 100% 50,0% СПЕЦИФИЧНОСТЬ 100% 85,4% ПЦОР 100% 92,3% ТОЧНОСТЬ 100% 82,4% Как показано в таблице 30 в «обучающей» выборке все показатели информативности составляют 100%. В «экзаменационной» выборке показатели информативности, особенно чувствительности (66,7%), ниже, что обусловлено малым количеством наблюдений (3 позвонка) в группе позвонков с патологическими переломами на фоне остеопороза. Тем не менее, показатель специфичности превышает показатель чувствительности, что свидетельствует о преимуществе сочетанного применения стандартной МРТ и МРТ-ДК в выявлении группы позвонков с переломами на фоне опухолевого поражения. 111 Таким образом, сочетание стандартной МРТ и МРТ-ДК имеет наивысшие показатели информативности, что обуславливает целесообразность применения данного алгоритма обследования в дифференциальной диагностике «опухолевых» и «остеопорозных» патологических переломов позвонков. 112 Глава 4 ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА ПАТОЛОГИЧЕСКИХ ПЕРЕЛОМОВ ПОЗВОНКОВ ПО НОЗОЛОГИЧЕСКИМ ФОРМАМ. РЕЗУЛЬТАТЫ, ОБСУЖДЕНИЕ И РАЗРАБОТКА АЛГОРИТМА ОБСЛЕДОВАНИЯ Для определения возможностей различных лучевых методов, а также клинической оценки в дифференциальной диагностике патологических переломов позвонков с уточнением типа опухоли сформированы 6 групп нозологических форм, которые представлены в таблице 31. Таблица 31 № группы Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Количество переломов позвонков в анализируемых группах Диагноз Количество позвонков Остеопороз 49 (32%) Метастазы рака молочной 41 (27%) железы Опухоли гематологической 28 (18%) природы Другие опухоли 20 (13%) Метастазы рака почки 12 (7%) Гемангиомы 4 (3%) ИТОГО 154 (100%) Клинико-анамнестические данные, рентгенологические, РКТ и МРТ признаки, характерные для «остеопорозных» переломов позвонков, представлены в предыдущей главе, поэтому в обсуждении настоящей главы мы акцентировали внимание, в первую очередь, на дифференциальной диагностике патологических переломов позвонков, вызванных различными опухолями. 113 4.1 Информативность клинико-анамнестических данных в дифференциальной диагностике патологических переломов позвонков по нозологическим формам Для создания «решающего правила» проанализированы клинико- анамнестические данные для 154 случаев патологических переломов позвонков. Среди них: 49 позвонков (32%) с остеопорозной деформацией, 41 (27%) с переломами на фоне метастазов рака молочной железы, 28 (18%) – на фоне опухолей гематологической природы, 20 (13%) – на фоне других опухолей, 12 (7%) – на фоне метастазов рака почки, 4 (3%) – на фоне гемангиом. Подход к анализу каждого перелома был обусловлен сочетанием у ряда больных деформаций позвонков различной этиологии. С учетом высокой зависимости точности отнесения объекта от наличия онкологического анамнеза и сопутствующих ему факторов, отмеченных в предыдущей главе, из 12 разработанных признаков нами отобраны 5 наиболее информативных без учета «онкологических» критериев, на основе которых было сформировано «решающее правило». При суммации коэффициентов в каждой из шести групп наименьшее значение указывает на наиболее вероятное отнесение позвонка с патологическим переломом к данной группе. 114 Таблица 32. Клинико-анамнестические признаки с их ВКИ Признак Мужской Женский Вертебралгия Вертебралгия+ радикулопатия Радикулопатия Отсутствие болевого синдрома Да Нет Да, адекватная Групп 1 Группа 2 214 12 12 Группа 3 Пол 376 2 Группа 4 62 76 Группа 5 Группа 6 31 129 33 125 40 109 Характер болевого синдрома 116 82 156 277 47 258 43 82 40 20 207 397 380 346 317 277 207 397 380 236 248 277 207 Неврологический дефицит 181 109 148 17 40 25 84 55 179 18 313 313 9 270 270 14 194 33 194 101 45 5 84 69 69 323 4 Да, неадекватная Нет 395 23 164 Да Нет 10 230 Наличие травмы в анамнезе 378 343 378 135 4 34 Сопутствующие заболевания 87 76 54 62 При анализе всех 12 признаков суммарная по всем группам частота правильной классификации объектов составила 83,2%. При анализе 5 отобранных признаков (без «онкологических» критериев) суммарная по всем группам частота правильной классификации объектов составила 63.1%. Как видно из полученных результатов, наличие онкологического диагноза, также как и при анализе двух групп, значительно влияет на правильную классификацию объекта. Для переломов позвонков на фоне остеопороза характерны следующие признаки: женский пол, болевой синдром по типу вертебралгии, отсутствие неврологического дефицита, наличие неадекватной травмы в анамнезе, наличие сопутствующих заболеваний. Для переломов позвонков на фоне метастазов рака молочной железы характерны следующие признаки: женский пол, сочетанный характер болевого 115 синдрома (вертебралгия+радикулопатия), отсутствие неврологического дефицита и травмы в анамнезе. Для переломов позвонков на фоне гематологических опухолей характерны следующие признаки: болевой синдром по типу вертебралгии или сочетанного характера и отсутствие неврологического дефицита и травмы в анамнезе. Для переломов на фоне других опухолей с поражением костной системы характерны следующие признаки: мужской пол, сочетанный характер болевого синдрома, отсутствие неврологического дефицита, травмы в анамнезе и сопутствующих заболеваний. Для переломов на фоне метастазов рака почки характерны следующие признаки: мужской пол, сочетанный характер болевого синдрома, отсутствие травмы в анамнезе и наличие сопутствующих заболеваний. Для переломов на фоне гемангиом характерны следующие признаки: мужской пол, характер болевого синдрома по типу вертебралгии, отсутствие неврологического дефицита и травмы в анамнезе. У первичных пациентов при манифестации заболевания патологическим переломом и отсутствии онкологического диагноза определение этиологии патологического перелома с уточнением типа опухоли с использованием данных признаков невозможно из-за неспецифичности клинических проявлений. Характерных особенностей болевого синдрома при переломах позвонков на фоне опухолевого поражения с учетом гистологического типа опухоли в литературе не отмечено. Боль радикулярного характера, как изолированная, так и в сочетании с вертебралгией за счет развития перелома является одним из признаков опухолевого поражения позвоночника вне зависимости от морфологической структуры [123]. Неврологический дефицит также характерен для данной патологии [124]. В нашем исследовании болевой синдром по типу вертебралгии наблюдался только при «остеопорозных» деформациях и переломах на фоне гемангиом. Для остальных групп был характерен болевой синдром смешанного характера. Неврологический дефицит в нашем исследовании 116 наблюдался преимущественно при переломах позвонков на фоне метастазов рака почки и в отдельных случаях гематологических опухолей. Неврологический дефицит при переломах позвонков на фоне остеопороза в настоящей работе не встречался. 4.2 Информативность рентгенографии в дифференциальной диагностике патологических переломов позвонков по нозологическим формам Для создания «решающего правила» стандартной рентгенографии для дифференциальной диагностики деформации позвонков с уточнением типа опухоли проанализированы данные 106 позвонков с патологическими переломами. Из них - 37 остеопорозного характера (35%), 33 с переломами на фоне метастазов рака молочной железы (31%), 15 – на фоне опухолей гематологической природы (14%), 11 – на фоне других опухолей (10%), 7 – на фоне метастазов рака почки (7%), 3 – на фоне гемангиом (3%). Из 30 разработанных признаков, нами отобраны 10 наиболее информативных, на основе которых было сформировано «решающее правило». При суммации коэффициентов в каждой из шести групп наименьшее значение указывает на наиболее вероятное отнесение позвонка с патологическим переломом к данной группе. 117 Таблица 33. Признаки стандартной рентгенографии с их ВКИ Признак Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Вид деформации тела позвонка Передняя 72 119 167 207 179 160 клиновидная Задняя клиновидная 343 280 277 207 248 230 «Рыбий» позвонок 274 280 277 277 248 230 «Crush» 204 280 207 277 248 230 деформация Смешанная 204 170 207 138 248 230 Боковая 274 170 167 207 109 230 «Vertebra plana» 343 349 277 207 248 230 Невозможно 274 211 167 207 248 160 оценить Вертикальная исчерченность («рубашка регбиста», «симптом» вельвета) выявляется Во всех позвонках 46 96 138 138 138 109 Только в пораженном 329 336 248 248 207 179 позвонке Не выявляется 150 65 87 53 69 179 Невозможно 219 267 138 248 207 109 оценить Снижение плотности (во всех позвонках) Да 12 84 101 129 125 91 Нет 256 62 78 45 55 91 Невозможно 325 333 170 239 194 160 оценить Разрушение коркового слоя пораженного позвонка Да 325 223 170 129 33 160 Нет 12 33 101 60 194 91 Невозможно 256 172 78 170 194 91 оценить Литическая деструкция в пораженном позвонке Да 325 172 239 129 55 160 Нет 12 76 60 101 125 91 Невозможно 256 102 101 101 194 91 оценить Смешанная деструкция в пораженном позвонке С преобладанием пластического 333 230 256 256 219 194 компонента С преобладанием литического 333 179 146 187 219 194 компонента В равной степени 263 230 187 256 219 194 118 Нет Невозможно оценить Одностороннее Двухстороннее Не изменен Невозможно оценить Да Нет Невозможно оценить 24 120 146 95 58 125 263 109 117 117 219 125 Распространение деструкции на задний комплекс позвонка 329 175 179 109 69 329 336 138 248 207 16 106 138 109 207 179 179 69 260 138 179 Очаги деструкции в других позвонках (без переломов) 325 93 60 239 194 8 93 129 20 33 160 51 325 80 154 109 170 138 239 194 160 Характер границы деструкции Границы не определяются Определяются нечетко Четкие Склерозированные «Фестончатые» Невозможно оценить Все тело позвонка ½ тела позвонка 2/3 тела позвонка Множественные очаги в одном позвонке Не определяется Нельзя оценить 27 204 194 194 230 138 336 182 263 154 91 207 336 336 336 204 343 343 263 263 263 194 263 263 160 230 230 207 207 207 226 66 55 102 230 138 336 336 336 Размеры деструкции 204 154 164 263 274 263 194 102 263 230 120 120 207 207 207 336 343 263 263 230 207 27 226 204 79 154 102 263 125 230 230 138 138 При анализе всех 30 признаков суммарная по всем группам частота правильной классификации объектов составила 73,9%. При анализе 10 отобранных признаков суммарная по всем группам частота правильной классификации объектов составила 73.2%. Для переломов на фоне остеопороза характерны следующие признаки: передняя клиновидная деформация тела поломанного позвонка, симптом «вельвета» во всех позвонках зоны исследования, снижение плотности костной ткани всех позвонков в зоне исследования, отсутствие разрушения коркового слоя и деструкции губчатой кости тела позвонка, неизмененный задний 119 комплекс, отсутствие очагов деструкции в других позвонках, отсутствие костной деструкции в теле при оценке границ и размеров зоны поражения в теле поломанного позвонка. Для переломов на фоне метастазов рака молочной железы характерны следующие признаки: передняя клиновидная деформация, отсутствие вертикальной исчерченности и снижения плотности и разрушения коркового слоя, как солитарная так и множественная деструкция других позвонков в зоне исследования. Для переломов на фоне гематологических опухолей характерны следующие признаки: отсутствие вертикальной исчерченности и снижения плотности в других позвонках зоны исследования, наличие очагов деструкции в других позвонках. Для переломов на фоне других опухолей с поражением костной системы характерны следующие признаки: смешанная деформация тела позвонка, отсутствие вертикальной исчерченности, снижения плотности костной ткани, разрушения коркового слоя, одностороннее или отсутствие поражения заднего комплекса, отсутствие очагов деструкции, поражение ½ тела позвонка. Для переломов на фоне метастазов рака почки характерны следующие признаки: боковая клиновидная деформация, отсутствие вертикальной исчерченности и снижения плотности костной ткани, наличие разрушения коркового слоя и литической деструкции губчатой кости, одностороннее поражение заднего комплекса, отсутствие очагов деструкции в других позвонках, нечеткая граница деструкции, поражение половины и 2/3 тела позвонка. Для переломов на фоне гемангиом характерны следующие признаки: передняя клиновидная деформация, вертикальная исчерченность во всех позвонках зоны исследования, как снижение плотности костной ткани, так и ее отсутствие, отсутствие разрушения коркового слоя, интактный задний комплекс, отсутствие очагов деструкции в других позвонках зоны исследования. 120 Поскольку при суммации коэффициентов в каждой из шести групп наименьшее значение указывает на наиболее вероятное отнесение позвонка с патологическим переломом к данной группе, то следует отметить, что, как показано в таблице 33, ряд признаков имеет минимальный ВКИ градации «невозможно оценить» для некоторых групп. Это свидетельствует об ограниченных возможностях рентгенографии в выявлении отдельных признаков и обуславливают низкую точность правильной классификации объекта. При анализе данных литературы следует отметить тот факт, что в большинстве работ патологические переломы позвонков на фоне опухолевого процесса рассматриваются как вторичное проявление болезни. Исследований, посвященных особенностям диагностики патологических переломов на фоне различных опухолевых процессов, не представлено. Таким образом, провести полноценное сопоставление полученных нами результатов с данными литературы затруднительно. Тем не менее, выявляется ряд закономерностей. Для метастазов рака почки характерен литический тип деструкции костной ткани, что соответствует нашим результатам [125]. При этом в противовес вышеупомянутым авторам, в нашем исследовании не выявлено четкого типа деструкции костной ткани при метастазах рака молочной железы, опухолях гематологической природы и других опухолях. Другие проанализированные нами признаки в качестве дифференциально-диагностических в работе данных авторов не учитываются. Для гемангиом характерна вертикальная исчерченность тела позвонка [126]. В нашем исследовании данный симптом оказался малоинформативным, что связано с малым количеством наблюдений и встречаемости этой патологии преимущественно у возрастного контингента с проявлениями остеопороза. 121 4.3 Информативность рентгеновской компьютерной томографии в дифференциальной диагностике патологических переломов позвонков по нозологическим формам 4.3.1 Информативность аксиальной рентгеновской компьютерной томографии Для создания «решающего правила» стандартной рентгеновской компьютерной томографии для дифференциальной диагностики деформации позвонков с уточнением типа опухоли проанализированы данные 120 позвонков с патологическими переломами. Из них - 38 остеопорозного характера (32%), 30 с переломами на фоне метастазов рака молочной железы (25%), 20 – на фоне опухолей гематологической природы (16%), 16 – на фоне других опухолей (13%), 12 – на фоне метастазов рака почки (10%), 4 – на фоне гемангиом (4%). Из 31 разработанного признака, нами отобраны 14 наиболее информативных, на основе которых было сформировано «решающее правило». При суммации коэффициентов в каждой из шести групп наименьшее значение указывает на наиболее вероятное отнесение позвонка с патологическим переломом к данной группе. 122 Таблица 34. Признаки аксиальной РКТ с их ВКИ Признак Да Нет Да Нет Невозможно оценить Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Снижение плотности (во всех позвонках) 5 81 60 128 85 299 58 78 32 55 Истончение коркового слоя пораженного позвонка Группа 6 69 69 232 15 18 194 19 203 30 155 14 270 84 84 302 355 313 294 270 194 Разрушение коркового слоя пораженного позвонка Да Нет Невозможно оценить 371 7 29 147 42 118 37 133 14 270 194 33 302 355 313 294 270 194 Вздутие коркового слоя пораженного позвонка Да Нет Невозможно оценить Да Нет Невозможно оценить 371 7 355 5 152 30 225 17 51 109 125 55 302 355 313 294 270 194 62 91 194 33 270 194 Литическая деструкция в пораженном позвонке 232 245 134 225 15 12 36 17 302 355 313 294 Смешанная деструкция в пораженном позвонке С преобладанием пластического компонента С преобладанием литического компонента В равной степени Нет Невозможно оценить Одностороннее Двухстороннее Не изменен Невозможно оценить Да Нет 266 181 252 304 283 219 376 47 91 74 283 219 376 17 222 251 212 102 194 125 283 26 150 81 306 361 321 304 283 219 Распространение деструкции на задний комплекс позвонка 373 53 123 69 57 373 179 61 138 116 7 163 207 160 277 207 207 47 373 289 317 299 277 207 Очаги деструкции в других позвонках (без переломов) 160 23 4 69 263 22 144 309 69 7 179 18 123 Интактны Сужены Невозможно оценить 24 176 Интактны Сужены Невозможно оценить 24 232 Да Нет Невозможно оценить Да Нет Границы не определяются Определяются нечетко Четкие Склерозированные «Фестончатые» Невозможно оценить Все тело позвонка ½ тела позвонка 2/3 тела позвонка Множественные очаги в одном позвонке Не определяется Нельзя оценить 302 210 371 5 371 120 35 Состояние позвоночного канала 99 93 115 51 57 45 270 14 33 194 270 194 270 14 33 194 294 270 194 64 86 14 270 194 33 294 270 194 Костные отломки 39 69 32 112 69 128 Характер границы деструкции 24 154 109 40 355 313 294 Состояние межпозвонковых отверстий 66 83 115 78 65 45 355 313 Внекостный компонент 55 65 91 93 355 244 25 363 325 199 289 160 309 59 117 69 109 230 239 378 378 155 363 363 164 325 325 239 309 309 81 289 289 160 120 230 309 184 95 170 289 230 309 239 378 Размеры деструкции 92 55 123 187 144 325 89 170 170 179 179 69 160 120 230 378 363 187 309 289 230 25 309 363 363 325 325 199 309 289 289 160 230 При анализе всех 31 признаков суммарная по всем группам частота правильной классификации объектов составила 79,2%. При анализе 14 отобранных признаков суммарная по всем группам частота правильной классификации объектов составила 74.7%. 124 Для переломов на фоне остеопороза характерны следующие признаки: снижение плотности костной ткани всех позвонков в зоне исследования, отсутствие истончения, разрушения или вздутия коркового слоя, отсутствие деструкции тела позвонка любого характера, неизмененный задний комплекс, интактный позвоночный канал и межпозвонковые отверстия, отсутствие очагов деструкции в других позвонках, отсутствие внекостного компонента и костных отломков. Для переломов на фоне метастазов рака молочной железы характерны следующие признаки: истончение, разрушение коркового слоя, смешанная деструкция с преобладанием литического компонента, одностороннее поражение заднего комплекса, наличие очагов в других позвонках в зоне исследования, суженый позвоночный канал, наличие внекостного компонента и костных отломков и нечеткие границы деструкции, которая занимает все тело позвонка. Для переломов на фоне гематологических опухолей характерны следующие признаки: истончение и разрушение коркового слоя, смешанная деструкция с преобладанием литического компонента с двусторонним поражением заднего комплекса, наличие очагов деструкции в других позвонках, сужение позвоночного канала и межпозвонковых отверстий за счет внекостного компонента, поражение всего тела позвонка. Для переломов на фоне других опухолей с поражением костной системы характерны следующие признаки: отсутствие снижения плотности костной ткани, истончение и разрушение коркового слоя, смешанная деструкция с преобладанием литического компонента, одностороннее поражение заднего комплекса, сужение позвоночного канала и межпозвонковых отверстий за счет внекостного компонента и костных отломков, нечеткие границы деструкции, которая занимает все тело позвонка. Для переломов на фоне метастазов рака почки характерны следующие признаки: истончение, разрушение и вздутие коркового слоя, литическая деструкция губчатой кости, одностороннее поражение заднего комплекса, 125 отсутствие очагов деструкции в других позвонках, сужение позвоночного канала и межпозвонковых отверстий за счет внекостного компонента и костных отломков, четкие границы деструкции с поражением 2/3 тела позвонка. Для переломов на фоне гемангиом характерны следующие признаки: отсутствие разрушения или вздутия коркового слоя, интактный задний комплекс, отсутствие очагов деструкции в других позвонках зоны исследования, неизмененный позвоночный канал и межпозвонковые отверстия, отсутствие внекостного компонента и костных отломков, склерозированные контуры и поражение ½ тела позвонка. Характерный для гемангиом симптом «горошка» и ячеистый тип костной деструкции оказались малоинформативными признаками за счет малого количества наблюдений в этой группе. Наибольшее количество ошибочной классификации объектов наблюдалось в группе позвонков с переломами на фоне гематологических опухолей и группе позвонков с переломами на фоне других опухолей с поражением костной системы. Это можно объяснить разными гистологическими типами новообразований, входящих в эти группы. 4.3.1 Информативность рентгеновской компьютерной томографии с мультипланарной реконструкцией Для создания «решающего правила» РКТ с мультипланарной реконструкцией для дифференциальной диагностики деформации позвонков с уточнением типа опухоли проанализированы данные 109 позвонков с патологическими переломами. Из них - 35 остеопорозного характера (32%), 22 с переломами на фоне метастазов рака молочной железы (20%), 20 – на фоне опухолей гематологической природы (18%), 16 – на фоне других опухолей (15%), 12 – на фоне метастазов рака почки (11%), 4 – на фоне гемангиом (4%). Из 31 разработанного признака, нами отобраны 19 наиболее информативных, на основе которых было сформировано «решающее правило». 126 При суммации коэффициентов в каждой из шести групп наименьшее значение указывает на наиболее вероятное отнесение позвонка с патологическим переломом к данной группе. 127 Таблица 35. Признаки РКТ с мультипланарной реконструкцией с их ВКИ Признак Подвывих/ смещение Вновь сформированный кифоз/сколиоз Нет нарушения статики Группа 1 Группа 2 Группа 3 Группа 4 Статика позвоночника Группа 5 Группа 6 253 160 244 184 270 194 59 102 49 99 91 194 99 82 118 74 62 33 Вид деформации тела позвонка Передняя клиновидная Задняя клиновидная «Рыбий» позвонок «Crush» деформация Смешанная Боковая «Vertebra plana» 79 267 168 203 294 129 373 179 336 267 329 260 244 313 294 294 239 239 194 267 150 313 294 239 96 190 174 128 212 105 226 150 174 Вертикальная исчерченность 127 73 155 38 105 54 99 99 294 129 239 239 212 373 263 Да 14 132 55 Нет 294 51 125 Невозможно 253 321 174 155 201 194 оценить Вертикальная исчерченность («рубашка регбиста», «симптом» вельвета) выявляется Во всех позвонках 10 131 69 160 138 98 Только в пораженном 366 325 317 299 277 138 позвонке Не выявляется 297 42 109 43 57 138 Невозможно 366 325 207 230 207 207 оценить Снижение плотности (во всех позвонках) Да 5 98 60 128 84 69 Нет 291 47 78 32 55 69 Уплотнение костной структуры под замыкательной пластиной Да 41 183 203 184 270 194 Нет 133 32 42 45 14 33 Невозможно 253 212 152 155 270 194 оценить Истончение коркового слоя пораженного позвонка Да 291 13 14 11 7 69 Нет 5 207 199 219 263 69 Разрушение коркового слоя пораженного позвонка Да 294 17 36 30 14 194 128 Нет Невозможно оценить 8 212 134 184 270 33 363 321 313 225 270 194 44 102 109 40 Вздутие коркового слоя пораженного позвонка Да Нет С преобладанием пластического компонента С преобладанием литического компонента В равной степени Нет Невозможно оценить Одностороннее Двухстороннее Не изменен Невозможно оценить Да Нет Интактны Сужены Интактны Сужены Да Нет Невозможно оценить 361 317 129 179 2 4 31 18 Смешанная деструкция в пораженном позвонке 299 329 252 304 283 219 368 40 102 64 283 219 368 16 190 219 212 91 235 125 283 26 150 81 299 329 321 304 283 219 Распространение деструкции на задний комплекс позвонка 366 61 138 59 57 366 146 61 160 116 8 164 207 160 277 207 207 47 366 325 248 299 277 207 263 7 179 18 263 7 18 179 263 7 18 179 51 109 125 55 155 270 194 64 86 14 270 194 33 294 270 194 24 154 109 40 289 160 Очаги деструкции в других позвонках (без переломов) 160 34 4 69 20 123 309 69 Состояние позвоночного канала 27 109 89 109 141 40 52 40 Состояние межпозвонковых отверстий 17 78 101 109 181 61 45 40 Линия перелома 144 142 152 225 37 44 49 37 253 Да Нет Невозможно оценить 363 5 Да Нет 121 35 Границы не 18 363 212 174 Внекостный компонент 38 65 127 93 321 244 Костные отломки 34 60 32 112 78 128 Характер границы деструкции 333 325 199 129 определяются Определяются нечетко Четкие Склерозированные «Фестончатые» Невозможно оценить Все тело позвонка ½ тела позвонка 2/3 тела позвонка Множественные очаги в одном позвонке Не определяется Нельзя оценить 371 84 117 78 109 230 302 371 371 125 333 333 164 325 325 199 309 309 81 289 289 160 120 230 302 172 95 170 289 230 371 271 371 Размеры деструкции 84 55 138 187 154 325 89 170 170 150 179 81 160 120 230 371 333 187 309 289 230 15 302 333 333 325 325 199 309 289 289 160 230 При анализе всех 31 признаков суммарная по всем группам частота правильной классификации объектов составила 84,5%. При анализе 19 отобранных признаков суммарная по всем группам частота правильной классификации объектов составила 83,1%. Для переломов на фоне остеопороза характерны следующие признаки: нарушение статики по типу вновь сформированного кифоза или сколиоза, передняя клиновидная деформация, вертикальная исчерченность по всех позвонках зоны исследования, снижение плотности костной ткани всех позвонков в зоне исследования, отсутствие истончения, разрушения или вздутия коркового слоя, деструкции губчатой кости тела позвонка любого характера, неизмененный задний комплекс, интактный позвоночный канал и межпозвонковые отверстия, отсутствие очагов деструкции в других позвонках, отсутствие линии перелома, внекостного компонента и костных отломков. Для переломов на фоне метастазов рака молочной железы характерны следующие признаки: отсутствие нарушения статики, смешанный тип деформации тела позвонка, отсутствие вертикальной исчерченности, снижения плотности костной ткани и субхондрального уплотнения костной структуры, 130 истончение, разрушение коркового слоя, смешанная деструкция с преобладанием литического компонента, одностороннее поражение заднего комплекса, наличие очагов в других позвонках в зоне исследования, суженый позвоночный канал, наличие внекостного компонента и костных отломков и нечеткие границы деструкции, которая занимает все тело позвонка. Для переломов на фоне гематологических опухолей характерны следующие признаки: вновь сформированный кифоз или сколиоз, деформация тела позвонка по типу “crush” или “vertebra plana”, вертикальная исчерченность во всех позвонках зоны исследования, истончение и разрушение коркового слоя, смешанная деструкция с преобладанием литического компонента с двусторонним поражением заднего комплекса, наличие очагов деструкции в других позвонках, сужение позвоночного канала и межпозвонковых отверстий за счет внекостного компонента, поражение всего тела позвонка. Для переломов на фоне других опухолей с поражением костной системы характерны следующие признаки: отсутствие нарушения статики, боковая клиновидная деформация, отсутствие вертикальной исчерченности, снижения плотности костной ткани и субкортикального уплотнения костной структуры, истончение и разрушение коркового слоя, смешанная деструкция с преобладанием литического компонента, одностороннее поражение заднего комплекса, сужение позвоночного канала и межпозвонковых отверстий за счет внекостного компонента и костных отломков, нечеткие границы деструкции, которая занимает все тело позвонка. Для переломов на фоне метастазов рака почки характерны следующие признаки: отсутствие нарушения статики позвоночника, смешанный или боковой тип деформации тела позвонка, отсутствие вертикальной исчерченности, снижения плотности, субкортикального уплотнения костной структуры, истончение, разрушение и вздутие коркового слоя, одностороннее поражение заднего комплекса, отсутствие очагов деструкции в других позвонках, сужение позвоночного канала и межпозвонковых отверстий за счет внекостного 131 компонента и костных отломков, линия перелома тела позвонка, четкие границы деструкции с поражением 2/3 тела позвонка. Для переломов на фоне гемангиом характерны следующие признаки: отсутствие нарушения статики позвоночника, передняя клиновидная или смешанная деформация тела позвонка, отсутствие разрушения или вздутия коркового слоя, субкортикального уплотнения костной структуры, интактный задний комплекс, отсутствие очагов деструкции в других позвонках зоны исследования, неизмененный позвоночный канал и межпозвонковые отверстия, отсутствие внекостного компонента и костных отломков, склерозированные контуры и поражение ½ тела позвонка. Характерный для гемангиом симптом «горошка» и ячеистый тип костной деструкции оказались малоинформативными признаками за счет малого количества наблюдений в этой группе. 4.3.3 Обсуждение результатов рентгеновской компьютерной томографии Ниже представлены сводные данные об информативности стандартной РКТ и РКТ с мультипланарной реконструкцией в дифференциальной диагностике патологических переломов позвонков по нозологическим формам. Таблица 36. Сводные данные показателей информативности стандартной РКТ и РКТ с мультипланарной реконструкцией Стандартная РКТ РКТ с мультипланарной реконструкцией Все признаки Отобранные признаки 79,2% 84,5% 74,7% 83,1% Как показано в таблице 36 точность отнесения объекта при РКТ с мультипланарной реконструкцией несколько выше, чем при аксиальной РКТ. При анализе ошибок классификации объектов следует отметить следующее. Во-первых, неправильное отнесение позвонка в соответствующую группу возникало из-за отсутствия данных о поле пациента с патологическим переломом. 132 Во-вторых, разнообразная РКТ-картина метастатического поражения позвоночника при раке молочной железы приводила к ошибочной классификации позвонка с патологическим переломом в группу опухолей гематологической природы или группу других опухолей. Обратное неверное отнесение объекта по тем же причинам также имело место. В литературе нами не найдено работ, посвященных КТ семиотике дифференциальной диагностики патологических переломов позвонков при различных нозологических формах опухолей. При анализе публикаций, посвященных отдельным типам опухолевого поражения позвоночника, следует отметить следующее. Для поражения костной системы при миеломной болезни характерны признаки: литические очаги деструкции, часть из которых имеет выраженный характер с формированием внекостного компонента, диффузная фоновая остеопения [127]. Наши результаты несколько расходятся с литературными данными, что связано с разнородностью нозологических форм в группе гематологических опухолей. Для гемангиом характерен симптом «горошка», который обусловлен поперечным срезом истонченных трабекул [128]. В нашем исследовании признаки, патогномоничные для данного типа опухолей оказались малоинформативными из-за малого количества наблюдений. 133 4.4 Информативность магнитно-резонансной томографии в дифференциальной диагностике патологических переломов позвонков по нозологическим формам Для создания «решающего правила» магнитно-резонансной томографии для дифференциальной диагностики деформации позвонков с уточнением типа опухоли проанализированы данные 147 позвонков с патологическими переломами. Из них - 49 остеопорозного характера (33%), 39 с переломами на фоне метастазов рака молочной железы (26%), 23 – на фоне опухолей гематологической природы (16%), 20 – на фоне других опухолей (14%), 12 – на фоне метастазов рака почки (8%), 4 – на фоне гемангиом (3%). Из 31 разработанного признака, нами отобраны 17 наиболее информативных, на основе которых было сформировано «решающее правило». При суммации коэффициентов в каждой из шести групп наименьшее значение указывает на наиболее вероятное отнесение позвонка с патологическим переломом к данной группе. 134 Таблица 37. Признаки магнитно-резонансной томографии с их ВКИ Признак Группа 1 Группа 2 Группа 3 Группа 4 Группа 5 Группа 6 Вид деформации тела позвонка Передняя 72 203 179 219 294 клиновидная Задняя клиновидная 402 313 340 260 294 «Рыбий» позвонок 172 273 230 219 294 «Crush» 241 244 160 329 294 деформация Смешанная 194 99 201 150 115 Боковая 333 152 179 121 86 «Vertebra plana» 292 244 160 190 294 Отек/инфильтрация костного мозга тела поломанного позвонка Тотальный 157 54 20 28 28 «Линейный» 41 376 329 317 277 Очаговый 327 98 219 179 207 Не определяется 236 376 329 317 277 Размеры опухолевого очага Все тело позвонка 398 95 76 73 144 ½ тела позвонка 398 148 194 183 173 2/3 тела позвонка 398 170 333 183 75 Множественные очаги в одном 329 170 125 252 283 позвонке Не определяется 9 378 263 212 283 Очаги в других позвонках Единичные 217 196 219 156 138 Множественные 287 42 121 317 207 Инфильтрация 327 266 65 98 277 костного мозга Не определяются 23 196 280 98 57 170 239 239 170 129 239 239 138 138 98 207 219 150 81 219 219 207 207 207 47 Солидная структура опухолевых очагов Да Нет 323 4 7 12 261 212 Жировые включения 4 309 7 263 40 109 Да Нет 323 4 232 212 309 10 12 4 Некроз в теле поломанного позвонка 194 15 40 109 Ограниченный Диффузный Сочетанный Не определяется 258 397 397 12 306 190 156 219 306 219 36 46 Патологические сосуды 207 138 317 53 277 57 138 207 207 207 207 47 Да 393 309 24 179 371 252 135 Нет 1 2 8 4 154 Распространение деструкции на задний комплекс позвонка Одностороннее 395 117 187 93 51 Двухстороннее 234 90 26 83 109 Не изменен 12 125 256 174 270 Состояние позвоночного канала Интактен 26 88 113 69 263 Сужен 162 53 38 69 7 Состояние межпозвонковых отверстий Интактны 10 66 113 78 263 Сужены 232 71 38 60 7 Внекостный компонент Да 363 57 57 38 7 Нет 1 82 82 114 263 Состояние дурального мешка Врастание 395 212 146 244 270 Сдавление 164 69 77 49 14 Не изменен 23 96 117 118 270 Костные отломки Да 131 79 86 93 51 Нет 34 109 117 105 201 Невозможно 395 154 131 134 132 оценить Жировая конверсия костного мозга «Жировые 157 156 219 179 167 островки» Тотальная 41 71 109 248 167 инволюция Не определяется 236 145 150 98 57 Невозможно 327 266 109 98 277 оценить Характер границы деструкции Четкие 398 148 194 160 75 Нечеткие 329 35 38 44 104 Фестончатые 398 378 333 321 283 Не определяются 9 378 263 321 283 Невозможно 398 378 263 252 283 оценить Перифокальный отек костного мозга Да 325 194 215 105 40 Нет 8 74 86 134 160 Невозможно 325 96 77 93 201 оценить 18 194 194 33 18 179 18 179 179 18 194 194 33 194 33 194 98 207 98 207 109 219 109 219 219 194 33 194 При анализе всех 31 признаков суммарная по всем группам частота правильной классификации объектов составила 86,0%. 136 При анализе 17 отобранных признаков суммарная по всем группам частота правильной классификации объектов составила 82.8%. Для переломов на фоне остеопороза характерны следующие признаки: передняя клиновидная деформация, «линейный» отек костного мозга, отсутствие очагов в других позвонках неизмененный задний комплекс, интактные позвоночный канал, межпозвонковые отверстия, дуральный мешок, отсутствие внекостного компонента, костных отломков, перифокального отека, тотальная жировая конверсия костного мозга. Для переломов на фоне метастазов рака молочной железы характерны следующие признаки: смешанный тип деформации тела позвонка, тотальная или очаговая инфильтрация костного мозга тела поломанного позвонка, поражение всего тела позвонка, множественные очаги в других позвонках солидной структуры, двустороннее поражение заднего комплекса истончение, сужение позвоночного канала, межпозвонковых отверстий и сдавление дурального мешка за счет внекостного компонента и костных отломков, нечеткие границы деструкции. Для переломов на фоне гематологических опухолей характерны следующие признаки: деформация тела позвонка по типу “crush” или “vertebra plana”, тотальный отек костного мозга тела поломанного позвонка, поражение всего тела позвонка, тотальная инфильтрация костного мозга тел всех позвонков, солидная структура очагов, двустороннее поражение заднего комплекса, сужение позвоночного канала и межпозвонковых отверстий и сдавление дурального мешка за счет внекостного компонента и костных отломков, нечеткие контуры очагов. Для переломов на фоне других опухолей с поражением костной системы характерны следующие признаки: боковая клиновидная деформация, тотальная инфильтрация костного мозга тела поломанного позвонка, либо отсутствие очагов в других позвонках либо тотальная инфильтрация костного мозга других позвонков в зоне исследования, солидная структура очагов, двустороннее 137 поражение заднего комплекса, сужение позвоночного канала и межпозвонковых отверстий и сдавление дурального мешка за счет внекостного компонента и костных отломков, нечеткие границы деструкции. Для переломов на фоне метастазов рака почки характерны следующие признаки: боковой тип деформации тела позвонка, тотальный отек костного мозга тела поломанного позвонка, поражение 2/3 тела позвонка, отсутствие очагов в других позвонках, солидная структура очагов с участками диффузного некроза и патологическими сосудами, одностороннее поражение заднего комплекса, сужение позвоночного канала и межпозвонковых отверстий и сдавление дурального мешка за счет внекостного компонента и костных отломков, четкие границы деструкции с периферическим отеком костного мозга. Отнесению позвонка в группу переломов на фоне гемангиом способствуют: передняя клиновидная или crush-деформация тела позвонка, очаговый отек костного мозга, поражение 2/3 тела позвонка, отсутствие очагов в других позвонках, солидная структура очагов с жировыми включениями, четкие или фестончатые границы очага. При анализе ошибок классификации объектов следует отметить следующее. Во-первых, неправильное отнесение позвонка в соответствующую группу, так же как и при РКТ, возникало из-за отсутствия данных о поле пациента с патологическим переломом. Во-вторых, разнообразная МРТ-картина метастатического поражения позвоночника при раке молочной железы приводила к ошибочной классификации позвонка с патологическим переломом в группу опухолей гематологической природы или группу других опухолей. Обратное неверное отнесение объекта по тем же причинам также имело место. Ошибочного отнесения позвонков с патологическими переломами на фоне метастазов рака почки не наблюдалось, что связано вероятнее всего с патогномоничными признаками, такими как диффузный некроз и наличие патологических сосудов в теле позвонка с патологическим переломом. 138 В доступной нам литературе представлена единственная работа, изучающая дифференциально-диагностические позвонков [60]. особенности Проанализированы данные патологических для 5 групп переломов нозологий: «остеопорозные» переломы, метастатические переломы, переломы на фоне миеломной болезни, переломы на фоне грыж Шморля, травматические переломы. Точность постановки правильного диагноза составила 94,6%. Однако, в отличие от нашего исследования, в этой работе, помимо МРТ-признаков, учитывались биохимические показатели и оценивалось функциональное состояние других органов. В отдельных публикациях, посвященных опухолевому поражению позвоночника, следует отметить следующее. Дифференциально-диагностических особенностей метастазов рака молочной железы в позвоночник не представлено. По данным Angtuaco с соавторами характеристика сигнала патологических изменений при специфическом поражении костной системы при миеломной болезни не имеет патогномоничных проявлений [127]. Однако, зачастую подобные очаги повышенного МР-сигнала в режиме с подавлением сигнала жировой ткани и пониженного в Т1 ВИ наблюдаются на фоне тотальной инфильтрации костного мозга инфильтрация костного мозга [129]. В нашем исследовании также наиболее часто тотальная выявлялась при специфическом поражении позвоночника опухолями гематологической природы. Для метастатического поражения костной системы в целом и позвоночника в частности при раке почки выявлен характерный симптом «пустого потока», частота встречаемости которого достигает 80% [130]. Данный симптом обусловлен формированием в структуре метастатического очага множественных патологических сосудов. По результатам нашего исследования этот признак оказался высокоинформативным и наблюдался только при метастазах рака почки. Для гемангиом по данным Laredo et al. характерны жировые включения. Причем, чем выраженнее жировой компонент, тем менее агрессивно клинически протекает гемангиома [131]. В нашем исследовании жировые включения выявлялось только в данном типе опухоли. 139 4.5 Сравнительная характеристика лучевых методов и разработка алгоритма обследования для дифференциальной диагностики патологических переломов позвонков по нозологическим формам Для разработки алгоритма обследования больных с патологическими переломами анализировались данные тех же 154 деформированных позвонков. Количественное распределение позвонков с патологическими переломами по методам диагностики то же, что и в предыдущей главе. Исключение составляет МРТ с динамическим контрастированием, которое в анализе 6 групп нозологий не подвергалось статистической обработке за счет малого количества наблюдений в каждой группе. Вычислялась информативность клинических данных и каждого метода лучевой диагностики на основании точности отнесения объекта в соответствующую группу. Показатели информативности различных методов лучевой диагностики вычислены на основании разработанных «решающих правил», представленных совокупностью признаков с их ВКИ, которые были получены на основании многофакторного анализа этих признаков. Для разработки алгоритма обследования больных с патологическими переломами позвонков с помощью клинической оценки и методов лучевой диагностики или их сочетаний проведена сравнительная характеристика точности отнесения объекта. (Таб. 38). Таблица 38. Сравнительная характеристика показателей информативности клинических данных и лучевых методов для дифференциальной диагностики патологических переломов позвонков по нозологическим формам Методы диагностики Точность отнесения объекта Клинические данные без учета онкологического 63,1% анамнеза Рентгенография 73,2% Аксиальная РКТ 74,7% РКТ с мультипланарной 83,1% реконструкцией Стандартная МРТ 82,8% 140 Сравнительная характеристика методов диагностики, представленная в таблице 38, выявила следующую закономерность. Клинические данные без учета онкологического анамнеза не позволяют проводить дифференциальную диагностику патологических переломов позвонков по нозологическим формам за счет своей неспецифичности проявления. Аксиальная РКТ незначительно превосходит стандартную рентгенографию, что связано, прежде всего, с невозможностью оценить ряд высокоинформативных признаков, таких как вид деформации, наличие вертикальной исчерченности и в некоторых случаях костных отломков из-за отсутствие мультипланарных реконструкций. В подтверждение этих слов, частота правильной классификации при проведении РКТ с мультипланарной реконструкцией значительно увеличивается и достигает 83,1%. Следует отметить, что точность отнесения объекта при МРТ сопоставима с таковой РКТ с реконструкцией. Это можно объяснить рядом причин. Поражение костного мозга при неизмененной трабекулярной структуре кости, некроз и патологические сосуды в опухолевом очаге выявляются только при МРТ. В то время как тип деструкции, наличие костных отломков, субкортикального уплотнения костной структуры, состояния коркового слоя можно полноценно оценить только при РКТ-исследовании. Таким образом, для улучшения качества дифференциальной диагностики патологических переломов позвонков по нозологическим формам целесообразно оценить возможности комплексного подхода. С этой целью проанализированы данные 65 позвонков с патологическими переломами. Из них: 26 с «остеопорозными» деформациями, 11 с переломами на фоне метастазов рака молочной железы, 8 с переломами на фоне гематологических опухолей, 10 с переломами на фоне других опухолей, 7 с переломами на фоне метастазов рака почки, 3 с переломами на фоне гемангиом. Во всех случаях проводилась клиническая оценка, выполнялись рентгенография, аксиальная РКТ, РКТ с мультипланарной реконструкцией, стандартная МРТ. На основании наиболее информативных признаков для каждого метода диагностики 141 сформировано «общее» «решающее правило», в которое вошло 31 признак. Из них: 4 клинических, 1 – по локализации в позвоночном столбе, 2 рентгенологических, 4 признаков аксиальной РКТ, 9 - РКТ с мультипланарной реконструкцией, 11 МРТ признаков. При анализе всех 54 признаков суммарная по всем группам частота правильной классификации объектов составила 95,1%. При анализе 31 отобранного признака суммарная по всем группам частота правильной классификации объектов составила 88,9%. Таким образом, комплексный подход повышает точность отнесения объекта, что обуславливает целесообразность применения в алгоритме обследования клинической оценки, РКТ с мультипланарной реконструкцией и МРТ. 142 Th7 а б MPR sag г в T2 sag T1 sag T2FS sag д е ж Рис 13. Диагностика «остеопорозных» патологических переломов позвонков. Больная О., 61 год. Без онкологического диагноза. Направительный диагноз: Патологические переломы позвонков на фоне опухолевого поражения? а-б: Стандартная рентгенография. Определяются множественные деформации тел грудных и поясничных позвонков с усилением грудного кифоза и поясничного лордоза. Диффузное снижение плотности костной ткани всех позвонков зоны исследования. На этом фоне убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» стандартной рентгенографии: Патологические переломы позвонков на фоне остеопороза. в-г: Рентгеновская компьютерная томография. В дополнение к изменениям, выявленным при рентгенографии, определяется вертикальная исчерченность тел всех позвонков зоны исследования. Без убедительных признаков костной деструкции. Заключение «решающего правила» РКТ: Патологические переломы позвонков на фоне остеопороза. 143 д-ж: Стандартная магнитно-резонансная томография. Определяется тотальный отек костного мозга тела Th10 позвонка и линейный субкортикальный отек тел Th11, Th12 позвонков без признаков очагового поражения. Остальные деформированные позвонки без признаков отека костного мозга. Признаков опухолевого процесса не выявлено. Заключение «решающего правила» стандартной МРТ: Патологические переломы позвонков на фоне остеопороза. Окончательный гистологический диагноз: Патологические переломы позвонков на фоне остеопороза. 144 MPR cor MPR sag в г L3 а б T2 cor T2 sag T1 sag T2FS sag д е ж з Рис 14. Диагностика патологического перелома позвонка на фоне метастаза рака молочной железы. Больная К., 34 года. Рак молочной железы. Направительный диагноз: Патологический перелом позвонка на фоне опухолевого поражения? а: Стандартная рентгенография. Определяется патологический перелом 3 степени тела L3 позвонка с боковой деформацией. Высказаться о характере деструкции в теле указанного позвонка затруднительно. В других позвонках определяются множественные зоны литической деструкции. Заключение «решающего правила» стандартной рентгенографии: Патологический перелом позвонка на фоне опухоли гематологической природы. б-г: Рентгеновская компьютерная томография. В дополнение к изменениям, выявленным при рентгенографии, в теле L3 позвонка определяется смешанная деструкция с преобладанием литического компонента с разрушением коркового слоя и формированием внекостного компонента. В остальных позвонках выявляются множественные зоны литической деструкции. Заключение «решающего правила» РКТ: Патологический перелом позвонка на фоне метастазов рака молочной железы. д-ж: Стандартная магнитно-резонансная томография. Определяется тотальное поражение тела L3 позвонка опухолью неоднородной солидной структуры. Множественные очаги в других позвонках зоны исследования 145 Заключение «решающего правила» стандартной МРТ: Патологический перелом позвонка на фоне метастазов рака молочной железы. Окончательный гистологический диагноз: Патологический перелом позвонка на фоне метастазов рака молочной железы. 146 а Th6 Th12 б в T2 sag T1 sag T2FS sag г д е Рис 15. Диагностика патологического перелома позвонка на фоне опухоли гематологической природы. Ошибка классификации объекта всеми методами. Больная К., 62 года. ПМЗО. Рак молочной железы. Острый лимфобластный лейкоз. Направительный диагноз: Патологический перелом позвонка на фоне метастаза рака молочной железы? а: Стандартная рентгенография. Определяется патологический перелом 2 степени тела Th6 позвонка с передней клиновидной деформацией. Высказаться о характере деструкции в теле указанного позвонка на фоне легочного рисунка затруднительно. В других позвонках убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» стандартной рентгенографии: Патологический перелом позвонка на фоне остеопороза. б-в: Рентгеновская компьютерная томография. В теле Th6 позвонка определяется смешанная деструкция. В остальных позвонках убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» РКТ: Патологический перелом позвонка на фоне метастазов рака молочной железы. г-е: Стандартная магнитно-резонансная томография. Определяется тотальное поражение тела Th6 позвонка опухолью неоднородной солидной структуры. 147 Множественные очаги в других позвонках зоны исследования, которые не определялись при РКТ – поражение костного мозга Заключение «решающего правила» стандартной МРТ: Патологические переломы позвонков на фоне метастазов рака молочной железы. Окончательный гистологический диагноз: Патологический перелом позвонка на фоне острого лимфобластного лейкоза с поражением костной системы. 148 MPR cor MPR sag г д Th11 а б T2 cor в T2 sag T1 sag T2FS sag з и к Th11 е ж Рис 16. Диагностика патологического перелома позвонка на фоне других опухолей с поражением костной системы. Больная С., 57 лет. Меланома кожи правой голени. Направительный диагноз: Патологический перелом позвонка на фоне метастаза меланомы? а-б: Стандартная рентгенография. Определяется патологический перелом 2 степени тела Th11 позвонка со смешанной деформацией на фоне литической деструкции с нечеткими контурами. В других позвонках убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» стандартной рентгенографии: Патологический перелом позвонка на фоне метастаза рака почки. в-д: Рентгеновская компьютерная томография. В теле Th11 позвонка с распространением на правую половину заднего комплекса определяется смешанная деструкция с преобладанием литического компонента и фрагментацией и разрушением коркового слоя. В остальных позвонках убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» РКТ: Патологический перелом позвонка на фоне метастазов рака молочной железы. е-к: Стандартная магнитно-резонансная томография. Определяется тотальное поражение тела Th11 позвонка опухолью неоднородной солидной структуры с 149 формированием небольших размеров паравертебрального компонента. В других позвонках без признаков очагового поражения. Заключение «решающего правила» стандартной МРТ: Патологические переломы позвонков на фоне других опухолей с поражением костной системы. Окончательный гистологический диагноз: Патологический перелом позвонка на фоне метастаза меланомы. 150 L1 а MPR cor б MPR sag L2 в г T2 sag T1 sag T2FS sag L1 д е ж з и к Рис 17. Диагностика патологических переломов позвонков на фоне метастазов рака почки. Больной К., 63 года. Рак почки. Направительный диагноз: Патологические переломы позвонков на фоне метастазов рака почки? а-б: Стандартная рентгенография. Определяются патологические переломы 3 степени со смешанной деформацией тела L1 позвонка и 2 степени с боковой деформацией тела L2 позвонка на фоне литической деструкции с разрушением коркового слоя и четкими контурами. В других позвонках убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» стандартной рентгенографии: Патологические переломы позвонков на фоне метастазов рака почки. в-е: Рентгеновская компьютерная томография. В телах L1, L2 позвонков с распространением на задние комплексы определяется литическая деструкция с вздутием, истончением и разрушением коркового слоя и формированием внекостного компонента. В остальных позвонках убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» РКТ: Патологические переломы позвонков на фоне метастазов рака почки. ж-к: Стандартная магнитно-резонансная томография. Определяется тотальное поражение тела L1 позвонка и 2/3 тела L2 позвонка опухолью неоднородной солидной структуры с жидкостными включениями (некроз) и множественными патологическими сосудами. Корковый слой разрушен с формированием интраканального и паравертебрального внекостного компонентов. В других позвонках без признаков очагового поражения. 151 Заключение «решающего правила» стандартной МРТ: Патологические переломы позвонков на фоне метастазов рака почки. Окончательный гистологический диагноз: Патологические переломы позвонков на фоне метастазов рака почки. 152 S1 T2 sag а б T1 sag T2FS sag в г Рис 18. Диагностика патологического перелома позвонка на фоне гемангиомы. Больная Х., 24 года. Агрессивная гемангиома. Направительный диагноз: Первичная костная опухоль? а: Рентгеновская компьютерная томография. В теле S1 позвонка определяется ячеистая деструкция с незначительным вздутием коркового слоя со склерозированными контурами. В других отделах убедительных признаков костной деструкции не выявлено. Заключение «решающего правила» РКТ: Патологический перелом позвонка на фоне гемангиомы. б-г: Стандартная магнитно-резонансная томография. В теле S1 определяется опухоль неоднородной структуры с включениями жидкости и жира с четкими фестончатыми контурами без признаков формирования внекостного компонента. В других позвонках без признаков очагового поражения. Заключение «решающего правила» стандартной МРТ: Патологический перелом позвонка на фоне гемангиомы. Окончательный гистологический диагноз: Патологический перелом позвонка на фоне гемангиомы. 153 ЗАКЛЮЧЕНИЕ Наиболее частой причиной патологических переломов позвонков является остеопороз [1]. При этом частота их возникновения увеличивается с возрастом и зависит от снижения минеральной плотности костной ткани. К 80-летнему возрасту у 40% женщин и 20% мужчин выявляются патологические переломы позвонков. Как правило, к компрессионной деформации приводит неадекватная травма, однако в случаях выраженного остеопороза переломы могут возникнуть на фоне нормальной физиологической активности, а иногда и спонтанно [3]. Выделяют два типа остеопороза: первичный (85%) и вторичный (15%). К первичному остеопорозу, относятся следующие формы: постменопаузальный, постандропаузальный, сенильный, ювенильный и идиопатический [4]. Вторичный остеопороз развивается вследствие различных, чаще всего системных, заболеваний или имеет ятрогенный характер. По степени распространенности остеопороза в скелете выделяют генерализованную и локализованную формы. Причиной локализованной формы остеопороза могут быть длительная иммобилизация, дистонический синдром [5] или в ряде случаев терапевтическое воздействие, такое как лучевая терапия [6]. Около 60% переломов позвонков при остеопорозе не сопровождаются клиническими симптомами [7]. Несмотря на это, переломы тел позвонков сопряжены с осложнениями и повышенной смертностью, которая увеличивается на 15% по сравнению с группой больных без патологических переломов [8]. Второй по частоте причиной развития патологических переломов позвонков является опухолевое поражение. Наиболее часто в кости метастазирует рак молочной железы (72%), предстательной железы (87%), щитовидной железы (50%), легкого (31%) и почки (37%). Таким образом, более 80% злокачественных опухолей метастазируют в кости [10, 11]. При этом до 39% метастазов в скелет локализуются в позвоночнике, и они могут приводить к патологическим переломам [7]. Ряд заболеваний, такие как миеломная болезнь, могут 154 манифестировать патологическими переломами, и частота их встречаемости достигает 60% [14]. Ряд опухолей имеет тенденцию к формированию массивного внекостного компонента. По данным некоторых авторов частота развития компрессии спинного мозга при НХЛ достигает 50% [23]. Компрессия спинного мозга обусловлена метастазами рака молочной железы, предстательной железы, легкого в 15-20% случаев [26]. У 20% больных онкологическое заболевание манифестировало неврологическим дефицитом вследствие метастатического поражения позвоночника. Следует отметить, что частота параплегии, вызванной опухолевым поражением составляет 8,5 на 100 000 населения и превышает таковую при травме позвоночника (3-5 на 100 000) [27]. Активное применение лучевых методов переломов позвонков началось с появлением рентгенографии. Однако в первую очередь это было обусловлено необходимостью выбора тактики лечения травматических переломов позвонков. Больные с патологическими переломами на фоне опухолевого поражения позвоночника или остеопороза считались бесперспективными из-за отсутствия эффективных методов лечения. В этот период дифференциальная диагностика патологических переломов позвонков не являлась актуальной проблемой. По мере развития как хирургических, так и консервативных методов лечения онкологических заболеваний и появлением возможности продления жизни пациентов даже с IV стадией болезни, возросла необходимость в дифференциальной диагностике патологических переломов позвонков. «Золотым стандартом» для выбора тактики ведения онкологического больного является морфологическое подтверждение диагноза. Однако, основным недостатком патоморфологического исследования, особенно при биопсии костной ткани, является длительность его проведения, и у больных с патологическими переломами позвонков и компрессией спинного мозга приходится начинать лечение без диагностики морфологической позволяют не верификации только диагноза. предположить Методы лучевой злокачественный или доброкачественный характер перелома, но и высказаться о типе опухоли. Это 155 способствует оптимизации плана обследования пациента для ускорения постановки правильного диагноза и начала лечения. В ряде случаях методы лучевой диагностики позволяют отказаться от выполнения трепанбиопсии позвонка в пользу динамического наблюдения. С учетом вышесказанного методы лучевой диагностики приобретают высокую значимость для определения этиологии патологического перелома. С развитием возможностей хирургического и терапевтического лечения в мире активно занимаются изучением и усовершенствованием лучевых методов для дифференциальной диагностики патологических переломов позвонков. Определение этиологии патологического перелома с помощью методов лучевой диагностики основывается на двух способах оценки изменений в поломанном позвонке. Первый способ включает анатомо-топографические методы, отражающие изменение структуры кортикальной и губчатой кости, состояние костного мозга и структуру самой опухолевой ткани (рентгенография, РКТ, стандартная МРТ). Второй способ включает методы, отражающие функциональные особенности костной ткани при опухолевом и неопухолевом ее поражении (методика МРТ-ДК, методика ДВ-МРТ, трехфазная сцинтиграфия с использованием различных РФП и позитронно-эмиссионная томография). Эти методы помимо качественных характеристик позволяют оценить количественные показатели, отражающие васкуляризацию, глюкозный и другие типы обмена веществ в позвонке с патологическим переломом и в окружающих структурах. В литературе работ, посвященных возможностям стандартной рентгенографии для дифференциальной диагностики патологических переломов позвонков представлено недостаточно, и все они изучают значимость отдельных признаков. С учетом современных требований информативность этого метода существенно ограничена. При рентгенологическом исследовании очаг литической деструкции может быть выявлен, если его размер более 1 см в диаметре, а плотность костной ткани в указанном очаге снижена не менее, чем на 50%. Это объясняет большое количество ложноотрицательных результатов, частота которых достигает 40% 156 [40], а наличие перелома еще больше затрудняет выявление «истинной» костной деструкции. С учетом большого количества ограничений данного метода, основная часть дифференциально-диагностических критериев этиологии патологического перелома имеет лишь косвенный характер. К подобным признакам относят локализацию уровня перелома и вид деформации поломанного позвонка [42, 44]. Ряд авторов особое значение предавали типу перелома замыкательных пластин тел позвонков для дифференциальной диагностики «неопухолевых» и «опухолевых» патологических переломов позвонков [44]. В большинстве работ патологические переломы позвонков на фоне опухолевого процесса рассматриваются как вторичное проявление болезни, поэтому четких дифференциально-диагностических критериев поражения позвоночника при различных опухолевых процессах представлено крайне мало. Таким образом, стандартную рентгенографию следует в большей степени рассматривать как метод скрининга для выявления переломов позвонков с последующей уточняющей диагностикой с помощью более информативных методов исследования. Возможности стандартную рентгеновской рентгенографию компьютерной в разграничении томографии между превосходят собой важных дифференциально-диагностических признаков, таких как деструкция коркового слоя при «опухолевых» переломах и формирование костных отломков при «остеопорозных» переломах [45]. Наличие внекостного компонента и разрушение губчатой кости тела поломанного позвонка ряд авторов относили к абсолютным признакам «опухолевого» перелома, другие же не считали эти критерии характерными для переломов на фоне опухолевого поражения [45,46]. Для адекватной оценки наличия перелома позвонка необходима мультипланарная реконструкция, которая позволяет выявить не диагностированное при аксиальной РКТ снижение высоты тела позвонка в 45% случаев [48-50]. РКТ семиотика поражения костной системы при различных опухолевых процессах практически не разработана и представлена единичными публикациями (127,128). 157 Возможности дифференциальной диагностики патологических переломов позвонков существенно расширились с появлением магнитно-резонансной томографии. По мере накопления клинических наблюдений были разработаны дифференциально-диагностические критерии патологических переломов позвонков [39,51-59]. Однако, лишь в единственной работе представлены показатели чувствительности и специфичности данного метода для дифференциальной диагностики «неопухолевых» и «опухолевых» переломов позвонков, которые составляют 97% и 94% соответственно [60]. В этом же исследовании проведен дифференциальный диагноз 5 групп нозологических форм, при этом частота правильной классификации составила 94,6%. При анализе данных литературы по нозологическим формам опухолей с поражением костной системы следует отметить наличие единичных публикаций, в которых представлены патогномоничные для отдельных опухолей признаки [127,129-131]. Несмотря на высокие показатели информативности как отдельных признаков стандартной МРТ, так и метода в целом, в ряде случаев определение этиологии патологического перелома позвонка существенно затруднено, что способствовало развитию дополнительной методики МРТ-ДК. Данная методика позволяет разграничивать опухолевую ткань, грануляционную ткань, реактивный отек и зоны некроза в позвонке с патологическим переломом. МРТ-ДК показала достаточно высокую точность в дифференциальной диагностике патологических переломов позвонков, однако при этом она не лишена ряда недостатков [78-82]. Применение методики ДВ-МРТ также выглядит многообещающей, однако в литературе представлены достаточно противоречивые сведения о возможности определения этиологии патологического перелома даже с помощью истинного коэффициента диффузии (ИКД) [98-104]. В публикациях, посвященных ОСГ, основной акцент делается на определение давности «остеопорозных» различными РФП для переломов [108-111]. дифференциальной Возможности диагностики переломов позвонков практически не изучаются. ОСГ с патологических Сведения о роли ПЭТ и 158 ПЭТ/КТ для решения данной диагностической задачи неоднозначны. Ряд авторов не выявили преимущества данного метода перед стандартной МРТ для дифференциальной диагностики патологических переломов позвонков [119, 120]. В России нет публикаций, в которых на собственном материале проведена сравнительная оценка информативности методов, основанных на изучении признаков структурных и функциональных изменений в позвонке с патологическим переломом. Таким образом, проблема дифференциальной диагностики патологических переломов позвонков различными лучевыми методами не решена. Помимо разногласий различных исследователей, касаемых диагностических возможностей тех или иных методов, отмечается немногочисленное количество статей, где проводится комплексный анализ различных методов лучевой диагностики и ядерной медицины, в то время как большинство публикаций посвящено одному методу. В связи с чем, невозможно четко определиться какой из применяемых в мире методов или совокупность методов лучевой диагностики наилучшим образом определяют этиологию патологического перелома позвонка. На основании литературных данных наиболее информативными методами в определении этиологии перелома является МРТ и методика МРТ-ДК. Однако отсутствие сравнительных работ, определяющих преимущества и недостатки данных методов и методик не позволяет сделать однозначный вывод. Таким образом, целью проведенной работы было повышение информативности методов лучевой диагностики в определении этиологии патологического перелома позвонка и разработки алгоритма обследования данной категории больных. Для решения поставленной цели были определены следующие задачи: 1. Разработать методику магнитно-резонансной томографии с динамическим контрастированием для дифференциальной диагностики патологических переломов позвонков. 159 2. Определить признаки различных лучевых методов для дифференциальной диагностики патологических переломов позвонков. 3. Определить показатели информативности лучевых методов для дифференциальной диагностики патологических переломов позвонков. 4. Провести сравнительный анализ информативности лучевых методов для дифференциальной диагностики патологических переломов позвонков. 5. Разработать алгоритм применения лучевых методов для дифференциальной диагностики патологических переломов позвонков. Для решения поставленных задач получены и проанализированы данные 154 деформированных позвонков, основную долю среди которых составляли переломы на фоне остеопороза – 49 (32%) и переломы на фоне метастатического поражения при раке молочной железы – 41 (27%). Анализировались клинические данные, признаки стандартной рентгенографии, рентгеновской компьютерной томографии, стандартной магнитно-резонансной томографии, качественные, полуколичественные и количественные признаки методики МРТ-ДК, методики ДВ-МРТ, планарной и трехфазной ОСГ. Для разработки и проверки «решающего правила», основанного на сумме ВКИ клинических признаков (без «онкологических критериев»), использованы данные 154 позвонков. Весовые коэффициенты информативности вычислялись на «обучающей выборке», в которую были включены данные 103 позвонков. Затем с помощью «решающего правила» определена информативность клинических признаков на «экзаменационной» выборке, в которую вошло 51 позвонок с патологическим переломом. Чувствительность клинических данных обеих выборок составила 91%-93%, специфичность – 77%-80% точность – 83%86%. Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков стандартной рентгенографии, использованы данные 106 позвонков. 160 Весовые коэффициенты информативности вычислялись на «обучающей выборке», в которую были включены данные 71 позвонка. С помощью «решающего правила» определена информативность признаков стандартной рентгенографии на «экзаменационной» выборке, в которую вошло 35 позвонков с патологическими переломами. Чувствительность стандартной рентгенографии обеих выборок составила 93%, специфичность – 81% точность – 86%. Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков аксиальной РКТ и РКТ с мультипланарной реконструкцией, использованы данные 109 позвонков. Весовые коэффициенты информативности вычислялись на «обучающей выборке», в которую были включены данные 72 позвонков. С помощью «решающего правила» определена информативность признаков РКТ с мультипланарной реконструкцией на «экзаменационной» выборке, в которую вошло 37 позвонков с патологическими переломами. Чувствительность РКТ обеих выборок составила 100%, специфичность – 85%-88% точность – 92%93%. Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков стандартной МРТ, использованы данные 147 позвонков. Весовые коэффициенты информативности вычислялись на «обучающей выборке», в которую были включены данные 97 позвонков. С помощью «решающего правила» определена информативность признаков стандартной МРТ на «экзаменационной» выборке, в которую вошло 50 позвонков с патологическими переломами. Чувствительность стандартной МРТ обеих выборок составила 98%-100%, специфичность – 92%-94% точность – 97%-98%. Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков методики МРТ-ДК, использованы данные 51 позвонка. Весовые коэффициенты информативности вычислялись на «обучающей выборке», в которую были включены данные 34 позвонков. 161 С помощью «решающего правила» определена информативность признаков МРТ-ДК на «экзаменационной» выборке, в которую вошло 17 позвонков с патологическими переломами. Чувствительность методики МРТ-ДК обеих выборок составила 95%-100%, специфичность – 86%-100% точность – 88%-97%. Сравнительная характеристика информативности всех представленных выше методов диагностики: клинической оценки, стандартной рентгенографии, РКТ, стандартной МРТ, методики МРТ-ДК выявило следующую закономерность. Анатомо-топографический метод стандартная МРТ имеет наивысшие показатели информативности по сравнению с другими методами, тем не менее, показатель чувствительности, превышает показатель специфичности. Обратная закономерность наблюдается при применении методики МРТ-ДК. При этой функциональной методике показатель специфичности превышает показатель чувствительности. Поэтому нами проведена сравнительная характеристика информативности данных методов: анатомо-топографического, отражающего структурные изменения в позвонке с патологическим переломом, и функциональной методики, отражающей васкуляризацию опухоли. Для этого сформированы группы, в которых применялись как анатомо-топографический, так и функциональный методы. Наивысшими показателями чувствительности и специфичности обладало сочетание стандартной МРТ и методики МРТ-ДК с оценкой качественных, полуколичественных и количественных признаков, которые в «обучающей» выборке достигали 100% для обоих показателей. При анализе информативности сочетанного применения анатомо- топографических методов (РКТ и МРТ) и клинической оценки, показатель чувствительности составлял 100%, а показатель специфичности для обеих выборок составлял 77%-90%. Таким образом, стандартная МРТ позволяет лучше выявлять группу позвонков с патологическими переломами на фоне остеопороза. А функциональная методика МРТ-ДК имеет преимущества в выявлении группы позвонков с 162 «опухолевыми» переломами. Полученные результаты, указывают на повышение точности дифференциальной диагностики патологических переломов позвонков при сочетании анатомо-топографического и функционального метода (стандартной МРТ и методики МРТ-ДК). Комплексное применение анатомотопографических методов даже в сочетании с клинической оценкой не целесообразно. Полученные результаты при обследовании позвонков с помощью методики ДВ-МРТ показали следующее. Данная методика отражает гетерогенную структуру позвонка с патологическим переломом. Однако ранжир показателей ИКД не позволяет выявить какой-либо зависимости данного параметра от этиологии патологического перелома. Анализ результатов как планарной остеосцинтиграфии, так и трехфазной остеосцинтиграфии также не выявил какой либо закономерности для дифференциальной диагностики патологических переломов позвонков. Кроме того, данные методы, особенно ТОСГ имеют ряд ограничений, не позволяющие адекватно оценивать полученные результаты. Дополнительно нами проводилась дифференциальная диагностика патологических переломов позвонков по 6 группам нозологических форм: переломы на фоне остеопороза, переломы на фоне метастазов рака молочной железы, переломы на фоне гематологических опухолей, переломы на фоне других опухолей с поражением костной системы, переломы на фоне метастазов рака почки и на фоне гемангиом. Для разработки и проверки «решающего правила», основанного на сумме ВКИ клинических признаков (без «онкологических критериев»), использованы данные 154 позвонков. Частота правильной классификации объекта составила 63,1%. Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков стандартной рентгенографии, использованы данные 106 позвонков. Частота правильной классификации объекта составила 73,2%. 163 Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков аксиальной РКТ, использованы данные 120 позвонков. Частота правильной классификации объекта составила 74,7%. Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков РКТ с мультипланарной реконструкцией, использованы данные 109 позвонков. Частота правильной классификации объекта составила 83,1%. Для разработки и проверки «решающего правила», основанного на сумме ВКИ признаков стандартной МРТ, использованы данные 147 позвонков. Частота правильной классификации объекта составила 82,8%. При комплексном применении методов лучевой диагностики и клинической оценки частота правильной классификации объекта составила 88,9%. 164 ВЫВОДЫ 1. Для дифференциальной диагностики патологических переломов позвонков разработана и динамическим внедрена методика контрастированием магнитно-резонансной (МРТ-ДК), томографии основанная на с анализе качественных, полуколичественных и количественных признаков. 2. Разработаны признаки рентгеновской компьютерной томографии мультипланарной с для стандартной томографии, рентгенографии, рентгеновской реконструкцией, аксиальной компьютерной стандартной магнитно- резонансной томографии и методики МРТ-ДК для разграничения групп позвонков с «остеопорозными» и «опухолевыми» переломами, а также дополнительно для 6 групп нозологических форм. 3. Для дифференциальной диагностики «остеопорозных» и «опухолевых» переломов позвонков чувствительность для клинической оценки без «онкологических» признаков составила 93,3%, специфичность – 77,8%, точность – 83,8%, стандартной рентгенографии - 92,8%, 80,9% и 85,7% соответственно, аксиальной РКТ - 100%, 85% и 92,7% соответственно, РКТ с мультипланарной реконструкцией 100%, 85% и 92,7% соответственно, стандартной МРТ – 100%, 93,4% и 98,0% соответственно, методики МРТ-ДК с оценкой качественных, полуколичественных и количественных признаков – 95%, 100% и 97,1% соответственно. 4. Частота гиперфиксации и степень накопления радиофармпрепарата при проведении остеосцинтиграфии не имеют статистически достоверных различий для «остеопорозных» и «опухолевых» патологических переломов позвонков. 5. Для дифференциальной диагностики патологических переломов позвонков по 6 группам нозологических клинической оценки без форм частота правильной «онкологических» классификации признаков составила для 63,1%, стандартной рентгенографии – 73,2%, аксиальной РКТ – 74,7%, РКТ с мультипланарной реконструкцией – 83,1%, стандартной МРТ – 82,8%. 165 6. Сравнительный анализ информативности лучевых методов в дифференциальной диагностике «остеопорозных» и «опухолевых» переломов выявил следующее. Аксиальная РКТ, РКТ с мультипланарной реконструкцией и стандартная МРТ имеют показатели чувствительности, ассоциированной с группой позвонков с переломами на фоне остеопороза, выше специфичности. Обратная закономерность выявлена для методики МРТ-ДК, которая имеет более высокие показатели специфичности, ассоциированной с группой позвонков с переломами на фоне опухолевого поражения. 7. Сравнительный анализ информативности лучевых методов в дифференциальной диагностике патологических переломов позвонков по 6 группам нозологических выявил, что наивысшая частота правильной классификации объекта наблюдается при применении РКТ с мультипланарной реконструкцией и МРТ. 166 СПИСОК ЛИТЕРАТУРЫ 1. Flemming D.J. Primary tumors of the spine/ Flemming D.J. et al.// Semin Musculoskelet Radiol – 2000 – №4 (3) – р. 299-320. 2. Grampp S. Radiologic diagnosis of osteoporosis. Current methods and perspectives/ Grampp S et al.// Radiol Clin North Am – 1993 - №35(1) – р. 1133-1145. 3. Guglielmi G. Integrated imaging approach to osteoporosis: state-of-the-art review and update/ Guglielmi G, Muscarella S, Bazzocchi A.// Radiographics – 2011 – №31 – р. 1343-1364. 4. Беневоленская Л.И. Руководство по остеопорозу/ Беневоленская Л.И., Насонов Е.Л. и др.// М. БИНОМ, 2003 – с. 11. 5. Guglielmi G. Imaging of metabolic bone diseases/ Guglielmi G, Muscarella S, Leone A et al.// Radiol Clin North Am – 2008 – №46(4) – р.735-754. 6. Noël-Savina Е. Osteoporotic vertebral compression fractures: a rare complication of radiotherapy in a patient with lung cancer/ Noël-Savina E., Descourt R. // Clinical Imaging – 2013 - №37 – р. 390–392 7. Peloschek P. Vertebral fractures and osteoporosis/ Peloschek P., Grampp S.// In: Cassar-Pullicino V., Imhof H. Spinal Trauma – An Imaging Approach – 2006// Thieme Stuttgard – 2006 – p.206. 8. Cooper С. The epidemiology of vertebral fractures/ Cooper C., O’Neil T., Silman A.// Bone – 1993 - №14 – р. 89-97. 9. Fink N. Disability after clinical fracture in postmenopausal women with low bone density: the fracture intervention trial (FIT)/ Fink N. et al.// Osteoporos Int - 2003 – №14 (1) – р. 69-76. 10. Alcalay M. Strategy for identifying primary malignancies with inaugural bone metastases/ Alcalay M., Azais I., Brigeon B. et al.// Revue du Rhumatisme - 1995 - № 62(10) – p. 632–642. 167 11. Brage M. E. Evaluation, prognosis, and medical treatment considerations of metastatic bone tumors/ Brage M. E., Simon M. A.// Orthopedics – 1992 - №15(5) – p. 589–596. 12. Tyrrell P. Bone Metastasis 1: Spine/ Tyrrell P, Cassar-Pullichino V, Lalam R, Tins B.// In Davies A, Sundaram M. James S. Imaging of bone tumors and tumor-like lesions. Springer – 2009 – р. 461-462. 13. Coleman RE. Metastatic bone disease: clinical features, pathophysiology and treatment strategies/ Coleman RE.// Cancer Treat Rev – 2001 - №27 – р.165–176. 14. Lecouvet F. Vertebral compression fractures in multiple myeloma. Part II. Assessment of fracture risk with MR imaging of spinal bone marrow/ Lecouvet F., Malghem J., Michaux L. et al.// Radiology – 1997 - №204 – р. 201–205. 15. Beal K. Primary bone lymphoma: treatment results and prognostic factors with long-term follow-up of 82 patients/ Beal K, Allen L, Yahalom J.// Cancer - 2006 №106 – р. 2652–2656. 16. Ramadan K.M. A clinicopathological retrospective study of 131 patients with primary bone lymphoma: a population-based study of successively treated cohorts from the British Columbia Cancer Agency/ Ramadan K.M., Shenkier T., Sehn L.H. et al.// Ann Oncol – 2007 - №18 – р.129–135. 17. Barbieri E. Primary NHL of the bone: treatment and analysis of prognostic factors for Stage I and Stage II/ Barbieri E., Cammelli S., Mauro F. et al.// Int J Radiat Oncol Biol Phys – 2004 - №59 – р.760–764. 18. Adams H. Primary diffuse large B-cell lymphomas of the bone: prognostic relevance of protein expression and clinical factors/ Adams H., Tzankov A., d’Hondt S. et al.// Hum Pathol – 2008 - №39 – р.1323–1330. 19. Yuste A.L. Primary lymphoma of bone: a clinico-pathological review and analysis of prognostic factors/ Yuste A.L., Segura A., Lopez-Tendero P. et al.// Leuk Lymphoma – 2004 - №45 – р.853–855. 20. Zinzani P.L. Primary bone lymphoma: experience with 52 patients/ Zinzani P.L., Carrillo G., Ascani S. et al.// Haematologica – 2003 - №88 – р.280–285. 168 21. Salvati M. Primary spinal epidural non-Hodgkin’s lymphomas: a clinical study/ Salvati M., Cervoni L., Artico M. et al.// Surg Neurol – 1996 - №46 – р.339–344. 22. Lim C. Spinal epidural non-Hodgkin’s lymphoma: case reports of three patients presenting with spinal cord compression/ Lim C., Chong B.K.// Singapore Med J – 1996 - №37 – р.497–500. 23. Vanneuville B. Non-Hodgkin’s lymphoma presenting with spinal involvement/ Vanneuville B., Janssens A., Lemmerling M. et al.// Ann Rheum Dis – 2000 - №59 – р.12–14. 24. Oviatt D.L. Successful chemotherapeutic treatment of epidural compression in non-Hodgkin’s lymphoma/ Oviatt D.L., Kirshner H.S., Stein R.S.// Cancer – 1982 №49 – р.2446–2448. 25. Monnard V. Primary spinal epidural lymphoma: patients’ profile, outcome, and prognostic factors: a multicenter Rare Cancer Network study/ Monnard V., Sun A., Epelbaum R., et al.// Int J Radiat Oncol Biol Phys – 2006 - №65 – р.817–823. 26. Levack P. Don’t wait for the sensory level – listen to the symptoms: a prospective audit of the delays in diagnosis of malignant cord compression/ Levack P., Graham J., Collie D. et al. Scottish Cord Compression Study Group// R Coll Radiol – 2002 - №14 – р.472-480. 27. Sundaresan S.N. Metastatic tumors of the spine/ Sundaresan S.N. , Krol G., DiGiacinto G.V., Hughes J.E.O// In: Sundaresan S.N., Scmidek H.H., Schiller A.L., et al., eds. Tumors of the Spine. Diagnosis and Clinical Management// Philadelphia: WB Saunders – 1990 – р.279-304. 28. Schiff D. Spinal Cord Compression/ Schiff D.// Neurol Clin – 2003 - №21 – р.67- 86. 29. Oner F. Classification: rationale and relevance/ Oner F.// In: Cassar-Pullicino V., Imhof H. Spinal Trauma – An Imaging Approach// Thieme Stuttgard – 2006 – p.55. 30. Holdsworth F.W. Fractures, dislocations and fracture-dislocations of the spine/ Holdsworth F.W.// J Bone Joint Surg – 1963 - №45-B – р.6-20. 169 31. Denis F. The three-column spine and its significance in the classification of the acute thoracolumbar spinal injuries/ Denis F.// Spine – 1983 - №8 – р.817-831. 32. Magerl M. А Comprehensive classification of thoracic and lumbar injuries/ Magerl M., Aebi M., Gertzbein S.D. et al.// Eur Spine J. – 1994 - №3 – р. 184-201. 33. Hurxthal L.M. Measurement of anterior vertebral compressions and biconcave vertebrae/ Hurxthal L.M.// Am J Roentgenol Radium Ther Nucl Med – 1968 - №103 – р.635–644. 34. Lunt M. Defining incident vertebral deformities in population studies: a comparison of morphometric criteria/ Lunt M., Ismail A.A., Felsenberg D. et al.// Osteoporos Int – 2002 - №13 – р.809–815. 35. Genant H.K. Vertebral fracture assessment using a semiquantitative technique/ Genant H.K., Wu C.Y., van Kuijk C. et al.// J Bone Miner Res – 1993 - №8 – р.1137– 1148. 36. Fisher Ch. A novel classification system for spinal instability in neoplastic disease/ Fisher Ch., DiPaola Ch., Ryken T. et al.// Spine – 2010 - №22 – р.1221-1229. 37. Roodman G.D. Mechanisms of disease: mechanisms of bone metastasis/ Roodman G.D. // NEJM. – 2004. – 16. – P. 1655-1664. 38. Guise T.A. Cancer and bone/ Guise T.A., Mundy G.R.// Endocr Rev – 1998 - №19 – р.18–54. 39. Yuh W.T. Vertebral compression fractures: distinction between benign and malignant cases with MRI imaging/ Yuh W.T. et al.// Radiology – 1989 - №172(1) – р.215-218. 40. Salvo N. The role of plain radiographs in management of bone metastases/ Salvo N., Christakis M., Rubenstein J. et al.// Journal of Palliative Medicine – 2009 - №12( 2) – р.195–198. 41. Rosenthal D.I. Radiologic diagnosis of bone metastasis/ Rosenthal D.I.// Cancer – 1997 - №80(8) – р.1595-1607. 170 42. Link Т. Radiologic assessment of osteoporotic vertebral fractures: diagnostic and prognostic implications/ Link T., Guglielmi G., van Kuijk C. et al.// Eur Radiol – 2005 №15 – р.1521–1532. 43. Sartoris D. Vertebral body collapse in focal and diffuse disease: patterns of pathologic processes/ Sartoris D., Clopton P., Nemcek A. et al.// Radiology - 1986 №160 – р.479-483. 44. Baudouin E. The intravertebral vacuum cleft: a sign of ischemic vertebral collapse/ Baudouin E. Maldague, M.D., Henry M. et al.// Radiology – 1978 - №129 – р.23-29. 45. Sattari A. Benign nontraumatic osteolytic vertebral collapse simulating malignancy/ Sattari A., Quillard A., Laredo J.D.// Eur Radiology – 2008 - №18 – р.631-638. 46. Laredo J.D. Acute vertebral collapse: CT findings in benign and malignant nontraumatic cases’/ Laredo J.D., Lakhdari K., Bellache L. et al.// Radiology – 1995 №194 – р.41-48. 47. Stabler A. Intravertebral vacuum phenomenon following fractures: CT study on frequency and etiology/ Stabler A., Schneider P., Link T.M. et al.// J Comput Assist Tomogr – 1999 - №23 – р.976–980. 48. Woo E.K. Incidental vertebral fractures on multidetector CT images of the chest: prevalence and recognition/ Woo E.K., Mansoubi H., Alyas F.// Clin Radiol. – 2008 №63 – р.160-164. 49. Williams A.L. Under-reporting of osteoporotic vertebral fractures on computed tomography/ Williams A.L., Al-Busaidi A., Sparrow P.J. et al.// Eur J Radiol. – 2009 №69 – р.179-183. 50. Chan P.L. Incidental vertebral fractures on computed tomography/ Chan P.L., Reddy T., Milne D., Bolland M.J.// N Z Med J. – 2012 – Feb 24 - №125(1350) – р.4550. 171 51. Baker L. Benign versus pathologic compression fractures of vertebral bodies: assessment with conventional spin-echo, chemical-shift, and STIR MR imaging/ Baker L., Goodman S., Perkash I. et al.// Radiology – 1990 - №174 – р.495-502. 52. Cuenod C.A. Acute vertebral collapse due to osteoporosis or malignancy: appearance on unenhanced and gadolinium-enhanced MR images/ Cuenod C.A., Laredo J.D., Chevret S. et al.// Radiology – 1996 - №199 – р.541-549. 53. Moulopoulos L.A. MR prediction of benign and malignant vertebral compression fractures/ Moulopoulos L.A., Yoshimitsu K., Johnston D.A. et al.// J Magn Reson Imaging – 1996 - №6 – р.667-674. 54. Palmer W.E. Benign versus malignant vertebral collapse: value of a fracture line on MR images/ Palmer W.E., Suri R., Kattapuram S.V.// Radiology – 1999 №213(Suppl. P) – р.293. 55. Baur A. Acute osteoporotic and neoplastic vertebral compression fractures: fluid sign at MR imaging/ Baur A., Stabler A., Arbogast S. et al.// Radiology - 2002 - №225 – р.730-735. 56. Malghem J. Intravertebral vacuum cleft: changes in content after supine positioning/ Malghem J., Maldague B., Labaisse M.A. et al.// Radiology - 1993 - №187 – р.483-487. 57. Rupp R.E. Magnetic resonance imaging differentiation of compression spine fractures or vertebral lesions caused by osteoporosis or tumor/ Rupp R.E., Ebraheim N.A., Coombs R.J.// Spine – 1995 - №20 – р.2499-2504. 58. An H.S. Can we distinguish between benign versus malignant compression fractures of the spine by magnetic resonance imaging?/ An H.S., Andreshak T.G., Nguyen C. et al.// Spine – 1995 - №20 – р.1776-1782. 59. Shih T.T. Solitary vertebral collapse: distinction between benign and malignant causes using MR patterns/ Shih T.T., Huang K.M., Li Y.W.// J Magn Reson Imaging – 1999 - №9 – р.635-642. 60. Токарь диагностике Т.Ю. острых Магнитно-резонансная патологических томография переломов в позвонков комплексной на основе 172 алгоритмического подхода: автореф. дисс. канд. мед. наук: 05.13.01/ Токарь Татьяна Юрьевна. – Воронеж, 2009. – 20 с. 61. Tan S.B. The limitations of magnetic resonance imaging in the diagnosis of pathologic vertebral fractures/ Tan S.B., Kozak J.A., Mawad M.E.// Spine – 1991 - №16 – р.919-923. 62. Frager D. Subacute osteoporotic compression fracture: misleading magnetic resonance appearance/ Frager D., Elkin C., Swerdlow M., Bloch S.// Skeletal Radiol – 1988 - №17 – р.123-126. 63. Hayes C. Assessing changes in tumor vascular function using dynamic contrast- enhanced magnetic resonance imaging/ Hayes C., Padhani A.R., Leach M.O. et al.// NMR Biomed. – 2002. – №15. – р.154-163. 64. Verstraete K.L. Benign and malignant musculoskeletal lesions: dynamic contrast- enhanced MRI – parametric “firstpass” images depict tissue vascularization and perfusion/ Verstraete K.L., De Deene Y., Roels H. et al.// Radiology – 1994 - №192 – р.835–843. 65. Verstraete K.L. Dynamic contrast-enhanced MR imaging of musculoskeletal tumors: basic principles and clinical applications/ Verstraete K.L., van der Woude H.J., Hogendoorn P.C.W. et al.// J Magn Reson Imaging – 1996 - №6 – р.311-321. 66. Brasch R.C. New directions in the development of MR imaging contrast-media/ Brasch R.C.// Radiology – 1992 - №183 – р.1–11. 67. Debaere T. Osteosarcoma after chemotherapy – evaluation with contrast material enhanced subtraction MR imaging/ Debaere T., Vanel D., Shapeero L.G. et al.// Radiology – 1992 - №185 – р.587–592. 68. Van der Woude H.J. Preoperative evaluation and monitoring chemotherapy in patients with high-grade osteogenic and Ewing’s sarcoma: review of current imaging modalities/ Van der Woude H.J., Bloem J.L., Hogendoorn P.C.W.// Skeletal Radiol – 1998 - №27 – р.57-71. 173 69. Van der Woude H.J. Osteosarcoma and Ewing’s sarcoma after neoadjuvant chemotherapy: value of dynamic MRI in detecting viable tumor before surgery/ Van der Woude H.J., Bloem J.L.,Verstreate K.L., et al.// AJR – 1995 - №165 – р.593–598. 70. Erlemann R. Musculoskeletal neoplasm: static and dynamic Gd-DTPA-enhanced MR imaging/ Erlemann R., Reiser M.F., Peters P.E. et al.// Radiology - 1989 - №171 – р.767-773. 71. Van der Woude H.J. Magnetic resonance imaging of the musculoskeletal system, part 9. Primary tumors/ Van der Woude H.J., Bloem J.L., Pope T.L.Jr.// Clin Orthop – 1998 - №347 – р.272–286. 72. Van der Woude H.J. Contrast enhanced magnetic resonance imaging of bone marrow/ Van der Woude H.J., Egmont-Petersen M.// Semin Musculoskelet Radiol – 2001 - №5 – р.21–33. 73. Van Rijswijk C.S. Dynamic contrast-enhanced MR imaging in monitoring response to isolated limb perfusion in high-grade soft tissue sarcoma: initial results/ Van Rijswijk C.S., Geirnaerdt M.J., Hogendoorn P.C. et al.// Eur Radiol – 2003 - №13(8) – р.1849-1858. 74. Verstraete K.L. Static, dynamic and first-pass MRI of musculoskeletal lesions using gadodiamide injection/ Verstraete K.L., Vanzieleghem B., De Deene Y., et al.// Acta Radiol – 1995 - №36(1) – р.27–36. 75. Shapeero L.G. MR imaging in the folow-up evaluation of aggressive soft tissue tumors/ Shapeero L.G., Vanel D.// Sem Musculoskeletal Radiol – 1999 - №3(2) – p.197-205. 76. Van der Woude H.J. Musculoskeletal tumors: does fast contrast-enhanced subtraction MR imaging contribute to the characterization?/ Van der Woude H.J., Verstraete K.L., Hogendoorn P.C.W., et al.// Radiology – 1998 - №208 – р.821-828. 77. Van Rijswijk C.S. Soft-tissue tumors: value of static and dynamic gadopentetatedimeglumine-enhanced MRI in prediction of malignancy/ Van Rijswijk C.S., Geirnaerdt M.J., Hogendoorn P.C. et al.// Radiology – 2004 - №233 – р.493–502. 174 78. Chen W.T. Vertebral bone marrow perfusion evaluated with dynamic contrast- enhanced MR imaging: significance of aging and sex/ Chen W.T., Shih T.T., Chen R.C. et al.// Radiology – 2001 - №220 – р.213-218. 79. Savvopoulou V. Differences in perfusion parameters lumbar vertebral between upper and lower segments with dynamic contrast-enhanced MRI (DCE MRI)/ Savvopoulou V., Maris T.G., Vlahos L., Moulopoulos L.A.// Eur Radiol – 2008 - №18 – р.1876–1883. 80. Shih T.T. Correlation of MR lumbar spine bone marrow perfusion with bone mineral density in female subjects/ Shih T.T., Liu H.C., Chang C.J. et al.// Radiology – 2004 - №233 – р.121–128. 81. Chen W.T. Blood perfusion of vertebral lesions evaluated with gadolinium- enhanced dynamic MRI: in comparison with compression fracture and metastasis/ Chen W.T., Shih T.T., Chen R.C. et al.// J Magn Reson Imaging – 2002 - №15 – р.308–314. 82. Tokuda O. Dynamic contrast-enhanced perfusion MR imaging of diseased vertebrae: analysis of three parameters and the distribution of the time-intensity curve patterns/ Tokuda O., Hayashi N., Taguchi K., Matsunaga N.// Skeletal Radiol – 2005 №34 – р.632–638. 83. Scherer A. Vertebral fractures in multiple myeloma: first results of assessment of fracture risk using dynamic contrast-enhanced magnetic resonance imaging/ Scherer A.,· Wittsack H.J.,· Strupp C. et al.// Ann Hematol – 2002 - №81 – р.517–521. 84. Kanchiku T. Dynamic сontrast-enhanced magnetic resonance imaging of osteoporotic vertebral fracture/ Kanchiku T., Taguchi T., Toyoda K., Fujii K. et al.// Spine – 2003 - №28(22) – р.2522–2526. 85. Moulopoulos L.A. Detection of malignant bone marrow involvement with dynamic contrast-enhanced magnetic resonance imaging/ Moulopoulos L.A., Maris T.G., Papanikolaou N. et al.// Annals of Oncology – 2003 - №14 – р.152–158. 86. Rahmouni A. Bone marrow with diffuse tumor infiltration in patients with lymphoproliferative diseases: dynamic gadoliniumenhanced MR imaging/ Rahmouni A., Montazel J.L., Divine M. et al.// Radiology – 2003 - №229 – р.710–717. 175 87. Zha Y. Dynamic contrast enhanced magnetic resonance imaging of diffuse spinal bone marrow infiltration in patients with hematological malignancies/ Zha Y., Li M., Yang J.// Korean J Radiol – 2010 - №11 – р.187-194. 88. Hillengass J. Lumbar bone marrow microcirculation measurements from dynamic contrast-enhanced magnetic resonance imaging is a predictor of event-free survival in progressive multiple myeloma/ Hillengass J., Wasser K., Delorme S. et al.// Clin Cancer Res – 2007 - №3(2) – р.475-481. 89. Stejskal E.O.T. Diffusion mesaurements: spin echoes in the presence of time- dependent field gradient/ Stejskal E.O.T., Spin J.E.// Journal of Chemical Physics – 1965 - №42 – р.5. 90. Szafer A. Theoretical model for water diffusion in tissues/ Szafer A., Zhong J., Gore J.C.// Magn Reson Med – 1995 - №33(5) – р.697-712. 91. Baur A. Diffusion-weighted imaging of tumor recurrences and posttherapeutical soft-tissue changes in humans/ Baur A., Huber A., Arbogast S., et al.// Eur Radiol – 2001 - №11(5) – р.828-833. 92. Dudeck O. Diffusion-weighted magnetic resonance imaging allows monitoring of anticancer treatment effects in patients with soft-tissue sarcomas/ Dudeck O., Zeile M., Pink D., et al.// J Magn Reson Imaging – 2008 - №27(5) – р.1109-1113. 93. Chenevert T.L. Diffusion MRI: a new strategy for assessment of cancer therapeutic efficacy/ Chenevert T.L., Meyer C.R., Moffat B.A., et al.// Mol Imaging. – 2002 - №1(4) – р.336-343. 94. De Keyzer F. Dynamic contrast enhanced and diffusion-weighted MRI for early detection of tumoral changes in single-dose and fractionated radiotherapy: evaluation in a rat rhabdomyosarcoma model/ De Keyzer F., Vandecaveye V., Thoney H. et al.// Eur Radiol. – 2009 - №19(11) – р.2663-2671. 95. Ross B.D. Evaluation of cancer therapy using diffusion magnetic resonance imaging/ Ross B.D. Moffat B.A., Lawrence T.S., et al.// Mol Cancer Ther – 2003 №2(6) – р.581-587. 176 96. Schnapauff D. Diffusion-weighted echo-planar magnetic resonance imaging for assessment of tumor cellularity in patients with soft-tissue sarcomas/ Schnapauff D., Zeile M., Niederhagen M.B., et al.// J Magn Reson Imaging. – 2009 - №29(6) – р.13551359. 97. Uhl M. Evaluation of tumor necrosis during chemotherapy with diffusion- weighted MR-imaging: preliminary results in osteosarcomas/ Uhl M., Saueressig U., Koehler G., et al.// Pediatr Radiol. – 2006 - №36(12) – р.1306-1311. 98. Baur A. Diffusion-weighted MR imaging of bone marrow: differentiation of benign versus pathologic compression fractures/ Baur A., Stabler A., Bruning R., et al.// Radiology. – 1998 - №207 – р.349–356. 99. Baur A. Diagnostic value of increased diffusion weighting of a steady-state free precession sequence for differentiating acute benign osteoporotic fractures from pathologic vertebral compression fractures/ Baur A., Huber A., Ertl-Wagner B., et al.// AJNR Am J Neuroradiol. – 2001 - №22 – р.366–372. 100. Castillo M. Diffusion-weighted MR imaging offers no advantage over routine noncontrast MR imaging in the detection of vertebral metastases/ Castillo M., Arbelaez A., Smith J.K., Fisher L.L.// AJNR Am J Neuroradiol – 2000 - №21 – р.948–953. 101. Zhou X.J. Characterization of benign and metastatic vertebral compression fractures with quantitative diffusion MR imaging/ Zhou X.J., Leeds N.E., McKinnon G.C., Kumar A.J.// AJNR Am J Neuroradiol – 2002 - №23 – р.165–170. 102. Chan J.H. Acute vertebral body compression fractures: discrimination between benign and malignant causes using apparent diffusion coefficients/ Chan J.H., Peh W.C., Tsui E.Y., et al.// Br J Radiol – 2002 - №75(891) – р.207–214. 103. Herneth A.M. Vertebral metastases: assessment with apparent diffusion coefficient/ Herneth A.M., Philipp M.O., Naude J., et al.// Radiology – 2002 - №225(3) – р.889–894. 104. Maeda M. Quantitative assessment of diffusion abnormalities in benign and malignant vertebral compression fractures by line scan diffusion-weighted imaging/ 177 Maeda M., Sakuma M., Maier S.E., Takeda K.// AJR Am J Roentgenol – 2003 №181(5) – р.1203–1209. 105. Savelli G. Bone scintigraphy and the added value oа the SPECT (single proton emission tomography) in detecting skeletal lesions/ Savelli G. et al.// QJ Nucl Med – 2001 - №45(1) – р.27-37. 106. Fogelman, I. Comparison for bone scanning and radiology in metabolic bone/ Fogelman I., Carr D.H.// J. Nucl. Med. – 1979. – №20(5) – р.602. 107. Fogelman I. Bone scanning in osteoporosis: the role of the bone scan and photon absorptiometry. In: Freeman L, ed. Nuclear medicine annual. New York, NY: Raven – 1990 – р.1-35. 108. Kolb F. Insufficiency fractures of the pelvis in severe osteoporosis (abstr)/ Kolb F., Morita E., Rodvien R.// Bone Miner Res – 1992 - I7(suppl 1) – р.298. 109. Ryan P.J. Osteoporosis and chronic back pain: a study with SPECT bone scintigraphy/ Ryan P.J., Evans P., Gibson T., Fogelman I.// Bone Miner Res – 1992 №7 – р.1455-1459. 110. Matin P. The appearance of bone scans following fractures, including immediate and long term studies/ Matin P.// J Nucl Med – 1979 - №20 – р.1227-1231. 111. Buyukdereli G. Tc-99m MIBI uptake in traumatic vertebral fractures and metastatic vertebral lesions: comparison with Tc-99m MDP/ Buyukdereli G., Ermin T., Kara O., Kibar M.// Adv Ther. – 2006 - №23(1) – р.33-38. 112. Thariat J. Sensitivity and specificity of thallium-201 scintigraphy for the diagnosis of malignant vertebral fractures/ Thariat J., Toubeau M., Ornetti P. et al.// Eur J Radiol. – 2004 - №51(3) – р.274-278. 113. Tokuda O. Malignant versus benign vertebral compression fractures: can we use bone SPECT as a substitute for MR imaging?/ Tokuda O., Harada Y., Ueda T. et al.// Nucl Med Commun. – 2011 - №32(3) – р.192-198. 114. Knapp E.L. Diagnostic imaging update: soft tissue sarcomas/ Knapp E.L., Kransdorf M.J., Letson G.D.// Cancer control – 2005 – №12(1) – р.22–26. 178 115. Dehdashti F. Benign versus malignant intraosseous lesions: discrimination by means of PET with 2-[F-18] fluoro-2-deoxy-D-glucose/ Dehdashti F., Siegel B.E., Griffeth L.K., et al.// Radiology – 1996 - №200(1) – р.243–247. 116. Glaspy J.A. Use of positron emission tomography in oncology/ Glaspy J.A., Hawkins R., Hoh C.K., Phelps M.E.// Oncology (Williston Park) – 1993 - №7(7) – рр. 41–46, 49–50. 117. Schmitz A. FDG-PET findings of vertebral compression fractures in osteoporosis: preliminary results. Schmitz A., Risse J.H., Textor J., et al.// Osteoporos Int – 2002 - №13(9) – р.755–761. 118. Shon I.H. F-18 FDG positron emission tomography and benign fractures/ Shon I.H., Fogelman I.// Clin Nucl Med – 2003 - №28(3) – р.171–175. 119. Bredella M. Use of FDG-PET in differentiating benign from malignant compression fractures/ Bredella M., Essary B., Torriani M. et al.// Skeletal Radiol – 2008 - №37 – р.405–413. 120. Cho W. Comparison of MR imaging and FDG-PET/CT in the differential diagnosis of benign and malignant vertebral compression fractures/ Cho W., Chang U.// J Neurosurg Spine – 2011 - №14 – р.177–183. 121. Ensrud K.E. What proportion of incident morphometric vertebral fractures are clinically diagnosed and vice versa?/ Ensrud K.E., Nevitt M.C., Palermo L. et al.// J Bone Miner Res – 1999 - №14S138. 122. Ettinger B. Clinical assessment of osteoporotic vertebral fractures/ Ettinger B, Cooper C.// In: Genant H.K., Jergas M., van Kuijk C. (ed) Vertebral fracture in osteoporosis. Radiology Research and Education Foundation, San Francisco, 1995 – p.15–20. 123. Posner J. Back pain and epidural spinal cord compression/ Posner J.// Med Clin North Am – 1987 - №71 – р.185-205. 124. Guidetti B. Differential diagnosis of intramedullary and extramedullary tumors/ Guidetti B., Fortuna A.// In Vinken P., Bruyn G. Handbook of clinical neurology. Amsterdam: North-Holland, 1975 – р.51-75. 179 125. Tyrrell P. Bone Metastasis 1: Spine/ Tyrrell P., Cassar-Pullichino V., Lalam R., Tins B.// In Davies A., Sundaram M.. James S. Imaging of bone tumors and tumor-like lesions. Springer – 2009 – р.464-477. 126. Laredo J.D. Vertebral hemangiomas: radiologic evaluation/ Laredo J.D., Reizine D., Bard M., Merland J.J.// Radiology – 1986 - №161 – р.183-189. 127. Angtuaco E.J. Multiple Myeloma: Clinical review and diagnostic imaging/ Angtuaco E.J., Fassas A., Walker R. et al.// Radiology – 2004 - №231 – р.11-23. 128. Price H. Computed tomographic findings in benign diseases of the vertebral column/ Price H., Batnitzky S.// CRC Crit Rev Diagn Imaging – 1985 - №24(1) – р.3989. 129. Angtuaco E.J. Imaging studies/ Angtuaco E.J., Moulopoulos L.A., Hronas T.// In: Mehta J., Singhal S., eds. Myeloma. London, England: Dunitz – 2002 – р.297–309. 130. Choi J. Osseous metastasis from renal cell carcinoma: “Flow-Void” sign at MR imaging/ Choi J., Lee K., Jun W. et al.// Radiology – 2003 - №228 – р.629–634. 131. Laredo J. Vertebral hemangiomas: fat content as a sign of aggressiveness/ Laredo J., Assouline E., Gelbert F. et al.// Radiology – 1990 - №177 – р.467-472.