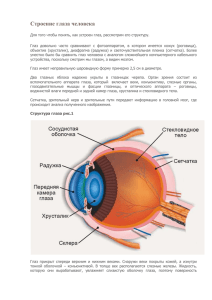
Документ 2309246
реклама

«East — West» Proceedings of the International Scientific Meeting Editor-in-Chief MD M. M. Bikbov (Ufa, 13–14 May, 2011) U fa — 2 0 11 «Восток — Запад» Сборник научных трудов научно-практической конференции по офтальмохирургии с международным участием (Уфа, 13–14 мая 2011 г.) Под редакцией профессора М. М. Бикбова У ф а — 2 0 11 УДК 617.7 ББК 56.7 В78 Ответственный редактор доктор медицинских наук, профессор М. М. Бикбов Редакционная коллегия: А. Ф. Габдрахманова, В. К. Суркова, А. Р. Халимов, Н. Е. Шевчук В78 Восток — Запад : сборник научных трудов научно-практической конференции по офтальмохирургии с международным участием «Восток — Запад», 13–14 мая 2011 г. / ГУ «Уфимский научноисследовательский институт глазных болезней» Академии наук Республики Башкортостан ; под ред. проф. М. М. Бикбова. — Уфа : ДизайнПолиграфСервис, 2011. — 572 с.: ил. ISBN 978-5-94423-234-2 В сборнике приведены статьи по широкому кругу проблем офтальмологии. В 9 разделах освещаются вопросы хирургического лечения, организации офтальмологической помощи, представлены результаты клинических и экспериментальных исследований, показана эффективность современных способов диагностики патологии различных отделов глаза и орбиты, рассмотрены уникальные случаи из практической медицины. Изложенные в сборнике материалы представляют интерес для офтальмохирургов, офтальмологов общей практики, научных сотрудников. The volume consist of the articles concerning the wide spectrum of problems of ophthalomology. In 9 sections the stu­ dies of the surgical treatment, the ophthalmic aid organization, the results of clinical and experiment investigations, the efficacy of modern diagnostic methods of different parts of the eye and orbit, unique cases of practice medicine are elucidated. The materials stated in collected articles are of interest of ophthalmosurgeons, ophthalmologists and research workers. Материалы в сборник помещены в авторской редакции. УДК 617.7 ББК 56.7 Научное издание Восток — Запад Сборник научных трудов Сдано в набор 13.04.2011. Подписано в печать 29.04.2011. Формат 60×84/8. Бумага офсетная. Гарнитура «Times». Печать ризографическая. Усл. печ. л. 66,49. Уч.-изд. л. 71,21. Тираж 300 экз. Заказ 115 Техническое редактирование и верстка выполнены в издательстве «ДизайнПолиграфСервис». 450077, г. Уфа, ул. К. Маркса, 37, оф. 205; тел. (347) 291-13-60. www.dizainpress.ru Отпечатано в типографии ООО «ДизайнПресс». Почтовый адрес: 450000, Уфа-центр, а/я 1535. E-mail: dizain_press@mail.ru ISBN 978-5-94423-234-2 © Уфимский научно-исследовательский институт глазных болезней АН РБ, 2011 © Оформление. ООО «ДизайПресс», 2011 Содержание Раздел I Организация офтальмологической помощи . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19 М. М. Бикбов Уфимский нии глазных болезней: роль и место в инновационном развитии офтальмологической науки . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 20 М. М. Бикбов, Л. Х. Мурова, И. М. Кагиров Итоги работы офтальмологической службы в Республике Башкортостан за 2010 год. . . . . . . . . . . . . . . . . 22 Т. К. Ботабекова, М. М. Курмангалиева, З. А. Джуматаева, Н. А. Алдашева Первая всемирная неделя глаукомы в Казахстане. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28 А. М. Газизов Анализ работы взрослого консультативно-поликлинического отделения Уфимского нии глазных болезней за 2006–2010 годы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 29 Г. М. Гизатулина, С. А. Петров Вопросы к организации офтальмологической помощи студентам с миопией. . . . . . . . . . . . . . . . . . . . . . . . 32 И. М. Кагиров, Л. Х. Мурова Офтальмохирургическая помощь в микрохирургических центрах и отделениях Республики Башкортостан по итогам 2010 года . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 34 Т. М. Калинина, С. Р. Авхадеева Состояние офтальмологической помощи и некоторые показатели глазной заболеваемости детей за 2007–2009 годы в Республике Башкортостан. . . . . . . . . . . . . . . . . . . . . . 35 Г. С. Кригер, Р. Р. Яруллина Наш опыт применения дистанционных форм профессионального обучения. . . . . . . . . . . . . . . . . . . . . . . . 37 В. Я. Мельников, Е. C. Куликова, Ю. В. Мельникова, Л. К. Ярлыкова Детский глазной травматизм в Приморском крае. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 38 Г. А. Моисеева, О. Ю. Колесников Структура детской инвалидности по зрению в Рязанской области. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40 А. Ш. Мухамедьянова, З. Р. Марванова Анализ клинико-экспертной работы и экспертизы временной нетрудоспособности гу «Уфимский нии глазных болезней» ан рб за 2010 год. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 42 Е. С. Пшеницына, В. В. Тюгашова, Ю. Г. Гусева, О. Н. Волкова, О. В. Липашева Интернет-ресурсы в создании безбарьерной среды для слабовидящих и слепых, проживающих в отдаленных районах Самарской области. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44 А. Э. Свирская Итоги изобретательской деятельности Уфимского нии глазных болезней за период с 2008 по 2011 годы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 46 В. В. Соловьёв Избранные биоэтические и правовые аспекты офтальмохирургической практики. . . . . . . . . . . . . . . . . . . 47 В. К. Суркова Интеллектуальная собственность Уфимского нии глазных болезней . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 49 М. А. Фролов, Н. С. Морозова, А. М. Фролов Оценка эффективности школы больных первичной открытоугольной глаукомой . . . . . . . . . . . . . . . . . . . . 51 Раздел II Патология роговицы и рефракционная хирургия . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 53 Albert Daxer Corneal intra-stromal implantation surgery (cisis) for the treatment of keratoconus . . . . . . . . . . . . . . . . . . . . . . 54 G. Wollensak Corneal collagen crosslinking: new hope. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 54 С. И. Анисимов; В. Н. Трубилин, К. А. Золоторевский Результаты проведения персонализированного кросслинкинга для лечения кератоэктазий. . . . . . . . . . . . 57 5 М. М. Бикбов, М. Ш. Абсалямов, А. А. Бикбулатова Дополнительная псевдофакичная иол Rayner Sulcoflex: новые возможности коррекции остаточной аметропии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 58 М. М. Бикбов, Г. М. Бикбова, А. Р. Халимов «Декстралинк» — новый протектор роговицы для кросслинкинга . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 60 М. М. Бикбов, Е. М. Гарипова, Г. М. Бикбова Структура аберраций у пациентов с кератоконусом после кросслинкинга роговичного коллагена. . . . . . 61 М. М. Бикбов, А. Х. Исхакова Имплантация интрастромальных роговичных сегментов Keraring в лечении пеллюцидной дегенерации роговицы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 63 Г. М. Бикбова, В. А. Заболотная Гистоморфология роговицы в отдаленный период после кросслинкинга по поводу кератоконуса . . . . . . 64 Г. М. Бикбова, А. Р. Халимов, Н. Э. Баймухаметов Кросслинкинг роговичного коллагена в лечении кератоконуса, отдаленные результаты . . . . . . . . . . . . . . 67 А. Р. Габбасов, И. Э. Мулдашева Алгоритм диагностики раннего кератоконуса (предварительное сообщение) . . . . . . . . . . . . . . . . . . . . . . . 69 Р. М. Гимранов Эксимерлазерная коррекция аномалий рефракции. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 71 В. В. Жаров, П. А. Перевозчиков, М. П. Григорьева, Н. Н. Самарцева, А. Н. Лялин Трансплантат — носитель наночастиц для хирургического лечения прогрессирующей миопии. . . . . . . . 72 А. В. Золоторевский, Н. Ф. Пашинова, К. Б. Першин, К. А. Золоторевский, Erkin Abdullayev Клиническое применение консервированной трупной роговицы с использованием среды «Eusol-C». . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 74 В. Н. Канюков, Ю. В. Канюкова, Д. А. Илюхин Первые результаты лечения буллезной кератопатии методом кросслинкинга коллагена роговицы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75 А. В. Колесников, М. Н. Николаев, О. И. Баренина, Щулькин, М. А Балакирев Коррекция свободнорадикального статуса роговицы препаратом «мексидол» после поверхностной эксимерлазерной абляции (фрк, епи-ласик) в эксперименте . . . . . . . . . . . . . . . 76 И. М. Корниловский Эксимерлазерные технологии при патологии роговицы и их классификация. . . . . . . . . . . . . . . . . . . . . . . . 79 С. А. Коротких, О. Г. Макеев, А. С. Шамкин, М. Ю. Герасимов, А. Е. Зверева, В. С. Коротких Сравнительнй опыт применения силикон-гидрогелевых линз у пациентов после эксимерлазерной коррекции методом LASEK . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81 А. Р. Корсиладзе, В. Н. Трубилин, С. И. Анисимов, К. А. Золоторевский Исследование морфологических изменений в роговице после проведенного кросслинкинга в эксперименте . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 83 Ш. Р. Кузбеков, Б. Т. Фаттахов Сравнительное исследование эффективности слезозамещающих препаратов в лечении синдрома сухого глаза у пациентов, перенесших LASIK. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 84 Н. А. Левченко, О. И. Кривошеина, И. В. Запускалов Роль аутологичных мононуклеаров крови в процессе заживления экспериментального поражения роговицы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 87 В. Р. Мамиконян, С. В. Труфанов Автоматизированная эндотелиальная кератопластика с трансплантацией десцеметовой мембраны (DMAEK). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 89 В. Р. Мамиконян, С. В. Труфанов Автоматизированная эндотелиальная кератопластика с удалением десцеметовой мембраны (DSAEK). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 91 В. Р. Мамиконян, С. В. Труфанов Обратная грибовидная кератопластика в хирургическом лечении буллезной кератопатии. . . . . . . . . . . . . 93 В. Р. Мамиконян, С. В. Труфанов Частичная обратная грибовидная кератопластика в лечении буллезной кератопатии . . . . . . . . . . . . . . . . . 95 Л. Р. Марванова, З. Р. Марванова, З. Р. Муслимова Количество эндотелиоцитов роговицы после факоэмульсификации катаракты. . . . . . . . . . . . . . . . . . . . . . 97 6 А. М. Нугуманова, Г. Х. Хамитова Состояние вегетативной нервной системы у пациентов с миопической рефракцией . . . . . . . . . . . . . . . . 100 Н. К. Полянская Комплексная профилактика инфекционных осложнений после сквозной кератопластики. . . . . . . . . . . . 101 К. Н. Руссков, С. Ю. Туровский, Е. А. Спиридонов, А. Н. Савельева Предварительный анализ динамики волнового фронта через год после эксимер-лазерной коррекции зрения, выполненной по методике «FemtoLASIK» и «MAGEK®». . . . . . . 103 В. А. Соколов, А. А. Федотов, Н. В. Исаева Аутоконъюнктивальная кератопластика с жесткой фиксацией в ложе дефекта как метод ургентной хирургии в лечении язвенных поражений роговицы. . . . . . . . . . . . . . . . . . . . . . . . . 104 А. Н. Ульянов, С. В. Ребриков, М. В. Иванова Анализ результатов ультрафиолетового кросслинкинга роговичного коллагена у пациентов с прогрессирующим кератоконусом по данным Oculus Pentacam. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 106 Б. Т. Фаттахов, С. Р. Хуснитдинова, И. И. Хуснитдинов Результаты офтальмоэргономических исследований после эксимерлазерной коррекции миопии высокой степени. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 108 А. Ф. Хабибуллин Случай лечения решетчатой дистрофии роговицы i типа методом кросслинкинга. . . . . . . . . . . . . . . . . . 109 И. И. Хуснитдинов, С. Р. Хуснитдинова Комплексная оценка LASIK при коррекции миопии высокой степени . . . . . . . . . . . . . . . . . . . . . . . . . . . . 111 А. Д. Чупров, Н. А. Кулигина Первый опыт применения уф-кросслинкинга . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 113 А. Д. Чупров, А. Г. Юдин Применение препарата «ВИЗИН чистая слеза» фирмы farmigea s. p. A (Италия) у пациентов после кераторефракционной хирургии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 114 Н. Е. Щеткина Изменение показателей внутриглазного давления после рефракционной операции LASIK. . . . . . . . . . . 115 Раздел III Новые технологии факоэмульсификации катаракты . . . . . . . . . . . . . . . . . . . . . . . . 117 Mathias Wagner Outcome of Phacoemulsification with torsional ultrasound. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 118 Р. А. Азнабаев, Р. Х. Искандаров, Д. Г. Кувандыкова Эффективность применения программного обеспечения OZil Intelliqent Phaco при факоэмульсификации катаракты . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 118 К. Н. Ахтямов, А. Р. Кашаева, Э. Л. Усубов Анализ остроты зрения у пациентов, оперированных по поводу дислокации ЗК иол и полного вывиха собственного хрусталика в зависимости от метода операции. . . . . . . . . . . . . . . . . . . . 119 М. М. Бикбов, М. Ш. Абсалямов, Г. Р. Алтынбаева Имплантация мультифокальной дифракционно-рефракционной ИОЛ после кераторефракционной операции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 121 А. А. Бикбулатова Контрастная чувствительность при односторонней гиперметропии высокой степени до и после рефракционной ленсэктомии с имплантацией ИОЛ. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 123 Р. А. Гундорова Т. Н. Киселева, К. А. Рамазанова, И. Ю. Бехорашвили, О. Г. Оганесян Возможности ультразвуковой иммерсионной биометрии для расчета оптической силы ИОЛ у пациентов с миопией. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 124 С. Г. Игнатьев, С. Г. Игнатьева, И. Х. Аль-Дандан, Н. Н. Бабошина Клиническое исследование актуальности вопроса профилактики и превентивного лечения начальной и незрелой катаракты. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 126 М. А. Ковалевская, В. Л. Кокорев, П. А. Шаповалов, Л. А. Филина, Н. В. Ведринцева К вопросу прогнозирования и профилактики послеоперационных осложнений в хирургии диабетической катаракты. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 128 А. В. Колесников, О. И. Баренина Имплантация капсульных колец в осложненных случаях хирургии катаракты . . . . . . . . . . . . . . . . . . . . . 130 7 А. В. Колесников, М. Г. Редкина, А. В. Кузьмин, В. Г. Васильев Инновационные технологии факоэмульсификации катаракты: ozil ip 1.8, Restore toric iq, иммерсионная биметрия. Первые клинические результаты. . . . . . . . . . . . . . . . . . . . . . . .132 А. В. Колесников, О. В. Шевякова Случай реимплантации ИОЛ в связи с нарушением ее прозрачности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 134 В. М. Малов, Е. Б. Ерошевская, И. В. Малов, С. Ю. Бочкарев, Ф. С. Галеева, Т. А. Осипова Непосредственные результаты интракапсулярной экстракции катаракты сублюксированного хрусталика. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 135 Б. Э. Малюгин, А. В. Терещенко, Ю. А. Белый, С. К. Демьянченко К вопросу о разрешающей способности интраокулярных линз. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 137 Р. Ф. Маннанова, А. А. Бикбулатова Возможности метода «полиартифакия» (обзор литературы). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 139 Л. В. Мироненко, В. А. Соколов, А. С. Пшенникова Технология «OZil® Intelligent Phaco» при удалении катаракт различной степени зрелости и плотности . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 142 А. Л. Рахматуллин, К. Р. Шавалеева Способ профилактики экссудата передней камеры после факоэмульсификации катаракты при осложненных случаях . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 143 И. А. Сайфуллина, Е. Г. Григорьева Методика ротационной ультразвуковой факоэмульсификации хрусталика при псевдоэксфолиативном синдроме. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 144 Тарасова М. Б., Фиронов Д. В. Анализ суммарных оптических аберраций после имплантации сферических ИОЛ. . . . . . . . . . . . . . . . . . 145 С. Ю. Туровский, Г. В. Крайнов Изменение величины исходного физиологического астигматизма после топографоориентированной факоэмульсификации катаракты. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 147 М. Ю. Тяжев, М. А. Шантурова, Е. Г. Шишкина Факоэмульсификация катаракты у пациентов с факичными иол . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 148 А. Д. Чупров, Ю. В. Кудрявцева, А. А. Замыров, К. С. Ивонин Опыт имплантации отечественной интраокулярной линзы «МИОЛ-26» . . . . . . . . . . . . . . . . . . . . . . . . . . 150 О. В. Шиловских, О. В. Сафонова, М. В. Иванова Результаты хирургического лечения катаракты на фоне хронических вялотекущих увеитов. . . . . . . . . . 151 Раздел IV Диагностика и лечение глаукомы . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 153 Г. Ш. Абизгильдина Значение сфигмометрических показателей в диагностике первичной открытоугольной глаукомы. . . . . . . 154 В. Н. Алексеев, Е. Б. Мартынова, И. Р. Газизова Состояние митохондрий аксонов зрительного нерва при экспериментальной глаукоме. . . . . . . . . . . . . . 156 С. Ю. Анисимова, С. И. Анисимов, И. В. Рогачева Результаты хирургического лечения различных клинических форм глаукомы с использованием биологического коллагена . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 158 А. Э. Бабушкин К вопросу о цилиохориоидальной отслойке после фистулизирующих операций. . . . . . . . . . . . . . . . . . . . 160 А. Э. Бабушкин, Е. И. Гумерова, О. И. Оренбуркина, Х. Г. Файзуллина, Э. К. Рыскулова Первый опыт применения дуотрава в лечении первичной открытоугольной глаукомы. . . . . . . . . . . . . . . 161 А. Э. Бабушкин, Л. Х. Мурова, О. И. Оренбуркина, Е. Н. Матюхина К вопросу о выявляемости, лечении и инвалидности от глаукомы в Республике Башкортостан за 2010 год. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 163 А. Э. Бабушкин, О. И. Оренбуркина, Е. Н. Матюхина, Н. Г. Саяпов, Ф. З. Имангулов, А. З. Калентьева Первичная инвалидность вследствие глаукомы в Республике Башкортостан за 2009 год. . . . . . . . . . . . . 165 А. Э. Бабушкин, О. И. Оренбуркина, А. Л. Рахматуллин, О. В. Чайка, Е. Н. Матюхина К вопросу о лечении неоваскулярной глаукомы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 166 8 А. Э. Бабушкин, О. И. Оренбуркина, Э. К. Рыскулова, Э. Ф. Файзуллина, Д. К. Абсаликова, М. Р. Файзуллина Отдаленные результаты гипотензивной терапии открытоугольной глаукомы комбинированным антиглаукомным препаратом. . . . . . . . . . . . . . . . . . . . . . . 167 А. Э. Бабушкин, Н. Е. Шевчук, О. И. Оренбуркина, Е. Н. Матюхина О влиянии цитокинов на репаративные процессы и исход антиглаукоматозных операций. . . . . . . . . . . . 168 Ю. А. Белый, А. В. Терещенко, И. А. Молоткова Применение анти-vegf препаратов в лечении неоваскулярной глаукомы. . . . . . . . . . . . . . . . . . . . . . . . . 171 А. Е. Галиева, О. И. Оренбуркина Эффективность использования клонидина у больных с открытоугольной глаукомой. . . . . . . . . . . . . . . . 173 С. Г. Гумерова, О. И. Оренбуркина Пептидные регуляторы в лечении больных первичной открытоугольной глаукомой. . . . . . . . . . . . . . . . . 174 И. В. Запускалов, О. И. Кривошеина, Ю. И. Хороших Роль плоскостного давления в патогенезе глаукомной оптической нейропатии. . . . . . . . . . . . . . . . . . . . . 175 С. Г. Игнатьев, С. Г. Игнатьева, И. Х. Аль-Дандан, Н. Н. Бабошина Активная и пассивная внутриглазная секреция в норме и при возрастной катаракте . . . . . . . . . . . . . . . . 177 С. Г. Игнатьев, С. Г. Игнатьева, И. Х. Аль-Дандан, Н. Н. Бабошина Эффективность внутриглазной гидродинамики как показатель функциональных нарушений внутриглазного гомеостаза. . . . . . . . . . . . . . . . . . . . . . . . . . 179 А. З. Калентьева, В. К. Суркова, Р. Т. Габсаликова К вопросу о наследственных факторах в диагностике первичной открытоугольной глаукомы . . . . . . . . 181 О. А. Киселева, Л. В. Якубова Трудности в развитии новых теоретических концепций патогенеза первичной открытоугольной глаукомы (обзор литературы). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .182 Е. В. Козина, Н. Э. Вахитова, В. Т. Гололобов К вопросу об эффективности местной медикаментозной гипотензивной терапии первичной открытоугольной глаукомы (предварительное сообщение) . . . . . . . . . . . . . . . . . . . . . . . . . . . . 184 М. А. Колесникова, А. В. Колесников, М. В. Соломатина Эффективность антиглаукомных операций фильтрующего типа при глаукоме нормального давления. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 186 А. В. Куроедов, В. Ю. Огородникова, В. В. Городничий, А. А. Эркенова Позиционирование прогрессирования перипапиллярной атрофии у пациентов с разными формами открытоугольной глаукомы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 188 Н. И. Курышева, Е. В. Топольник, В. Н. Трубилин Селективная лазерная трабекулопластика у больных с артифакией: особенности послеоперационного периода и отдаленные результаты. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 190 Б. Э. Малюгин, Е. В. Ковшун, В. А. Власова, Д. Г. Узунян, И. Н. Шормаз Возможности оптической когерентной томографии переднего отрезка глаза и ультразвуковой биомикроскопии в диагностике вторичной глаукомы у пациентов с сосудистыми бельмами. . . . . . . . . . 192 С. А. Петров, Т. Н. Тезелашвили, С. А. Рухлова, Т. С. Клиндюк Дистрофические изменения роговицы при первичной открытоугольной глаукоме. . . . . . . . . . . . . . . . . . 194 В. М. Петухов, Л. Г. Сеннова Дифференцированный подход к местной гипотензивной терапии при первичной открытоугольной глаукоме . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 197 Е. С. Пшеницына Улучшение гемодинамики и гидродинамики глаза под влиянием отдельных физиотерапевтических факторов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 198 Т. В. Рязанцева, Г. Н. Маслякова, Л. И. Кравец Экспериментальное обоснование применения нового эксплантодренажа с наноструктурированной поверхностью при антиглаукоматозных операциях . . . . . . . . . . . . . . . . . . . . . 200 А. В. Терещенко, Ю. А. Белый, И. А. Молоткова, Е. В. Ерохина Хирургическое лечение первичной открытоугольной глаукомы с применением т-образного дренажа. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 201 Р. Р. Файзрахманов, Н. А. Собянин Влияние центральной толщины роговицы на внутриглазное давление в норме. . . . . . . . . . . . . . . . . . . . . 203 9 Х. Г. Файзуллина Эффективность консервативного лечения больных первичной открытоугольной глаукомой. . . . . . . . . . 205 М. А. Фролов, Н. С. Морозова, А. М. Фролов Эффективность и безопасность пероральной формы цитиколина (cdp — choline) в лечении глаукоматозной оптической нейропатии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 207 О. В. Чайка, О. И. Оренбуркина Результаты комбинированной хирургии катаракты и глаукомы у больных с умеренно повышенным офтальмотонусом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 209 А. П. Шахалова Объективная оценка параметров нейроретинального пояска при различных стадиях первичной открытоугольной глаукомы по данным оптической когерентной томографии. . . . . . . . . . . . . 211 С. Ю. Щербакова, С. В. Харинцева Эффективность селективной трабекулопластики в лечении нестабилизированной открытоугольной глаукомы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 212 Раздел V Лечение заболеваний сетчатки и зрительного нерва . . . . . . . . . . . . . . . . . . . . . . . . 215 Helmut G. Sachs Subretinal electronic chips allow blind patients to read letters and combine them to words. Technology and the transchoroidal implantation procedure. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 216 У. Р. Алтынбаев Хирургическое лечение экссудативной отслойки сетчатки, осложненной макулярным разрывом у пациента с врожденной ямкой зрительного нерва. . . . . . . . . . . . . . . . . . . . . . . . 217 Д. И. Беда Целесообразность применения экзогенных антиоксидантов в сочетании с гбо в лечении возрастной макулярной дегенерации. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 218 М. М. Бикбов, У. Р. Алтынбаев, А. Л. Ярмухаметова, Ф. Р. Амангильдина Динамика функциональных свойств сетчатки на фоне интравитреального введения препарата Луцентис у пациентов с влажной формой возрастной макулярной дегенерации. . . . . . . . . . . 220 М. М. Бикбов, У. Р. Алтынбаев, А. Л. Ярмухаметова, Р. М. Бикбулатов Анализ эффективности хирургического удаления неоваскулярных мембран у больных с влажной формой возрастной макулярной дегенерации . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 222 Г. Б. Валиева, С. Э. Шамсутдинова Применение антиоксидантных препаратов в терапии сухой формы возрастной макулярной дегенерации. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 224 З. Н. Валиуллина, В. К. Суркова Пути профилактики ретинальных осложнений у пациентов с сахарным диабетом 2 типа. . . . . . . . . . . . 227 Р. Т. Габсаликова, А. З. Калентьева Результаты интравитреального введения гемазы в комплексном лечении гемофтальма. . . . . . . . . . . . . . 229 Р. А. Гундорова Витрэктомия в лечении посттравматической рецидивирующей гифемы . . . . . . . . . . . . . . . . . . . . . . . . . . 230 И. А. Дашко, И. В. Запускалов, О. И. Кривошеина Эффективность комбинированной пневморетинопексии в хирургии регматогенной отслойки сетчатки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 232 С. Н. Зеленцов, В. М. Зеленцова Оптическая когерентная томография в диагностике поражения зрительного анализатора при рассеянном склерозе . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 234 Л. Х. Исангулова Окклюзионные поражения вен сетчатки: оценка гемодинамических, морфометрических, фибринолитических показателей. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 236 С. А. Коротких, Е. С. Князева, Е. С. Червякова Пептидная нейропротекция в лечении возрастной макулярной дистрофии сетчатки . . . . . . . . . . . . . . . . 240 А. В. Кузнецова, М. А. Александрова, В. Г. Лихванцева, А. В. Васильев, А. В. Карпова Морфологическая характеристика ретинального пигментного эпителия, культивируемого in vitro, как источника клеточной репарации. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 241 10 А. В. Кузнецова, В. Г. Лихванцева, М. А. Александрова, А. В. Федоренко Количественная оценка секреции vegf и pedf клетками ретинального пигментного эпителия глаза взрослого человека в культуре. . . . . . . . . . . . . . . . . . . . . . . . . 243 А. В. Кузнецова, Л. А. Милюшина, В. Г. Лихванцева, М. А. Александрова, А. В. Федоренко Методика получения культуры клеток ретинального пигментного эпителия. . . . . . . . . . . . . . . . . . . . . . . 244 В. Г. Лихванцева, Г. Г. Зиангирова, А. В. Федоренко, А. В. Кузнецова, М. А. Александрова, Э. О. Султанова, А. Ю. Салихов, О. В. Белоус Изучение эффективности репарации сетчатки с помощью технологии трансплантации культивированного ретинального пигментного эпителия (экспериментальные исследования) . . . . . . . . 245 В. Г. Лихванцева, К. А. Кузьмин, Г. Г. Зиангирова, А. В. Федоренко, А. В. Кузнецова, М. А. Александрова, Э. О. Султанова, А. Ю. Салихов, О. В. Белоус Способ количественной оценки эффективности клеточных технологий при репарации сетчатки. . . . . . 247 В. Г. Лихванцева, А. В. Федоренко, Э. О. Султанова, А. Ю. Салихов, О. В. Белоус, Е. В. Ильичова, М. В. Архипова Экспериментальные модели заболеваний сетчатки для разработки клеточных технологий (экспериментальные исследования). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 249 Н. В. Меркулова, Е. В. Тур, В. С. Рыкун Состояние светочувствительности сетчатки и гемодинамики сосудов глаза и орбиты при различных формах оптической нейропатии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 250 А. Ш. Мухамедьянова, Р. А. Азнабаев Динамика показателей лазерной сканирующей томографии сетчатки глаз у пациентов с предисциформной стадией возрастной макулярной дегенерации и гипертонической болезнью на фоне лечения препаратом Мексидол . . . . . . . . . . . . . . . . . 253 А. Ш. Мухамедьянова, Р. А. Азнабаев Функциональные показатели органа зрения у пациентов с предисциформной стадией возрастной макулярной дегенерации и гипертонической болезнью на фоне лечения препаратом Мексидол. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 255 В. В. Нероев, Т. Н. Киселева, М. В. Рябина, Т. Д. Охоцимская, О. В. Золотых Исследование состояния глазного кровотока в эксперименте у крыс допплеровскими методами. . . . . . 257 А. М. Нугуманова, Г. Х. Хамитова, А. Н. Шавалеев Возрастная макулодистрофия у пациентов с миопической рефракцией . . . . . . . . . . . . . . . . . . . . . . . . . . . 259 О. И. Оренбуркина, А. Э. Бабушкин Применение нейропротектора ретиналамин в лечении глаукомной оптической нейропатии (обзор литературы). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 261 М. С. Петрачкова, И. В. Запускалов, Д. В. Петрачков Первый опыт применения ферментного препарата «коллализин» при лечении идиопатических макулярных разрывов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 263 Т. А. Свирина, Л. В. Мироненко, А. В. Колесников Анализ первых результатов субтотальной витрэктомии при различной офтальмопатологии. . . . . . . . . . 264 Л. Г. Сеннова, Т. И. Крикун, О. В. Рыжаева, Е. Е. Гришина, А. А. Суркова, Г. В. Цыгановкина Ретробульбарный неврит как проявление объемных процессов головного мозга. . . . . . . . . . . . . . . . . . . . 265 М. В. Сизова, И. А. Ронзина, Н. С. Галоян, Н. Л. Шеремет Сравнительная оценка структурных и функциональных параметров сетчатки до и после комплексного лечения диабетического макулярного отека. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 267 В. С. Стебнев Опыт использования Brilliant Blue G на тяжелой (дейтериевой) воде в хирургии идиопатических макулярных отверстий. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 269 В. С. Стебнев Хромовитрэктомия и интравитреальный краситель «Brilliant Blue G» (краткий обзор литературы). . . . 271 О. А. Степушина Ранняя диагностика и мониторинг диабетической ангиоретинопатии и гипертонической ангиопатии с использованием метода калиброметрии сосудов сетчатки в сочетании с адаптивной оптикой и флюоресцентной ангиографией у пациентов с аномалиями рефракции . . . . . . . 273 М. А. Фролов, Э. М. Альдиева Эффективность применения комплексного лечения возрастной макулярной дегенерации. . . . . . . . . . . . 275 11 Т. А. Чехова, В. И. Братко Комбинированное лечение острой формы центральной серозной хориоретинопатии. . . . . . . . . . . . . . . . 277 Т. В. Шелковникова, Д. А. Савин Барьерная лазеркоагуляция в профилактике осложнений ретиношизиса . . . . . . . . . . . . . . . . . . . . . . . . . . 278 Т. В. Шелковникова, Д. А. Савин Профилактическая лазеркоагуляция у пациентов с односторонней дегенеративной отслойкой сетчатки. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 279 Н. Л. Шеремет, Т. В. Смирнова, И. Ю. Разумова Вопросы дифференциальной диагностики оптического неврита и ишемической оптической нейропатии у лиц молодого и среднего возраста . . . . . . . . . . . . . . . . . . . . . . 280 О. Г. Шивелёва Результаты применения ретиналамина при лечении возрастной макулярной дегенерации в амбулаторных условиях . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 282 М. М. Шишкин, Н. М. Юлдашева, К. Т. Гаджиева, М. Мустафа Хадж Осман Фармакотерапия в системе щадящей витреоретинальной хирургии пролиферативной диабетической ретинопатии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 284 Раздел VI Воспалительные заболевания глаз и придаточного аппарата . . . . . . . . . . . . . . 287 Д. К. Абсаликова, В. Б. Мальханов, Н. Е. Шевчук Изучение локального содержания простагландина е2 при экспериментальном иммуногенном увеите кроликов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 288 м. Т. Азнабаев, Г. А. Азаматова, Р. Р. Хисматуллин Эффективность глазных лекарственных пленок с левофлоксацином в профилактике и лечении экспериментального бактериального эндофтальмита . . . . . . . . . . . . . . . . . . . 290 л. Т. Архипова, О. Г. Леванова, М. М. Архипова, Ю. А. Капитонов Патогенетически ориентированные подходы к профилактике и лечению посттравматических и послеоперационных неинфекционных воспалительных осложнений в глазу. . . . . . . . . . . . . . . . . . . . . 292 Е. Л. Атькова, А. А. Фёдоров, Л. В. Резникова, В. Г. Белоглазов, Г. А. Абдурахманов, Э. Р. Юсипова Особенности репаративного процесса после трансканаликулярной лазерной дакриоцисториностомии по данным цитологического исследования . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 294 Э. В. Бойко, А. Л. Позняк, М. В. Алябьев, В. С. Агеев Влияние хронической рино- и одонтогенной инфекции, включая хламидийную, на показатели местного иммунитета глаза. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 296 Ю. К. Бурханов, Р. Р. Абдуллин, Р. Р. Клявлин, Ш. Р. Кузбеков Опыт применения лазерного аппарата «ЛАХТА-МИЛОН» для лечения больных дакриоциститом в Уфимском НИИ глазных болезней АН РБ. . . . . . . . . . . . . . . . . 298 Ю. К. Бурханов, Ш. Р. Кузбеков, Л. П. Алексеева Хирургическое лечение дакриостенозов с помощью биканаликулярного дренирования . . . . . . . . . . . . . 299 а. Х. Газизова, З. Г. Узбекова Микрофлора конъюнктивальной полости и исследование ее чувствительности к антибиотикам . . . . . . 301 Л. Т. Газизова Анализ заболеваемости эпидемическим кератоконъюктивитом по данным обращаемости в Уфимский НИИ глазных болезней в 2010 г. . . . . . . . . . . . . . . . . . . . . . . . . . . 303 Г. Х. Зайнутдинова Изучение механизмов иммуно-гормональных взаимодействий при передних эндогенных увеитах. . . . 305 н. Б. Зайнуллина Кератит и кросслинкинг. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 309 н. Ю. Закелова Клиническое наблюдение пациентки с синдромом Фогта — Коянаги — Харада в возрастной период с 12 до 17 лет. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 310 М. Н. Йўлдошева, Х. М. Камилов, М. С. Касымова, Х. Н. Содиков Сравнительный анализ эффективности лечения герпетических кератитов. . . . . . . . . . . . . . . . . . . . . . . . . 313 х. М. Камилов, М. Н. Йўлдошева, Х. Н. Содиков Протефлазид в комплексном лечении герпетических заболеваний глаз. . . . . . . . . . . . . . . . . . . . . . . . . . . . 314 12 х. М. Камилов, М. С. Касымова, М. Н. Йўлдошева Результаты лечения больных с офтальмогерпесом при применении препаратов протефлазид и вирган. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 315 а. В. Колесников Показатели перекисного окисления липидов и антиоксидантной защиты крови при экспериментальной гнойной язве роговицы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 317 Д. Ю. Майчук, А. Р. Григорян, Л. Б. Чилингарян, И. А. Пронкин Современный взгляд на течение и стадии аденовирусного конъюнктивита. . . . . . . . . . . . . . . . . . . . . . . . 319 Д. Ю. Майчук, И. А. Пронкин Эффективность использования Вориконазола в комбинированной терапии грибковых кератитов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 320 Ю. Ф. Майчук, К. Е. Селиверстова, Е. В. Яни, Е. Р. Стирманова Оптическая когерентная томография переднего отдела глаза при герпетических поражениях роговицы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 322 В. Б. Мальханов, Г. Х. Зайнутдинова, Н. А. Никитин Метод экспресс-диагностики аденовирусного поражения поверхности глаза . . . . . . . . . . . . . . . . . . . . . . 323 В. Б. Мальханов, Г. Х. Зайнутдинова, Н. Е. Шевчук Диагностическое значение обнаружения ранних антител к вирусу герпеса простого и цитомегаловирусу при передних эндогенных увеитах. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 324 В. Б. Мальханов, Г. Х. Зайнутдинова, Н. Е. Шевчук Серологический профиль и оптимизация диагностики герпетической и цитомегаловирусной инфекций у больных передними эндогенными увеитами. . . . . . . . . . . . . . . . . . . 326 В. Б. Мальханов, Н. Е. Шевчук Синдром «сухого глаза»: диагностика, патогенез, лечение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 330 В. Б. Мальханов, Н. Е. Шевчук, Г. Х. Зайнутдинова Уровень антител к раннему, ядерному и капсидному антигенам вируса Эпштейна-Барр в сыворотке крови больных передним эндогенным увеитом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 336 Н. М. Марачева, Е. А. Дроздова Влияние комплексного консервативного лечения на показатели кровотока в сосудах глаза и орбиты при остром посттравматическом увеите. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 338 Н. М. Марачева, Е. А. Дроздова Динамика показателей регионарной гемодинамики у пациентов с осложненным течением посттравматического увеита. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 340 З. Р. Марванова, Л. Р. Марванова, Н. Е. Шевчук Тактика ведения больных с герпетическим кератитом до и после сквозной кератопластики. . . . . . . . . . 342 В. В. Позднякова, Л. Н. Якушина, Ю. Ф. Майчук Новые подходы в лечении глазной бактериальной инфекции, сопровождающейся аллергической реакцией. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 344 И. Ю. Разумова, Н. Л. Шеремет, В. В. Комов Гемосорбция и плазмаферез в лечении увеитов при некоторых аутоиммунных заболеваниях. . . . . . . . . 346 В. Р. Стирманова, Ю. Ф. Майчук, О. В. Кашаева, А. И. Щипанова Экспериментальное исследование новой глазной лекарственной формы деринат® — капли глазные. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 348 в. М. Хокканен, М. В. Соловьева, В. М. Батаев, О. Г. Ионова Исследование роли цитокинов в течении туберкулезных увеитов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 350 В. М. Хокканен, О. В. Чудинова Гемодинамические нарушения и их связь с пролиферативным процессом в клинике увеитов различного генеза. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 352 в. М. Хокканен, О. В. Чудинова Способ регистрации возникновения очаговой реакции при хориоретинитах. . . . . . . . . . . . . . . . . . . . . . . 354 л. Б. Чилингарян, Д. Ю. Майчук, А. Р. Григорян, Т. С. Финогенова Сравнительная оценка эффективности применения адаптированного алгоритма терапии у пациентов с сезонным аллергическим конъюнктивитом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 355 н. Е. Шевчук, В. Б. Мальханов Диагностика и лечение хламидийных конъюнктивитов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .357 13 Н. Е. Шевчук, В. Б. Мальханов Современное состояние проблемы диагностики и лечения аденовирусных конъюнктивитов и кератоконъюнктивитов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 360 Раздел VII Детская офтальмопатология . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 365 Uwe Kämpf, Igor Rabitchev, Felix Muchamedjarow & Elena Yachmeneva Temporal Phase Losses in Neuronal Coding as a Possible Reason for spatial distortions in Amblyopia. . . . . . 366 И. В. Ариткулова Случай травматической катаракты в сочетании с мидриазом у ребёнка с тубулоинтерстициальным поражением почек. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 367 м. М. Бикбов, И. С. Зайдуллин, Н. Г. Саяпов Патология хрусталика в нозологической структуре детской инвалидности по зрению в Республике Башкортостан. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 370 М. М. Бикбов, Л. Ш. Ишбердина, П. В. Назаров Анализ результатов витреоретинальных операций при ретинопатии недоношенных. . . . . . . . . . . . . . . . 372 н. Ф. Боброва, Т. А. Сорочинская, Л. А. Суходоева Локальная химиотерапия ретинобластом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 374 Р. Ф. Гайнутдинова, М. Г. Тухбатуллин, Л. П. Болгова, А. Н. Шарапова Особенности течения, диагностики и лечения острых воспалительных заболеваний орбиты у детей. . . . 376 И. А. Гндоян, А. В. Петраевский, В. В. Ковылин Опыт применения дренажной системы «AHMEDTM GLAUCOMA VALVE» в лечении врожденной глаукомы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 378 А. Г. Давлетшина Диагностика и прогнозирование течения ретинопатии недоношенных в рубцовой фазе . . . . . . . . . . . . . 380 А. Г. Давлетшина Состояние рефракции у детей с ретинопатией недоношенных в рубцовой фазе . . . . . . . . . . . . . . . . . . . . 383 в. В. Жаров, Д. И. Старикова, О. В. Блинова, Н. А. Звездина, В. Г. Лубнин, С. Г. Тоубкина, А. В. Зайцев Оптическая когерентная томография макулярной области сетчатки при амблиопии. . . . . . . . . . . . . . . . . 385 в. В. Жаров, Е. С. Мыкольникова, О. В. Ворошилова Лечение зрительного утомления у школьников на аппарате «Визотроник 3М». . . . . . . . . . . . . . . . . . 386 А. Ж. Жуманиязов Отдаленные результаты комбинированного метода лечения ангиом придаточного аппарата глаза у детей . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 388 и. С. Зайдуллин Отдаленные результаты хирургического лечения подвывиха хрусталика у детей. . . . . . . . . . . . . . . . . . . 390 е. Н. Иомдина, М. А. Аливердиева, Ж. Н. Иващенко, Н. А Тарасова, Г. А. Маркосян, К. В. Голубцов, В. Г. Трунов Возрастные и рефракционные особенности временной контрастной чувствительности к хроматическим стимулам у детей и лиц молодого возраста. . . . . . . . . . . . . . . . . . . . 393 А. Ф. Икрамов Клинические особенности миопии у школьников и факторы риска ее развития . . . . . . . . . . . . . . . . . . . . 395 А. Ф. Икрамов, Г. Н. Маматходжаева Лечение спазма аккомадации у детей школьного возраста . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 397 л. Ш. Ишбердина Медико-генетическая помощь населению Республики Башкортостан (лекция). . . . . . . . . . . . . . . . . . . . . 399 л. Ш. Ишбердина, П. В. Назаров, М. М. Нургалеева Витреоретинальные вмешательства при ретинопатии недоношенных . . . . . . . . . . . . . . . . . . . . . . . . . . . . 401 л. Ш. Ишбердина, Н. С. Чернова, И. В. Ариткулова Иммуногенетические особенности миопии у детей в Республике Башкортостан . . . . . . . . . . . . . . . . . . . 404 х. М. Камилов, Д. М. Бабаханова, М. С. Касымова Некоторые клинико-функциональные показатели у детей с гиперметропической амблиопией. . . . . . . . 407 х. М. Камилов, Н. И. Каримджанова, М. С. Касымова Функциональное состояние органа зрения у детей с хроническим гломерулонефритом. . . . . . . . . . . . . .409 14 в. Н. Канюков, В. Ю. Форофонтова Распространенность сердечно-сосудистой патологии среди пациентов детского возраста Оренбургского филиала ФГУ «МНТК микрохирургия глаза». . . . . . . . . . . . . . . . . . . . 410 а. А. Караваева, И. Е. Панова, Е. П. Тагиева, И. А. Червоняк Клинические особенности течения ретинопатии недоношенных у детей, рожденных от многоплодной беременности. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 413 Л. В. Коголева, Л. А. Катаргина Современные подходы к коагуляции сетчатки в активной фазе ретинопатии недоношенных . . . . . . . . . 415 Л. Б. Кононов, А. В. Хватова, Т. Б. Круглова, Л. В. Коголева, Н. С. Егиян Врожденные катаракты и интраокулярная коррекция у недоношенных детей. . . . . . . . . . . . . . . . . . . . . . 416 с. А. Коротких, М. А. Карякин, Е. А. Степанова, С. В. Хлопотов Витреоретинальная хирургия в лечении v стадии ретинопатии недоношенных. . . . . . . . . . . . . . . . . . . . 418 В. Я. Мельников, Е. C. Куликова, Ю. В. Мельникова, В. И. Негода Дакриоциститы новорожденных. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 420 П. И. Мусаев Галбинур, С. Т. Алиева, А. М. Абдуллаева Аккомодация глаза у детей с врожденной миопией. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 421 л. Р. Мухамедьярова Особенности цветовосприятия у детей с соматической патологией. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 424 р. М. Мухаметшина Ведущие факторы близорукости у школьников. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .425 п. В. Назаров, Л. Ш. Ишбердина, У. Р. Алтынбаев Результаты хирургического лечения отслоек сетчатки у детей. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 426 в. Г. Нафикова, Р. А. Азнабаев, Э. Ф. Файзуллина, А. А. Акманова Экстраокулярная патология у детей с бактериальным конъюнктивитом. . . . . . . . . . . . . . . . . . . . . . . . . . . 428 е. С. Пшеницына, О. А. Горшенева Наблюдение пациента с врожденным двусторонним микрофтальмом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 429 Л. З. Рахматуллина, Э. Р. Сафина, Е. И. Рыжая Результаты сочетанного применения чрескожной электростимуляции зрительного анализатора и воздействия инфракрасным излучением на рефлексогенные зоны периорбиты при лечении устойчивых форм содружественного косоглазия . . . . . . . . . . . . . . . . . . . . . . . . 431 В. С. Рыкун, Н. А. Ключко, С. А. Мохначева, Е. В. Ядыкина, А. В. Колесова, О. С. Куликова, М. В. Бойко, И. А. Сорокина, А. Ю. Семикина, Е. А. Лаптева Влияние центральной толщины роговицы на уровень внутриглазного давления у детей и подростков с различными видами рефракции . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 433 э. И. Сайдашева, В. А. Любименко, Н. В. Фомина Реализация городской программы по профилактике и лечению ретинопатии недоношенных (первый опыт в рф). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 435 р. Р. Саматова, З. А. Даутова, Ф. Х. Камилов Опыт применения препарата на основе хондроитин сульфата при лечении детей с прогрессирующей близорукостью. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 437 а. В. Терещенко, Ю. А. Белый, А. В. Терещенкова, Ю. А. Сидорова, П. Л. Володин Новая тактика лазерного лечения задней агрессивной ретинопатии недоношенных. . . . . . . . . . . . . . . . . 439 и. А. Филатова, И. А. Романова Хирургическое лечение рубцовых деформаций век у детей с врожденными и посттравматическими деформациями. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 441 Э. Г. Хуснутдинова Опыт комплексной терапии приобретенной близорукости. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 443 И. А. Червоняк, И. Е. Панова, Е. П. Тагиева Клинические особенности течения периферических витреохориоретинальных дистрофий у детей с прогрессирующей близорукостью . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 444 Н. С. Чернова Особенности гемодинамики в центральной артерии сетчатки при гемангиомах век у детей. . . . . . . . . . 446 Т. В. Янченко, Е. В. Громакина, Т. В. Кукуюк, Н. А. Билык Ретинобластома — трудности диагностики. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 448 15 т. В. Янченко, Е. В. Громакина, Т. В. Кукуюк, О. В. Фролова Токсико-аллергические реакции на глазном дне. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 449 о. М. Яраданкулиева, Т. Н. Киселева, Т. А. Малиновская, Л. В. Коголева Влияние магнитофореза и биорезонансной терапии на глазной кровоток у детей с ретинопатией недоношенных. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 451 Раздел VIII Травмы органа зрения. реконструктивные и пластические операции . . . . . . 453 А. Р. Амбарцумян Роль ультразвуковой биомикроскопии в диагностике офтальмосидероза. . . . . . . . . . . . . . . . . . . . . . . . . . 454 А. А. Акманова, А. Ж. Жуманиязов, А. А. Гайсина Хирургическое лечение блефароптозов (обзор литературы). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 456 С. И. Алекперов, В. А. Рейтузов, А. Б. Селезнев, Г. Г. Родионов, Д. В. Фокина Исследование возможности применения лечебной мягкой контактной линзы на этапах медицинской эвакуации . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 458 аммар али Ахмед Табет, Д. В. Давыдов, Л. А. Брусова Возможности устранения посттравматических дефектов и деформаций скуло-глазничного комплекса силиконовыми имплантатами . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 460 Г. Ф. Гайсина Структура энуклеаций и формирование постэнуклеационной культи по данным Уфимского НИИ ГБ за 2010 г.. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 461 Е. А. Горбунова, О. И. Кривошеина, А. А. Березовская, И. В. Запускалов Имплантат из никелида титана с аутологичными мононуклеарами крови в реконструктивно-пластической хирургии орбиты. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 462 р. А. Гундорова Витрэктомия в лечении посттравматической рецидивирующей гифемы . . . . . . . . . . . . . . . . . . . . . . . . . . 464 Р. А. Гундорова, Т. Н. Киселева, А. Н. Бедретдинов, Д. С. Беляев Диагностика изменений гемодинамических показателей при контузии глазного яблока . . . . . . . . . . . . . 465 Р. А. Гундорова, Н. Л. Лепарская, П. И. Шалдин Исследование показателей микроциркуляции глаза при травматической отслойке сетчатки до и после оперативного лечения. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 466 Е. А. Дроздова, Е. С. Бухарина, Г. М. Хакимова, И. А. Сироткина Диагностика повреждения экстраокулярных мышц при травме орбиты. . . . . . . . . . . . . . . . . . . . . . . . . . . 468 и. А. Кубарева, Н. К. Николайчук, М. А. Васева, Е. А. Гиззатуллина, А. А. Зенин Атрофия зрительного нерва как манифестация стрессорного воздействия черепно-мозговой травмы в судебно-медицинской экспертизе. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 470 а. В. Степанов, И. Б. Алексеева, К. В. Луговкина, М. А. Хральцова, В. В. Павлова Современные методы диагностики тяжелой контузионной травмы глаза. . . . . . . . . . . . . . . . . . . . . . . . . . 472 Р. Р. Файзрахманов Метод восстановления слезного канальца при отрыве нижнего века от внутреннего угла. . . . . . . . . . . . 475 Р. Р. Файзрахманов, Н. А. Собянин Программное обеспечение в пластической хирургии придаточного аппарата глаза . . . . . . . . . . . . . . . . . 477 и. А. Филатова, Е. Н. Иомдина, Д. Н. Ситникова Биомеханические свойства кожи век и бровей с рубцовой деформацией и свободных кожных трансплантатов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 479 И. А. Филатова, И. А. Романова Изменение показателя микроциркуляции крови свободного кожного аутотрансплантата при реконструкциях век под действием магнитотерапии. . . . . . . . . . . . . . . . . . . . . . . 480 Раздел IX Разное . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 483 А. В. Абсаликов, Д. К. Абсаликова Лечение синдрома сухого глаза (обзор литературы). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 484 16 л. П. Алексеева, Ш. Р. Кузбеков, А. Э. Бабушкин Тактика анестезиологического пособия для проведения лазерной эндоскопической дакриоцисториностомии в условиях отделения стационарзамещающих технологий . . . . . . . . . . . . . . . . 486 о. М. Бабайлова, И. Е. Панова, Ю. С. Клевакина, А. С. Мочалова Определение доминирующего психического состояния у пациентов с офтальмопатологией. . . . . . . . . . 487 ю. А. Белый, А. В. Терещенко Анализ эффективности комбинированного позиционирования электродов при проведении электрохимического лизиса больших внутриглазных новообразований в эксперименте . . . . . . . . . . . . . 489 е. А. Битная Опыт применения мягких контактных линз у пациентов зрелого возраста. . . . . . . . . . . . . . . . . . . . . . . . . 490 ю. К. Бурханов, В. Б. Мальханов, Д. К. Абсаликова, Н. А. Никитин Синдром Шарпа: клинико-диагностические мероприятия и лечение (случай из практики). . . . . . . . . . . 492 З. Н. Валиуллина, В. К. Суркова Пути профилактики ретинальных осложнений у пациентов с сахарным диабетом 2 типа. . . . . . . . . . . . 494 А. Ф. Габдрахманова Концепция диагностики онкопатологии органа зрения в Республике Башкортостан. . . . . . . . . . . . . . . . . 496 р. Ф. Гайнутдинова, Ф. С. Гилмуллина, Д. А. Бикмухаметова, О. М. Пигалова Случаи дирофиляриоза человека в Республике Татарстан. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 498 Р. Ф. Гайнутдинова, А. Н. Самойлов, А. Н. Амиров, М. Г. Тухбатуллин Итоги обучения врачей-офтальмологов ультразвуковой диагностике. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 500 Т. Р. Гильманшин, У. Р. Алтынбаев, К. Н. Ахтямов, Р. Т. Габсаликова, Л. П. Алексеева Преимущества и недостатки локальных путей введения препаратов в офтальмологии . . . . . . . . . . . . . . 501 Р. Г. Гиндуллина Сравнительный анализ прихода лекарственных средств по терапевтическим группам и лекарственным формам за 2009–2010 гг. в аптеке гу «уфнии гб» ан рб. . . . . . . . . . . . . . . . . . . . . . 503 л. Г. Загитова, А. Р. Хамзин Особенности анестезии в офтальмологии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 505 и. Ф. Ибрагимова Демодекоз век. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 506 А. З. Игдавлетова Современные методы лечения конъюнктивитов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 508 А. В. Киреева Фальсифицированные и забракованные лекарственные средства, методы контроля. . . . . . . . . . . . . . . . . 509 и. М. Кириченко Исследование эффективности препарата окомистин® в офтальмологии . . . . . . . . . . . . . . . . . . . . . . . 510 м. А. Колесникова, А. В. Колесников, Д. Р. Бурнашева Апитерапия в офтальмологии (обзор литературы). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 512 З. А. Кудашева Применение очковых линз с ar-покрытием у пациентов с пресбиопией. . . . . . . . . . . . . . . . . . . . . . . . . . 514 в. Г. Лихванцева, Т. Н. Сафонова, О. А. Гонтюрова К вопросу о клинике эндокринной офтальмопатии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 515 В. Г. Лихванцева, Н. Ю. Свириденко, Е. И. Руденко, О. А. Гонтюрова, В. А. Выгодин Антитела к тиреопероксидазе у пациентов с болезнью Грейвса как фактор риска развития тяжелых и высокоактивных форм эндокринной офтальмопатии. . . . . . . . . . . . . . . . . . . . . . . . . 517 В. Г. Лихванцева, Н. Ю. Свириденко, Е. И. Руденко, О. А. Гонтюрова, В. А. Выгодин Клинические и иммунологические параллели при эндокринной офтальмопатии. . . . . . . . . . . . . . . . . . . 520 В. Г. Лихванцева, Е. В. Степанова, Э. Ш. Соломко, Е. В. Арутюнян, О. В. Белоус, Р. С. Есипов, К. А. Бейрахова, В. Н. Степаненко Сравнительные аспекты биологической активности проангиогенных пептидов регуляторов ангиогенеза VEGF и β-FGF . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 522 В. Г. Лихванцева, С. И. Харлап, М. В. Мельникова Поиск экспертных эхографических признаков активности эндокринной офтальмопатии . . . . . . . . . . . . 523 17 а. Н. Лялин, В. В. Жаров, О. Е. Бутолина, О. А. Корепанова, А. В. Паймухин, О. В. Швецова Аппарат «визотроник мз» в лечении некоторых форм рефракционной и инволюционной офтальмопатологии . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 525 о. С. Мальковская Методы и средства лучевой диагностики . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 527 в. Б. Мальханов, Е. И. Гумерова Применение окомистина при воспалительных заболеваниях глазной поверхности. . . . . . . . . . . . . . . . . . 529 В. С. Мезенцева Санаторно-курортное лечение глазных болезней. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 531 н. Ф. Молокова, Н. В. Малых, Е. М. Ремнякова Сравнительные данные результатов эхобиометрических исследований в трех поколениях близоруких пациентов. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 534 З. Р. Муслимова, З. А. Даутова, Ш. М. Сафин, И. М. Заитов Динамика зрительных нарушений в зависимости от способа оперативного вмешательства у пациентов с новообразованиями хиазмально-селлярной области. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 534 а. Ф. Никитина, Д. К. Абсаликова, Н. А. Никитин Антиоксидантная система зрительного анализатора и антиоксиданты, применяемые в офтальмологии (обзор литературы). . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .536 А. М. Нугуманова, Г. Х. Хамитова, Н. И. Хамидуллина Уровень глюкозы в слезе при сахарном диабете. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 540 а. А. Плюхова, М. В. Будзинская, Г. Н. Соболева, Э. Э. Казарян, Н. С. Галоян, В. К. Сургуч Структурные изменения нейроэпителия у пациентов с системным атеросклерозом по данным оптической когерентной томографии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 542 М. А. Прокопьев, В. А. Пислегина, Е. В. Ивашкина Опыт применения наропина в офтальмологии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 543 и. С. Сусло, И. Е. Панова, И. А. Кученкова, Л. Е. Семенова, Д. А. Важенина Клиническая характеристика эпителиальных злокачественных опухолей кожи век при первично-множественном поражении в условиях офтальмоонкологического центра г. Челябинска . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 545 Н. А. Сухов Лазерная энергия в хирургии переднего отдела глаза . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 546 з. Г. Узбекова, А. Х. Газизова Показатели работы клинико-диагностической лаборатории ГУ «УфНИИ ГБ» АН РБ за 2007–2009 гг.. . . 548 Л. М. Фархутдинова Лечение эндокринной офтальмопатии. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 549 Л. Л. Фаттахова Роль экстемпоральных лекарственных средств в современной медицине. . . . . . . . . . . . . . . . . . . . . . . . . . 551 а. Р. Халимов, Э. Ф. Файзуллина Анализ работы гистологической службы Уфимского НИИ глазных болезней за 2008–2010 гг.. . . . . . . . 552 Р. Р. Хисматуллин, М. Т. Азнабаев, Г. А. Азаматова Способ лечения гифемы. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 553 Р. А. Шамсутдинова, Ф. А. Петрова, Р. Ф. Гайнутдинова, Р. Ф. Ахметшин, З. Р. Азизова Изменения органа зрения, связанные с гестозом беременных (патогенез, обзор литературы). . . . . . . . . 555 С. Э. Шамсутдинова Антиоксиданты в лечении миопии у детей. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 557 В. Ф. Экгардт, А. И. Скребков Экономический аспект операции протезирования носослезного канала у больных с хроническим гнойным дакриоциститом. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 559 Приложение. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 561 18 Раздел I Организация офтальмологической помощи М. М. Бикбов УФИМСКИЙ НИИ ГЛАЗНЫХ БОЛЕЗНЕЙ: РОЛЬ И МЕСТО В ИННОВАЦИОННОМ РАЗВИТИИ ОФТАЛЬМОЛОГИЧЕСКОЙ НАУКИ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Определяющим направлением развития науки и практического здравоохранения в ГУ «Уфимский НИИ глазных болезней» (УфНИИ ГБ) Академии наук Республики Башкортостан (АН РБ) является постоянное совершенствование и внедрение новых технологий диагностики, хирургии и консервативного лечения офтальмологических больных, улучшающих оптические результаты. Веяние сегодняшнего времени — замена первичной сырьевой ориентации страны на развитие инноваций во всех сферах деятельности, в т. ч. и науки. Многие приоритетные исследования и разработки в этом направлении выполняются учеными Уфимского НИИ глазных болезней. Под эгидой АН РБ институт принимает учас­ тие в разработке Республиканской целевой инновационной программы Республики Башкортостан, результатом которой являются готовые технологии хирургии, современные материалы и изделия медицинского назначения. Правительство РБ, Академия наук республики поддерживают данные исследования, создают благоприятный климат для внедрения перспективных инновационных разработок в целом по стране. Институт последние три года участвует в инновационных проектах, направленных на решение задач социально-экономического развития РБ. Разрабатываются основные этапы работы по выпус­ ку изделий медицинского назначения, устройств и аппаратов для лечения патологии органа зрения. Этому способствует режим софинансирования инновационных проектов руководством республики. Внедрение новой продукции направлено на повышение качества лечения, снижение числа слепых и слабовидящих, уменьшение инвалидности по зрению в РБ. В процессе инновационной деятельнос­ ти уделяется внимание созданию инновационной инфраструктуры — технопарка, подготовке кадров с новым мышлением. Результаты инновационной деятельности — разработанные в институте аппарат «УФалинк» и корнеопротектор «Декстралинк» для лечения патологии роговицы — были представлены и отмече20 ны дипломами на 6 выставках, в т. ч. на III Петербургском международном инновационном форуме и XIV международном форуме «Российский промышленник» в Санкт-Петербурге, III Российском общенациональном офтальмологическом форуме в Москве. Это первые ростки коммерциализации научных идей. Имеется первый опыт применения аппарата «Уфалинк» с имплантацией интрастромальных кольцевых сегментов с целью стабилизации и предотвращения дальнейшего прогрессирования кератоконуса. Кросслинкинг и имплантация интрастромальных роговичных колец взаимно дополняют друг друга, получены положительные результаты, но необходимо накапливать опыт, оценивать отдаленные результаты. С 2010 г. проводится эндотелиальная кератоплас­ тика, которая завоевывает все большую популярность. Неблагоприятным фоном для кератопластики является васкуляризация собственно роговицы и неоваскуляризация трансплантата. Субконъюнктивальные инъекции и инстилляции бевацизумаба, в связи с его антивазопролиферативным действием, в ряде случаев помогали предотвратить отторжение трансплантата, добиться облитерации сосудов. В институте отработан порядок диагностической, лечебной и хирургической деятельности, направленный на массовое оказание высококвалифицированной офтальмологической помощи населению РБ и прилежащих регионов России. В консультативнополиклиническом отделении создана система записи пациентов на прием через Интернет, организована единая электронная регистратура. Все это направлено на создание более комфортных условий для пациентов, приезжающих на обследование в институт из самых отдаленных районов республики. Налажена новая экономическая система оценки труда специалистов с учетом количества пролеченных больных и качества восстановленного зрения. Работает экспертная комиссия, которая, наряду с заведующими отделениями, ежедневно докладывает о результатах проведенных операций и качестве оказанных услуг. Достижением 2010 г. является организация и открытие в институте отделения стационарзамещающих технологий, в котором уже с января 2011 г. получают лечение пациенты с различной офтальмопатологией. По-прежнему в институт за помощью обращается большой поток больных с дакриоциститом. Внедрение малоинвазивного лазерного метода хирургии (трансканаликулярная дакриоцисториностомия) с применением эндоскопических инструментов позволило перевести эту категорию пациентов в отделение стационарзамещающих технологий. Изучаются результаты лечения непроходимости слезоотводящих путей в детском возрасте, при посттравматических повреждениях слезоотводящей системы, меры борьбы с рецидивами (заращением дакриостомы). Основное внимание научных исследований в Уфимском НИИ глазных болезней уделяется исследованию функциональных признаков и патофизиологических механизмов ишемических процессов в сетчатке и зрительном нерве при возрастной макулярной дегенерации, диабетической ретинопатии, глаукоме. Предложены критерии прогноза течения диабетичес­ кой ретинопатии и отслойки сетчатки. Изучаются механизмы влияния на ретинальную функцию интравитреального введения препаратов при диабетической ретинопатии и хориоидальной неоваскуляризации, разрабатываются критерии прогнозирования эффекта хирургического лечения этих заболеваний. Установлено, что изменения макулярной области сетчатки у больных с влажной формой возрастной макулярной дегенерации происходят при диссоциации и деструкции пигментного и нейросенсорного эпителия сетчатки. Изучаются патогенетически ориентированные методы хирургических вмешательств при открытоугольной и рефрактерной глаукоме. В институте совершенствуются технологии оказания анестезиологического пособия и реанимационных услуг детям, особенно глубоко недоношенным. Приобретены наркозный аппарат и новый операционный микроскоп для проведения витреоретинальных вмешательств у детей, обучены специалисты. Качество анестезии должно обеспечить адекватное обезболивание ребенка и хорошую фиксацию глаза. Учитывая, что ретинопатия недоношенных остается одной из важных проблем детской офтальмопатологии, ведущей к слепоте и ранней инвалидности, организована группа научных сотрудников по изучению этой патологии, решающей задачи в контакте с неонатологами Республиканской детской клинической больницы и городского неона21 тального лечебно-диагностического консультативного центра МЛПУ ГДКБ № 17 г. Уфы. Изучается комплексная система реабилитации детей и подростков с рефракционной амблиопией на основе применения различных хирургических методов коррекции аметропий в сочетании с консервативным лечением. Обнадеживающие результаты получены при имплантации добавочной сулькусной линзы нового поколения Sulcoflex у детей и подростков с остаточной аметропией, факичных заднекамерных ИОЛ ICL STAAR surgical в коррекции рефракционной амблиопии у подростков. Институт прилагает усилия к привлечению талантливой молодежи к научной деятельности, работе в инновационной сфере, стремится повысить заинтересованность студентов, интернов, ординаторов и аспирантов в изобретательской работе. Учас­ тие в традиционных в республике Днях молодежной науки (в 2010 г. тема конференции «Роль молодежи в инновационной модернизации России»), наряду с привлечением молодых людей к научноисследовательской деятельности, способствуют формированию успешного специалиста, энергия и предприимчивость которого реализуется в интеллектуальной продуктивности. Поощрение активнос­ ти молодых специалистов является системой мотивации к инновационной деятельности. Подготовка кадров высшей квалификации попрежнему остается одним из важных направлений деятельности института. В 2010 г. защищены 4 кандидатские диссертации, выполняются 5 докторских и 12 кандидатских диссертаций. Известно, что успешные проекты с хорошим выходом в практическое здравоохранение — результат международного сотрудничества академических университетов. Поэтому институт стремится поддерживать это веяние, о чем свидетельствует проведение международных конференций, совместное участие в мастер-классах по хирургии, стажировки за рубежом. Только в 2010 г. офтальмологи института выезжали на учебу в Германию, Австрию, Сингапур, Хорватию. Проведены 3 научно-практические конференции, которые сопровождались трансляцией «живой» хирургии с демонстрацией высокотехнологичных операций. В международной научно-практической конференции по офтальмохирургии «Восток — Запад» (22–23 апреля 2010 г.) приняли участие более 350 офтальмологов России и РБ, а также ведущие специалисты-офтальмологи из Великобритании, Германии, Индии. 25–26 июня 2010 г. были про- ведены 80-е Международные Тюбингенские курсы по витреоретинальной патологии, представлены доклады профессоров из Германии, Японии, Великобритании. Научно-практическая конференция по офтальмологии «Современные технологии хирургического и консервативного лечения заболеваний роговицы» (12 ноября 2010 г.) прошла с участием проф. А. Даксера из Австрии. Проведено 2 заседания Башкирского регионального общества офтальмологов России. Сотрудники института приняли участие в 18 науч­ но-практических конференциях и симпозиумах, в т. ч. 3 зарубежных, и представили более 30 устных и 5 стендовых докладов. Изданы сборник научных трудов международной научно-практической конференции по офтальмохирургии «Восток — Запад» и монография «Рефракционная амблиопия». Результаты научных исследований специалистов института по разным проблемам офтальмологии отражены в 153 публикациях, в т. ч. в 1 монографии, 20 работах в центральной и 6 в зарубежной печати. Разработки сотрудников защищены 14 патентами РФ, многие из них внедрены в офтальмологических клиниках РБ и ряда регионов России. Развитие офтальмологии в настоящее время — непрерывное совершенствование техники оперативного лечения больных. Внедрение современного высокотехнологичного хирургического оборудования в практику оказывает существенное влияние на структуру проводимых операций. Приобретены операционный микроскоп FS2-21, офтальмологичес­ кий комплекс Assistant, наркозный аппарат «Фабиус плюс» в комплекте фирмы «Дрегер», аппарат лазерный «ЛАХТА МИЛОН». Общее количество операций в 2010 г. составило 25 729 при неизменном количестве специалистов. Число факоэмульсификаций катаракты за последние 5 лет увеличилось в 8,8 раз, при этом отмечается снижение количества традиционных методов экстракции катаракты на 9,6 %. Отмечена более высокая эффективность ультразвуковых технологий удаления катаракты, связанная с ростом квалификации хирургов, отработкой техники, обеспечивающих быстрое по времени проведение операции. Внедрение научных разработок сократило число послеоперационных осложнений, сроки пребывания больных в стационаре до 1–4 дней, повысило оборот койки (с 28,7 в 2006 г. до 40,2 в 2010 г.). С ноября 2009 г. начата работа по оказанию помощи жителям отдаленных сельских регионов РБ мобильными офтальмологическими бригадами из числа высококвалифицированных специалистов УфНИИ ГБ. За это время осуществлено 14 выездов в 13 районов республики, при этом проконсультированы более 5,5 тыс. пациентов, в т. ч. более 900 из них прооперированы. Работа ГУ «УфНИИ ГБ» АН РБ высоко оценена в республике. В 2010 г. институт награжден премией Президента Республики Башкортостан в области качества продукции (товаров, услуг) по итогам работы 2009 г. с вручением Кубка качества с эмблемой Премии и диплома I степени, а также Дипломом Правительства РБ за вклад в развитие экономики Республики Башкортостан. В 2010 г. институт награжден золотой медалью и дипломом лауреата конкурса в номинации «100 лучших научно-исследовательских учреждений и организаций России». Все вышеизложенное свидетельствует о стабильном и динамичном развитии института. Полученные научные и практические результаты служат основой для совершенствования комплекса лечебнодиагностических мероприятий в соответствии с мировыми стандартами, что позволяет УфНИИ ГБ обеспечивать высокое качество оказания офтальмологической помощи и поступательное развитие российской офтальмологической науки. М. М. Бикбов, Л. Х. Мурова, И. М. Кагиров ИТОГИ РАБОТЫ ОФТАЛЬМОЛОГИЧЕСКОЙ СЛУЖБЫ В РЕСПУБЛИКЕ БАШКОРТОСТАН ЗА 2010 ГОД ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Первичная офтальмологическая помощь в Рес­ муниципальных районов и городских округов, публике Башкортостан оказывается на уровне а специализированная, в том числе высокотех22 нологичная хирургическая офтальмологическая помощь, — в Уфимском НИИ глазных болезней и Всероссийском центре глазной и пластической хирургии. Укомплектованность врачами-офтальмологами в Республике Башкортостан по итогам 2010 г. составляет 415 человек (без учета специалистов в частных клиниках и медицинских учреждений федерального уровня (ВЦГ и ПХ, клиника БГМУ, поликлиники ФСБ и др.). Обеспеченность врачамиофтальмологами составляет 1,02 на 10 000 населения. По сравнению с 2009 г. (0,93 на 10 000 населения) наблюдается увеличение количества врачей-офтальмологов в городских округах и учреждениях муниципального уровня — ГКБ и МП в основном за счет молодых специалистов. Высшую категорию имеют 19,5 % офтальмологов, первую — 8 %, вторую — 17 % штатного персонала врачей, 55,5 % из общего числа специалистов — без категории, 93,4 % офтальмологов сертифицированы. В настоящее время в двух городах (г. Агидель, г. Давлеканово) и двух районах республики (Ермекеевский, Иглинский) нет офтальмологов. В 4 муниципальных районах (Аскинский, Бурзянский, Мечетлинский, Федоровский) работают врачи офтальмологи на 0,5 ставки (без учета офтальмологов г. Уфы). Обеспеченность врачамиофтальмологами в поликлиниках города Уфы одна из самых низких, составляет — 66 % (0,7 на 10 000 населения). Из них 18 врачей (17 %) работают в детских поликлиниках и 50 врачей (49 %) — в поликлиниках для взрослых. Таблица 1 Состав врачей-офтальмологов в динамике с 2007 по 2010 гг. Год 2007 2008 2009 2010 Кол-во врачей 376 399 374 415 На 10 000 населения 0,9 0,94 0,91 1,02 Данная ситуация связана со слабым материальнотехническим оснащением поликлинического звена, не отвечающем современному уровню развития офтальмологии, с высокой нагрузкой на врачаофтальмолога, недостатком среднего персонала и большим объемом заполняемой медицинской документации. Стационарная помощь в 2010 г. в Республике Башкортостан осуществлялась на 684 койках, из них 649 круглосуточных (включая Уфимский НИИ глазных болезней — 300 коек) и 35 дневных коек. Детских коек всего 57 (УфНИИ глазных болезней — 50, Стерлитамак — 2, Октябрьский — 1, Нефтекамск — 1, Сибай — 2, Мелеуз — 1). По отношению к 2009 г. наблюдается уменьшение коечного фонда на 33. Офтальмологическая помощь организована на уровне муниципальных районов в 56 кабинетах поликлиник и 10 отделениях центральных районных больниц (ЦРБ) на 167 койках, в городском округе в 75 кабинетах поликлиник и 6 отделениях городских клинических больниц на 217 койках. За последние годы идет планомерное сокращение офтальмологических коек в ЛПУ республики. Коечный фонд республики по офтальмологии приводится в соответствие с общероссийскими стандартами. Рис. 1. Стационарная офтальмологическая помощь в Республике Башкортостан 23 На стационарном лечении в 2010 г. в учреждениях муниципального и городского уровня находилось 13 266 больных (2009 г. — 13 910 человек), операций выполнено всего 6800 (2009 г. — 7287). Из общего числа операций, производимых на данном уровне, экстракции катаракты с имплантацией искусственного хрусталика выполнено 3475 (51,1 %). По РБ в 2010 г. средняя занятость койки составила 365 дней (2009 г. — 365 дней), среднее пребывание одного больного на койке — 9,62 (2009 г. - 9,0), оборот койки — 40,8 (2009 г. — 37,1), хирургическая активность — 51,9 % (2009 г. — 56 %). Специализированную медицинскую помощь в республике обеспечивает Уфимский НИИ глазных болезней. В 2010 г. средняя занятость койки составила 365 дней (2009 г. — 365 дней), среднее пребывание одного больного на койке — 7,2 (2009 г. — 8,8), оборот койки — 44,1 (2009 г. — 41,0), хирургическая активность — 80,6 % (2009 г. — 72,3 %). Операции по поводу удаления катаракты с имплантацией искусственного хрусталика в институте осуществляются преимущественно современным микроинвазивным ультразвуковым методом (фако­ эмульсификация). Соотношение факоэмульсификации к традиционным методу удаления (экстракапсулярная экстракция катаракты) в 2007 г. составило — 37,9, в 2008 — 63,8, 2009 — 81,1, в 2010 — 89,15 %. Показатель госпитализации населения с патологией органа зрения в 2010 г. увеличился и составил по республике в среднем 82 человека на 10 000 населения (2009 г. — 68 человек на 10 000 населения). В республике число лиц пожилого возраста составляет 25,6 % от общего количества населения, что проявляется ростом показателей заболеваемости катарактой, глаукомой, диабетичес­ кой ретинопатией, дегенеративными изменениями сетчатки и др. Заболеваемость глазными болезнями в Респуб­ лике Башкортостан в течение 5 лет увеличилась на 16 %, по итогам 2010 г. на уровне первичной медикосанитарной помощи заболеваемость составила Рис. 2. Хирургическая активность стационара Уфимского НИИ глазных болезней Рис. 3. Количество операций по поводу удаления катаракты в Уфимском НИИ глазных болезней 24 Рис. 4. Заболеваемость по обращаемости в РБ за 2008–2010 гг. 721 346 больных (1 774 на 10 000 населения), из них 159 063 ребенка (22,05 %). В течение последних трех лет показатель заболеваемости по обращаемости остается стабильно высоким и составляет: в 2007 г. — 663 622 (1633 на 10 000 населения); в 2008 — 664 688 (1695 на 10 000 населения); в 2009 — 707 127 больных (1739 на 10 000 населения). Структура заболеваемости глазными болезнями по сравнению с 2008 и 2009 гг. претерпела изменения за исключением первого места: первое место — нарушения рефракции — 38,55 %; на втором месте — катаракта 13,46 %; на третьем — воспалительные заболевания глаз — 12,07 %; на четвертом — заболевания сетчатки и зрительного нерва 5,9 %; на пятом — глаукома 5,35 %. Лидирующую позицию в структуре заболеваемости продолжают занимать нарушения рефракции — 278 072 пациента. С катарактой в 2010 г. было зарегистрировано 97 087 больных, что на 21,08 % больше по сравне- нию с 2009 г. (80 174 больных). По РБ 12 812 больных с данным диагнозом получили оперативное лечение. Воспалительные заболевания глаз по итогам 2010 г. переместились со второго места на третье (87 049 человек), заболевания сетчатки и зрительного нерва занимают в общей структуре заболеваемости глазными болезнями четвертое место (42 305 больных). На пятом месте по обращаемости — глаукома (5,35 %). В 2010 г. было зарегистрировано 38 571 больных, что всего на 0,15 % меньше по сравнению с 2009 г. (38 646 больных). Неукомплектованность сотрудниками (врачами, медсестрамитонометристами), недостаточное оснащение необходимым оборудованием в поликлиниках в ряде районов и городов, отсутствие широкого спектра антиглаукоматозных препаратов в списке жизненно необходимых лекарственных средств (ЖНВЛС), приводит к ежегодному увеличению инвалидности по данному заболеванию. Из 1673 операций по поводу глаукомы в 2010 г., 825 (49,3 %) были проведены в УфНИИ ГБ (без уче- Рис. 5. Структура заболеваемости по обращаемости за 2010 г., в % 25 та лазерных операций, количество которых достигло 1 607 операций) и 848 (50,7 %) в микрохирургических отделениях. По данным годового отчета за 2010 г., операции по поводу глаукомы продолжают выполняться в недостаточном объеме в следующих микрохирургических отделениях: г. Дюртюли (12 операций), г. Ишимбай (9 операций), г. Туймазы (7 операций), Кумертау (7 операций), г. Янаул (7 операции), г. Мелеуз (1 операция), г. Нефтекамск (антиглаукоматозные операции не выполняются). Таблица 2 Количество выполненных антиглаукоматозных операций в микрохирургических центрах и отделениях РБ Микрохирургические отделения и центры г. Уфа (больница №10) г. Сибай Салаватский р-н г. Белорецк г. Стерлитамак г. Октябрьский г. Учалы г. Белебей г. Салават г. Дюртюли г. Туймазы г. Мелеуз г. Ишимбай г. Янаул г. Кумертау г. Нефтекамск Больные с глаукомой 14 496 336 223 597 1733 260 74 90 92 106 1184 444 1487 795 1180 1244 455 534 243 431 1361 40 66 40 37 12 7 1 9 7 7 0 А/г В РБ зарегистрировано 75 147 больных сахарным диабетом, и половина из них нуждается в лазерном лечении сетчатки глаза, но лишь часть данной категории пациентов получают его своевременно. Общепризнана эффективность лазерного лечения (1–3 раза в год) при диабетической ретинопатии, которая приостанавливает развитие патологического процесса и, следовательно, позволяет уменьшить число слабовидящих и слепых. Необходимое оборудование и высококвалифицированные специалисты имеются только в клинике института, но, к сожалению, лазерные аппараты устарели, так как не приобретались с 2000 г. В Республике Башкортостан только в клинике института проводятся все виды тотальной и частичной витрэктомии с заменой стекловидного тела на силиконовое масло и перфторорганические соеди26 нения. За последние 4 года выполнено 1376 эндовитреальных хирургических вмешательств при патологии сетчатки и стекловидного тела, и количество их увеличивается с каждым годом: 2007 г. выполнено 266 операций, в 2008 г. — 302, в 2009 — 381, в 2010 — 427. Общее количество травм за анализируемый период сохранилось на уровне 2009 г. (17 576) и составило 17 556 случаев. В большинстве случаев травмы были получены в бытовых условиях — 11 884 случая (67,7 %), на втором месте промышленные — 2565 (14,6 %), на третьем детские — 2140 случаев (12,2 %). Травм, полученных в прочих условиях, зарегистрировано 577 случая (3,3 %), сельскохозяйственных травм было 390 случаев (2,2 %). При травмах органа зрения общее количество операций также сохранилось на уровне 2009 года (544 хирургических вмешательства) и составило в 2010 г. 522 операции, что составило 2,3 % от общего количества всех операций. В Республике Башкортостан на диспансерном учете в 2010 г. находилось 62 897 детей с различной офтальмопатологией, дети с нарушением рефракции составили 69,1 % случаев. За анализируемый период с врожденной патологией органа зрения было зарегистрировано 1 890 детей, из них с ретинопатией недоношенных 192 ребенка, что составляет 0,3 %, с катарактой — 329 детей (0,5 %), с глаукомой — 45 (0,07 %). Современные аспекты проблемы предупреж­ дения роста инвалидности вследствие патологии органа зрения определяются своевременным анализом причин слепоты и слабовидения и факторов, способствующих формированию инвалидности у офтальмологических больных. Наиболее значимым критерием является первичный выход на инвалидность. Показатель первичного выхода на инвалидность вследствие заболеваний органа зрения в республике остается стабильно высоким и составил в 2010 г. 2,5 на 10 000 населения (в абс. ч. 1039 человек), в 2009 г. — 2,6 на 10 000 населения (в абс. ч. 1053 человека). Основные причины первичного выхода на инвалидность в РБ в 2010 г.: 1. Заболевания сетчатки и зрительного нерва — 392 (37,7 %). 2. Глаукома — 329 (31,7 %). 3. Миопия — 154 (14,8 %). Таким образом, заболевания сетчатки и зрительного нерва в 2010 г. занимают лидирующую позицию среди первично освидетельствованных инвалидов по зрению в РБ по сравнению 2009 г. (32,8 %), а глаукома переместилась на второе место (2009 г. — 34,5 %). Высокие показатели первичного выхода на инвалидность свидетельствуют о недостаточной работе амбулаторно-поликлинической службы по раннему выявлению заболеваний и несвоевременному направлению больных на лечение. Общее количество слепых по РБ составило в 2010 г. 11 400 человек (28 % на 10 000 населения), на оба глаза — 3 360 человек (29,5 %), на один глаз — 8 040 человек (70,5 %). Из общего количества слепых 10 911 взрослых (95,7 %) и 489 детей (4,3 %). Общее количество слабовидящих по РБ составило в 2010 г. 15 499 человек (38 % на 10 000 населения), на оба глаза — 6 794 человека (43,8 %), на один глаз — 8 705 человек (56,2 %). По нозологии инвалиды по зрению распределились следующим образом: 1. Заболевания сетчатки и зрительного нер­ва — 4530 (26,1 %). 2. Глаукома — 3 530 (20,34 %). 3. Миопия — 1 083 (16,8 %). Всего признано инвалидами по заболеваниям органа зрения в отчетном году 17 349 человек. Среди групп инвалидности наибольшую долю составляет III группа — 48 %; II группа — 30,5 % и I группа — 21,5 %. Основными причинами высоких показателей инвалидности по зрению являются, с одной стороны, низкий жизненный уровень населения, распространение табакокурения и алкоголизма, с другой — недостаточная пропаганда среди населения здорового образа жизни, знаний по профилактике травм органа зрения, а также недостатки в организации медицинской помощи на амбулаторнополиклиническом этапе. Неукомплектованность сотрудниками (врачами, медсестрами-тоно­м ет­ рис­та­ми), недостаточное оснащение необходимым оборудованием в поликлиниках в ряде районов и городов, отсутствие широкого спектра антиглаукоматозных препаратов в списке жизненно необходимых лекарственных средств (ЖНВЛС) способствуют формированию инвалидности у офтальмологических больных. Анализ состояния офтальмологической службы в республике по уровням оказания специализированной помощи показал, что наибольшее количество 27 проблем сосредоточено в первичном амбулаторнополиклиническом звене, в связи с чем первоочередной задачей является укрепление амбулаторнополиклинического звена офтальмологической службы республики: — укомплектование и обеспечение необходимым офтальмологическим оборудованием кабинетов и отделений, согласно приказу Минздравсоцразвития России № 115-н от 27 февраля 2010 г.; — активное внедрение стационарзамещающих, ресурсосберегающих клинических технологий, час­тичное выведение на амбулаторный уровень лечебной (консервативной и хирургической) помощи, увеличение количества коек дневного пребывания. Для улучшения оказания специализированной помощи населению необходимо: — внедрение во всех офтальмологических отделениях ЛПУ республики новых технологий хирургического и консервативного лечения заболеваний органа зрения; — обучение специалистов современным малоинвазивным методам хирургических вмешательств (организация и проведение международных конференций с привлечением специалистов из других регионов РФ, демонстрация «живой» хирургии, выезды врачей офтальмологов в ведущие клиники России и зарубежья); — участие специалистов Уфимского НИИ глазных болезней совместно с главным внештатным офтальмологом Минздравсоцразвития России в разработке нормативно-правовых документов, порядков оказания офтальмологической помощи и стандартов медицинской помощи (в 2009 году специалисты Уфимского НИИ глазных болезней участвовали в доработке стандартов оказания медицинской помощи больным с заболеваниями органа зрения). — включить Уфимский НИИ глазных болезней в программу модернизации здравоохранения субъекта Российской Федерации на 2011–2012 гг. Все вышеизложенное позволит повысить квалификацию врачей-офтальмологов в диагностике и лечении заболеваний органа зрения на более ранних этапах развития заболевания, сделать офтальмологическую помощь доступной для всех слоев населения Республики Башкортостан, достигнуть более высоких функциональных результатов в оказываемой офтальмологической помощи, снизить заболеваемость и инвалидность по зрению. Т. К. Ботабекова, М. М. Курмангалиева, З. А. Джуматаева, Н. А. Алдашева ПЕРВАЯ ВСЕМИРНАЯ НЕДЕЛЯ ГЛАУКОМЫ В КАЗАХСТАНЕ КазНИИ глазных болезней, г. Алматы, Казахстан Глаукома, оставаясь одной из основных причин необратимой слепоты и инвалидности в развитых странах, вышла за рамки чисто офтальмологической проблемы и может быть решена только на основе комплексного подхода с учетом современных лечебно-диагностических технологий и новых организационных принципов системы диспансеризации. Известный факт, что половина больных глаукомой не знает о своем заболевании, свидетельствует о том, что ни пациенты, ни зачастую врачи не осознают реальной опасности последствий глаукомы. В целях привлечения внимания населения и средств массовой информации к проблеме глаукомы с 2008 года проводится Всемирный день глаукомы. Инициатором его проведения выступили Всемирная ассоциация глаукоматологов и Всемирная ассоциация больных глаукомой. В рамках Дня проводятся дни открытых дверей в глаукомных центрах, скрининговые обследования на глаукому, в средствах массовой информации освещаются вопросы, связанные с ранней диагностикой и лечением заболевания. Учитывая успех данного мероприятия во многих странах и широкий резонанс по его окончании, было принято решение о проведении в 2011 году с 6 по 12 марта Всемирной недели глаукомы (ВНГ). Казахский НИИ глазных болезней принимает участие в данной международной акции с 2008 года, а в этом году была разработана специальная программа по проведению ВНГ. Цель — проанализировать предварительные результаты первой ВНГ, проведенной в Казахстане. Материал и методы. Разработанная в Казахском НИИ глазных болезней программа проведения ВНГ состояла из пяти блоков. Первый блок включал в себя Школу по глаукоме. Данная школа проводится в КазНИИ ГБ на протяжении уже 5 лет, в одних случаях она была организована для пациентов с глау­комой, в других для — врачей-глаукоматологов. Особенностью последней школы явилось то, что она состояла из двух частей. Во время первой час­ ти был проведен семинар для офтальмологов, посвященный медикаментозному лечению глаукомы и знакомству с новым простагландином без консервантов — тафлотаном. Вторая часть школы была проведена в виде лекции для больных глаукомой, 28 в которой разъяснялась сущность данного заболевания и его последствия, основные методы лечения, правильная техника закапывания гипотензивных капель. После лекции больные имели возможность получить ответы на вопросы, связанные с особенностями образа жизни и режима при глаукоме. Второй — четвертый блоки включали в себя проведение скринингов на глаукому 9–10 марта в КазНИИ ГБ, консультативной поликлинике института, поликлинике Центральной больницы управления делами президента Республики Казахстан (РК), а также в 10 глаукомных кабинетах областных офтальмологических центров. Информация о предстоящем скрининге в клиниках г. Алматы была предоставлена офтальмологам на Школе глаукомы, пациенты имели возможность узнать о предстоящем обследовании из печатных объявлений в клиниках. Для информирования региональных офтальмологов был издан приказ главного внештатного офтальмолога Минздрава РК. Скрининг проводился в два этапа. Первый доврачебный этап предусматривал измерение ВГД медсестрой на бесконтактном тонометре. При офтальмотонусе 21 мм рт. ст. и выше больной направлялся на исследование центрального поля зрения методом FDT, далее офтальмолог проводил осмотр пациента и интерпретацию данных обследования. При необходимости проводились гониоскопия, гейдельбергская ретинальная томография. На основании полученных данных врач либо выставлял диагноз глаукомы, либо снимал его, либо оставлял подозрение на глаукому. В последнем случае больному рекомендовалось повторное обследование на глаукому через 3–6 месяцев. При установлении диагноза глаукомы пациенту разъяснялась сущность заболевания, возможные последствия и необходимость лечения, рекомендовалось встать на диспансерный учет по месту жительства. Скрининг на глаукому был запланирован также на базе двух лечебно-диагностических поездов (Денсаулык и Жардем). Обследование на глаукому в поездах осуществляли четыре офтальмолога из КазНИИ ГБ, которые принимали участие в обследовании населения отдаленных регионов Казахстана согласно разработанному республиканскому плану. В данном случае скрининг проводился на основе тонометрии и офтальмоскопии. При подозрении на глаукому больной направлялся для дополнительного обследования по месту жительства. Последний блок программы предусматривал освещение мероприятий ВНГ в средствах массовой информации. Для этого в редакции 5 республиканских газет были направлены пресс-релизы о предстоящей ВНГ. Необходимо отметить активное учас­ тие фирм производителей гипотензивных препаратов в проведении ВНГ («Алкон», «Пфайзер», «Сантен»), предоставивших образцы капель, буклеты, памятки, плакаты по глаукоме. Результаты и обсуждение. Отличительной особенностью проведенной Школы глаукомы было активное участие больных (40 человек) и врачей (30 человек). Пациентам была предоставлена возможность пройти бесплатное обследование (тонометрия, компьютерная периметрия) и консультации у ведущих специалистов по глаукоме. При этом у части больных отсутствовало «давление цели» (уровень ВГД, необходимый для данного пациента), в связи с чем им была рекомендована дополнительная гипотензивная терапия, лазерные операции. Результаты скрининга на глаукому в КазНИИ ГБ были таковы: всего обследование прошли 62 человека. У 14 человек было выставлено подозрение на глаукому. После дополнительного обследования диагноз открытоугольной глаукомы был установлен в 6 случаях, в том числе у двух пациентов глаукома была псевдоэксфолиативной, и в одном случае — узкоугольной. Начальная стадия глаукомы отмечалась на 4 глазах, развитая — на 8 и далеко зашедшая — на одном. В поликлинике Центральной больницы управления делами президента РК скрининговым обследованием был охвачен 81 больной. У трех пациентов на первом этапе скрининга было выставлено подозрение на глаукому. После дополнительного обследования в двух случаях диагноз не подтвердился, одному больному было рекомендовано повторное обследование через полгода. Данные скринингов на базе глаукомных кабинетов областных центров в настоящее время обрабатываются для отчетов. В трех газетах («Егемен Казахстан», «Экспресс К», «Алаш Айнасы») вышли материалы, посвященные проводимой в Казахстане ВНГ. Агентство «Хабар» отсняло сюжет для телепередачи, посвященной современным методам диагностики и лечения глаукомы. Выводы. Скрининговые обследования, организованные в рамках недели, дали возможность выявить глаукому, по данным КазНИИ ГБ, в 9,7 %. Проведенная первая ВНГ в Казахстане позволила привлечь внимание различных слоев населения, пациентов, офтальмологов к проблеме ранней диагностики и своевременного лечения глаукомы, тем самым увеличив возможность сохранения зрения при столь коварном недуге. А. М. Газизов АНАЛИЗ РАБОТЫ ВЗРОСЛОГО КОНСУЛЬТАТИВНОПОЛИКЛИНИЧЕСКОГО ОТДЕЛЕНИЯ УФИМСКОГО НИИ ГЛАЗНЫХ БОЛЕЗНЕЙ ЗА 2006–2010 ГОДЫ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Взрослое консультативно-поликлиническое отделение (ВКПО) ГУ «Уфимский НИИ глазных болезней» Академии наук Республики Башкортостан (УфНИИ ГБ АН РБ) является важным и неотъемлемым подразделением Уфимского НИИ глазных болезней. Основные задачи консультативнополиклинического отделения: обеспечение больных квалифицированной офтальмологической помощью; проведение инструментальных и аппаратных иссле29 дований с применением современных методов обследования; коррекция организационных и методических вопросов, связанных с диспансеризацией и госпитализацией больных; рекомендации по лечению больных в условиях амбулаторно-поликлинических и стационарных учреждений по месту жительства. После обследования больным выдается медицинское заключение с указанием установленного диагноза, рекомендаций о дальнейшем лечении и наблюдении. Цель — провести анализ деятельности ВКПО УфНИИ ГБ АН РБ по обращаемости населения за консультативной помощью за 2006–2010 гг. Материал и методы. В консультативно-поликли­­ ническом отделении запись больных на прием ведется по направлению офтальмологов Республики Башкортостан, других субъектов РФ (табл. 1). Также ведется прием по ДМС. Прием ведут 6 врачей: 4 врача высшей квалификационной категории, 1 врач первой категории, 1 врач второй категории. Разбор больных со сложными диагнозами проводится на консилиумах с заведующими микрохирургических отделений, научными сотрудниками института, профессорско-преподавательским составом института и кафедры офтальмологии БГМУ. Таблица 1 Количество проконсультированных больных ВКПО за 2006–2010 гг. 11 мес. 2010 г. Башкортостан 27730 30539 29483 29174 30037 РФ 959 179 359 369 501 ВСЕГО 28689 30718 29842 29543 30538 Регион 2006 г. 2007 г. 2008 г. 2009 г. Результаты и обсуждение. За 2006–2010 гг. на консультацию во взрослое консультативнополиклиническое отделение УфНИИ глазных болезней обратилось 149 330 пациентов по ОМС и 5234 — по ДМС. Жители города Уфы составили 48 % (71 688 чел.), других городов РБ — 16,7 % (24 941 чел.), сельские жители РБ — 33,7 % (50 334 чел.) и РФ — 1,6 % (2367 пациентов). Увеличивается число консультируемых больных, особенно среди жителей города Уфы. Госпитализировано в отделения института из числа принятых в ВКПО в 2006 — 8766 (30,5 %), 2007 — 7 098 (23 %), 2008 — 11 690 (39 %), 2009 — 10 548 (35,7 %), 11 мес. 2010 г. — 11 711 (38,4 %) больных. Среди пациентов, обратившихся за 5 лет во взрослое консультативно-поликлиническое отделение института, первое место занимают пациенты с катарактой (23,8 %); на втором месте с глаукомой (14,2 %), на третьем — с заболеваниями сетчатки (10 %). Структура заболеваемости по обращаемости во ВКПО УфНИИ ГБ отражена в табл. 2. Таблица 2 Распределение контингента принятых по ОМС больных ВКПО по назологическим единицам за 2006–2010 гг. № Заболевания 2006 г. 2007 г. 2008 г. 2009 г. 11 мес. 2010 г. 2904 10,1 % 3154 10,2 % 2785 9,3 % 2882 9,6 % 2149 7,1 % 1 Нарушение рефракции и аккомодации 2 Болезни век, слезного аппарата 1293 4,5 % 1124 3,6 % 1340 4,4 % 1243 4,2 % 914 3 % 3 Болезни конъюнктивы 1205 4,2 % 1533 4,3 % 1538 5,1 % 1440 4,8 % 1188 3,9 % 4 Болезни роговицы и склеры 625 2,8 % 1227 3,9 % 573 2 % 1062 3,5 % 751 2,5 % 5 Болезни сосудистой оболочки и цилиарного тела 654 2,2 % 982 3 % 893 2,9 % 803 2,7 % 691 2,3 % 6 Болезни хрусталика 4956 17,2 % 6874 22 % 8145 27,2 % 8189 27,7 % 7683 25,2 % 7 Болезни сетчатки, в т. ч. отслойка сетчатки 2123 7,4 % 2765 9 % 2045 6,8 % 5082 17,8 % 2505 8,3 % 8 Глаукома 4956 17,2 % 5699 12 % 4338 14,5 % 4643 15,7 % 3511 11,6 % 9 Болезни стекловидного тела и глазного яблока 201 0,7 % 773 2,5 % 611 2 % 808 2,7 % 392 1,3 % 10 Болезни зрительного нерва 548 1,8 % 552 1,8 % 569 1,9 % 658 2,2 % 582 1,9 % 11 Болезни глазницы 55 0,1 % 71 0,2 % 44 0,1 % 33 0,1 % 50 0,1 % 30 Окончание таблицы 2006 г. 2007 г. 2008 г. 2009 г. 11 мес. 2010 г. 12 Травма глаза и его придаточного аппарата 55 0,1 % 330 1 % 382 1,2 % 362 1,2 % 241 0,8 % 13 Новообразования 116 0,3 % 335 1 % 409 1,3 % 478 1,6 % 328 1 % 14 Прочие 9058 31,5 % 5295 10,4 % 6170 10,9 % 1860 6,2 % 9553 31 % 28689 30718 29842 29543 30538 № Заболевания ВСЕГО Количество принятых и госпитализированных больных врачами ВКПО УфНИИ ГБ за 2006–2010 гг. Растет количество консультированных и госпитализированных на стационарное лечение в отделения института больных (см. рис.). С каждым годом число лиц пожилого возраста увеличивается, что проявляется ростом показателей заболеваемости катарактой, глаукомой, диабетической ретинопатией, дегенеративными изменениями сетчатки. Выводы: 1. Проведение необходимых инструментальных, аппаратных исследований с применением современных методов обследования больных во взрослом консультативно-поликлиническом отделении УфНИИ ГБ способствует обеспечению большего количества больных квалифицированной офтальмологической помощью. 2. Коррекция организационных и методических вопросов, связанных с диспансеризацией и госпитализацией больных, способствует своевременному оказанию квалифицированной медицинской помощи. 31 3. Отмечается ежегодное увеличение количества консультируемых и госпитализированных на ста­ цио­нарное лечение больных. 4. Отмечается тенденция роста госпитализированных больных с катарактой. 5. По обращаемости за консультацией в УфНИИ ГБ преобладают больные с патологией хрусталика, глаукомой, заболеваниями сетчатки, слезоотводящих путей. 6. За последние годы отмечается увеличение количества консультируемых больных с патологией сетчатки и стекловидного тела, особенно при сопутствующем сахарном диабете. Это связано с внедрением в УфНИИ ГБ современных технологий витреоретинальной хирургии. 7. Отмечается тенденция к уменьшению обращаемости пациентов в ВКПО с аномалиями рефракции, что связано с организацией работы кабинетов эксимерлазерной коррекции зрения и контактной коррекции зрения. Г. М. Гизатулина, С. А. Петров ВОПРОСЫ К ОРГАНИЗАЦИИ ОФТАЛЬМОЛОГИЧЕСКОЙ ПОМОЩИ СТУДЕНТАМ С МИОПИЕЙ ГОУ ВПО «Тюменская государственная медицинская академия Минздравсоцразвития РФ», г. Тюмень За годы обучения в школе отмечается рост час­ тоты встречаемости миопии в 3,4 раза, в том числе миопия слабой степени увеличивается в 2,6 раза, средней — в 6,9 раза, высокой — в 4,1 раза [4]. Итогом процессов развития и прогрессирования школьной миопии являются статистические данные о распространенности ее среди студентов, которая составляет от 25,0 до 42,5 % [1, 6]. Распространенность миопии среди студентов копенгагенских (датских) университетов составляет 50,0 % [7]. При анализе степени близорукости среди студентов, по обобщенным данным литературы Шерстневой Л. В. с соавт (1998), выявлено следующее распределение степени близорукости: на первом курсе — слабая у 44,0, средняя — у 32,0, высокая — у 24,0 %; к пятому курсу — соответственно 10, 48 и 42 %. При одномоментном наблюдении на пятом курсе ММА им. И. М. Сеченова прослеживалась более утешительная картина рефракции: слабая степень близорукости встречается в 49,2 % случаев, средняя — в 39,1, высокая — в 11,7. Имеются сведения о влиянии общего состояния организма на развитие и течение миопии у детей и подростков [5]. В число наиболее вероятных факторов риска, обусловливающих появление и развитие миопии, Е. И. Ковалёвский относит ранние детские общесоматические и инфекционные болезни, неполноценное питание [2]. Получено много данных, свидетельствующих об общих изменениях в организме больных прогрессирующей миопией, сопровождающихся глубоким нарушением разных видов обмена веществ. Так в 58,5–70,0 % случаев у лиц с миопией имеются клинические признаки вторичного иммунодефицитного состояния (ВИДС) [3]. Все эти неблагоприятные факторы особенно актуальны для учащихся вузов. Студенты попадают в новую обстановку, осваивают новую информацию, становятся более самостоятельными. В то же время, поглощенные учебным процессом, они не всегда следят за своим здоровьем, питанием. Многие хронические заболевания возникают и прогрессируют 32 именно в студенческом возрасте, усугубляя течение уже существующих болезней. Цель — изучение общесоматического статуса у студентов с миопией на начальных и поздних курсах обучения. Материал и методы. Обследовано 2867 студентов 1 курса ГОУ ВПО ТюмГМА Минздравсоцразвития РФ в течение 2005–2009 гг. в рамках комплексного профилактического медицинского осмотра студентов, проводимого ежегодно. Обследование проводилось в многопрофильной клинике ТюмГМА и включало осмотр врачейспециалистов: офтальмолога, невропатолога, хирурга, ЛОР-врача, эндокринолога, гинеколога или уролога. При выявлении патологии рефракции дополнительно проводилось клинико-анамнестическое обследование, визометрия без коррекции и с коррекцией, определение резервов аккомодации (РА), отрицательного и положительного запасов объема относительной аккомодации (ОЗООА и ПЗООА), объема относительной аккомодации (ООА), скиаскопия без циклоплегии и после циклоплегии, биомикроскопия и офтальмоскопия. Статистическая обработка полученных результатов проводилась на ПЭВМ IBM/РС при помощи стандартных статистических пакетов «SPSS 11,5 for Windows». Результаты и обсуждение. При ежегодных профилактических осмотрах студентов усиленный тип рефракции (миопия) выявляется более чем у 35 % студентов (табл. 1). Таблица 1 Данные по осмотру студентов ТюмГМА I курса с 2005 по 2009 гг. Нозология 2005 2006 2007 2008 2009 Всего осмотрено, чел. 586 599 579 547 556 Миопия: — чел.; — % 211 36 218 36 257 44 186 34 238 43 видно из представленных данных, в последние годы увеличивается количество поступающих студентов Гиперметропия 7 9 6 2 3 с патологией позвоночника (42,0±8,6 и 17,0±8,8 соотАстигматизм 15 21 9 3 11 ветственно при p<0,05). В то же время при обучении Косоглазие 3 2 2 4 2 в вузе наблюдается значимый рост заболеваний ЖКТ Другие болезни 11 14 9 2 4 у студентов (21,0±7,1 и 67,0±13,6 соответственно при Группа студентов с миопией берется на диспан- p<0,01), в том числе хронический гастрит увеличивасерный учет, главная задача которого — замедлить ется в 3,7, гастродуоденит — в 2,8 раза. При этом непрогрессирование миопии и предупредить возмож- обходимо отметить у студентов с миопией высокую ные осложнения. При этом студенты осматрива- частоту встречаемости ВИДС (42 %). ются 2–3 раза в год, проводятся курсы питающей Таблица 2 терапии, даются рекомендации, определяется физХарактеристика соматического статуса культурная группа. Периодические осмотры дану студентов с миопией 1–3 курсов ной группы студентов включают: контроль остро(1 группа) и 4–6 курсов (2 группа), % ты зрения, периметрию, скиаскопию, биомикроскопию отделов глаза, осмотр глазного дна, подбор 1 группа 2 группа очков, при необходимости консультации других (n=33 чел.) (n=12 чел.) специалистов. Для улучшения обменных процес- Вегето-сосудистая дисто36,0±8,4 33,0±13,6 сов в сетчатке применяются витамины (А, В, С, Е, ния (ВСД) Искривление позвоночника 42,0±8,6 17,0±8,8 * В1, В6, стрикс, витрум-вижн), склероукрепляющая Болезни ЖКТ 21,0±7,1 67,0±13,6 ** терапия (препараты кальция, аскорутин), препара42,0±8,6 42,0±14,0 ты для улучшения кровотока (никотиновая кислота, ВИДС Примечание. * — достоверность различия (* — p<0,05; ** — p<0,01). трентал, кавинтон и др.), антигипоксанты (эмоксипин 1 %). При прогрессировании близорукости Выводы. Среди студентов 1 курса наблюдаети появлении осложнений пациенты направляются на консультацию в областной офтальмологический ся высокая распространенность миопии (34–44 %), диспансер для лазерного (ППЛКС), либо хирурги- которая ассоциируется с наличием у них соматичес­ ческого (склеропластика, склеропломбирование) кой патологии. Поэтому при проведении комплекслечения. Кроме того, на диспансерном учете со- ных профилактических мероприятий в вузах, таких стоят пациенты с гиперметропией высокой степе- как оптимизация учебного процесса, обеспечение ни, астигматизмом, врожденной патологией органа регулярного и полноценного питания, санитарнопросветительская работа, регулярные медицинские зрения и др. При этом необходимо учитывать наличие сле­дую­ осмотры, необходимо в первую очередь учитывать щих соматических заболеваний, которые были уста- наличие заболевания ЖКТ и патологии позвоночновлены при обследовании студентов (табл. 2). Как ника. Окончание таблицы 1 Литература 1. Деев, Л. А. Оценка состояния клинической рефракции у студентов СГМА / Л. А. Деев // Актуальные проблемы современной офтальмологии: тез. докл. — Смоленск: СГМА, 1995. — С. 99–101. 2. Ковалёвский, Е. И. Офтальмология / Е. И. Ковалёвский. — М.: Медицина, 1995. 3. Петров, С. А. Офтальмоиммунология близорукости / С. А. Петров, Ю. Г. Суховей. — Тюмень, 2007. — 180 с. 4. Петров, С. А. Клинико-функциональные и иммунопатогенетические механизмы формирования усиления рефракции: автореф. дис.… д-ра. мед. наук / С. А. Петров. — М., 2009. — 44 с. 5. Сердюченко, В. Соматический статус и физическое развитие детей и подростков как факторы риска развития миопии / В. Сердюченко, Е. Драгомирецкая, Е. Ностопырева, И. Головко // Санитарный врач. — 2005. — № 11. — С. 40–42. 6. Шерстнёва, Л. В. Анализ распределения клинической рефракции (по данным взаимной диспансеризации студентов ММА им. И. М. Сеченова) / Л. В. Шерстнёва [и др.] // Вестн. офтальмол. — 1998. — № 5. — С. 55 — 56. 7. Fledelius, H. C. Myopia profile in Copenhagen medical students 1996–98. Refractive stability over a century is suggested / H. C. Fledelius // Acta-Ophthalmol-Scand. — 2000. — № 78 (5). — Р. 501–505. 33 И. М. Кагиров, Л. Х. Мурова ОФТАЛЬМОХИРУРГИЧЕСКАЯ ПОМОЩЬ В МИКРОХИРУРГИЧЕСКИХ ЦЕНТРАХ И ОТДЕЛЕНИЯХ РЕСПУБЛИКИ БАШКОРТОСТАН ПО ИТОГАМ 2010 ГОДА ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Офтальмохирургическая помощь в микрохирургических центрах и отделениях Республики Башкортостан направлена на оказание специализированной, квалифицированной, доступной и бесплатной медицинской помощи населению республики. Оказание офтальмологической помощи проводится в соответствии с ежегодно принимаемой Правительством Республики Башкортостан Программой государственных гарантий оказания гражданам бесплатной медицинской помощи. Государственный заказ для обеспечения прик­ реп­ленного населения специализированной офтальмологической помощью и рационального использования коечного фонда на оказание офтальмологической помощи, помимо муниципального заказа, сконцентрирован в 7 межрайонных офтальмологических отделениях (МХО) в гг. Стерлитамак, Салават, Белебей, Октябрьский, Дюртюли, Нефтекамск, Белорецк и в 5 микрохирургических офтальмологических центрах (МХЦ) гг. Сибай, Кумертау, Туймазы, Янаул и в Салаватском районе. Муниципальный заказ сконцентрирован в 3 городских МХО — в гг. Уфа, Мелеуз, Ишимбай и в городском МХЦ в г. Учалы. За 2010 г. фактическое выполнение муниципального заказа составило 104 %, государственного — 123 %. Следует отметить, что при выполнении муниципального заказа практически во всех микрохирургических отделениях и центрах в городах и районах РБ наблюдается низкая хирургическая активность: в гг. Ишимбай — 29, Мелеуз — 32, Нефтекамск — 35, Дюртюли — 40, Стерлитамак — 50, Янаул — 51, Кумертау — 52 %. Значительное перевыполнение государственного заказа отмечается в гг. Сибай — 273, Белорецк — 170, Стерлитамак — 136 %, а недовыполнение муниципального заказа в городах Сибай — 61 и Кумертау — 97 %. В 2010 г. офтальмологическую службу в 6 микрохирургических центрах и в 10 микрохирур34 гических отделениях Республики Башкортостан представляли 37 врачей. Большинство из них имеют высшую — 19 (51,3 %) и первую — 8 (21,6 %) квалификационные категории. Вторую категорию имеют — 3 (8,1 %) врача, без категории работают — 7 (19 %) врачей. Стационарная помощь микрохирургическими центрами и отделениями республики осуществлялась в 2010 г. на 349 круглосуточных койках. Отмечается ежегодное сокращение офтальмологических коек по республике. Так, если в 2005 г. коечный фонд в МХЦ и МХО составил 488 коек, то в 2006 г. — 450, в 2007 г. — 462, в 2008 г. — 436, а в 2009 г. —407. Стационарное лечение в МХЦ и МХО получили 13 266 человек. На хирургическом лечении в 2010 г. в учреждениях муниципального и городского уровней находилось 6800 человек, операций всего выполнено 7031. Катаракта является одной из ведущих причин обратимой слепоты и слабовидения во всем мире. Из общего числа операций — 7031, произведенных в МХЦ и МХО, экстракций катаракты выполнено — 3842 (54,6 %), из них с имплантацией ИОЛ — 3475 (90,4 %). В настоящее время глаукома остается достаточно распространенным заболеванием, требующим квалифицированного подхода в лечении. Основной задачей хирургического лечения этого заболевания является снижение и стабилизация внутриглазного давления. По данным годового отчета за 2010 г., больным глаукомой в МХО и МХЦ РБ проведены 839 операций. Для сравнения, в 2006 г. было выполнено 658, в 2007 — 657, в 2008 — 744, в 2009 — 772 операций. В целях дальнейшего совершенствования оказания высококвалифицированной специализированной офтальмологической помощи населению Республики Башкортостан необходимо: — организация стационарзамещающих отделений на базе больничных учреждений, частичный переход с круглосуточных коек на койки дневного пребывания, что позволит более широко и экономически эффективно использовать ресурсные возможности коечного фонда в МХО и МХЦ РБ, — повышение квалификации офтальмологов поликлинического звена, а также МХО и МХЦ, с вне- дрением в практику новых микрохирургических технологий, — укрепление материально-технической базы офтальмологических кабинетов, микрохирургичес­ ких центров и отделений в соответствии с приказом №115н от 27.02.2010 Минздравсоцразвития России. Т. М. Калинина, С. Р. Авхадеева 1 Состояние офтальмологической помощи и некоторые показатели глазной заболеваемости детей за 2007–2009 годы в Республике Башкортостан ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа, 1 Башкирский государственный медицинский университет, кафедра офтальмологии, г. Уфа Охрана зрения детского населения в настоящее время является одним из приоритетных направлений работы офтальмологической службы Республики Башкортостан (РБ). Офтальмологи Уфимского НИИ глазных болезней совместно с сотрудниками кафедры офтальмологии БГМУ в течение ряда лет проводят изучение показателей заболеваемости у детей, выявление основных тенденций по различным аспектам врожденных и приобретенных заболеваний глаз. Цель — оценка состояния офтальмологичес­ кой помощи детскому населению Республики Башкортостан: заболеваемости по обращаемости, диспансерному обслуживанию, профилактическим осмотрам. В статье использованы результаты анализа годовых отчетов районных и городских офтальмологов РБ за 2007–2009 гг. Проведены комплексные статистические исследования и их экспертная оценка. Офтальмологическая помощь детям осуществляется в районах Республики Башкортостан — окулистами на смешанном приеме, в городах — окулистами детских поликлиник. Квалифицированную консультативную и лечебную помощь дети получают в детском консультативно-поликлиническом отделении и детском микрохирургическом отделении Уфимского НИИ глазных болезней, который является одним из ведущих центров по детской офталь35 мологии в Российской Федерации. В институте разработано комплексное лечение врожденных катаракт с первых месяцев жизни с целью получения высоких функциональных результатов, различные методы рефракционной хирургии, в том числе рефракционная кератопластика, имплантация интра­ оку­лярных линз, начиная с 2-месячного возраста; реконструктивные операции последствий травм органа зрения. Несмотря на улучшение материально-техничес­ кой базы и достижения современной офтальмологии, заболеваемость глаз по обращаемости в последние годы имеет тенденцию к увеличению, и в 2009 г. составила 1826 на 100 тыс. детского населения, тогда как в 2008 г. — 1666 на 100 тыс. детей. В общей структуре глазных болезней по обращаемости у детей по нозологии в 2009 году, как и в прошлые годы, на первом месте стоят нарушения рефракции (45,7 %), из них близорукость составила 81,4 %; на втором — воспалительные заболевания конъюнктивы (16,8 %, в 2008 г. — 15,7 %); на третьем — воспалительные заболевания век (4,7 %, в 2008 г. — 4,3 %); затем косоглазие и врожденные аномалии глаз. На диспансерном наблюдении у районных и городских окулистов в 2009 г. находились 73 829 детей и подростков (888 на 10 тыс. детского населения), а в 2008 г. этот показатель составил 76 470 человек. Доля детей от 0 до 14 лет в структуре диспан- Рис. 1. Заболеваемость по обращаемости в РБ за 2007–2009 гг. серного наблюдения существенно не изменилась. В 2009 г. на учете наблюдалось 45 332 ребенка до 14 лет, в 2008 — 47 108, в 2007 — 46 828 маленьких пациентов. Наибольшее количество детей ежегодно наблюдалось поводу миопии (около 67,7 %), из них большинство (92 %) — школьники. Более 70 % детей, находящихся на диспансерном учете, имели миопию слабой степени со спазмом аккомодации. На втором месте — дети с косоглазием (около 5,5 %), на третьем — с гиперметропией (около 2 %). Приоритетным направлением деятельности детских офтальмологов является профилактическая работа. В 2009 г. профосмотрами было охвачено 485 628 детей. Было выявлено 12,5 % детей от числа осмотренных с патологией органа зрения, в том числе 1522 пациента с врожденной патологией (в 2008 г. — 1031 ребенок). Одним из важнейших разделов работы врачейофтальмологов является наблюдение за детьми с ограниченными возможностями. В республике охвачены диспансерным осмотром офтальмологов 1206 детей, посещающих специализирован- ные детские сады и школы для слепых и слабовидящих. Особое внимание сотрудники детских отделений уделяют детям коррекционной школыинтерната 4 типа № 28 г. Уфы для слепых и слабовидящих, где обучаются 209 детей. Постоянным вниманием окружены дети с катарактой и афакией. В последние пять лет проводится медикогенетическое обследование детей с врожденной наследственной катарактой. По показаниям им проводится оперативное лечение. В 2009 г. стационарное лечение в УфНИИ ГБ получили 1663 ребенка, что меньше, чем в 2008 г., это связанно с сокращением коечного фонда. В 2009 г. в РБ проведено 1001 операций детям до 17 лет (в 2008 — 632), причем наблюдается значительный рост высокотехнологичных операций (из 103 операций по поводу катаракты — 101 с имплантацией ИОЛ), в 2007 г. эти показатели составили соответственно 54 и 51. Количество детей-инвалидов по зрению на 10 000 детского населения составило 9,25. В 2009 г. впервые выявлено 95 детей-инвалидов. Рис. 2. Охват диспансерным наблюдением детей и подростков 36 Общее количество слепых детей 531, в 2008 г. — 422 ребенка, слабовидящих — 1564. Нозологическая структура инвалидности по зрению среди детского населения следующая: заболевания сетчатки и зрительного нерва — 43,6 %; миопия — 19,9 %; катаракта — 8,3 %; анофтальм — 3,4 %; прочие — 16,8 %. Для улучшения качества и доступности офтальмологической помощи детям РБ необходимо сохранение и укрепление материально-технической базы ортоптических кабинетов детских поликлиник, введение штатных единиц детских офтальмологов в межрайонных диагностических центрах, организация офтальмологического кабинета выявления и мониторинга ретинопатии недоношенных, развитие сети специализированных детских садов и групп в школах для детей с патологией органа зрения. Необходимо запланировать проведение регулярных совместных конференций со специалистами, работающими в образовательных учреждениях для детей-инвалидов по зрению (педагоги, психологи, воспитатели) и разработку программ по улучшению комплексной (медицинской, психологической социальной) реабилитации детей с патологией зрения. Г. С. Кригер, Р. Р. Яруллина НАШ ОПЫТ ПРИМЕНЕНИЯ ДИСТАНЦИОННЫХ ФОРМ ПРОФЕССИОНАЛЬНОГО ОБУЧЕНИЯ Ресурсный центр «Московская школа медицинской оптики», г. Москва Основной задачей любого профессионального образовательного учреждения является подготовка новых специалистов той или иной отрасли, профессиональная переподготовка и повышение уровня квалификации действующих специалистов. Врачи-офтальмологи, как занимающиеся лечебной деятельностью, так и работающие в сфере оптического бизнеса, а также специалисты в облас­ ти медицинской оптики и оптометрии должны постоянно повышать свой профессиональный уровень. В нашей стране подготовкой таких специалистов занимаются на сегодняшний момент только два государственных образовательных учреждения: Санкт-Петербургский медико-технический колледж и ресурсный центр «Московская школа медицинской оптики» на базе кафедры сервиса и сферы услуг (СиСУ) колледжа предпринимательства № 11 г. Москвы. Малое количество таких образовательных учреждений приводит к тому, что основной контингент слушателей курсов повышения квалификации — жители других регионов страны. До недавнего времени профессиональное обучение проходило при обязательном присутствии преподавателя и обучающихся в аудитории. Однако в ходе своей образовательной деятельности в традиционном аудиторном режиме мы столкнулись со следующими проблемами: у руководства 37 оптичес­ких салонов возникают сложности при отправлении на длительный срок своих сотрудников на обучение (затраты на проезд, проживание, возрастание нагрузки на оставшихся сотрудников салона, численность которых в период экономического кризиса и так сведена к минимуму); да и сами сотрудники, направленные на длительную учебу, испытывают определенные трудности (отрыв от семьи, затраты на питание, телефонную связь и др.). Решить эти проблемы нам помогло использование, наряду с традиционными, дистанционных форм обучения. Развитие компьютеризации и появление Интернета, а также их доступность сделали возможным распространение дистанционного обучения по всему миру [1]. Появилась возможность общаться и получать необходимую информацию, независимо от места проживания. Распространение «быстрого Интернета» дало возможность использовать для обучения онлайн-семинары (вебинары) [2]. Впервые дистанционная форма обучения была применена в Московской школе медицинской оптики в январе 2010 года [3]. Тогда в рамках проведения выездных циклов обучения по специальности «Медицинская оптика» была организована экспериментальная онлайн-трансляция с использованием интернет-технологий. Слушатели выездных курсов повышения квалификации по направлениям «Техник-оптик» и «Продавец-консультант оптического салона», проходившие обучение на базе Первой республиканской клинической больницы (г. Ижевск, Удмуртская Республика), получили возможность в режиме реального времени аудиовизуально присутствовать на лекциях преподавателей кафедры СиСУ. Помимо лекционного материала слушатели получили возможность присутствовать в онлайн-режиме и в производственной лаборатории РЦ «МШМО», где было установлено оборудование, позволяющее наблюдать за работой современных станков и всеми этапами изготовления очков. Слушатели по ходу практической части семинара могли также задавать вопросы специалисту. В дальнейшем, опираясь на положительный опыт онлайн-трансляции, мы стали применять дистанционное обучение и на курсах по подготовке специалистов в сфере оптометрии. Слушателями таких курсов с января 2010 по март 2011 года стали работники оптических салонов Казани, Краснодара, Пятигорска. Во время теоретической части курсов обучающиеся в онлайн-режиме слушают лекторов, а во время практической части наблюдают за работой преподавателей кафедры в оптометрической лаборатории, оснащенной современным оптометрическим, офтальмологическим и аудиовизуальным оборудованием. Дистанционное обучение мы применили также и при проведении мастер-классов в рамках профессиональных выставок очковой оптики [4]. В декабре 2010 и феврале 2011 года мы транслировали для аудитории в выставочном комплексе «Крокус Экспо» подбор средств коррекции пациентам, которые находились в это время в оптометрической лаборатории РЦ «МШМО». Слушатели во время мастеркласса могли задавать вопросы как преподавателю, так и пациенту. Таким образом, наш опыт показал, что дистанционный метод обучения можно считать успешным и перспективным. Стремительность современного мира требует применения наиболее быстрых и дешевых способов передачи знаний, и интернет-техно­ ло­гии позволяют это успешно осуществлять. Нельзя не отметить и тот немаловажный факт, что дистанционное обучение многократно сокращает расходы на повышение квалификации сотрудников, так как исключает необходимость оплачивать проезд и проживание в другом городе. Это дает возможность большему количеству региональных сотрудников оптических сетей пройти обучение и существенно повысить качество своей работы. Литература 1. Малитиков, Е. М. Актуальные проблемы развития дистанционного образования в Российской Федерации и странах СНГ / Е. М. Малитиков, М. П. Карпенко, В. П. Колмогоров // Право и образование. — 2000. — № 1 (2). — С. 42–54. 2.Полат, Е. С. Педагогические технологии дистанционного обучения / Е. С. Полат, М. В. Моисеева, А. Е. Петров; под ред. Е. С. Полат. — М.: Академия, 2006. 3. Зайцева, М. В. Дистанционное обучение в «Московской школе медицинской оптики» / М. В. Зайцева // Оправы и линзы. — 2010. — № 2. — С. 52. 4. Зайцева, М. В. РЦ «МШМО» в «Крокус Экспо»: новые технологии в обучении оптометрии / М. В. Зайцева // Веко. — 2011. — № 1. — С. 87. В. Я. Мельников, Е. C. Куликова, Ю. В. Мельникова, Л. К. Ярлыкова ДЕТСКИЙ ГЛАЗНОЙ ТРАВМАТИЗМ В ПРИМОРСКОМ КРАЕ ГОУ ВПО ВГМУ Минздравсоцразвития России, кафедра офтальмологии с курсом детской офтальмологии, ГБУЗ «Краевая клиническая больница №2», г. Владивосток Повреждения глазного яблока и его вспомогательного аппарата в структуре детской глазной патологии составляют около 10 %; большинство повреждений глаз у детей носит характер микротравм 38 (60 %) и тупых травм (30 %), на долю проникающих ранений приходится не более 2 %, ожогов — около 8 % [5]. В детских офтальмологических стационарах страны дети с повреждениями органа зрения составляют почти 50 % больных, в т. ч. с тупыми травмами — 70 %, с ожогами — 20 и с ранениями — примерно 10 % от всех больных с повреждениями; 85 % тупых травм наблюдаются у детей школьного возраста и 15 % приходится на дошкольников; у детей до 2 лет повреждения глаз носят исключительно спорадический характер [3]. Детский глазной травматизм вызывает тяжелые осложнения, занимает одно из ведущих мест среди причин слабовидения и слепоты. По данным ВОЗ, в мире насчитывается около 150 млн слепых и слабовидящих людей, из них 1,5 млн — дети до 14 лет [6]. В нашей стране каждый четвертый из числа незрячих — ребенок или взрослый, утративший зрение в детстве. Уровень детской инвалидности по зрению в Российской Федерации составляет 5,2 на 10 000 населения соответствующего возраста, в т. ч. 1 % — инвалидность по зрению после травм [4]. Травмы глаз и их придатков у детей могут быть следствием воздействия механических, термичес­ ких, химических повреждающих факторов, а также лучевых поражений. Воздействие колющих, режущих, тупых предметов приводит к ранениям и контузиям глазного яблока. Влияние термичес­ ких, химических факторов, а также инфракрасного и ультрафиолетового излучений вызывает ожоги. Часто встречается сочетание механических и термических поражений, термических и химических, термических и лучевых ожогов с повреждениями костей орбиты [2]. Травмы органа зрения у детей характеризуются повреждениями как самого глазного яблока, так и его вспомогательных органов, век, слезных органов, глазницы. Повреждения глазного яблока могут быть следствием непроникающих, проникающих и сквозных ранений глаза. Следует иметь в виду, что контузии глаза бывали как без нарушения целостности склеры, так и с субконъюнктивальными разрывами. Проникающие ранения глаз были роговичными, склеральными и корнеосклеральными, с инородными телами (магнитные или амагнитные) внутри глаза и без инородных тел [1]. По степени тяжести различают легкие непроникающие ранения — без нарушения целости фиброзной капсулы; средней тяжести — с прободением глазного яблока, но без выпадения внутренних оболочек; тяжелые — сопровождающиеся выпадением оболочек, хрусталика, стекловидного тела, кровоизлиянием внутрь глаза, повышением внутриглазного давления, внедрением инородных тел. Очень тяже39 лые — при которых происходит разрушение глазного яблока [7]. Цель — оценка структуры детского глазного травматизма в Приморском крае и результатов хирургического лечения детей, которые обратились по поводу травматического повреждения органа зрения в глазную клинику Владивостокского государственного медицинского университета с 2008 по 2010 гг. Материал и методы. За период наблюдения в детское глазное отделение ГБУЗ Краевой клинической больницы № 2 г. Владивостока обратилось 52 пациента детского возраста с различными травмами глаз, нуждающихся в хирургическом лечении. Изучались данные об этиологии травм, характере клинических проявлений, анатомичес­ кому положению, сроках обращения после полученной травмы, наличия инородных внутриглазных тел. Распределение детей с травмой глаз по полу и возрасту Возраст 0–3 года 4–6 лет 7–10 лет 10–13 лет 14–17 лет ВСЕГО Пол муж. 4 10 10 10 12 46 жен. 0 2 3 0 1 6 Всего % 4 12 13 10 13 52 7,7 % 23,0 % 25,0 % 19,3 % 25,0 % 100,0 % Результаты и обсуждение. У 32 (61,5 %) пациентов ранения были проникающие, у 12 (23 %) — непроникающие, у 5 (9,7 %) — контузии тяжелой степени, у 3 (5,8 %) — контузии средней степени тяжести. Ранения склеры диагностированы у 11 (21,2 %) человек, роговичные ранения — у 19 (36,5 %), роговично-склеральные — у 6 пациентов (11,5 %), рваные раны век и конъюнктивы — у 7 человек (13,5 %), контузии тяжелой и средней степени — у 8 (15,4 %) и у 1 ребенка — ранение орбиты (1,9 %). В первые часы и до 24 часов после травмы в глазной травмпункт обратились 41 человек (78,9 %), которым была проведена первичная хирургическая обработка ран, отсроченная у 6 человек (11,5 %), и поздняя хирургическая обработка — у пяти обратившихся (9,6 %). Из всех пострадавших у семи пациентов (13,5 %) были обнаружены внутриглаз- ные инородные тела, которые при хирургической обработке были удалены. Методы лечения. В нашей клинике наряду с традиционными методами лечения применяется катетеризация ретробульбарного пространства с введением лекарственных средств (антибиотиков, противовоспалительных, дедистрофических препаратов). В первые 3–5 суток используется субконъюнктивальное введение гемазы для рассасывания кровоизлияний. В более позднем периоде (более 5 суток) используется фонофорез с коллализином. При первичной хирургической обработке применяется кератопокрытие амнионом, используются мягкие контактные линзы с лечебной и тектонической целью. Клинический пример. Больная Р., 5 лет, поступила в глазное отделение Краевой клинической больницы № 2 с проникающим ранением роговицы (сложным, звездчатой формы) правого глаза. Проведена первичная хирургическая обработка раны с дополнительным кератопокрытием амнионом и наложением мягкой контактной линзы с тектонической целью. В послеоперационном периоде отмечалась герметизация раны, быстрая регенерация роговицы, в отдаленном периоде — нежное рубцевание роговицы. Выводы. В структуре детского глазного травматизма в Приморском крае преобладают проникающие ранения глазного яблока, причем мальчики страдают в 7 раз чаще девочек. Из анатомических структур наиболее часто (36,6 %) повреждается роговица. Большинство (78,9 %) пострадавших обращается за помощью в первые 24 часа с момента травмы. По нашим данным, наиболее эффективным является комбинированное лечение с применением современных технологий. Литература 1. Аветисов, Э. С. Руководство по детской офтальмологии / Э. С. Аветисов, Е. И. Ковалевский, А. В. Хватова. — М., 1987. — 496 с. 2. Боброва, Н. Ф. Травмы глаза у детей / Н. Ф. Боброва. — М., 2003. 3. Ковалевский, Е. И. Глазные болезни / Е. И. Ковалевский. — М.: Медицина, 1980. 4. Либман, E. С. Состояние и динамика слепоты и инвалидности вследствие патологии органа зрения в России / E. С. Либман, Е. В. Шахова // VII Всесоюз. съезд офтальмологов: тез. докл. — М., 2001. 5. Травмы глаза / под общ. ред. Р. А. Гундоровой, В. В. Нероева, В. В. Кашникова. — М., 2009. — 560 с. 6. Тэйлор, Д. Детская офтальмология / Д. Тэйлор, К. Хойт. — М., 2002. — 248 с. 7. Хватова, А. Н. Травма глаза / А. Н. Хватова, Д. Тэйлор. — М., 2002. Г. А. Моисеева, О. Ю. Колесников СТРУКТУРА ДЕТСКОЙ ИНВАЛИДНОСТИ ПО ЗРЕНИЮ В РЯЗАНСКОЙ ОБЛАСТИ ГУЗ РКБ им. Н. А. Семашко, г. Рязань По данным Е. С. Либман (2007), ежегодно инвалидами по зрению в России становятся 4300 детей, в связи с чем вопросы охраны зрения детей являются не только медицинской, но и социальной проблемой. Профилактика и снижение слепоты и инвалидности являются одними из основных направлений работы детских офтальмологов России. Цель — изучение структуры первичной глазной детской инвалидности по Рязанской области за 3 года (с 2006 по 2008 годы). Материал и методы. Проведен анализ результатов освидетельствования детей, направленных на 40 глазную МСЭК по Рязанской области за 2006–2008 го­ ды. Результаты и обсуждение. За указанный период на МСЭК было направлено 548 детей, из них 95 человек впервые были признаны инвалидами по зрению. За 2006 год признано инвалидами 35 детей, за 2007 — 38, за 2008 год — 22 ребенка. Таким образом, в 2008 году количество детей-инвалидов было значительно ниже по сравнению с 2006 и 2007 годами. Среди детей-инвалидов, поставленных на учет в 2006 году, 28,6 % детей — жители сель- Структура первичной детской инвалидности по нозологиям ской местности и 71,4 % — городские жители, в 2007 году — 18,4 и 81,6 % соответственно. Из взятых на учет в 2008 году 36,4 % детей было из села и 63,6 % из города. Таким образом, за 2006–2008 годы среди детей, впервые признанных инвалидами, преобладали дети, проживающие в городской местности. Из приведенного рисунка видно, что в структуре первичной инвалидности у детского населения преобладают аномалии рефракции: от 34,3 % — в 2006 до 50,0 — в 2008 году. Подавляющее большинство этой патологии составляет врожденная близорукость. На втором месте находится врожденная патология глаз. Третье место принадлежит травмам органа зрения. Инвалидность по поводу врожденной патологии устанавливалась чаще в возрасте до 3 лет, а по поводу аномалий рефракции — в дошкольном возрасте. Аномалии рефракции, в основном, выявлялись при профилактических осмотрах при поступлении детей в школу. Травмы глаза отмечались чаще в дошкольном, младшем и среднем школьном возрастах, т. е. в период наибольшей двигательной активности детей. Глазной травматизм у детей (как и любой вид травматизма) имеет ярко выраженный сезонный характер: пики приходятся на сентябрь — начало октяб­ ря, март — апрель, меньше — на июнь, что связано 41 с изменением погодных условий и началом и окончанием учебного года. Глазная травма у мальчиков встречается примерно в 5 раз чаще, чем у девочек; девочки чаще становятся «невольными жертвами» травм в силу специфики детских игр. Из врожденной патологии чаще всего причинами инвалидности по зрению у детей являются: врожденная глаукома, врожденная катаракта, аномалии развития глазного яблока (микрофтальм, колобомы сосудистой оболочки, аниридия, аномалии зрительного нерва и др.), дистрофические и атрофические процессы на глазном дне (врожденный токсоплазмоз). Выводы. За 2006–2008 годы в Рязанской области первичная инвалидность по зрению была установлена у 95 детей из 548, направленных на глазную МСЭК. Отмечено значительное снижение уровня первичной инвалидности в 2008 году по сравнению с предыдущими годами. Установлено, что инвалидами по зрению в 2–3 раза чаще становятся дети, проживающие в городе, по сравнению с сельскими жителями. Глазная травма, приводящая к инвалидизации, у мальчиков встречается примерно в 5 раз чаще, чем у девочек. Среди причин, приводящих к детской инвалидности по зрению, на первом месте находятся аномалии рефракции, на втором — врожденная патология, на третьем — травмы органа зрения. А. Ш. Мухамедьянова, З. Р. Марванова АНАЛИЗ КЛИНИКО-ЭКСПЕРТНОЙ РАБОТЫ И ЭКСПЕРТИЗЫ ВРЕМЕННОЙ НЕТРУДОСПОСОБНОСТИ ГУ «УФИМСКИЙ НИИ ГЛАЗНЫХ БОЛЕЗНЕЙ» АН РБ ЗА 2010 ГОД ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Клинико-экспертная работа и работа по экспертизе временной нетрудоспособности в ГУ «Уфимский НИИ глазных болезней» АН РБ (далее — ГУ «УфНИИ ГБ» АН РБ) осуществляется на основании нормативных и законодательных актов Российской Федерации и Республики Башкортостан, постановлений и распоряжений Правительства РФ и РБ, приказов Минздравсоцразвития РФ и Министерства здравоохранения РБ, приказов РФОМС, Программы Государственных гарантий оказания бесплатной медицинской помощи, а также приказов директора ГУ «УфНИИ ГБ» АН РБ. Организационная работа Заседания врачебной комиссии (ВК) в течение 2010 года проводились ежедневно в соответствии с утвержденным Положением об организации деятельности врачебной комиссии ГУ «УфНИИ ГБ» АН РБ. ВК решала вопросы экспертизы временной нетрудоспособности, экспертизы качества медицинской помощи, рационального назначения лекарственных средств, выдачи медицинских заключений о характере полученных повреждений здоровья в результате несчастного случая на производстве и степени их тяжести, о необходимости направления граждан РБ в медицинские учреждения, участвующие в выполнении Государственного задания на оказание высокотехнологичной медицинской помощи, справок для оплаты лечения застрахованных лиц при повреждении здоровья в результате несчастного случая на производстве, занималась разбором жалоб и обращений граждан и др. Всего в 2010 году на заседаниях ВК проведено 959 разборов. Порядок организации деятельности и персональный состав врачебной комиссии ГУ «УфНИИ ГБ» АН РБ утвержден приказом директора № 145-К от 04.06.2010 (в соответствии с приказом Минздравсоцразвития РФ от 24.09.2008 г. № 513н «Об утверждении положения о врачебной комиссии медицинской организации»). Заместителями главного врача (по организа­ цион­но-методической работе и лечебному контро42 лю и по поликлинике) систематически проводился контроль за обоснованностью госпитализации, оформлением медицинских карт амбулаторного и стационарного больного, первичным описанием больного, рациональным назначением лекарственных препаратов, ведением врачебных записей в медицинских картах стационарного больного, оформлением выписных эпикризов. Случаев необоснованной госпитализации выявлено не было, замечания по ведению историй болезни разбирались в рабочем порядке и на врачебных конференциях, упущения и недочеты были исправлены. Проводилась проверка адекватности назначенной терапии, результаты проверок обсуждались в отделениях и на врачебных конференциях. Осуществлялся регулярный контроль за выпис­ кой и выдачей листков нетрудоспособности (ЛН) больным, находящимся на стационарном лечении (в консультативной поликлинике ЛН не оформляются). Выборочный анализ показал, что врачи правильно собирают экспертный анамнез, указывают сроки явки к врачу при выписке на амбулаторное лечение в случаях продолжения временной нетрудоспособности. Проведено всего 60 разборов на заседаниях ВК (6,3 %) по вопросам экспертизы временной нетрудоспособности. В 6 случаях из 60 (10,0 %) имело место несвоевременное представление на ВК больных, длительно находящихся на ЛН (свыше 30 дней). Чаще всего подобные упущения встречались, когда пациенты не информировали врача о предыдущем пребывании на ЛН. За отчетный период было выявлено 3 случая (5,0 %) несвоевременного представления истории болезни на оформление листка нетрудоспособнос­ ти. Во всех случаях имелись объективные причины: перевод пациента в другое учреждение, выпис­ка ЛН «по совместительству», о которой не было информации при оформлении медицинской карты стационарного больного, пациенты своевременно не сообщили, что являются работающими, а после выписки предоставляли справки с места работы и просили оформить ЛН (несмотря на то, что все пациенты при поступлении в стационар ставят подпись под информацией о месте работы). Все случаи выдачи ЛН за прошедшее время решались через ВК и оформлялись в медицинских картах стационарного больного и в журнале формы 035y-02 согласно приказу Минздравсоцразвития РФ № 514 от 01.08.07 года «О порядке выдачи медицинскими организация­ми листков нетрудоспособности». В течение года заместителями главного врача (по организационно-методической работе и лечебному контролю и по поликлинике) проводилась экспертиза медицинских карт стационарных и амбулаторных больных (по законченному случаю) с обсуждением результатов проверок с врачами и заведующими отделениями в соответствии с «Положением по ведению медицинской документации (медицинская карта стационарного больного, амбулаторная карта) в системе обязательного медицинского страхования в ГУ „УфНИИ ГБ“ АН РБ». Проводился контроль за длительностью пребывания больного на койке. В 76 случаях из 959 (7,9 %) на заседаниях ВК было принято решение о необходимости продолжения лечения больных сверх установленных нормативов. Каждый случай рассматривался индивидуально. В основном, это были клинически тяжелые больные, которым было необходимо проведение дополнительных диагностических, медикаментозных и хирургических мероприятий. Продление пребывания на стационарном лечении проводилось только через ВК. В ГУ «УфНИИ ГБ» АН РБ за 2010 год всего проведено 2500 высокотехнологичных операций. Следует отметить, что из всего перечня высокотехнологичной медицинской помощи нами выполняются практически все виды оперативных вмешательств, лишь в редких случаях возникает необходимость направления пациентов в федеральные медицинские учреждения. Работа по отбору и направлению граждан РБ в федеральные медицинские учреждения для оказания высокотехнологичной медицинской помощи является важной составляющей деятельности комиссии. Всего на лечение в Федеральные центры РФ было направлено 42 пациента (4,4 %). Из них в ФГУ «Московский НИИ глазных болезней им. Гельм­ гольца Росмедтехнологий» направлено на лечение 22 пациента (52,4 %), ФГУ МНТК «Микрохирургия глаза» им. академика С. Н. Федорова «Росмедтехнологий» (г. Москва) — 11 (26,2 %), ФГУ «Всероссийский центр глазной и пластической хирургии Минздравсоцразвития РФ» (г. Уфа) — 8 (19,0 %), 43 ГУ «Научно-исследовательский институт глазных болезней» Российской академии медицинских наук (г. Москва) — 1 (2,4 %). Направление пациентов проводилось согласно Перечню федеральных бюджетных медицинских учреждений, находящихся в ведении Министерства здравоохранения и социального развития Российской Федерации, участвующих в выполнении государственного задания на оказание в 2010 году высокотехнологичной медицинской помощи гражданам РФ и Перечню методов лечения при оказании высокотехнологичной медицинской помощи по профилю «Офтальмология». На заседаниях ВК в 2010 году обсуждались вопросы назначения 5 и более препаратов одномоментно или 10 препаратов в течение 1 месяца пациентам согласно Приказу Министерства здравоохранения социального развития РФ от 24.09.08 № 513-Н «Об организации деятельности врачебной комиссии медицинской организации». Количество заседаний по поводу рационального назначения лекарственных препаратов составило 689 (71,8 %). Большое количество заседаний данной подкомиссии объясняется тем, что глазные капли включались в протокол ВК помимо местных и системных инъекционных препаратов (антибактериальных, противовоспалительных, десенсибилизирующих средств, ангиопротекторов, кортикостероидов) и дополнительно назначенных терапевтом лекарственных средств при сопутствую­ щей соматической патологии, что существенно увеличило нагрузку на врачей-офтальмологов при оформлении медицинской документации. Исходя из опыта офтальмологических клиник других регионов РФ, нами была осуществлена попытка снизить данную нагрузку путем исключения глазных капель из подсчета при назначении одному больному пяти и более наименований лекарственных средств в течение одних суток, ссылаясь на отсутствие их в перечне Федеральных стандартов, однако разрешение не было получено. Поэтому большое количество заседаний ВК по назначению 5 препаратов и более объясняется необходимостью включения глазных капель, помимо местных и системных назначений, в протокол ВК независимо от вида и тяжести заболевания. Таким образом, ВК решала следующие вопросы: — назначение 5 и более лекарственных препаратов — 689 случаев (71,8 %); — экспертиза временной нетрудоспособности — 60 (6,3 %); — контроль за пребыванием на койке: превышение сроков медико-экономических стандартов — 76 (7,9 %), укорочение — 58 (6,0 %); — направление граждан РБ в федеральные медицинские учреждения РФ для оказания высокотехнологичной медицинской помощи — 42 (4,4 %); — оформление медицинского заключения о степени тяжести травмы на производстве — 15 (1,6 %); — выдача справок на оплату лечения РО Фондом социального страхования РФ по РБ пациентов с производственными травмами — 16 (1,7 %). Выводы. Врачебная комиссия ГУ «УфНИИ ГБ» АН РБ принимает решения в наиболее сложных и конфликтных случаях по вопросам диагностики, лечения, направления пациентов для оказания высокотехнологичной медицинской помощи в федеральные медицинские учреждения, определения трудоспособности граждан, а также осуществления оценки качества и эффективности лечебнодиагностических мероприятий, в том числе оценки обоснованности эффективности назначения лекарственных средств. Признано необоснованным ограничение назначения 5 и более лекарственных препаратов в условиях ГУ «УфНИИ ГБ» АН РБ, где проходит лечение особо сложный контингент пациентов с глазной патологией. Рациональное использование лекарственных средств в 71,8 % случаев в условиях оказания специализированной помощи является обоснованным. Несмотря на небольшое количество оформленных листков нетрудоспособности за прошедшее время, требуется усилить контроль по данному разделу экспертной работы. Превышение сроков лечения незначительно и во всех случаях обоснованно. В течении года в федеральные медицинские учреждения РФ для оказания высокотехнологичной медицинской помощи было направлено достаточно малое число граждан РБ, что говорит о возможности получения ими высококвалифицированной офтальмологической помощи у себя в республике в условиях ГУ «УфНИИ ГБ» АН РБ. Е. С. Пшеницына, В. В. Тюгашова, Ю. Г. Гусева, О. Н. Волкова, О. В. Липашева ИНТЕРНЕТ-РЕСУРСЫ В СОЗДАНИИ БЕЗБАРЬЕРНОЙ СРЕДЫ ДЛЯ СЛАБОВИДЯЩИХ И СЛЕПЫХ, ПРОЖИВАЮЩИХ В ОТДАЛЕННЫХ РАЙОНАХ САМАРСКОЙ ОБЛАСТИ ГОУ ВПО «СамГМУ Минздравсоцразвития России», ГУК «Самарская областная библиотека для слепых и слабовидящих», МУЗ «Челно-Вершинская ЦРБ», ГУ Самарской области «Центр социальной адаптации инвалидов по зрению», г. Самара Создание безбарьерной среды для инвалидов по зрению входит в задачи по исполнению Международной конвенции по правам инвалидов. Основная цель Конвенции заключается в поощрении, защите и обеспечении полного и равного осуществления всеми инвалидами прав человека и основных свобод, а также в уважении достоинства людей с ограниченными возможностями здоровья. Реализация постулатов Конвенции призвана повысить уровень качества жизни указанного контингента граждан Российской Федерации. Использование Интернет ресурсов для создания безбарьерной среды для слабовидящих и слепых (незрячих) пользователей дает возможность беспрепятственного и незамедлительного доступа данной 44 группы населения к различного рода информации, включающей в себя том числе и возможность дистанционного обучения. Особенно важным и актуальным доступ к порталам Интернет становится для жителей отдаленных районов. Согласно данным статистики в Челно-Вершинском районе Самарской области из 36 инвалидов 1 и 2 группы по зрению, входящих в разные возрастные группы, тифлосредствами в настоящее время пользуется только один инвалид. Этот факт обусловлен недостаточной информированностью врачей-офтальмологов и социальных работников о современных тифлосредствах, в том числе и о специальных порталах и сайтах Интернета, доступных для незрячих и слабовидящих пользователей. Цель — для успешного обеспечения реализации прав инвалидов, указанных в Международной конвенции, кафедра глазных болезней института последипломного образования СамГМУ совместно с «Центром адаптации инвалидов по зрению» и «Библиотекой для слепых и слабовидящих» г. Самары проводит лекционные, семинарские и практические занятия для врачей офтальмологов специализированных стационаров и амбулаторно-поликлинического звена, а также для врачей общей практики (семейных врачей), посвященные современным возможностям применения высоких технологий для социальной адаптации слепых и слабовидящих. Материал и методы. В условиях «Центра адаптации инвалидов по зрению» и «Библиотеки для слепых и слабовидящих» сотрудниками организованы компьютерные классы, на базе которых идет обучение, в том числе и дистанционное, слепых и слабовидящих пользоваться информационными услугами сети Интернет. Все сотрудники, проводящие такие занятия, являются незрячими или слабовидящими, что имеет очень важное психологическое значение для обучающихся. С помощью сотрудников компьютерного класса возможно установить техническое обеспечение компьютера для слепого или слабовидящего пользователя. Техническое обеспечение включает следующие программы — синтезатор речи, программу экранного доступа, программу, увеличивающую изображение на экране (для слабовидящих), а также программу оптического распознавания текста. В условиях компьютерного класса инвалиды знакомятся с программой экранного доступа NVDA со свободным исходным кодом, которую можно приобрести на сайте Русского сообщества пользователей, а также с другими программами, наиболее распространенной из которых стала программа JAWS for Windows. Сайт «Говорящий Linux» посвящен специальным возможностям, которые позволяют успешно работать с этой операционной системой. Синтезаторы речи могут быть установлены на различную скорость речи, которая изменяется по специальной шкале, есть возможность менять интонации речи — вплоть до монотонного звучания. Очень важным для жителей отдаленных районов Самарской области является возможность консультироваться по вопросам установки специальных программ с сотрудниками «Центра» по телефону. Освоив основные приемы выхода в сеть Интернет, инвалид по зрению может при возникновении затруднений задать вопрос в формате электронной почтовой конференции в специальном российском портале и получить грамотный ответ. В сети Интернет существуют также голосовые чаты для незрячих и слабовидящих. С помощью таких чатов проводятся коллективные дистанционные соревнования среди инвалидов по зрению, проживающих не только в Самаре и Самарской области, но и по всей России, на Украине, в Германии, Израиле и других странах. Специальный раздел портала «Компьютерные технологии для незрячих и слабовидящих» посвящен играм, в том числе развивающим, и логическим играм для детей. С работой этого раздела знакомятся в детских группах, объединяющих детей инвалидов по зрению. Результаты и обсуждение. Совместная работа по созданию безбарьерной среды для слепых и слабовидящих проводится нами в течение двух лет. За этот период с работой «Центра социальной адаптации» и «Библиотеки для слепых и слабовидящих» познакомились 48 врачей-офтальмологов. Обладая такими знаниями, врачи получили возможность грамотно информировать своих пациентов о современных тифлосредствах и оформлять на них заявки через Бюро медико-социальной экспертизы. Выводы. Информационные занятия с врачами офтальмологами и врачами общей практики дают возможность слепым и слабовидящим (в том числе и поздноослепшим) Самары и Самарской области, получая своевременный доступ к необходимым им высокотехнологичным тифлосредствам, не только существенно улучшить качество жизни, но и продолжить образование и избежать социальной депривации. Литература 1. Высокотехнологичные средства реабилитации для незрячих и слабовидящих // Мат-лы I Межрегиональной науч.практ. конф. «Медико-социальная реабилитация инвалидов по зрению». — СПб., 2007. 2. Комплексная реабилитация людей с ограниченными возможностями здоровья в Самарской области. Опыт. Практика. Инновации // Мат-лы областной науч.-практ. конф. — Самара, 2008. 3. Егорова, Т. С. Коррекция слабовидения: средства и методики подбора / Т. С. Егорова. — М., 2007. 45 А. Э. Свирская ИТОГИ ИЗОБРЕТАТЕЛЬСКОЙ ДЕЯТЕЛЬНОСТИ УФИМСКОГО НИИ ГЛАЗНЫХ БОЛЕЗНЕЙ ЗА ПЕРИОД С 2008 ПО 2011 ГОДЫ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа До 1 января 2008 г. правовая охрана результатов интеллектуальной деятельности (РИД) человека регулировалась отдельными законами — действовали Закон об авторском праве, Закон о правовой охране программ для ЭВМ и баз данных, Патентный закон, Закон о товарных знаках. С 1 января 2008 года вступила в силу часть 4 Гражданского кодекса Российской Федерации, целиком посвященная правовой охране РИД. Глава 69 — Общие положения, Глава 70 — Авторское право, Глава 71 — Права, смежные с авторскими, Глава 72 части 4 ГК РФ посвящена патентному праву. Поэтому в литературе четвертую часть ГК РФ часто называют Кодексом об интеллектуальной собственности. Как и прежде, в качестве изобретения охраняется техническое решение в любой области, относящееся к продукту (в частности, устройству, веществу, штамму микроорганизмов, культуре клеток растений или животных, генетической конструкции) или способу (процессу осуществления материальных действий над материальным объектом с помощью материальных средств). Необходимо знать, что из патентной охраны исключены: — способы клонирования человека; — способы модификации генетической целостности клеток зародышевой линии человека; — использование человеческих эмбрионов в промышленных и коммерческих целях; — иные решения, противоречащие общественным интересам, принципам гуманности и морали. Изобретению предоставляется правовая охрана при соответствии его трем критериям патентоспособности: 1. Мировая новизна (т. е. изобретение не должно быть раскрыто в общедоступном источнике информации, включая Интернет, в том числе и авторами изобретения). Существует авторская льгота по новизне: публикация автором сведений об изобретении не порочит новизну изобретения при условии, если заявка на изобретение подана в течение 6 месяцев со дня раскрытия информации. 2. Изобретательский уровень, т. е. изобретение явным образом не следует из уровня техники для 46 среднего специалиста в данной области (неочевидно). Уровень техники включает любые сведения, ставшие общедоступными в мире, до даты приоритета изобретения. 3. Промышленная применимость — изобретение должно быть воспроизводимо и его можно использовать в промышленности, сельском хозяйстве, здравоохранении, других отраслях экономики или в социальной сфере. За период с 2008 г. по настоящее время сотрудниками ГУ «УфНИИ ГБ» АН РБ подано 49 заявок на изобретения и полезные модели, 4 заявки на товарные знаки, 1 заявка на базу данных, получено 2 решения о регистрации товарного знака и 55 патентов РФ. Среди ученых института с высокой изобретательской активностью необходимо выделить Бикбова М. М. (получено 29 патентов), Габдрахманову А. Ф. (получено 9 патентов), Алтынбаева У. Р. (получено 9 патентов), Халимова А. Р. (получено 7 патентов), Зайдуллина И. С. (получено 7 патентов), Бабушкина А. Э. (получено 6 патентов). Можно отметить молодых ученых института: Бикбова Г. М. (получено 5 патентов), Якупова Г. Ф. (получено 4 патента), Усубов Э. Л. (получено 4 патента), Хисматуллин Р. Р. (получено 3 патента), Гитинов Р. К. (получено 3 патента), Кузбеков Ш. Р. (получено 2 патента), Исхакова А. Х. (получены 1 патент и 2 решения о выдаче патента). Важность правовой охраны РИД заключается в следующем: — патент удостоверяет авторство и приоритет разработки; — патентование обеспечивает моральное и материальное поощрение лиц, занимающихся творческой деятельностью; — патентная информация способствует распространению информации об интеллектуальных новшествах, обеспечивая развитие науки и техники; — патентование способствует передаче технологий, главным образом, через лицензирование; — предотвращает безвозмездное использование чужого интеллектуального творения третьими лицами в коммерческих целях. В. В. Соловьёв ИЗБРАННЫЕ БИОЭТИЧЕСКИЕ И ПРАВОВЫЕ АСПЕКТЫ ОФТАЛЬМОХИРУРГИЧЕСКОЙ ПРАКТИКИ ГОУ ВПО «Красноярский государственный медицинский универститет им. проф. Войно-Ясенецкого», г. Красноярск В процессе оказания медицинской помощи врач любой специальности берёт на себя не только профессиональную, но также моральную и юридическую ответственность за качество и последствия своих действий. В тоже время следует, вероятно, исходить из того, что весьма сложные взаимоотношения врача и пациента должны строиться на основе знания и выполнения биоэтических и правовых норм и правил с соблюдением Российского законодательства, отечественных и международных биоэтических деклараций, конвенций, клятв и кодексов [5]. Цель данной публикации — привлечь внимание коллег к некоторым общим и специфическим для офтальмологии аспектам биомедицинской этики и деонтологии, а также правовым вопросам в офтальмохирургической практике. При этом они затрагивают, прежде всего, взаимоотношения больного и всех, кто участвует в офтальмохирургическом вмешательстве: оперирующего врача, анестезиологическую бригаду, средний и младший мед. персонал, обеспечивающий послеоперационный уход. Однако ещё до принятия решения о необходимости проведения операции офтальмохирургу, безусловно, следует всесторонне взвесить все факторы «за» и «против», возможные осложнения, общесоматическую и психологическую готовность больного к операции, вполне естественное беспокойство его и родственников за исход операции и др. Отсутствие психологического взаимопонимания между оперирующим врачом, больным или его родственниками иногда ведёт к конфликтным ситуациям, которые возникают из-за недостаточной биоэтической, деонтологической и правовой подготовки офтальмохирурга. В связи с этим немаловажное значение в офтальмохирургической практике имеют довольно непростые аспекты прав больного и его информированного согласия на хирургическое вмешательство. Информировать пациента о состоянии его здоровья, результатах обследования, диагнозе заболевания, возможных результатах лечения и прогнозе, врачей 47 обязывает статья 31 «Основ законодательства РФ об охране здоровья граждан» [4]. В случае неблагоприятного прогноза заболевания или повреждения глаз, информация должна сообщаться больному или его родственникам в деликатной форме, если больной не запретил сообщать им об этом. Авторитетный специалист в области медицинского права, доктор медицинских наук, профессор Ю. Д. Сергеев указывает, что объём, характер и форма даваемого объяснения зависят от психоэмоционального состояния больного, уровня его интеллекта и тяжести заболевания [6]. Нельзя не упомянуть и о другом аспекте — оказании офтальмохирургической помощи без согласия граждан. Ведь иногда офтальмологу приходится иметь дело с больным, которого необходимо госпитализировать и оперировать, когда он находится бессознательном состоянии (кома, шок различного генезиса) и не может высказывать своё отношение к происходящему. В соответствии со статьёй 32 «Основ законодательства» в таких ситуациях вопрос о необходимости оперативного вмешательства решает консилиум, а при невозможности собрать консилиум — непосредственно лечащий или дежурный врач с последующим уведомлением должностных лиц лечебнопрофилактического учреждения. Такая же тактика считается правомочной в отношении лиц до 15 лет и недееспособных. В последние годы возросло число больных с травмами глаз различного характера, находящихся в состоянии алкогольного или наркотического опьянения. Они нередко нуждаются в неотложном офтальмохирургическом вмешательстве, но не всегда способны адекватно оценить ситуацию и тем более дать информированное согласие на оперативное вмешательство в письменной форме. В «Основах законодательства'' тактика врача в таких ситуациях не обсуждается, и соответствующих установок по этим вопросам нет. Большой хирургический опыт профессора А. Н Орлова, его незаурядная эрудиция в области биомедицинской этики и деонтологии, по- зволяли ему высказывать своё мнение даже по таким сложным вопросам ясно и понятно. „…Я думаю, когда экстренное вмешательство… может спасти жизнь нетрезво мыслящего больного, врачи, игнорируя его несогласие, должны оказать медицинскую помощь в оптимальном объёме и своё коллегиальное решение отразить в истории болезни“» [3]. Когда болезнь или травма глаза представляет реальную угрозу потери зрения или органа, а больной или его родственники, будучи в здравом уме и доходчиво проинформированные врачом о тяжёлых последствиях, тем не менее отказываются от операции, то согласно статье 33 «Основ законодательства» и предлагаемой авторами статьи 36 [2] они имеют право отказаться от медицинского вмешательства или потребовать его прекращения. В такой ситуации всё это оформляется соответствующей записью с соблюдением всех предусмотренным законодательством условий. Кроме того, в офтальмологической практике встречаются случаи, когда во время хирургического вмешательства, выполняемого под общим наркозом с информированного согласия больного, врач обнаруживает, что необходимо произвести более расширенную операцию, чего ранее не предполагалось. Должен ли хирург прекратить операцию, вывести больного из состояния наркоза и спросить у него разрешения на дальнейшее оперативное вмешательство? Здесь можно опять-таки воспользоваться компетентным мнением А. Н. Орлова:… «в указанных интраоперационных ситуациях врачу нужно взять на себя всю полноту ответственности, но с одним условием: решение принимать коллегиально и вносить его в историю болезни». (Цит. по: Орлов А. Н., 2001, с. 87). Следует учитывать также, что большинство офтальмологических операций проводится под местной анестезией или в сочетании с внутривенным обезболиванием при сохраненном сознании пациента [1]. В связи с этим, не только офтальмохирург, но и весь участвующий в операции медперсонал, должны в полной мере осознавать всю тяжесть физического и психологического состояния пациента и сделать всё возможное, чтобы добрым словом и делом помочь ему, вселить уверенность в том, что он доверил себя истинным профессионалам. Весьма сложны и порой трудноразрешимы биомедицинские, деонтологические и правовые вопросы курации офтальмоонкологических больных, нуждающихся в хирургическом лечении. Исходя из деонтологических соображений, предлагать такому больному операцию, обсуждать с ним и его родственниками возможные исходы и последствия операции имеет моральное право только тот офтальмолог, который непосредственно будет оперировать и лечить больного, и который берёт на себя личную ответственность за предстоящее лечение. Если больному предстоит довольно объёмная, радикальная и косметически небезупречная операция энуклеации или экзентерации орбиты, офтальмохирург обязан сообщить ему или его родственникам об этом, как и о возможности в последующем современного косметического глазного протезирования. Вместе с тем, офтальмохирург должен помнить о том, что в соответствии со статьей 61 «Основ законодательства» он несёт нравственную, гражданскую и юридическую ответственность за решение сложных и деликатных задач хранения врачебной тайны. По нашему мнению в любой ситуации, где возникает вопрос о том, говорить больному правду о его заболевании или нет, с позиций биомедицинской этики и права врачу следует вести себя осторожно и продуманно, и поступать в каждом конкретном случае не только в соответствии с законом, но и принципами гуманизма. Таким образом, медико-правовые и биоэтические вопросы офтальмохирургической практики довольно сложны, а решение их нередко представляет определённые трудности. В связи с этим, от врачей-офтальмологов требуется систематическое совершенствование не только их профессиональной, но также этико-деонтологической и правовой подготовки. Литература 1. Беспальчий, А. Н. Пути развития офтальмоанестезиологии / А. Н. Беспальчий, Ю. Ф. Коваленко // Обезболивание в офтальмохирургии: сб. науч. тр. МНИИ «МГ» — М., 1986. — С. 9–14. 2. Музалевская, Л. В. «Кодекс медицинской деонтологии Российского врача» как нормативная основа профессиональной деятельности (проект-предложение к дискуссии) / Л. В. Музалевская, А. В. Воропаев, Ю. С. Исаев // Сибирский медицинский журнал. — Иркутск. — 2005. — № 6. — С. 108–112. 48 3. Орлов, А. Н. Информированное согласие на медицинское вмешательство // Мат-лы краевой науч.-практ. конф. — Красноярск, 2001. — С. 80–87. 4. Основы законодательства РФ об охране здоровья граждан. — М., 1993. 5. Российские и международные биоэтические декларации, конвенции, клятвы, кодексы / под ред. проф. А. Н. Орлова. — Красноярск, 2001. — 134 с. 6. Сергеев, Ю. Д. Профессия врача. Юридические основы / Ю. Д. Сергеев. — Киев, 1988. В. К. Суркова Интеллектуальная собственность уфимского нии глазных болезней ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Термин «модернизация» — от французского слова «moderne», предполагает изменения в соответствии с новейшими современными требованиями и нормами. Модернизация является основой инновационной деятельности — главной особенности современного периода развития всех отраслей науки. Базовым условием инновационного развития является формирование рынка интеллектуальной собственности, обеспечивающего его общий интерес авторов, предприятий и заказчиков. В последнее время в стране намечен курс на создание инновационной продукции, в том числе на разработку медицинских технологий и изделий. Предметом обсуждения последних научно-практических конференций стали вопросы повышения эффективности инновационной деятельности, вовлечение в хозяйственный оборот её результатов, оснащение лечебных учреждений высокотехнологическим оборудованием. Особое значение приобретает формирование рынка цивилизованной интеллектуальной собственности, то есть всего того, что изобретают и производят ученые, исследователи, сотрудники НИИ, университетов, ВУЗов. Нобелевский лауреат Ж. И. Алферов сказал: «Россия — страна гениальных ученых и изобретателей, однако занимает одно из последних мест по объему продаж наукоемкой продукции мировой торговли. У нас нет мотивации превращения системы знаний в новые технологии, товары, услуги». В стране не научились оформлять и продавать результаты своего творческого труда [Алдошин С. М., 2010]. Тем не менее, интеллектуальная собственность в условиях инновационной экономики является основным объектом рынка наряду с традиционными товарами и услугами. 49 В настоящее время уделяется большое внимание развитию технологии наноструктур с заданными оптическими, механическими и другими свойствами. Всё шире применяются нанотехнологии для производства изделий и продуктов с улучшенными свойствами, в т. ч. и в медицине, экологии, фармакологии, промышленности, сельском хозяйстве и т. д. Достоинства нанотехнологий — в улучшении качества и снижении себестоимости продукции по сравнению с традиционным производством. Поскольку наноматериалы проникают в медицину, быт, спорт, пищевую промышленность и т. д., можно ожидать успеха или риска во всех сферах деятельности человека [Онищенко Г. Г., 2010]. Поэтому с самого начала следует проводить оценку безопасности всего цикла рождения нанопродуктов: на экспериментальной стадии, в процессе производства и сфере использования. Большинство охраноспособных результатов интеллектуальной деятельности в нашей стране, полученных при бюджетном финансировании, содержится в отчетах НИР, научно-технической документации, права на которые не оформляются ни через патентование, ни через «ноу-хау» в режиме коммерческой тайны, а, следовательно, не вовлекаются в легальный гражданский оборот [Лопатин В. Н., 2010]. В этих условиях крупнейшие иностранные производители ведут беспрецедентную в международной практике работу по юридическому закреплению за собой исключительных прав на изобретение российских авторов, созданных за счет бюджетных средств. Нередки случаи, когда технологии, на разработку которых ушли годы кропотливого труда российских ученых и специалистов и миллиарды рублей бюджетных средств, скупаются и уходят за рубеж [Осипов В. К., 2009, Черешев В. А., 2010]. Нужно стремится реализовывать не сколько продукт, сколько технологии изготовления, которые можно продавать неограниченное число раз, в то время как товар продал несколько раз — и больше его нет. Патентовать надо то, что коммерчески значимо, а у нас зачастую — это для защиты диссертации или престижа. Этот призыв чаще встречается в научных журналах, выступлениях руководителей РБ и страны в целом. Критерий коммерциализации научных разработок должен быть главным в принятии решения о патентовании прав на их результат. Есть 2 способа закрепления прав в научно-технической сфере: патентование, и закрытое — «ноу-хау». Результативнее всегда последнее. Согласно закона «Об инновационной деятельности в РБ» УфНИИ ГБ работает над инновационными проектами по разработке аппаратов и изделий медицинского назначения. Ежегодно институт получает более 30 патентов на изобретения и решений о выдаче патентов, тем не менее они в основном не содержат критерия коммерциализации, следовательно не создают добавочную стоимость. С 2007 г. руководство института сделало акцент на решение этой проблемы. Специалисты института объединились в области инновационной тематики по актуальной проблеме лечению заболеваний роговицы, основной целью которой является разработка изделий медицинского назначения, технологий хирургии. Была поставлена цель улучшить структуру и биомеханику роговицы, повысить прочность этой важной оптической системы глаза, страдающей при генетическиобусловленных эктатических и эндотелиально-эпителиальных заболеваний глаз. Идет работа над созданием инфраструктурной среды для эффективной реализации проектов, рассчитанных на долгосрочную перспективу ИП. Предварительные фундаментальные и прикладные исследования способствовали разработке метода восстановления структуры роговицы при её заболеваниях и травмах. Научные сотрудники разработали аппарат, лечебное действие которого основано на исправлении биомеханики роговицы. Создана система воздействия ультрафиолетового облучения на роговицу с целью улучшения её морфологической структуры. Разработано офтальмологическое устройство для УФ-кросслинкинга, обеспечивающее укрепление стромальных коллагеновых волокон роговицы за счет комбинированного воздействия ультрафиолетового излучения и фотосенсибилизирующего вещества. 50 В результате коллективной работы сотрудников института в 2008–2009 гг. был создан бизнесинкубатор (технопарк), сконструирован опытный образец устройства «Уфалинк», проведена экспериментальная апробация, получен патент РФ на изобретение, разработаны технические условия на производство, подготовлены технический паспорт и реклама. В 2009 г. аппарат, названный «Уфалинк», рекомендован для УФ–кросслинкинга многих заболеваний роговицы: кератоконуса I-II ст., ятрогенной кератэктазии, краевой дегенерации роговицы, кератоглобуса, буллезной кератопатии I-II стадии. Для выполнения процедуры УФ-кросслинкинга предложено и получено новое офтальмологическое средство — протектор роговицы «Декстралинк». Проведены его исследования на молекулярном уровне. Это первые результаты в институте, полученные с использованием наномолекулярных биотехнологий, когда объектом исследований является клетка (молекула). Разработана поэтапная программа организации производства нового аппарата и Декстралинка. Экспериментальные и серийные модели выпущены благодаря успешному сотрудничеству с производственными организациями РБ. Деловые контакты на платной основе позволили изготавливать аппараты и изделия медицинского назначения, тем не менее, не исключены трудности при взаимодействии с сотрудничающими фирмами. Информационная поддержка разрабатываемого инновационного продукта всегда важна для его реализации. Чем больше фирм будут информированы о разработках, тем может больше появиться желающих участвовать в проекте. Наш опыт показывает, что более экономично и реально заказывать изготовление экспериментальных образцов у небольших компаний и фирм, у которых есть доступное оборудование и материалы. А это важно с тех позиций, что институту не нужно дублировать закупку всего необходимого для выпуска продукции. Новые разработки имеют большой потенциал для практического использования, востребованы многими лечебно-профилактическими учреждениями Республики Башкортостан и Российской Федерации. Отечественные производители аналогичную продукцию не выпускают. Институт активно участвует в международных проектах. Исследования и дискуссии проводятся в тесном сотрудничестве с учеными российских и международных научных и производственных центров. В 2010 году изделия медицинского назначения УфНИИ глазных болезней экспонировались на III Петербургском Международном Инновационном Форуме, XIV международном форуме «Российский промышленник» и III Российском офтальмологическом общенациональном форуме в г. Москве. Получены высокие отзывы специалистов. Таким образом, в Уфимском НИИ глазных болезней рождается первый опыт вхождения в рыночную экономику. Недаром в выступлениях и тезисах президентов России и Республики Башкортостан звучит: «Россия в ближайшие десятилетия должна стать страной, где благополучие и высокое качество жизни обеспечивается не за счет сырьевых источников, а за счет интеллектуальных ресурсов, в результате чего люди должны стать богатыми и успешными». М. А. Фролов, Н. С. Морозова, А. М. Фролов ОЦЕНКА ЭФФЕКТИВНОСТИ ШКОЛЫ БОЛЬНЫХ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМОЙ Российский университет дружбы народов, кафедра глазных болезней, г. Москва Глаукома — вторая в мире причина полной потери зрения, и со временем она выйдет на первые позиции: ожидается, что количество случаев этого заболевания в мире вырастет с 60 млн в 2010 году до 80 млн в 2020 [2]. По данным эпидемиологических исследований, 50 % больных глаукомой не знают о своем заболевании, 50 % с поставленным диагнозом глаукома не получают адекватного лечения, 50 % людей после 40 лет никогда не проверяли внутриглазное давление. От 6 % до 20 % случаев заболевания глаукомой заканчиваются полной слепотой, во многом из-за того, что заметные симптомы заболевания проявляются лишь на поздних стадиях, когда значительная часть зрительных функций безвозвратно утеряна [1, 2, 4]. История создания Школ для пациентов с различными хроническими заболеваниями насчитывает в России около 10 лет. В последние годы активное развитие получило направление обучения пациентов с глаукомой [4]. Школа для пациентов с глаукомой, основателем которой в России является Нестеров А. П., является организационной формой профилактического группового консультирования и рассматривается как медицинская профилактическая услуга, т. е. имеет самостоятельное законченное значение и направлена на профилактику осложнений заболевания, своевременное лечение, оздоровление [1, 4]. Цель — разработка, применение и оценка эффективности проведения образовательной Школы глаукомы у больных с диагнозом: первичная открытоугольная глаукома (ПОУГ). 51 Материал и методы. Исследование проводилось на базе городской клинической больницы № 1 им. Пирогова Н. И. города Москвы при технической поддержке фирмы Alcon, которая является разработчиком и производителем офтальмологических препаратов, хирургических инструментов и средств по уходу за глазами. Кроме этого, компания организует бесплатные семинары для больных глаукомой, которые проводят на добровольной основе врачи-офтальмологи. Цель консультирования — дать соответствующие знания, обучить необходимым навыкам и умениям, сформировать мотивацию к изменениям нездоровых привычек и поддержать стремление пациента к оздоровлению и выполнению рекомендаций и назначений врача [1–4]. В начале и по окончании Школы глаукомы с помощью разработанных для данной патологии анкет — вопросников проводилось тестирование для определения информированности пациентов о глазной патологии и методах лечения глаукомы. Вёлся документированный учёт обращаемости и госпитализации пациентов, прошедших обучение. Школу глаукомы прошли 43 человека — пациенты с ПОУГ различных стадий (основная группа). Проведено 3 образовательных цикла с демонстрацией адаптивного ауди- и визуального материалов. Полученные данные сравнивались с информацией, полученной в стационаре, где у 41 пациента с аналогичным диагнозом подобной Школы в лечебном процессе не проводилось (контрольная группа). Каждое занятие включало информационный материал и активные формы обучения, направленные на разви- тие умений и практических навыков у пациентов: самостоятельному пальпаторному исследованию внутриглазного давления, навыкам закапывания капель, упражнениям для глаз. Обучение проводилось в виде групповых занятий и принципиально отличалось от простых бесед с пациентами на те или иные темы, связанные с глаукомой. Все лекции хронометрированы, имелись чёткие инструкции по ведению занятий. Результаты и обсуждение. Сотрудничество пациента и врача — комплайенс — сompliance (англ.) — определяет течение и прогноз заболевания. Даже при точной диагностике, грамотно назначенном лечении, эффективность лечения будет низкой, если пациент не следует ему. Если при лечении острого состояния ответственность — на враче, то при профилактическом подходе фокус перемещается на пациента. Проведённое сравнительное исследование выявило, что уровень информированности в группе, прошедшей обучение, на 20–25 % выше, а уровень снижения офтальмотонуса на 25–35 % ниже по сравнению с группой контроля. Использование информационной образовательной программы для больных глаукомой с участием лечащего врача — офтальмолога увеличивает коплайентность. Отмечается снижение госпитализаций по данному виду заболевания, что в итоге приводит к экономии средств, затраченных на лечение, и улучшает качество жизни пациентов. Существенно изменились установки пациентов и отношение к здоровью: улучшилась мотивация больных на выполнение профилактических рекомендаций; снизилось число больных, считающих действия медицинского персонала неэффективными; экономический фактор перестал считаться главным препятствием для выполнения рекомендаций врача по оздоровлению. Увеличилось число больных, принимающих инстилляционную гипотензивную терапию регулярно (с 58,5 % до 96,7 %). Вдвое уменьшилось число случаев госпитализации по поводу некомпенсированного офтальмотонуса и втрое — с острым приступом глаукомы. Выводы. Данная Школа проводилась с целью повышения уровня осведомлённости пациентов о глаукоме, о причинах её проявления, развитии и диагностике, лечении и профилактике этого опасного заболевания. В течение 1,5-часовой презентации пациенты получали сведения о различных аспектах лечения глаукомы, необходимых изменениях в поведении и способах первичной и вторичной её профилактики. По завершении презентации слушатели Школы задавали интересующие их вопросы и получали ответы. Из проведённой нами работы следует вывод о необходимости внедрения Школы глаукомы в комплекс реабилитационных мер офтальмологических отделений других стационаров. Школа глаукомы призывает к сотрудничеству пациента и врача! Литература 1. Долгова, И. Г. Комплаенс и «школа пациента»: решение общей задачи / И. Г. Долгова, Т. Н. Малишевская, А. С. Лазарева // Глаукома. — 2009. — № 3. — С. 35–41. 2. Либман, Е. С. Эпидемиологическая характеристика глаукомы / Е. С. Либман // Глаукома. — 2009. — № 1. — С. 2–3. 3. Мушников, Д. Л. Медико-организационные технологии работы с пациентами: классификация, опыт внедрения в негосударственных учреждениях здравоохранения / Д. Л. Мушников, Б. А. Поляков, Н. Н. Куканова, [др.] // Вестник РУДН. — 2009. — № 4. — С. 72–79. 4. Онищенко, А. Л. Об организации работы школы здоровья для больных глаукомой / А. Л. Онищенко, И. Г. Лихачёва, С. Л. Пластинина // Глаукома: теории, тенденции, технологии: мат-лы науч.-практ. конф. — М., 2007. — Т. 8. — № 2. — С. 75–78. 52 Раздел II Патология роговицы и рефракционная хирургия Albert Daxer CORNEAL INTRA-STROMAL IMPLANTATION SURGERY (CISIS) FOR THE TREATMENT OF KERATOCONUS Gutsehen Eye Center Ybbs and Department of Ophthalmology, Medical University Inssbruck, Austria Purpose — to evaluate the long term results of CISIS for the treatment of Keratoconus. Methods. CISIS is characterized by the formation of an intra-corneal pocket of 9 mm in diameter at 300 microns depth using the PocketMaker Micro­ keratome (DIOPTEX GmbH, Austria). After formation of the intra-corneal pocket a flexible continous MyoRing implant (DIOPTEX GmbH, Austria) is inserted into the intra-corneal pocket via a small incission tunnel of about 4 mm width. The nomogram depends exclussively on the average central K-reading. Fifteen eyes of 11 patients with moderate to severe Keratoconus with a mean age of 35 years (range 22 to 60 years) were included into the study. Postoperative Follow-up was 1 year. Results. The mean average central K-reading decreased by 5.75 Diopters (D) from 48.95 D to 43.20 D. The uncorrected visual acuity (UCVA) improved by almost 10 lines from 0.07 to 0.56 after 1 year. The best spectacle corrected visual acuity improved by almost 3 lines from 0.42 to 0.77. Mean sphere reduced from –5.13 D to 0.1 D and mean cylinder from –3.5 D to –1.27 D. No relevant intra — or postoperative complication occured. Side effects include glare and night-vision problems in some patients. Conclusion. Treatment of Keratoconus using the PocketMaker Microkeratome and the MyoRing intracorneal implant is safe and effective. G. Wollensak CORNEAL COLLAGEN CROSSLINKING: NEW HOPE Laser Eye Institute, Halle, Germany Corneal collagen crosslinking treatment (CXL) of progressive keratoconus using the chromophore riboflavin and UVA was introduced by Wollensak et al. in 2003 [1, 2]. Crosslinking is an old and widespread technique. Both chemical and physical crosslinking methods are being used in many areas of modern technology like in hardening filling materials in dentistry, preserving biological tissue specimens in pathology or also in the leather and automobile industry. The success of the corneal crosslinking method is based on the induced increase of corneal biomechanical rigidity by about 300 % and the anterior localization of the effect leaving the endothelium intact. In both animal and human studies, a long-term effect of the treatment has been shown. Studies in rabbits have revealed apoptosis of keratocytes after CXL down to 300 µm stromal depth. These findings were later confirmed by confocal microscopy in patients [3]. In both in vivo and in vitro studies, the cytoto­ xicity threshold for keratocytes was determined to be 0.5 mW/cm². The endothelial cells are more sensitive 54 and have a cytotoxic threshold of 0.36 mW/cm². Therefore, the minimal stromal thickness must be 400 µm to prevent endothelial apoptosis. The post-CXL wound healing process including the stromal repopulation with new keratocytes is completed after 2 — 3 months. As a morphological correlate of the intrafibrillar crosslinking effect, an increase in collagen fiber diameter of the anterior stroma by 12.2 % was found and as a biochemical correlate a collagen polymer band of at least 1000 kDa and multiple proteoglycan polymer bands in sizes from 100–150 kDa were identified on electrophoresis. In hydration experiments, the absence of stromal swelling in the anterior 250 µm due to interfibrillar crosslinks was demonstrated. The hydrothermal shrinkage temperature was increased from 70 °C to 75 °C in the anterior stroma after CXL. The resistance against collagenase digestion was increased from six to fifteeen days. Microbiologically, a significant bactericidal effect was described against various bacteria. Also, the resistance against collagenase digestion was increased from six to fifteen days. The first and main application of CXL is the treatment of progressive keratoconus because in keratoconus the biomechanical stability of the cornea is reduced significantly. Methods. CXL is a photodynamic crosslinking method. In CXL, the absorption of UVA light is potentiated by the photosensitizer riboflavin at its absorption maximum of 370 nm so that 90 % of UVA is absorbed in the corneal stroma. Thereby, the biomechanical effect is maximal and the risk for the endothelium, lens and retina minimal. So-called reactive oxygen species (ROS) are created by the UVA inducing covalent intraand interfibrillar collagen and proteoglycan crosslinks [2; Fig. 1]. A temperature effect is excluded because there is only a minimal temperature rise by 2 °C at the corneal surface. In standard CXL, the epithelium is debrided in the central 8 mm of the cornea after topical anesthesia with proparacaine eye drops. Corneal pachymetry is performed to ensure a stromal thickness of 400 µm. A 0.1 % riboflavin-phosphate solution with 20 % dextran T-500 is applied every three minutes starting 15 minutes before the irradiation. UVA light of 370 nm 55 is applied for thirty minutes with a surface UVA irradiance of 3 mW/cm² using an array of UVA diodes in their focussing distance. After the crosslinking procedure, antibiotic ointment like ofloxacine is applied for 3 to 5 days until epithelial closure. Other postoperative regimens include the application of non-steroidal antiinflammatory drugs (NSAID´s), antibiotic drops and the use of a bandage contact lens. In the transepithelial treatment variant called C3-R, benzalkoniumchloride containing anesthetic drops are applied for 30 minutes before the irradiation loosening the tight junctions of the epithelium. However, using C3-R the biomechanical effect is significantly reduced compared to CXL due to inhomogeneous and reduced diffusion of riboflavin [4]. A continuing problem in CXL treatment are corneas thinner than 400 µm because of the risk for the endothelium. There are three different approaches for such cases: Leaving the epithelium intact in the areas of stromal thinning (pachymetry guided epithelial debridement), swelling the stroma with the help of a hypoosmolar riboflavin solution or using transepithelial C3-R. However, all of these methods result in a weaker overall biomechanical crosslinking-effect. Results. The first study on crosslinking treatment of keratoconus was performed in 2003 by Wollensak [1]. In this 3-year study, 22 patients with progressive keratoconus were treated with riboflavin and UVA. In all treated eyes, the progression of keratoconus was at least stopped («freezing»). In 16 there also was a slight reversal and flattening of the keratoconus by 2 diopters. Best corrected visual acuity improved slightly in 15 eyes. The 6-year-long term follow-up data of this study including 241 treated eyes again demonstrated a decrease of keratectasia by up to 4.34 dpt after 3 years, a slight increase in visual acuity and improved contact lens tolerance [5]. Two eyes had to be crosslinked twice due to continued progression. These patients had steroid treatment for neurodermitis, however. Other treatment failures were reported in pregnant patients. Apart from that, neither progression of keratectasia nor serious complications have been observed in the Dresden study so far. In CXL, the early crosslinking effect stops the progression or keratec­ tasia («freezing») while the reduction of keratectasia and a «push-up» effect on the cone in about 50 % of the patients is caused in the following months by the wound contraction during wound healing («remodeling»). The main indication of CXL is the treatment of progressive keratoconus. CXL for keratoconus is increasingly combined with refractive corrections using PRK or intracorneal ring —insertion. Besides the paradigm keratoconus, CXL treatment is now being evaluated in various other clinical indications like post-LASIK keratectasia [6], pellucid marginal degeneration, bullous keratopathy, ulceration and severe keratitis. However, in infectious keratitis the use of crosslinking is only reasonable in infections restricted to the anterior third of the stroma. In various clinical studies, post-CXL endothelial damage could be excluded using confocal microscopy, lens damage by Scheimpflug-Pentacam exams and retinal damage by optical coherence tomography. Typically, an anterior demarcation area can be seen on anterior optical coherence tompography and increased stromal collagen reflectivity and tissue compaction on confocal microscopy. Apart from a temporary glare for 2 to 3 months post-CXL due to honeycomb edema-induced light scattering in the anterior stroma only rare, single cases with serious side effects have been described many of which are due to the incorrect use of a postoperative bandage contact lens. Reported side effects are peripheral ste­ rile infiltrates with stromal thinning, calcific band keratopathy, severe keratitis due to E. coli, Acanthameba or Streptococcus infection with perforation, reactivation of a herpes infection, diffuse lamellar keratitis in CXL after LASIK and stromal scarring or perforation after CXL in thin corneas. Conclusions. CXL is a safe and efficient procedure to stabilize the cornea. Preoperative pachymetry is mandatory to avoid damage to the endothelium. The use of postoperative NSAID´s and a bandage lens should not be routine after CXL due to the risk of severe infection. Collagen-crosslinking treatment has become the treatment of first choice for progressive keratoconus and post-LASIK ectasia and is entering the mainstream use. CXL can be combined with refractive corrections like intracorneal rings or PRK to further reduce the optical distortions. The usefulness of CXL for other indications like pellucid marginal degeneration, severe keratitis, ulceration, flap stabilization or corneal edema is being assessed in current studies. There is hope that the need for keratoplasty in various corneal diseases can be diminished significantly in the future thanks to corneal collagen crosslinking treatment. References 1. Wollensak, G. Riboflavin/ultraviolet-A-induced collagen crosslinking for the treatment of keratoconus / G. Wollensak, E. Spoerl, T. Seiler // Am. J. Ophthalmol. — 2003. — Vol. 135. — P. 620–627. 2. Wollensak, G. Crosslinking treatment of progressive keratoconus: new hope / G. Wollensak // Curr. Opin. Ophthalmol. — 2006. — Vol. 17. — P. 356–360. 3. Mazzotta, C. Treatment of progressive keratoconus by riboflavin-UVA-induced cross-linking of corneal collagen. Ultrastructural analysis by Heidelberg retinal tomograph II in vivo vconfocal microscopy in humans / C. Mazzotta, A. Balestrazzi, C. Traversi [et al.] // Cornea. — 2007. — Vol. 26. — P. 390–397. 4. Wollensak, G. Biomechanical and histological changes after corneal crosslinking with and without epithelial debridement / G. Wollensak, E. Iomdina // J. Cataract Refract. Surg. — 2009. — Vol. 35. — P. 540–546. 5. Raiskup-Wolf, F. Collagen crosslinking with riboflavin and ultraviolet-A light in keratoconus: Long-term results / F. Raiskup-Wolf, A. Hoyer, E. Spoerl, L. E. Pillunat // J. Cataract Refract. Surg. — 2008. — Vol. 34. — P. 796–801. 6. Vinciguerra, P. Corneal collagen cross-linking for ectasia after excimer laser refractive surgery: 1-year results / P. Vinciguerra, F. Carnesasca, E. Albé, S. Trazza // J. Refract. Surg. — 2009. — Vol. 22. — P. 1–12. 56 С. И. Анисимов; В. Н. Трубилин, К. А. Золоторевский Результаты проведения персонализированного кросслинкинга для лечения кератоэктазий Клиника «Восток-Прозрение», г. Москва, Клиника глазных болезней ФМБА, кафедра офтальмологии, г. Москва В настоящее время наблюдается тенденция роста как первичной заболеваемостью кератоконусом [1], так и числа вторичных эктазий роговицы в отдаленном послеоперационном периоде после проведенных операций по технологии LASIK [2]. Процедура кросслинкинг позволяет добиться стойкой стабилизации дегенеративного процесса в роговице у больных кератоэктазиями [3]. Осложнениями данной операции могут быть рецидивирующие эрозии роговицы, кератиты, которые развиваются в 8,6 % случаев [4]. Мы предлагаем методику персонализированного кросслинкинга, которая позволяет снизить вероятность развития таких осложнений. Цель — разработать методику проведения персонализированного кросслинкинга, внедрить данный вид операции в клиническую практику, дать оценку клиническим результатам после проведения персонализированного кросслинкинга у больных с кератоэктазиями. Материал и методы. Для диагностики кератоэктазий наряду с рутинными методами исследования (рефрактометрия, кератопахиметрия, биомикроскопия с помощью щелевой лампы) выполняли специальные (Ocular Rezistance Analyzator (ORA) (Reichert, США) и кератотопография с помощью оптической системы Orbscan (Baush&Lomb, США). При непосредственном проведении персонализированного кросслинкинга использовали аппарат для фототерапии EVOLUTION (ООО «Трансконтакт», Россия) и Рибофлавин мононуклеотид 1 % (Фармстандарт-УФАВИТА, Россия). Индивидуальные маски печатали на режущем плоттере (GraftRobo, Япония). После проведения всех диагностических методов исследования кератотопограмму обрабатывали с помощью программы Evolution для преобразования ее в кератотензотопограмму. Зоны пониженной прочности размечали и переносили с помощью лазерного принтера на диафрагму-маску. Проводили местную анестезию, удаляли наружный эпителий роговицы и в течение 20 минут проводили закапывания раствора Рибофлавина мононуклеотида с интервалом в 1 минуту. После этого 30 минут роговицу облучали прибором Evolution через диафрагмумаску. Результаты и обсуждение. При сроках наблюдения до 18 месяцев у всех оперированных больных отмечали стабилизацию рефракции. Процесс носил волнообразный характер. В сроки до 3 месяцев после процедуры, как правило, отмечали снижение максимальной остроты зрения на 1–3 строчки. Это было связано с появлением легких опасификаций в зоне воздействия УФ. В дальнейшем у 67 % оперированных больных отмечали повышение остроты зрения на 1–4 строчки, в связи с уменьшением роговичного астигматизма. Кроме того, анализ данных гистерезиса роговицы выявил незначительные колебания показателя, что может свидетельствовать о сохранении эластичности центральной зоны роговицы, которая не подвергалась воздействию УФ в процессе проведения локального кросслинкинга. Выводы. Метод персонализированного кросслинкинга менее инвазивен по сравнению с классическим. После данной операции у больных повышается корригируемая острота зрения. Литература 1. Севостьянов, Е. Н. Кератоконус плюс / Е. Н. Севостьянов, Е. Н. Горскова. — 2006. 2. Binder, P. S. Analysis of ectasia after laser in situ keratomileusis: risk factors / P. S. Binder // J. Cataract Refract. Surg. — 2007. — Vol. 33. — № 9. — P. 1530–1538. 3. Hafezi, F. Corneal Collagen crosslinking with riboflavin and ultraviolet-A to treat induced keratectasia / F. Hafezi // J. Refract. Surg. 2007. — Vol. 33. — № 12. — P. 2035–2040. 4. Raiskup, F. Spӧrl, Е. // Der Ophthalmologe. — 2010. — Vol. 107. — P. 837–842. 57 М. М. Бикбов, М. Ш. Абсалямов, А. А. Бикбулатова ДОПОЛНИТЕЛЬНАЯ ПСЕВДОФАКИЧНАЯ ИОЛ RAYNER SULCOFLEX: НОВЫЕ ВОЗМОЖНОСТИ КОРРЕКЦИИ ОСТАТОЧНОЙ АМЕТРОПИИ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Неточности послеоперационной рефракции могут быть связаны с некорректным обследованием пациента, ошибками медицинского персонала клиники, браком производителя ИОЛ, осложнениями и особенностями самой имплантации [2]. Эти факторы ведут к имплантации в глаз ИОЛ, оптическая сила которой не позволяет достигнуть рефракции цели. Одним из решений проблемы является удаление из глаза неподходящей ИОЛ и замена ее на оптимальную по диоптрийности. Однако удаление первой ИОЛ достаточно травматично для глаза: необходимо расширять тоннельный разрез роговицы либо фрагментировать линзу в передней камере, с чем связан риск повреждения эндотелия роговицы. При большой давности первой операции эксплантация ИОЛ из капсульного мешка может быть проблематичной в связи со сращением переднего и заднего листков капсульного мешка. Эксимерлазерная коррекция остаточной аметропии является альтернативной операцией, для возможности проведения которой необходимо специальное оборудование, а также прозрачная роговица пациента с биометрическими параметрами, позволяющими безопасно выполнить кераторефракционную операцию. Эффективным и точным методом докоррекции остаточной аметропии является имплантация дополнительной псевдофакичной ИОЛ [1]. Для успешного результата корригирующей операции хирургу необходимо знать обо всех особенностях первой операции. Фиксация дополнительной ИОЛ возможна как в капсульном мешке, так и в иридоцилиарной борозде. При внутрикапсульной фиксации обеих линз возможно образование межлинзовой плёнки в отдаленном послеоперационном периоде, в связи с чем рекомендуется имплантация второй линзы в цилиарную борозду [2]. Прогрессивное усовершенствование и разработка новых интраокулярных линз обусловили появление на офтальмологическом рынке дополнительной псевдофакичной 58 ИОЛ Rayner Sulcoflex (Великобритания), предназначенной для коррекции остаточной аметропии [3,4]. Цель исследования — оценить эффективность и безопасность имплантации ИОЛ Rayner Sulcoflex при остаточной аметропии в артифакичном глазу. Материал и методы. Пациентке B., 70 лет, на правом глазу в октябре 2009 года была проведена факоэмульсификация незрелой возрастной катаракты с имплантацией гибкой моноблочной ИОЛ Alcon Acrysof Natural (+25,5 D) из гидрофобного акрила. Операция проходила без осложнений, линзу успешно имплантировали в капсульный мешок, слабости связочного аппарата при дооперационном осмотре и в ходе операции выявлено не было, задняя капсула оставалась интактной. Ранний послеоперационный период протекал практически ареактивно. В связи с ошибкой персонала диоптрийная сила имплантированной линзы не соответствовала необходимой, и в послеоперационном периоде была получена рефракция, соответствующая миопии средней степени. Рефракция парного неоперированного глаза составляла +2,0 D, острота зрения с коррекцией +2,0 D 0,9, пациентка испытывала неудовлетворенность визуальными результатами операции. В то же время на повторную операцию по замене ИОЛ пациентка на тот момент не соглашалась. При выписке из стационара острота зрения оперированного глаза составляла 0,1, с коррекцией — 4,0 D 0,6. Спустя 6 месяцев после операции пациентка изъявила желание осуществить коррекцию остаточной аметропии в связи с продолжающимся ощутимым зрительным дискомфортом и непереносимостью полноценной очковой коррекции. Острота зрения без коррекции была равной 0,1, с коррекцией —3,75 D 0,8. Клиническая рефракция: sph —3,25 D cyl —1,0 ax 157°. Рефракция роговицы: в оптически слабом меридиане 44,25D×173°, в сильном меридиане 45,50D×83°. Длина передне-задней оси глаза составляла 23,10 мм. Толщина роговицы в центре — 426 мкм. Плотность эндотелиальных клеток — 3150 кл. на мм². Биомикроскопически: роговица прозрачная, передняя камера средней глубины (по данным оптической когерентной томографии переднего отрезка глаз истинная глубина передней камеры от эндотелия до передней поверхности ИОЛ — 3,81 мм, угол передней камеры 40°), влага передней камеры прозрачная, ИОЛ в капсульном мешке, располагается центрально. Глазное дно без видимой патологии. Учитывая объективные офтальмологические данные пациентки при выборе оптимальной для нее рефракционной операции, ей была предложена имплантация дополнительной псевдофакичной моноблочной ИОЛ Rayner Sulcoflex из гидрофильного акрила, поскольку «тонкая» роговица не позволяла эффективно устранить остаточную аметропию с помощью эксимерлазерного кератомилёза in situ, а эксплантация ИОЛ для ее замены была связана с высоким риском повреждения капсулы хрусталика и эндотелия роговицы. Расчет оптической силы дополнительной ИОЛ, который проводили на калькуляторе в режиме on line на сайте Rayner, составил — 4,5 D. Операцию проводили под местной субтенноновой анестезией 2 % раствором лидокаина 2,0 мл. С целью уменьшения роговичного астигматизма тоннель длиной 2,5 мм был выполнен в верхнем секторе перпендикулярно оптически сильному меридиану, располагавшемуся на 83° (локализация тоннельного доступа при первой операции была в височном секторе). Зрачок предварительно расширяли инстилляцией 0,5 % раствора цикломеда, для усиления мидриаза в переднюю камеру был введен 0,1 мл 1 % раствор мезатона. Далее передняя камера была заполнена комбинированным вискоэластиком DisCoVisc (Alcon). С помощью одноразового инжектора псевдофакичную ИОЛ легко имплантировали в заднюю камеру. Расправление линзы происходило плавно, гаптические элементы фиксировались в иридоцилиарной борозде. Псевдофакичную ИОЛ ротировали так, чтобы ее гаптические элементы располагались перпендикулярно к гаптическим элементам первой ИОЛ. Вискоэластик вымывали из глаза физиологическим раствором. В конце операции в конъюнктивальную полость инстиллировали тобрадекс. Результаты и обсуждение. Послеоперационный период протекал спокойно. На следующие сут59 ки после операции острота зрения без коррекции составила 1,0. Достигнутый результат полностью удовлетворял пациентку. Данные клинической рефракции при выписке из стационара: sph +0,25 D cyl +0,5 ax 18°. Рефракция роговицы: в оптически слабом меридиане 43,50D×138°, в сильном меридиане 44,50D×48°. Внутриглазное давление 11 мм рт. ст. Биомикроскопически: роговица прозрачная, передняя камера средней глубины, влага передней камеры прозрачная, добавочная и первая линзы расположены центрально, межлинзовое пространство чистое. Гониоскопически угол передней камеры открыт, средней ширины. По данным оптической когерентной томографии расстояние между линзами равно 0,38 мм, истинная глубина передней камеры от эндотелия до передней поверхности добавочной линзы — 3,25 мм, угол передней камеры 36°. Спустя 2 месяца после операции: некорригированная острота зрения 1,0, рефракция эмметропическая, внутриглазное давление 12 мм рт. ст. Глаз спокойный, обе линзы в центре, не контактируют, поверхность линз и межлинзовое пространство чистые. Конструкция, оригинальный дизайн линзы Rayner Sulcoflex (большой диаметр волнообразной гаптики с круглым краем, ее ангуляция) и материал, из которого она изготовлена, обеспечили надежную фиксацию, качественную центрацию, ротационную стабильность линзы в иридоцилиарной борозде и биосовместимость с окружающими тканями, предотвращая воспалительные осложнения и дисперсию пигмента радужки. Большой диаметр оптики снижает риск захвата ее радужкой. Вогнутая задняя поверхность оптики добавочной линзы позволяет уменьшить вероятность контакта между двумя имплантами и, следовательно, минимизировать возможность появления оптических искажений в зоне контакта между ИОЛ, а также межлинзовой пленки, снижающей визуальные результаты. Результаты представленного клинического случая свидетельствуют о совместимости внутри глаза линзы Rayner Sulcoflex с другими моделями ИОЛ, находящимися в капсульном мешке, в частности с мягкими акриловыми линзами из гидрофобного материала. Вывод. В настоящее время катарактальная хирургия нацелена на достижение эмметропии сразу после факоэмульсификации путем улучшения точности расчета афакичной ИОЛ и профилактики индуцированного операционного роговичного астиг- матизма. В тоже время, офтальмологам приходится решать проблему стремящихся улучшить остроту зрения пациентов с остаточной аметропией, оперированных ранее с применением большого роговичного разреза, перенесших удаление катаракты в детстве, а также тех больных с артифакией, которые желают избавиться от ношения очков для чтения. Возможность безопасной имплантации дополнительной псевдофакичной ИОЛ в артифакичном глазу, в том числе при имплантации первой ИОЛ в сроки большой давности, к примеру, в детстве; наличие на офтальмологическом рынке широкого ассортимента псевдофакичных ИОЛ (асферические, торические, мультифокальные) позволяют вывести катарактальную и рефракционную хирургию на новый качественно высокий уровень. Безуслов- но, имплантация дополнительной псевдофакичной ИОЛ имеет свои показания и противопоказания и является альтернативным методом выбора докоррекции, однако значительно расширяет арсенал и возможности офтальмохирургии. Наш первый опыт имплантации ИОЛ Rayner Sulcoflex показал эффективность и безопасность операции. Несложность технического выполнения доступность ИОЛ по цене свидетельствуют о тации, отсутствие необходимостив дорогостоящем оборудованииогоия очков для чтениясор имплантации дополнительной ИОЛ, отсутствие в необходимости дорогостоящего оборудования, доступность ИОЛ по цене будут способствовать широкому применению ИОЛ Rayner Sulcoflex с целью коррекции остаточной аметропии в перспективе. Литература 1. Линник, Л. Ф. Имплантация дополнительной ИОЛ для коррекции остаточной гиперметропии у пациентов с артифакией / Л. Ф. Линник, А. В. Перетрухин, Е. А. Линник, Ашер Салим // Офтальмохирургия. — 1999. — № 4. — С. 24–30. 2. Першин, К. Б. Занимательная факоэмульсификация. Записки катарактального хирурга / К. Б. Першин. — СПб.: Борей Арт, 2007. — 133 с. 3. Amon, M. Enhancement of refractive results after cataract surgery and IOL-implantation with a supplementary IOL implanted in the ciliary sulcus / M. Amon // Oftalmologia. — 2009. — Vol. 53. — № 4. — P. 91–95. 4. Claoue, C. Sulcoflex pseudophakic supplementary IOLs / C. Claoue, M. Amon, N. Korber, R. Daniel, R. Smith // Supplement to J. Cataract Refract. Surg. — 2009. — № 11–12. — P. 2–11. М. М. Бикбов, Г. М. Бикбова, А. Р. Халимов «Декстралинк» — новый протектор роговицы для кросслинкинга ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Как известно, эктазия роговицы один из самых непредсказуемых патологических процессов глаза, сопровождающийся постоянно прогрессирующими дистрофическими нарушениями роговой оболочки, нередко приводящий к перфорациям, помутнению, рубцеванию и, соответственно, значительному снижению остроты зрения. Патогенез заболевания обусловлен дегенеративными изменениями в эпителии, активацией коллагеназных ферментов и апоптоза кератоцитов, приводящими к разрушению связей между фибриллами коллагена роговицы. Новый, малоинвазивный способ лечения дистрофической патологии роговицы, в частности кератоконуса, — коллагеновый кросслинкинг, основанный на облучении роговицы источником диодного ультрафиоле60 тового излучения и одновременном использовании фотосенсибилизатора (рибофлавина). Выполнение данной процедуры способствует замедлению прогрессирования заболевания за счет укрепления биомеханических свойств роговицы, обусловленного фотополимеризацией коллагена. Однако при выполнении УФ-кросслинкинга наблюдается быстрое удаление раствора рибофлавина (в течение нескольких минут) с поверхности роговицы и из конъюнктивальной полости, что требует частых инстилляций препарата. Следует отметить, что специальных офтальмологических растворов для проведения коллагенового кросслинкинга нет. Цель — разработать протектор роговицы для кросслинкинга. Материал и методы. Нами предложен и запатентован протектор роговицы для кросслинкинга «Декстралинк» (регистрационное удостоверение №ФСР 2010/09071), содержащее рибофлавин и дополнительно декстран в изоосмотичном буфере с консервантом. После завершения экспериментального изучения предлагаемого раствора в Уфимском НИИ глазных болезней проводились доклинические исследования на базе испытательной лаборатории АНО «Институт медико-биологических исследований и технологий» (г. Москва). Приемочные технические испытания «Декстралинк» выполнены в Испытательном центре медицинских изделий Профессионального Сертификационного Агентства (г. Москва). В эксперименте облучали роговицу кроликов с использованием устройства для ультрафиолетового облучения роговицы «УФалинк» (регистрационное удостоверение № ФСР 2009/05489). Продолжительность предварительного закапывания раствора «Декстралинк» составила 15 минут. В последующем выполнялось комбинированное облучение роговицы и инстилляции предлагаемого офтальмологического раствора в течение 30 минут (6 интервалов по 5 мин при длине волны 370 нм). Ежедневная биомикроскопия и офтальмоскопия глаз животных в течение 20 дней позволила вести наблюдение роговицы в динамике. В клинические наблюдения были включены 12 больных (8 мужчин и 4 женщины) возрасте от 32 до 44 лет с диагнозом кератоконус II стадии. Паци- енты были сопоставимы по частоте общих и сопутствующих заболеваний. Результаты и обсуждение. Введение полимера в состав предлагаемого раствора существенно повышает его вязкость и обеспечивает требуемый пролонгированный контакт фоточувствительного рибофлавина с роговицей. Кроме этого декстран обладает противоотечными и дезинтоксикационными свойствами. Использование раствора «Декстралинк» позволило в 4–6 раз сократить число инстилляций. Сенсибилизирующего действия образцов данного изделия на белых крысах-самцах не выявлено, дегрануляции тучных клеток и провокационная кожная проба имели отрицательную реакцию. Экспериментальные исследования при многократной инстилляции в конъюнктивальный мешок глаза кролика предлагаемого офтальмологического средства не выявили токсического и раздражающего действия. При определении цитотоксичности in vitro образцов «Декстралинк» установлено, что морфология клеток была аналогичной контролю (интактные животные) — токсического действия не выявлено. Вывод. Разработанный в ГУ «Уфимский НИИ глазных болезней» АН РБ протектор роговицы «Декстралинк» не обладает раздражающим, сенсибилизирующим действием, не токсичен для тканей глаза, достоверно установлена его экспериментальная, клиническая безопасность и эффективность при проведении кросслинкинга. М. М. Бикбов, Е. М. Гарипова, Г. М. Бикбова СТРУКТУРА АБЕРРАЦИЙ У ПАЦИЕНТОВ С КЕРАТОКОНУСОМ ПОСЛЕ КРОССЛИНКИНГА РОГОВИЧНОГО КОЛЛАГЕНА ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Кератоконус — дистрофическое, невоспалительное, чаще двустороннее прогрессирующее заболевание роговицы, характеризующееся выпячиванием ее кпереди, изменением оптических свойств и истончением в зоне верхушки. Характерными для кератоконуса являются: тенденция к росту заболеваемости, широкий возрастной диапазон, двустороннее поражение органа зрения, а также социальная значимость в связи с прогрессирующим характером 61 течения, приводящим пациентов к инвалидизации по зрению в молодом и работоспособном возрасте [1]. Современным методом лечения кератоконуса I–II степени является кросслинкинг роговичного коллагена. Методика перекрестного связывания коллагена при помощи ультрафиолетового облучения и рибофлавина, разработанная T. Seiler, G. Wollensak в 2003 г., успешно применяется с целью биомехани- ческой стабилизации роговицы при прогрессирующей эктазии роговицы у пациентов с начальным кератоконусом [2]. Патологический процесс в роговице при кератоконусе приводит к возникновению нерегулярности ее поверхности, следствием чего является увеличение аберраций, в том числе аберраций высших порядков, значительно снижающих остроту зрения [3]. Цель — изучение структуры аберраций у пациентов с кератоконусом после кросслинкинга роговичного коллагена. Материал и методы. На 14 глазах у 12 пациентов с кератоконусом I–II стадии (по классификации Amsler) были проведены аберрометрические исследования до и через 1, 3, 6, 12 месяцев после кросслинкинга роговичного коллагена. Объективная аберрометрия выполнялась на приборе OPD-scan ARK-10000 фирмы Nidek (Japan). Прибор оснащен версией программного обеспечения для оценки оптических аберраций. Анализировался каждый вид аберраций на основе расчета коэффициентов Цернике. Результаты и обсуждение. В ходе наблюдений данные аберрометрии претерпевали существенные изменения. Динамика этих изменений представлена в таблице. В результате исследований у всех пациентов было установлено снижение коэффициентов всех видов аберраций через 1 месяц после кросслинкинга, в наибольшей степени: Tilt (S1) — на 0,44, High — на 0,40, T. Coma — на 0,24, T. Trefoil — на 0,29. Через 3 месяца отмечалось умеренное увеличение значений аберраций, но данные не достигали дооперационных показателей, за исключением сферической аберрации, составившей 0,32. В целом, после кросслинкинга в течение 1 года у всех пациентов наблюдалось постепенное уменьшение коэффициентов аберрометрии (M ± m, мкм): Tilt (S1) (c 2,61±0,37 до 1,87±0,70), T. Coma (с 0,99±0,12 до 0,66±0,21), T. Trefoil (1,10±0,18 до 0,89±0,24). По данным Балашевича Л. И., увеличение аберраций T. Coma и T. Trefoil являются характерными признаками кератоконуса. После проведения кросслинкинга роговичного коллагена отмечалось уменьшение этих аберраций, что указывало на значительную роль роговицы в их формировании. Аберрации High, T. Sph и HiAstig хоть и претерпели изменения в раннем послеоперационном периоде, но в целом остались стабильными в течение всего периода наблюдения, соответственно составив в среднем 1,60±0,18, 0,27±0,08 и 0,17±0,03, данные изменения свидетельствовали о смешанной этиологии этих аберраций. В то же время, отмечалось повышение показателей аберрометрии T.4Foil c 0,14±0,03 до 0,78±0,53. Суммарные аберрации волнового фронта — Total — уменьшились c 6,62±0,46 до 5,35±0,61. Структура аберраций оптического тракта до и после кросслинкинга роговичного коллагена Тип аберраций Total Tilt(S1) High T. Coma T. Trefoil T.4Foil T. Sph HiAstig Количественная характеристика аберраций оптического тракта глаза (по коэффициенту Цернике) до процедуры через 1 мес. через 3 мес. через 6 мес. через 1 год 6,62 6,02 6,11 5,64 5,35 2,61 2,17 2,44 2,14 1,87 1,60 1,20 1,53 1,20 1,60 0,99 0,75 0,91 0,82 0,66 1,10 0,81 1,04 0,68 0,24 0,14 0,12 0,13 0,15 0,78 0,27 0,23 0,32 0,22 0,26 0,17 0,12 0,17 0,17 0,17 Изучение аберраций человеческого глаза позволяет дать дополнительную оценку оптическому аппарату глаза и эффективности лечения пациентов с кератоконусом. В результате кросслинкинга изменяются биомеханические свойства коллагеновых волокон, которые компенсируют оптические аберрации, обусловленные нерегулярностью роговичной 62 поверхности, что приводит к улучшению зрительных функций. Вывод. Кросслинкинг роговичного коллагена ведет к уменьшению показателей аберраций высшего порядка, и в первую очередь комы и трефойла, являющихся характерными признаками кератоконуса. Литература 1. Севостьянов, Е. Н. Кератоконус плюс / Е. Н. Севостьянов, Е. Н. Горскова. — Челябинск, 2006. — С. 6. 2. Wollensak, G. Riboflavin Ultravoilet-A-induced collagen crosslinking for the treatment of keratoconus / G. Wollensak, E. Spoerl, T. Seiler // Am. J. Ophthalmol. — 2003. — Vol. 135. — № 5. — P. 620–626. 3. Бобровских, Н. В. Оптические аберрации при кератоконусе и изучение возможностей их компенсации: автореферат дис. … канд. мед. наук / Н. В. Бобровских. — М., 2009. — 24 с. 4. Егорова, Г. Б. Аберрации человеческого глаза, способы их изучения и коррекции (обзор литературы) / Г. Б. Егорова, Н. В. Бородина, И. А. Бубнова // Клин. офтальмол. — 2003. — Т. 4 — № 4. — С. 30–32. М. М. Бикбов, А. Х. Исхакова Имплантация интрастромальных роговичных сегментов Keraring в лечении пеллюцидной дегенерации роговицы ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Пеллюцидная краевая дегенерация (краевая дегенерация прозрачной зоны, кератоторус) — подобное кератоконусу, невоспалительное, дегенеративное заболевание роговицы. Характеризуется краевым истончением роговицы в нижнем сегменте и эктазией истонченных участков, которые обычно ограничены периферической зоной роговицы вдоль нижнего лимба. Выявляются зоны истончения в нижней части роговицы от 4 до 8 часового меридиана, в виде серповидной полосы, процесс медленно прогрессирует и поражает оба глаза. Центральная зона роговицы выстоит над областью истончения, в вертикальном меридиане — уплощение с выраженным неправильным астигматизмом. В отличие от кератоконуса отсутствуют кольца Флейшнера и стрии Вогта, но в тяжелых случаях в нижней части роговицы может развиваться отек эпителия [1]. Для точной диагностики пеллюцидной дегенерации на ранней стадии требуется изучение топографии роговицы, при этом виден характерный паттерн в виде «двух целующихся птиц» (kissing birds; butterfly pattern) [2]. Как правило, медикаментозное лечение не эффективно. Очковая коррекция малоэффективна из-за нарастания неправильного астигматизма, применение жестких контактных линз более эффективно. Радикальными методами лечения являются: клиновидная резекция пораженной ткани, сквозная кератопластика, серповидная послойная кератопластика и термокератопластика [3]. В связи с трудностью получения донорского материала актуальным является применение нового метода лечения эктазии роговицы. 63 Цель — оценка эффективности хирургического лечения краевой дегенерации роговицы методом имплантации интрастромальных роговичных сегментов. Материал и методы. В Уфимском НИИ глазных болезней 13 пациентам (15 глаз) с пеллюцидной дегенерацией роговицы в возрасте от 19 до 40 лет, были имплантированы интрастромальные роговичные сегменты Keraring (Mediphacos, Бразилия). Всем пациентам проводились функциональные исследования в следующие сроки: до операции, через 1, 3, 6, 12 месяцев после операции. Помимо стандартного офтальмологического обследования пациентам проводилась конфокальная биомикроскопия (HRT-III Heidelberg Retinal Tomographer «Heidelberg Engineering», Германия), пахиметрия, оптико-когерентная томография (Visante OCT, Carl Zeiss, Германия), кератотопография (Nidek OPD-scan, Япония). Имплантацию сегментов осуществляли пациентам с пеллюцидной дегенерацией роговицы при прозрачной центральной зоне роговицы и непереносимости контактной коррекции. Сферический эквивалент рефракции составил 4,30±0,28 D, преломляющая сила роговицы — 50,26±0,57 D, толщина роговицы в центре — 504,85±10,95 мкм. Противопоказаниями для имплантации явились: рубцы роговицы, повышенное внутриглазное давление, воспалительные заболевания глаз, аутоиммунные и общие воспалительные заболевания. Подбор интрастромальных роговичных сегментов проводился на основании вида эктазии по таблице Mediphacos (2007). Операция проводилась под местной анестезией, по стандартной методике [L. Grupenmacher Brazil, 2007]. В послеоперационном периоде применяли антибактериальные, противовоспалительные препараты и репаративные средства. Результаты и обсуждение. Результатом имплантации интрастромальных роговичных сегментов стало повышение некорригированной остроты зрения с 0,1±0,03 до 0,5±0,15, и корригированной остроты зрения — с 0,3±0,03 до 0,6±0,13 непосредственно после операции. В ходе наблюдения отмечалось постепенное увеличение некорригированной и корригированной остроты зрения, стабилизация наступала в среднем через 6 месяцев, составив от 0,6±0,03 до 0,8±0,05 соответственно, и к 1 году оставалась на достигнутом уровне. Преломляющая сила роговицы снизилась с 55,25±1,24 D до 45,5±1,24 D, сферический эквивалент рефракции — до 3,5±1,2 D на момент последнего обследования (рис. в Приложении). Величина роговичного астигматизма, составившая до операции 6,55±1,4 D, уменьшилась до 3,5±1,2 D через месяц после операции, с постепенным снижением до 2,5±0,5 D к 1 году после имплантации. При анализе результатов пахиметрии выявлено, что толщина роговицы в центре увеличивается с 465,2±31,14 мкм до 475,45±24,32 мкм на момент последнего обследования. На снимке дифференци- альной пахиметрической карты характерно увеличение толщины истонченной парацентральной зоны роговицы на 35±0,5 мкм. Также при проведении оптической когерентной томографии выявлено увеличение угла передней камеры с 31,5±3,5° до 34,65±2,5°, и уменьшение глубины передней камеры — с 3,5±0,5 до 3,1±0,4 мм. При проведении конфокальной биомикроскопии с помощью лазерного сканирующего томографа отмечено, что кератоциты принимали овальную, более вытянутую форму, с четкими контурами, хорошо визуализирующимся ядром, разглаживались складки десцеметовой мембраны между установленными сегментами. Основным достоинством имплантации интрастромальных роговичных сегментов является повышение некорригированной остроты зрения непосредственно после операции. Механизм действия основан на изменении радиуса кривизны передней поверхности роговицы, в результате чего исправляется эктатическая зона роговицы, и улучшаются офтальмометрические показатели. Вывод. Имплантация интрастромальных сегментов является эффективным методом лечения пеллюцидной дегенерации роговицы. Однако, для подтверждения стабильности и предсказуемости результатов требуется дальнейшее наблюдение пациентов. Литература 1. Varley, M. G. Long-term survival of large diameter penetrating keratoplasties for keratoconus and pellucid marginal dege­ neration / M. G. Varley, J. J. Arentsen, P. R. Laibson // Am. J. Ophthalmology. — 1990. — Vol. 110. — № 2. — P. 149–152. 2. Rasheed, K. Surgical treatment of advanced pellucid marginal degeneration / K. Rasheed, Y. S. Rabinowitz // Ophthalmo­ logy. — 2000. — Vol. 107. — № 10. — Р. 1836–1840. 3. Vissr, R. Keratoconus and pellucid marginal degeneration, etiology and clinical presentation of irregular astigmatism / R. Vissr. — 2008. Г. М. Бикбова, В. А. Заболотная ГИСТОМОРФОЛОГИЯ РОГОВИЦЫ В ОТДАЛЕННЫЙ ПЕРИОД ПОСЛЕ КРОССЛИНКИНГА ПО ПОВОДУ КЕРАТОКОНУСА ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Кератоконус — невоспалительная прогресси- время кератоконус становится социально значимой рующая эктазия центральной части роговицы при проблемой, поскольку чаще всего это заболевание нормальном внутриглазном давлении. В настоящее развивается в возрасте 15–30 лет и приводит к ин64 валидизации молодых трудоспособных людей. Решение проблемы лечения кератоконуса особенно актуально для жителей Юга России, где частота встречаемости кератоконуса варьирует от 1:250 до 1:250 000 [2]. Несмотря на большой объем проведенных исследований, этиология кератоконуса остается неразгаданной. Обсуждаются иммунологическая, аллергическая, эндокринная, экологическая теории. Метод роговичного коллагенового кросслинкинга (метод UV-x-linking) представляет собой фотополимеразацию стромальных коллагеновых волокон роговицы, возникающую в результате комбинированного воздействия фотосенсибилизирующего вещества (рибофлавин или витамин В2) и ультрафиолетового излучения [3, 4]. Для успешного решения задач оптической и хирургической коррекции аметропии, сопровождающей кератоконус, большое значение имеет адекватная оценка функционального и морфологического состояния роговой оболочки. Изучение структурных изменений роговицы необходимо также для оценки тяжести патологического процесса, эффективности лечения и определения тактики ведения больного. В связи с этим целесообразность неинвазивных методов исследования, позволяющих оценить степень морфологических изменений в роговице, является неоспоримой. Одним из современных методов исследования роговицы является прижизненная конфокальная микроскопия. Данный метод в силу его большой разрешающей способности позволяет визуализировать живые ткани роговицы на клеточном уровне, измерить толщину каждого из ее слоев, оценить количество, форму, размер клеток эпителия, стромы, заднего эпителия роговицы, степень десквамации эпителиальных клеток при воздействии контактных линз и хирургических вмешательств [1]. Цель — оценка структурных изменений, происходящих в роговице у пациентов, прооперированных методом кросслинкинга роговичного коллагена по поводу кератоконуса, в сроки 1, 3, 6, 12 месяцев и более после процедуры. Материал и методы. Конфокальная микроскопия проведена у 32 пациентов (34 глаз) после кросслинкинга роговичного коллагена при помощи роговичной насадки лазерного сканирующего томографа Heidelberg Retinal Tomographer HRT-III, «Heidelberg Engineering» (Гемания). Период наблюдения составил 3,5±0,12 года после процедуры. 65 Результаты и обсуждение. Эпителизация у всех пациентов наступала в сроки 3,02±0,15 дней. В раннем послеоперационном периоде наблюдались явления эпителиопатии в виде увеличения числа слущивающихся клеток, ядра эпителиоцитов визуализировались ярче, чем окружающая их цитоплазма. Наблюдался полиморфизм клеток базального эпителия в виде клеток различных по величине и контрастности. Через месяц после кросслинкинга явления эпителиопатии исчезали, эпителиальные клетки визуализировались с четкими границами, полиморфизм клеток был менее выражен. В последующие сроки наблюдения данная картина не менялась (рис. 1). Рис. 1. Микроскопическая картина эпителия через 7 дней после кросслинкинга роговичного коллагена (конфокальная микроскопия, ув. х 300; глубина 26 мкм) Визуализируются гиперрефлективные ядра эпителиоцитов. В боуменовой оболочке наблюдалось появление гиперрефлективных зон различной степени выраженности. Прозрачность ее восстанавливалась через месяц после процедуры и оставалась неизмененной на протяжении всего периода наблюдения (рис. 2). В передних слоях стромы в первую неделю после кросслинкинга роговичного коллагена наблюдался апопотоз кератоцитов, который визуализировался в виде «пчелиных сот», свидетельствующий о наличии лакунарного отека вокруг погибающих кератоцитов, обуславливающий явления псевдохейза. Ядра кератоцитов не визуализировались (рис. 3). Рис. 2. Микроскопическая картина боуменовой оболочки через 2 недели после кросслинкинга роговичного коллагена (конфокальная микроскопия, ув. х 300; глубина 39 мкм): а — слабовыраженные зоны гиперрефлективности, b — яркие, высокоотражательные зоны в области боуменовой мембраны Апоптоз кератоцитов наблюдался в пределах 300 мкм. В течение 3–4 месяцев явления лакунарного отека уменьшались, определяясь в виде уменьшения сетчатой структуры. Строма становилась более гомогенной, наблюдалось появление единичных активированных кератоцитов. Одновременно с этим наблюдали появление складчатости, обусловленное, по нашему мнению, так называемым «эффектом стягивания», возникающей в результате кросслинкинга (рис. 4). В ходе наблюдения в сроки до 3 лет складчатость передних слоев стромы сохранялась в зоне воздействия на глубине 300 мкм. Плотность кератоцитов восстанавливалась к 6 месяцам и оставалась неизмененной в течение всего периода наблюдения. Задние слои стромы и эндотелий оставались неизмененными весь период наблюдения. Рис. 3. Микроскопическая картина передней порции стромы в первую неделю после кросслинкинга роговичного коллагена. Апоптоз кератоцитов, определяющийся в виде « пчелиных сот», ядра кератоцитов не визуализируются (конфокальная микроскопия, ув. х 300; глубина 85 мкм) Рис. 4. Микроскопическая картина передней порции стромы через 1 год после UV кросслинкинга (конфокальная микроскопия, ув. х 300; глубина 81 мкм). Складчатость стромы в виде тонких разнонаправленных линий низкой отражательной способности: a, b — единичные активированные кератоциты, восстановление структуры стромы роговицы 66 При изучении эндотелия отмечался полимор- следования, позволяющим выявить изменения рофизм клеток, выраженность которого зависела от говицы на клеточном и микроструктурном уровне, стадии кератоконуса (рис. 5). более полно изучить патогенетические механизмы при различных заболеваниях, в том числе при кератоконусе. Метод дает возможность детального изучения и визуализации всех роговичных структур. Исследование гистоморфологической картины роговицы после кросслинкинга показало, что воздействие ультрафиолета происходит на передние слои стромы роговицы, не затрагивая задние слои стромы и эндотелий. В результате проведенного исследования, конфокальная микроскопия роговицы позволила выявить следующие изменения: после операции наблюдался отек стромы роговицы, который проходил к моменту завершения эпителизаРис. 5. Микроскопическая картина эндотелия ции. Через месяц после процедуры полиморфизм (конфокальная микроскопия, ув. х 300; глубина 424 мкм). эпителиальных клеток был менее выражен, боумеПолиморфизм клеток эндотелия нова мембрана восстанавливала свою прозрачность, восстановление клеточной популяции происходило Выводы. Конфокальная микроскопия является к 6 месяцам и оставалось неизмененным весь перивысокоинформативным неинвазивным методом ис- од наблюдения. Литература 1. Аветисов, С. Э. Конфокальная микроскопия роговицы. Сообщение 2. Морфологические изменения при кератоконусе / С. Э. Аветисов, Г. Б. Егорова, А. А. Федоров, Н. В. Бобровских // Вестн. офтальмол. — 2008. — № 3 — С. 6–10. 2. Cевостьянов, Е. Н. Особенности патогенеза, современная диагностика и консервативное лечение кератоконуса: автореф. дис. … д-ра мед наук / Е. Н. Cевостьянов. — Самара, 2003. — 28 с. 3. Boxer Wachler, B. S. Corneal Collagen Crosslinking With Riboflavin / B. S. Boxer Wachler // J. Cataract Refract. Surg. — 2005. 4. Wollensak, G. Stress strain measurements of human and porcine corneas after riboflavin ultraviolet-A-induced crosslinking / G. Wollensak, E. Spoerl, Th. Seiler // J. Cataract Refract. Surg. — 2003. — Vol. 29. — P. 1780–1785. Г. М. Бикбова, А. Р. Халимов, Н. Э. Баймухаметов КРОССЛИНКИНГ РОГОВИЧНОГО КОЛЛАГЕНА В ЛЕЧЕНИИ КЕРАТОКОНУСА, ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Кератоконус — хроническое, прогрессирующее дистрофическое заболевание роговицы, характеризующееся ее истончением, растяжением, конусовидным выпячиванием, помутнением и рубцеванием, приводящим к снижению остроты зрения вплоть до слепоты. Методика перекрестного связывания коллагена при помощи ультрафиолетового облучения и рибофлавина, разработанная T. Seiler, G. Wollensak в 2003 г., успешно применяется с целью биомеха67 нической стабилизации роговицы при ее прогрессирующей эктазии у пациентов с начальным кератоконусом и ятрогенной кератоэктазией. В основе механизма такого воздействия лежат процессы образования свободных радикалов, участвующих в появлении новых химических связей между макромолекулами коллагена. Использование метода коллагенового кросслинкинга, так же известного, как UV-кросслинкинг, UV-x-linking, обеспечивает перекрестное связывание коллагеновых фибрилл роговицы и способствует предотвращению дальнейшего прогрессирования заболевания. Цель — оценка отдаленных функциональных результатов применения метода кросслинкинга роговичного коллагена в лечении кератоконуса. Материал и методы. Под наблюдением находилось 32 пациента (36 глаз) с кератоконусом II–III ст. по классификации Amsler. Преломляющая сила роговицы до процедуры составила в среднем 52,49±1,15 D, величина роговичного астигматизма — в среднем 4,25±1,58 D, радиус кривизны роговицы — в среднем 6,49±0,11 мм. Процедура проводилась в условиях операционной. Под местной анестезией (раствор лидокаина гидрохлорида 2 %), после деэпителизации роговицы диаметром 7 мм, производились инстилляции 0,1 % раствора рибофлавина с 20 % раствором декстрана в течение 15 минут и облучение роговицы с использованием устройства «УФалинк» в режиме 370 нм на расстоянии 1 см (6 интервалов по 5 минут) с одновременным использованием тех же растворов. В послеоперационном периоде проводилась местная антибактериальная и дегидратационная терапия. Период наблюдения составил в среднем 3,2±0,24 года. Устройство «УФалинк», разработанное в Уфимском НИИ глазных болезней в рамках инновационного проекта «Новые технологии в лечении патологии роговицы» (Патент № 72401 от 20.04.09., рег. удостоверение № ФСР 2009/05489), предназначено для проведения кросслинкинга. Светодиоды аппарата создают высокогомогенное ультрафиолетовое излучение. Рекомендуемые параметры воздействия гарантируют клиническую эффективность и безопасность процедуры. «УФалинк» состоит из 4 основных частей: блок излучателя с двумя диодами ультрафиолетового диапазона, пульта управления, сетевого адаптера и механической подвески. Основные технические характеристики «УФалинк» представлены в таблице. Основные технические характеристики «УФалинк» Длина волны 370–380 нм Потребляемая мощность 5 Вт Электропитание от сети (220±20) В, 50 Гц переменного тока Интенсивность излучения не более 5 мВт/см2 Рабочий диаметр светового пятна 10±2 мм «УФалинк» обеспечивает укрепление коллагеновых волокон в строме роговицы за счет комбинированного воздействия ультрафиолетового излучения и фотосенсибилизирующего вещества. Результаты и обсуждение. После процедуры в первую неделю мы наблюдали снижение некорригированной остроты зрения в среднем с 0,28±0,07 до 0,10±0,05, что было обусловлено псевдохейзом в результате возникновения лакунарного отека вокруг погибающих кератоцитов [Wollensak G., 2010]. Через 3 месяца, по мере восстановления прозрачности роговицы, острота зрения увеличилась до уровня дооперационной, одновременно с этим было отмечено, что пациенты лучше стали переносить жесткие газопроницаемые контактные линзы. К 6 месяцу после операции было отмечено увеличение корригированной остроты зрения с 0,52±0,09 до 0,63±0,05. Преломляющая сила роговицы уменьшилась до 49,41±1,69D, по мере исчезновения псевдохейза данный показатель увеличился до 51,00±0,34D и оставался стабильным в течение года. В дальнейшем (через 3 года) вновь наблюдалось постепенное снижение величины преломляющей силы роговицы, составив разницу до- и послеоперационной кератометрии в 3,5±0,54 D. Вывод. Оценка отдаленных результатов кросслинкинга роговичного коллагена в лечении кератоконуса показала, что метод является эффективным, безопасным, позволяющим остановить прогрессирование заболевания. Литература 1. Wollensak, G. Stress — strain measurements of human and porcine corneas after riboflavin Ultravoilet-A-induced collagen crosslinking / G. Wollensak, E. Spoerl, T. Seiler // J. Cataract. Refract. Surg. — 2003. — Vol. 29. — P. 1780–1785. 2. Caporossi, A. Parasurgical therapy for keratoconus by riboflavin — ultraviolet type A rays induced crosslinking of corneal collagen: Preliminary refractive results in an Italian study / A. Caporossi, S. Baiocchi [et al.] // J. Cataract Refract. Surg. — 2006. — Vol. 32. — № 5. — P. 837–845. 68 А. Р. Габбасов, И. Э. Мулдашева Алгоритм диагностики раннего кератоконуса (Предварительное сообщение) Клиника лазерной хирургии ООО «Еврооптик», г. Уфа По данным разных авторов, частота встречаемости кератоконуса колеблется от 1:2000 до 1:650 [Caporossii A., 2005, Балашевич Л. И., 2002]. Диагностика кератоконуса на 3–4 стадиях не представляет затруднений. Во-первых, на этих стадиях клинические симптомы заболевания выражены в значительной степени, а, во-вторых, пациенты с такими формами кератоконуса составляют контингент клинических учреждений, располагающих кадрами и технологиями для квалифицированной диагностики этого заболевания [Азнабаев Б. М. и др., 2008]. Наш клинический опыт показывает, что трудности в диагностике кератоконуса возникают на ранних стадиях процесса и, в основном связаны с недостаточной оснащенностью офтальмологических кабинетов [Аветисов Э. С., 2001]. В нашей клинике разработан алгоритм обследования пациентов с рефракционными нарушениями, позволяющий диагностировать кератоконус на ранней стадии в зависимости от уровня оснащенности кабинета офтальмолога. Первый уровень оснащенности кабинета оф­ таль­молога — некомпьютеризированный: 1. Сбор анамнеза. При общении с пациентом можно выявить следующие косвенные признаки кератоконуса: — постоянная смена очков и недовольство ими (возможно и при сложном миопическом астигматизме, заболеваниях сетчатки и др.) — появление рефракционных нарушений в 15 лет и позже (иногда возможно при миопии слабой степени, катаракте с миопизацией, травматическом рубце роговицы) — астенопические жалобы и жалобы на периодический дискомфорт в глазах, чувство сухости, инородного тела и т. п. (возможно при синдроме сухого глаза, дисплейном синдроме, спазме аккомодации и др.) При наличии медицинской карты с неоднократными ранее проведенными обследованиями офтальмолога можно выявить достоверный рост астигматизма (колебания астигматической рефракции по данным подбора очков или по данным 69 авторефрактометрии, проведенной не в условиях циклоплегии, не учитываются), рост или значительные колебания (более 1 дптр) показателей кривизны роговицы 2. Аппаратное обследование. При отсутствии компьютеризированных офтальмологических аппаратов можно выявить следующие косвенные признаки кератоконуса: — невозможно подобрать очковую коррекцию, обеспечивающую остроту зрения 1,0 (возможно при амблиопии, заболеваниях преломляющих сред глаза, сетчатки, зрительного нерва и др.) — относительно высокая острота зрения без очковой коррекции при значительных рефракционных нарушениях (возможно при способностях к аккомодации выше среднестатистических показателей, аномально маленьком размере колбочек и палочек в макуле и др.) — диафрагмирование значительно улучшает остроту зрения (специфический тест, являющийся достоверным признаком наличия нерегулярного астигматизма, то есть аберраций высокого порядка) — косые оси астигматизма — при проведении скиаскопии направление движения тени не однонаправленное и возникают сложности при определении оси астигматизма и другие данные обследования нестабильны (требуется специфический опыт у проводящего обследование офтальмолога) — сложности и локальные искажения картины глазного дна при офтальмоскопии — синдром Мансона, то есть выпячивание нижнего века при взгляде вниз — при биомикроскопии в зависимости от стадии развития кератоконуса могут выявляться асферичность и очаговое сужение оптического среза роговицы в зоне верхушки кератоконуса (при щелевидной боковой подаче луча света микроскопа), вертикальные линии напряжения Фогта на уровне десцеметовой мембраны (исчезают при надавливании на глазное яблоко), кольцо Флейшнера (отложения депозитов железа в эпителии роговицы, которые желто-коричневой полосой как бы частично обрамляют верхушку кератоконуса). 3. Алгоритм поведения офтальмолога. Врач обязан отправить пациента на дополнительное обследование в специализированное офтальмологическое учреждение в случае выявления достоверного роста астигматизма и показателей кератометрии, невозможности подобрать очковую коррекцию, обеспечивающую остроту зрения от 0,8 и выше (при исключении амблиопии и заболеваний преломляющих сред глаза и макулы), выявления скиаскопических и биомикроскопических признаков кератоконуса. Второй уровень оснащенности кабинета офтальмолога — компьютеризированный. В дополнение к выше приведенным признакам кератоконуса проводятся следующие действия. 1. Аппаратное обследование. При проведении обследования на компьютеризированной аппаратуре можно выявить следующие косвенные признаки кератоконуса: — при авторефрактокератометрии существенная разница сферических и астигматических показателей между правым и левым глазом, наличие преломляющей силы роговицы выше 46 дптр, уменьшение кривизны роговицы менее 7,3 и косые оси астигматизма — при ультразвуковой биометрии примерно одинаковые размеры передне-заднего отрезка глазного яблока обоих глаз при существенной разнице рефракционных данных — при проведении пахиметрии наличие парацентрального измерения толщины роговицы, меньшего или равного по размеру измерению, проведенному в оптическом центре роговицы. 2. Алгоритм поведения офтальмолога. При выявлении хотя бы одного из трех перечисленных косвенных признаков кератоконуса врач обязан отложить любой вид оперативного лечения (если он планировался) и направить пациента на дополнительное обследование — кератотопографию. Третий уровень оснащенности кабинета офтальмолога — наличие кератотопографа. Единственный прямой (абсолютный) признак кератоконуса — данные кератотопографии. Кератотопография позволяет создать рефракционную карту роговицы на базе нескольких тысяч точечных измерений преломляющей силы её различных участков. На такой карте участки роговицы 70 с более слабой преломляющей силой обозначены синим или зеленым цветом, а с более сильной рефракцией — желтым и красным. Существуют различные автоматические программы для обработки данных кератотопографии, позволяющие с очень высокой вероятностью выводить индексы, диагностирующие раннюю стадию кератоконуса. Однако при некоторых субклинических стадиях кератоконуса (по сути, подозрении на кератоконус), особенно перед проведением корнеорефракционных операций или операций с роговичным доступом, не стоит доверять постановку диагноза программному обеспечению, иногда способному к гиподиагностике. Диагностировать «подозрение на кератоконус» можно по рефракционной карте. При наличии астигматизма в центре карты есть участок повышенной преломляющей силы в виде «бабочки» или «восьмерки». Подозревать субклиническую стадию кератоконуса стоит, когда одно из «крыльев бабочки» по площади и рефракции существенно больше другого. Такой пациент для постановки окончательного диагноза нуждается в динамическом наблюдении. Подобная «гипердиагностика» позволит исключить развитие после впоследствии проведенной корнеорефракционной операции ятрогенного кератоконуса. Однако данные кератотопографии должны являться подтверждением или опровержением результатов ранее проведенных офтальмологических обследований, перечисленных выше. На сегодняшний день невозможно представить проведение кератотопографии всем пациентам, пришедшим на прием к офтальмологу, то есть в режиме скринингдиагностики. Именно поэтому так важно при проведении офтальмологического обследования обращать внимание на возможные косвенные признаки кератоконуса. Выводы. Ранняя диагностика кератоконуса дает возможность достаточно эффективно проводить такие виды лечения, как ношение жестких контактных линз и кросслинкинг, что в свою очередь позволяет поддерживать у пациента высокую остроту зрения, предотвратить дальнейшее прогрессирование кератоконуса и отсрочить послойную или сквозную кератопластику. Эффективность предложенного алгоритма диагностики раннего кератоконуса и результаты его практического применения требуют дальнейшего изучения. Р. М. Гимранов ЭКСИМЕРЛАЗЕРНАЯ КОРРЕКЦИЯ АНОМАЛИЙ РЕФРАКЦИИ Клиника лазерной хирургии ООО «Еврооптик», г. Уфа Техника лазерного кератомилёза (Lasik), появившаяся в 1990 г., в течение последних лет непрерывно совершенствуется и занимает все более значительное место в современной рефракционной хирургии. После операции Lasik эпителий роговицы сохраняется, ранний послеоперационный период отличается минимальными субъективными расстройствами, отсутствием болевого синдрома, характерного для других рефракционных операций. Превосходит Lasik другие рефракционные операции и по такому важному показателю, как регрессия полученного рефракционного эффекта с течением времени и точной прогнозируемостью послеоперационных результатов, как при миопии, так и сложном миопическом астигматизме различных степеней. В руках опытных и квалифицированных офтальмохирургов методика Lasik, несмотря на техническую сложность операции, не сопровождается большим числом операционных осложнений. Наиболее часто они имеют место на этапе выкраивания лоскута роговицы (ламеллярный кератомилёз), который является основой методики. В нашей клинике лазерной хирургии глаза «Еврооптик» используется микрокератом ZYOPTIX XP (BAUSCH & LOMB) позволяющий проводить формирование клапана роговицы, толщиной в диапазоне 120–140 микрон. По данным A. Ebbie Soroudi (2010), вышеназванная модель микрокератома, относится к самой передовой технологии, сравниваемой по результатам выкраивания роговичного лоскута с фемтосекундным лазером, а в некоторых позициях даже превосходя его. Аналогичные данные подтверждают работы отечественных авторов Г. Ф. Качалина с соавт. (2008). По их мнению, изменения фиброцеллюлярной структуры роговицы достоверно меньше, при формировании лоскута микрокератомом Zyoptix, чем при использовании микрокератома Moria. Под нашим наблюдением находились 1925 пациентов, которым были проведены 3600 операций по методике Lasik с различными степенями миопии и сложного миопического астигматизма. Миопия слабой степени была диагностирована у 866 (45 %) пациентов, миопия средней степени — у 501 (26 %) и миопия высокой степени наблюдалась у 558 пациентов (29 %). Коррекция миопии и миопического астиг71 матизма проводилась с помощью эксимерного лазера ЕС-5000 фирмы NIDEK со щелевидной подачей луча, величиной энергии 120–140 мкДж/см и с частотой 30– 40 Гц, оптическая зона —6,0 мм, переходная зона — 7,5 мм. Из осложнений на этапе выкраивания роговичного лоскута нами наблюдались следующие: неполный срез роговицы, полный срез роговицы, потеря вакуума. В случаях неполного среза роговицы и потери вакуума, однозначно этим пациентам проводилась реоперация в сроки через 1–2 месяца с использованием насадки микрокератома глубиной 140 микрон. Тактика ведения пациентов с полным срезом роговицы (соответственно лазерная абляция им проводилась) отличалась тем, что после операции они находились в течении 1 часа в положении, лежа на спине. Рекомендованное ранее использование МКЛ в качестве бандажа считаем нецелесообразным, так как при последующем снятии контактной линзы, как правило, происходит смещение роговичного лоскута, что требует дополнительной его укладки и разглаживания. У всех оперированных пациентов были получены достаточно высокие функциональные результаты, в то же время ряду пациентов проводилась реоперация по докоррекции зрения с поднятием лоскута роговицы (от 5 % до 7 %). Поднятие лоскута роговицы и последующую процедуру докоррекции зрения мы проводили в сроки от нескольких месяцев до 5–6 лет со времени проведения первой лазерной коррекции глаза. По всей видимости, случаи докоррекции были связаны с длительным пользованием контактными линзами (от 8 до 15 лет) и последующей повышенной регенеративной способностью роговицы в послеоперационном периоде. Выводы. Коррекция различных степеней миопии и миопического астигматизма по методике Lasik c использованием микрокератома Zyoptix XP является одним из надежных и безопасных на сегодняшний день, минимизирует осложнения на этапе формирования роговичного лоскута. Использование МКЛ в случаях полученного полного среза роговицы считаем неактуальным и нецелесообразным, так как при снятии контактной линзы происходит полное смещение лоскута роговицы. Эффективно лоскут расправить и разгладить без какой либо дальнейшей фиксации его. В. В. Жаров, П. А. Перевозчиков, М. П. Григорьева, Н. Н. Самарцева, А. Н. Лялин ТРАНСПЛАНТАТ — НОСИТЕЛЬ НАНОЧАСТИЦ ДЛЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ПРОГРЕССИРУЮЩЕЙ МИОПИИ ГУЗ «РОКБ МЗ УР», г. Ижевск В настоящее время насчитывают несколько десятков видов имплантатов, применяемых в хирургическом лечении миопии, но проблема выбора оптимального трансплантата остается не решенной. В основе общепринятых склеропластических операций при лечении прогрессирующей близорукости в офтальмологии лежит принцип экстрасклерального укрепления склеры — создание дополнительной соединительно-тканной оболочки на ее поверхности. С этой целью используются макроскопические трансплантаты из биологических материалов (твердая мозговая оболочка, склера, аорта, перикард, широкая фасция бедра и т. д.), имплантируемые через большие разрезы слизистой оболочки. В итоге на поверхности склеры происходит замещение трансплантата клетками реципиента с формированием соединительно-тканной капсулы. Кроме того, существует методика имплантации биологических материалов в виде крупноизмельченной дисперсной взвеси, вводимой на поверхность склеры с помощью шприца через прокол слизистой. При взаимодействии крупноизмельченных частиц биологического материала с тканями реципиента также происходит формирование новообразованной соединительной ткани только на поверхности склеры. Также в виде трансплантатов широко используются брефоткани человека (плацента, пуповина, амнион). Их преимущество заключается в том, что они обладают низкими антигенными свойствами, высокой пластичностью и биологической совместимостью. В процессе своего рассасывания они образуют депо биологически активных веществ, ускоряющих регенерацию тканей реципиента и стимулирующих процессы васкуляризации. В обычной медицинской практике брефоткани используют в виде макроскопических трансплантатов или крупнодисперсного порошка [3]. При этом взаимодействие трансплантата с тканями реципиента происходит в основном в зоне их контакта, что, естественно, ограничивает область регенерации поврежденных тканей только границей контакта, тогда как в абсолютном большинстве случаев требуется не поверхностная, а глубокая (интраму72 ральная) регенерация тканей, которая может лежать в основе принципа комбинированного укрепления склеры (как в самой склере, так и на ее поверхности). Создание высокодисперсных трансплантатов из биологических материалов, способных глубоко проникать в ткани реципиента, вызывая в них репарацию и ангиогенез, способствуя тем самым восстановлению их трофики и функции, является актуальной задачей в лечении прогрессирующей близорукости. Цель — морфологическое изучение динамики репаративных процессов в зоне имплантации трансплантата — носителя наночастиц плаценты. Задачи: 1. Разработать и создать трансплантат-носитель наночастиц плаценты; 2. Провести в эксперименте на кроликах имплантацию трансплантата — носителя наночастиц плаценты в субтеноново пространство; 3. Морфологически изучить структуры глаза в области имплантации и оценить степень проникновения наноструктурированной плаценты в окружающие ткани реципиента. Материал и методы. Исследования выполнены на кроликах породы Шиншилла обоего пола в возрасте от 1 года до 2 лет массой тела от 3 кг до 3,5 кг. Забор плаценты и пуповины производился в родильных домах не позднее 12 часов после родов. Консервацию осуществляли в отделении заготовки тканей РОКБ по методике «Биопласт» [2]. В качестве наполнителя использовалась взвесь плаценты человека, измельченная до размеров наночастиц (60–140 нм) [1]. Качественный элементный и количественный анализ на возможное привнесение примесей в образцы плаценты при механоактивации проводился методом атомной эмиссионной спектроскопии с индуктивно связанной плазмой на приборе Spectroflame Modula фирмы Spectro Analytical Ynstrumens (Германия). Содержание Si в образцах как до, так и после механической активации не превышает 0,005 мас. %, остальных элементов — 0,0002 мас. %. Морфология частиц исследовалась методом атомной силовой микроскопии с использованием сканирующего зондового микроскопа Solver Pro (NT- мтд), Россия. Агломераты имеют хорошо просматриваемую зеренную структуру с размерами зерен от 60 до 140 нм [4]. В день операции производили приготовление трансплантата, представляющего собой пуповинный амнион с наночастицами плаценты. Техника операции следующая: в верхненаружном квадранте глазного яблока производили разрез конъюнктивы на расстоянии 7 мм от лимба и концентрично ему длиной 5–7 мм. В теноновом пространстве между верхней и наружной прямыми мышцами формировали туннель к заднему полюсу глаза. Трансплантат вводили в сформированный туннель. На рану конъюнктивы накладывался непрерывный обвивной шов. Материал для морфологического исследования забирался через 7 дней, 14 дней, 1 месяц и 3 месяца после операции. Энуклеированные глаза фиксировали в 10 % нейтральном формалине, заливали в парафин. Депарафинированные срезы окрашивали гематоксилин–эозином и по Ван-Гизону. Результаты и обсуждение. В ходе проведенных экспериментальных исследований отмечено, что послеоперационный период у кроликов протекал без видимых осложнений, не наблюдалось явной картины отторжения и вторичной инфекции. На 7-е сутки отмечено, что трансплантат окружен инфильтратом, основу которого составляют клетки лимфоидного ряда и эозинофилы. По периферии инфильтрата, в склере, эписклере и слизистой оболочке регистрировалось расширение кровеносных сосудов. Наноплацента в виде агломератов красновато-синеватого цвета отслеживается в толще трансплатата, окружающем инфильтрате, на поверхности склеры, внутри клеток-макрофагов. На 14-е сутки после трансплантации в месте имплантации наблюдается формирование соедини- тельной ткани. Инфильтрат вокруг трансплантата становится более компактным, в нем помимо клеток лимфоидного ряда, появляются фибробласты. Агломераты наноплаценты видны как в межклеточном пространстве трансплантата, инфильтрата, проникают на ⅓ толщины склеры; кроме того, определяются в клетках-макрофагах. Через 1 месяц после трансплантации место трансплантата представляет собой скопление эпителиоидных клеток, лимфоцитов, эозинофилов, пролиферирующих фибробластов. Поверхность склеры в зоне имплантации покрыта новообразованной соединительной тканью, содержащей множество клеток, заполненных агломератами наноплаценты. Единичные агломераты наноплаценты видны в средних слоях склеры (до ½ толщины склеры). В зоне трансплантации большое количество расширенных новообразованных сосудов. Через 3 месяца после имплантации на месте трансплантата определяются аморфные массы, окруженные эпителиоидными и гигантскими клетками, волокнами новообразованной соединительной ткани. На поверхности склеры наблюдаются новообразованные соединительнотканные волокна, большое количество активных фибробластов. Выводы. Изучив морфологические изменения в зоне имплантации, можно выделить значительные биологические эффекты, не только на границе склера — трансплантат, но и практически во всей толще склеры в проекции имплантации трансплантата — носителя наночастиц плаценты человека. При этом происходит укрепление как склеры реципиента в области не менее ½ ее толщины, так и формирование плотной соединительной ткани в зоне имплантации на поверхности склеры. Результаты исследования указывают на перспективность исследований, направленных на применение наноструктурированной плаценты человека в офтальмологии для хирургического лечения прогрессирующей близорукости. Литература 1. Андрюшкова, О. В. Механохимия создания новых материалов: учеб. пособие / О. В. Андрюшкова, В. А. Полубояров, И. А. Паули, З. А. Коротаева. — Новосибирск: Изд-во НГТУ, 2007. — 385 с. 2. Жаров, В. В. Отделение заготовки, консервации и производства пластических материалов «Биопласт» / В. В. Жаров, Е. Р. Точилова, Н. Н. Самарцева, А. Н. Лялин // Ижевские родники — 2008. Российская научно-практическая конференция офтальмологов с международным участием: сб. научных статей. — Ижевск, 2008. — С. 255–257. 3. Муслимов, С. А. Морфологические аспекты регенеративной хирургии / С. А. Муслимов. — Уфа: Башкортостан, 2000. — 168 с. 4. Способ приготовления биофункционального трансплантата в виде наночастиц: Патент на изобретение № 2367448 от 09.01.2008. 73 А. В. Золоторевский, Н. Ф. Пашинова, К. Б. Першин, К. А. Золоторевский, Erkin Abdullayev Клиническое применение консервированной трупной роговицы с использованием среды «Eusol-C» ООО «ИМРОГ», г. Москва International Sight Restoration Inc., Tampa, USA Разработка и клиническое внедрение новых, совершенных методов консервации роговицы для последующего применения в процессе проведения кератопластики, имеет важное научно-клиническое значение. Это связано с расширением показаний для выполнения различных видов кератопластики, улучшением клинического результата этих операций. Цель — провести клиническую оценку результатов проведения сквозной кератопластики больным кератоконусом с применением донорского материала, консервированного в среде «Eusol-C», а также надежность и эффективность работы предприятия ИМРОГ по производству зарегистрированного медицинского изделия «Трансплантат роговичный». Материал и методы. Операция сквозной кератопластики была выполнена на 15 глазах больных с кератоконусом III–IV ст. В качестве донорского материала применяли зарегистрированное медицинское изделие «Трансплантат роговичный» (регистрационное свидетельство ФСР 2009/04469 от 04.03.09). Технология производства изделия по ТУ9393-001-484656592006. 10 изделий были производства ООО ИМРОГ (Москва) и 5 — производства компании International Sight Restoration (Tampa, USA). В качестве материала для производства изделия применяли трупные глаза, энуклеированные у доноров в течение 20 часов после смерти. Возраст доноров от 47 до 69 лет. Операцию сквозной кератопластики проводили по общепринятой технологии (регистрационное свидетельство 2008/089 от 25.05.2008). Срок консервации составлял от 3 до 12 дней. В качестве консерванта использовали лабораторную среду «Eusol-C» производства фирмы Al. CHI. MI. A. (Италия). Максимальный срок наблюдения за больными составил 9 месяцев. Наряду с рутинными методами обследования до проведения кератопластики все трансплантаты исследовали с помощью эндотелиального микроскопа (EB-3000 XYZHAILab. Inc США). Оценивали количество клеток заднего эпителия, их форму, наличие включений. Результаты и обсуждение. Результаты исследований представлены в таблице. 74 Результаты эндотелиальных исследований медицинского изделия «Трансплантат роговичный» Время от констатации смерти до консервации/ ПЭК и возраст донора До 10 часов От 11 до 15 часов От 16 до 20 часов 47–60 лет 61–69 лет 3420±125 3340±98 3250±108 3159±112 3287±105 3176±136 Анализ данных эндотелиальной микроскопии свидетельствовал, что эндотелиальная плотность консервированных роговиц оставалась неизмененной в течение всего периода наблюдения за изделием в течение 14 дней после консервации, также не изменялась форма клеток и их внутренняя структура. Кроме того, нами не было выявлено статистически достоверной разницы плотности эндотелиальных клеток трансплантатов от доноров 47–60 лет и 61–69 лет. Все операции сквозной кератопластики были выполнены без осложнений. Осложнения также не были выявлены в ближайшем и отдаленном послеоперационном периодах. Во всех случаях было достигнуто прозрачное приживление консервированной ткани в глазу реципиента. Выводы. Представленные данные свидетельствуют, что использование медицинского изделия «Трансплантат роговичный» позволяет достичь высоких функциональных результатов у больных осложненным кератоконусом после проведенной сквозной кератопластики. Лабораторная среда «Eusol-C» позволяет надежно и эффективно консервировать донорскую роговицу, сохранять ее витальные функциональные характеристики. Технология производства медицинского изделия «Трансплантат роговичный» (ИМРОГ, Москва, Россия) позволяет изготовлять консервированный материал, который обеспечивает прозрачное приживление ткани при проведении сквозной кератопластики. Более полная информация на сайте www.imrog.ru. В. Н. Канюков, Ю. В. Канюкова, Д. А. Илюхин Первые результаты лечения буллезной кератопатии методом кросслинкинга коллагена роговицы Оренбургский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова Росмедтехнологии», г. Оренбург Буллезная болящая кератопатия — это дистрофия роговицы, развивающаяся в результате потери клеток эндотелия — внутреннего слоя клеток роговицы, выполняющего барьерную функцию. Снижение количества эндотелиальных клеток приводит к проникновению жидкости передней камеры глаза в роговицу, пропитыванию ее слоев и нарушению водно-солевого обмена. В результате возникает отек, помутнение роговицы, что проявляется снижением остроты зрения, а также в эпителии образуются пузыри — «буллы», которые, разрываясь, образуют эрозивную поверхность, что вызывает сильные острые боли, слезотечение и светобоязнь. Медикаментозное лечение буллезной кератопатии малоэффективно и сводится к назначению симптоматических препаратов. В настоящее время предложен новый способ [3, 4] лечения эндотелиально-эпителиальной дистрофии (ЭЭД) роговицы — коллагеновый кросслинкинг, основанный на комбинированном применении высокогомогенного ультрафиолетового излучения и фоточувствительной субстанции и способствующий укреплению коллагеновых фибрилл и повышению биомеханической стабильности роговицы. В основе метода лежит увеличение числа интери интрафибриллярных ковалентных связей, возникающих в результате воздействия ультрафиолетового облучения на рибофлавин, с высвобождением свободных радикалов, которые и индуцируют образование перекрестных связей между молекулами коллагена [1, 2]. Цель — определение терапевтического эффекта кросслинкинга коллагена роговицы в лечении болящей формы буллезной кератопатии. Материал и методы. В Оренбургском филиале МНТК «Микрохирургия глаза» под наблюдением находилось 5 пациентов с болевой формой вторичной дистрофии роговицы, которым в остром периоде был проведен кросслинкинг коллагена роговицы. Показанием к назначению процедуры УФоблучения с рибофлавином был выраженный рого75 вичный синдром, проявляющийся сильными болями в глазу, светобоязнью, слезотечением и чувством инородного тела. Противопоказанием к проведению кросслинкинга явилось наличие у больных системных коллагенозов, герпетического кератита в анамнезе, толщины роговицы менее 440 мкм, аллергических реакций на рибофлавин, а также невозможность находиться длительное время в положении лежа на спине. Всем пациентам в до- и послеоперационный период проводились функциональные исследования. Помимо стандартного офтальмологического обследования проводилась пахиметрия и по возможности кератотопография. За сутки до операции назначались противовоспалительные и антибактериальные капли 5 раз в день. При проведении операции кросслинкинга больного укладывали на операционный стол, проводили обработку конъюнктивальной полости и кожи лица по принятой технологии. Местная анестезия осуществлялась инстилляциями 0,4 % раствора инокаина. После установки блефаростата круглый отметчик диаметром 6–7 мм устанавливали на переднюю поверхность роговицы. После этого передний эпителий роговицы легко удалялся скребцом или шпателем. В случаях васкуляризации роговицы эпителий удалялся, не доходя 1 мм до концевых отделов артериоло-венуляных петель. Тщательное и полное удаление эпителия необходимо для того, чтобы рибофлавин легче пенетрировал в низлежащие слои роговицы, что необходимо для защиты заднего эпителия роговицы, хрусталика и сетчатки от повреждающего действия ультрафиолета. Проводилась пахиметрия в центре и «тонком месте» роговицы. После этого пациентам закапывали капли раствора, содержащего 20 % декстран и 0,1 % рибофлавин, в течение 30 минут каждые 3–5 минут. Проводилась повторная пахиметрия с перерасчетом данных для «тонких мест». В случаях полного пропитывания стромы роговицы раствором рибофлавина и в контрольных точках более 400 мкм по данным пахи- метрии переходили к следующему этапу операции. На аппарате UV-X (IROC AG, Швейцария) проводилось воздействие на роговицу с помощью ультрафиолетового облучения (365 nm, Е = 3,0 mW/cm2) в течение 30 минут. Во время UV-облучения продолжали инстилляцию раствора рибофлавин + декстран. После автоматического отключения прибора роговицу промывали физиологическим раствором, в конъюнктивальную полость закапывали антибактериальные капли, накладывали бандажную мягкую контактную линзу. В послеоперационном периоде местно назначали антибактериальную, противовоспалительную и репаративную терапию. На 3–5 день после полной эпителизации роговицы снимали контактную линзу. Контрольные осмотры проводили на 1-е, 7-е, 14-е сутки после операции, через 1, 3, 6, 12 месяцев. Результаты и обсуждение. В результате проведенных хирургических вмешательств у всех пациентов была сохранена целостность роговой оболочки, купирован воспалительный и болевой синдром. Процесс эпителизации роговицы завершался в среднем через 3,2±1,4 дней. При биомикроскопии после снятия линзы эпителий сохранялся ровным, без дефектов и пузырьков. По данным пахиметрии уже через 1 месяц имеется тенденция к снижению отека и, следовательно, к уменьшению толщины роговицы в пределах 47–73 мкм. К концу первой недели после кросслинкинга отмечено повышение остроты зрения с 0,01 до 0,06. В одном случае отмечен регресс васкуляризации роговицы в виде запустевания сосудов и повышения прозрачности периферических отделов роговицы. Выводы. Кросслинкинг коллагена роговицы в сочетании с рибофлавином является альтернативным и эффективным методом лечения болящей формы буллезной кератопатии, заключающийся в снижении отека роговицы, в ряде случаев увеличении остроты зрения и купировании болевого синдрома. Однако для подтверждения стабильности и предсказуемости результатов требуется дальнейшее наблюдение пациентов. Литература 1. Медведев, И. Б. Лечение кератоконуса методом кросслинкинга / И. Б. Медведев, Н. И. Медведева, С. Н. Багров. — М.: Известия, 2010. — 107 с. 2. Бикбов, М. М. Терапевтический потенциал кросслинкинга в лечении буллезной кератопатии / М. М. Бикбов, Г. М. Бикбова // Офтальмохирургия, — 2009. — № 2. — С. 30–33. 3. Wollensak, G. Riboflavin ultraviolet-A-induced collagen crosslinking for the treatment of keratoconus / G. Wollensak, E. Spoerl, T. Seiler // Am. J. Ophthalmol. — 2003. — Vol. 135. — P. 620–627. 4. Spoerl, E. Induction of cross-links in corneal tissue / E. Spoerl, M. Huhle, T. Seiler // Exp. Eye Res. — 1998. — Vol. 66. — № 1. — Р. 97–103. А. В. Колесников, М. Н. Николаев, О. И. Баренина, Щулькин, М. А Балакирев КОРРЕКЦИЯ СВОБОДНОРАДИКАЛЬНОГО СТАТУСА РОГОВИЦЫ ПРЕПАРАТОМ «МЕКСИДОЛ» ПОСЛЕ ПОВЕРХНОСТНОЙ ЭКСИМЕРЛАЗЕРНОЙ АБЛЯЦИИ (ФРК, ЕПИ-ЛАСИК) В ЭКСПЕРИМЕНТЕ ГОУ ВПО «РязГМУ Минздравсоцразвития России», офтальмологическая клиника «Око», г. Рязань Эксимерная лазерная коррекция зрения — революционная разработка в области хирургического исправления несовершенств оптической системы глаза. Пациенты, избравшие хирургический путь лечения, должны гарантированно достичь максимально качественного зрения независимо от метода эксимер-лазерной рефракционной хирургии. Несмо76 тря на современный арсенал высокотехнологичного оборудования и достаточный клинический опыт, существуют интра- и послеоперационные осложнения, результатом которых является уменьшение качества зрения (аберрации высоких порядков, помутнение роговицы), ухудшение биомеханических характеристик роговицы. Технологии поверхностного мо- делирования роговицы (ФРК, ЭПИ-ЛАСИК) сопровождаются значительно меньшим ухудшением биомеханических свойств роговицы, однако сопряжены с большей вероятностью формирования субэпителиальных помутнений (haze) (в сравнении с ЛАСИК). Индукция haze — следствие фотоабляции как таковой, а так же развивающего окислительного стресса и потери эпителиальных клеток. Применение ЭПИ-Ласик позволяет сохранить порядка 90 % эпителиальных клеток, что позволило существенно уменьшить формирование haze роговицы в послеоперационном периоде, но не исключить полностью. Окислительный стресс формируется в процессе фотоабляции роговицы как в результат повреждения и последующей воспалительной реакции, так и в результате воздействия ультрафиолетового излучения. Исключить факторы, индуцирующие окислительный стресс, на современном этапе развития лазерной рефракционной хирургии практически не возможно. В связи с этим остаются актуальными вопросы изучения биохимических изменений тканей глаза в послеоперационном периоде, а также поиск эффективных фармакологических средств для их коррекции. Цель — оценить эффективность коррекции антиоксидантного статуса роговицы после операций фоторефрактивной кератэктомии (ФРК) и субэпителиального лазерного кератомилеза (ЭПИ-ЛАСИК) с использованием препарата мексидол. Материал и методы. Работа выполнена на 39 половозрелых кроликах самцах породы шиншилла средней массой 4,2±0,31 кг. Все вмешательства осуществлялись под кетаминовым наркозом (25 мг/кг). Животные были разделены на 13 серий (3 кролика, 6 глаз в каждой серии). 1 серия — интактные кролики; 2, 3, 4 серии — кролики на 1, 7 и 14 день после операции ФРК; 5, 6, 7 серии — животные, подвергнутые операции ЭПИ-ЛАСИК, на 1, 7 и 14 день после вмешательства; 8, 9, 10 серии — животные, которым после операции ФРК в течение 1, 7 и 14 дней закапывали мексидол; 11, 12, 13 серии — кролики, подвергнутые ЭПИ-ЛАСИК, которым закапывали мексидол в течение 1, 7 и 14 дней соответственно. Операции проводились на установке ОЛИМП-2000. ФРК производилась стандартно (механическое удаление эпителия). При ЭПИ-ЛАСИК формирование поверхностного эпителиального лоскута проводилось с помощью эпикератома AMADEUS II MOZART (AMO, Zeimer group). 5 % раствор мексидола («Фармасофт») закапывали 3 раза в день по 77 2 капли в глаз. Помимо мексидола животные получали стандартную послеоперационную терапию. Животных выводили из эксперимента методом газовой эмболии. Для биохимического исследования из энуклеированных глаз выделяли роговицу. Выраженность окислительного стресса оценивали по содержанию вторичного продукта пероксидации липидов — малонового диальдегида (МДА). Состояние антиоксидантной системы защиты (АОЗ) определяли по уровню свободных SH-групп, активности антиоксидантных (АО) ферментов: глутатионпероксидазы (G-per), глутатионредуктазы (G-red), глутатион-SH-трансферазы (G-tr) и супероксиддисмутазы (СОД). Статистическую обработку проводили с использованием программы «Statistica 6.1». Различия между группами оценивали с помощью однофакторного дисперсионного анализа (ANOVA), тест Ньюмена-Кейсла. Результаты и обсуждение. Полученные результаты представлены в таблице. Операция ФРК сопряжена с удалением переднего эпителия роговицы, что приводит к удалению ее естественного защитного слоя. Потеря эпителиальных клеток приводит к выделению цитокинов, что в свою очередь индуцирует генерацию активных форм кислорода, активизирует кератоциты, стимулирует пролиферацию. В отличие от этого, операция ЭПИ-ЛАСИК — это гибридная технология — при сохранении положительных моментов поверхностной абляции сохраняется передний эпителий роговицы с собсвенной базальной мембраной (lamina lucida Боуменовой пластинки роговицы). В настоящем исследовании установлено, что как после операции ФРК, так и после ЭПИ-ЛАСИК роговице происходило повышение содержания МДА, что свидетельствует об интенсификации ПОЛ. После ФРК максимальный уровень МДА определялся на 7 сутки, а после ЭПИ-ЛАСИК — на первые. По данным литературы известно, что ультрафиолетовый свет и тепловое воздействие, инфильтрация полиморфноядерными лейкоцитами ткани роговицы, снижение активности антиоксидантных ферментов (СОД и G-per) вызывает активацию образования активных форм кислорода. В настоящем исследовании установлено, что в основе интенсификации ПОЛ после операций ФРК и ЭПИ-ЛАСИК могут лежать разные патогенетические механизмы. На 1 сутки после ЭПИ-ЛАСИК происходило достоверно (p<0,05) большее снижение уровня свободных SH-групп, чем после ФРК. В то же время активность АО фермен- тов снижалась в большей степени (недостоверно, р>0,05) после ФРК, чем после ЭПИ-ЛАСИК. Возможно, это связано с тем, что при ФРК удаляется поверхностный слой роговицы — эпителий (в котором содержится большая часть АО ферментов) и строма, богатая сульфгидрильными группами. В ходе ЭПИЛАСИК удаляется только строма, а эпителий повреждается незначительно (менее 10 %). С этой точки зрения можно предположить, что более значимое снижение SH-групп при ЭПИ-ЛАСИКе может быть связано с большим их расходом в реакциях ферментативной нейтрализации активных радикалов и промежуточных продуктов окисления. Курсовое применение мексидола приводило к значительному улучшению окислительного статуса роговицы как после ФРК, так и после ЭПИ-ЛАСИК: нормализовался уровень МДА и концентрация SH-групп, восстанавливалась активность АО ферментов. Известно, что реактивные формы кислорода вызывают деградацию коллагена и протеогликанов и вызывают в ответ агрессивное заживление раны. Заживление раны роговицы индуцирует haze и регрессию рефракции после ФРК. Haze роговицы и пролиферация кератоцитов могут быть уменьшены путем подавления инфильтрации воспалительных клеток в область абляции после ФРК. Предполагается, что повышение уровня МДА в слезной жидкости и хрусталике глаза, после операции ЛАСИК, лежит в основе развития катаракты. Таким образом, применение мексидола, который подавлял активность ПОЛ, позволит снизить частоту данных осложнений. Выводы. После операций ФРК и ЭПИ-ЛАСИК происходит патологическая интенсификация ПОЛ, что проявляется в повышении содержания МДА, снижении уровня SH-групп и снижением активности антиоксидантных ферментов. После ФРК происходит снижение активности антиоксидантных ферментов, а после ЭПИ-ЛАСИК — преимущественно SH-групп, что связано с особенностями проведения операций. Применение мексидола как после ФРК, так и после ЭПИ-ЛАСИК нормализует окислительный статус роговицы. Влияние курсового введения мексидола на выраженность окислительного стресса в роговице после операций ФРК и ЭПИ-ЛАСИК 1,36±0,056 3,1±0,22 0,34±0,016 0,88±0,067 2,6±0,18 1,17±0,07 2,6±0,31 0,23±0,014* 0,67±0,035 1,7±0,11* Активность G-tr нмоль ХДНБ/ мин×мг белка Активность СОД ЕА/мг белка 3,6±0,21 5,4±0,32* Активность G-red нмоль НАДФН/ мин×мг белка Свободные SH-группы мкмоль/мг белка Интактные кролики 1 день после ФРК Серии эксперимента Активность G-per нмоль НАДФН/ мин×мг белка МДА нмоль/мг белка Изучаемые показатели 7 день после ФРК 6,4±0,52* 0,86±0,06* 2,1±0,13 0,19±0,011* 0,76±0,052 2,1±0,14 14 день после ФРК 5,1±0,41* 1,24±0,09 2,4±0,21 0,27±0,015 0,81±0,062 2,4±0,14 1 день после ЭПИ-ЛАСИК 5,4±0,39* 0,84±0,05* 2,7±0,14 0,26±0,016 0,61±0,031* 1,8±0,09* 7 день после ЭПИ-ЛАСИК 4,8±0,31 0,95±0,06* 2,8±0,36 0,25±0,023* 0,7±0,052 2,4±0,19 14 дней после ЭПИ-ЛАСИК 4,3±0,27 1,1±0,06 3,0±0,41 0,3±0,021 0,85±0,066 2,9±0,21 1 день после ФРК+мексидол 4,9±0,38 1,07±0,05 2,8±0,32 0,21±0,011* 0,72±0,052 1,9±0,19 7 день после ФРК+мексидол 5,0±0,35*,# 1,1±0,07 2,3±0,28 0,25±0,016* 0,84±0,042 2,0±0,11 14 день после ФРК+мексидол 4,4±0,33 1,34±0,07 2,7±0,41 0,27±0,019 0,81±0,051 2,1±±0,08 1 день после ЭПИЛАСИК+мексидол 4,9±0,32 1,1±0,09 2,8±0,34 0,27±0,025 0,71±0,55 2,1±0,14 7 день после ЭПИЛАСИК+мексидол 4,7±0,29 1,02±0,08* 3,0±0,46 0,31±0,025 0,76±0,43 2,5±0,16 14 день после ЭПИЛАСИК+мексидол 3,8±0,26 1,25±0,09 3,4±0,51 0,38±0,031# 0,84±0,61 2,4±0,19 * — р<0,05 — достоверные различия с показателями интактных животных. # — р<0,05 — достоверные различия показателей животных получающих мексидол в сравнении с показателями животных подвергнутых одной операции. 78 И. М. Корниловский Эксимерлазерные технологии при патологии роговицы и их классификация ИУВ ФГУ «НМХЦ им. Н. И. Пирогова» Минздравсоцразвития России, г. Москва Современная эксимерлазерная микрохирургия при патологии роговицы предусматривает целый комплекс различных технологий абляции эпителия, боуменовой оболочки и поверхностных слоёв стромы роговицы [1–5]. Данные технологии имеют ряд особенностей и не укладываются в ранее предложенное и широко употребляемое за рубежом название фототерапевтическая кератэктомия — ФТК (Phototherapeutic keratectomy, PTK). Цель — рассмотреть эксимерлазерные технологии при патологии роговицы и предложить их классификацию. Материал и методы. Настоящее сообщение базируется на 20-ти летнем клиническом опыте проведения эксимерлазерных операций при различной патологии роговицы (свыше 1000 операций). Операции выполнялись на отечественных и зарубежных офтальмологических эксимерных лазерных установках I–V поколений. Результаты и обсуждение. Принципиальным отличием Российских технологий эксимерлазерных операций при патологии роговицы явилось то, что все они выполнялись трансэпителиально, без предварительной механической скарификации эпителия роговицы [1]. Это обеспечило строгое сохранение принципа прецизионности вмешательства, который неизбежно нарушается при механическом удалении эпителия. Такой подход позволил использовать эффекты сглаживания и заполнения собственным эпителием неровностей поверхности роговицы. Вторым важным отличием Российских технологий эксимерлазерных операций при различных заболеваниях роговицы и их исходах, явилось применение сглаживающих абляционных составов на основе 0,5–1,0 % раствора желатина. Данные растворы обладали целым рядом уникальных возможностей фазового изменения вязкости при температурных колебаниях. Во всех случаях выбор концентрации раствора предопределялся характером неровностей поверхности роговицы [1–3]. 79 Третьим отличительным признаком разработанных нами технологий явилось то, что в зависимости от характера неровностей поверхности роговицы, помимо обычного капельного нанесения абляционного сглаживающего состава, применялся капельнопалпебральный, палпебрально-компрессионный, аэрографический, фонографический и комбинированные методики их нанесения на поверхность роговицы. Для лучшей адгезии абляционного состава проводилось предварительное подсушивание поверхности и последовательное нанесение состава по мере послойной абляции. Во всех случаях объём абляции эпителия, боуменовой оболочки и поверхностных слоёв стромы определялся конкретным видом патологии роговицы. Фактически осуществлялась строго индивидуальная технология эксимерлазерной абляции в зависимости от вовлечения в процесс различных слоёв роговицы [1–4]. Следует отметить, что в последние годы появилась реальная возможность персонализированной фоторефракционной абляции роговицы по данным компьютерной кератотопографии и аберрометрии. Однако в целом ряде случаев при таком подходе не достигался необходимый лечебный и оптикорефракционный эффекты. Примером могут служить язвенные формы кератитов. Это касается и случаев, когда в исходе кератита, из-за вторичных изменений в эпителии роговицы, существенно искажаются кератотопографические рефракционные показатели и резко увеличиваются аберрации высших порядков. Всё это приводит к ситуации, когда перестают работать рефракционные программы персонализированной абляции по данным кератотопографических и аберрометрических исследований. В таких случаях целесообразно планировать двух и даже трёхэтапное эксимерлазерное вмешательство с обязательным применением на первом этапе специальных технологий нанесения сглаживающих абляционных составов. Вышеизложенный трансэпителиальный подход с применением различных методик нанесения абляционных сглаживающих покрытий позволил разра- ботать целый ряд эксимерлазерных технологий при патологии роговицы и предложить следующую их классификацию. Так, в зависимости от решаемой задачи, все эксимерлазерные технологии проведения операций при патологии роговицы были разделены на: лечебные, оптические, рефракционные и комбинированные (лечебно-оптические, оптико-рефракционные и т. д.). Такое подразделение важно с практической точки зрения, поскольку четко предопределяет какую конечную цель, преследует проводимая операция. Так, лечебные эксимерлазерные технологии выполняются на глазах без или с нарушением целостности поверхности роговицы и направлены на купирование роговичного синдрома. Это, прежде всего, кератиты и кератоуветы различной этиологии с изъязвлением роговицы. В исходе любого воспалительного процесса в роговице формируются помутнения, рубцы, может развиваться индуцированная вторичная аметропия, неправильный астигматизм. Такие глаза спокойны и роговичный синдром отсутствует. Вот почему эксимерлазерные операции проводятся с оптической, рефракционной или оптико-рефракционной целью и имеют соответствующее название в предлагаемой классификации. В зависимости от того, на каких структурах роговицы осуществляется дозированная абляция, делается соответствующая добавка в название технологии проводимой операции. Например, лечебная эксимерлазерная эпителиоэктомия или эпителибоуменэктомия или трансэпителиальная поверхност- ная кератоэктомия. Другими словами, в названии операции отражается полное название конкретной технологии, что делает понятным с какой целью и какой объём эксимерлазерного вмешательства выполнен. Все вышеизложенные технологии могут быть проведены на качественно более высоком уровне при использование эксимерных лазеров VI поколения с возможностью интраоперационного контроля за толщиной удаляемого слоя роговицы по данным оптической когерентной томографии (ОКТ). Предлагаемый арсенал эксимерлазерных технологий при патологии роговицы и их классификация уже в ближайшее время могут быть дополнены в связи с большими перспективами, которые открываются при сочетанном применении фемтосекундных и эксимерных лазеров [6]. Выводы. Транэпителиальные технологии послойной абляции эпителия, боуменовой оболочки и поверхностных слоёв стромы роговицы позволяют сохранить эффект сглаживания собственным эпителием неровностей поверхности роговицы. Выбор концентрации сглаживающего абляционного состава на основе желатина и способа его нанесения предопределяется характером неровностей поверхности роговицы. Современные технологии эксимерлазерной хирургии роговицы предусматривают проведение прецизионной абляции эпителия, боуменовой оболочки и поверхностных слоёв стромы роговицы с лечебной, оптической, рефракционной и оптико-рефракцион­ной целью. Литература 1. Корниловский, И. М. Эксимерлазерная микрохирургия при патологии роговицы: автореф. дис. … д-ра мед. наук / И. М. Корниловский. — 1995. — 42 с. 2.Корниловский, И. М. Случай успешного лечения посттравматической рецидивирующей дисплазии эпителия роговицы излучением эксимерного лазера / И. М. Корниловский // Новое в офтальмологии. — 1996. — № 4. — C. 32–33. 3. Kornilovsky, I. M. New Approaches to Technology for Transepithelial PRK / I. M. Kornilovsky // The 5-th Annual NIDEK Intern. Excimer Users Meeting. — Miyazaki, 1999. — P. 21. 4. Малюгин, Б. Э. Трансэпителиальная фототерапевтическая кератэктомия при булёзной кератопатии / Б. Э. Малюгин, А. А. Верзин, И. М. Корниловский // Новое в офтальмологии. — 2000. — № 3. — С. 23–25. 5. Каспаров, А. А. Фототерапевтическая кератостромэктомия и стромальная диатеромокоагуляция при лечении буллезной болящей кератопатии / А. А. Каспаров, Е. А. Каспарова, Евг. А. Каспарова [и др.] // Cб. науч. статей науч.практ. конф. «Лазеры в офтальмологии: вчера, сегодня, завтра». — М., 2009. — С. 268–274. 6. Корниловский, И. М. Новые неинвазивные технологии лазерной модификации оптико-рефракционных структур глаза / И. М. Корниловский // Рефракционная хирургия и офтальмология. — 2009. — Т. 9. — № 3. — С. 17–26. 80 С. А. Коротких 1, О. Г. Макеев 2, А. С. Шамкин 1, М. Ю. Герасимов 1, А. Е. Зверева 2, В. С. Коротких1 сравнительнй Опыт применения силикон-гидрогелевых линз у пациентов после эксимерлазерной коррекции методом LASEK ГОУ ВПО «„Уральская государственная медицинская академия“ Минздравсоцразвития РФ», кафедра офтальмологии, г. Екатеринбург, 1 2 ГУЗ Свердловской области «Институт медицинских клеточных технологий», г. Екатеринбург Среди хирургических методов коррекции миопии и астигматизма наиболее перспективным является лазерный эпистромальный кератомилез (LASEK), который позволяет добиваться существенно большей результативности оперативных вмешательств за счет сочетания микрохирургических методик и заданных параметров лазерного луча. В качестве бандажа в ближайший послеоперационный период LASEK используются мягкие контактные линзы. Однако они могут различаться по характеристикам, способным оказывать влияние на темпы репарации роговичного эпителия. К ним относятся: — низкая способность к дегидратации для поддержания влажности регенерирующей поверхности, — высокая кислородопроницаемость (DK/t>90) для нивелирования гипоксических влияний на роговицу, — базовая кривизна более 8,4 для обеспечения оптимальной посадки на плоской прооперированной роговице. Кроме того, важным условием успешной репарации является наличие разрешения на непрерывное ношение линз в течение минимум 3–5 дней. Исходя из приведенного перечня, для исследования были отобраны две марки силикон-гидрогелевых линз, незначительно отличающихся по характеристикам, заявленным фирмами-производителями (табл. 1). Однако при использовании таких линз в качестве бандажа, по нашему мнению, не учитывается такое важное свойство, как клеточная адгезия роговичной поверхности, так как фиксация на ней клеток способна повредить новообразованный пласт роговичного эпителия во время удаления линзы. Для уточнения данного вопроса была использована разработанная нами технология тестирования адгезии культивируемых кератоцитов (роговичных фибробластов) к поверхности контактных линз. 81 Таблица 1 Сравнительная характеристика линз Acuvue Oasys (Senofilcon A) и Pure Vision (Balafilcon A) Параметр Метод получения Базовая кривизна, мм Режим непрерывного ношения Влагосодержание, % Кислородная проницаемость, DK/t Модуль упругости, Мра Acuvue Pure Vision Oasys плазменная полимеризация 8.8 8.6 до 7 суток до 30 суток (6 ночей) 38 36 147 110 0,72 1,08 Фибробласты в качестве средства оценки адгезивной способности поверхности, были выбраны неслучайно. Известно, что при культивировании они синтезируют внеклеточный матрикс, образующий на культуральной поверхности адгезивный слой. Фибробласт при взаимодействии с адсорбированными молекулами, реагирует на контакт перестройкой цитоскелета и распластыванием на плоскости. Это позволяет проводить прижизненную оценку адгезии кератоцитов к тестируемой поверхности контактных линз. Цель — усовершенствование протокола ведения послеоперационного периода у пациентов, оперированных по технологии LASEK, с учетом данных об адгезии культуры кератоцитов к роговичной поверхности контактных линз. Материал и методы. Для оценки адгезивных свойств роговичной поверхности линз Acuvue Oasys и Pure Vision использовалась линия человеческих кератоцитов (роговичных фибробластов), полученных из эксплантата лимба. Суспензию, содержащую 105 клеток на мл, наносили на роговичную поверхность линз. Культиви- ровали в среде DMEM (4500 mg/L glucose, SigmaAldrich, USA) с добавлением 10 % эмбриональной телячьей сыворотки (Sigma-Aldrich, USA) течение 10 суток. Смену среды и витальный контроль проводили трехкратно с целью оценки наличия фибробластов, фиксированных к роговичной поверхности линз. Оценка витальных препаратов продемонстрировала, что на роговичной поверхности линз Acuvue Oasys к восьмым суткам отмечается фиксация лишь отдельных клеток, а последующее культивирование сопровождается остановкой дальнейшего роста. При этом кератоциты формируют многочисленные межклеточные связи со слабой адгезией клеток к поверхности (рис. 1). На основании результатов тестирования линз исследовали эффективность и качество репарации эпителия в ближайший послеоперационный период на 20 пациентах, оперированных по технологии модифицированный LASEK. Всего было прооперировано 20 пациентов (40 глаз), среди них женщин — 15, мужчин — 5. Возраст пациентов составил от 18 до 39 лет (в среднем 24,9 лет). Пахиметрия центральной зоны на аппарате Tomey AL-3000 варьировала от 487 мкм до 575 мкм (в среднем 518,5 мкм). Значения рефракции пациентов составляли от —2,00D до —9,50D. Миопический астигматизм ≥1,0D в группе был отмечен у 5 человек. Средняя некорригированная острота зрения составляла 0,081±0,04, средняя корригированная — 0,981±0,02. Методика оперативного лечения включала аппликационную анестезию, удаление поверхностного эпителия скарификатором, фотоабляцию на эксимерном лазере Carl Zeiss Mel 80, репозицию отслоенного эпителия на роговичное ложе по всем меридианам с фиксацией мягкой контактной линзой. В качестве бандажа были использованы линзы Acuvue Oasys и Pure Vision на парный глаз. В послеоперационный период применяли единый для всех пациентов медикаментозный протокол: Ципромед, Визмед гель, ДиклоФ по 1 капле 6 раз в день в оба Рис. 1. Округлые роговичные фибробласты глаза. Биомикроскопию и удаление линз проводили с многочисленными межклеточными связями. на 2-е (48 часов) или на 3-и (72 часа) сутки после Витальная микроскопия. Olympus CKX41. х200 операции в зависимости от динамики и качества эпителизации на месте абляции. Оценка витальных препаратов на линзах Pure Результаты и обсуждение. В группе, где приVision свидетельствовала о том, что на роговичной менялись менее адгезивные линзы, отмечалась более поверхности к восьмым суткам наблюдается плотэффективная и быстрая эпителизация роговицы, а полный монослой распластанных кератоцитов (рис. 2). ное закрытие эпителия спустя 48 часов наблюдалось в большинстве глаз. Во второй группе, где использовали более адгезивные линзы, напротив, репарация замедлялась, а качество было существенно ниже (табл. 2). Спустя 48 часов эпителий в оптической зоне у половины глаз был рыхлый, по типу «звезды». Таблица 2 Сроки заживления роговичного эпителия (2–3 сутки) Время исследования Рис. 2. Фиксированные к поверхности роговичные фибробласты. Витальная микроскопия. Olympus CKX41. х400 48 часов 72 часа >72 часов 82 Группа Группа Acuvue Oasys Pure Vision Количе% Количе- % ство глаз ство глаз 16 80 10 50 4 20 9 45 — — 1 5 Выводы. Адгезивная способность роговичной поверхности контактных линз является важным параметром, способным влиять на темпы и качество репарации эпителия роговицы. Использования линз Acuvue Oasys в послеоперационном периоде при операциях по технологии LASEK позволяет сократить сроки и увеличить качество репарации эпителия роговицы и, тем самым, способствует повышению оптического результата операции. Окончание таблицы 2 Время исследования Тип регенерации Полная регенерация эпителия Рыхлый эпителий в оптической зоне по типу «звезды» Группа Группа Acuvue Oasys Pure Vision Количе% Количе- % ство глаз ство глаз 20 100 17 85 — — 3 15 А. Р. Корсиладзе, В. Н. Трубилин, С. И. Анисимов, К. А. Золоторевский Исследование морфологических изменений в роговице после проведенного кросслинкинга в эксперименте Клиника глазных болезней ФМБА, кафедра офтальмологии, г. Москва, Онкологический центр АМН РФ, клиника «Восток-Прозрение», г. Москва В доступной литературе имеется значительное число работ, посвященных анализу биохимических и клинико-функциональных изменений, развивающихся в роговице больных после перенесенного кросслинкинга [1, 2, 3]. Подобные исследования убедительно доказывают, что после проведенной процедуры, происходили изменения свойств коллагена стромы роговицы в сторону увеличения их механической прочности [4]. Именно с данной закономерностью авторы связывали положительный клинический результат кросслинкинга [5]. Цель — проведение морфологических исследований для оценки характера изменений, развивающихся в тканях роговицы экспериментальных животных после проведенного кросслинкинга. Материал и методы. Исследования выполнены на 6 глазах кроликов породы шиншилла (самцы). Всем животным под местной анестезией выполняли процедуру типичного кросслинкинга по цюрихскому протоколу. Для облучения использовали аппарат EVOLUTION (ООО «Трансконтакт», Россия). Использовали дозы облучения: мощность — 40 % и 50 %; длительность экспозиции — от 15 до 17 минут. На 5 день кроликов забивали воздушной эмболией, глаза энуклеировали. Морфологические исследования выполняли с применением световой (окраска гаматоксилином и эозином) и электронной микроскопии. Результаты и обсуждение. Проведенные исследования показали, что при световой микроскопии не выявляли существенных грубых морфологических 83 изменений в структуре стромы роговицы кролика. Можно отметить разволокнение структуры и появление эозинофильных лейкоцитов в строме роговицы. Данные электронной микроскопии показали наличии активного коллагеногенеза. На снимках выявляли появление активных фибробластов. При этом количество таких клеток увеличивалось по мере увеличения интенсивности облучения. Также было отмечено появление коллагеновых волокон разного диаметра. Данный вид исследования не дает возможности дифференцировать типы волокон, но можно предположить, что начинают появляться новые колллагеновые волокона после проведения процедуры кросслинкинг. Следует особо подчеркнуть, что ни в одном из исследований нами не было выявлено явлений некроза тканей, характерных для ожогов роговицы. Кроме того, при любой мощности УФ—излучения эндотелий роговицы сохранялся интактным. Таким образом, представленные данные свидетельствуют о существенном влиянии на процесс коллагеногенеза процедуры кросслинкинг. Это вмешательство ускоряет синтез коллагена, не вызывает ожоговых и дистрофических изменений тканей роговицы и не повреждает эндотелий. Выводы. Проведение процедуры кросслинкинг способствует выработке факторов коллагеногенеза в строме роговицы. Выполненные исследование позволяют предположить появление юных коллагеновых волокон после проведения кросслинкинга. При этом не было выявлено явлений некроза тканей, а эндотелий роговицы остается интактным. Литература 1. Wollensak, G. Gel electrophoretic analysis of corneal collagen after photodynamic cross-linking treatment / G. Wollensak // Cornea. — 2008. — Vol. 27. — № 3. — P. 353–356. 2. Sedaghat, M. Biomechanical parameters of the cornea after collagen crosslinking measured by waveform analysis / M. Sedaghat // J. Cataract Refract. Surg. — 2010. — Vol. 36. — Р. 1728–1731. 3. Tomkins, O. Collagen cross-linking: strengthening the unstable cornea / O. Tomkins, H. J. Garzozi // Clin. Opthalmol. — 2008. — Vol. 2. — № 4. — P. 863–867. 4. Wollensak, G. Long-term biomechanical properties of rabbit cornea after photodynamic collagen cross-linking / G. Wollensak // Acta Opthalmol. — 2009. — Vol. 87. — № 1. — P. 48–51. 5. Jankov, L. Corneal collagen cross-linking / L. Jankov // Middle East Afr. J. Opthalmol. — 2010. — Vol. 17. — № 1. — Р. 21–27. Ш. Р. Кузбеков, Б. Т. Фаттахов Сравнительное исследование эффективности слезозамещающих препаратов в лечении синдрома сухого глаза у пациентов, перенесших LASIK ГУ «Уфимский НИИ глазных болезней» АН РБ, Уфа Одной из частых причин нарушения стабильности слезной пленки, приобретающих в последние годы все большую актуальность, являются кераторефракционные операции [1]. В части из них повреждающий фактор является механическим (радиальная рефракционная кератотомия), или лучевым (фоторефракционная кератэктомия), в других случаях имеет место комбинированное повреждение роговицы (LASIK). В результате воздействия на роговицу упомянутых выше негативных факторов нарушается функция ее наружной эпителиальной мембраны, что неотвратимо приводит и к нарушению стабильности слезной пленки. Многие авторы отмечают различные проявления синдрома сухого глаза (ССГ) у пациентов, перенесших фоторефракционные операции, при этом как в раннем (после ФРК и LASIK), так и в позднем (после ФРК и ФТК) послеоперационном периоде [3, 4]. Хотелось бы отметить, что у большинства пациентов нарушения слезопродукции носят временный характер, и через месяц после операции проявления ССГ утихают. Так, по данным H. Gimbel [3], после ФРК те или иные нарушения слезопродукции отмечаются у 5–18 % прооперированных пациентов. Доктор A. Agarwal [2], анализируя результаты свыше 2000 операций LASIK, отмечает развитие симптомов ССГ легкой и средней степени тяжести у 5,6 % пациентов. 84 Основным средством лечения больных рассматриваемой категории служит назначение им в виде капель препаратов «искусственной слезы». Они представляют собой водные растворы гидрофильных полимеров с включением различных консервантов и неорганических солей для придания препарату требуемых значений кислотности и осмолярности. В основе препаратов «искусственной слезы», в основном, применяются производные метилцеллюлозы (чаще — гидроксипропилметилцеллюлоза), поливиниловый спирт, поливинилпирролидон, натрия гиалуронат, хондроитин-сульфат, полиакриламид, различные варианты карбомеров и многие другие. Для достижения желаемого эффекта упомянутые препараты ежедневно инстиллируют в больной глаз с периодичностью до 6 раз в сутки. Цель — провести сравнительную оценку эффективности препаратов искусственной слезы в лечении ССГ у пациентов, перенесших LASIK. Материал и методы. Под наблюдением находились 82 пациента (164 глаза) в возрасте от 22 до 45 (в среднем 28,4±4,6) лет, с клиническими признаками ССГ после проведения LASIK по поводу миопии различной степени, в сроки от 2 до 6 месяцев после операции. Все пациенты были разделены на 3 группы в зависимости от препарата, использованного для терапии ССГ. В первую группу вошли 42 пациента (84 глаза), которые применяли препарат Офтолик, во вторую — 20 пациентов (40 глаз), применяв- ших препарат Дефислез, в третью — 20 пациентов (40 глаз), лечение ССГ у которых проводили препаратом Офтагель. Для оценки состояния слезной пленки применяли пробы Ширмера и Норна. Оценку субъективных жалоб и объективных симптомов проводили по четырехбальной шкале: 0 — отсутствие признака; 1 — едва уловимые проявления признака; 2 — отчетливые проявления признака; 3 — резко выраженные проявления признака. Обследование пациентов проводили до начала лечения, через 3, 7, 14 и 28 суток после его начала. Кратность инстилляций препарата искусственной слезы определялась индивидуально и составляла, в зависимости от степени выраженности ССГ, от 2 до 4 раз в день. Результаты и обсуждение. Во всех наблюдаемых группах отмечали положительную динамику изменения субъективных жалоб пациентов (табл. 1). Однако на 3 сутки лечения исследуемыми препаратами в первой группе снижение субъективных жалоб отметили 16 пациентов, в то время как во второй и третьей группах уменьшений жалоб отмечалось у 3 и 5 пациентов соответственно. Через 7 дней от начала лечения в первой группе 35 пациентов (83,3 %) отмечали существенное уменьшение жалоб, что составило в среднем 1,18±0,21 балла и достоверно отличалось от исходного уровня (p<0,05). В группе пациентов, применявших препарат Дефислез, 1 пациент отметил непереносимость препарата, что заставило нас отказаться от его применения. Уменьшение жалоб отметили 7 и 11 пациентов второй и третьей групп соответственно. Через 2 недели лечения результаты, полученные в первой группе, сохранялись на прежнем уровне и оставались стабильными на протяжении всего срока наблюдения, до 4 недель. Во второй и третьей группах было выявлено статистически достоверное отличие уровня субъективных жалоб от исходного уровня. У 6 (14,2 %) пациентов первой исследуемой группы субъктивные симптомы были полностью купированы, что подтверждалось результатами объективного обследования. Это позволило отменить применение слезозамещающей терапии уже через 2 недели после начала лечения. Обследование пациентов до начала лечения исследуемыми препаратами Офтолик, Дефислез и Офтагель показало, что выраженность объективных симптомов находилась в пределах от 0 до 3 баллов, составив в среднем 1,2±0,11, 1,22±0,13 и 1,19±0,1 соответственно (табл. 2). Применение всех трех препаратов не вызывало ухудшения объективных симптомов. Через 3 и 7 суток после начала терапии ССГ состояние глаз пациентов в среднем не изменялось. Однако пациенты, применявшие препарат Офтолик отмечали меньшее количество жалоб, связанных с приемом препарата (слипание век, временное затуманивание зрения и т. д.), характерных для препаратов искусственной слезы. Через 2 недели после начала лечения показал, что в первой группе снижение выраженности объективных симптомов достигло статистически значимого уровня (p<0,05) и находилось в пределах от 0 до 2 баллов, в среднем 0,8±0,12. В то время как во второй и третьей группах этот показатель состаТаблица 1 Динамика изменения субъективных жалоб, в баллах (M ± SD) Препарат Офтолик Дефислез Офтагель До лечения 1,86±0,17 1,79±0,2 1,91±0,12 3 суток 1,7±0,12 1,73±0,10 1,8±0,09 Сроки наблюдения 7 суток 1,18±0,21* 1,62±0,16 1,71±0,3 14 суток 1,16±0,15* 1,25±0,17* 1,27±0,16* 28 суток 1,12±0,11* 1,22±0,11* 1,2±0,15* * — изменения статистически достоверны по сравнению с исходными значениями, p<0,05 Таблица 2 Динамика изменения объективных симптомов, в баллах (M ± SD) Препарат Офтолик Дефислез Офтагель До лечения 1,2±0,11 1,22±0,13 1,19±0,1 3 суток 1,1±0,15 1,2±0,14 1,17±0,17 Сроки наблюдения 7 суток 1,1±0,11 1,18±0,14 1,16±0,12 * — изменения статистически достоверны по сравнению с исходными значениями, p<0,05 85 14 суток 0,8±0,12* 1,1±0,15 1,03±0,14 28 суток 0,56±0,13* 0,95±0,15* 0,9±0,12* вил в среднем 1,1±0,15 и 1,03±0,14 балла, и не было выявлено статистически достоверной разницы по сравнению с исходными значениями. Через 4 недели терапии ССГ в первой группе уровень объективных симптомов продолжал снижаться до 0,56±0,13 баллов, при этом ни у одного пациента он не превышал 1 балла. Во второй исследуемой группе значение уровня объективных симптомов составило в среднем 0,95±0,15 балла, и достоверно отличалось от исходного значения (p<0,05). При этом у 3 пациентов (15 %) уровень объективных симптомов составил 2 балла, а у одного пациента (5 %) — 3 балла. В третьей группе выраженность объективных симптомов снизилась в среднем до 0,9±0,12 баллов. У 4 пациентов (20 %) данной группы степень выраженности объективных симптомов составила 2 балла. Из таблицы 3 видно, что динамика изменения результатов пробы Норна соответствует данным, полученным при оценке выраженности объективных симптомов ССГ. Так статистически достоверное (p<0,05) увеличение времени разрыва слезной пленки (ВРСП) до нормальных значений в первой группе произошло через 2 недели после начала лечения. Во второй и третьей группах в аналогичные сроки наблюдения ВРСП находилось в пределах от 5 до 12 секунд и составило в среднем 8,3±0,1 и 8,1±0,14 секунд соответственно и достоверно не отличалось от исходного уровня. Через 4 недели лечения исследуемыми препаратами значение ВРСП составило 14,3±0,15, 12,2±0,12 и 13,1±0,17 сек. соответственно. Данные результаты соответствуют нормальным значениям пробы Норна. При этом в первой группе у 5 пациентов (12 %) ВРСП составило менее 10 секунд, во второй группе — у 4 пациентов (20 %), в третьей — у 3 пациентов (15 %). Значение пробы Ширмера на фоне проводимой терапии во всех исследуемых группах достоверно не изменилось и составило 11,0–11,3 мм/5 мин на 28 сутки лечения (табл. 4). Это свидетельствует о механизме развития ССГ у пациентов после LASIK, основную роль в котором имеет разрыв рефлекторной цепи, на фоне нормальной работы слезной железы. Выводы. Препарат «Офтолик» оказался наиболее эффективным в лечении пациентов с ССГ после проведения LASIK. Нормализация состояния слезной пленки, достоверное уменьшение объективных и субъективных проявлений ССГ наблюдали уже через 7±0,65 дней. Наиболее информативными критериями эффективности проводимой терапии оказались показатели субъективных жалоб и объективных симптомов, оцененные в баллах, и значение времени разрыва слезной пленки. Таблица 3 Динамика изменения времени разрыва слезной пленки, секунд (M ± SD) Препарат Офтолик Дефислез Офтагель До лечения 6,1±0,12 6,0±0,11 6,2±0,14 3 суток 8,7±0,15 7,0±0,16 7,1±0,13 Сроки наблюдения 7 суток 9,5±0,22 7,4±0,17 7,7±0,21 14 суток 13,1±0,12* 8,3±0,1 8,1±0,14 28 суток 14,3±0,15* 12,2±0,12* 13,1±0,17* * — изменения статистически достоверны по сравнению с исходными значениями, p < 0,05 Таблица 4 Динамика изменения пробы Ширмера, мм/5 мин (M ± SD) Препарат Офтолик Дефислез Офтагель До лечения 10,6±0,5 10,8±0,7 11,1±0,6 3 суток 10,8±0,8 10,7±0,8 10,9±0,6 Сроки наблюдения 7 суток 10,6±0,7 10,8±0,6 10,7±0,9 14 суток 10,7±0,5 10,8±0,4 10,9±0,6 28 суток 11,1±0,6 11,3±0,5 11,0±0,7 Литература 1. Бржеский, В. В. Роговично-конъюнктивальный ксероз (диагностика, клиника, лечение) / В. В. Бржеский, Е. Е. Сомов. — СПб.: «Левша. Санкт-Петербург», 2003. — 120 с. 2. Agarwal, A. Photorefractive correction myopic astigmatism / A. Agarwal, C. Puliafito, [et al] // J. Cataract Refract. Surg. — 2000. — Vol. 12. — P. 34–36. 3. Gimbell, H. The LASIK complications / H. Gimbell, L. Probst // OSN. — 2001. — P. 54. 4. Machat, J. The Art of LASIK / J. Machat, S. Slade // Hard Cover. — 1999. — P. 544. 86 Н. А. Левченко, О. И. Кривошеина, И. В. Запускалов РОЛЬ АУТОЛОГИЧНЫХ МОНОНУКЛЕАРОВ КРОВИ В ПРОЦЕССЕ ЗАЖИВЛЕНИЯ ЭКСПЕРИМЕНТАЛЬНОГО ПОРАЖЕНИЯ РОГОВИЦЫ Сибирский государственный медицинский университет, г. Томск Одной из актуальных проблем современной офтальмологии является проблема лечения воспалительных заболеваний роговицы [1, 6], что связано с ростом частоты поражения роговой оболочки, так и с тяжестью течения данного вида патологии, приводящих к значительному снижению зрения, а нередко и к гибели глаза. В настоящее время очевидны серьезные негативные последствия традиционной антибактериальной терапии: развитие дисбактериоза и присоединение грибковой инфекции, рост числа антибиотикорезистентных штаммов микроорганизмов, развитие аллергических реакций, а также присоединение синдрома «сухого глаза» [2, 3, 4, 6]. В связи с этим существует актуальная задача разработки эффективного метода лечения кератитов, который сочетал бы в себе возможность адресной доставки препарата непосредственно к патологическому очагу, способствовал быстрому купированию воспалительного процесса и улучшению зрительных функций. Цель — в эксперименте in vivo изучить патоморфологические особенности заживления повреждений роговицы на фоне интрастромального введения аутологичных мононуклеаров крови. Материал и методы. Выполнена серия экспериментов на 20 кроликах породы Шиншилла массой 2,5–4,0 кг. В условиях операционной под наркозом каждому животному выполнялась тотальная деэпителизация роговицы и механическое повреждение стромы и эндотелия роговой оболочки одного из глаз. В зависимости от способа лечения животные были разделены на 2 груп­ пы: — основную (n=10) — животным данной группы, наряду с инстилляциями раствора ципролета 6 р. и корнерегеля 3 р. в день, в строму роговицы вводили аутологичные мононуклеары крови. Мононуклеары, взятые из крови экспериментального животного, выделяли методом фракционирования в градиенте плотности на разделяющем растворе фиколл-верографин. Чистота клеток составляла 96–98 %. 87 — группу сравнения (n=10) — животным после повреждения роговицы выполнялись только инстилляции ципролета 6 р. и корнерегеля 3 р. в день. Общая продолжительность эксперимента составила 21 сутки. В ходе эксперимента проводились наружный осмотр, биомикроскопия, флюоресцентная проба, фоторегистрация. Забор материала производился на 3, 7, 14, 21 сутки от начала эксперимента. Из каждой группы с помощью глубокого наркоза выводили по 2 животных с последующей энуклеацией обоих глаз. Забой экспериментальных животных осуществляли с соблюдением правил и норм, прописанных в директивах Европейского сообщества (86/609 ЕЕС) и Хельсинской декларации. Полученный материал фиксировали для световой микроскопии, для окраски материала использовались гематоксилин и эозин. Результаты и обсуждение. На 3-и сутки от начала эксперимента у животных основной группы эпителий роговицы был представлен 5–6 слоями плоских клеток. Подлежащая пограничная мембрана визуализировалась на всем протяжении. Основное вещество роговой оболочки содержало пучки коллагеновых волокон, расположенных несколько неупорядоченно. В строме отмечалась диффузная мононуклеарная инфильтрация, занимающая около трети толщины роговицы. Десцеметова мембрана и эндотелий определялись не на всем протяжении. На их месте, на поверхности задней стенки роговицы выявлялись тонкие фибриновые нити, формирующие округлые образования округлой и овальной формы, заполненные нежной сетью фибрина. У животных группы сравнения эпителий роговицы был представлен дистрофически измененными эпителиоцитами. Передняя пограничная мембрана визуализировалась не на всем протяжении. Подлежащая строма роговицы характеризовалась выраженным отеком, коллагеновые волокна в ней располагались в виде рыхлой сети. В области лимба отмечалась густая инфильтрация с большим количеством полиморфноядерных лейкоцитов. Задняя пограничная мембрана на всем протяжении выглядела утолщенной, местами была отслоена от стромы роговицы. Эндотелий роговицы на большем протяжении десквамирован. Просвет передней камеры глаза заполнен оксифильными массами с примесью лимфоцитов и лейкоцитов. На 7-е сутки — у животных основной группы эпителий роговицы был представлен 5–6 слоями плоских клеток. Базальные эпителиоциты активно пролиферировали. Передняя пограничная мембрана хорошо визуализировалась на всем протяжении. В строме роговицы ход коллагеновых пучков становился упорядоченным. В области лимба обнаруживалось диффузное скопление мононуклеарных клеток и единичные расширенные сосуды краевой петлистой сети. Задняя пограничная мембрана выглядела несколько утолщенной и хорошо определялась на всем протяжении. Эндотелий роговицы сохранялся практически на всем протяжении и был представлен одним слоем пролиферирующих эпителиоцитов, за счет чего клетки имели кубическую форму. У животных группы сравнения клетки эпителия располагались в 6–7 слоев и имели кубическую форму. На поверхности эпителия обнаруживались очаговые отложения фибрина. В области лимба поверхностный слой эпителиоцитов характеризовался выраженными дистрофическими изменениями: клетки содержали в цитоплазме светлые вакуоли, оттеснявшие ядра к периферии. В передней трети стромы отмечалось уменьшение отека, коллагеновые волокна здесь располагались компактно. В задней части роговицы пучки коллагеновых волокон были расслоены отечной жидкостью и имели волнообразный ход. В собственном веществе роговой оболочки наблюдалась диффузная лимфомоноцитарная инфильтрация и тонкостенные новообразованные сосуды. Эндотелий роговицы представлял собой один ряд плоских клеток, местами был слущен. На 14-е сутки — у животных основной группы эпителий роговицы содержал 4–5 слоев плоских клеток. При этом эпителиоциты базального слоя имели кубическую форму, в ядрах единичных из них наблюдались митозы. Передняя пограничная мембрана определялась на всем протяжении. Строма роговицы содержала упорядоченно расположенные пучки коллагеновых волокон. Эндотелий был представлен одним слоем призматических клеток. У животных группы сравнения эпителий роговицы состоял из 4–5 слоев плоских клеток. Базальные эпителиоциты имели высокопризматическую форму и гиперхромные ядра. Передняя пограничная мембрана была гомогенной, несколько утолщенной. В задней трети стромы собственное вещество роговицы было гомогенным, при этом дифференцировать волокнистые структуры не представлялось возможным вследствие деструкции основного вещества. В области лимба в строме роговицы обнаруживались сосуды, некоторые из которых имели утолщенную стенку за счет циркулярного расположения гладких миоцитов, что свидетельствует о формировании артериол. Вокруг сосудов отмечались очаговые скопления лимфоцитов и моноцитов. Задняя пограничная мембрана хорошо визуализировалась. На 21-е сутки — у животных основной группы эпителий роговицы содержал 4–5 слоев плоских клеток. Эпителиоциты базального слоя имели кубическую форму, в ядрах единичных из них наблюдались митозы. Передняя и задняя пограничные мембраны определялись на всем протяжении. Строма роговицы имела нормальное строение и была представлена упорядоченно расположенными коллагеновыми волокнами. У животных группы сравнения эпителий роговицы имел нормальное строение. Передняя пограничная мембрана определялась на всем протяжении, однако была несколько утолщенной. На уровне передних двух третьих стромы отмечались активное образование коллагеновых волокон и новообразованные сосуды, в задней трети — сохранялись отек и гомогенизация волокон. Выводы. В ходе экспериментальных исследований установлено, что на фоне интрастромального введения аутологичных мононуклеаров крови значительно уменьшается продолжительность и выраженность воспаления, а также активизируется процесс регенерации поврежденных роговичных структур. Литература 1. Либман, Е. С. Слепота и инвалидность вследствие патологии органа зрения в России / Е. С. Либман, Е. В. Шахова // Вестн. офтальмол. — 2006. — № 1. — С. 35–37. 88 2. Майчук, Ю. Ф. Новое в эпидемиологии и фармакотерапии глазных инфекций / Ю. Ф. Майчук // Рус. мед. журн. — 2000. — № 1. — С. 48–52. 3. Мельников, В. Я. Гнойные поражения роговой оболочки — комплексная диагностика и методы лечения в современных условиях / В. Я. Мельников, Н. А. Шульгина // Современные методы диагностики и лечения заболеваний роговицы и склеры: cб. науч. тр. — М., 2007. — С. 311–313. 4. Мошетова, Л. К. Флоксал в терапии воспалительных заболеваний переднего отдела глаза / Л. К. Мошетова // Клиническая офтальмол. — 2002. — № 3. — С. 124. 5. Суркова, В. К. Лечение тяжелых активных процессов роговицы / В. К. Суркова, З. А. Даутова // Современные методы диагностики и лечения заболеваний роговицы и склеры: cб. науч. тр. — М., 2007. — С. 339–342. 6. Шаимова, В. А. Клинико-этиологические особенности различных типов лечения гнойной язвы роговицы / В. А. Шаимова // Вестн. офтальмол. — 2002. — № 1. — С. 39–41. В. Р. Мамиконян, С. В. Труфанов Автоматизированная эндотелиальная кератопластика с трансплантацией десцеметовой мембраны (DMAEK) ГУ «НИИ глазных болезней РАМН», г. Москва Современная эндотелиальная кератопластика является операцией выбора в лечении буллезной кератопатии. Эндотелиальная кератопластика позволяет удалять у больного и трансплантировать только вовлеченную в патологический процесс заднюю часть роговицы с пораженным эндотелиальным слоем. Чем меньше количество трансплантируемой ткани, тем меньше чужеродных антигенов передается реципиенту. Отсутствие швов между трансплантатом и собственной роговицей пациента уменьшает риск врастания сосудов в трансплантат и доставку иммунных клеток и комплексов по ним. Все это снижает риск реакции тканевой несовместимости, минимизирует выраженность послеоперационного астигматизма [1]. Одной из последних модификаций эндотелиальной кератопластики является трансплантация десцеметовой мембраны — Descemet's membrane endothelial keratoplasty (DMEK) [2–5]. Цель — оценка результатов автоматизированной эндотелиальной кератопластики с трансплантацией десцеметовой мембраны со стромальным кольцом (Descemet membrane automated endothelial keratoplasty — DMAEK) у больных с буллезной кератопатией. Материал и методы. Прооперированно 8 пациентов (8 глаз) в возрасте от 53 до 75 лет (средний возраст — 64,3±7,3). Срок наблюдения — до 1,5 лет. Из них 5 женщин, 3 мужчин. Все пациенты имели псевдофакичную буллезную кератопатию. У 4 из них ра89 нее была проведена экстракапсулярная экстракция катаракты с роговичным разрезом около 10 мм, в 4 случаях — факоэмульсификация. Острота зрения до операции с максимальной очковой коррекцией составляла 0,07±0,03. До операции сопутствующая компенсированная глаукома на комбинированном медикаментозном режиме имелась у 3 пациентов, у 1 из них ранее оперированная. Операцию выполняли следующим образом: микрокератомом Moria One срезали и удаляли переднюю часть роговицы на глубину около 370 µм 9–10 мм в диаметре. Затем корнеосклеральный лоскут укладывали эндотелием вверх. Под десцеметову мембрану вводили иглу 0,45 мм в диаметре (26 G) срезом вверх на шприце 2 мл с воздухом. Вкол осуществляли на крайней периферии роговицы и проводили иглу парацентрально до середины роговицы прямо под десцеметовой мембраной, стараясь не углубляться в строму. С определенным усилием воздух вводили под десцеметову мембрану до образования пузыря отслоенной мембраны около 7 мм в диаметре. Большее количество воздуха откачивали обратно в шприц, добиваясь спадения пузыря. На эндотелий роговицы наносили протектор эндотелиальных клеток. Корнеосклеральный лоскут переворачивали и устанавливали в искусственную переднюю камеру (Moria). Вакуумным трепаном 7 мм в диаметре делали насечку в пневматизированных задних слоях стромы на глубину около 150–200 µм. При помощи лезвия, ножниц и шпателя иссекали глубокие слои стромы отслоенные от десцеметовой мембраны. Извлекали лоскут из устройства. Вновь переворачивали его эндотелиальным слоем вверх и трепанировали при помощи вакуумного пробойника для донорской роговицы 9 мм в диаметре. Таким образом, получали трансплантат 9 мм в диаметре, где центральная часть 7 мм в диаметре, представляющая собой обнаженную десцеметову мембрану с эндотелием, была окружена каймой стромы роговицы шириной в 1 мм. Пациенту закапывали миотик. После ретробульбарной анестезии, акинезии, удаляли отечный эпителий роговицы, если отек затруднял четкий обзор передней камеры. Темпорально ножом 1,2 мм формировали тоннельный разрез на ширину лезвия, который начинался в 1 мм кнаружи от лимба. Устанавливали поддерживатель передней камеры через дополнительный разрез роговицы. Трепаном или специальным разметчиком намечали на передней поверхности роговицы круговую границу 8 мм в диаметре. Ножом для десцеметорексиса, введенным в переднюю камеру рассекали десцеметову оболочку по намеченной границе. Специальными скребцами десцеметова мембрана отслаивалась от стромы и удалялась из передней камеры. После расширения тоннельного разреза роговицы до 4 мм через сформированный доступ втягивали трансплантат в переднюю камеру при помощи цангового пинцета. Пинцет вводили в переднюю камеру через парацентез с противоположной доступу стороны роговицы. Трансплантат, как правило, практически полностью расправлялся в передней камере. Тоннельный разрез ушивали. В переднюю камеру под трансплантат вводили воздух, восполняющий камеру, полностью расправляющий и прижимающий трансплантат всей его передней поверхностью к строме роговицы. Затем осуществляли разглаживающие движения шпателем по передней поверхности роговицы для центрации трансплантата и эвакуции жидкости из интерфейса. Швы роговичного разреза удаляли через 2 недели. При задержке эпителизации применяли мягкие контактные линзы. Результаты и обсуждение. Прозрачное приживление трансплантата достигнуто у 7 пациентов (7 глаз) из 8 прооперированных (87 %). У одного пациента, несмотря на полное прилегание трансплантата к строме, после повторного введения воздуха, роговица оставалась отечной с буллами эпителия в течение 1,5 месяцев после операции. Вследствие 90 чего ему произведена рекератопластика по технологии DSAEK. Острота зрения через 3 месяца после операции без коррекции составляла 0,4±0,23, с максимальной очковой коррекцией — 0,66±0,15. Дополнительными причинами, снижающими остроту зрения, были: макулодистрофия — 1 глаз, глаукомная нейропатия — 3 глаза. Данные клинической рефракции и кератометрии через 3 месяца после операции, оставались стабильными в последующий период наблюдения. Величина астигматизма по данным рефрактометрии варьировала от 0,25 до 4,0 дптр, составляя в среднем 1,9±1,5 дптр. Сферический компонент варьировал в пределах от 0,75 до 2,5 дптр, составляя в среднем 1,8±0,77 дптр. Роговичный астигматизм был от 0,75 до 3,62 дптр. со средним значением 1,98±1,14 дптр. Наибольшая степень астигматизма наблюдалась у больных с достаточно протяженным (около 10 мм) рубцом роговицы у верхнего лимба после экстракапсулярной экстракции катаракты. Количество эндотелиальных клеток, по данным зеркальной и конфокальной микроскопии, через 6 месяцев после операции составляло в среднем 1854±238 и концу года снижалось до 1666 ±283 клеток/мм². Толщина роговицы через 6 месяцев после операции составляла от 472 до 560 µm (среднее 517,4±28,5µm). У обследуемой группы больных выявлены следующие ранние послеоперационные осложнения: — наличие ложной камеры (частичное отслоение трансплантата) на следующий день после операции отмечено у 5 пациентов из 8 прооперированных (68 %). Потребовалось повторное введение воздуха в переднюю камеру. В трех случаях — дважды; — задержка эпителизации отмечена на 1 глазу. Одета мягкая контактная линза, под которой роговица заэпителизировалась полностью к 4 суткам после операции; — у одного пациента, несмотря на полное прилегание трансплантата к строме, после повторного введения воздуха, роговица оставалась отечной с буллами эпителия в течение 1,5 месяцев после операции. Была произведена рекератопластика по технологии DSAEK. При подготовке трансплантата в 3 случаях произошел разрыв десцеметовой мембраны на этапе формирования воздушного пузыря. Такие трансплантаты отбраковывались. В одном случае отде- лить десцеметову мембрану воздухом удалось лишь частично. Выводы. Автоматизированная эндотелиальная кератопластика с трансплантацией десцеметовой мембраны со стромальным кольцом у больных с буллезной кератопатией (DMAEK) позволяет добиться высокой частоты прозрачного приживления трансплантата при низком риске реакции тканевой несовместимости. Преимуществами этой операции по сравнению с DSAEK являются лучшая острота зрения, меньшие сроки зрительной реабилитации, стабилизации рефракции. При этом сохраняется естественная толщина роговицы и ее архитектоника в центральной 7 мм зоне. Минимальное количество слоев роговицы трансплантата обеспечивает меньшую антигенную нагрузку. Потери эндотелиальных клеток незначительно выше чем, при DSAEK. Тем не менее процесс выкраивания трансплантата достаточно трудоемкий и сопряжен с высоким риском разрыва десцеметовой мембраны. Литература 1. Gorovoy, M. S. Descemet-stripping automated endothelial keratoplasty / M. S. Gorovoy // Cornea. — 2006. —Vol. 25. — № 8. — P. 886–889. 2. McCauley, M. B. Descemet membrane automated endothelial keratoplasty: hybrid technique combining DSAEK stability with DMEK visual results / M. B. McCauley, F. W. Jr. Price, M. O. Price // J. Cataract Refract. Surg. — 2009. — Vol. 35. — № 10. — P. 1659–1664. 3. Melles, G. R. A technique to excise the descemet membrane from a recipient cornea (descemetorhexis) / G. R. Melles, R. H. Wijdh, C. P. Nieuwendaal // Cornea. — 2004 — Vol. 23. — P. 286–288. 4. Melles, G. R. Descemet membrane endothelial keratoplasty (DMEK) / G. R. Melles, T. S. Ong, B. Ververs, J. van der Wees // Cornea. — 2006. — Vol. 25. — № 8. — P. 987–990. 5. Studeny, P. Descemet membrane endothelial keratoplasty with a stromal rim (DMEK-S) / P. Studeny, A. Farkas, M. Vokrojova // Br. J. Ophthalmol. — 2010. — Vol. 94. — № 7. — P. 909–914. В. Р. Мамиконян, С. В. Труфанов Автоматизированная эндотелиальная кератопластика с удалением десцеметовой мембраны (DSAEK) ГУ «НИИ глазных болезней РАМН», г. Москва. Эндотелиальная кератопластика является наиболее патогенетически ориентированной и наименее травматичной операцией при лечении буллезной кератопатии. Она включает в себя замещение вовлеченных в патологический процесс задних слоев роговицы и эндотелия при сохранении собственных передних слоев [1–6]. Цель — оценка результатов автоматизированной эндотелиальной кератопластики с удалением десцеметовой мембраны (DSAEK) у больных с буллезной кератопатией по собственной методике. Материал и методы. С 2007 по 2009 год прооперированно 26 пациентов (26 глаз) в возрасте от 53 до 84 лет. Из них 15 женщин, 11 мужчин. 21 пациент имел псевдофакичную буллезную кератопатию, 5 — дистрофию Фукса. Острота зрения до операции с максимальной очковой коррекцией составляла 0,029±0,03. До операции со91 путствующая глаукома на комбинированном медикаментозном режиме имелась у 5 пациентов, у 3 из них — ранее оперированная. Частичная нисходящая атрофия зрительного нерва выявлена у одного пациента, амблиопия — в одном случае. На авитреальном глазу кератопластика произведена у 1 больного. Операцию выполняли следующим образом: под эпибульбарной анестезией удаляли отечный эпителий роговицы. Дополнительно оценивали степень прозрачности передних слоев без эпителия. Закапывали миотик. При отсутствии значительных помутнений и неровностей передней поверхности приступали к выкраиванию трансплантата. Микрокератомом Moria One делали срез роговицы на глубину около 370 µм. Вакуумным пробойником для донорской роговицы 8,5 или 9,0 мм, в зависимости от размера роговицы пациента вы- краивали трансплантат задних слоев со стороны эндотелия. На эндотелий наносили небольшое количество протектора эндотелия роговицы. Через край стромальной части трансплантата проводили шов 10–0 с двумя длинными прямыми иглами длинной 16 мм для склеральной фиксации хрусталика. С диаметрально противоположной стороны трансплантата через край стромальной части проводили нейлоновый шов 10–0. После ретробульбарной анестезии, акинезии, если первым этапом операции не выполнялась факоэмульсификация с имплантацией ИОЛ, темпорально ножом 1,2 мм производили тоннельный разрез на ширину лезвия, который начинался в 1 мм кнаружи от лимба. В переднюю камеру вводили протектор эндотелия роговицы или устанавливали поддерживатель передней камеры через дополнительный разрез роговицы. Трепаном или специальным разметчиком намечали на передней поверхности роговицы круговую границу 8,5 или 9 мм в диаметре в зависимости от размера трансплантата. Ножом для десцеметорексиса, введенным в переднюю камеру проводили разрез десцеметовоой оболочки немного кнутри от намеченной границы, чтобы в дальнейшем трансплантат несколько перекрывал ту зону, где удалена десцеметова мембрана. Специальными скребцами десцеметова мембрана с пораженным эндотелием отслаивалась от стромы и удалялась из передней камеры. По периферии десцеметорексиса со стороны передней камеры осуществляли некоторое разволокнение стромальной поверхности для лучшей адгезии трансплантата. Тоннельный разрез роговицы расширяли до 5 мм. Обе длинные иглы, расположенные на концах одной нити, ранее проведенной через край трансплантата, поочередно вводили в переднюю камеру глаза через тоннельный разрез, вкалывали в роговицу со стороны передней камеры рядом друг с другом в проекции намеченной на передней поверхности круговой границы, на стороне диаметрально противоположной тоннельному разрезу. Выкол игл осуществляли на переднюю поверхность роговицы. Протектор эндотелия тщательно вымывался из передней камеры. Посредством натяжения этого шва трансплантат втягивали в переднюю камеру через тоннельный разрез. Иглы другого нейлонового шва аналогичным образом вкалывали со стороны передней камеры и выкалывали на переднюю поверхность роговицы по намеченной круговой границе на стороне тоннельного разре92 за. Оба шва натягивали без значительного усилия (патент 2365360). Трансплантат, как правило, практически полностью расправлялся и центрировался. Тоннельный разрез ушивали. В переднюю камеру под трансплантат вводили воздух, восполняющий камеру и прижимающий трансплантат всей его передней поверхностью к строме роговицы. Парацентрально выполняли дренирюущие разрезы роговицы и осуществляли разглаживающие движения шпателем от центра к периферии роговицы для эвакуции жидкости из интерфейса. Швы, фиксирующие трансплантат, удаляли через 2–4 дня после оперции, а швы тоннельного разреза — через 2 недели. При задержке эпителизации применяли мягкие контактные линзы. Результаты и обсуждение. Прозрачное приживление трансплантата достигнуто у 25 пациентов (25 глаз) в 96 %. Реакция тканевой несовместимости, возникшая через 1 год после операции, привела к необратимому отеку роговицы на одном глазу, где впоследствии была произведена реокератопластика. Острота зрения через 6 месяцев после операции в среднем без коррекции составляла 0,34±0,19, с максимальной очковой коррекцией — 0,47±0,21. Дополнительными причинами, снижающими остроту зрения, были: макулодистрофия — 3 глаза, глаукомная нейропатия — 3 глаза, амблиопия — 1 глаз, вторичная катаракта — 3 глаза, частичная нисходящая атрофия зрительного нерва — 1, облачковидные центральные помутнения в передних слоях стромы — 2. Величина астигматизма по данным рефрактометрии варьировала от 0,5 до 6,0 дптр, составляя в среднем 2,07±1,38 дптр. Сферический компонент варьировал в пределах от 0 до 5,25 дптр, составляя в среднем 1,63±,32 дптр. Роговичный астигматизм составил от 0,3 до 6,25 дптр. со средним значением 1,64±0,87 дптр. Количество эндотелиальных клеток по данным зеркальной и конфокальной микроскопии через 6 месяцев после операции составляло в среднем 1996±275 и концу года было 1746±447, через 2 года — 1484±268 клеток/ мм². Толщина роговицы через 6 месяцев после операции — от 571 до 680 µm (среднее 636,8±29,8µm). У обследуемой группы больных выявлены следующие послеоперационные осложнения: — наличие ложной камеры (частичное отслоение трансплантата) у 5 пациентов (19 %) на следующий день после операции. В четырех случаях для поддержания передней камеры использовался про- тектор эндотелия. Потребовалось повторное введение воздуха в переднюю камеру и дополнительная эвакуация жидкости, возможно остатков протектора, через дренирующие разрезы роговицы. У одного пациента на авитреальном глазу повторно был введен уже перфторциклобутан. — задержка эпителизации отмечена на 5 глазах (19 %). При отсутствии полной эпителизации в срок 5–7 дней после операции одевалась мягкая контактная линза, способствовавшая полной эпителизации роговицы в течение 3–5 суток. — гипертензия в раннем послеоперационном периоде у 3 пациентов купировалась назначением гипотензивного режима. У одного пациента с ранее дважды оперированной глаукомой на медикаментозном режиме через 3 недели после операции наступила декомпенсация внутриглазного давления. Компенсация внутриглазного давления была достигнута после усиления гипотензивного режима и сокращения инстилляций стероидов. Выводы. Автоматизированная эндотелиальная кератопластика с удалением десцеметовой мембраны (DSAEK) у больных с буллезной кератопатией позволяет добиться высокой частоты прозрачного приживления трансплантата при низком риске реакции тканевой несовместимости. Неоспоримыми преимуществами такой операции являются минимальные нарушения кривизны передней поверхности роговицы, сохранение иннервации передних слоев, отсутствие длительной шовной фиксации, и связанных со швами осложнений. К преимуществам методики следует также отнести относительно короткий период реабилитации и несложное выполнение реоперации при неудаче. Потери эндотелиальных клеток сопоставимы с результатами сквозной кератопластики. Предложенный способ временной шовной фиксации трансплантата обеспечивает его надежную адаптацию, предотвращая дислокацию в переднюю камеру, что по данным литературы является наиболее частым послеоперационным осложнением. Литература 1. Gorovoy, M. S. Descemet-stripping automated endothelial keratoplasty / M. S. Gorovoy // Cornea. — 2006. —Vol. 25. — № 8. — P. 886–889. 2. Melles, G. R. J. Sutureless, posterior lamellar keratoplasty / G. R. J. Melles, F. Lander, C. Nieuwendaal // Cornea. — 2002. — Vol. 21. — P. 325–327. 3. Melles, G. R. A technique to excise the descemet’s membrane from a recipient cornea (descemetorhexis) / G. R. Melles, R. H. Wijdh, C. P. Nieuwendaal // Cornea. — 2004. — Vol. 23. — P. 286–288. 4. Price, F. W. Descemet’s stripping with endothelial keratoplasty in 50 eyes: A refractive neutral corneal transplant / F. W. Price, M. O. Price // J. Refract. Surg. — 2005. — Vol. 21. — P. 339–345. 5. Price, F. W. Descemet’s stripping with endothelial keratoplasty in 200 eyes: Early challenges and technique to enhance donor adherence / F. W. Price, M. O. Price // J. Cataract Refract. Surg. — 2006. — Vol. 32. — P. 411–418. 6. Terry, M. A. Rapid visual rehabilitation with deep lamellar endothelial keratoplasty / M. A. Terry, P. J. Ousley // Cornea. — 2004. — Vol. 23. — P. 143–153. В. Р. Мамиконян, С. В. Труфанов Обратная грибовидная кератопластика в хирургическом лечении буллезной кератопатии ГУ «НИИ глазных болезней РАМН», г. Москва Для лечения буллезной кератопатии операцией выбора является на сегодняшний день эндотелиальная кератопластика [3]. Операция позволяет добиться достаточно высокой остроты зрения. Тем не менее, по мнению некоторых авторов, даже при современной технике выполнения эндотелиальной кератопластики имеет место снижение прозрачности роговицы на уровне интерфейса (поверхности соприкосно93 вения ложа и трансплантата), что может несколько ухудшать остроту зрения. Кроме того, одним из необходимых условий проведения задней послойной кератопластики является достаточная прозрачность передних слоев роговицы пациента. Поэтому в ряде случаев повышения остроты зрения можно добиться, только выполнив сквозную кератопластику, удалив помутневшие передние слои роговицы пациента. В 2003 г. M. Busin описал технику выполнения, так называемой, послойно-сквозной — мануальной обратной грибовидной кератопластики при лечении больных с декомпенсацией эндотелия, в том числе при помутнении передних слоев [2]. Данная операция включала в себя оптические преимущества сквозной кератопластики, т. к. не предусматривала расслоение роговицы в ее оптической зоне, при этом достигалась более надежная адаптация послеоперационной раны, профиль которой способствовал самогерметизации под воздействием внутриглазного давления. Ранее в отечественной литературе описывалась обратная грибовидная кератопластика [1], но ее техника была слишком сложна и несовершенна. Данная работа посвящена первому опыту выполнения мануальной грибовидной кератопластики в варианте, предложенном профессором M. Busin. Цель — оценка результатов мануальной обратной грибовидной кератопластики у больных с буллезной кератопатией. Материал и методы. С февраля по ноябрь 2008 г. нами было прооперированно 7 пациентов (7 глаз) в возрасте от 52 до 78 лет. 6 пациентов имели псевдофакичную буллезную кератопатию. В двух случаях буллезная кератопатия на артифакичном и факичном глазах развилась после рецидивируещего герпетического кератита. Острота зрения до операции в среднем составляла 0,014±0,01. Сопутствующая глаукома имелась у 4 больных (4 глаза). Из них: у 2 пациентов в анамнезе имелась оперированная компенсированная глаукома 2 стадии, у 1 наблюдалась декомпенсация внутриглазного давления на максимальном медикаментозном режиме. На 3 глазах имелась артифакия с переднекамерной ИОЛ, в одном случае с дислокацией. Операцию выполняли следующим образом: после проведения ретробульбарной анестезии, акинезии вакуумным трепаном 7 мм в диаметре производили циркулярную насечку роговицы реципиента на глубину 300µм. Концентрично насечке наносили на передней поверхности роговицы круговую разметку 9 мм в диаметре. Круглым ножом расслаивали роговицу из основания насечки к лимбу несколько дальше проекции 9 мм разметки. Оттуда лезвием ножа проникали в переднюю камеру. Роговичные ножницы вводили в образованный периферический карман и производили иссечение донорского диска, разрезая задние слои роговицы по проекции 9 мм метки. Таким образом, формиро94 вался обратный грибовидный профиль разреза. На донорском глазу делали насечку на глубину 300µм вакуумным трепаном 7 мм в диаметре. Круглым ножом расслаивали роговицу из основания насечки к лимбу. Выкроенный роговичный корнеосклеральный лоскут центрировался в вакуумном пробойнике для донорской роговицы 9 мм в диаметре. Со стороны эндотелия пробивался диск роговицы 9 мм. Предварительно расслоенный на периферии роговичный диск на глубине 300 µм позволял пинцетом удалить периферическое кольцо передних слоев стромы 1 мм шириной. Таким образом, формировался трансплантат обратного грибовидного профиля. Этот трансплантат состоял из центральной части 7 мм в диаметре, которая включала все слои роговицы, и, окружающей ее, периферической, влючающей задние слои стромы, десцеметову мембрану и эндотелий, шириной 1 мм. Трансплантат укладывали в подготовленное ложе, фиксировали узловыми провизорными, а затем непрерывным швом 10–0. Швы проводили на глубину 300 µм, тo есть так, чтобы они не проходили через периферическую заднюю часть трансплантата. Затягивали с умеренным натяжением. Если передняя камера не восстанавливалась в ходе операции самостоятельно, ее восстанавливали через парацентез физиологическим раствором. В комбинации с кератопластикой выполнена замена переднекамерной ИОЛ на заднекамерную со склеральной фиксацией у 3 пациентов, экстракапсулярная экстракция катаракты с имплантацией заднекамерной ИОЛ у 1 пациента, трабекулэктомия с амниотическим вкладышем под склеральный лоскут у 1 больного [2]. Непрерывный шов удаляли через 4 — 5 месяцев после операции. Результаты и обсуждение. Во всех случаях (7 глаз) отмечено прозрачное приживление трансплантата, отсутствовали признаки реакции тканевой несовместимости на протяжении всего периода наблюдения. Острота зрения через 2 месяца после удаления непрерывного шва, фиксирующего трансплантат, составила в среднем 0,20±0,23 без коррекции, а с максимальной очковой коррекцией — 0,39±0,19. Дополнительными причинами, снижающими остроту зрения, явилась глаукомная оптическая нейропатия — 2 пациента, частичная атрофия зрительного нерва — 1 больной, амблиопия — 1 пациент. Величина астигматизма по данным рефрактометрии варьировала от 1,25 до 8,0 дптр, составляя в среднем 4,48±2,14 дптр. Сферический компонент составил от 0,75 до 4,0 дптр, в среднем 2,23±1,22 дптр. Роговичный астигматизм варьировал от 2,4 до 8,2 дптр. со средним значением 4,74±1,88 дптр. Количество эндотелиальных клеток, по данным зеркальной микроскопии, к 6 месяцам после операции составляло от 1900 до 2980, в среднем 2436±354 клеток/мм², к концу года — от 1600 до 2650, в среднем 2195±387 клеток/мм², через 2 года — от 1506 до 2430, в среднем 1958±369. Толщина роговицы в центре через 1 год после операции — от 530 до 607 µm (среднее 575±29,6µm). У обследуемой группы больных выявлены следующие послеоперационные осложнения: — передняя плоскостная синехия сформировалась у пациента с ранее оперированной компенсированной на медикаментозном режиме глаукомой. На максимальном медикаментозном режиме при отсутствии компенсации через 1,5 месяца после кератопластики имплантирован клапанный дренаж Ahmed. Выводы. Мануальная обратная грибовидная кератопластика у больных с буллезной кератопатией позволяет добиться прозрачного приживления трансплантата с высокой частотой. Период послеоперационной реабилитации при данном способе проведения операции значительно короче, чем при сквозной кератопластике, герметизация операционной раны надежнее. Потери эндотелиальных клеток меньше. В тоже время, рефракционные нарушения сопоставимы. В отличие от эндотелиальных кератопластик можно оперировать пациентов с помутнениями передних слоев роговицы. Доступ «открытое небо» является более удобным для сочетанных интраокулярных процедур на переднем отрезке глаза. При перечисленных преимуществах необходимо учесть, что на операцию требуется большее количество времени, чем на сквозную кератопластику. Сформировать ложе в роговице реципиента, четко соответствующее трансплантату, не всегда легко. Литература: 1. Дронов, М. М. Руководство по кератопластике / М. М. Дронов. — СПб., 1997. — С. 82–113. 2. Busin, M. A new lamellar wound configuration for penetrating keratoplasty surgery / M. Busin //Arch. Ophthalmol. — 2003. — Vol.121. — № 2. — P. 260–265. 3. Gorovoy, M. S. Descemet-stripping automated endothelial keratoplasty / M. S. Gorovoy // Cornea. —2006. —Vol. 25. — № 8. — P. 886–889. В. Р. Мамиконян, С. В. Труфанов Частичная обратная грибовидная кератопластика в лечении буллезной кератопатии ГУ «НИИ глазных болезней РАМН», г. Москва Обратная грибовидная кератопластика является более патогенетически ориентированной операцией, по сравнению с традиционной сквозной кератопластикой в хирургическом лечении буллезной кератопатии при наличие необратимых изменений в передних отделах стромы. Обратная грибовидная кератопластика позволяет пересаживать большее количество эндотелиальных клеток при сходном объеме трансплантируемой ткани передних слоев [1]. Существует вариант так называемой частичной обратной грибовидной кератопластики (Half-top-hat). В этой операции сочетался традиционный для сквозной керато95 пластики вертикальный профиль разреза у реципиента и трансплантат в форме обратного гриба [2, 3]. Цель — оценка результатов мануальной частичной обратной грибовидной кератопластики у больных с буллезной кератопатией. Материал и методы. С 2009 по 2010 год нами прооперированно 30 пациентов (30 глаз) в возрасте от 18 до 88 лет. По тяжести состояния переднего отрезка глаза всем этим пациентам задняя кератопластика, по нашему мнению, была противопоказана. У них имелись значительные помутнения в стромальных слоях роговицы с захватом оптического центра или присутствовали протяженные передние синехии, передняя камера была мелкой. Острота зрения до операции в среднем составляла 0,02±0,02. 23 пациента имели буллезную кератопатию на артифакичном глазу. На 6 глазах имелась артифакия с переднекамерной ИОЛ, у двух больных афакия, в одном случае — дислокация заднекамерной ИОЛ с разрывом капсулы хрусталика. В двух случаях буллезная кератопатия развилась после рецидивирующего герпетического кератита. У 4 больных отмечен рецидив буллезной кератопатии на трансплантате. Сопутствующая глаукома 2–4 стадии на медикаментозном режиме имелась у 11 больных (11 глаза). Из них: у 4 пациентов — ранее оперированная. Отсутствие компенсации внутриглазного давления на максимальном режиме отмечено у 2 пациентов. Операцию выполняли следующим образом. На донорском глазу делали насечку на глубину 400µм вакуумным трепаном 7 мм в диаметре. Круглым ножом расслаивали роговицу из основания насечки на этой глубине к лимбу. Выкроенный роговичный корнеосклеральный лоскут переворачивали эндотелием вверх, устанавливали и центрировали в вакуумном пробойнике для донорской роговицы. Со стороны эндотелия пробивался диск роговицы 9 мм в диаметре на всю толщину роговицы. Предварительно расслоенный на периферии роговичный диск на глубине 400 µм позволял пинцетом удалить периферическое кольцо передних слоев стромы 1 мм шириной. Таким образом, формировался трансплантат обратного грибовидного профиля. Этот трансплантат состоял из центральной части 7 мм в диаметре, которая включала все слои роговицы, и, окружающей ее, периферической, включающей задние слои стромы, десцеметову мембрану и эндотелий, шириной 1 мм. У реципиента после проведения ретробульбарной анестезии, акинезии вакуумным трепаном 7 мм в диаметре делали разрез роговицы на всю ее толщину как при традиционной сквозной кератопластике. Разрез завершали при помощи роговичных ножниц. Трансплантат укладывали в подготовленное ложе, заправляя периферическую часть, включающую задние слои стромы, десцеметову мембрану и эндотелий, шириной 1 мм в переднюю камеру. Трансплантат фиксировали узловыми провизорными, а затем непрерывным швом 10–0 к роговице реципиента. Швы проводили на глубину 400 µм, тo есть так, чтобы они не проходили через периферическую заднюю часть трансплантата. Затяги96 вали с умеренным натяжением. Периферическая задняя часть трансплантата прилегала к десцеметовой мембране роговичного козырька реципиента. В комбинации с кератопластикой была выполнена замена 6 переднекамерных и одной дислоцированной заднекамерной ИОЛ на заднекамерную со склеральной фиксацией у 7 пациентов, вторичная имплантация заднекамерной ИОЛ со склеральной фиксацией произведена у 2 пациентов, экстракапсулярная экстракция катаракты с имплантацией ИОЛ в капсульный мешок — у 3 больных, трабекулэктомия с амниотическим вкладышем под склеральный лоскут у 2 пациентов. Также выполняли переднюю витрэктомию и пластику радужки с формированием зрачка. Непрерывный шов удаляли через 4–5 месяцев после операции. Результаты и обсуждение. Прозрачное приживление трансплантата получено у 22 больных (73 %). Острота зрения через 2 месяца после удаления непрерывного шва, фиксирующего трансплантат, составила в среднем 0,25±0,15 без коррекции, а с максимальной очковой коррекцией 0,36±0,17. Дополнительными причинами, снижающими остроту зрения, явилась глаукомная оптическая нейропатия — 5 пациентов, частичная атрофия зрительного нерва — 1 больной, амблиопия — 1 пациент, макулодистрофия — 6. Величина астигматизма через 2 месяца после удаления непрерывного шва по данным рефрактометрии варьировала от 2,5 до 9,0 дптр, составляя в среднем 4,7±2,29 дптр. Сферический компонент был в пределах от 0,25 до 4,0 дптр, составляя в среднем 2,0±1,4 дптр. Роговичный астигматизм варьировал от 2,0 до 9,87 дптр. со средним значением 5,2±2,2 дптр. Количество эндотелиальных клеток, по данным зеркальной микроскопии, к 6 месяцам после операции составляло от 2098 до 2900, в среднем 2490±293 клеток/мм², к концу года — от 1878 до 2735, в среднем 2241±344 клеток/мм², через 2 года — от 1774 до 2570, в среднем 2189±399. Толщина роговицы в центре через 1 год после операции в среднем имела значение 485±31µm. У обследуемой группы больных выявлены следующие послеоперационные осложнения: — реакция тканевой несовместимости развилась у 5 пациентов в сроки от 3 до 6 месяцев. В 4 случаях реакция носила необратимый характер и, несмотря на активное медикаментозное лечение, привела к помутнению трансплантата. В 1 случае на фоне активного местного применения стероидов и назначения циклоспорина внутрь по схеме реакция тканевой несовместимости была купирована. — послеоперационная гипертензия отмечена у 7 пациентов. В 6 случаях она была купирована назначением гипотезивного медикаментозного режима. У одной пациентки со щелевидной передней камерой и высоким послеоперационным внутриглазным давлением выполнена пункция стекловидного тела и восстановлена передняя камера. — вторичная глаукома выявлена у двух пациентов. В одном случае декомпенсация внутриглазного давления на максимальном медикаментозном режиме произошла через пол года у пациентки с предшествующей кератопластике вторичной компенсированной глаукомой. В другом случае сформированная передняя плоскостная синехия привела к декомпенсации внутриглазного давления через 1 год после кератопластики. У этих больных проведены антиглаукоматозные операции с дренажом. Через 2 месяца после антиглаукоматозного вмешательства рецидив буллезной кератопатии отмечен у одного пациента. — у одной пациентки через 3 месяца после операции выявлен грибковый кератит, устойчивый к медикаментозному лечению. Была выполнена лечебная рекератопластика. Выводы. Мануальная частичная обратная грибовидная кератопластика у больных с буллезной кератопатией позволяет добиться прозрачного приживления трансплантата с высокой частотой. Период послеоперационной реабилитации при данном способе проведения операции значительно короче, чем при сквозной кератопластике. Герметизация операционной раны надежнее. Потери эндотелиальных клеток меньше. В тоже время, рефракционные нарушения сопоставимы. В отличае от задних кератопластик можно оперировать пациентов с помутнениями передних слоев роговицы. Доступ «открытое небо» является более удобным для сочетанных интраокулярных процедур на переднем отрезке глаза. Выполнить частичную обратную грибовидную кератопластику существенно легче, чем обратную грибовидную кератопластику. Времени на нее требуется практически столько же, как на традиционную сквозную кератопластику. Измененный профиль задней поверхности роговицы на периферии в радиусе 7–9 мм после операции, по нашему опыту, существенно не повышает риск образования передних синехий в сравнении с традиционной сквозной кератопластикой. Литература 1. Busin, M. A new lamellar wound configuration for penetrating keratoplasty surgery / M. Busin //Arch. Ophthalmol. — 2003. — Vol. 121. — № 2. — P. 260–265. 2. Kaiserman, I. Half-top-hat — a new wound configuration for penetrating keratoplasty / I. Kaiserman, I. Bahar, D. S. Rootman // Br. J. Ophthalmol. — 2008. — Vol. 92. — № 1. —P. 143–146. 3. Kaiserman, I. Half top hat wound configuration for penetrating keratoplasty: 1-year results / I. Kaiserman, I. Bahar, A. R. Slomovic, D. S. Rootman // Br. J. Ophthalmol. — 2009. —Vol. 93. — № 12. —P. 1629–1633. Л. Р. Марванова, З. Р. Марванова, З. Р. Муслимова КОЛИЧЕСТВО ЭНДОТЕЛИОЦИТОВ РОГОВИЦЫ ПОСЛЕ ФАКОЭМУЛЬСИФИКАЦИИ КАТАРАКТЫ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Эндотелий роговицы человека — одна из важнейших в функциональном отношении составных частей роговой оболочки. Изучению эндотелия посвящены многочисленные исследования [2–5]. В настоящее время в связи с внедрением новых технологий в хирургии роговицы, а также с расширением возможностей функциональной диагностики, инте97 рес ученых к данной проблеме нарастает. Сегодня важно не просто выполнить стандартную операцию, например, экстракцию катаракты, а достичь и сохранить высокий оптический результат на все последующие годы жизни пациента [1]. Обнаружено, что плотность эндотелиальных клеток роговицы (ПЭК) у человека неуклонно па- дает с возрастом. В 18–50 лет ПЭК в среднем колеблется от 2600 до 4000 кл/мм2, у лиц старше 80 — от 900 до 1400 кл/мм2, при этом имеются значительные вариации плотности клеток у каждого индивидуума в любой возрастной группе [5]. По данным различных авторов, в пласте эндотелия погибает от 0,4 до 0,7 % клеток в год [3, 4]. К моменту рождения эндотелий, в основном, представлен клетками гексагональной формы, одинаковыми по размеру и расположенными равномерно по всей роговице. К 30 годам клеток шестигранной формы становится 70 %. Гексагональная форма клеток наиболее благоприятна, так как они обладают меньшим поверхностным натяжением и более стабильны в пласте [2]. Цель — провести сравнительный анализ количества эндотелиоцитов роговицы у пациентов до и после проведения факоэмульсификации катаракты с целью прогноза развития дистрофии роговицы. Материал и методы. Проведено обследование 35 пациентов (35 глаз) со зрелой возрастной катарактой до и после выполнения факоэмульсификации катаракты c имплантацией заднекамерной интраокулярной линзы в Уфимском НИИ глазных болезней в период с 2010 г. по 2011 г. Мужчин было 16 (45,7 %), женщин — 19 (54,3 %). Возраст пациентов варьировал от 42 до 83 лет. У всех пациентов до и после операции (через 2 недели, 1, 3, 6 и 12 месяцев) было проведено исследование содержания эндотелиоцитов роговицы с помощью роговичной насадки лазерного сканирующего томографа Heidelberg Retinal Tomographer HRT-III («Heidelberg Engineering», Германия). Всем пациентам в послеоперационном периоде назначали традиционную медикаментозную терапию, включающую антибактериальные, противовоспалительные препараты, стимуляторы регенерации роговицы. При проведении анализа не включили в группу исследования пациентов с осложненными формами развития катаракты и сопутствующей патологией. Группу контроля составили парные интактные глаза тех же пациентов (35 глаз). Сроки наблюдения составили от 2 недель до 12 месяцев после ФЭК. Результаты и обсуждение. Острота зрения перед операцией у 16 (46 %) пациентов была в пределах от светоощущения с правильной проекцией света до 0,01, у 8 (23 %) — от 0,02 до 0,04, у 6 (17 %) — от 0,05 до 0,08 и у 5 (14 %) — от 0,09 до 0,2. В ходе выполнения факоэмульсификации катаракты с имплантацией интраокулярной линзы осложнений отмечено не было. В послеоперационном периоде острота зрения от светоощущения с правильной проекцией света до 0,03 была достигнута у 2 (5,7 %) пациентов, от 0,04 до 0,09 — у 5 (14,3 %), от 0,1 до 0,4 — у 9 (26 %) и от 0,5 до 0,8 у 11 (31 %) и от 0,9 до 1,0 — у 8 (23 %) пациентов. Низкая острота зрения в послеоперационном периоде у 7 (20 %) пациентов была связана с дистрофическими изменениями на сетчатке, которые обнаружились в послеоперационном периоде. В зависимости от возраста, пациенты были разделены на 5 групп исследования: 1 группа — пациенты в возрасте от 41 до 50 лет (6 человек), 2 группа — 51–59 лет (7 человек), 3 группа — 60–69 лет (7 человек), 4 группа — 70–79 лет (10 человек), 5 группа — 80–86 лет (5 человек). Во всех группах исследования количество эндотелиальных клеток до операции и в группе контроля соответствовало возрастной норме (табл.). В 1 группе исследования количество эндотелиальных клеток через 1 месяц после операции снизилось на 7,2 %. В течение первого полугодия потеря эндотелиоцитов происходила равномерно и соста- Количество эндотелиоцитов роговицы до и после факоэмульсификации катаракты Группа исследования Возраст Группа контроля (кл/мм2) 1 2 3 4 5 41–50 51–59 60–69 70–79 80–86 2488 2431 2379 2105 1890 Количество эндотелиоцитов После ФЭК ( % потери эндотелиоцитов) До операции (кл/мм2) ч/з 2 нед. ч/з 1 мес 2451 2401 2330 2130 1845 4,2 % 12,5 % 19,6 % 24,5 % 27,7 % 3 % 11 % 11,5 % 16,7 % 17,8 % * — достоверность различия (p≤ 0,05) 98 ч/з 3 мес. ч/з 6 мес. 2,1 % 2,4 % 3,5 % 4,2 % 7,4 % 2 % 2,7 % 3,2 % 3,6 % 4,1 % ч/з через 1 год 12 мес. п/е ФЭК 0,9 % 1,5 % 1,5 % 1,8 % 2,1 % 12,2 % 30,1 % 39,3 % 50,8 % 59,1 % вила 11,3 %, во втором полугодии потеря эндотелиоцитов значительно уменьшилась, была в пределах 0,9 % и не превышала значений физиологической нормы. Во 2 и 3 группах наблюдения, у пациентов в возрасте от 51 до 69 лет в течение 1 месяца после ФЭК снижение количества эндотелиальных клеток было достоверно выше (p≤0,05) по сравнению с первой группой наблюдения и варьировало в пределах от 23,5 до 31,1 %. В течение последующих 11 месяцев в обеих группах наблюдения снижение уровня эндотелиоцитов было существенно меньше (p≤0,05) по сравнению с 1 группой наблюдения и не превысило значений физиологической убыли клеток эндотелия, составляя 0,7–0,9 % ежемесячно. Общая ПЭК в течение 1 года после операции у пациентов в возрасте от 51 до 69 лет составила в среднем 34,7 % от физиологической нормы. В 4 группе наблюдения ПЭК в течение 1 месяца после ФЭК снизилась на 41,2 %, в последующие 3 месяца количество эндотелицитов снижалось в среднем ежемесячно на 6,9 %. Во втором полугодии после ФЭК снижение количества эндотелиоцитов было незначительным и не превысило значений физиологической убыли клеток. В среднем ежемесячно потери составляли 0,9 %. В 5 группе наблюдения, где возраст пациентов был 80 лет и старше, была отмечена максимальная потеря эндотелиоцитов как в течение первого месяца после ФЭК — 45,5 %, так и в последующие 3 месяца после операции, в среднем ежемесячно — 8,4 %. Во втором полугодии гибель эндотелиоцитов ежемесячно в среднем составляла 1 %. При проведении анализа результатов факоэмульсификации было выявлено, что в течение года после операции ни у кого из пациентов 1 группы не было отмечено развития дистрофии роговицы. Во 2 и 3 группах наблюдения развитие вторичной дистрофии роговицы через 3 месяца после операции наблюдалось у 1 (2,8 %) пациента. В 4 и 5 группе наблюдения дистрофические изменения в роговице наблюдались у 5 (14,3 %) пациентов в сроки от 2 недель до 1 месяца после ФЭК. Таким образом, во всех группах исследования послеоперационное снижение количества эндотелиоцитов превышает значения физиологической убыли клеток в зависимости от возраста. Минимальная потеря эндотелиоцитов наблюдалась у пациентов в возрасте от 41 до 50 лет, максимальная — у лиц старше 80 лет. У пациентов в возрасте от 41 до 70 лет стабилизация процесса наступила в течение 1 месяца после факоэмульсификации катаракты, тогда как у пациентов старше 80 лет — в течение 3 месяцев после выполнения операции. Вывод. Количественные изменения эндотелиоцитов роговицы напрямую зависят от возраста пациента, что позволяет осуществлять дифференцированный подход к выбору хирургического лечения катаракты. Литература 1. Baradara, A. Effect of hydrodynamic parameters on corneal endothelial cell loss after phacoemulsification / A. Baradara, [et al.] // J. Cataract Refract. Surg. — 2009. — Vol. 35. — P. 732–737. 2. Carloson, K. H. Variations in Human Corneal Endothelial Cell Morphology and permeability to Fluorescein with age / K. H. Carloson [et al.] // Exp. Eye Res. — 1988. — Vol. 47. — P. 27–41. 3. Kaufman, H. E. Endothelial damage from intraocular lens insertion / H. E. Kaufman [et al.] // Invest. Ophthalmol. Vis. Sci. — 1976. — Vol. 15. — P. 996–1000. 4. Laule, A. Endothelial Cell Population Changes of Human Cornea During Life / A. Laule [et al.] // Arch. Ophthalmol. — 1978. — Vol. 6. — P. 2031–2035. 5. Sperling, S. Estimates of endothelial cell densities in whole human eys and excised corneas / S. Sperling // Cornea. — 1986. — Vol. 5. — № 1. — P. 15–18. 6. Waring, G. O. The Corneal Endothelium / G. O. Waring [et al.] // Ophthalmology. — 1982. — Vol. 89. — № 6. — P. 531–590. 99 А. М. Нугуманова, Г. Х. Хамитова СОСТОЯНИЕ ВЕГЕТАТИВНОЙ НЕРВНОЙ СИСТЕМЫ У ПАЦИЕНТОВ С МИОПИЧЕСКОЙ РЕФРАКЦИЕЙ Казанский государственный медицинский университет, г. Казань, Республика Татарстан Одной из распространенных причин снижения зрения у человека является миопия [8, 9, 10]. Однако до настоящего времени нет однозначного ответа на вопрос о происхождении этой патологии. Среди множества причин развития близорукости ряд исследователей рассматривают стресс [1, 3–5]. Согласно теории Г. Селье [6], первая стадия стрессового процесса — «реакция тревоги». Наиболее распространенной методикой, позволяющей дифференцированно измерять тревожность и как личностное свойство, и как состояние, является методика, предложенная Ч. Д. Спилбергером. На русском языке его шкала была адаптирована Ю. Л. Ханиным [10]. Для определения выраженности типа ВНС применялся баллированный вегетативный опросник А. М. Вейна [2]. Цель — изучить типы вегетативной нервной системы у студентов с различными видами рефракции, а так же характер их устойчивости к стрессу. Задачи исследования: 1. Изучить характер и распространенность клинической рефракции у студентов 5 курса педиатрического факультета Казанского медицинского университета. 2. На основании данных анкетирования проанализировать преобладающий тип ВНС у студентов с эмметропией и миопией. 3. Изучить и сравнить уровни реактивной и личностной тревожности у студентов с эмметропией и миопией. Материал и методы. В исследовании приняли участие 70 студентов 5 курса педиатрического факультета КГМУ в возрасте от 21 до 28 лет (средний возраст — 22,3 г.). Первоначально методом автокераторефрактометрии у них был установлен вид клинической рефракции. Лица с эмметропией и миопией ответили на вопросы, содержащиеся в тесте Вейна для выявления у них преобладающего типа ВНС. Затем этим же студентам был предложен опросник Спилбергера для выявления у них уровня тревожности. Результаты и обсуждение. По результатам тестирования были сформированы 2 группы студентов: 1 группу составили учащиеся с миопической рефракцией (49,3 %); 2 группу — учащиеся с эмметропической рефракцией (50,7 %). На следующем этапе, на основании опросника Вейна были изучены типы ВНС в каждой из образованных студенческих групп. Так, среди миопов Рис. 1. Уровни ситуативной тревожности в зависимости от вида рефракции 100 только 2,9 % студентов оказались симпатикотониками, 11,4 % были ваготониками и 85,7 % — нормотониками. Среди эмметропов преобладали студенты с нормотоническим типом ВНС (97,2 %) и меньше всего оказалось ваготоников — 2,8 %, симпатикотоников среди них не оказалось. Анализируя данные об уровне ситуативной тревожности, полученные при анкетировании по опроснику Спилбергера, было установлено, что невысокие уровни тревожности (низкая и умеренная) более характерны для эмметропов: на 6,4 % и 7,9 % встречались чаще, чем среди миопов; в то время как выраженный уровень ситуативной тревожности встретился только среди миопов — в 14,3 %, что свидетельствует в пользу мнения о влиянии состояния нервной системы на процесс формирования клинической рефракции. Выводы. Распространенность миопической рефракции среди сту дентов 5 курса педиатрического факультета составила 49 %. Среди всех опрошенных студентов с эмметропической рефракцией нормотонический тип ВНС встречался у 97 %, а среди лиц с миопической рефракцией — на 11 % реже, что составляет 86 % случаев. Парасимпатический тип ВНС у лиц с миопией встречается в 4 раза чаще, чем у студентов с эмметропией (в 11,4 % и 2,8 % соответственно). Изучение уровня ситуативной тревожности студентов показало: низкий и умеренный типы реагирования на стресс чаще встречались у студентов с эмметропической рефракцией (75 % и 25 %, соответственно). Выраженная реакция на стресс была обнаружена у студентов с миопией (14,3 %), у студентов с эмметропией она отсутствовала. Литература 1. Аветисов, Э. С. Влияние острого психогенного стресса на состояние некоторых функций зрительного анализатора / Э. С. Аветисов, Н. А. Гундорова, А. А. Шакарян, А. А. Оганесян // Вестн. офтальмол. — 1991. — №1. 2. Вейн, А. М. Вегетативные расстройства: клиника, диагностика, лечение / А. М. Вейн. — М., 2003. — 752 с. 3. Волкова, Е. М. Влияние тонуса вегетативной нервной системы на функциональное состояние аккомодации при миопии / Е. М. Волкова. — СПб., 2007. 4. Петухов, В. М. Значимость психофизиологической коррекции в лечении миопии / В. М. Петухов, Н. В. Кийко. — Ерошевские чтения: сб. — Самара, 1997. 5. Райгородский, Д. Я. Практическая психодиагностика. Методики и тесты / Д. Я. Райгородский. — Самара: БАХРАХ-М, 2000. 6. Селье, Г. Стресс без дистресса / Г. Селье. — М.: Прогресс, 1979. — С. 124. 7. Спилбергер, Ч. Д. Концептуальные и методологические проблемы исследования тревоги / Ч. Д. Спилбергер. — М.: Физкультура и спорт, 1983. 8. Dunaway, D. Worldwide Distribution of Visual Refractive Errors and What to Expect at a Particular Location / D. Dunaway, I. Berger // Retrieved August 31, 2006. 9. Logan, N. S. Ametropia and ocular biometry in a U. K. university student population / N. S. Logan, L. N. Davies, E. A. Mallen, B. Gilmartin // Optom. Vis. Sci. — 2005. — Vol. 82. — № 4. — P. 261–266. 10.Wu, H. M. Does education explainethnic differences in myopia prevalence? A population-based study of young adult males in Singapore / H. M. Wu [et al.] // Optom. Vis. Sci. — 2001. — Vol. 78. — P. 234–239. Н. К. Полянская Комплексная профилактика инфекционных осложнений после сквозной кератопластики ГУЗ «Воронежская областная клиническая офтальмологическая больница», г. Воронеж Прозрачность приживления роговичного трансплантата и сохранение зрения на оперированном глазу во многом зависит от правильного ведения пациентов после сквозной кератопластики [1]. Ин- фекционные осложнения после сквозной кератопластики, как и при любой полостной операции, могут привести к грозным последствиям, вплоть до потери глаза. 101 Цель — разработать алгоритм профилактики инфекционных осложнений после трансплантации роговицы. Материал и методы. В ГУЗ «Воронежская областная клиническая офтальмологическая больница» произведено 58 трансплантаций роговицы (55 — сквозных и 3 — глубоких послойных). Сквозная кератопластика (СКП) была проведена у 45 пациентов: с кератоконусом ΙΙΙ–ΙV стадии — 13, буллезной кератопатией — 11, ожоговыми бельмами — 7, травматическими рубцами роговицы — 2, нейротрофическими кератитами — 2, рубцовыми помутнениями роговицы в исходе кератитов и язв — 19, наследственной дистрофией роговицы — 1. Двусторонняя кератопластика с интервалом от 9 до 12 месяцев проведена 5 пациентам. У 4 больных СКП — повторно из-за помутнения трансплантата. Сроки наблюдения от 2 месяцев до 4,5 лет. Всем пациентам при поступлении в стационар проводилось стандартное офтальмологические, лабораторные обследования и исследование мазков с конъюнктивы на микрофлору. Большое внимание уделялось состоянию конъюнктивальных сводов, конъюнктивы век. Более половины пациентов получали консервативное лечение в течение предшествующего операции месяца. Результаты и обсуждение. Выявлено, что большинство пациентов с ожоговыми бельмами, нейротрофическими кератитами, рубцовыми помутнениями роговицы в исходе кератитов и язв, буллезной кератопатией имели в анамнезе хронические конъюнктивиты, предъявляли жалобы на периодическое слизистое отделяемое из конъюнктивальной полости. В мазках с конъюнктивы определялись лейкоциты (от единичных до 20–30 в поле зрения). Для уменьшения риска иммунной реакции традиционно длительно назначают в послеоперационном периоде местно кортикостероиды [2], которые в свою очередь, подавляя местный иммунитет, замедляют регенерацию эпителия и, как правило, вызывают вторичную гипертензию, поэтому очень важно начинать профилактику послеоперационных осложнений с момента госпитализации больного. В нашей клинике с этой целью всем пациентам проводилось промывание слезных путей раствором мирамистина 0,01 %, в инстилляциях до операции назначались: левофлоксацин (офтаквикс 5 %), пиклоксидина гидрохлорид (витабакт 0,05 %), бринзоламид (азопт 1 %) или дорзоламид (дорзопт 2 %), помимо дексаметазона 0,1 %. В послеоперационном периоде все пациенты получали в инстилляциях первые 2 недели — дексаметазон 6 раз в день, левофлоксацин (из группы фторхинолонов) — 4 раз в день, витабакт, баларпан, корнергель — 4 раз в день, азопт или дорзопт на ночь. Учитывая побочное действие кортикостероидов, с третьей недели кратность инстилляций их уменьшалась до 4 раз в сутки. Однако у 8 пациентов с ожоговыми бельмами и буллезной кератопатией отмечалось усиление инъекции глазного яблока, чувство жжения и дискомфорта после инстилляций левофлоксацина уже на 5–7 день применения препарата, и вышеуказанные явления проходили после назначения противоаллергических средств и отмены препарата, поэтому препаратом выбора стал тобрамицин (тобропт) — аминогликозид широкого спектра действия. В зависимости от исходного состояния оперированного глаза, анамнеза, антибиотики местно назначались от 1 до 2 месяцев, но даже при хорошей переносимости, через месяц заменяли препараты фторхинолоной группы на аминогликозиды, так как длительное применение увеличивает риск появления токсико-аллергических реакций. Антисептики местно получали до 6 месяцев более половины больных. Противовирусные препараты назначались местно на 1–2 месяца пациентам с вирусными кератитами в анамнезе. Кортикостероиды (с 4 месяца не чаще 1–2 раз в день), корнеопротекторы, гипотензивные препараты пациенты получали от 6 до 15 месяцев. В стационаре пациенты получали кортикостероиды парабульбарно, десенсибилизирующие препараты, антибиотики широкого спектра (парабульбарно, перорально, внутривенно) после реконструктивных операций на переднем отрезке глаза в сочетании с СКП, на фоне хронических воспалительных процессов глазной поверхности. В раннем послеоперационном периоде (до 1 месяца) у 4 (7,3 %) пациентов, перенесших СКП, появились признаки инфильтрации трансплантата по швам, при бактериологическом посеве на питательные среды отделяемого из конъюнктивальной полости только в двух случаях дал рост сапрофитный стафилококк, в двух других — посев роста не дал. Клиническая картина соответствовала развитию глубокого кератита с последующим тотальным помутнением трансплантата у 3 из 4 пациентов. Рекератопластика на фоне мощной антибактериальной 102 терапии позволила получить прозрачное приживление в 2 из 3 случаев. В более поздние сроки (до 3 месяцев) у 2 пациентов с нейротрофическими кератитами, появилась инфильтрация трансплантата в оптической зоне с последующим истончением. Учитывая «чистые» мазки с конъюнктивы, отсутствие роста на питательные среды отделяемого с поверхности роговицы, умеренную перикорнеальную инъекцию глазного яблока, выраженный исходный синдром «сухого глаза», состояние расценино как болезнь трансплантата с формированием «стерильной язвы». В одном случае глаз спасти не удалось (пациентка страдала синдромом Сьегрена, в анамнезе две перфорации роговицы, СКП носила органосохранный характер). Выводы. С целью профилактики инфекционных осложнений после СКП целесообразно проводить исследование мазков с конъюнктивы в группах риска, назначать антибиотики широкого спектра действия (левофлоксацин, тобрамицин) и антисептики в послеоперационном периоде на фоне неизбежной, длительной кортикостероидной терапии с коррекцией ее побочных эффектов. Схема лечения в каждом случае должна корректироваться в зависимости от исходного состояния глаза, объема оперативного лечения и лекарственной переносимости. Литература 1. Слонимский, Ю. Б. Амбулаторное ведение больных после сквозной кератопластики / Ю. Б. Слонимский, А. Ю. Слонимский // Тез. докл. ΙХ съезда офтальмологов России. — М., 2010. — С. 316. 2. Кански, Д. Д. Клин. офтальмол. / Д. Д. Кански. — М.: Логосфера, 2006. — С. 145–148. К. Н. Руссков, С. Ю. Туровский, Е. А. Спиридонов, А. Н. Савельева ПРЕДВАРИТЕЛЬНЫЙ АНАЛИЗ ДИНАМИКИ ВОЛНОВОГО ФРОНТА ЧЕРЕЗ ГОД ПОСЛЕ ЭКСИМЕР-ЛАЗЕРНОЙ КОРРЕКЦИИ ЗРЕНИЯ, ВЫПОЛНЕННОЙ ПО МЕТОДИКЕ «FemtoLASIK» и «MAGEK®» Самарская клиническая офтальмологическая больница им. Т. И. Ерошевского, г. Самара Эксимер-лазерная коррекция зрения по технологии «ФРК» с применением митомицина С в меньшей степени изменяет структуру волнового фронта в сравнении с «LASIK» из-за отсутствия клапанного интерфейса [1]. При этом больше других увеличиваются комаподобные и сферические аберрации. Фемтосекундная технология формирования клапанного интерфейса приводит к меньшему увеличению аберрации в сравнении с микрокератомом [2]. Цель — сравнить изменение аберраций по типу кома, сферических аберраций высшего порядка и величину среднеквадратичной ошибки аберраций высшего порядка через 1 год после операции «FemtoLASIK» и «MAGEK®». Материалы и методы. Было прооперировано 16 пациентов (32 глаза) по поводу миопии, миопического астигматизма по методикам: «FemtoLASIK» и «MAGEK®». До и после операции проводилось стандартное (для рефракционных вмешательств) обследование. Дополнительно проводили анализ аберраций по типу кома, сферических аберраций высшего порядка и величины среднеквадратичной ошибки аберраций высшего порядка (RMSHo). Период наблюдения составил 1 год. В зависимости от выполненной методики операции, пациенты были разделены на группы: группа А — 16 глаз с миопией и миопическим астигматизмом прооперировано по методике «MAGEK®». Среднее значение сфероэквивалента — –4,06 дптр. (от –1,5 до –5,75 дптр.), средняя глубина абляции — 70,34 мкм. группа В — 16 глаз с миопией и миопическим астигматизмом прооперированы по методике «FemtoLASIK». Среднее значение сфероэквивален- 103 та — –4,8 дптр. (от –2,5 до –7,25 дптр.), средняя глубина абляции — 76,81 мкм. Эксимер-лазерная абляция выполнялась на установке «Allegretto WAVE Eye-Q» (WaveLight, Германия), диаметр оптической зоны — 6,5 мм, диаметр абляции — 9,0 мм. Роговичный лоскут формировался при помощи фемтосекундного лазера «FEMTEC®» (Technolas Perfect Vision, Германия), диаметром 930 мкм, толщиной 110 мкм, с ножкой на 12 часах, длиной дуги 55°. Измерение волнового фронта проводили в скотопических условиях без применения циклоплегических средств, на приборе « ALLEGRO Analyser», основанном на принципе Чернинга. Результаты и обсуждение. Клиническая рефракция к третьему месяцу после операции в группе «А» — эмметропия, в группе «В» — слабая миопия. Средняя некорригированная острота зрения после операции в сравнении со средней максимально корригированной остротой зрения до операции в группе «А» увеличилась на 8 % и составила 1,05, в группе «В» увеличение произошло на 5 % и составило 0,98. Статистический анализ показал увеличение исследуемых аберраций высшего порядка в обеих группах. Среднее значение комы в группе «А» увеличилось на 0,21 мкм, в группе «В» — на 0,11 мкм. Сферические аберрации высшего порядка в группе «А» увеличились на 0,30 мкм, в группе «В» — на 0,25 мкм. Величина RMSHo в группе «А» увеличилась на 0,23 мкм, т. е. на 72 % от исходной величины, в группе «В» — на 0,19 мкм — 59 %. Выводы. — Выявлено увеличение аберраций высшего порядка при применении как «MAGEK», так и «FemtoLASIK». — Методика «MAGEK» через 1 год после операции вносит на 13 % больше изменений в волновой фронт, чем методика «FemtoLASIK». — Методика «FemtoLASIK» в меньшей степени индуцирует сферические аберрации высшего порядка и аберрации по типу кома. — Методика «MAGEK» более предсказуема. Для проведения статистически достоверного анализа результатов операции необходимо большее число пациентов. Литература 1. Slade, S. G. A prospective, contralateral eye study comparing thin-flap LASIK (sub-Bowman keratomileusis) with photorefractive keratectomy / S. G. Slade, D. S. Durrie, P. S. Binder // Ophthalmology. — 2009. — Vol. 116. — P. 1075–1082. 2. Мonte´s-Mico´ R. Femtosecond laser versus mechanical keratome LASIK for myopia / R. Мonte´s-Mico´, A. Rodrı ´guezGalietero, J. L. Alio // Ophthalmology. — 2007. — Vol. 114. — P. 62–68. В. А. Соколов, А. А. Федотов, Н. В. Исаева Аутоконъюнктивальная кератопластика с жёсткой фиксацией в ложе дефекта как метод ургентной хирургии в лечении язвенных поражений роговицы ГОУ ВПО «Рязанский государственный медицинский университет им. акад. И. П. Павлова» Минздравсоцразвития РФ, ГУЗ «РКБ им. Н. А. Семашко», г. Рязань Повреждения и заболевания роговицы занимают одно из лидирующих мест среди причин слепоты и слабовидения в мире. Особую группу больных составляют пациенты с грубыми нарушениями целостности роговицы. В случаях грубых дефектов роговичной ткани, грозящих перфорацией, требуется срочное хирургическое вмешательство. Основным направлением в хирургии глубоких поражений роговицы является лечебная кератопластика, целью которой является сохранение целостности глазного яблока путём удаления патологических участков роговицы и замещения её дефектов донорскими тканями — роговицей, склерой, мозговой оболочкой, амнионом, аллоплантом, слизистой и другими [2, 3, 4]. 104 За последние годы сложилась сложная ситуация с наличием донорских материалов, что заставляет хирургов всё чаще и чаще прибегать к использованию собственных анатомических структур глаза, в частности, эпибульбарной конъюнктивы. Последние 4 года сотрудниками нашего отделения в случаях парацентральных и периферических дефектов роговицы успешно применяется методика частичной аутоконъюнктивальной кератопластики на ножке с жёсткой фиксацией в ложе дефекта. Метод предложен группой учёных в составе Р. А. Гундоровой, О. Г. Оганесян, П. В. Макарова, Ю. Ф. Майчук, И. П. Масловой и др. в 2002 году и используется нами в хирургической практике [1]. Актуальностью проблемы является поиск новых материалов и способов срочной хирургической помощи, а также возможность укорочения сроков реабилитации в случаях глубоких поражений роговицы. Способ прост. Соответственно месту поражения роговичной ткани из эпибульбарной слизистой выкраивается «язычок» на ножке, по размерам соответствующий дефекту роговичной ткани, укладывается в ложе, предварительно очищенном от некротических тканей дефекта, и жёстко фиксируется край в край с неповреждённой роговицей. Дефект эпибульбарной ткани после выкраивания эпибульбарного лоскута не ушивается. Подсаженный лоскут обеспечивает надёжную защиту изменённого участка роговицы от механических раздражителей, от конъюнктивальных секретов, улучшает состояние роговицы в целом. Цель — оценка клинической эффективности использования методики как способа ургентной помощи при глубоких поражениях роговиц. Материал и методы. Использовались статистические данные анализа историй болезни пациентов, получивших срочную помощь указанным выше методом, а также клинические наблюдения за течением послеоперационного периода: жалобы пациента, контроль остроты зрения, биомикроскопические наблюдения за поражённым участком и окружающей роговичной тканью, необходимость использования дополнительных методик хирургической помощи. С 2008–2010 гг. получили экстренное хирургическое лечение 68 человек. Все пациенты оперированы в сроки от 1 до 5 часов с момента поступле- ния в клинику. Операция проводилась под местной анестезией без использования предварительной премедикации, занимала небольшой временной отрезок и хорошо переносилась больными. В послеоперационном периоде проводилось общее и местное противовоспалительное и антибактериальное лечение, эпителизирующая терапия, иммунокорректирующая терапия. Эффективность лечения оценивалась по следующим параметрам: сохранение глазного яблока, эпителизация дефекта, состояние роговицы в целом, острота зрения, необходимость и частота использования других пластических способов. Результаты и обсуждение. Жалобы пациентов на боль в глазу, слёзотечение, светобоязнь купированы ко 2–3 дню. Перикорнеальная инъекция исчезла к 4–5 дню, а в дальнейшем наблюдалась локальная инъекция в области подсаженного лоскута. Состояние видимой части роговицы улучшилось к 3–4 дню. Уменьшился отёк, исчезли микродефекты эпителия, у 48 человек исчезли явления десцеметита. У 20 человек десцеметит значительно менее выражен. К 7 дню прозрачность роговицы восстановилась полностью у всей группы больных. Благодаря тому, что подсаженный лоскут занимал периферическую зону, удалось проследить за состоянием радужки, зрачковой зоны и вовремя корректировать терапию. Методика даёт возможность следить за динамикой зрения с момента поступления пациента и в послеоперационном периоде. Кроме того, в послеоперационном периоде у пациента в акте зрения участвуют оба глаза, что даёт возможность избежать многих негативных жалоб со стороны больного. Сравнительный анализ остроты зрение до и после лечения получены следующие результаты, отраженные в таблице. 105 Динамика остроты зрения До После операции операции Правильная проекция света 3 чел. 2 чел 0,01–0,1 21 10 0,2–0,3 17 14 0,4–0,5 18 17 0,6 и выше 8 25 Зрение В двух случаях наблюдали частичную дислокацию конъюнктивального лоскута, что потребовало повторной конъюнктивокератопластики. К 7 дню выписано на амбулаторное лечение 16 человек. На 14 день выписана большая часть больных — 38 человек. На 18 день выписаны из стационара остальные 14 человек. Повторных госпитализаций за указанный период времени не наблюдалось. Выводы. Анализ полученных результатов даёт возможность использовать метод частичной аутоконъюнктивальной кератопластики и в дальнейшем, так как имеет ряд положительных сторон, включающих: — не требует наличия банка донорского материала; — операция проста в исполнении и хорошо переносится пациентами; — быстрая психологическая адаптация пациента в послеоперационном периоде; — возможность участия больного глаза в акте зрения; — даёт возможность врачам объективно оценивать клиническую картину и корректировать лечение; — сокращает сроки лечения в стационаре в среднем на 7–10 дней. Литература 1. Гундорова Р. А., Оганесян О. Г., Макаров П. В., Майчук Ю. Ф. // Мат-лы науч.-практ. конф. — М., 2000. — С. 45. 2. Мулдашев, Э. Р. Аллопланты для офтальмохирургии / Э. Р. Мулдашев, С. М. Муслимов. — Уфа, 1987. — 3 с. 3. Пучковская, Н. А. Лечебная кератопластика и возможности стимуляции регенеративной способности роговой оболочки / Н. А. Пучковская // Офтальмол. журн. — 1983. — № 2. — С. 69–71. 4. Сафонова, Т. Н. Лечение прободных язв роговицы при синдроме Шёгрена / Т. Н. Сафонова, Н. В. Ермаков // Тез. докл. VII Съезда офтальмологов России. — М., 2000. — Т. 2. — С. 42–43. А. Н. Ульянов, С. В. Ребриков, М. В. Иванова Анализ результатов ультрафиолетового кросслинкинга роговичного коллагена у пациентов с прогрессирующим кератоконусом по данным Oculus Pentacam Екатеринбургский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова Росмедтехнологии», г. Екатеринбург Кератоконус — это прогрессирующее невоспалительное дистрофическое заболевание роговицы, чаще двустороннее, постепенно приводящее к ее истончению, формированию миопической рефракции и нерегулярного астигматизма [1]. Основным методом лечения прогрессирующего кератоконуса в настоящее время признан ультрафиолетовый кросслинкинг роговичного коллагена. Метод ультрафиолетового кросслинкинга роговичного коллагена был предложен в 1999 году профессором Т. Зейлером и соавт. В основе метода лежит «склеивающий эффект», который возникает при элиминации радикалов кислорода [2]. Радикалы кислорода, высвобождаясь, формируют допол- нительные связи между коллагеновыми волокнами и вызывают уплотнение стромы роговицы. В литературных данных анализ результатов после ультрафиолетового кросслинкинга роговичного коллагена производился с помощью компьютерной кератотопографии, кератометрии и пахиметрии, однако, в послеоперационном периоде коэффициент преломления роговицы значимо меняется до 1,5 мм [3] и стандартный перерасчет радиуса кривизны роговицы в ее преломляющую силу дает ошибочные результаты, а увеличение плотности стромы роговицы в послеоперационном периоде приводит к ошибочным данным ультразвуковой пахиметрии. 106 Цель — анализ результатов кросслинкинга роговичного коллагена в лечении прогрессирующего кератоконуса по данным Oculus Pentacam. Материал и методы. В группу наблюдения вошло 26 пациентов (30 глаз), из них 18 мужчин, 8 женщины, в возрасте от 16 до 35 лет. Во всех случаях это были пациенты с диагнозом прогрессирующий кератоконус II-III степени. Период наблюдения составил от 5 до 15 месяцев. Данные обследования пациентов до операции характеризовались «крайним» разнообразием: средняя острота зрения без коррекции — 0,18±0,15, с коррекцией — 0,37±0,19. Средние данные кератометрии: 50,35± 7,25 D; средний радиус кривизны роговицы по данным Oculus Pentacam — 6,75±0,98 мм. Средние значения пахиметрии в тонком месте по данным Pentacam 490±31 мкм; подъем передней поверхности роговицы 21±15 мкм; подъем задней поверхности роговицы 47±30 мкм. Из специальных методов исследования всем пациентам выполнялась обследование на Oculus Pentacam, а также оптический срез роговицы OCT Visante через 1 месяц после операции для измерения глубины положения «демаркационной линии». Результаты и обсуждение. В связи со значительным различием данных в группе исследования, нами не анализировались средние значения показателей, а оценивались их изменения. Острота зрения без коррекции спустя месяц после операции не изменялась, к 3 месяцам наблюдалось увеличение в среднем на 0,15, к 6 месяцам — на 0,16, к году — на 0,2. Острота зрения с коррекцией также не менялась к 1 месяцу после операции, к 3 месяцам на- блюдалось ее увеличение на 0,2, и это значение сохранялось до конца периода наблюдения. Среднее значение радиуса кривизны роговицы до операции составило 6,75±0,98 мм. К 3 месяцам после операции роговица стала более плоской, и радиус кривизны увеличился на 0,17 мм. И с 3 месяцев после операции эти значения не менялись. По данным пахиметрии к месяцу после операции наблюдается уменьшение толщины роговицы в среднем на 30±0,12 мкм. Данные подъема задней поверхности роговицы имели колебания в пределах 5 мкм к 3 и к 6 месяцам после операции, и к 12 месяцам эти параметры стабилизировались. Изменения передней поверхности роговицы не были столь явными. Значения колебались в районе 2 мкм на всем протяжении периода наблюдения. В большинстве случаев процедура кросслинкинга роговичного коллагена приводила к повышению переносимости МКЛ и улучшению качества жизни пациентов. Выводы. 1. Изменение значений подъема передней и задней поверхности роговицы после УФ кросслинкинга роговичного коллагена отличалось крайним разнообразием с тенденцией незначительного увеличения максимальных значений. 2. Изменения анализируемых параметров происходило до 3 месяцев после операции и сопровождалось последующей стабилизацией всех параметров при дальнейшем наблюдении. 3. Изменение керато-топографических параметров роговицы в послеоперационном периоде сопровождалось повышением корригированной и некорригированной остроты зрения, что говорит о выборе правильной техники и ведения послеоперационного периода. Литература 1. Raiskup-Wolf, F. Collagen crosslinking with riboflavin and ultraviolet-A-light in keratoconus / F. Raiskup-Wolf, A. Hoyer, E. Spoerl, L. E. Pillunat // J. Cataract Refract. Surg. — 2008. — Vol. 34. — P. 796–801. 2. Spoerl, E. Increased resistance of riboflavin-UVA-treated cornea against enzymatic digestion / E. Spoerl, G. Wollensak, T. Seiler // Curr. Eye Res. — 2004. — Vol. 29. — P. 35–40. 3. Spörl, E. Untersuchungen zur verfestigung der hornhhaut am kaninchen / E. Spörl, J. Schreiber, K. Hellmund [et al.] // Der Ophthalmologe. — 2000. — Bd. 97. — № 3. — S. 203–206. 107 Б. Т. Фаттахов, С. Р. Хуснитдинова, И. И. Хуснитдинов Результаты офтальмоэргономических исследований после эксимерлазерной коррекции миопии высокой степени ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Технология фоторефракционной кератэктомии в меньшей степени индуцирует аберрации высшего порядка, оказывающие негативное влияние на качество зрения, по сравнению с LASIK [5]. Оптические аберрации ухудшают пространственную контрастную чувствительность, главным образом, в области высоких пространственных частот [3]. На фоне высоких показателей остроты зрения, некоторые пациенты отмечают изменение качества и комфорта зрительного восприятия в помещениях при искусственном освещении, при взгляде на источники света, снижение контрастной чувствительности [2, 3]. Цель — изучить контрастную чувствительность и аберрации у пациентов с высокой близорукостью до и после LASIK. Материал и методы. Пространственная контрастная чувствительность (ПКЧ) оценивалась на компьютере с помощью программы «Зебра» (авторы А. Е. Белозеров, А. М. Шамшинова, «ООО Астроинформ СПЕ»). До операции исследования проводили с максимальной очковой коррекцией, после операции — без коррекции. Аберрометрическую картину изучали на аппарате OPD-scan NIDEK. Волновой фронт исследовали на узкий зрачок (4,2±0,05 мм). Представленные офтальмоэргономические исследования проведены у 30 пациентов (60 глаз) до операции и через 1, 3, 6 месяцев после LASIK. Средний возраст — 27±2,1 лет. Дооперационная величина в сферическом эквиваленте рефракции составила — 11,5±0,72 D, после операции — 0,89±0,04 D. Операции выполнялись по стандартной методике на эксимерлазерной установке NIDEK EC-5000. Оценивали суммарные аберрации — Total (Z1 — Z44), низких порядков — Low (Z1 — Z5), высоких порядков — High (Z6 — Z44). За вариант нормы принимались показатели аберраций и контрастной чувствительности контрольной группы из 20 здоровых добровольцев (40 глаз), средний возраст — 25±2,3 лет. Результаты и обсуждение. Показатели контрастной чувствительности в группе контроля составили в области низких частот (0,5–1,4 цикл/гр) — 18,43±0,56 цикл/гр, в диапазоне средних (2,0–5,6 цикл/гр) — 22,56±0,64 цикл/гр и высоких (8,1–22 цикл/гр) пространственных частотах — 20,06±0,63 цикл/гр. Визоконтрастометрия у пациентов с миопией высокой степени в условиях максимальной очковой коррекции во всех частотах была снижена в среднем на 2–3 дБ (рМ-У<0,05) относительно нормы. У исследованных пациентов различий в контрастной чувствительности к разным цветам на низких частотах практически не отмечалось, в то время как в области средних и высоких частот выявлялось расхождение кривых ПКЧ. Максимальной была контрастная чувствительность к ахроматическим решеткам, далее в порядке уменьшения сенситивности следовали кривые ПКЧ к зеленому, красному и синему цветам. После операции через 1 месяц были выявлены следующие существенные отличия контрастной чувствительности по сравнению с дооперационным уровнем: снижение контрастной чувствительности, в большей степени к ахроматическим и красным синусоидальным решеткам по сравнению с предоперационным уровнем. Ухудшение наблюдалось в области средних частот от 0,5 до 1,5 дБ (рМ-У<0,05) и в диапазоне высоких частот — от 2,1 до 3,4 дБ (рМ-У<0,05). Исследуя динамику показателей ПКЧ через 3 и 6 месяцев после эксимерлазерной коррекции миопии высокой степени отмечается некоторое улучшение показателей визоконтрастометрии, однако восстановления предоперационного уровня достигнуто не было. При исследовании аберрометрической картины в группе контроля средний уровень суммарных оптических аберраций (RMS Total) составил 0,71±0,02 мкм, низших порядков (RMS Low) — 0,48±0,03 мкм и суммарных высших порядков (RMS High) — 0,21±0,01 мкм. Средние значения RMS коэффициентов аберраций пациентов с миопией высокой степени до и через 1 месяц после LASIK соответственно составили: 108 RMS Total — 8,91±0,53 и 1,87±0,03 мкм, RMS Low — 8,87±0,31 и 1,72±0,04 мкм, RMS High — 0,32±0,01 и 0,72±0,03 мкм (рФ<0,05). Исходно до операции аберрации высокого порядка (АВП) в глазах с миопией превышают значения группы контроля. Через 1 месяц после эксимерлазерной коррекции суммарный волновой фронт сокращался за счет низших порядков, при этом АВП удваивался. Показатели аберраций в динамике после операции через 3 и 6 месяцев соответственно были следующими: RMS Total — 1,36±0,02 и 1,37±0,02 мкм, RMS Low — 1,29±0,05 и 1,19±0,05 мкм, RMS High — 0,51±0,06 и 0,48±0,06 мкм (рФ<0,05). Отмечено снижение уровня аберраций низших порядков, так как при сферической или торической абляции корригируются аберрации первого (сфера) и второ- го (цилиндра) порядка [4]. Происходит незначительная корректировка показателей аберраций высоких порядков, но до значений нормы не достигают, при этом следует особо отметить, что АВП не могут корректироваться сфероцилиндрической оптикой [1]. При контрольном обследовании аберраций через 6 месяцев после операции данные существенно не менялись. Выводы. Наше исследование соотносится с данными других авторов, происходит увеличение аберраций высшего порядка, которые в течение 3 месяцев постепенно уменьшаются, однако не достигают исходного уровня. LASIK у пациентов с миопией высокой степени способствует ухудшению пространственной контрастной чувствительности на средних и высоких частотах. Литература 1. Семчишен, В. Влияние оптических аберраций, вызванных децентрацией зоны абляции при лазерной коррекции зрения, на остроту зрения / В. Семчишен, М. Мрохен, И. Гуревич, Т. Сайлер // Вестн. офтальмол. — 2001. — № 6. — С. 16–20. 2. Шамшинова, А. М. Новый метод исследования контрастной чувствительности в клинике глазных болезней / В. Семчишен, М. Мрохен, И. Гуревич, Т. Сайлер // Вестн. офтальмол. — 1997. — № 1. — С. 22–25. 3. Эскина, Э. Н. Контрастная чувствительность при различных аномалиях рефракции до и после фоторефракционной кератэктомии / Э. Н. Эскина, А. М. Шамшинова, А. Е. Белозеров // Клин. офтальмол. — 2001. — Т. 2. — № 2. — С. 75–79. 4. Guiaro, A. Effect of beam size on the expected benefit of customized laser refractive surgery / A. Guiaro, D. R. Williams, S. M. MacRae // J. Refract. Surg. — 2003. — Vol. 19. — P. 15–23. 5. Zhao Kan-sing Wang Yan. Comparison of wavefront aberrations induced by laser in situ keratomileusis and by photorefractive keratectomy / Zhao Kan-sing Wang Yan // NIDEK International Excimer Laser Symposium. — Monaco, 2001. — P. 30. А. Ф. Хабибуллин СЛУЧАЙ ЛЕЧЕНИЯ РЕШЕТЧАТОЙ ДИСТРОФИИ РОГОВИЦЫ I ТИПА МЕТОДОМ КРОССЛИНКИНГА ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Решётчатая дистрофия роговицы I типа — это первичное, наследственное, двустороннее заболевание, характеризующееся нитевидными амилоидными помутнениями стромы, ведущее к стойкому снижению остроты зрения и чувствительности роговицы [5]. Первые клинические признаки проявляются в первом-втором десятилетии жизни. Полная клиническая картина наступает в третьем-четвертом десятилетии, и для неё характерны прозрачные решетчатые структуры в передних и средних слоях стромы, точечные сероватые помутнения в по- верхностных слоях и центральное диффузное субэпителиальное помутнение [3, 12]. В эндотелии и десцеметовой мембране амилоидные отложения отсутствуют. Данный вид дистрофии связан с мутациями гена TGFBI [7], белковым продуктом которого является кератоэпителин — экстрацеллюлярный матриксный белок, состоящий из 683 аминокислот [9]. Установлено, что мутации в гене TGFBI предопределяют наследственные дистрофии с аутосомно-доминантным типом наследования, в том числе и решетчатую дистрофию I типа [6, 10]. 109 При биомикроскопии срезов роговицы наблюдают фибриллярные депозиты амилоида, которые расположены под боуменовой мембраной, а также в поверхностных и средних слоях стромы. Депозиты имеют вид тонких (диаметр 8–10 нм) неразветвленных фибрилл, которые расположены параллельно волокнам коллагена [15, 11]. Вокруг нитевидных помутнений роговица прозрачная. По мере развития процесса в строме появляются мелкие серые вкрапления в центральной зоне роговицы. Увеличивается число помутнений по периферии. Сливаясь, они образуют дисковидное помутнение, захватывающее все слои стромы. При прогрессировании заболевания наблюдаются рецидивирующие эрозии, поверхность роговицы становиться шероховатой. Значительно снижается острота зрения и чувствительность роговицы. Дистрофические заболевания роговицы при отсутствии систематического курсового лечения неустанно прогрессируют, а в терминальном периоде сопровождаются изъязвлением, болевым роговичным синдромом и потерей зрения. Центральное место в лечении дистрофии роговицы занимают препараты метаболической (репаративной) терапии [1]. К хирургическим методам лечения относятся: при начальной стадии заболевания — эксимерлазерная фототерапевтическая кератэктомия [2], при 2 и 3 стадии заболевания — глубокая послойная или сквозная кератопластика [8]. В 2003 году T. Seiler и G. Wollensak разработали метод перекрестного связывания роговичного коллагена при помощи ультрафиолетового облучения с рибофлавином. В настоящее время методика успешно применяется в лечении пациентов с начальным кератоконусом, ятрогенной эктазией [14] и начальной стадией эндотелиально-эпителиальной дистрофии [4, 13]. Нами представлен случай лечения пациента К., 25 лет, обратившегося в Уфимский НИИ глазных болезней с диагнозом решетчатая дистрофия роговицы I типа. При поступлении пациент жаловался на прогрессирующее ухудшение зрения и периодическое чувство инородного тела в глазах. Снижение остроты зрения, некорригируемое очками, отмечает с 16 лет. Ранее наблюдался и получал курсы консервативной терапии у офтальмолога по месту жительства. В результате лечения отмечал исчезновение чувства инородного тела, однако острота зрения не повышалась. В дооперационном периоде острота зрения правого глаза составила 0,1, не корр., левого — 0,3, не корр. Биомикроскопически наблюдали нарушение гладкости эпителия, небольшой отек поверхностных слоев стромы, множественные субэпителиальные нитчатые помутнения в оптической зоне и по периферии. Помимо стандартных офтальмологических методов исследования пациенту была проведена оптикокогерентная томография (Vizante-OCT, Carl Zeiss, Germany). По данным пахиметрической карты толщина роговицы OD до операции составила 620 мкм. Кросслинкинг проводили в условиях операционной. После полной деэпителизации роговицы шпателем инстиллировали раствор «Декстралинк» в течение 20 минут. Далее, на аппарате «УФалинк» проводили ультрафиолетовое облучение роговицы с одновременной инстилляцией раствора «Декстралинк» в течении 30 мин по формуле: 6 облучений по 5 минут с интервалом 1 минута. В послеоперационном периоде были необходимы местная антибактериальная и противовоспалительная терапия после завершения эптелизации. Период наблюдения составил 4 месяца. Эпителизация роговицы завершилась на 3 сутки. Эпителий был прочно сцеплен с подлежащей стромой. При биомикроскопическом исследовании наблюдали незначительный отек поверхностных слоев стромы роговицы, сохранялись нитчатые помутнения. Пациент выписан из стационара на десятые сутки. В течение всего периода наблюдения биомикроскопически отмечали постепенное рассасывание амилоидных нитчатых помутнений роговицы начиная с 3 дня. Прозрачность роговицы практически полностью восстановилась к 4 месяцу наблюдения. Анализ пахиметрических карт оптикокогерентной томографии показал достоверное уменьшение толщины роговицы на 30 мкм, которая сохранялась неизменной в течение всего периода наблюдения. Пациент отмечал субъективное колебание остроты зрения в течение 3 мес. Через 1 месяц после операции острота зрения без коррекции составляла 0,2, к 4 месяцу — 0,5 с коррекцией cyl — 2,0D ax140° = 0,9. Мы предполагаем, что воздействие ультрафиолетового излучения разрушило имеющиеся амилоидные отложения. Уплотнение структуры роговицы, возникшее вследствии эффекта «склеивания» коллагеновых волокон, обеспечило условия для 110 минимального отложения образующегося амилоида. Применение метода кросслинкинга роговичного коллагена у пациента с решетчатой дистрофией роговицы I типа позволило восстановить прозрачность роговицы, повысить остроту зре- ния и, соответственно, улучшить качество жизни пациента. Однако, остается актуальным вопрос изучения механизма рассасывания амилоидных отложений стромы и продолжительности эффекта, что является темой дальнейших исследований. Литература 1.Ларина, Л. А. Применение вита-йодурола методом инстилляции и магнитофереза в лечении метаболических заболеваний глаз / Л. А. Ларина, Ю. Ф. Майчук // Клин. офтальмол. — 2003. — № 3. — С. 102–104. 2. Майчук, Д. Ю. Эрозии роговицы: клинические формы, новые методы лечения / Д. Ю. Майчук // Клин. офтальмол. — 2004. — № 1. — С. 17–20. 3. Майчук, Ю. Ф. Стромальные дистрофии: клинические формы и лечение / Ю. Ф. Майчук, Л. Э. Орловская // Офтальмол. журн. — 1993. — № 4. — С. 224–232. 4. Barbosa, M. M. Effect of cross-linking on corneal thickness in patients with corneal edema / M. M. Barbosa, J. B. Barbosa, F. E. Hirai, A. Hofling-Lima // Cornea. — 2009 (in press). 5. De Sousa, L. B. The stromal dystrophies. Cornea / L. B. De Sousa, M. J. Mannis. — 2-nd ed. — Philadelphia, 2005. — P. 911–912. 6. Dighiero, P. Histologic phenotype-genotype correlation of corneal dystrophies associated with eight distinct mutations in the TGFBI gene / P. Dighiero, F. Niel, P. Ellies [et al.] // Ophtalmology. — 2001. — Vol. 108. — P. 818–823. 7. Kamal, M. К. Classic lattice corneal dystrophy associated with monoclonal gammopathy following exclusion of a tgfbi mutation / Kamal M. К. [et al.] // Cornea. — 2009. — Vol. 28. — № 1. — P. 97–98. 8. Kawamoto, K. Delayed corneal epithelial wound healing alter penetrating keratoplasty in individuals with lattice corneal dystrophy / K. Kawamoto, N. Morishige, N. Yamada [et al.] // Am. J. Ophtalmol. — 2006. — Vol. 142. — № 1. — P. 173–174. 9. Le Baron, R. G. Beta IG-H3, a novel secretory protein inducible by transforming growthfactor-beta, is present in normal skin and promotes the adhesion and spreading of dermal fibroblasts in vitro / R. G. Le Baron, K. I. Bezverkov, M. P. Zimber [et al.] // J. Invest. Dermatol. — 1995. — Vol. 104. — P. 844–849. 10.Muniez, L. F. Keratoepithelin mutation in four 5g31-linked corneal dystrophies / L. F. Muniez, E. Korvatska, A. Djemai, [et al.] // Nat. Genet. — 1997. — 15. — P. 247–251. 11.Thiel, H. Dystrophien des Stromas in Augenheilkunde in Klinik und Praxis / H. Thiel. — Bd. 2. — Stuttgart; New York: Thieme Verlag, 1981. — P. 90–97. 12.Wirschel, H. Hornhautdystrophien und Molekulargenetik / H. Wirschel // Ophthalmologe. — 2002. — Vol. 99. — № 6. — P. 415–417. 13.Wollensak, G. Patential use of Riboflavin/UVA crosslinking in bullouse keratopathy / G Wollensak., H. Aurich, C. Wirbelauer, D. T. Pham // Ophthalmic Reserch. — 2008. — № 41. — P. 114–117. 14.Wollensak, G. Riboflavin Ultravoilet-A-induced collagen crosslinking for the treatment of keratoconus / G. Wollensak, E. Spoerl, T. Seiler // Am. J. Ophtalmol. — 2003. — Vol. 135. — № 5. — P. 620–626. 15.Zechner, E. M. Superficial involvement in lattice corneal dystrophy / E. M. Zechner, J. O. Croxatto, E. S. Malbran // Ophtalmologica. — 1986. — Vol. 193. — P. 193–199. И. И. Хуснитдинов, С. Р. Хуснитдинова Комплексная оценка LASIK при коррекции миопии высокой степени ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Внедрение в клиническую практику эксимерных лазеров значительно расширило возможности коррекции аномалий рефракции [1]. В структуре эксимерлазерной хирургии подавляющее большинство операций выполняется по поводу миопии, из них весьма значительную долю занимает коррекция миопии высокой степени [4]. Результаты LASIK оценивают по четырем критериям: эффективность, безопасность, предсказуемость и стабильность [2, 3]. 111 Цель — изучение эффективности, безопасности и предсказуемости операции LASIK у пациентов с миопией высокой степени. Материал и методы. Эксимерлазерная коррекция методом LASIK проведена у 25 пациентов (50 глаз) с миопией высокой степени. Средний возраст составил 26±2,5 лет. Дооперационное обследование состояло из общепринятых методов исследования. Сферический эквивалент рефракции до и после лазерной коррекции составил соответственно — 11,2±0,65 D и — 0,89±0,06 D. Показатели предоперационной пахиметрии в центральной оптической зоне равнялись в среднем 573 мкм (от 551 мкм до 630 мкм). Формирование роговичного лоскута производилось микрокератомом МК-2000 NIDEK (Япония). Операции по методике LASIK выполнялись на эксимерлазерной установке NIDEK EC-5000 (Япония). В послеоперационном периоде назначались антибактериальные и противовоспалительные глазные капли. Срок наблюдения составил 6 месяцев и более. Результаты и обсуждение. Средний объем эксимерлазерной абляции составил 141 мкм (от 92 мкм до 189 мкм). Необходимо отметить, что использовалась возможность минимизировать глубину абляции за счет уменьшения диаметра зоны абляции. Диаметр оптической зоны составил в среднем 6,45 мм (от 5,7 мм до 7 мм), при общем диаметре абляции 8,5 мм. Соотношение количества глаз (в %) с некорригированной остротой зрения (НОЗ) после операции 0,5 и выше к числу глаз (в %) с послеоперационной остротой зрения без коррекции, равной максималь- ной корригированной до операции оценивается критерием эффективности, который в исследуемой группе составил 96 %. До операции НОЗ и в условиях полной очковой коррекции острота зрения соответственно составила 0,05±0,04 и 0,8±0,11. После LASIK показатели НОЗ повысились в 100 % случаев, и составили 0,85±0,06, таким образом, мы не наблюдали потери наилучшей корригированной остроты зрения, что является критерием безопасности операции. Предсказуемость методики оценивалась отношением числа глаз, послеоперационная рефракция которых не отличалась от запланированной более, чем на ±0,5 дптр к общему числу наблюдений. В 92 % случаев достигнута рефракция в пределах ±0–0,5 дптр от запланированной коррекции. В исследуемой группе пациентов после LASIK стабилизация рефракции отмечалась в течение первых 3 месяцев и в последующие сроки наблюдения существенно не менялась. Отмечалось отклонение рефракции в пределах ±0,12 дптр преимущественно в цилиндрическом компоненте, в итоге астигматизм не превысил физиологической нормы, а данное изменение не отразилось на остроте зрения. Интраоперационных и послеоперационных осложнений у наблюдаемых пациентов отмечено не было. Выводы. Высокая предсказуемость, эффективность, стабильность результатов и отсутствие осложнений свидетельствуют о безопасности эксимерлазерной коррекции миопии высокой степени методом LASIK. Литература 1. Дога А. В. Эксимерлазерная рефракционная микрохирургия роговицы на базе сканирующей установки «Микроскан»: дис. … д-ра мед. наук / А. В. Дога. — М., 2003. — С. 271. 2. Першин К. Б. Комплексная оценка лазерного in situ кератомилеза (ЛАСИК). Осложнения и критерии эффективности / К. Б. Першин, Н. Ф. Пашинова, Л. В. Баталина [и др.] // Рефракционная хирургия и офтальмология. — 2002. — Т. 2. — № 1. — С. 21–28. 3. George O. Standard graphs for reporting refractive surgery / O. George, S. Waring // J. Refract. Surg. — 2000. — Vol. 16. — P. 459–466. 4. Holladay J. T. Mean visual acuity / J. T. Holladay, T. C. Prager // Am. J. Ophthalmol. — 1991. — № 3. — Р. 372–373. 112 А. Д. Чупров, Н. А. Кулигина ПЕРВЫЙ ОПЫТ ПРИМЕНЕНИЯ УФ-КРОССЛИНКИНГА Кировская клиническая офтальмологическая больница, г. Киров Кератоконус — дегенеративное невоспалительное заболевание глаза, при котором роговица истончается и принимает коническую форму. Заболевание, характеризующееся прогрессирующей деформацией и дистрофическими изменениями роговой оболочки и приводящее к значительному снижению зрения. Чаще всего пациенты предъявляют жалобы на светобоязнь, двоение, размазывание изображения. Диагноз обычно ставится в юности, а наиболее тяжёлой стадии течение болезни достигает к двадцати или тридцати годам. Первое подробное описание кератоконуса, отделившее его от других эктазий роговицы, представил в 1854 году британский врач Джон Ноттингем. До сих пор кератоконус остаётся малоисследованным заболеванием, неясны причины его возникновения, также не представляется возможным и прогнозировать ход болезни после постановки диагноза. Оставаясь загадкой для врачей, кератоконус уже не является для пациентов проблемой настолько серьёзной, какой был до разработки методов терапии, контактной коррекции и появления микрохирургии. Ключевым патологическим процессом является постепенное разрушение Боуменовой мембраны, располагающейся между эпителием и стромой роговицы. Эпителий входит в контакт со стромой, что приводит к клеточным и структурным изменениям. Происходит избыточный апоптоз кератоцитов и активация коллагеназных ферментов, приводящих к разрушению межфибриллярных связей и коллагена роговицы. На сегодняшний период существует несколько методов лечения кератоконуса, одним из которых является метод кросслинкинга. Кросслинкинг — относительно новый метод лечения для нашей страны, однако применяется уже с 1994 г. в Европе, а с 2004 г. — во всем мире. Метод роговичного коллагенового кросслинкинга (так же известного, как метод UV-x-linking, С3-R, crosslinking method, UVA method, CCL method) представляет собой фотополимеразацию стромальных волокон, возникающих в результате комбинированного воздействия фотосенсибилизирующего вещества (рибофлавин или витамин В2) и ультрафи- олетового света. Метод был предложен в 1999 году профессором Теодором Зейлером и его соавторами для лечения ряда глазных заболеваний. Основной целью метода является приостановка прогрессии кератоконуса. В нашей клинике мы проводили лечение прогрессирующего кератоконуса, буллезной кератопатии методом кросслинкинга на аппарате «УФалинк». Срок наблюдения составил 7 месяцев. Цель — оценить эффективность проведения кросслинкинга на аппарате «УФалинк» при различных патологиях роговицы. Материал и методы. Под наблюдением находилось 7 пациентов (8 глаз) с диагнозом — прогрессирующий кератоконус I–III стадии. Из них 3 — женского пола и 4 — мужского. Возраст пациентов — от 20 до 32 лет. Один пациент имел в анамнезе радиальную кератотомию по поводу прогрессирующего кератоконуса в 2005 г., рецидив прогрессии кератоконуса наблюдался через 4 года после кератотомии. Под наблюдением также находилось 5 пациентов (5 глаз) с диагнозом буллезная кератопатия (после УЗ ФЭК+ИОЛ в различные периоды). Из них 4 — женского пола и 1 — мужского, в возрасте 57–78 лет. Обследование пациентов включало визометрию, авторефрактометрию, кератотопографию, пахиметрию, офтальмоскопию. Все пациенты обследованы до лечения, через 1, 3, 6 месяцев. Всем пациентам на фоне инстилляционной анестезии выполнена деэпителизация роговицы, затем инстилляция раствора «Декстралинк» в течение 15 минут, после чего выполнено ультрафиолетовое облучение роговицы устройством «УФалинк» в течение 30 минут (6 интервалов по 5 минут, при длине волны 370 нм). Одета мягкая контактная линза до полной эпителизации. Результаты и обсуждение. После проведенного лечения прогрессирующего кератоконуса острота зрения без коррекции улучшилась с 0,04 до 0,1; острота зрения с коррекцией — с 0,09 до 0,4. Данные кератометрии после лечения снизились в среднем с 53,47±8,6 до 49,77±7,4 D, сферический эквивалент рефракции — в среднем с 7,6±0,4 до 4,9±0,1D. По кератотопографической картине от- 113 мечено уменьшение зоны эктазии к 6 месяцу. По пахиметрическим данным — увеличение толщины роговицы в сравнении с дооперационным в среднем с 402 мкм до 498 мкм. У 2 пациентов (в т. ч. пациента с оперированным кератоконусом) острота зрения через 6 месяцев после проведения кросслинкинга сохранялась аналогичной до операции. Не отмечалось также и прогрессии кератоконуса в этот период, хотя до лечения наблюдалась явная тенденция к прогрессии. В послеоперационном периоде 4 пациента из 7 жаловались на ухудшение и неустойчивость зрения, затуманивание в течение примерно 2–3 недель после кросслинкинга. Объективно при офтальмоскопии наблюдался легкий отек слоев стромы, который проходил самостоятельно. Аналогичным образом выполнялось ультрафиолетовое облучение роговицы у пациентов с буллезной кератопатией. У 2 из 5 пациентов контактная линза была оставлена сроком на 1 месяц. После проведенного лечения острота зрения улучшилась в среднем с 0,01 до 0,05. Субъективно все пациенты отмечали уменьшение затуманенности, слезотечения, чувства инородного тела. Объективно при офтальмоскопии наблюдалась полная эпителизация роговицы, исчезновение буллезных изменений, уменьшение складчатости десцеметовой мембраны. К сожалению, данные эффекты сохранялись лишь около месяца. Оба пациента, находившиеся в контактной линзе месяц, в среднем также через 1 месяц после ее снятия отметили появление симптомов, которые были до лечения. Выводы. Применение ультрафиолетового облучения роговицы устройством «УФалинк» у пациентов с прогрессирующим кератоконусом, а также пациентов с буллезной кератопатией является эффективным. Требуется дальнейшее ведение и анализ результатов лечения данных категорий пациентов. А. Д. Чупров, А. Г. Юдин ПРИМЕНЕНИЕ ПРЕПАРАТА «ВИЗИН чистая слеза» ФИРМЫ FARMIGEA S. p. A (Италия) У ПАЦИЕНТОВ ПОСЛЕ КЕРАТОРЕФРАКЦИОННОЙ ХИРУРГИИ Кировская клиническая офтальмологическая больница, г. Киров Все большую распространенность в последние годы приобретает синдром «сухого глаза». Данное заболевание характеризуется огромным количеством субъективных симптомов при относительно малой выраженности объективных признаков. По данным различных авторов, данная патология встречается в среднем у 15–17 % взрослого населения развитых стран мира, и этот показатель неуклонно растет из года в год. На рост заболеваемости в большей степени оказывают влияние широкое развитие офисной техники, систем кондиционирования воздуха, компьютеров, мониторов. Свою роль играют развитие «контактной коррекции», системное использование медикаментов, косметические средства и ухудшение экологической обстановки. Бурное развитие кераторефракционной хирургии (ФРК, ЛАСЕК, ЛАСИК, Супер-ЛАСИК и т. д.) тоже, несомненно, вносит свой вклад в увеличение заболеваемости синдромом «сухого глаза». В связи с этим очень актуален поиск современного, эффек- тивного и недорогого средства для лечения данной патологии. Цель — оценить клинические результаты использования капель «ВИЗИН чистая слеза» фирмы FARMIGEA S. p. A (Италия) у пациентов после кераторефракционной хирургии. Материал и методы. Обследовано 32 человека в возрасте от 18 до 38 лет, из них 19 женщин и 13 мужчин. Всем пациентам в анамнезе были выполнены рефракционные операции (ФРК — 18 пациентов (56 %) и LASIK — 14 пациентов (44 %)), во всех случаях хирургия выполнялась на оба глаза. По срокам после хирургического вмешательства пациенты были разделены на три группы: 11 человек (34 %) — первый месяц после операции; 13 пациентов (41 %) — от 1 до 6 месяцев после операции; 8 пациентов (25 %) — более 6 месяцев после операции. Во время исследований использовались капли «ВИЗИН чистая слеза» фирмы FARMIGEA S. p. A (Италия). Пациенты оценивали свои ощущения до 114 и после использования капель с помощью анкетирования, врач оценивал объективное состояние по 6 признакам так же до и после терапии. Результаты и обсуждение. При анкетировании 56 % (18 человек) не отметили никаких изменений, 28 % (9 человек) отметили ухудшение неприятных симптомов таких как чувство жжения, реакция на свет, ветер, кондиционированный воздух, при этом, помимо ухудшения симптоматики, у 4 человек появилось отделяемое белого цвета у основания ресниц и во внутреннем уголке глаза, 16 % (5 человек) отметили уменьшение затуманивания зрения и улучшение переноси­мости ветра, кондиционированного воздуха и т. д. При осмотре в 69 % случаев (22 человека) не зафиксировано ни отрицательной, ни положительной динамики; в 25 % (8 человек) — отмечено ухудшение в виде увеличения отека конъюнктивы, появления отделяемого из конъюнктивальной полости, уменьшения времени разрыва слезной пленки, появление ксероза в области смыкания глазной щели; в 6 % (5 человек) — было отмечено увеличение времени разрыва слезной пленки. Выводы. Нужно продолжать изучение влияние препарата «ВИЗИН чистая слеза» фирмы FARMIGEA S. p. A (Италия) на течение синдрома «сухого глаза» у пациентов после кераторефракционной хирургии. Н. Е. Щеткина Изменение показателей внутриглазного давления после рефракционной операции LASIK ЗАО СП «Визус-1», г. Нижний Новгород В связи с ростом количества рефракционных операций за последние десятилетия возникает необходимость в адекватной оценке параметров внутриглазного давления у пациентов, перенёсших рефракционную операцию. Известно, что на показатели ВГД влияет толщина роговицы, которая уменьшается в результате лазерного воздействия, а вместе с этим меняются и показатели измеренного ВГД. Следовательно, показатели ВГД у прооперированных пациентов должны быть ниже, что нужно учитывать для своевременного выявления повышения ВГД у таких пациентов в будущем. Цель — сравнить показатели ВГД у пациентов с миопией, сложным миопическим астигматизмом до проведения рефракционной операции LASIK и после нее. Материал и методы. Было обследовано 108 пациентов, 216 глаз с миопией слабой, средней и высокой степени, сложным миопическим астигматизмом до проведения рефракционной операции по технологии LASIK на эксимерном лазере NIDEK-EC 5000 и после проведения операции в сроки от 1 до 3 месяцев. Возраст пациентов от 18 до 45 лет. Всем пациентам проводилась пневмотонометрия на аппарате AUTO/REF/KERATO/TONOMETER RKT 7700 NIDEK. Пациенты были распределены на 3 группы по степени близорукости: 1-я — с миопией слабой степени, сложным миопический астигматизмом — 35 человек (70 глаз); 2-я — с миопией средней степени, сложным миопический астигматизмом — 48 человек (96 глаз); 3-я — с миопией высокой степени, Средние показатели ВГД, мм рт. ст., (М±m) Группы пациентов До операции Миопия слабой степени, сложный миопический астигматизм Миопия средней степени, сложный миопический астигматизм Миопия высокой степени, сложный миопический астигматизм 15,4±0,85 В сроки от 1 до 3 месяцев после операции 11,39±0,82 16,63±0,77 11,09±0,62 15,27±0,80 9,17±0,58 115 Снижение ВГД после операции LASIK 4,01±0,51 р<0,05 5,54±0,45 р<0,05 6,1±0,98 р<0,05 сложным миопический астигматизмом — 25 человек (50 глаз). Результаты и обсуждение. Средние показатели ВГД представлены в таблице. Выводы. Анализ показателей ВГД после проведения рефракционной операции LASIK свидетельствует о снижении ВГД у прооперированных пациентов. Чем выше степень миопии, устраняемая в ходе операции, тем больше снижаются показатели ВГД, измеренные с помощью пневмотонометрии. В результате проведения рефракционной операции LASIK меняется не только рефракция глаза, но и показатели измеренного ВГД. В связи с этим необходимо научиться правильно оценивать показатели измеренного ВГД у пациентов, перенёсших рефракционные операции. Литература 1. Балашевич, Л. И. Рефракционная хирургия / Л. И. Балашевич. — СПб., 2002. — 288 с. 2. Куренков, В. В. Эксимерлазерная хирургия роговицы / В. В. Куренков. — М.: БЭБиМ, 1998. — 154 с. 3. Шамшинова, А. М. Функциональные методы исследования в офтальмологии / А. М. Шамшинова, В. В. Волков. — М.: Медицина, 1999. — 416 с. 4. Серик, А. Н. Офтальмоэргономическое обоснование эксимерлазерных рефракционных операций при миопии: дис. ... канд. мед. наук: 14.00.08 / А. Н. Серик. — М., 2002. — 123 с. 116 Раздел III Новые технологии факоэмульсификации катаракты Mathias Wagner Outcome of Phacoemulsification with torsional ultrasound Augenklinik Großräschen, Germany Many of new phacotechnologies were developed in the It could shown, that the addition of torsional ultralast years worldwide. The new phacoemulsification system sound improves surgeon control and occlusion manage­ from Alcon Laboratories Inc., Fort Worth, Texas, delivers ment by constantly repositioning material on the phaadditional to the longitudinal a torsional ultrasound. koemulsification tip. It also enhances cutting perforWe investigated phacoemulsification procedures with mance, allowing for lower energy production with a longitudinal and additional torsional ultrasound technolo- resultant lower risk for therminal injury and improved gies (Alcon phakomachines Legacy and Infinity). followability. Post-operativ healing time is shortened, Intra-operativ handling and complications, surgical post-operativ visual acuity better in addition with torclock time, post-operativ visual acuity and post-operativ sional ultrasound healing time were reseached. Р. А. Азнабаев, Р. Х. Искандаров, Д. Г. Кувандыкова Эффективность применения программного обеспечения OZil Intelliqent Phaco при факоэмульсификации катаракты Клиника «РИА МЕДОПТИК», г. Уфа Программное обеспечение OZil Intelliqent Phaco (Alcon, Fort-Yort, USA), или OZil IP, было выпущено в сентябре 2009 года. Оно позволяет сочетать две опции рукоятки OZil факоэмульсификатора Infiniti — продольный и торсионный ультразвук. По сравнению с традиционным продольным ультразвуком, торсионный характеризуется меньшей вибрацией и низким термальным воздействием на ткани глаза. Комбинация продольного и торсионного ультразвука позволяет избежать застоя потока и закупорки просвета факоиглы. Однако при факоэмульсификации плотных катаракт возникает необходимость избыточного использования продольного ультразвука. Благодаря OZil IP продольный ультразвук активируется автоматически на короткий промежуток времени при блокировке наконечника крупными фрагментами хрусталика. На фоне активации продольный ультразвук поступает короткими импульсами по 10 мс не более 20, причем их мощность эквивалентна мощности торсионного. Факоэмульсификация при применение OZil IP проходит плавно, без резких подъемов вакуума. Освобождение наконечника от хрусталиковых масс позволяет увеличить аспирационный поток и снизить вакуум. Цель — оценка эффективности применения OZil IP в сравнении с обычной факоэмульсификацией. Материал и методы. Прооперировано 36 человек (47 глаз) в возрасте 68–85 лет с катарактами 3–4 степени плотности по Буратто. Из них 17 женщин и 19 мужчин. Острота зрения до операции была в пределах от светоощущения с правильной проекцией до 0,1. Факоэмульсификацию проводили на аппарате INFINITI Vision System с применением OZil Intelliqent Phaco (17 человек, 22 глаза) и без него (19 человек, 36 глаз). В настройке системы OZil IP продольный ультразвук активировался при повышении вакуума до 95 % от заданного в 400 мм рт. ст. с продолжительность импульса 20 мс. Во время факоэмульсификации при обоих вариантах устанавливались высота бутылки 110, ирригация 65, аспирация 18, динамический подьем 3, вакуум 400. Параметры ультразвука состави- 118 ли следующие показатели: общее использование кумулятивной энергии факоэмульсификации — 9–17 с (OZil IP) и 12–22 с (без OZil IP), продольный ультразвук — 20–24 % и 23–26 %, время — 7–9 с и 9–12 с, торсионный — 20–25 % и 21–26 %, время — 8–19 с и 9–18 с соответственно. При этом достоверно различалось среднее время общего использования кумулятивной энергии факоэмульсификации: с OZil IP оно составило 13,4±1,1 с, без OZil IP — 17,4±1,3 с (р<0,05). Во всех случаях имплантировали гибкие ИОЛ через роговичный тоннельный разрез 2,4 мм. Результаты и обсуждение. Острота зрения пациентов через 1 неделю после операции была в пределах 0,3–1,0, не отличаясь достоверно в обе- их группах (в среднем 0,68±0,14 — в группе с OZil IP и 0,63±0,12 — в группе без OZil IP). Все операции прошли без интра- и постоперационных осложнений, снижение зрения во всех случаях было связано с сопутствующей патологией. Различий в течении послеоперационного периода, в т. ч. в быстроте исчезновения отека роговицы не наблюдалось. Выводы. Программное обеспечение OZi IP позволяет включать дополнительную энергию только в случае необходимости, что обеспечивает уменьшение суммарной мощности и времени ее использования, что является несомненным шагом вперед в развитии технологии данного способа удаления катаракты. К. Н. Ахтямов, А. Р. Кашаева, Э. Л. Усубов Анализ остроты зрения у пациентов, оперированных по поводу дислокации ЗК иол и полного вывиха собственного хрусталика в зависимости от метода операции ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Дислокации ЗК ИОЛ и дистопии собственного хрусталика — нечастая ситуация в офтальмохирургии. Но какой из хирургов, сталкивающийся с этой проблемой не чувствует волну отчаяния, сопряженную с некоторой беспомощностью, говоря с пациентом о потенциально низком прогнозе для зрения? По данным разных авторов, клинически значимые децентрации ИОЛ встречаются в 3 % всех вмешательств по поводу экстракции катаракты [2, 3]. Частота же полных вывихов собственного хрусталика среди пациентов с осложненной катарактой варьирует от 0,1 до 14 % [1], такой разброс данных объясняется в этом случае недоступностью офтальмологической помощи в ряде стран. По России статистика данной патологии не регистрируется и в печати не опубликована. Помимо ухудшения остроты зрения и различного рода нежелательных зрительных эффектов, дислокации ИОЛ и дистопии хрусталика могут привести и к более грозным осложнениям, например, гемофтальм, отслойка сетчатки, кистозный макулярный отек. По данным ряда авторов отслойка сетчатки осложняет дислокацию ИОЛ в 2 % случа- ев, а полную люксацию собственного хрусталика в 10–13 % [5]. Учитывая сложность каждого индивидуального случая дистопии, наличие сопутствующей системной или офтальмопатологии до сих пор не существует определенных рекомендации по технике оперативного вмешательства. Прогноз для зрения во всех случаях низкий. Вероятность послеоперационных осложнений требует полного контроля всего органа зрения пациента в сроки от 2 месяцев до 2 лет. Цель — анализ остроты зрения в «сложных», с хирургической точки зрения, глазах — у пациентов с полным вывихом собственного хрусталика в стекловидное тело и пациентов с люксацией заднекамерной ИОЛ в стекловидное тело в зависимости от метода операции. Материал и методы. В данном проспективном одноцентровом исследовании представлен анализ остроты зрения в глазах с дислокацией ЗК ИОЛ или собственного хрусталика в зависимости от метода операции. В исследовании участвовали 19 пациентов (19 глаз) из них 15 мужчин, 4 женщины, проопе- 119 рированных в сроки от 18.01.2010 по 01.08.2010 в 4 микрохирургическом отделении Уфимского НИИ глазных болезней. Возраст пациентов колебался от 45 до 82 лет. Период наблюдения составил от 1 до 8 месяцев. Критерием включения являлись все случаи дистопии хрусталика и интраокулярной линзы. Критериями исключения являлись: женский пол в репродуктивном возрасте, перенесенные ранее рефракционные операции, травмы глаз, предшествующие дистопии микроангиопатии, патология макулярной области, амблиопия. Пациенты были разделены на 2 группы по нозологическому признаку: вывих собственного хрусталика в стекловидное тело (14 глаз) и дислокация ЗК ИОЛ в стекловидное тело (5 глаз). Всем пациентам было проведено расширенное пред- и послеоперационное обследование, состоящее из определения остроты зрения без коррекции и с максимальной очковой коррекцией, определение уровня внутриглазного давления (ВГД), ультразвуковую биометрию, эхографию (В-сканирование), биомикроскопию, непрямую офтальмоскопию с использованием Ocular Osher MaxField 78,0D. Техника операции. Все оперативные вмешательства выполнялись по стандартным методикам, однако, в зависимости от индивидуальных особенностей глаз варьировали по продолжительности (от 48 до 169 минут). Пациентам с вывихом собственного хрусталика в стекловидное тело выполнялась ленсвитрэктомия с последующей имплантацией ЗК ИОЛ со склеральной фиксацией (10 глаз) или фиксацией к радужке (4 глаза), пациентам с дислокацией ИОЛ — репозиция вывихнутой ИОЛ, субтотальная витрэктомия с дальнейшей фиксацией ИОЛ к радужке (2 глаза) или к склере (3 глаза). При статистической обработке данных применяли Statistica 6.0. Для расчета средней остроты зрения индивидуальные значения в десятичной системе переводили в логарифмическую шкалу logMAR. Различия между средними величинами непрерывных переменных оценивали по парному критерию Стьюдента и считали достоверными при p<0,05, для определения статистически значимых различий использовали критерий Краскелла-Уолиса, а для выявления отличных групп — критерий Данна. Результаты и обсуждение. Две нозологические группы были разделены на подгруппы по методу операции. В группе с дислоцированным хрусталиком в стекловидное тело средняя острота зрения до опера- ции без коррекции составила 0,02, с полной очковой коррекцией — 0,08. Хирургическое вмешательство с имплантацией ИОЛ со склеральной фиксацией привело к статистически значимому повышению некоррегируемой остроты зрения до 0,32 (р=0,001) и наилучшей коррегированной остроты зрения до 0,52 (р=0,005). Ленсвитрэктомия с имплантацией ИОЛ с ирисфиксацией привело к статистически значимому повышению некоррегируемой остроты зрения до 0,47 (р=0,005) и наилучшей коррегированной остроты зрения до 0,61 (р=0,001). Во всех случаях ИОЛ сохраняла правильное положение на всем протяжении наблюдения. В группе с дислокацией ЗК ИОЛ средняя острота зрения до операции без коррекции составила 0,03, с полной очковой коррекцией — 0,05. Репозиция вывихнутой ИОЛ, субтотальная витрэктомия с дальнейшей фиксацией ИОЛ к склере статистически значимо повысила некоррегируемую остроту зрения до 0,57 (р=0,003) и наилучшую коррегированную остроту зрения до 0,61 (р=0,005). Репозиция вывихнутой ИОЛ, субтотальная витрэктомия с имплантацией ИОЛ с ирисфиксацией привело к статистически значимому повышению некоррегируемой остроты зрения до 0,65 (р=0,001) и наилучшей коррегированной остроты зрения до 0,79 (р=0,001). В одном случае были зафиксированы геморрагии из радужки, которые купировались стандартной медикаментозной терапией в течение 12 дней. Достоверно более высокий оптический результат наблюдался при фиксации ИОЛ к радужке, в случае вывиха ИОЛ в стекловидное тело. В каждой нозологической группе при фиксации ИОЛ к радужке, острота зрения была достоверно выше, чем при склеральной фиксации. Подшивание ИОЛ к радужке, как метод ее фиксации, имеет массу известных достоинств — относительная простота и быстрота технического исполнения, снижение риска инфекционных осложнений, в сравнении с транссклеральной фиксацией это выраженное снижение риска развития эпителиальной дисфункции, деформации зрачка. Однако при всех достоинствах шовной фиксации ИОЛ к радужке следует помнить, что данный метод не является универсальным способом крепления ИОЛ. Его применение невозможно или нежелательно в целом ряде случаев, связанных с функциональным или анатомическим дефектом радужной оболочки. 120 Сложность предоперационного состояния глаза при дистопиях хрусталика и дислокациях ИОЛ, необходимость применения витрэктомии диктует хирургу индивидуальное решение в каждом клиническом случае, с учетом его опыта и знаний, а также в зависимости от владения определенной методикой. Выводы. В данной работе на примере 19 осложненных случаев дислокации ЗК ИОЛ и хрусталика определена статистически значимая разница в послеоперационной остроте зрения пациентов с раз- личными методами фиксации ИОЛ. Однако, на данном этапе исследования не планировалось рассчитывать хирургически индуцированный астигматизм и сроки его разрешения или возможности его коррекции, данное направление также может характеризовать метод фиксации ИОЛ по отношению к окончательному прогнозу. Также в дальнейшем планируется введение модели исследования «один хирург», что также снижает вероятность статистической ошибки. Литература 1. Маллюгин, Б. Э. Проблемы хирургии катаракты и интраокулярной коррекции: достижения отечественной школы и современные тенденции развития / Б. Э. Маллюгин, Л. Ф. Линник, Э. В. Егорова [и др.] // Вестн. РАМН. — 2007. — № 8. — С. 9–16. 2. Kraff, M. C. A servey of intraocular lens explantations / M. C. Kraff, D. R. Sanders, M. G. Raanan // J. Cataract Refract. Surg. — 1986. — Vol. 12. — P. 644–650. 3. Mamalis, N. Complications of foldable intraocular lenses requiring explantation or secondary intervention — 1998 survey / N. Mamalis // J. Cataract Refract. Surg. — 2000. — Vol. 26. — P. 766–772. 4. Lichten Wu. Intraocular Lens Dislocation / Wu Lichten // Medicine Ophthalmology. — Mar. 9, 2010. 5. Ruiz-Moreno J. M. Repositioninig dislocated posterior chamber intraocular lenses. In Master Techniques in Ophthalmic Sergery / J. M. Ruiz-Moreno. — Williams & Wilkins, 1995. — P. 797–807. М. М. Бикбов, М. Ш. Абсалямов, Г. Р. Алтынбаева Имплантация мультифокальной дифракционно-рефракционной ИОЛ после кераторефракционной операции ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Коррекция астигматизма различных степеней с помощью эксимерлазерной абляции прочно вошла в хирургическую практику. Данная методика позволяет достичь высокой остроты зрения. Интраокулярная коррекция после предшествующего LASIK заманчива и перспективна. Однако представляет определенный риск. Современные мультифокальные линзы позволяют достичь «псевдоаккомодационного» зрения, этот эффект возникает благодаря наличию переходных зон в оптической части, тем самым обеспечивая для пациентов комфортное зрение на любом расстоянии до рассматриваемого предмета при различных условиях освещения [1, 2, 3]. Ранее перенесённая радиальная кератотомия считается противопоказанием для имплантации аподизированной дифракционной линзы Acrysof ReSTOR. Успешное развитие факоэмульсификации, социальный рост пациентов, необходимость в качественном зрении вблизи и вдаль, привело к расши- рению показаний к применению мультифокальных линз. Материал и методы. Пациентка В., 38 лет, обратилась в Уфимский НИИ ГБ с жалобами на низкое зрение левого глаза. Смешанный астигматизм левого глаза выявлен в детском возрасте. По поводу имеющегося заболевания ОS пациентке было проведено рефракционное вмешательство — LASIK. Спустя год начала отмечать прогрессивное снижение зрения левого глаза, что и заставило обратиться за медицинской помощью. Зрительные функции парного глаза были сохранены, при объективном исследовании не было выявлено признаков начальной катаракты и пресбиопии. Острота зрения правого глаза — 0,9 н. к., левого — 0,08 н. к. Кератометрия: OD — K1–43,68 ax 116°, K2–44,20 ax 26°, OS — K1–41,87 ax 173°, K2–42,61 ax 83°. 121 Кератотопография левого глаза на аппарате «OPD-scan»: в центральной зоне толщина роговицы 528 мкм. Длина передне-задней оси правого и левого глаза 22,85 и 23,05 мм соответственно. Учитывая объективные данные и мотивацию пациентки избавиться от дополнительной очковой коррекции для близи, было проведено оперативное вмешательство: факоэмульсификация с имплантацией мультифокальной ИОЛ Acrysof Restor (add +3) по стандартной методике. О возможных осложнениях (погрешность в расчете, учитывая предшествующее кераторефракционное вмешательство, побочные фотопические феномены) больная была предупреждена. Расчет оптической силы ИОЛ производился на аппарате «IOL-Master» по формуле SRK/II на M-0,2. Расчетная сила ИОЛ на OS была +23,5 дптр. Операция выполнялась на факоэмульсификаторе «INFINITY» по общепринятой методике с тоннельным самогерметизирующимся разрезом в более сильном меридиане. Линза имплантировалась в капсульный мешок, тщательно центрировалась. В конце операции использовали инстилляции миотиков для стабильного положения ИОЛ. В послеоперационном периоде пациентка получила стандартную противовоспалительную терапию. Для оценки зрительных функций исследовали визометрию на различных расстояниях и при различных условиях освещения, проводили рефрактометрию, пневмотонометрию. Определялись ближайшая точка ясного зрения, объем псевдоаккомодации, пространственно-контрастная чувствительность, субъективная удовлетворенность путем анкетирования, абберации волнового фронта. Результаты и обсуждение. Послеоперационный период ареактивный. В 1-е сутки после операции острота зрения OS вдаль была 0,7, вблизи — 0,3. Через 1 мес. после операции: жалоб нет. Объективно, по данным биомикроскопии OS: глаз спокоен, слизистая спокойна, роговица прозрачная, передняя камера средней глубины, влага прозрачная, интраокулярная линза в правильном положении, центрирована, зрачок круглый, 3 мм в диаметре, радужка спокойна. Офтальмоскопия OS: ДЗН бледно — розовый, границы четкие, ход сосудов не изменен. Острота зрения на различные расстояния представлена в табл. 1. Как видно из таблицы во всех случаях высокие результаты получены при фотопических условиях, что совпадает с литературными данными. Таблица 1 Острота зрения пациентки В., после имплантации МИОЛ Acrysof Restor Условия Острота Острота Острота зрения на освещен- зрения зрения среднем расстояности вдаль вблизи нии (65–70 см) Мезопические 0,9 0,4 0,2 Фотопические 1,0 0,6 0,3 Таблица 2 Динамика показателей авторефрактометрии Срок наблюдения sph cyl До операции –9,25 –5,00 2 день после операции +1,25 –1,00 Спустя 1 месяц после операции +0,5 –0,75 ax 7 141 135 По данным авторефрактометрии (табл. 2) сферический компонент составил +0,5 дптр, но объективно он не изменял остроту зрения ни вблизи, ни вдаль. Как известно, данный метод при имплантации мультифокальных ИОЛ не является информативным из-за погрешностей, возникающих при прохождении луча через дифракционную структуру линзы. Но, как видно в таблице, спустя месяц сферический компонент имел тенденцию к регрессии, стремился к «рефракции цели». Объем псевдоаккомодации (методом дефокуса с добавлением сфер 0,5 дптр) на оперированном глазу составил 4,5 дптр, на парном неоперированном глазу — 5,5 дптр. Ближайшая точка ясного зрения на левом глазу была равна 30 см, на парном глазу — 20 см. После операции на оперированном глазу отмечалось снижение пространственно-контрастной чувствительности к ахроматическим синусоидальным решеткам на высоких и средних частотах по сравнению с парным глазом на 7–9 %. Данные аберрометрии (рис. в Приложении) показывали уменьшение клинически значимых аберраций после операции. Субъективно пациентка удовлетворена проведенным лечением, бинокулярной некорригированной остротой зрения вдаль, вблизи и на промежуточном расстоянии. Пациентка не использует очковую коррекцию для близи и дали, не отмечает затруднений при работе на компьютере, вождении автомобиля в сумерках и темноте. Световые явления не выявлены. 122 Выводы. На основе представленного клиниче- коррекции афакии после кераторефракционных опеского случая подтверждается эффективность имплан- раций и возможность полноценной зрительной реабитации мультифокальных ИОЛ AcrySof ReSTOR для литации пациентов в послеоперационном периоде. Литература 1. Балашевич, Л. И. Факоэмульсификация катаракты — 10 летний опыт / Л. И. Балашевич, И. Я. Баранов, Л. А. Переведенцева // Офтальмохирургия. — 2005. — № 3. — С. 45–51. 2. Егорова, Е. В. Первый опыт имплантации мультифокальных линз ACRYSOF RESTOR / Е. В. Егорова // Новые технологии в офтальмологии, 4-я: мат-лы. — Новосибирск, 2006. — С. 49–50. 3. Тахчиди, Х. П. Мультифокальные ИОЛ: патентный поиск и классификация / Х. П. Тахчиди, Б. Э. Малюгин, Т. А. Морозова // Новое в офтальмологии. — 2004. — № 4. — С. 31–39. А. А. Бикбулатова Контрастная чувствительность при односторонней гиперметропии высокой степени до и после рефракционной ленсэктомии с имплантацией ИОЛ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Для комплексной оценки функционального состояния зрительного анализатора и результатов лечения, помимо стандартной визометрии по таблицам Сивцева, проводят исследование пространственной контрастной чувствительности (ПКЧ) — визоконтрастометрию. Контрастная чувствительность глаза — функция, определяющая минимальный контраст, необходимый для обнаружения изображений различной величины и контраста [2, 3]. Цель — исследовать контрастную чувствительность при односторонней гиперметропии высокой степени до и после рефракционной ленсэктомии с имплантацией ИОЛ. Материал и методы. Под нашим наблюдением находилось 17 детей в возрасте от 6 до 16 лет с односторонней гиперметропией высокой степени, осложненной во всех случаях «глубокой» амблиопией. Клиническая рефракция оперированных глаз составляла от +6,38 D до +12,0 D (7,85±0,46 D). Рефракция парного глаза была в пределах ±1,0 D от эмметропии. Аспирацию прозрачного хрусталика выполняли по щадящей «сухой» технологии без ирригации с применением вискоэластика. Для имплантации применяли заднекамерные монофокальные ИОЛ модели Simkoe из полиметилметакрилата и складывающиеся ИОЛ (Centerflex и Acrysof). Исследование ПКЧ проводили на IBM совместимом компьютере с помощью программы «Зе- бра» (авторы А. Е. Белозеров, А. М. Шамшинова, «ООО Астроинформ СПЕ»). Стимулами служили ахроматические (черно-белые) и хроматические (черно-красные, черно-зеленые и черно-синие) синусоидальные решетки вертикальной и горизонтальной ориентации с пространственными частотами от 0,5 до 22 цикл/град. Динамику ПКЧ оперированных глаз оценивали на основе сравнения с ПКЧ глаз здоровых детей, исследованных нами ранее [1]. Результаты и обсуждение. Острота зрения без коррекции (0,17±0,03) уже в раннем послеоперационном периоде после рефракционной ленсэктомии с имплантацией ИОЛ превышала уровень дооперационной корригированной (0,09±0,03). При исследовании визоконтрастометрии до операции в условиях полной очковой коррекции выявлено снижение ПКЧ глаз с односторонней аметропией высокой степени на все паттерны: как на ахроматические, так и на цветные (рис. в Приложении). В области низких пространственных частот (0,5–1,4 цикл/град) контрастная чувствительность была в пределах допустимых границ нормы. Снижение ПКЧ от средних значений нормы на низких частотах составило до 5 дБ. В диапазоне средних частот (2,0–5,6 цикл/град) выявлено снижение контрастной чувствительности в пределах от 7 до 15 дБ ниже нормы. Более выраженное снижение контрастной чувствительности наблюдалось в области высо- 123 ких частот (8,0–22,0 цикл/град), составив от 14,5 до 20 дБ ниже нормы. Наблюдалась тенденция к меньшему снижению сохранности контрастной чувствительности к синему стимулу по сравнению с красным (рис. в Приложении). Максимальные различия в контрастной чувствительности к синим и красным синусоидальным решеткам соответствовали зоне высоких частот. В результате интраокулярной коррекции односторонней аметропии высокой степени контрастная чувствительность в области средних и высоких частот существенно повысилась по сравнению с дооперационными данными, а на низких частотах практически не отличалась от средних нормальных значений (рис.6). На средних частотах снижение чувствительности составило в диапазоне от 1 до 7 дБ ниже нормы. На высоких частотах снижение сохранности ПКЧ было в пределах от 6 до 12 дБ ниже нормы. На контрлатеральных глазах без амблиопии в нашем исследовании у 25,5 % детей до операции выявлено снижение контрастной чувствительности в области высоких частот до 5 дБ ниже нормы (рис. в Приложении). Несмотря на нормальные в среднем показатели контрастной чувствительности контрлатеральных глаз, после хирургической коррекции глаз с аметро- пией высокой степени наблюдалось дополнительное повышение ПКЧ неоперированных глаз на всех частотах (рис. в Приложении). При решении вопроса о проведении операции на начальном этапе исследования мы рекомендовали рефракционную ленсэктомию 2 детям с глубокой амблиопией, у которых дооперационная некорригированная острота зрения составляла 0,03, а корригированная — всего лишь на одну сотую выше. Но эти дети также, несмотря на незначительную динамику остроты зрения в ранние сроки после операции, отмечали повышение чёткости и яркости изображений, что подтверждалось повышением пространственной контрастной чувствительности оперированного глаза. Таким образом, развитие и совершенствование хирургических методов коррекции обуславливает стремление к достижению не только полного и предсказуемого рефракционного эффекта, но ставит задачу улучшения офтальмоэргономических показателей. Повышение ПКЧ в результате рефракционной ленсэктомии с имплантацией ИОЛ положительно характеризует метод, как улучшающий качество зрения, и подтверждает его эффективность в коррекции односторонней гиперметропии высокой степени у детей. Литература 1. Бикбов, М. М. Сравнительный анализ контрастной чувствительности у здоровых детей различного возраста / М. М. Бикбов, А. А. Бикбулатова, А. А. Фархутдинова // Современные методы диагностики в офтальмологии. Анатомо-физиологические основы патологии органа зрения. Федоровские чтения — 2006: сб. науч. ст. — М., 2006. — С. 15–17. 2. Шамшинова, А. М. Контрастная чувствительность в диагностике заболеваний зрительного анализатора: метод. пособие для врачей / А. М. Шамшинова, В. М. Шапиро, А. Е. Белозеров [и др.]. — М., 1996. — 18 с. 3. Эскина Э. Н. Контрастная чувствительность при различных аномалиях рефракции до и после фоторефракционной кератэктомии / Э. Н. Эскина, А. М. Шамшинова, А. Е. Белозеров // Клин. офтальмол. — М., 2001. — Т. 2. — № 2. — С. 75–78. Р. А. Гундорова, Т. Н. Киселева, К. А. Рамазанова, И. Ю. Бехорашвили, О. Г. Оганесян Возможности ультразвуковой иммерсионной биометрии для расчета оптической силы ИОЛ у пациентов с миопией ФГУ «МНИИ глазных болезней им. Гельмгольца» Минздравсоцразвития России, г. Москва Известно, что рефракция глаза зависит от пре- размера глаза. Точная оценка этих биометрических ломляющей силы роговицы, хрусталика, его поло- параметров определяет качество интраокулярной жения в оптической системе глаза и переднезаднего коррекции афакии. Исследования, проведенные 124 Olsen в 2007 и 2008 гг., показали, что на послеоперационный рефракционный результат влияют погрешности при измерении дооперационных биометрических параметров глазного яблока: глубины передней камеры (42 %), переднезадней оси (ПЗО) глаза (36 %) и горизонтального диаметра роговицы (22 %). Высокие требования к точности расчета оптической силы ИОЛ и в ряде случаев неудовлетворенность рефракционными результатами имплантации искусственных хрусталиков стимулировали появление новых высокотехнологичных методов измерения биометрических параметров глаза. В последние годы многие авторы указывают на более точное определение биометрических показателей с помощью оптической когерентной биометрии. Однако, до сих пор методом выбора остается ультразвуковая биометрия, продолжается поиск и разработка оптимальных критериев точности расчета ИОЛ при различных величинах ПЗО глаза. Цель — изучение возможности иммерсионной биометрии в измерении биометрических параметров глаза и сравнительная оценка ультразвуковой контактной, иммерсионной и оптической когерентной биометрии для точности расчета ИОЛ у лиц с миопией. Материал и методы. Обследовано 40 пациентов (65 глаз) с катарактой и миопией в диапазоне от —1,5 Д до —17,0 Д (в среднем —9,25 Д). Возраст пациентов колебался от 46 до 78 лет. Средний возраст составил 67,5 лет. Помимо традиционных офтальмологических методов исследования, всем пациентам проводили офтальмометрию, ультразвуковую контактную и иммерсионную биометрию, а также оптическую когерентную биометрию глаза. Ультразвуковую контактную и иммерсионную биометрии проводили на ультразвуковом сканере А-Scan Plus, Accutome (США) с использованием датчика частотой 10 МГц со световой фиксацией. Оптическую когерентную биометрию выполняли при помощи прибора «IOL-Master 500» (Carl Zeiss, Германия). Осуществляли пятикратное измерение биометрических показателей на обоих глазах с определением погрешностей между максимальными и минимальными значениями. В зависимости от величины ПЗО все пациенты были разделены на 2 группы. В 1 группу вошли 18 пациентов (30 глаз) с ПЗО глаза до 25 мм, 2 группа включала 22 пациента (35 глаз) с ПЗО глаза более 25 мм. Для расчета оптической силы ИОЛ использовали формулы последнего поколения SRK-II, SRK/T, Hoffer Q, Haigis, Holladay 1. Вычисляли ошибку расчета оптической силы ИОЛ — разницу между расчетной и полученной послеоперационной рефракцией. Результаты и обсуждение. Сравнительный анализ точности расчета оптической силы ИОЛ на основании ультразвуковой контактной, иммерсионной и оптической биометрии показал, что оптическая когерентная биометрия и иммерсионная биометрия имеют преимущество по сравнению с контактной. В результате измерения биометрических показателей разница между значениями ПЗО, полученными при оптической и иммерсионной биометрии в среднем равнялась 0,30 мм, при оптической и контактной биометрии — 0,55 мм. При этом значение случайной погрешности измерения показателя ПЗО глаза при контактной биометрии составило 0,24 мм, при оптической биометрии — 0,05 мм и иммерсионной биометрии — 0,03 мм. При проведении контактной биометрии максимальные значения погрешности отмечались у пациентов 2 группы с ПЗО более 25,0 мм, поскольку при измерении размера глаза в области стафиломы будет получена большая величина, чем, если ультразвуковая волна отразится от края стафиломы. Измерение глубины передней камеры с помощью ультразвуковой контактной биометрии показало значительную погрешность, равную в среднем 0,34 мм и минимальную при иммерсионной биометрии — 0,04 мм. Ошибка расчета оптической силы ИОЛ при использовании оптической биометрии у всех пациентов в среднем составила 0,58 Д, при контактной ультразвуковой биометрии — 0,66 Д, при иммерсионной биометрии — 0,62 Д. В 1 группе средняя ошибка расчета при оптической биометрии была 0,42 Д, при контактной ультразвуковой биометрии — 0,52 Д, при иммерсионной биометрии — 0,66 Д. Во 2 группе при оптической биометрии средняя ошибка составляла 0,58Д, при контактной ультразвуковой биометрии — 0,74 Д, при иммерсионной биометрии — 0,62Д. Выводы. Применение метода оптической когерентной биометрии способствует уменьшению средней ошибки расчета оптической силы ИОЛ по сравнению с контактной и иммерсионной биометрией (от 0,42 Д до 0,52 и 0,66 Д) у лиц с миопией и величиной ПЗО глаза не более 25 мм. В то же время у пациентов с ПЗО глаза более 25 мм средняя ошибка расчета оптической силы ИОЛ при проведении 125 оптической когерентной биометрии была аналогична таковой при измерении ПЗО с помощью метода иммерсионной биометрии. Учитывая, что возможности метода оптической биометрии ограничены при помутнениях роговицы, зрелых и плотных за- днекапсулярных катарактах, иммерсионный метод биометрии остается методом выбора для измерения биометрических параметров глаза с последующим расчетом ИОЛ у лиц с катарактой и миопией средней и высокой степени. С. Г. Игнатьев 1, С. Г. Игнатьева 2, И. Х. Аль-Дандан 1, Н. Н. Бабошина 3 КЛИНИЧЕСКОЕ ИССЛЕДОВАНИЕ АКТУАЛЬНОСТИ ВОПРОСА ПРОФИЛАКТИКИ И ПРЕВЕНТИВНОГО ЛЕЧЕНИЯ НАЧАЛЬНОЙ И НЕЗРЕЛОЙ КАТАРАКТЫ 1 АНО НИЦ «Биофизика ангионейропротекции», 2 3 кафедра офтальмологии МГСМУ, ЦАХ ФГУЗ «ЦМСЧ №119 ФМБА России», г. Москва Удаление катаракты является самой распространённой глазной операцией. Она хорошо отработана по технике исполнения, даёт очень высокий процент положительных результатов и минимальное количество осложнений. При этом предлагается широкий ассортимент аксессуаров как для пациента, так и для хирурга. Успехи в хирургии катаракты обусловлены тем вниманием, которое уделяется международной научной офтальмологической общественностью за последние 40 лет. Если проследить тематику публикаций в научной литературе, то можно отметить возрастание количества статей по катарактальной хирургии и неуклонное снижение публикаций по достижениям профилактики и лечения начальных стадий помутнения хрусталика. За последние 10 лет последние — вообще единичные. Несмотря на успехи хирургии катаракты, актуальность совершенствования этого направления по-прежнему сохраняется. Об этом свидетельствуют такие факты как обязательное включение этой тематики, и её доминирование в регламенте почти всех научно-практических конференций и съездов офтальмологов. В то же время актуальность вопроса профилактики и превентивного лечения начальной катаракты видимо исчезает с «повестки дня». Этот тематический раздел, в настоящее время, очень редко включается в рабочие планы офтальмологических «мероприятий». Мы столкнулись на практике, при обсуждении научных тематик, даже с таким мнением, что даль- нейшая разработка профилактического направления при катаракте бесперспективна и является необоснованной тратой финансовых и иных средств. Это мнение официально не публикуется, но «кулуарно» имеет место быть. Мы решили провести научное социальное исследование с целью: выяснить актуальность вопроса превентивного консервативного и хирургического лечения катаракты с точки зрения самих пациентов. Материал и методы. Нами была разработана специальная анкета, посредством которой было опрошено 150 пациентов с начальной и незрелой катарактой. Из них 45 мужчин и 105 женщин в возрасте от 56 до 78 лет, которые наблюдались в течение 2–3 лет с частотой осмотра 2–3 раза в год. Пациентам разъясняли, что консервативное лечение не улучшит зрительных функций, а может лишь стабилизировать их. Хирургическое лечение может радикально улучшить зрительные функции вплоть до их восстановления или даже превысить остроту зрения, до существовавшей до формирования катаракты. Больные были распределены на три группы в зависимости от остроты зрения (0,9–0,3) (табл. 1). Всем пациентам проводилось стандартное офтальмологическое обследование: авторефкератометрия, визометрия, тонометрия, компьютерная периметрия, эхобиометрия, исследование КЧСМ, биомикроскопия переднего и заднего отрезка глаза, прямая и обратная офтальмоскопия. Причиной снижения остроты зрения были только изменения в хрусталике. Другие причины исклю- 126 Таблица 1 Характеристика исследуемых групп Острота зрения № гр. I II III ВСЕГО 0,7–0,9 0,6–0,5 0,4–0,3 Кол-во n % 55 50 45 150 36,7 33,3 30,0 100 Возраст 56–62 67–74 69–78 56–78 чались. При необходимости проводили оптическую когерентную томографию сетчатки и зрительного нерва, флюоресцентную ангиографию и электрофизиологические исследования. Этиология катаракты была различной (табл. 2). Таблица 2 Виды катаракты Виды катаракты Возрастная Осложненная Врожденная Травматическая ВСЕГО Количество человек 133 12 3 2 150 % 88,6 8,0 2,0 1,3 100 Результаты и обсуждение. Пациенты первой группы в 49,1 % случаев жалоб активно не предъявляли вообще, в 27,3 % случаев отмечали периодическое появление «тумана » перед глазами, в 23,6 % случаев жаловались на снижение зрения вдаль или вблизи. Во второй группе 32 % активно жалоб не предъявляли, в 20 % случаев жаловались на периодическое затуманивание (появление «пелены») в глазах или снижение зрения вдаль, и лишь 48 % чётко отмечали постоянное снижение зрения вдаль и вблизи. Среди пациентов третьей группы жалобы отсутствовали в 6,7 % случаев, периодическое снижение зрения вдаль и вблизи, искажение предметов отмечали 15,6 %, конкретные жалобы на изме- n 11 15 19 45 Муж. Пол % 7,3 10,0 12,7 30,0 n 44 35 26 105 Жен. % 29,3 23,3 17,3 69,9 нение зрения, в том числе, снижение зрения вдаль и улучшение зрения вблизи, искажение предметов, эффект «гало» при взгляде на источник света, изменение цветоощущения предъявляли 77,8 % больных. Проводимое консервативное лечение по поводу катаракты (табл. 3) включало: местное, (таурин, квинакс, катахром, витайодурол); общее — приём поливитаминов, биологически активных добавок (БАД). В первой группе существующая острота зрения устраивала полностью 105 человек (63,6 %), 22 пациента хотели бы её улучшить (36,6 %), но без хирургического вмешательства. Причинами отказа от операции были: боязнь операционных и послеоперационных осложнений — 28 человек (17 %); неудовлетворительное общее состояние — 2 человека (1,2 %). Среди пациентов 2-ой группы существующая острота зрения устраивала 61 человека (40,7 %), остальные 74 (49,3 %) опрошенных хотели бы улучшить её, но без операции. Только 15 пациентов (10 %) этой группы в возрасте до 62 лет, с нарушением бинокулярного зрения (разницей в остроте зрения между глазами более 30 %), согласились на хирургическое лечение катаракты. Пациентов 3-ей группы имеющаяся острота зрения устраивала в 39 случаях (28,9 %), 69 человек (51,1 %) хотели бы ее улучшить без операции (причина — боязнь операционных осложнений), 27 человек (20 %) при снижении зрения вдаль до 0,5–0,4 Таблица 3 Выбор пациентами тактики лечебных мероприятий Группа I II III ВСЕГО 55 50 45 150 n 21 37 42 100 Консервативное лечение местное общее % n 14,0 12 24,7 17 28,0 23 66,7 52 127 Хирургическое лечение % 8,0 11,3 15,3 34,6 n % — 5 9 14 — 3,3 6,0 9,3 активно выбрали тактику хирургического лечения катаракты. Анализ результатов проведенного исследования показал, что при начальной катаракте и снижении остроты зрения вдаль (до 0,7), «существующее положение вещей» устраивает до 100 % пациентов и они предпочитают тактику пассивного выжидания (40 %) или превентивной консервативной терапии (60 %). При незрелой катаракте с остротой зрения вдаль до 0,6 консервативное лечение предпочитает 90 % больных. Лишь 10 % выбирает хирургическую тактику решения проблемы. Но выбор хирургического лечения обусловлен снижением зрения лишь у 50 % пациентов, а в остальных случаях неверием в эффективность закапывания капель на существующих житейских примерах. При незрелой катаракте со снижением остроты зрения вдаль до 0,5–0,3 в 20 % случаев пациенты вы- бирают хирургическую тактику решения проблемы. Даже при наличии сниженного зрения, которое реально и существенно ощущается человеком, тактику консервативного лечения выбирает 80 % пациентов из-за боязни операции и операционных осложнений. Выводы. Проведенное нами исследование показывает, что лишь 9,3 % больных с начальной и незрелой катарактой выбирают тактику активного хирургического лечения. Остальные 68,5 % пациентов, по многоплановым причинам выбирают активную тактику превентивного консервативного лечения, а 22,2 % пассивного выжидания. Поэтому, учитывая такой выбор наших пациентов, поиск новых методов консервативного лечения катаракты является таким же актуальным направлением современной офтальмологии, как усовершенствование и разработка более безопасных способов хирургического лечения катаракты. М. А. Ковалевская, В. Л. Кокорев, П. А. Шаповалов, Л. А. Филина, Н. В. Ведринцева К ВОПРОСУ ПРОГНОЗИРОВАНИЯ И ПРОФИЛАКТИКИ ПОСЛЕОПЕРАЦИОННЫХ ОСЛОЖНЕНИЙ В ХИРУРГИИ ДИАБЕТИЧЕСКОЙ КАТАРАКТЫ Кафедра офтальмологии Воронежской государственной медицинской академии им. Н. Н. Бурденко, г. Воронеж Механизм развития осложненных катаракт схож с катарактогенезом при возрастной катаракте. При осложненной катаракте процессы изменения в хрусталике происходят более интенсивно под воздействием нарушений иммунологического баланса, окислительных процессов и биохимических изменений, которые происходят в организме и местно в органе зрения. Наибольшее количество осложнений возникает при экстракции осложненной катаракты, так как её развитие уже связано с наличием какого-либо фонового заболевания (расстройства обмена, эндокринные нарушения), дополнительной глазной патологией (увеиты, синдром Фукса, вторичная глаукома), воздействием внешних факторов. Подобного рода состояния обуславливают наличие патологических изменений в иммунной, со- судистой системах, обменные нарушения, обусловливающие различные послеоперационные осложнения (гифема, послеоперационный иридоциклит, экссудативная воспалительная реакция (ЭВР), эпителиально-эндотелиальные дистрофии роговицы, макулярный отек с исходом в дистрофию сетчатки). Таким образом, прогнозирование и профилактика послеоперационных осложнений, а так же алгоритм специфической схемы предоперационной подготовки является важными и актуальными в хирургии диабетической катаракты. Цель — изучить состояние иммунной и антиоксидантной систем организма пациентов с осложненной диабетической катарактой, оценить эффективность применяемой предоперационной подготовки для профилактики осложнений в интра- и послеоперационном периоде. 128 Материал и методы. Нами были исследованы 2 группы пациентов: I — больные с осложненной диабетической катарактой (78 пациентов); II — контрольная группа — пациенты с возрастной катарактой (58 человек). Материалом исследования служили: слезная жидкость, переднекамерная жидкость и кровь больных с осложненной катарактой для исследования иммунного статуса организма, показателей ПОЛ в слезе и крови и определения активного пероксиредоксина VI и/или фрагментов его распада в слезе и переднекамерной жидкости. Пациентам всех групп в до- и послеоперационном периоде были проведены клинические и офтальмологические исследования, изучали белковый состав слезы, жидкости передней камеры, стекловидного тела, субретинальную жидкость, иммунологический статус (клеточный и гуморальный иммунитет, показатели неспецифической резистентности) и показателей ПОЛ в слезе и крови (определение предпоследнего звена в цепи ПОЛ — МДА в слезе и крови и определение содержания SH-групп в крови). Экстракция катаракты проведена методом факоэмульсификации на аппарате BAUSCH&LOMB «MILLENNIUM» с имплантацией интраокулярной линзы. Результаты и обсуждение. В предоперационном периоде в группе больных с осложненной диабетической катарактой, состоящей из 78 пациентов (156 глаз), со стороны клеточного иммунитета наблюдалась Т-лимфопения с дефицитом Т-хелперов и небольшим дефицитом Т-супрессорного звена, что привело к дисбалансу хелперно-супрессорного соотношения и снижению индекса CD 4/CD 8 (р<0,05). При исследовании гуморального звена иммунитета в группе с диабетической катарактой важно отметить достоверное снижение содержания В-лимфоцитов и иммуноглобулина M (IgМ) по сравнению с группой пациентов с возрастной катарактой (. р<0,05), а также достоверное увеличение концентрации иммуноглобулинов A и G (IgA и IgG) (. р<0,05). В группе больных с возрастной катарактой было отмечено увеличение содержания IgМ, и снижение — IgA и IgG. Изучая показатели ПОЛ в предоперационном периоде, в группе с осложненной диабетической катарактой отмечались достоверно более высокие цифры содержания конечного продукта перекис- ного окисления липидов (МДА) в крови и слезе по сравнению с группой пациентов с возрастной катарактой (р<0,05), повышение содержания SH-групп крови по сравнению с контрольной группой не было достоверным. При исследовании переднекамерной жидкости у пациентов I группы был выявлен маркер развития метаболических нарушений при осложненной катаракте — белок 45 kDa — транспортер гидрофобных соединений семейства Sec—14p — подобных белков. В составе слезы II группы пациентов (возрастная катаракта различной степени зрелости) обнаружен важный антиоксидантный белок — пероксиредоксин VI. В группе пациентов с осложненной диабетической катарактой данный маркер полностью отсутствовал или был выявлен в сверхмалых количествах. При исследовании переднекамерной жидкости у пациентов I группы были идентифицированы следующие белки: I. Chain A, Human Serum Albumin Mutant R218p Complexed With Thyroxine; II. Chain A, 2.0 Angstrom Structure Of Intact Alpha-1-Antitrypsin: A Canonical Template For Active Serp; IIIa. Chain A, 2.85 A Crystal Structure Of Pedf etc. Кроме того, был выявлен маркер развития метаболических нарушений при осложненной катаракте и ПВР — белок 45 kDa — транспортер гидрофобных соединений семейства Sec—14p — подобных белков. В составе слезы II группы пациентов (возрастная катаракта различной степени зрелости) — были идентифицированы следующие белки: I. Chain A, Structure Of Human Apolactoferrin At 2.0 A Resolution; II. Chain A, Crystal Structure Of Human Fcari Bound To Iga1-Fc; III. Chain B, Human Zinc-Alpha-2-Glycoprotein; V. Chain A, Crystal Structure Of Mutant Human Lysozyme Substituted At Left-Handed Helical Positions. Кроме того, был выявлен маркер развития возрастных изменений хрусталика — пероксиредоксин VI в пробах. Во всех образцах при возрастной катаракте проявлялась полоса в области 14 килодальтон. Нами выявлена деградация пероксиредоксина VI на фрагменты с массой около 14 килодальтон. В дополнение к традиционной схеме на протяжении 10 дней перед операцией и в послеоперационном периоде (5–7 дней) мы назначали: Даприл (лизиноприл) внутрь в качестве ангиопротекторного и гипотензивного средства; Окомистин — 2 капли 129 в оперируемый глаз 4 раза в день в качестве антисептика и местного иммуномодулятора; Гистохром в качестве антиоксиданта — подконъюнктивально 0,02 % раствор ежедневно по 0,3 мл 2 раза в день; Глутоксим 1 % — 1 мг, 1 раз в 3 дня. В I группе визуальные исходы были достоверно выше, по сравнению с исходными показателями, острота зрения в послеоперационном периоде в среднем составила 0,8±0,05 (р<0,05), количество осложнений в послеоперационном периоде было значительно ниже по сравнению со второй группой. Гифема наблюдалась в 3 случаях из 31-го, макулярный отек — в 2, экссудативно-воспалительная реакция развилась у 3 пациентов. При исследовании иммунологического статуса в первой группе больных после проведения предложенной нами предоперационной терапии отмечалась нормализация иммунологических показателей, достоверное увеличение общего количества Т-лимфоцитов и Т-хелперов в периферической крови (р<0,05). Со стороны гуморального звена иммунитета в первой группе наблюдалось достоверное увеличение количества В-лимфоцитов и достоверное снижение содержания IgG и IgA по сравнению с исходными данными (р<0,05). Отмечалось также увеличение концентрации IgM по сравнению с исходными данными. При анализе содержания МДА в крови и слезе, SH-групп крови, после операции и проведения предоперационного лечения, в данной группе было выявлено их достоверное снижение по сравнению с исходными данными (р<0,05). Выводы. Предложенная схема предоперационной подготовки и послеоперационного ведения пациентов позволяет селективно осуществлять профилактику воспалительных и сосудистых осложнений при экстракции диабетической катаракты. Разработанный алгоритм для пациентов с диабетической катарактой необходим для расчета степени риска в предоперационный период и прогнозирования функциональных результатов операции. А. В. Колесников, О. И. Баренина Имплантация капсульных колец в осложненных случаях хирургии катаракты ГОУ ВПО «РязГМУ Минздравсоцразвития России», г. Рязань Стандартом лечения катаракты является ультразвуковая факоэмульсификация через минимальный разрез с имплантацией внутрикапсулярной интраокулярной линзы (ИОЛ). Несмотря на современные достижения в офтальмохирургии, проблема осложненной катаракты остается актуальной. Сублюксация хрусталика, псевдоэксфолиативный синдром, узкий ригидный зрачок, сопутствующая глаукома, увеит, предшествовавшие полостные оперативные вмешательства на глазу, травмы глаза и т. д. могут значительно усложнить течение и исход операции. При данных патологиях существует вероятность сморщивания капсульного мешка на этапе удаления ядра и аспирации кортикальных масс, что затрудняет проведение факоэмульсификации и имплантацию ИОЛ в хрусталиковую сумку. Поэтому основной задачей хирурга является сохранение стабильности капсулы хрусталика в условиях повышенного риска повреждения хрусталиковой сумки и цинновых связок [1, 2, 4]. Применение с этой це- лью внутрикапсульных стабилизирующих колец зарекомендовало себя как эффективный, безопасный и малотравматичный метод, улучшающий результаты экстракции некоторых видов осложненных катаракт [3, 5, 6]. Цель — оценить эффективность применения капсульного кольца (КК) в хирургии осложненной катаракты. Материал и методы. Стабилизатор капсулы хрусталика представляет собой разомкнутое кольцо, на концах которого выполнены утолщения с манипуляционными отверстиями по середине. Размеры колец от 10 до 14 мм, изготовлены из различного материала. В клинике глазных болезней РязГМУ и в офтальмологической клинике «ОКО» г. Рязань, за два года (2009 и 2010 год) с применением КК (изготовлены из полиметилметакрилата в МНТК «Микрохирургия глаза», г. Москва) прооперировано 26 пациентов (28 глаз), из них 17 женщин 130 и 9 мужчин. Возраст пациентов — от 62 до 84 лет (средний возраст — 71 год). В зависимости от патологии распределение больных по нозологиям было следующим: незрелая катаракта — 21,4 % (6 глаз); незрелая катаракта и оперированная глаукома — 7,1 % (2 глаза); незрелая катаракта и открытоугольная глаукома — 28,6 % (8 глаз); зрелая катаракта —17,9 % (5 глаз); зрелая катаракта и открытоугольная глаукома — 10,7 % (3 глаза); перезрелая катаракта — 14,2 % (4 глаза). Перед операцией всем пациентам проводили комплексное офтальмологическое обследование, включающее визометрию, рефрактометрию, кератометрию, тонометрию, биомикроскопию, офтальмоскопию. Острота зрения была от правильной проекции света до 0,02 — 0,03. У всех больных отмечалась неравномерность глубины передней камеры. Иридодонез, подвывих хрусталика различной степени наблюдался в 96,4 % случаев, псевдоэксфолиативный синдром — в 7,1 %, миопия высокой степени — в 10,7 %. Внутриглазное давление составляло от 18 до 22 мм рт. ст. Всем больным была выполнена факоэмульсификация катаракты с имплантацией ИОЛ. При выполнении ФЭК во всех случаях отмечалось смещение хрусталика, экватор был виден в поле зрения; при удалении ядра и аспирации хрусталиковых масс капсула сморщивалась, имплантация ИОЛ в капсульный мешок становилась затруднительной. С целью придания хрусталиковой сумки нормальной формы применяли КК. Стабилизатор капсулы был имплантирован с помощью инжектора на 3 глазах перед удалением ядра хрусталика, у 4 больных — перед удалением кортикальных масс, и в остальных случаях — перед постановкой ИОЛ. В двух случаях кольцо было диаметром 13 мм, в осталь- ных — 12 мм. В конце операции кольцо не удаляли. Срок наблюдения за больными составил от 3 месяцев до 2 лет. Результаты и обсуждение. В 82,1 % глаз имплантация внутрикапсульного кольца и постановка ИОЛ произошла без осложнений. В 17,9 % случаев потребовалось дополнительное подшивание искусственного хрусталика в иридоцилиарную борозду для нормализации положения комплекса капсульный мешок — КК — ИОЛ. Эта манипуляция требовалась в случае значительного дефекта цинновых связок — больше 210 °. В двух случаях кольцо перфорировало заднюю капсулу и находилось в полости стекловидного тела, у этих пациентов операции завершились постановкой искусственного хрусталика в переднюю камеру глаза (ПКЛ). В послеоперационном периоде осложнений не наблюдалось; воспалительная реакция отсутствовала, ВГД было в пределах от 18 до 22 мм рт. ст. Острота зрения при выписке у 76 % больных составила 0,6–0,7; у 18 % — 0,4–0,5; у 6 % — 0,2–0,3. В послеоперационном периоде при сроке наблюдения от 3 месяцев до 2 лет, на всех глазах наблюдалось стабильное положение как ИОЛ, имплантированных в капсульную сумку и переднюю камеру глаза, так и ИОЛ, подшитых к иридоцилиарной борозде. Выводы. Имплантация КК в осложненных случаях катаракты позволяет провести ФЭК, сохранить капсульный мешок и имплантировать ИОЛ в её наиболее физиологическое положение — в капсульный мешок задней камеры глаза. Применение КК способствует стабильному положению ИОЛ. Использование КК является эффективным и малотравматичным методом, позволяющим уменьшить количество осложнений и достичь хороших функциональных результатов в хирургии осложненной катаракты. Литература 1. Аветисов, С. Э. Результаты интраокулярной коррекции афакии при несостоятельности связочно-капсулярного аппарата хрусталика / С. Э. Аветисов, Д. В. Липатов // Современные технологии хирургии катаракты: сб. науч. ст. — М., 2000. — С.13–14. 2. Гундорова, Р. А. Факоэмульсификация травматических катаракт / Р. А. Гундорова, В. В. Нероев, С. В. Антонюк. — М., 2003. — 176 с. 3. Иошин, И. Э. Внутрикапсульное кольцо — профилактика осложнений экстракции катаракты при подвывихе хрусталика / И. Э. Иошин, Э. В. Егорова, С. Н. Багров, А. В. Виговский // Офтальмохирургия. — 2002. — № 1. — С. 25–28. 4. Тахчиди, Х. П. Диагностическая и хирургическая тактика при нарушении целостности связочного аппарата хрусталика / Х. П. Тахчиди, А. В. Зубарев // Офтальмохирургия. — 2001. — № 2. — С. 27–36. 5. Fine, I. H. The Endocapsular Tension Ring / I. H. Fine // VJO. — 1999. — Vol. 15. — № 2. 6. Mackool, R. J. Intracapsular posterior chamber intraocular lens insertion with capsular tears of zonular instability / R. J. Mackool, S. Russel // J. Cataract Refract. Surg. — 1995. — Vol. 21. — P. 376–377. 131 А. В. Колесников, М. Г. Редкина, А. В. Кузьмин, В. Г. Васильев ИННОВАЦИОННЫЕ ТЕХНОЛОГИИ ФАКОЭМУЛЬСИФИКАЦИИ КАТАРАКТЫ: OZIL IP 1.8, RESTORE TORIC IQ, ИММЕРСИОННАЯ БИМЕТРИЯ. ПЕРВЫЕ КЛИНИЧЕСКИЕ РЕЗУЛЬТАТЫ ГОУ ВПО «РязГМУ Минздравсоцразвития России», офтальмологическая клиника «Око», г. Рязань Непрерывное совершенствование технологий хирургии катаракты существенно увеличило требования хирурга к качеству технического обеспечения хирургического процесса, а пациента — к конечному результату хирургии, что тесно между собой взаимосвязано. Особое значение указанные факты имеют при удалении катаракты начальных стадий при высокой остроте зрения, а так же прозрачного хрусталика с рефракционной целью. Применение разрезов меньше 2,0 мм с использованием микрокоаксиальной техники позволило минимизировать вплоть до полного исключения ятрогенный астигматизм роговицы, однако этот тезис правомочен только в не осложнённых случаях, в частности, когда отсутствует ожог роговицы в месте основного операционного доступа, кератопатия. Указанные осложнения находятся в прямой зависимости от энергетической нагрузки, при повреждении эндотелия существенное значение имеет объём ирригационной жидкости. Современная интраокулярная коррекция афакии позволяет решить не только проблему восстановления прозрачности хрусталика, но и формирование псевдоаккомодации; одноэтапное удаление катаракты и коррекцию астигматизма до 5,0 Дптр; одноэтапное удаление катаракта, коррекцию астигматизма и формирование псевдоаккомодации. Имплантация сложных ИОЛ предполагает максимально точное попадание в расчётную послеоперационную рефракцию, что существенно повышает требования к кератометрии, биометрии и технике хирургического вмешательства. Цель — оценить результаты применения новых технологий хирургии катаракты и расчёта ИОЛ, представить первые результаты имплантации псевдоаккомодирующих торических ИОЛ ReStore Toric IQ. Материал и методы. Для анализа результатов факоэмульсификации были взяты пациенты, которым была произведена операция на Infiniti с использованием технологии Ozil и Ozil IP, части из которых был произведён первичный задний кап- сулорексис (зКР). Для расчёта ИОЛ использовали биометр OcuScan в режимах контактной и иммерсионной биометрии (количество измерений — 10 на каждый глаз). Для унификации результатов были отобраны пациента с 2–3 степенью плотности ядра (ПЯ) по Buratto, имплантируемая ИОЛ — AcrySof IQ или AcrySof Natural, картридж D. Отдельно были проанализированы результаты хирургии катаракты 4 степени плотности с применением режимов комбинированный непрерывный убывающий торсионный ультразвук с импульсным нарастающим продольным (нOzil-иПр); непрерывный Ozil IP (нOzil IP); импульсный Ozil IP (иOzil IP). Для основного операционного доступа использовались калиброванные ножи 1,8 и 2,2 мм, для производства парацентезов — ножи 1,2 мм. Оценивали данные кератометрии до и после операции (разница сфероэквивалента и цилиндра), C. D. E., объём использованного ирригационного раствора (ОИР), соответствие планируемой и полученной рефракции (R). Результаты и обсуждение. Результаты исследования проведённого анализа представлены в таблицах. Первые результаты имплантации торической псевдоаккомодирующей ИОЛ AcrySof ReStore Toric IQ представлены в таблице 4 (Ozil IP 1,8, первичный задний капсулорексис) Выводы: 1. Применение операционного доступа 1,8 мм позволяет достоверно и существенно снизить расход ирригационного раствора и вероятность индуцированного астигматизма при неосложнённой факоэмульсификации с использованием торсионной модуляции ультразвука в сравнении с доступом 2,2 мм как при «мягких» катарактах, так и при 4 степени плотности ядра. 2. Применение технологии Ozil IP 1,8 позволяет достоверно снизить энергетическую интраоперационную нагрузку в сравнении с Ozil; в большей степени, 132 Таблица 1 Параметры факоэмульсификации, данные кератометрии до и после операции при удалении катаракты 2–3 ПЯ с использованием различных операционных доступов и модуляции ультразвука Разрез Режим УЗ N C. D. E. ОИР 2,2 1,8 1,8 Ozil Ozil Ozil IP 564 487 189 9,34±2,14 10,49±2,2 5,21±1,54 89,41±20,12 51,91±14,3 40,87±6,3 Разница SE (керато) 0,55±0,15 0,54±0,25 0,35±0,12 Разница Cyl (керато) 0,7±0,25 0,36±0,12 0,25±0,12 Таблица 2 Параметры факоэмульсификации, частота кератопатии при удалении катаракты 4 ПЯ с использованием различных операционных доступов и модуляции ультразвука Режим УЗ Доступ N C. D. E. ОИР (мл) нOzil-иПр нOzil IP нOzil IP иOzil IP 2,2 2,2 1,8 1,8 128 19 6 32 39,87±11.34 34,76±7,48 33,56±9,31 21,43±4,19 98,7±41,1 102,3±15,1 66,2±21,48 54,5±5,48 Частота кератопатии в раннем п/о периоде 29,7 % 26,3 % 33,3 % 15,6 % Таблица 3 Разница полученных рефракционных результатов с расчётными после факоэмульсификации катаракты при расчёте ИОЛ с использованием разных методов биометрии, с и без первичного заднего капсулорексиса Тип биометрии Контактная Иммерсионная зКР N Без С Без С 298 15 768 276 Разница Индуцированный рефракции рефракционный с расчётной ast 1,25 0,85 0,55 0,25 0,75 0,04 0,7 0,03 Разница между расчётным и полученным остаточным рефракционном ast при имплантации торических ИОЛ N R ast 5 0,89 4 0,16 25 0,75 41 0,13 Таблица 4 Пациент Г. р. С.1 1977 П. 1972 С.2 1974 Глаз Кераторефракто до операции Sph Cyl –1,25 OD –9,0 (6°) –1,75 OS –8,25 (172°) –1,5 OD –4,5 (10°) –1,5 OS –3,5 (170°) +2,0 OS +5,5 (12°) VIS с корр Cyl (керато) –1,25 (1°) –1,75 (173°) –1,75 (7°) –1,5 (165°) –2,75 (10°) ИОЛ Кераторефракто после операции Sph 0,9 10,0Т3 0,9 10,5Т4 –0,25 0 0,7–0,8 19,5Т4 –0,25 0 0,7–0,8 20,0Т4 0 0,8 0 Cyl 0 –0,5 30,0Т5 –0,25 –0,5 Cyl (керато) –1,5 (1°) –1,75 (170°) –1,75 (6°) –1,75 (166°) –2,5 (8°) VIS без корр даль 0,9 0,9 1,0 1,0 0,8 1,0 1,2 чтение 0,8 0,8 0,8 0,8 0,9 1,0 0,7 чем при Ozil 1,8 уменьшить количество ирригацион3. При 4 степени плотности катаракты предпоной жидкости в сравнении с разрезом 2,2 мм, но до- чтителен по энергетической нагрузке, объёму ирристоверного изменения в объёме ирригационного рас- рационного раствора, вероятности развития кератвора между Ozi 1,8 и Ozil IP 1,8 обнаружено не было. топатии является режим импульсного торсионного 133 ультразвука с использованием программного обеспечения IP. 4. Иммерсионная биометрия позволяет достоверно точнее рассчитать преломляющую силу ИОЛ. 5. Применение первичного заднего капсулорексиса достоверно снижает ошибки расчёта ИОЛ и послеоперационную цилиндрическую рефрак- ционную ошибку при имплантации торических ИОЛ. 6. Имплантация торических псевдоаккомодирующих ИОЛ AcrySof ReStore Toric IQ — эффективный метод одноэтапного формирования псевдоаккомодации с коррекцией астигматизма до 3 Дптр с качественной и быстрой социальной адаптацией пациента. А. В. Колесников, О. В. Шевякова Случай реимплантации ИОЛ в связи с нарушением ее прозрачности ГОУ ВПО РязГМУ Минздравсоцразвития России, офтальмологическая клиника «ОКО», г. Рязань Каждый год более чем одному миллиону человек выполняется хирургическое лечение по поводу катаракты. Хрусталик является одним из основных оптических элементов глаза, фокусирующих изображение предмета на сетчатку, поэтому его удаление при катаракте требует обязательной оптической коррекции. Наиболее физиологичным методом коррекции афакии является имплантация искусственного хрусталика (ИОЛ). Имплантация ИОЛ, как и любая другая хирургическая процедура, не лишена риска осложнений, и пациенты могут обращаться за специализированной помощью не только в раннем, но и в позднем послеоперационном периоде. В ряде случаев эти осложнения связаны непосредственно с нарушением хирургической тактики в ходе операции, что приводит к дислокации ИОЛ, повреждению задней капсулы и отклонениям от расчетной рефракции глаза. К таким же осложнениям со стороны ИОЛ могут приводить также инволюционные, склеротические, процессы в связках капсульного мешка, дисплазии радужки, эндотелиально-эпителиальная дистрофия роговицы, травматическое повреждение глаза. Тактика врача при указанных осложнениях может быть различной. Обычно, осложнения корригируются соответствующими хирургическими приемами, но если это сделать невозможно, то производится удаление или замена ИОЛ. Среди всех причин, по которым приходится удалять ИОЛ, крайне редко встречается изменение качественных свойств линзы в виде нарушения прозрачности материала ИОЛ. Клинический случай. Пациентка Н, 1938 года рождения, поступила в офтальмологическую кли- нику «ОКО» 26.03.2010 года с диагнозом: Двухсторонняя артифакия. Помутнение искусственного хрусталика правого глаза. История заболевания. 7.11.2007 года по поводу катаракты правого глаза была проведена экстракапсулярная экстракция катаракты роговичным разрезом с имплантацией ЗКЛ. Был имплантирован искусственный хрусталик из сополимера коллагена отечественного производства. В течение года после операции острота зрения была 0,5–0,6, а в последние полгода острота зрения снизилась до 0,2. На левом глазу в апреле 2009 года произведена факоэмульсификация катаракты с имплантацией ЗКЛ модели AcrySof IQ. Объективный офтальмологический статус при поступлении OD — Vis = 0, 2 н/к. Глаз спокоен, роговица прозрачная, передняя камера глубокая, положение ЗКЛ правильное, линза с диффузным помутнением в оптическом центре, глазное дно визуализируется под флёром, видимой патологии не обнаружено. OS — Vis = 0,6 + 0, 75Д = 1,0. Глаз спокоен, положение ЗКЛ правильное, глазное дно без патологии. 17.03.2010 года произведена операция — удаление помутневшей ЗКЛ с имплантацией ЗКЛ +22,5Д на правом глазу. Описание операции. После обработки операционного поля и анестезии конъюнктива вскрыта в верхнем височном отделе глазного яблока, отсепарована от склеры до лимба. Лимбальный тоннельный разрез калибра 3,2 мм. Через парацентез в переднюю камеру введен вискоэластик. Мутная ЗКЛ вывихнута в переднюю камеру. Через тоннель 134 ножницами Vannas отсечены гаптические элементы. ЗКЛ рассечена на 3 фрагмента, модели AcrySof IQ ИОЛ было обнаружено фиброзное изменение задней капсулы, что потребовало выполнить задний капсулорексис. На капсульный мешок в иридоцилиарную борозду имплантирована ЗКЛ +22.5Д модели AcrySof IQ, положение ИОЛ после имплантации было достаточно стабильным, дополнительная шовная фиксация не потребовалась. На тоннель наложен один узловой шов 10/0. Вискоэластик аспирирован. Послеоперационный период протекал гладко, без осложнений. Пациентка выписана на 2-ой день после операции. При выписке OD — Vis = 0,4 н/к, глаз спокоен, роговица прозрачная, передняя камера глубокая, положение ЗКЛ правильное. Данный случай демонстрируется как редкий случай помутнения гибкого искусственного хрусталика, что потребовало реконструктивного хирургического вмешательства, которое закончилось благоприятным исходом. В. М. Малов, Е. Б. Ерошевская, И. В. Малов, С. Ю. Бочкарев, Ф. С. Галеева, Т. А. Осипова НЕПОСРЕДСТВЕННЫЕ РЕЗУЛЬТАТЫ ИНТРАКАПСУЛЯРНОЙ ЭКСТРАКЦИИ КАТАРАКТЫ СУБЛЮКСИРОВАННОГО ХРУСТАЛИКА Самарский государственный медицинский университет, г. Самара Лечение больных с патологией хрусталика достигло своего совершенства благодаря энергетическим технологиям [2–5, 10–12, 16–19]. Вместе с тем, факотопические изменения и сегодня представляют трудную задачу для офтальмохирурга. Предложены оригинальные технологии с использованием капсульных колец, бимануальной факоэмульсификации, «щадящих» режимов аспирации-ирригации и вакуума, различных приемов фиксации капсульной сумки позволяют расширить показания к факоэмульсификации при значительной утрате связочного аппарата хрусталика, вплоть до ⅔ окружности [1, 6–9, 13–15, 20–23]. Но даже эти достижения не избавляют хирургов от затруднений сохранить капсульную сумку. В таких ситуациях экстракция хрусталика производится вместе с капсулой с помощью криоэкстрактора или петли. Негативными сторонами этих технологий является необходимость проведения операции при достаточно большом корнеосклеральном или роговичном разрезе, травматичность операции из-за использования дополнительных инструментов, механического воздействия на задний эпителий роговицы, радужку, что создает опасность интраоперационного выпадения стекловидного тела и геморрагических осложнений и значительного отягощения течения послеоперационного периода. Цель — анализ непосредственных результатов интраокулярной коррекции афакии после интракапсулярной экстракции сублюксированного хрусталика по предложенной технологии. Материал и методы. Под нашим наблюдением находились 21 пациент — 11 мужчин и 10 женщин в возрасте от 69 до 80 лет с неполной осложненной катарактой и подвывихом хрусталика. Сопутствующей патологией была первичная открытоугольная глаукома третьей стадии с нормальным внутриглазным давлением у 12 больных, 9 из них ранее перенесли антиглаукоматозную операцию: 7 пациентов — трабекулэктомию, 2 — глубокую склерэктомию. Гипотензивные препараты получали семь пациентов. Псевдоэксфолиативный синдром наблюдался у всех больных. Наличие узкого ригидного зрачка отмечено у половины пациентов. Всем больным произведено интракапсулярное удаление сублюксированного хрусталика, так как были невозможными факоэмульсификация или экстракапсулярная экстракция. Интракапсулярная экстракция заключалась в следующем: выполнялся послабляющий надрез передней капсулы хрусталика для уменьшения его объема и выведения хрусталика либо целиком, либо поочередно — ядро, хрусталиковые массы, хрусталиковая сумка. При этом оставалась сохраненной гиалоидная мембрана, и выпадения стекловидного тела не происходило. Исходная острота зрения была от 0,02 до 0,2. Внутриглазное давление — от 15 до 20 мм рт. ст. Предоперационная подготовка включала назначение 250 мг диакарба и 1 мг феназепама внутрь накануне и в день операции, перед операцией — ин- 135 стилляции β-блокаторов и препаратов нестероидных противовоспалительных средств. Операции проводились под ретробульбарной анестезией. На всех этапах хирургического вмешательства использовались вискоэластики. При недостаточном мидриазе применяли механическое расширение зрачка двумя ирис-ретракторами ЭТП «МНТК „Микрохирургия глаза“ им. академика С. Н. Федорова». Всем больным во время имплантации переднекамерной интраокулярной линзы Appalens или Уфаленс в переднюю камеру вводили воздух. У 12 пациентов была произведена периферическая иридэктомия, у остальных она была выполнена ранее при антиглаукоматозной операции. Результаты и обсуждение. Интраоперационных осложнений не было. Течение послеоперационного периода было спокойным. Острота зрения при выписке из стационара повысилась у всех больных и была в пределах 0,2—1,0, в среднем — 0,3±0,18, и зависела от выраженности глаукоматозного процесса. Внутриглазное давление у всех больных при выписке было нормальным. Зрачок и интраокулярная линза занимали центральное положение. Выводы. Использование предложенной технологии позволяет уменьшить травматичность и трудоемкость операции, снизить риск осложнений во время интракапсулярной экстракции катаракты у больных с подвывихом хрусталика. Метод позволяет сохранить мембрану стекловидного тела и не допустить его выпадения в переднюю камеру глаза и в операционную рану. Профилактика данного операционного осложнения предотвращает вероятность экспульсивного кровотечения и послеоперационных осложнений: иридоциклит, вторичная глаукома, дистрофия роговицы, врастание эпителия, синдром Ирвина-Гасса, отслойка сетчатки. Литература 1. Аветисов, С. Э. Морфологические изменения при несостоятельности связочно-капсулярного аппарата хрусталика / С. Э. Аветисов, Д. В. Липатов, А. А. Федоров // Вестн. офтальмол. — 2002. — Т. 118. — № 4. — С. 22–23. 2. Азнабаев, М. Т. Результаты гидромониторной факоэмульсификации катаракт / М. Т. Азнабаев, Р. Р. Хисматуллин, Г. Ф. Якупова // Мат-лы российской науч.-практ. конф. «Ижевские родники — 2008». — Ижевск, 2008. — С. 457–459. 3. Азнабаев, Б. М. Ультразвуковая хирургия катаракты / Б. М. Азнабаев. — М., 2005. — 129 с. 4. Буратто, Л. Хирургия катаракты. Переход от экстракапсулярной экстракции катаракты к факоэмульсификации / Л. Буратто. — Fabiano Editore, 1999. — 472 с. 5. Гринев, А. Г. Математическое экспериментальное и клиническое обоснование профилактики и коррекции роговичного астигматизма и патологии капсульного мешка: автореф. … д-ра. мед. наук / А. Г. Гринев. — Самара, 2009. — 24 с. 6.Егорова, Э. В. Информативность ультразвуковой биомикроскопии в диагностике псевдоэксфолиативного синдрома / Э. В. Егорова, Д. Г. Узунян, А. И. Толчинская, А. Саруханян // Съезд офтальмологов России, 8-й: тез. докл. — М., 2005. — С. 578–579. 7. Иошин, И. Э. Внутрикапсульное кольцо — профилактика осложнений экстракции катаракты при подвывихе хрусталика / И. Э. Иошин [и др.] // Офтальмохирургия. — 2002. — № 1. — С. 25–28. 8. Иошин, И. Э. Факоэмульсификация катаракты с внутрикапсульной имплантацией ИОЛ при обширных отрывах волокон цинновой связки / И. Э. Иошин, Р. Р. Тагиева // Офтальмохирургия. — 2005. — № 1. — С. 18–23. 9. Малюгин, Б. Э. Хирургия катаракты и интраокулярная коррекция: итоги и перспективы / Б. Э. Малюгин // Тез. докл. 1Х съезда офтальмологов России. — М., 2010. — С. 192–195. 10.Малюгин, Б. Э. Клинический опыт применения интраокулярных линз модели SlimFlex Y (PhysIOL) / Б. Э. Малюгин, Т. В. Фадеева // Современные технологии катарактальной и рефракционной хирургии. — М., 2006. — С. 168–172. 11.Николашин, С. И. Факоэмульсификация катаракты на основе вертикального чопа с горизонтальным разделением ядра хрусталика / С. И. Николашин, В. А. Мачехин // Федоровские чтения. — М., 2008. — С. 189–190. 12.Паштаев, Н. П. Классификация дислокаций хрусталика, современная тактика лечения / Н. П. Паштаев // Актуальные проблемы хирургии хрусталика, стекловидного тела и сетчатки. — М., 1986. — С. 34–37. 13.Тахчиди, Х. П. Хирургическая технология удаления катаракты при нарушении связочного аппарата хрусталика / Х. П. Тахчиди, А. Б. Зубарев // Офтальмохирургия. — 2004. — № 4. — С.16–18. 14.Тахчиди, Х. П. Выбор тактики хирургии катаракты с учетом оценки симптоматики псевдоэксфолиативного синдрома по данным ультразвуковой биомикроскопии / Х. П. Тахчиди, Э. В. Егорова, А. И. Толчинская [и др.] // Офтальмохирургия. — 2006. — № 4. — С. 4–9. 15.Тахчиди, Х. П. Среднесрочные результаты имплантации асферических ИОЛ при факоэмульсификации катаракты / Х. П. Тахчиди, Б. Э. Малюгин, С. К. Демьянченко-Шульга // Современные технологии катарактальной и рефракционной хирургии. — М., 2006. — С. 244–247. 136 16.Тахчиди, Х. П. Функциональные результаты факоэмульсификации катарактыс имплантацией интраокулярной линзы на авитреальных глазах / Х. П. Тахчиди, Е. Н. Пантелеев, В. В. Малышев // Федоровские чтения. — М., 2008. — С. 193. 17.Фечин, О. Б. Технология механической факофрагментации в хирургии катаракты: автореф. дис. … канд. мед. наук / О. Б. Фечин. — М., 2003. — 27 с. 18.Чупров, А. Д. Применение инновационных технологий факоэмульсификации катаракты и имплантации интраокулярных линз / А. Д. Чупров, А. А. Замыров // Современные технологии катарактальной и рефракционной хирургии. — М., 2006. — С. 280–282. 19.Cionni, R. J. Management of profound zonular dialysis or weakness with a new endocapsular ring designed for scleral fixation / R. J. Cionni, R. H. Osher // J. Cataract Refract. Surg. — 1998. — Vol. 24. — № 10. — Р. 1299–1306. 20.Guo, S. Characterizing pseudoexfoliation syndrome through the use of ultrasound biomicroscopy / S. Guo, M. Gewirtz, R. Thaker, M. Reed // J. Cataract Refract. Surg. — 2006. — Vol. 32. — № 4. — P. 614–617. 21.Lee, D. H. Effect of capsular tension ring on intraocular lens decentration and tilting after cataract surgery D. H. / D. H. Lee, S. C. Shin, C. K. Joo // J. Cataract Refract. Surg. — 2002. — Vol. 28. — № 6. — Р. 843–846. 22.Kurz, S. Capsular bag shrinkage after implantation of a capsular tension ring / S. Kurz, F. Krummenauer, P. Hacker [et al.] // J. Cataract Refract. Surg. — 2005. — Vol. 31. — № 10. — P. 1915–1920. Б. Э. Малюгин 1, А. В. Терещенко 2, Ю. А. Белый 2, С. К. Демьянченко 2 К ВОПРОСУ О РАЗРЕШАЮЩЕЙ СПОСОБНОСТИ ИНТРАОКУЛЯРНЫХ ЛИНЗ 1 ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова», г. Москва, 2 Калужский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова», г. Калуга Имплантация интраокулярных линз (ИОЛ) в афакичный глаз стала надежной процедурой, позволяющей возвращать пациентам утраченное зрение и обеспечивать его высокий функциональный уровень. Технические характеристики имплантируемых ИОЛ являются одним из основных критериев, определяющих оптические свойства системы «глаз-ИОЛ». Различия показателей разрешающей способности различных моделей ИОЛ, изготовленных из аналогичных материалов, могут быть обусловлены особенностями их конструкции, при этом немаловажную роль играет качество обработки преломляющих поверхностей в процессе промышленного производства. Цель — провести сравнительную оценку качества обработки оптической поверхности асферических и сферических ИОЛ (изготовленных из гидрофильного и гидрофобного акрила) различных производителей, измерить показатели разрешающей способности этих интраокулярных линз и определить влияние асферичности и качества обработки оптической поверхности на показатели разрешающей способности ИОЛ. Материал и методы. Исследование разрешающей способности ИОЛ проводилось на оптической скамье ОСК-3, которая предназначена для исследования качества изображения оптических систем и измерения их оптических характеристик. Для проведения измерений разрешающей способности испытуемых линз на станинах были установлены: длиннофокусный коллиматор с мирой в фокусе объектива коллиматора, осветитель с конденсором, лампой накаливания, суппорт с универсальной оправой, в которую вставляется испытуемая линза, микроскоп. Разрешающую способность ИОЛ определяли по наименьшим штрихам миры, видимым отчетливо через испытуемую линзу. Расчет разрешающей способности линзы производили по формуле: α=К×120/Д, где: α — наименьший угол, под которым через данную линзу два штриха будут видны раздельно (не будут сливаться в один); коэф. К = 1,2 для простых телескопических систем; Д — диаметр исследуемой линзы; 120 — число, принятое при вычислении разрешающей способности. Качество оптических поверхностей различных моделей ИОЛ оценивали на интерферометре New View-5000 Zygo (Германия). Принцип работы данного прибора заключается в освещении объекта белым светом в момент измерения, при этом наблюдается интерференционная картина поверхности, которая 137 фиксируется цифровой камерой и обрабатывается компьютером. В результате измерения определяются следующие показатели-коэффициенты, характеризующие качество сравниваемых поверхностей оптической части ИОЛ: RMS — среднеквадратичное отклонение точек поверхности относительно средней высоты по всей изучаемой области; PV — расстояние между высшей и низшей точками исследуемой области; Ra — среднее отклонение точек поверхности от срединной поверхности. Гладкость поверхности считается тем лучше, чем меньше полученные в результате измерения коэффициенты. Для исследования были взяты эластичные линзы разных производителей, отличающиеся профилем оптической части (сферические и асферические) изготовленные из гидрофильного и гидрофобного акрила: Akreos Adapt AO (Bausch & Lomb Inc.), Acrysof IQ SN60WF (Alcon), Tecnis Z9003 (AMO), HELILENS (Hanita), AquaSens (Rumex), Nidek. Все ИОЛ были одинаковой диоптрийности (20 дптр.) по 3 экземпляра каждой модели. Измерения проводили трижды, полученные показатели усредняли. Результаты обрабатывали с помощью статистического анализа. Для проведения оценки разрешающей способности и интерференционной микроскопии ИОЛ из гидрофильного акрила остатки влаги с оптической поверхности линзы удаляли. Угловые значения разрешающей способности исследуемых ИОЛ определяли по существующим табличным данным (соответствие углового расстояния номеру миры и номеру элемента миры). Результаты и обсуждение. ИОЛ с асферической оптикой (Akreos AO, Acrysof IQ) показали лучшие результаты разрешающей способности, превышающие расчетные значения. Самый низкий показатель разрешающей способности оказался у ИОЛ Rumex. Результаты измерения гладкости оптической поверхности ИОЛ представлены в таблицах 1 и 2. Таблица 1 Показатели качества оптической поверхности ИОЛ из гидрофобного акрила, в нм (М ± σ) Линза Pv (мкм) RMS (нм) Ra (нм) Acrysof IQ 0,24 ± 0,1 12,06 ± 1,68 9,25 ± 1,21 Tecnis Z9003 1,06 ± 1,09 31,62 ± 2,93 14,5 ± 1,39 Nidek 8,05 ± 4,74 170,56 ± 52,6 90,65 ± 10,26 Таблица 2 Показатели качества оптической поверхности ИОЛ из гидрофильного акрила в нм. (М ± σ) Линза Akreos AO Akreos Adapt Hanita Rumex Pv (мкм) 0,72 ± 0,33 1,25 ± 0,41 8,13 ± 6,0 9,91 ± 3,48 RMS (нм) Ra (нм) 40,98 ± 4,85 30,56 ± 4,95 66,86 ± 12,73 50,9 ± 9,34 247,25 ± 58,2 170,94 ± 11,16 427,38 ± 54,5 335,08 ± 52,4 Результаты интерференционной микроскопии показали, что для ИОЛ, изготовленных из гидрофобного акрила, характерны более низкие значения Pv, RMS и Ra. Полученные результаты имеют статистически достоверные различия. Возможно, это связано с особенностями производства линз из гидрофобного акрила: отсутствие гидратации линз по завершении обработки способствует лучшему качеству оптической поверхности ИОЛ по сравнению с линзами, изготовленными из гидрофильного акрила. При сравнении показателей разрешающей способности и качества обработки оптической поверхности исследуемых ИОЛ нами были учтены материал ИОЛ и аберрационные свойства интраокулярных линз. Из числа исследованных линз три модели изготовлены из гидрофобного акрила (Acrysof IQ SN60WF, Tecnis Z9003, Nidek) и четыре — из гидрофильного (Akreos AO, Akreos Adapt, HELILENS, AquaSense). Разрешающая способность в группе линз из гидрофобного акрила оказалась выше у Acrysof IQ SN60WF, Tecnis Z9003 и Nidek. Это, по всей видимости, связано с различными показателями «шероховатости» оптических поверхностей. Интерференционная микроскопия Acrysof IQ SN60WF выявила лучшие показатели качества оптической поверхности (PV, RMS, Ra). ИОЛ Tecnis Z9003 и Nidek по уровню качества оптических поверхностей заняли второе и третье место соответственно. Определенное влияние на полученные результаты разрешающей способности оказали аберрометрические свойства ИОЛ. Acrysof IQ индуцирует меньшее количество отрицательной сферической аберрации, чем Tecnis Z9003 (-0,2мкм и —0,27мкм соответственно). Nidek — сферическая линза — индуцирует положительные сферические аберрации (СА), числовые значения которой производителем не указываются. Однако, по данным литературы, значения положительной СА для сферических линз варьируют от 0,3 до 0,5 мкм. 138 При сравнении показателей разрешающей способности (РС) ИОЛ из гидрофильного акрила (Akreos AO, Akreos Adapt, HELILENS, AquaSens) оказалось, что лучшие значения РС принадлежат ИОЛ Akreos AO. Это, скорее всего, связано с более высокими показателями качества оптической поверхности (PV, RMS, Ra) и отсутствием индуцированных сферических аберраций. Второе, третье и четвертое место по значению РС принадлежит Akreos Adapt, HELILENS и AquaSens соответственно, что, по нашему мнению, связано с уровнем качества обработки оптики данных ИОЛ. Выявлена прямая корреляционная зависимость между показателями разрешающей способности ИОЛ и показателями качества оптической поверхности (Ra, RMS). При этом, чем выше качество оптической поверхности, тем выше показатели разрешающей способности. Вычисленный коэффициент корреляции между РС и RMS составил 0,88, а между РС и Ra — 0,89. На наш взгляд, клинический эффект от коррекции сферических аберраций может быть достигнут только при условии высокого качества обработки оптических поверхностей ИОЛ. Выводы. Показатели разрешающей способности ИОЛ находятся в зависимости от качества обработки оптической поверхности и от аберрационных свойств ИОЛ. При этом, чем ниже шероховатость оптической поверхности, а так же, чем ниже количество индуцируемых ИОЛ сферических аберраций, тем выше разрешающая способность линзы. Р. Ф. Маннанова, А. А. Бикбулатова ВОЗМОЖНОСТИ МЕТОДА «ПОЛИАРТИФАКИЯ» (ОБЗОР ЛИТЕРАТУРЫ) ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа В настоящее время подавляющее большинство операций по поводу катаракты производится с использованием техники малых разрезов и внутрикапсульной фиксацией ИОЛ, обеспечивающих прогнозируемый анатомо-функциональный результат и минимально влияющей на топографию роговицы [8]. По данным ВОЗ, ежегодно в мире производится несколько миллионов операций, связанных с имплантацией ИОЛ. Однако, у 10–80 % пациентов с артифакией в послеоперационном периоде выявляется остаточная аметропическая рефракция различной степени [7, 10]. И, если остаточная миопия в большинстве случаев является расчетной, т. е. запланированной хирургом с учетом возраста и социальных потребностей пациента, то гиперметропическая рефракция, встречающаяся в 4–35,6 % случаев, является, как правило, следствием ошибок при расчете оптической силы ИОЛ [14]. Остаточная аметропия или рефракционная ошибка является разницей между действительной послеоперационной и запланированной рефракцией [16]. Несмотря на высокий технический уровень современной катарактальной хирургии и доступность достаточно совершенных формул расчета оптиче- ской силы ИОЛ, рефракционных ошибок часто не удается избежать. Поскольку данные, используемые в формулах расчета ИОЛ, представляют собой измеряемые величины, возникновение подобных ошибок в определенном проценте случаев неизбежно. Помимо возможных погрешностей кератометрии и измерения аксиальной длины глаза, существует ряд факторов, которые являются предпосылкой для возникновения рефракционных ошибок при расчете ИОЛ. Чаще ошибки рефракции возникают в «длинных» и «коротких» глазах (при миопии и гиперметропии высокой степени). Современные методы коррекции аметропий подразделяются на три основных вида: очковая, контактная, хирургическая. В офтальмологической литературе достаточно широко обсуждаются преимущества каждого из этих методов, но до настоящего времени не выработано единого мнения по данному вопросу [2–4]. В свою очередь, в 1995 г. В. К. Зуев и соавт. [4] отметил: «Непереносимость традиционных методов коррекции повышает социальную и медицинскую значимость разработки хирургических методов коррекции аметропии для профилактики развития ранней глубокой амблиопии, косоглазия и соответственно нарушения бинокуляр- 139 ного зрения». Поэтому в настоящее время одним из перспективных методов для лечения и коррекции аметропии остается хирургический. В последние годы в зарубежной литературе появились сообщения об одномоментной имплантации в глаз двух ИОЛ. Этот метод коррекции афакии, получивший название полиартифакия (piggyback), первоначально был применен с целью коррекции гиперметропии высокой степени на глазах с размером передне-задней оси менее 19 мм в связи с отсутствием интраокулярной линзы оптической силы более 30 диоптрий [6]. Одни исследователи имплантировали обе линзы в капсульный мешок [5, 18, 19, 21, 22], другие предпочли имплантировать вторую ИОЛ в цилиарную борозду [5, 6, 15, 17]. В настоящее время искусственные хрусталики «высокой» оптической силы становятся более доступными и ряд фирм сообщают о производстве линз до 40 диоптрий. Однако, по данным исследователей имплантация интраокулярных линз свыше 30,0 дптр, в соответствии с законами физиологической оптики, является менее предпочтительной, чем двух линз меньшей оптической силы, так как создает большой уровень оптических аберраций [20]. Помимо коррекции гиперметропии высокой степени, Касьянов А. А. (2004) использовал метод «полиартифакия» для коррекции рефракционных ошибок хирургии катаракты. Анализ рефракционных результатов коррекции послеоперационной аметропии показал, что вторичная имплантация дополнительной ИОЛ является простой, высокоэффективной и малотравматичной методикой [5]. Дополнением к рефракционной ошибке, препятствующей достижению высоких зрительных функций, является астигматизм. Большая протяженность роговичных разрезов, применяемых при классической экстракции катаракты, является основной причиной возникновения астигматизма высокой и средней степеней. Некорригированный астигматизм способствует значительному снижению остроты зрения и торможению развития зрительного анализатора, а также ухудшает качественные показатели зрения [1]. Для коррекции афакии и роговичного астигматизма был разработан метод сфероцилиндрической полиартифакии [8], при проведении которого получены положительные функциональные результаты. В ходе операции осуществлялась имплантация в капсульный мешок двух ИОЛ: сферической — для коррекции афакии и цилиндрической — для исправления астигматизма. Пресбиопия, как естественный процесс физиологического старения глаза у лиц 40–50 лет и старше, сопровождается медленным ослаблением рефракции. Традиционные методы коррекции не всегда устраивают пациента. Полиартифакия была использована Тахтаевым Ю. В. (2008) для коррекции пресбиопии и гиперметропии высокой степени путем замены прозрачного хрусталика на комбинацию двух ИОЛ (монофокальной и дифракционнорефракционной бифокальной), при этом бифокальную ИОЛ имплантировали в капсульный мешок, а монофокальную — в заднюю камеру с фиксацией в иридоцилиарную борозду. Полиартифакия в варианте комбинации монофокальной и дифракционнорефракционной бифокальной ИОЛ позволяет корригировать высокие степени гиперметропии, сохраняя при этом мультифокальный характер зрения, а так же открывает путь к более широкому использованию метода удаления прозрачного хрусталика с целью исправления аномалий рефракции и устранения пресбиопии [11]. Причиной возникновения межлинзовой пленки в отдаленном послеоперационном периоде, является циркуляция клеток герминативного хрусталикового эпителия, основой для пролиферации которых является соприкосновение обеих имплантируемых линз и остатки вискоэластических препаратов. Данное осложнение приводит к снижению остроты зрения, в связи с чем рекомендуется имплантация второй линзы в цилиарную борозду. В настоящее время на офтальмологическом рынке появилась дополнительная псевдофакичная ИОЛ нового поколения Sulcoflex (Rayner, Великобритания). Данная линза представлена тремя видами: асферическая, торическая, мультифокальная. ИОЛ Sulcoflex разработана для коррекции любого вида постоперационной или остаточной аметропии, которая не вызывает дополнительную травматизацию и не увеличивает риск при замене ИОЛ [12, 13]. Вогнутая задняя поверхность оптики добавочной ИОЛ позволяет уменьшить вероятность контакта между двумя линзами и, следовательно, минимизировать возможность появления оптических искажений в зоне контакта между ИОЛ и межлинзовой пленкой, снижающей визуальные результаты. «Волнообразный» дизайн гаптики обеспечивает ротационную стабильность линзы в иридоцилиарной борозде, надежную фиксацию, качественную центрацию. Материал, из которого она изготовлена, обеспечивает биосовместимость с окружающими 140 тканями, предотвращая воспалительные осложнения и дисперсию пигмента радужки. Большой диаметр оптики снижает риск захвата ее радужкой. Данную линзу имплантируют в пространство между первой ИОЛ, находящейся в капсульном мешке, и радужкой. Гаптические элементы Sulcoflex фиксируют в иридоцилиарной борозде. ИОЛ Sulcoflex имеет достаточно широкие показания, позволяющие повысить точность коррекции в артифакичном глазу, улучшить зрение для близи и для дали, а также скорректировать роговичный астигматизм. В то же время, мировой опыт применения ИОЛ Sulcoflex еще мал и результаты имплантации линзы требуют дальнейшего изучения. Литература 1. Аветисов, Э. С. Руководство по детской офтальмологии / Э. С. Аветисов, Е. И. Ковалевский, А. В. Хватова. — М.: Медицина, 1987. — С. 495. 2. Бикбов, М. М. Коррекция анизометропии высокой степени у детей: дис. … д-ра мед. наук / М. М. Бикбов. — Самара, 1998. 3. Вязовский, А. И. Субъективное и объективное определение вторичной анизейконии / А. И. Вязовский // Офтальмол. журн. — 1976. — № 4. — С. 260. 4. Зуев, В. К. Отдаленные результаты имплантации отрицательной ИОЛ у детей при высокой односторонней миопии / В. К. Зуев, Э. Р. Туманян, Б. М. Азнабаев // Офтальмохирургия. — 1995. — № 3. — С. 36–29. 5. Касьянов, А. А. Вторичная имплантация дополнительной ИОЛ для коррекции рефракционных ошибок интраокулярной коррекции афакии / А. А. Касьянов // Офтальмология. — 2004. — № 1. — С. 24–28. 6.Линник, Л. Ф. Имплантация дополнительной ИОЛ для коррекции остаточной гиперметропии у пациентов с артифакией / Л. Ф. Линник, А. В. Перетрухин, Е. А. Линник, Ашер Салим // Офтальмохирургия. — 1999. — № 4. — С. 24–30. 7. Малов, В. М. Интраокулярная коррекция афакии и возможности повышения ее эффективности: дис. … д-ра мед. наук. — М., 1988. — 42 с. 8. Малюгин, Б. Э. Интраокулярная коррекция астигматизма в ходе факоэмульсификации: техника и результаты / Б. Э. Малюгин, В. О. Филлипов, В. М. Треушников // Офтальмохирургия. — 2004. — № 4. — С. 9–15. 9. Погорелова, В. В. Коррекция гиперметропии высокой степени полиартифакией: дис. … канд. мед. наук / Б. Э. Малюгин, В. О. Филлипов, В. М. Треушников. — М., 2008. 10.Сергиенко, Н. М. Интраокулярная коррекция / Н. М. Сергиенко. — Киев, 1990. — 126 с. 11.Тахтаев Ю. В. Интраокулярная коррекция аметропий и пресбиопии: дис. … д-ра мед. наук / Ю. В. Тахтаев. — СПб., 2008. — 40 с. 12.Amon, M. Enhancement of refractive results after cataract surgery and IOL-implantation with a supplementary IOL implanted in the ciliary sulcus / M. Amon // Oftalmologia. — 2009. — Vol. 53. — № 4. — P. 91–95. 13.Claoue, C. Sulcoflex pseudophakic supplementary IOLs / C. Claoue, M. Amon, N. Korber [et al.] // Supplement to J. Cataract Refract. Surg. — 2009. — № 11–12. — P. 2–11. 14.Hoffer, K. The Hoffer Q formula: a comparison of theoretic and regression formulas / K. Hoffer // J. Cataract Refract. Surg. — 1993. — Vol. 19. — № 11. — P. 700–720. 15.Habot-Wilner, Z. Refractive results with secondary piggyback implantation to correct pseudophakic refractive errors / Z. Habot-Wilner, D. Sachs, M. Cahane [et al.] // J. Cataract Refract. Surg. — 2005. — № 31. — Р. 2101–2103 16.Inatomi, M. Intraocular lens power calculation for microftalmos / M. Inatomi, K. Ishii, R. Koide [et al.] // J. Cataract Refract. Surg. — 1997. — Vol. 23. — P. 1208–1212. 17.Kahraman, G. New supplementary intraocular lens for refractive enhancement in pseudophakic patients / G. Kahraman, M. Amon // J. Cataract Refract. Surg. — 2010. — Vol. 36. — № 7. — Р. 1090–1094. 18.Masket, S. Piggyback intraocular lens implantation / S. Masket // J. Cataract Refract. Surg. — 1998. — Vol. 24. — № 4. — P. 569–570. 19.Mejía, L. F. Piggyback posterior chamber multifocal intraocular lenses in anisometropia / L. F. Mejía // J. Cataract Refract. Surg. — 1999. — Vol. 25. — № 12. — P. 1682–1684. 20.Mittelviefbaus, H. Piggyback intraocular lens with exchangeable optic / H. Mittelviefbaus // J. Cataract Refract. Surg. — 1996. — Vol. 22. — № 6. — Р. 676–681. 21.Spencer, T. S. Interlenticular opacification of piggyback acrylic intraocular lenses / T. S. Spencer, N. Mamalis, S. S. Lane // J. Cataract Refract. Surg. — 2002. — Vol. 28. — P. 1287–1290. 22.Werner, L. Interlenticular opacification: dual-optic versus piggyback intraocular lenses / L. Werner, N. Mamalis, S. Stevens [et al.] // J. Cataract Refract. Surg. — 2006. — Vol. 32. — № 4. — Р. 655–661. 141 Л. В. Мироненко, В. А. Соколов, А. С. Пшенникова ТЕХНОЛОГИЯ «OZil® INTELLIGENT PHACO» ПРИ УДАЛЕНИИ КАТАРАКТ РАЗЛИЧНОЙ СТЕПЕНИ ЗРЕЛОСТИ И ПЛОТНОСТИ OOO «Офтальмологическая клиника» ГОУ ВПО «РязГМУ им. акад. И. П. Павлова Минздравсоцразвития России», г. Рязань В последние годы факоэмульсификация катаракты заняла ведущее место среди способов удаления помутневшего хрусталика. Применение ультразвуковой энергии, совершенствование аппаратов, позволило вывести эту операцию в разряд довольно безопасных, хотя отрицательное воздействие ультразвука на ткани глаза еще остается. Компания Alcon в 2005 г. представила новую версию факоэмульсификатора Infiniti Vision System 2,0. В ней используется традиционный продольный ультразвук, колебательные (торсионные) движения иглы, а также их сочетание — технология OZil. Это значительно снизило отрицательное воздействие на фрагмент хрусталика и другие ткани глаза [1]. Одним из недостатков этой технологии оставалось забивание просвета иглы кусочками хрусталика и высокие параметры вакуума. В 2009 г. компания Alcon представляет технологию «OZil® INTELLIGENT PHACO» — «ИНТЕЛЛЕКТУАЛЬНОЕ ФАКО», так называемое интеллектуальное управление энергией. Эта технология усиливает факоэмульсификацию OZil®, удерживая материал хрусталика в плоскости разрушения; увеличивает притяжение, недопуская достижения максимального вакуума; поддерживает глаз в естественном состоянии, снижая колебания ВГД. При включении OZil® IP поддерживается идеальное расположение фрагментов, без отталкивания, сохраняется свободным УЗ наконечник, а постоянная работа помпы позволяет осуществлять движение фрагментов к ультразвуковому наконечнику. Основная цель OZil® IP — повышение эффективности факоэмульсификации. Цель — проанализировать возможность применения OZil® IP для удаления катаракт различной стадии зрелости. Материал и методы. С октября 2009 г. по май 2010 г. с использованием технологии OZil® IP прооперировано 895 пациентов (916 глаз), в возрасте от 39 до 96 лет, мужчин было 40,2 %, женщин — 59,8 %. Острота зрения до операции от 1/∞ pr l c до 0, 1 диагностирована у у 0,3 % пациентов, от 0,2 до 0,3 — у 10,2 %, от 0,4 до 0,6 — у 9,5 % больных. Начинающаяся катаракта отмечена в 3,2 % случаев, незрелая — в 64,3 %, зрелая — в 25,5 %, перезрелая набухающая — в 7 %. По плотности ядра (по классификации Буратто) с 1 степенью плотности ядра было 6,3 % больных, со 2 — 18,6 %, с 3 — 36,2 %, с 4 — 29,6 %, с 5 — 9,2 % пациентов. В 10,8 % случаев катаракта сопровождалась первичной открытоугольной глаукомой развитой и далекозашедшей стадией развития с компенсированным медикаментозно или хирургически внутриглазным давлением, в 11,5 % — миопией высокой степени, в 12,7 % — возрастной макулодистрофией, в 2,6 % — подвывихом хрусталика в одном квадранте. Результаты и обсуждение. Все операции с использованием технологии OZil® IP проходили гладко, без осложнений, не зависимо от стадии зрелости и плотности катаракты. Во время операций с подвывихом хрусталика дополнительно имплантировалость внутрикапсульное кольцо, которое не изменило ход операции. В послеоперационном периоде отмечались единичные складки десцеметовой оболочки при 4–5 степени плотности ядра из-за большего времени использования ультразвука. Применялось стандартное медикаментозное лечение — антибиотики, нестероидные и стероидные противовоспалительные препараты. Острота зрения после операции от 0,01 до 0,1 диагностирована у 5,7 % больных, от 0,2 до 0,3 — у 3,8 %, от 0,4 до 0,5 — у 8,9 %, от 0,6 до 1,2 — у 81,6 % человек. Низкая острота зрения (до 0,1) объяснялась наличием у больных далекозашедшей стадией глаукомы, возрастной макулодистрофией и осложненной миопией высокой степени. Выводы. Проведенные операции по технологии OZil® IP показали возможность применения этой технологии при различных стадиях зрелости и степенях плотности ядра. Однако при 4 и 5 степени плотности ядра время затраченного ультразвука немного больше, что не ухудшает послеоперационные визуальные данные. 142 Литература 1. Шиловских, О. В. Возможность применения технологии OZiL для удаления катаракт различной плотности / О. В. Шиловских [и др.] // Современные технологии катарактальной и рефракционной хирургии — 2007: cб. науч. тр. VIII Междунар. науч.-практ. конф. — М., 2007. — С. 281–283. А. Л. Рахматуллин, К. Р. Шавалеева Способ профилактики экссудата передней камеры после факоэмульсификации катаракты при осложненных случаях ГУ «Уфимский НИИ глазных болезней» АН РБ, Башкирский государственный медицинский университет, кафедра офтальмологии, г. Уфа После перенесенных иридоциклитов, антиглаукоматозных операций, лазериридотомии возможно появление задних синехий Проведение операции факоэмульсификации катаракты у данной категории пациентов представляет определенные технические трудности. При невозможности медикаметозного расширения зрачка приходится прибегать к механическому растяжению зрачка или применять крючкиретракторы. Эти процедуры могут вызвать нежелательные последствия. Во время операции может возникнуть кровотечение, или на второй день после операции появляется экссудат в передней камере в ответ на травматизацию радужки. Выпот, как правило, бывает серозным или фибринозным в виде нитей, паутины. Офтальмохирургам известно, что введение стерильного воздуха в переднюю камеру препятствует возникновению гифемы. А возможность применения воздуха для предупреждения возможной экссудации в переднюю камеру известна не всем хирургам. Цель — изучить возможность профилактики экссудации путем введения стерильного воздуха в переднюю камеру. Материал и методы. Проведен анализ 12 операций факоэмульсификации катаракты с механическим расширением зрачка, синехиотомией и пластикой радужки. 8 случаев составили пациенты с осложненной увеальной катарактой с задними синехиями или полным заращением зрачка. 3 пациента были со спайками радужки после антиглаукоматозной операции и 1 после длительного применения миотиков и последующей лазериридотомии. В 6 случаях в конце операции передняя камера была восстановлена стерильным воздухом. При этом стремились максимально заполнять камеру для того, чтобы единый пузырь воздуха оказывал давление на радужку, механически преграждая выпот из пораженных сосудов. Контрольную группу составляли 6 пациентов, которым передняя камера в конце операции была восстановлена физиологическим раствором по общепринятой методике. Пациенты обеих групп получали противовоспалительное лечение. Учитывалась неинфекционная этиология воспалительного процесса. Назначались местно кортикостероиды и парентрально неспецифические противовоспалительные средства. Результаты и обсуждение. Воздух в передней камере у больных основной группы рассасывался в течение 2–3 дней. Экссудат в области зрачка в виде паутины был выявлен у 2 пациентов. После адекватного лечения кортикостероидами и мидриатиками «паутина» полостью рассосалась на 3-й день. У 4 пациентов влага передней камеры оставалась прозрачной. В котрольной группе выпот в переднюю камеру различной степени наблюдался у всех пациентов. У 1-го больного развился экссудативный иридоциклит с образованием стерильного гипопиона, уровнем 3 мм. После интенсивного противовоспалительного и антибактериального лечения на 8-й день удалось купировать процесс. У 3 пациентов выявлен серозно-фибринозный экссудат. Потребовалось также довольно активное противовоспалительное, и затем рассасывающее лечение. У оставшихся двух пациентов выпот в виде нитей фибрина в области 143 зрачка рассосался на 2-3-й день в результате местного лечения. Выводы. Степень экссудативной реакции зависит от объёма хирургической травмы радужки. Соответственно, при рассечении обширных, плоскост- ных спаек ожидается более выраженная реакция, чем при рассечении небольших синехий. Введение стерильного воздуха в переднюю камеру в большинстве случаев предотвращает послеоперационный экссудат передней камеры. Литература 1. Буратто, Л. Факоэмульсификация катаракты / Л. Буратто. — С. 122–124. 2. Тахчиди, Х. П. Интраокулярная коррекция в хирургии осложненных катаракт / Х. П. Тахчиди, Э. В. Егорова, А. И. Толчинская. — М., 2004. — С. 3–4. 3. Федоров, С. Н. Ошибки и осложнения при имплантации искусственного хрусталика / С. Н. Федоров, Э. В. Егорова. — М., 1992. — С. 12–14. И. А. Сайфуллина, Е. Г. Григорьева МЕТОДИКА РОТАЦИОННОЙ УЛЬТРАЗВУКОВОЙ ФАКОЭМУЛЬСИФИКАЦИИ ХРУСТАЛИКА ПРИ ПСЕВДОЭКСФОЛИАТИВНОМ СИНДРОМЕ Офтальмологическое отделение АНО МСЧ АГ и ОАО ММК, г. Магнитогорск Современная хирургия катаракты — это безусловно факоэмульсификация, показания к которой неуклонно расширяются. В 31 % случаев факоэмульсификация катаракты производится на фоне псевдоэксфолиативного синдрома (ПЭС). Операция факоэмульсификация катаракты при псевдоэкфолиативном синдроме сопряжена со значительным риском интраоперационных осложнений за счёт плохо расширяющегося зрачка и слабости цинновых связок [Иошин И. Э. с соавт., 2003; Малюгин Б. Э. с соавт., 2004; Georgopoulos G. T. et al., 2000]. До недавнего времени узкий зрачок, плотное ядро, слабость связочного аппарата считались абсолютными противопоказаниями к проведению факоэмульсификации [Першин К. Б. 2007]. Поэтому особенности факоэмульсификации катаракты у лиц с сопутствующим ПЭС изучены недостаточно. Наиболее распространённые на сегодняшний день методики факоэмульсификации катаракты: «divideandconquer» и «phacochop» основаны на разделении хрусталика на части. Однако при применении данных методик имеется значительная нагрузка на связочный аппарат в определённых меридианах и возрастает риск интраоперационных осложнений. Цель — разработка методики ультразвуковой факоэмульсификации при псевдоэксфолиативном синдроме и изучение эффективности применения ротационного способа факоэмульсификации у пациентов с ПЭС. Материал и методы. Представлены больные, прооперированные методом факоэмульсификации катаракты, проведенной в офтальмологическом отделении АНО МСЧ АГ и ОАО ММК с октября 2008 г. по сентябрь 2010 г. Всего было обследовано и прооперировано 497 пациентов с ПЭС. Клинически ПЭС характеризовался ригидным зрачком, отложением псевдоэксфолиативного материала, подвывихом хрусталика I–II степени. Средний возраст пациентов составлял 62 года. Пациенты с незрелой катарактой составили 76,3 %, а зрелой катарактой — 23,7 %. В основную группу вошло 184 пациента (37 %), прооперированных с помощью ротационного метода, в т. ч. у 88 (48 %) пациентов ПЭС осложнён подвывихом хрусталика I–II степени. Контрольную группу составили 313 пациентов (63 %), прооперированных по стандартной методике. Пациентам обеих групп проведена ультразвуковая факоэмульсификация с помощью факоэмульсификатора INFINITY фирмы ALCON. Метод предусматривает круговые движения ядра в горизонтальной плоскости против часовой стрелки с одномоментной эмульсификацией хрусталикового вещества по окружности. 144 Предлагаемый нами способ осуществляют следующим образом. Выполняется микроразрез в роговице на 11 и 14 часах. Вводится вискоэластик в переднюю камеру. Выполняется капсулорексис. В разрез вводится факонаконечник. Рабочий скос иглы факонаконечника погружается в толщу хрусталика под углом и включается режим ультразвука в позиции префако или борозды в зависимости от степени плотности ядра хрусталика и производится факоэмульсификация хрусталика. Во время факоэмульсификации проводится гидроделинеация ядра хрусталика ирригационной жидкостью через ирригационную систему факонаконечника, после чего ядро начинает свободно ротироваться, срезается слой за слоем по окружности с наружных слоев до центра ядра. После эмульсификации ядра производится аспирация кортикального слоя через аспирационную систему факонаконечника в режиме ирригации и аспирации, либо в режиме префако при более плотных корковых слоях. Как правило, они выходят единым бло- ком, так как предварительно были отделены от капсулы хрусталика. Результаты и обсуждение. Интраоперационных осложнений в основной группе не отмечалось. У18 пациентов с подвывихом хрусталика 111степени во время операции была установлена переднекамерная ИОЛ. В контрольной группе в ходе операции у 53 пациентов (17 %) произошёл разрыв или отрыв капсульного мешка с выпадением стекловидного тела, дислокацией остатков ядра и хрусталиковых масс в стекловидное тело. Выводы. Преимуществом предлагаемого метода является более равномерное распределение нагрузки на связочный аппарат хрусталика. При факоэмульсификация катаракты ротационным способом у пациентов с ПЭС в 1,7 раза реже, чем в контрольной группе мы получили интраоперационные осложнения. Таким образом, ротационный метод является эффективным при ультразвуковой факоэмульсификации с сопутствующим ПЭС. Тарасова М. Б., Фиронов Д. В. Анализ суммарных оптических аберраций после имплантации сферических ИОЛ Глазная клиника «МЕДИНВЕСТ», г. Челябинск По мере совершенствования технологий удаления мутного хрусталика, возрастания требований пациентов к результатам операции и срокам реабилитации, проблема адекватной коррекции рефракционных нарушений в хирургии катаракты становится все более актуальной. Решается она за счет имплантации интраокулярной линзы (ИОЛ). Причем совершенствование методов дооперационного обследования пациентов и расчета оптической силы ИОЛ в подавляющем большинстве случаев позволяют обеспечить вид и степень послеоперационной клинической рефракции, близкие к расчетным. Современные технологии удаления помутневшего хрусталика и имплантации ИОЛ позволяют получить высокую остроту зрения без дополнительной коррекции уже в раннем послеоперационном периоде. Однако наличие исходных рефракционных нарушений или нарушений, возникших в ходе операции, в послеоперационном периоде (индуцированный астигматизм, децентрация ИОЛ, ошибки в расчете ИОЛ, фиброз задней капсулы) могут привести к неудовлетворительному результату, а следовательно, снизить эффект операции. Практически любое хирургические вмешательство индуцирует аберрации высших и низших порядков. После удаления катаракты методом факоэмульсификации с имплантацией ИОЛ отмечается значительное увеличение аберраций высших (преимущественно 4–го) порядков [Xiong Y., Lu Y. et al., 2002]. Предпринята попытка разработки ИОЛ с отрицательными сферическими аберрациями, которые частично компенсируют положительные сферические аберрации роговицы. Цель — совершенствование эксимерлазерной хирургической тактики коррекции аберраций у пациентов с артифакией на основе изучения клиникофункционального характера аберраций. Задачи: 1. Изучить структуру оптических аберраций, функциональные исходы после операции факоэ- 145 мульсификации катаракты с имплантацией сферических ИОЛ. 2. Провести сравнительную оценку функциональных исходов в группах пациентов с артифакией до и после проведения эксимерлазерной коррекции аметропии. Материал и методы. Исследование проведено на базе глазной клиники «МЕДИНВЕСТ» (г. Челябинск). Анализ результатов BioStat. Операция ФЭК проведена по стандартной методике на факоэмульсификаторе Catarhex (Швейцария), имплантированы сферические ИОЛ AcrySof (ALCON). Количественную оценку уровня оптических аберраций глаза проводили на анализаторе «волнового фронта» OPD-scan (NIDEK) через 3 месяца после ФЭК и после Lasik на артифакичном глазу. Эксимерлазерную коррекцию остаточных рефракционных нарушений и оптических аберраций проводили по технологии Lasiк (flap 90 mkm), методом персонализированной абляции (Final Fit) (NIDEK EC 5000 CX ll) через 4–8 месяцев после ФЭК. Исследование толщины роговицы и состояния макулярной области сетчатки проводилось на OCT (OptoVue). Исследуемая группа — 48 пациентов (48 глаз) с артифакией: мужчин — 16, женщин — 32, возраст — 47,4±2,3, ВГД — 16,9±0,3 мм рт. ст., толщина роговицы — 540,4±5,2. Средние показатели рефракции сф — 1,10D±0,37, цил. — 1,37D±0,2, ось — 78,7º±8,5. Результаты и обсуждение. Данные рефракционных показателей и остроты зрения до и по- сле Lasik у пациентов с артифакией представлены в табл.1. Максимальная корригированная острота зрения увеличилась в среднем до 0,8 в сравнении с дооперационной (0,68). Таблица 1 Данные рефракционных показателей и остроты зрения до и после Lasik у пациентов с артифакией Параметры visus Sph, D. Cyl, D. ax ИГ до операции 0.68 ± 0.03 –1.10 ± 0.37 –1.37 ± 0.2 78.7 ± 8.5 ИГ после операции 0.8 ± 0.02 + 0.05 ± 0.07 –0.18 ± 0.078 66.7 ± 8.2 Анализ структуры оптических аберраций после имплантации ИОЛ и после дополнительной эксимерлазерной коррекции представлены в таб­ лице 2. Как видно из таблицы, показатели оптических аберраций уменьшились почти в 2 раза по сравнению с исходными. Выводы. При высоких функциональных показателях после ФЭК с имплантацией сферических ИОЛ достаточно значимым остается уровень суммарных оптических аберраций (Total, Tilt S1, High, T.coma, T.trefoil). Персонализированная лазерная абляция в отдаленном периоде позволяет уменьшить уровень аберраций высшего порядка и достичь остроты зрения выше максимально корригированной, что определяет возможность широкого применения данной методики. Таблица 2 ИГ до операции ИГ после операции Total 3,13 ± 0,37 1,44 ± 0,19 Tilt (s1) 0,81 ± 0,12 0,47 ±0,07 High 1,07 ±0,20 0,52 ± 0,07 T.coma 0,47 ± 0,1 0,23 ± 0,05 T.trefl 0,56 ± 0,93 0,29 ± 0,03 T.4foil 0,28 ± 0,07 0,12 ± 0,02 T.sph 0,27 ± 0,05 0,13 ± 0,03 hiAstig 0,31 ± 0,06 0,11 ± 0,02 Литература 1. Аветисов, С. Э. Возможности профилактики индуцированного «шовного» астигматизма при экстракции катаракты / С. Э. Аветисов, В. Р. Мамикоян, А. А. Касьянов, Э. Э. Казарян // Вестн. офтальмол. — 2003. — Т. 119. — № 3. — С. 15–18. 2. Алиев, А-Г. Д. Аберрации оптической системы глаза при имплантации искусственного хрусталика / А-Г. Д. Алиев, М. И. Исмаилов. — М., 2000. — 144 с. 3. Антонюк, С. В. Эксимерлазерная коррекция посттравматических аномалий рефракции по технологии Лазик методом персонализированной абляции на основе данных аберрометрии / С. В. Антонюк // Рефракционная хирургия и офтальмология. — 2003. — Т. 3. — № 2. — С. 4–9. 4. Балашевич, Л. И. Рефракционная хирургия / Л. И. Балашевич. — СПб.: Издательский дом СПбМАПО, 2002. — 288 с. 146 5. Корнюшина, Т. А. Аберрации оптической системы глаза человека и их клиническое значение / Т. А. Корнюшина, Ю. З. Розенблюм // Вестник оптометрии. — 2002. — № 3. — С. 13–20. 6. Эль Маатуй, Л. М. Профилактика индуцированного и коррекция исходного роговичного астигматизма при факоэмульсификации с имплантацией ИОЛ: дис. ... канд. мед. наук / Л. М. Эль Маатуй. — М., 2003. — С. 14. 7. Chalita, M. R. Wavefront Analysis in Post-LASIK Eyes and its Correlation with Visual Symptoms, Refraction and Topography / M. R. Chalita, S. Waheed [et al.] // Invest. Ophthalmol. Vis. Sci. — 2003. — № 44 (5). — Р. 2651. 8. Xiong, Y. Investigation of wavefront aberrations for patients with cataract surgery / Y. Xiong, Y. Lu [et al.] // Invest. Ophtalmol. Vis. Sci. — 2002. — Vol. 43. — № 12. — Р. 387. С. Ю. Туровский, Г. В. Крайнов ИЗМЕНЕНИЕ ВЕЛИЧИНЫ ИСХОДНОГО ФИЗИОЛОГИЧЕСКОГО АСТИГМАТИЗМА ПОСЛЕ ТОПОГРАФООРИЕНТИРОВАННОЙ ФАКОЭМУЛЬСИФИКАЦИИ КАТАРАКТЫ Самарская клиническая офтальмологическая больница им. Т. И. Ерошевского, г. Самара Факоэмульсификация в настоящее время является золотым стандартом хирургии катаракты, обладает рядом неоспоримых преимуществ перед шовной методикой: быстрая реабилитация, высокая острота зрения, минимальные ограничения в послеоперацонном периоде [1]. Индуцированный астигматизм, который зачастую нивелирует усилия хирурга в достижении высокого функционального результата, остаётся актуальной проблемой, особенно если исходный астигматизм был физиологическим и не оказывал значительного влияния на зрение [2]. Современные разработки позволяют модифицировать степень астигматизма во время операции с помощью различных доступов, протяженности тоннельного разреза [3, 4, 6]. В мировой практике чаще применяется роговичный доступ [1–5]. Известно, что топографоориентированный роговичный разрез способствует уменьшению исходного астигматизма [4, 5]. Цель — проанализировать изменение величины исходного астигматизма после топографоориентированной факоэмульсификации, выполненной в различных модификациях у пациентов с физиологическим астигматизмом (до 1 диоптрии). Использовать полученные данные для идеально точного расчета астигматического компонента торических интраокулярных линз (ИОЛ) и прогнозирования послеоперационного функционального результата у пациентов с выраженным исходным астигматизмом. Материал и методы. Работа проведена на основе ретроспективного анализа данных 89 пациентов (115 глаз), которые были амбулаторно прооперированы в отделении рефракционной хирургии СКОБ им. Т. И. Ерошевского по поводу неосложненной катаракты без сопутствующей патологии глаз, исходным роговичным астигматизмом до 1 диоптрии, неосложненным ходом операции и послеоперационным периодом, некорригированой остротой зрения после операции 1,0. Операции выполнялись на факоэмульсификаторе фирмы «Opticon», модель «Assistant». Больные разделены на 2 группы в зависимости от модификации факоэмульсификации: I группа — бимануальная, с выполнением двух парацентезов для эвакуации хрусталика и тоннельного разреза для имплантации ИОЛ (72 глаза), II группа — коаксиальная, с выполнением тоннельного разреза для эвакуации хрусталика и имплантации ИОЛ, одним парацентезом (43 глаза). Обе группы были однородными по полу, возрасту, общесоматическому статусу. Средний возраст пациентов в I группе составил 63,61±3,57 лет, во II группе — 65,58±5,24 лет. Тоннельный разрез формировался одноразовым кератотомом шириной 2,75 мм по оси сильного меридиана астигматизма. Всем пациентам имплантировались современные эластичные ИОЛ одной модели с использованием инжектора. 147 Пред- и послеоперационное обследование включало проведение стандартных для такого вида вмешательств исследований, в том числе визометрии с применением фороптера и проектора знаков, бесконтактной тонометрии, авторефрактометрии, автокератометрии. Степень изменения индуцированного или редуцированного астигматизма оценивалась через 1 месяц после операции. Результаты и обсуждение. До операции среднее значение величины астигматизма составило 0,78D± ±0,12 для бимануальной методики и 0,62D±0,22 — для коаксиальной. После операции средние значение величины астигматизма составило 0,65D±0,1 и 0,89D±0,22 соответственно. В I группе выявлено усиление астигматизма до 0,5D в 27,15 % случаев, от 0,5 до 1,0D — в 7,14 %. Вероятность уменьшения дооперационного астигматизма составила 48,57 % и 12,86 % соответственно. Во II группе индуцирование астигматизма до 0,5D отмечено в 42,12 %, от 0,5 до 1,0D — в 31,58 %. Редукция дооперационного астигматизма составила 21,05 % и 5,25 % соответственно. Выводы: 1. Изменения величины исходного астигматизма как в сторону редукции, так и в сторону индукции незначительны при выполнении обеих модификаций факоэмульсификации, объективно не влияют на остроту зрения. 2. Риск увеличения исходного астигматизма в 2 раза выше при проведении коаксиальной модификации, чем при бимануальной. 3. При проведении бимануальной модификации факоэмульсификации в 2,3 раза чаще удается добиться редукции исходного астигматизма, по сравнению с коаксиальной. 4. Вероятность достижения расчетной рефракции при имплантации торических ИОЛ по показаниям выше при выборе бимануальной модификации. Литература 1. Alio, J. L. MICS (Micro-Incision Cataract Surgery). Highlights of Ophthalmology International / J. L. Alio, J. L. RodríguezPrats, A. Galal. — Miami, 2004. ISBN Nº. 9962-613-30-2. 2. Speirer, A. Changes in astigmatism after congenital cataract surgery and intraocular lens implantation / A. Speirer, S. M. BarSela// Arch. Ophthalmol. — 2004. — Vol. 122. — № 5. — P. 695–697. 3. Barequet, I. S. Astigmatism outcomes of horizontal temporal versus nasal clear corneal incision cataract surgery / I. S. Barequet, E. Yu, S. Vitale [et al.] // J. Cataract Refract. Surg. — 2004. — Vol. 30. — № 2. — P. 1418–1423. 4. Pfleger, T. Long-term course of induced astigmatism after clear corneal incision cataract surgery / T. Pfleger, C. Skorpik, R. Menapace [et al.] // J. Cataract Refract. Surg. — Vol. 22. — № 1. — P. 72–77. 5. Wilczynski, M. Comparison of surgically induced astigmatism after coaxial phacoemulsification through 1.8 mm microincision and bimanual phacoemulsification through 1.7 mm microincision / M. Wilczynski, E. Supady, P. Loba [et al.] // J. Cataract Refract. Surg. — 2009. — Vol. 35. — № 9. — P. 1563–1569. 6. Kaufmann, C. Limbal relaxing incisions versus on-axis incisions to reduce corneal astigmatism at the time of cataract surgery / Claude Kaufmann, Jayanthi Peter, Kenneth Ooi [et al.] // J. Cataract Refract. Surg. — 2005. — Vol. 31. — № 12. — P. 2261–2265 [My paper]. М. Ю. Тяжев, М. А. Шантурова, Е. Г. Шишкина ФАКОЭМУЛЬСИФИКАЦИЯ КАТАРАКТЫ У ПАЦИЕНТОВ С ФАКИЧНЫМИ ИОЛ Иркутский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Фёдорова Росмедтехнологии», г. Иркутск Развитие рефракционной офтальмохирургии показало её преимущество перед другими способами коррекции миопии высокой степени (очковая и контактная коррекция). В последние десятилетия особенно успешно стала развиваться импланта- ция факичных ИОЛ. Это связано с сохранностью аккомодационной способности глаза, а также со значительным повышением качества и совершенствованием модельного ряда факичных линз. В то же время у некоторых пациентов, которым 148 в 90-е годы были имплантированы первые модели факичных ИОЛ (RSC, Россия), стала развиваться катаракта. Формирование помутнений в переднекортикальных слоях хрусталика было обусловлено тем, что эта линза довольно часто прилипала к передней капсуле хрусталика. В более современных моделях факичных ИОЛ (RSК-3, Россия) этот серьёзный недостаток был практически устранен нанесением микроперфорационного отверстия в оптической части. Так как помутнения в хрусталике локализовались преимущественно в проекции оптической оси, это значительно снижало остроту зрения у пациентов, зачастую приводило к ограничению профессиональной деятельности и существенно влияло на качество жизни. Для социальной реабилитации этим больным была проведена операция — удаление факичной ИОЛ, факоэмульсификация катаракты с имплантацией ИОЛ. Цель — разработать микроинвазивную технологию хирургии катаракты у пациентов с факичными ИОЛ. Материал и методы. Было прооперировано 15 пациентов (22 глаза) с катарактой после имплантации факичных ИОЛ. Среди них было 9 женщин и 6 мужчин, что составило соответственно 60 % и 40 %. Возраст пациентов варьировал от 37 до 57 лет (в среднем 46 лет). Все они ранее получили хирургическое лечение по поводу близорукости высокой степени — имплантация факичных ИОЛ. В ходе операции через роговичный тоннельный разрез (~3.5 мм) в заднюю камеру глаза была имплантирована сополимер-коллагеновая факичная линза (RSC, Россия). Срок развития катаракты от момента имплантации составил от 3 до 12 лет (в среднем 9 лет). Всем пациентам была выполнена факоэмульсификация катаракты с имплантацией заднекамерной эластичной модели ИОЛ с одновременным удалением факичной ИОЛ. Хирургическое вмешательство проводилось под субтеноновой анестезией и включало следующие этапы: выполняли 2 корнеоцентеза, в переднюю камеру вводили комбинированный вискоэластик — «Discovisc», обладающий адгезив- ными и когезивными свойствами. Использование именно этого вискоэластика позволяло надёжно защитить эндотелий и поддерживать стабильную глубину передней камеры глаза в ходе всех интраокулярных манипуляций. Затем вискоэластик вводили под факичную линзу одновременно канюлей, вывихивая ИОЛ в переднюю камеру. Далее формировали тоннельный роговичный самогерметизирующийся разрез 1.8 мм. Поэтапно фиксируя цанговым пинцетом (23g) факичную ИОЛ, производили продольный разрез линзы цанговыми ножницами (23g). Затем полученные части ИОЛ свободно удаляли из передней камеры глаза через роговичный тоннель, не расширяя его, этим же пинцетом. Цанговым пинцетом для капсулорексиса выполняли передний дозированный круговой капсулорексис. Далее, используя MICS-технологию, проводили факоэмульсификацию катаракты с интракапсульной имплантацией ИОЛ. Результаты и обсуждение. В ходе операций каких-либо специфических осложнений отмечено не было. Ранний послеоперационный период протекал аррективно. Острота зрения у всех пациентов после операции значительно повысилась в среднем (с 0,23 до 0,61). В позднем послеоперационном периоде у одного пациента развилась вторичная катаракта, которая потребовала повторного хирургического вмешательства. Выводы: 1. Предложенный метод удаления факичной ИОЛ не требует расширения роговичного тоннельного разреза, позволяет в полном объёме использовать все преимущества MICS технологии при удалении катаракты. 2. Отсутствие индуцированного астигматизма способствует быстрой рефракционной стабилизации и, соответственно, быстрой медико-социальной реабилитации пациентов. 3. У всех пациентов после операции отмечается повышение остроты зрения, что позволяет им вернуться к полноценной жизни и прежней профессиональной деятельности. Литература 1. Балашевич, Л. И. Рефракционная хирургия / Л. И. Балашевич. — Спб.: Издательский дом СПбМАПО, 2002 — 288 с. 2. Зуев, В. К. Современные аспекты хирургической коррекции миопии высокой степени: дис. … д-ра мед. наук / В. К. Зуев. — М., 1995. — 170 с. 149 3. Коновалов, М. Е. Способ лечения осложненной катаракты у пациентов после факичной коррекции / М. Е. Коновалов, Е. М. Молокотин // XI науч.-практ. конф. «Современные технологии катарактальной и рефракционной хирургии»: сб. науч. ст. — М., 2010. — 100 с. 4. Першин, К. Б. Занимательная факоэмульсификация / К. Б. Першин. — СПб.: Борей Арт, 2007. — 136 с. 5. Туманян, Э. Р. Клинико-функциональное состояние глаз с миопией высокой степени после имплантации отрицательной ИОЛ: дис. … д-ра мед. наук / Э. Р. Туманян. — М., 1998. — 161 с. 6. Тяжев, М. Ю. Патогенетическое обоснование бинариметрии в реабилитации больных миопией высокой степени после имплантации интраокулярных факичных линз: дис. … канд. мед. наук / М. Ю. Тяжев. — Иркутск, 2007. — 135 с. 7. Khiun O. Microcoaxial phacoemulsification: a new standard in cataract surgery? / O. Khiun, F. Tjia // J. Cataract Refract. Surg. — 2006. — № 3. — P. 18–30. 8. Kyung-Min Lee. Microcoaxial cataract surgery outcomes: Comparison of 1,8 mm system and 2,2 mm system / Kyung-Min Lee [et al.] // J. Cataract Refract. Surg. — 2004. — Vol. 30. — № 5. — P. 1014–1019. А. Д. Чупров, Ю. В. Кудрявцева, А. А. Замыров, К. С. Ивонин ОПЫТ ИМПЛАНТАЦИИ ОТЕЧЕСТВЕННОЙ ИНТРАОКУЛЯРНОЙ ЛИНЗЫ «МИОЛ–26» Кировская клиническая офтальмологическая больница, г. Киров В настоящее время ультразвуковая факоэмульсификация является стандартом хирургии катаракты. Возможность проведения данной операции через тоннель роговицы в 1,8 мм позволяет за счёт минимизации хирургической травмы добиться высокого качества зрения и максимально сократить период реабилитации пациента, после операции. В то же время, большинство ИОЛ предназначены для имплантации через стандартный тоннель, а выбор линз для микродоступов ограничен 1–2 импортными ИОЛ, которые имеют большую стоимость. Новая линза «МИОЛ–26» является первой отечественной линзой для имплантации через микроразрез. Технические характеристики МИОЛ–26 позволяют имплантировать ее через тоннель 1,8 мм с помощью инжектора. В капсульном мешке ИОЛ занимает трехмерное положение и плотно прилегает к задней капсуле. Это позволяет имитировать заполнение капсульного мешка, восстановить дооперационную анатомию переднего сегмента глаза и обеспечить стабилизацию искусственного хрусталика в капсуле. Цель — оценить результаты имплантации интраокулярной линзы «МИОЛ–26». Материал и методы. В исследовании участвовали 7 пациентов (3 мужчины и 4 женщины), 7 глаз с не осложненной катарактой различной степени зрелости. Возраст пациентов варьировал от 67 до 82 лет, средний возраст составил 73 года. При пре- доперационном обследовании не было выявлено заболеваний, которые могли бы повлиять на функциональный результат хирургии. У всех пациентов предполагалось получить максимальную остроту зрения. Для расчета использовали А-константу равную 118,4. Техника расчета была стандартной и включала биометрию, кератометрию и формулы SRK II и SRK\T. В послеоперационном периоде оценивали удовлетворенность пациента хирургическим вмешательством, максимальную остроту зрения, уровень послеоперационного астигматизма. Развитие вторичной катаракты не изучали по причине новизны ИОЛ и небольшого срока наблюдения. Выполнена стандартная микрокоаксиальная ультразвуковая факоэмульсификация катаракты через доступ 1,8 с использованием одноразовых кератомов Alcon на факоэмульсификаторе Millenium (Baush&Lomb) по технике «Phacochop». Использовали технологию CCS, режимы burst и гиперпульс. Во всех случаях оперативное вмешательство прошло без осложнений. Для имплантации использовали интраокулярную линзу «МИОЛ–26» производства Репер-НН. Результаты и обсуждение. Во всех случаях пациенты были удовлетворены результатом хирургии. Максимальная острота зрения после операции варьировала от 0,7 до 1,0. В среднем острота зрения составила 0,85±0,05. Все хирурги отмечали легкость и предсказуемость имплантации. Послеоперационный астигматизм не превышал 0,5 диоп- 150 трий, сферический эквивалент составил в среднем 0,75±0,05 диоптрий. При биомикроскопии у всех пациентов отмечено ареактивное течение после­ операционного периода, хорошая центрация ИОЛ и плотный контакт поверхности линзы с задней капсулой. Выводы. Интраокулярная линза «МИОЛ–26» является достойной альтернативой дорогостоящим импортным ИОЛ для имплантации через тоннель роговицы в 1,8 мм. Это подтверждается высокими послеоперационными функциональными результатами и предсказуемостью имплантации во время хирургии. О. В. Шиловских, О. В. Сафонова, М. В. Иванова Результаты хирургического лечения катаракты на фоне хронических вялотекущих увеитов Екатеринбургский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Фёдорова Росмедтехнологии», г. Екатеринбург При всём многообразии существующих методов лечения, проблема поиска оптимальных технологий хирургии осложнённой катаракты на фоне хронических вялотекущих увеитов остаётся актуальной. В нашей клинике был разработан метод хирургического лечения увеальной катаракты с интраокулярной коррекцией, препятствующий развитию спаечного процесса в переднем отрезке глаза. Цель — анализ результатов хирургического лечения катаракты у пациентов с хроническим вялотекущим увеитом. Материал и методы. Группу исследования составили 36 пациентов (44 глаза), средний возраст — 32,5 года (от 5 до 59 лет). По этиологии: ЮРА — 15 глаз, болезнь Бехтерева — 3 случая, ревматоидный артрит — 6 глаз, туберкулёз — 1 случай, в 19 случаях — неустановленная этиология увеита. Средняя острота зрения — 0,35±0,11 (от pr. l. certae до 0,7). На 11 глазах наблюдалась лентовидная дегенерация роговицы, задние синехии — в 27 случаях, иридокорнеальные сращения на 2 глазах, вторичная глаукома в 3 случаях. Среднее ВГД — 12,5 мм рт. ст (от 7 до 50,5 мм рт. ст.). Операции выполнялись по оригинальной технологии, включающей удаление катаракты, формирование заднего капсулорексиса и переднюю витрэктомию. Пациентам имплантировалась трёхчастная ИОЛ (МА60АС или МА60ВМ), при этом оптическая часть ИОЛ заводилась за задний капсулорексис, что обеспечивало максимальную удалённость последней от задней поверхности радужной оболочки. Сроки наблюдения составили от 3 мес. до 3 лет. Результаты и обсуждение. В раннем послеоперационном периоде (до 3 месяцев) острота зрения 0,5 и выше наблюдалась на 17 глазах (38,6 %), 0,2–0,5 — в 17 случаях (50 %), менее 0,2 — на 5 глазах (11,4 %). В 15 случаях был выявлен кистозный макулярный отёк, исчезновение которого и восстановление зрительных функций в 9 случаях произошло на фоне консервативной терапии, на 4 глазах — в результате витрэктомии с интравитреальным введением кеналога. В 16 случаях наблюдалось отложение преципитатов на поверхности ИОЛ, сопровождающееся снижением остроты зрения. При назначении противовоспалительной терапии на 10 глазах произошло исчезновение преципитатов с полным восстановлением зрения, в 6 случаях было выполнено удаление преципитатов с помощью ИАГ — лазера. Декомпенсация ВГД, потребовавшая дополнительных вмешательств, произошла в 3 случаях, посредством НГСЭ и ЛДГП ВГД было компенсировано. Средняя дистанция от задней поверхности роговицы до ИОЛ на первые-вторые сутки после операции составляла 4,41±0,14, к 3 месяцам после операции уменьшилась в среднем на 0,2 мм и далее оставалась стабильной. Данные о состоянии остроты зрения до 3 лет в динамике представлены в таблице. Остальные исследуемые признаки в период наблюдения оставались стабильно компенсированными на фоне адекватной противовоспалительной и гипотензивной терапии. 151 Динамика остроты зрения Visus Менее 0,2 0,2–0,5 > 0,5 Ранний Через 1 год Через 3 года п/о период (n=26) (n=19) (n=44) 5 (11,4 %) 3 (11,1 %) 3 (15,8 %) 22 (50 %) 9 (33,3 %) 9 (47,6 %) 17 (38,6 %) 14 (51,9 %) 7 (36,8 %) Выводы. Предложенный метод хирургического лечения катаракты у пациентов с хроническим вялотекущим увеитом препятствует спаечному процессу в переднем отрезке глаза и, несмотря на осложнения послеоперационного периода, позволяет достигнуть хороших функциональных результатов. 152 Раздел IV Диагностика и лечение глаукомы Г. Ш. Абизгильдина Значение сфигмометрических показателей в диагностике первичной открытоугольной глаукомы ГКБ, г. Стерлитамак, Республика Башкортостан Одно из первых мест среди причин необратимой слепоты, слабовидения и первичной инвалидности занимает глаукома. Этиопатогенез заболевания характеризуется повышением внутриглазного давления (ВГД) с нарушением внутриглазного кровотока. Трудности в диагностике первичной открытоугольной глаукомы (ПОУГ) связывают с бессимптомным течением начальных стадий патологического процесса, широким диапазоном клинических картин течения заболевания, отсутствия четкой закономерности, широкой вариабельности клинических проявлений. Так начальные стадии глаукомы у 30 % больных протекают без повышения ВГД, у 80 % пациентов изменения в зрительном нерве не регистрируются [7]. Исследование гидро- и гемодинамики глаза путем регистрации и измерения колебаний офтальмотонуса (глазного пульса), возникающего за счет сердечных сокращений, объединены в сфигмометрические показатели [1, 2, 3]. Цель — изучение внутриглазного кровотока у больных с ПОУГ на основе сфигмометрических показателей. Материал и методы. Обследовано 65 пациентов (128 глаз) с ПОУГ. В качестве контрольных использованы величины сфигмометрических параметров гемодинамики у 40 здоровых лиц (80 глаз). Все обследованные находились в одном возрастном диапазоне (от 40 до 60 лет), и на момент исследования артериальное давление соответствовало возрастным нормативам. Для оценки зависимости показателей кровотока от уровня офтальмотонуса все глаукомные пациенты были распределены на 3 группы: группа А — с нормальным ВГД (Ро до 20 мм. рт ст); группа В — с умеренно повышенным ВГД (Ро от 20 мм рт. ст. до 26 мм рт. ст.) и группа С — с высоким ВГД (Ро с 27 мм рт. ст. до 35 мм рт. ст.). Исследование проводилось на глазном тонографе «Глаутест-60» (Россия) путем вычисления комплекса тонографических, тонометрических и сфигмометрических показателей: 1. Систолический прирост пульсового объема (Аv), мм3 — показатель отражает разницу между максимальным и минимальным объемом переднего сегмента глазного яблока в течение одного сердечного цикла. 2. Пульсовой объем крови (ПОК), мм3 — величина Аv в пересчете на площадь всего глазного яблока с учетом индивидуальной величины переднезадней оси глаза. 3. Минутный объем крови (МОК), мм3 — суммарная величина объемов крови, протекающих во время сердечного цикла через системы цилиарных и ретинальных сосудов за 1 минуту. МО = ПОК × Рs — частота пульса 4. Амплитуда глазного пульсового давления (Аp), мм рт. ст. 5. Показатель эластичности сосудов глаз (ПЭСГ), мм3/мм рт. ст. Аv/ Аp Результаты и обсуждение. Исследование гемодинамики в контрольной группе показало стабильные данные объемного кровотока. Величина пульсового объема крови составила 7,3±2,4 мм3, МОК — 492±158 мм3. Наблюдалось снижение значения сфигмометрических показателей в группе с ПОУГ (таб. 1). Величина пульсового объёма крови составила в среднем 6,1±2,1 мм3, что достоверно отличалась от соответствующего показателя в группе контроля. Минутный объём крови также был значительно ниже, чем в здоровых глазах, и составлял 427±105 мм3. Таблица 1 Сфигмометрические показатели при ПОУГ и в контрольной группе (M±m) Сфигмометрические показатели Ро, мм рт. ст. Аv, мм3 МОК, мм3 ПОК, мм3 Ар, мм рт. ст ПЭСГ, мм3/мм рт. ст. Контрольная группа (n=80) 16,0±1,2 0,86±0,32 492±158 7,3±2,4 0,2±1,4 0,9±3,0 ПОУГ (n=128) 18,81±6,1 1,8±0,25 427±105 * 6,1±2,1 ** 1,78±2,5 ** 1,64±1,6 * Примечание. Достоверность различий * — p<0,05, ** p<0,01, *** p<0,001. В целом средние значения объемных гемодинамических показателей при глаукоме уменьшались на 23 % по сравнению с контролем, в то время как 154 средние величины ВГД, как в группе контроля, так и при ПОУГ, были близкими. Таким образом, по данным сфигмометрии, для больных глаукомой характерен дефицит кровоснабжения в артериальнокапиллярной сети внутренних оболочек глаза. Представлял интерес оценить показатели сфигмометрии в зависимости от степени тяжести глаукомного процесса и уровня ВГД у больных ПОУГ. Повышение офтальмотонуса сопровождалось уменьшением параметров объемного кровотока (табл. 2). Даже в группе с нормальным ВГД параметры объёмного кровотока у пациентов с ПОУГ были достоверно ниже, чем в группе контроля. Наименьшие величины объемного кровотока обнаруживались в группе С — с высоким уровнем офтальмотонуса, причем они оказались в 2 раза хуже, чем у здоровых лиц. Анализируя изменения объёмных показателей гемодинамики глаза в зависимости от стадии глаукомы (табл. 3), видно, что по мере развития заболевания ухудшение гемодинамики прогрессировало. Причем значительное падение гемодинамики, на 16 % по сравнению с нормой, мы отмечали уже на начальных стадиях заболевания. Во второй стадии заболевания объёмные показатели продолжали снижаться, хотя их различие с первой стадией не были статически значимым. При этом III и особенно IV стадии заболевания отличались существенным, более чем двухкратным по отношению к норме падением объемных показателей кровотока. Выводы. Cпособом измерения сфигмометрических показателей установлено достоверное снижение Аv и минутного объема кровотока у пациентов с ПОУГ по сравнению с контролем. Выявлена обратная зависимость величины объемных гемодинамических параметров у пациентов с ПОУГ от уровня ВГД. Отмечено значимое снижение падение объемных показателей глазного кровотока у пациентов с доклиническими проявлениями ПОУГ и дальнейшее их снижение по мере развития заболевания. Таблица 2 Зависимость показателей сфигмометрии от уровня офтальмотонуса при глаукоме (M ±m) Сфигмометрические показатели Ро, мм рт. ст. Аv, мм3 МОК, мм3 ПОК, мм3 Ар, мм рт. ст. ПЭСГ, мм3/мм рт. ст. Контрольная группа (n=80) 16,0±1,2 0,86±0,32 492±158 7,3±2,4* 0,2±1,4 0,9±3,0 Группа А (n=89) Группа В (n=27) Группа С (n=12) 15,5±4.0 0,61±0,23** 433±127 6,5±2,0* 1,2±1.0* 0,96±1,3 24,2±1,4 0,49±0,29 401±123** 5,6±3,0 1,5±2,0* 1,5±0,4 36,4±8,0** 0,49±0,34 354±196** 4,9±2,0 1,8±2,1*** 0,6±0,2 Примечание. Достоверность различий * — p<0,05, ** p<0,01, *** p<0,001. Таблица 3 Зависимость показателей сфигмометрии от стадии глаукомы (M ±m) Сфигмометрические показатели Ро, мм рт. ст. Аv, мм3 МОК, мм3 ПОК, мм3 Ар, мм рт. ст ПЭСГ, мм3/мм рт. ст. I стадия (n=56) II стадия (n=44) III стадия (n=23) IV стадия (n=5) 16,9±6,1 2,0 ±0,11 421±121* 6,7±1,9 1.78±0,2* 1,64±0,3 17,6±4,9* 2,1±0,30 455±106** 6,5±1,9 1,9±0,1** 1,09±0,1 19,6±8,1 1,8 ±0,30 378±134** 5,4±2,3 2,46±0,5 0,88±0,3*** 24,9±9,4 1.9±0,54 223±78 2.8±1,2* 2,56±1,0* 0,87±0,1 Примечание. Достоверность различий * — p<0,05, ** p<0,01, *** p<0,001. Литература 1. Алексеев, В. В. Плетизмографические и патоморфологические параллели снижения объёмного внутриглазного кровотока при первичной открытоугольной глаукоме / В. В. Алексеев, В. В. Страхов, Н. В. Корчагин. — 2010. — Т. 11. — С. 121–122. 2. Бунин, А. Я. Гемодинамика глаза и методы ее исследования / А. Я. Бунин. — М.: Медицина, 1971. — 196 с. 155 3. Волков, В. В. Глаукома при псевдонормальном давлении: руководство для врачей / В. В. Волков. — М.: Медицина, 2001. — 351 с. 4. Котляр, К. Е. Методы исследования гемодинамики глаза / К. Е. Котляр // Клиническая физиология зрения. — М., 2006. — С. 639–739. 5. Нестеров, А. П. Внутриглазное давление. Физиология и патология / А. П. Нестеров, А. Я. Бунин, Л. А. Канцельсон. — М.: Наука, 1974. — 381 с. 6. Страхов, В. В. Эссенциальная гипертензия глаза и первичная глаукома: автореф. дис. … д-ра мед. наук / В. В. Страхов. — Ярославль, 1997. — 26 с. 7. Фламмер, Д. Ж. Глаукома / Д. Ж. Фламмер. — Минск, 2003. — С. 35–37, 86–91. 8. Silver, D. M. Estimatoin of pulsatile ocular blood flow from intraocular pressure / D. M. Silver, R. A. Farell, M. E. Langham [et al.] // Acta Ophthalmologica. — 1989. — Vol. 191. — P. 25–29. В. Н. Алексеев, Е. Б. Мартынова, И. Р. Газизова Состояние митохондрий аксонов зрительного нерва при экспериментальной глаукоме Государственная медицинская академия им. И. И. Мечникова, г. Санкт-Петербург Проблема первичной открытоугольной глаукомы по праву считается одним из приоритетных направлений в офтальмологии в силу своей медикосоциальной значимости. До сих пор заболевание является причиной необратимой слепоты и слабовидения, занимая одно из ведущих мест в перечне инвалидизирующих заболеваний органа зрения [3, 4, 5, 6, 11]. Несмотря на многочисленные исследования этиологии и патогенеза и полученные очевидные успехи в диагностики и лечении первичной открытоугольной глаукомы, у большинства больных с длительным течением глаукомы установлено прогрессивное ухудшение зрительных функций с переходом заболевания в более тяжелую форму [1]. На наш взгляд, причиной сложившейся ситуации могут быть неизученные на сегодняшний день механизмы патогенеза и факторы прогрессирования глаукомного процесса [2]. Таким неучтенным фактором может быть так называемая митохондриальная патология, в последнее время активно изучаемая в неврологии, педиатрии и офтальмологии [7, 8, 13, 14]. В настоящее время доказана связь болезни Альцгеймера и митохондриальной патологии [10, 12]. Можно напомнить, что и болезнь Альцгеймера и первичную открытоугольную глаукому в последнее время относят к нейродистрофическим заболеваниям. Болезни, связанные с нарушением функции митохондрий — митохондриальные цитопатии (атрофия зрительного нерва Лебера). Наряду с ними су- ществуют заболевания, которые включают в себя те или иные нарушения клеточной энергетики как вторичные звенья патогенеза [9, 10, 12, 13]. Среди таких заболеваний: синдром хронического утомления, мигрени, кардиомиопатии, болезни соединительной ткани, диабет. Чаще всего в процесс вовлекаются органы с высокой метаболической активностью. В связи с этим становится актуальным изучение состояния митохондрий различных структур глазного яблока, особенно заднего отрезка (сетчатки и зрительного нерва), при глаукоме. Цель — изучить состояние митохондрий аксонов зрительного нерва при экспериментальной глаукоме. Материал и методы. Для изучения состояния митохондрий аксонов зрительного нерва была воспроизведена модель адреналин-индуцированной глаукомы у кроликов породы «Серая Шиншилла» (10 животных). Данная модель разработана и предложена Е. М. Липовецкой (1966) в НИИ глазных болезней и тканевой терапии имени академика В. П. Филатова. Опытным животным через день в ушную вену вводили 0,1 мл 0,1 % раствора адреналина гидрохлорида в течение 3 месяцев. Такое хроническое внутривенное введение кроликам небольших доз адреналина приводит к развитию первичной открытоугольной глаукомы со всеми характерными признаками этого заболевания. Контрольную группу составили интактные кролики (7 животных). После окончания клинической фазы кролики были выведены из эксперимента воздушной эмболией пу- 156 тем введения в ушную вену 10 мл воздуха. Изучение структур волокон зрительного нерва проводилось путем электронной микроскопии. Всего в итоге просмотрено более 60 срезов. Результаты и обсуждение. При электронной микроскопии срезов контрольной группы животных митохондрии волокон зрительного нерва имели удлиненную форму, электронно-плотный матрикс и относительно редкие пластинчатые кристы. Иная картина была зарегистрирована при электронной микроскопии волокон зрительного нерва у кроликов с экспериментальной глаукомой. Митохондрии с явлениями дегенерации, деструкции. Матрикс митохондрий резко просветлён. Кристы укорочены, редуцированны, дезинтегрированы, отмечалось уменьшение размеров крист, расположены они вблизи мембраны. В миелиновой оболочке — отслоение разной степени выраженности, местами расслоения. Большинство митохондрий были резко увеличены и просветлены. Выявлялись набухшие органеллы. В них визуализировались вакуоли. Единичные митохондрии были изменены в форме. В итоге просмотрено более 60 срезов. Изменения митохондрий различной степени выраженности выявлены у 97 % органелл. Выводы. Выявленные морфологические изменения могут привести к нарушению функций митохондрий как структуры, отвечающей за энергетические процессы в клетке. Умеренные нарушения клеточной энергетики не проявляются как самостоятельное заболевание, однако сказываются на характере течения, например, глаукомной нейрооптикопатии при первичной открытоугольной глаукоме. Данное направление является весьма перспективным и заслуживает дальнейшего изучения. Литература 1. Алексеев, В. Н. К вопросу о методах определения давления цели / В. Н. Алексеев, Т. Г. Лобова // Мат-лы III Всерос. школы офтальмологов. — М., 2004. — С. 16–21. 2. Алексеев, В. Н. Значение митохондриальной патологии в медицине и в офтальмологии / В. Н. Алексеев, Е. Б. Мартынова, О. А. Малеванная [и др.] // Мат-лы конф. «Глаукома: теория и практика». — СПб., 2011. — С. 3–5. 3.Егоров, Е. А. Патогенетические аспекты лечения первичной открытоугольной глаукомы / Е. А. Егоров, В. Н. Алексеев, Е. Б. Мартынова [и др.] — М., 2001. — 118 с. 4.Либман, Е. С. Слепота и инвалидность по зрению в населении России / Е. С. Либман, Е. В. Шахова // VIII Всесоюз. съезд офтальмологов: тез. докл. — М., 2005. — С. 78–79. 5. Мошетова, Л. К. О тактике подхода к лечению больных глаукомой / Л. К. Мошетова, Ю. М. Корецкая // Клин. офтальмол. — 2005. —Т. 6. — № 2. — С. 78–80. 6. Нестреров, А. П. Первичная открытоугольная глаукома: патогенез и принципы лечения / А. П. Нестреров // Клин. офтальмол. — 2000. — Т. 1. — № 1. — С. 4–5. 7. Abu-Amero, K. K. Mitochondrial abnormalities in patients with primary open-angle glaucoma / K. K. Abu-Amero, J. Morales, T. M. Bosley // Invest. Ophthalmol. Vis. Sci. — 2006. — Vol. 47. — P. 2533–2541. 8. Izzotti, A. Mitochondrial damage in the trabecular meshwork of patients with glaucoma / A. Izzotti, S. C. Sacca, М. Longobardi [et al.] // Arch. Ophthalmol. — 2010. — Vol. 128. — № 6. — P. 724–730. 9. Mauro di, S. Mitochondrial respiratory-chain diseases / S. di Mauro, E. A. Schon // N. Engl. J. Med. — 2003. — Vol. 348. — P. 2656–2668. 10.McKenzie, M. Mitochondrial disease: mutations and mechanisms / M. McKenzie, D. Liolitsa, M. G. Hanna // Neurochem. Res. — 2004. — Vol. 29. — P. 589–600. 11.Quigley, H. A. The number of people with glaucoma worldwide in 2010 and 2020 / H. A. Quigley, A. T. Broman // Br. J. Ophthalmol. — 2006. — Vol. 90. — Р. 262–267. 12.Schmiedel, J. Mitochondrial сytopathies / J. Schmiedel, S. Jackson, J. Schefer, H. Reichmann // J. Neurol. — 2003. — Vol. 250. — P. 267–277. 13.Tanwar, M. Mitochondrial DNA analisis in primari congenital glaucoma / M. Tanwar, R. Dada, T. Dada, R. Sihota // Mol. Vis. — 2010. — Vol. 16. — P. 518–533. 14.Tatton, W. G. Apoptosis and anti-apoptosis signalling in glaucomatous retinopathy / W. G. Tatton, R. M. Chalmers-Redman, N. A. Tatton // Eur. J. Ophthalmol. — 2001. — Vol. 11. — P. 12–22. 157 С. Ю. Анисимова, С. И. Анисимов, И. В. Рогачева Результаты хирургического лечения различных клинических форм глаукомы с использованием биологического коллагена ООО «Глазной центр „Восток-Прозрение“», г. Москва В основе патогенеза открытоугольной глаукомы лежит целый каскад патологических изменений в глазу. Нарушение гидроциркуляции внутриглазной жидкости в переднем отрезке глаза вызывает повышение гидростатического давления в глазном яблоке с последующими нарушениями в структурах заднего отрезка глаза, приводящими, в конечном счете, к атрофии зрительного нерва [1, 2, 3]. Если исходить из того, что на оболочки глаза действуют силы, которые описываются уравнением Лапласа, то становится ясным, что при повышении внутриглазного давления в области диска зрительного нерва (ДЗН) нарастают растягивающие напряжения, уплощающие диск и снижающие его резистентность к давлению жидкости со стороны ядра глаза. Это приводит к развитию глубоких и обширных экскаваций [4]. Не вызывает сомнения актуальность разработки способов хирургического лечения глаукомы, позволяющих не только снижать внутриглазное давление (ВГД) до толерантного уровня, но и проводить коррекцию патологических процессов в заднем полюсе глазного яблока [2, 3]. Поэтому для хирургического лечения глаукомы мы используем биологический материал Ксенопласт, который представляет собой высокоочищенный костный коллаген I типа животного происхождения, насыщенный сульфатированными гликозоаминогликанами (сГАГ). Материал Ксенопласт, являясь «тканеспецифическим», проводит коррекцию патофизиологических процессов в склеральной ткани, что способствует сохранению её структуры, трофики и биомеханических свойств. Сульфатированные гликозаминогликаны обладают слабым противовоспалительным, гемостатическим действием, повышают биологическую совместимость имплантируемого материала [2]. Цель — провести анализ отдаленных результатов хирургического лечения различных клинических форм глаукомы с использованием биологических имплантатов на основе костного коллагена Ксенопласт при антиглаукоматозной операции и периневральной склеропластике. Материал и методы. Материал Ксенопласт для периневральной склеропластики (Сертификат соответствия № РОСС RU. ИМ24. В00881 от 09.11.07) изготовлен из чистого костного коллагена типа I животного происхождения (ксеноткань). Пористая структура материала обеспечивает надежный контакт склеры и имплантируемого коллагена, что улучшает биомеханические характеристики и трофику склеры в заднем полюсе глазного яблока. В отдаленном послеоперационном периоде этот процесс закрепляется в результате интеграции склеры и имплантируемого коллагена. Дренаж коллагеновый антиглаукоматозный ДКА Ксенопласт (Сертификат соответствия № РОСС RU. ИМ02. В15777 от 04.08.08) изготовлен из высокоочищенного костного коллагена типа I животного происхождения (ксеноткань) и дополнительно насыщен сГАГ — хондроитин-сульфатом. Данным материалом осуществляется пластика анатомически измененного участка трабекулы, так как гистологическая структура костного коллагена может имитировать строение трабекуллярного аппарата глаза человека. Проведен анализ результатов хирургического лечения глаукомы у 124 больных (132 глаза) с далекозашедшей стадией заболевания, которым выполнена операция — непроникающая глубокая склерлимбэктомия (НГСЭ) + ДКА Ксенопласт + периневральная склеропластика материалом Ксенопласт (1 группа). У 45 больных (47 глаз) с далекозашедшей стадией заболевания (2 группа) выполнена операция периневральной склеропластики материалом Ксенопласт на фоне нормализованного офтальмотонуса. Контрольная группа (3 группа) 20 больных ─ 25 глаз с начальной стадией заболевания, которым выполнена НГСЭ+ДКА Ксенопласт без периневральной склеропластики материалом Ксенопласт. Наблюдение больных в динамике осуществляли в течение 2 лет после операции. Оценивали степень послеоперационной реакции глаза, 158 уровень роговично-компенсированного (РК) ВГД, необходимость назначения дополнительного хирургического и медикаментозного лечения, формирование фильтрационной подушечки. Проводили визометрию, компьютерную периметрию, А и В-эхобиометрию. Офтальмотонус оценивали по данным пневмотонометрии с динамической двунаправленной аппланацией роговицы на приборе Ocular Response Analyzer (ORA). До операции в 1 и 3 группах ВГД РК по данным прибора ORA составило 25,2±8,37 мм рт. ст. на максимальном медикаментозном режиме, фактор резистентности роговицы (ФРР) составил 8,9±3,3, а корнеальный гистерезис (КГ) — 6,3±2,5. У пациентов 2 группы до операции ВГД РК по данным прибора ORA составило 15,5±1,4 мм рт. ст. на 1±0,5 медикаментозном препарате, ФРР составил 7,3±1,2, а КГ — 7,3±1,2. Морфометрические параметры диска зрительного нерва и толщину слоя нервных волокон сетчатки определяли по данным оптической когерентной томографии (ОКТ). Результаты и обсуждение. У пациентов опытной и контрольной групп интраоперационных осложнений не было. Степень послеоперационной реакции глазного яблока 0-I. При ультразвуковом исследовании (В-скан) определялся контур материала Ксенопласт в заднем полюсе глазного яблока у пациентов опытной группы, т. е. после периневральной склеропластики толщина склеры в заднем полюсе глазного яблока становится больше. Согласно уравнению Лапласа, чем больше толщина оболочек глаза, тем меньше силы напряжения, которые действуют на них и способствуют развитию глаукомной экскавации диска зрительного нерва. Уровень ВГД РК через 2 года после операции у пациентов 1 группы составил 16,2±2,6 мм рт. ст. на 1±0,5 медикаментозном препарате, ФРР — 8,6±1,8, а КГ — 8,6±1,6. У пациентов 2 группы через 2 года после операции ВГД РК по данным прибора ORA составило 15,8±1,5 мм рт. ст. на 1±0,5 медикаментозном препарате, ФРР составил 9,2±1,4, а КГ — 9,3±1,32. У пациентов контрольной группы через 2 года после операции ВГД РК по данным прибора ORA составило 18,4±1,5 мм рт. ст. на 1±0,5 медикаментозном препарате, ФРР составил 8,5±1,5, а КГ — 8,2±1,4. Фильтрационные подушечки были разлитые плоские, с хорошим сосудистым рисунком. По данным ОКТ отмечена положительная динамика изменения морфометрических параметров диска зрительного нерва. Экскавация ДЗН уменьшилась у пациентов 1 и 2 групп с 0,73±0,12 до 0,67±0,15 через год после операции и вернулась к исходному уровню через 2 года. Объем экскавации ДЗН уменьшился с 0,61±0,12 до 0,51±0,14 через год после операции и через 2 года составил 0,59±0,13. Полученные результаты ОКТ показали увеличение толщины слоя нервных волокон сетчатки после операции у пациентов 1 и 2 групп в носовом квадранте с 43,1±2,5 мкм до 49,1±2,7 мкм через год после операции и 49,7±1,8 мкм через 2 года. В нижнем квадранте с 48,9±2,1 мкм до 51,5±2,7 мкм через год после операции и до 51,7±1,9 мкм через 2 года. Выводы: 1. Периневральная склеропластика в комбинации с нормализацией внутриглазного давления позволяет добиться стабилизации величины экскавации, толщины нервных волокон в перипапиллярной области. 2. Антиглаукоматозные операции с использованием биологического материала на основе костного коллагена Ксенопласт позволяют получить длительный гипотензивный эффект и сократить количество операционных и послеоперационных осложнений. Литература 1. Аветисов, С. Э. Исследование биомеханических свойств роговицы с помощью двунаправленной аппланации: новые подходы к трактовке результатов / С. Э. Аветисов, И. А. Новиков, И. А. Бубнова [и др.] // Вестн. офтальмол. — 2008. — № 5. — С. 22–24. 2. Анисимов, С. И. Патофизиологические аспекты использования нового биологического материала Ксенопласт в хирургическом лечении глаукомы / С. И. Анисимов, С. Ю. Анисимова, Г. А. Дроздова [и др.] // Глаукома. — 2008. — № 2. — С. 40–45. 3. Иомдина, Е. Н. Механические свойства тканей глаза человека / Е. Н. Иомдина // Современные проблемы биомеханики. — 2006. — № 11. — С. 183–200. 4. Светлова, О. В. Физиологическая роль ригидности склеры в формировании уровня внутриглазного давления в норме и при глаукоме / О. В. Светлова, Л. О. Балашевич, М. В. Засеева [и др.] // Глаукома. — № 1. — 2010. — С. 26–40. 159 А. Э. Бабушкин К ВОПРОСУ О ЦИЛИОХОРИОИДАЛЬНОЙ ОТСЛОЙКЕ ПОСЛЕ ФИСТУЛИЗИРУЮЩИХ ОПЕРАЦИЙ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Цилиохориоидальная отслойка (ЦХО) является нередким осложнением антиглаукоматозных фистулизирующих операций. Несмотря на большое количество различных консервативных методов лечения и профилактики ЦХО, приоритет, по прежнему, в значительной степени отдается хирургическим вмешательствам (задней склеро- или эктомии). Причем повторного вмешательства иногда тоже может быть недостаточно. Цель — исследование частоты, факторов риска и эффективности лечения ЦХО после фистулизирующих операций. Материал и методы. Проведен ретроспективный анализ историй болезней 125 больных (143 глаза) первичной открытоугольной глаукомой (в т. ч. у 36 больных — с послеоперационной ЦХО), которым во II хирургическом отделении института в 1996–1997 гг. были проведены 143 фистулизирующие операции (глубокая склерэктомия или трабекулэктомия). Результаты и обсуждение. Как уже упоминалось выше, после 143 выполненных операций, ЦХО имела место на 36 глазах 36 больных, что составило 25,2 %. При этом, после 15 операций, выполненных в I стадии ЦХО была диагностирована в 2 глазах (13,3 %), 54 операций во II стадии — в 12 (22,2 %), 60 операций в III стадии — в 17 (28,3 %) и 14 операций в IV стадии — в 5 (35,7 %). Данное осложнение отмечалось у пациентов в возрасте 59–86 лет (в среднем — 68,2±7,5) и в 80,5 % случаев (29 человек) наблюдалось у лиц старше 60 лет, причем несколько чаще у женщин (55,6 % или 20 человек), чем у мужчин (44,4 % или 16 человек). В подавляющем большинстве случаев (22 из 36 или в 61,1 %) ЦХО имела место на глазах в запущенных стадиях ПОУГ (с далекозашедшей — в 17 из 36 или в 47,2 % глаз и терминальной — 5 из 36 или в 13,9 %). В развитой и начальной стадиях ПОУГ отслойка сосудистой оболочки отмечалась соответственно лишь в 27,8 % (10) и 5,6 % (2) случаев. Высокое ВГД до операции (77,8 %, 28 глаз) отмечалось в 3,5 раза чаще, чем умеренно повышенное (22,2 %, 8 глаз). У больных без ЦХО данный показатель составил 1,9 (соответственно 72,0 % или в 77 глазах и 38,0 % или 30 глаз). Большинство больных с ЦХО (32 глаза, 88,9 %) имело по заключению терапевта те или иные сопутствующие общие заболевания (преимущественно сердечно-сосудистой системы). В группе больных (89) без ЦХО сопутствующие заболевания были выявлены у 56 пациентов (62,9 %). В большинстве случаев (22 глаза или 61,1 %) отслоение сосудистой оболочки имело двусторонний характер (односторонняя ЦХО была диагностирована в 38,9 % или на 14 глазах). Высокая отслойка имела место в 15 глазах (41,6 %), средневысокая — в 11 (30,6 %) и плоская — в 10 (27,8 %). Избыточная фильтрация под конъюнктиву была отмечена на 20 глазах (55,6 %), наружная фильтрация (потребовавшая наложения дополнительных конъюнктивальных швов) — на 2 (5,6 %). В остальных 14 глазах имела место оптимальная — умеренно выраженная и развитая фильтрация под конъюнктиву. Подавляющее число данного осложнения встречалось в первые 4 суток после операций — 28 (77,8 %). На 5–12 сутки пришлось 5 случаев (13,9 %) ЦХО. Поздняя отслойка сосудистой оболочки, диагностированная через 14 дней — 2 месяца после фистулизирующих операций, наблюдалась в 3 случаях (8,3 %). Выраженная гипотония была выявлена в 30 глазах (83,3 %), нормальное ВГД — в 5 (13,9 %), гипертензия (у больной с гемморрагической ЦХО) — в 1 глазу (2,8 %). Явления ирита отмечались в 20 глазах (55,6 %), гифема, возникшая на фоне уменьшения глубины передней камеры — в 19 (52,8 %). Мелкая передняя камера имела место в 27 случаях (75,0 %), щелевидная (или ее отсутствие) — в 2 (5,6 %). Нормальная глубина передней камеры на глазах с ЦХО была зафиксирована только в 7 случаях (19,4 %). В 19 случаях (52,8 %) лечение больных с ЦХО было консервативным. Больные в послеоперационном периоде получали инстилляции и субконъюнктивальные инъекции кортикостероидов (дексазон), мидриатиков (в основном, мезатон, реже — атропин) и кофеина на новокаиновой подушке. Нередко использовались (в конъюнктивальную полость) фитильки с 1 % мезатоном (2 раза в день). Применялись также внутримышечные инъекции нестероидных 160 противовоспалительных препаратов и внутривенные инфузии кортикостероидов. В случае избыточной фильтрации использовалась давящая повязка. Консервативная терапия привела к исчезновению ЦХО через 4 и более суток в 11 (57,9 %) из 19 глаз, в остальных случаях отслойка прилегла в первые трое суток. При отсутствии эффекта от консервативного лечения в течение 2–3 дней, проводилось хирургическое лечение ЦХО. Дополнительное хирургическое вмешательство (склерэктомия, крестообразная склеротомия, склерциклостомия) с целью эвакуации субхориоидальной жидкости потребовалось в 17 случаях (47,2 %), причем в 14 (82,4 %) из них отслойка прилегла в течение первых 2–3 суток и лишь в 1 случае — на 5 день. В 2 глазах (11,8 %) по причине рецидива ЦХО дополнительное хирургическое вмешательство было выполнено дважды. При щелевидной передней камере или ее отсутствии, а также неэффективности консервативных мероприятий, выпускание субхориоидальной жидкости в 2 случаях производилось в течение первых суток после обнаружения отслойки. В одном случае при незначительной положительной динамике на фоне консервативных мероприятий, выпускание субхориоидальной жидкости было выполнено только на 3 сутки после диагностирования ЦХО, что в дальнейшем (уже через 2 суток) привело к набуханию частично мутного хрусталика и необходимости экстракапсулярной экстракции катаракты. Ухудшение остроты зрения при возникновении отслойки было отмечено в 63,9 % случаях (23 из 36 глаз), однако при выписке (после прилегания отслойки и купирования воспалительной реакции) этот показатель значительно снизился — до 19,4 % (7 глаз), а в группе без ЦХО он составил — 7,5 % (8 из 107 глаз). Непосредственные гипотензивные результаты в глазах с ЦХО (36 глаз) и без данного осложнения (107 глаз) не отличались, гипотензивный эффект был достигнут в 100 % случаев в обеих группах. Однако средний уровень офтальмотонуса в глазах с перенесенной ЦХО при выписке оказался все же ниже (11,9±2,0 мм рт. ст.), чем в группе без отслойки (13,5±1,6 мм рт. ст.). Средний койко-день у больных с ЦХО оказался 12,3±2,1, у пациентов без данного осложнения — 8,1±1,2. Вывод. ЦХО после фистулизирующих операций возникает наиболее часто у больных старше 60 лет, с запущенными (III-IV) стадиями ПОУГ, высоким уровнем ВГД до хирургического вмешательства и сопутствующими сердечно-сосудистыми заболеваниями. Исследования позволили констатировать недостаточную эффективность применяемой консервативной терапии (52,8 %) и частую необходимость использования дополнительного хирургического вмешательства (47,2 %), к которому в 11,8 % случаев пришлось прибегнуть дважды. Это определяет необходимость разработки эффективных методов профилактики и лечения ЦХО. А. Э. Бабушкин, Е. И. Гумерова 1, О. И. Оренбуркина, Х. Г. Файзуллина, Э. К. Рыскулова Первый опыт применения дуотрава в лечении первичной открытоугольной глаукомы ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа, 1 городская поликлиника № 52, г. Уфа Снижение внутриглазного давления (ВГД) является основным направлением в лечении глаукомы. В последние годы становится все более популярной группа препаратов — аналогов простагландинов (глазные капли — Ксалатан, Траватан). В частности, Траватан (Алкон, США) является сильным агонистом FP-рецепторов в цилиарной мышце и трабекулярной сети, снижая офтальмотонус у больных первичной открытоугольной глаукомой (ПОУГ) путем усиления оттока внутриглазной жидкости (преимущественно увеосклерального). Однако, при монотерапии Траватаном далеко не всегда удается достигнуть необходимого снижения офтальмотонуса. Чтобы поддержать адекватный уровень ВГД, в таких случаях приходится использовать несколько гипотензивных препаратов из разных фармакологических групп или применять фиксированные комбинации (2 в 1), которые, как правило, обладают более высоким гипотензивным и низкими побочными эффектами, удобным режимом применения (меньшая кратность закапываний), в сравне- 161 нии с использованием каждого из составляющих их в отдельности, меньшими экономическими затратами на лечение со стороны пациента, что в целом увеличивает шансы на регулярное выполнение рекомендованного режима лечения. По мнению многих офтальмологов, наиболее востребованной является фиксированная комбинация неселективного β-адреноблокатора (0,5 % Тимолола) с одним из препаратов простагландинового ряда — Латанопростом, Травопростом или Биматопростом (Ксалаком — Пфайзер, США, Дуотрав — Алкон, США и Ганфорт — Аллерган, США). Дуотрав — один из самых современных комбинированных препаратов, применяемых для лечения первичной открытоугольной глаукомы и глазной гипертензии. Зарубежные клинические исследования, показали, что Дуотрав по своей гипотензивной эффективности превосходит основные медикаментозные средства, применяемые для лечения ПОУГ, снижая ВГД до 38 % от исходного [1, 2, 3]. Дуотрав эффективен даже в тех случаях, когда другая гипотензивная терапия (Латанопрост, Тимолол, комбинированная терапия) не дает достаточного снижения внутриглазного давления. При переводе пациентов на Дуотрав удается добиться дополнительного снижения ВГД независимо от первоначальной терапии [4, 5]. В сравнительных исследованиях Дуотрав показал более выраженную гипотензивную активность, чем Ксалаком [3, 6]. Цель — изучение гипотензивной эффективности новой фиксированной комбинации — Дуотрава в лечении больных ПОУГ. Материал и методы. Исследования проведены у 6 больных (7 глаз) ПОУГ в возрасте 54–83 лет (в среднем 65,8 лет). Мужчин было 4, женщин — 2. Начальная стадия ПОУГ диагностирована в 2 глазах, развитая — в 5, далекозашедшая (ранее оперированная) — в 1 глазу. С гипотензивной целью все больные до назначения Дуотрава получали местно различные препараты (Тимолол и его аналоги, Бетоптик, Траватан, Ксалатан, Косопт, Ксалаком). До начала исследования все ранее применявшиеся гипотензивные препараты отменялись на 1–2 дня, после чего пациентам назначалась комбинированная терапия Дуотравом 1 раз в день. Наблюдение за пациентами в динамике проводилось в течение 2–4 месяцев. Результаты и обсуждение. Исследования показали, что через 2–4 месяца у всех пациентов на фоне использования Дуотрава было отмечено понижение ВГД в среднем до уровня в 17,7 мм рт. ст. или на 9,7 мм рт. ст. (35,4 %) от исходного (27,4±2,5 мм рт. ст.). Степень понижения ВГД варьировала от 5 до 14 мм рт. ст., в т. ч. после ранее использованной комбинированной терапии (Косопт, Ксалаком) — от 5 до 8 мм рт. ст. При использовании Дуотрава уровень офтальмотонуса, измеренный пневмотонометром, ниже 18 мм рт. ст. был отмечен в 4 (57,1 %) из 7 глаз. Электротонографические исследования показали, что снижение ВГД было достигнуто преимущественно вследствие улучшения оттока, а также (в меньшей степени) уменьшения продукции внутриглазной жидкости. Переносимость препарата пациентами была достаточно хорошей, ни в одном случае Дуотрав не был отменен из-за местных (преходящие жжение, дискомфорт, конъюнктивальная гиперемия, в основном, слабой степени) или системных (не наблюдались) побочных эффектов. Опрос пациентов показал регулярность применения препарата на всем протяжении исследования. Вывод. Предварительные исследования показали высокую гипотензивную эффективность Дуотрава, удобство в применении, хорошую переносимость и приверженность пациентов к лечению. При переводе больных на Дуотрав с применяемой ранее гипотензивной терапии (в т. ч. комбинированной) удалось добиться снижения ВГД в среднем на 9,7 мм рт. ст. (35,4 %). Литература 1. Barnebey, H. S. The safety and efficacy of travoprost 0.004 %/timolol 0.5 % ophthalmic solution / H. S. Barnebey, S. Orengo-Nania, B. E. Flowers [et al.] // Amer. J. Opthalmol. — 2005. — Vol. 140. — P. 1–7. 2. Schuman, J. S. Efficacy and safety of fixed combination travoprost 0.004 %/timolol 0.5 % ophthalmic solution once daily for open-angle glaucoma or ocular hypertension / J. S. Schuman, G. J. Katz, R. A. Lewis [et al.] // Am. J. Ophthalmol. — 2005. — Vol. 140. — P. 242–250. 3. Topouzis, F. A one-year study to compare the efficacy and safety of once-daily travoprost 0.004 %/timolol 0.5 % to once-daily latanoprost 0.005 %/timolol 0.5 % in patients with open-angle glaucoma or ocular hypertension / F. Topouzis, S. Melamed, H. Danesh-Meyer [et al.] // Eur. J. Ophthalmol. — 2007. — Vol. 17. — P. 183–190. 162 4. Pfieffer, N. Safety and efficacy of changing to travoprost/timolol maleate fixed combination (DuoTrav®) from prior mono-or adjunct therapy in Germany / N. Pfieffer, M. L. Scherzer, H. Maier [et al.] // Poster presented, 2009. 5. Arend, К. О. Observational study results in glaucoma patients undergoing a regimen replacement to fixed combination travoprost 0.004 % / timolol 0.5 % in Germany / К. О. Arend, T. Raber // J. Oc. Pharm. and Ifter. — 2008. — Vol. 24. — № 4. — P. 414–420. 6. Konstas, A. G. P. 24-hour intraocular pressure control with evening dosed travoprost/timolol, compared with latanoprost/ timolol, fixed combinations in exfoliative glaucoma / A. G. P. Konstas, D. G. Mikropoulos, T. Embeslidis [et al.] // Poster presented. — 2009. А. Э. Бабушкин, Л. Х. Мурова, О. И. Оренбуркина, Е. Н. Матюхина К вопросу о выявляемости, лечении и инвалидности от глаукомы в Республике Башкортостан за 2010 год ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Актуальность и социальная значимость глаукомы определяется тем, что она занимает одно из ведущих мест в структуре инвалидности и неустранимой слепоты. Учитывая социальную значимость, принципиально важными и требующими своего разрешения являются вопросы организации раннего выявления, рационального лечения и диспансерного наблюдения за больными глаукомой. По данным республиканского годового отчета за 2010 год, на диспансерном учете с диагнозом глаукома в Республике Башкортостан состоит всего 24 536 человек, из них хирургическое лечение было осуществлено 6 860 (27,9 %) больным. С первичной глаукомой на учете состоит 22 645 человек (92,3 %), в т. ч. мужчин — 43,9 % (9 943), женщин — 56,1 % (12 702). По возрасту больные, состоящие на диспансерном наблюдении по поводу глаукомы, распределились следующим образом: старше 60 лет — 76,8 % (18 839), 35–60 лет — 22,5 % (5 515) и лица моложе 35 лет — 0,7 % (182) (рис. 1). С начальной стадией зафиксировано 33,6 % пациентов (7 615), с развитой — 32,0 % (7 254), с далекозашедшей — 21,3 % (4 815) и с терминальной — 13,1 % (2 961) (рис.2). Удельный вес первичной открытоугольной глаукомы (ПОУГ) составил 81,8 % (18 524), закрытоугольной — 12,3 % (2785), смешанной — 5,9 % (1336). Слепых на оба глаза среди диспансерных больных глаукомой — 1327 человек, на один глаз — 2919, т. е. в целом, 4246 человек (17,3 %) от общего числа пациентов, состоящих на учете. При этом, впервые признанных инвалидами вследствие глаукомы за 2010 год было 329 человек. Количество пациентов, находящихся на инвалидности по поводу глаукомы, составило 3919 человек, в том числе инвалидов I группы — 1149 (31,8 %), II группы — 1297 (35,8 %) и III группы — 1173 (32,4 %). Рис. 1 Распределение больных глаукомой по возрасту 163 Рис. 2. Распределение больных по стадиям глаукомы С целью раннего выявления глаукомы в 2010 году обследовано 590 866 человек (86,0 %) из 687 220, подлежащих осмотру. С подозрением на глаукому выявлено 6 304 человек (1,1 %). Впервые установлен диагноз данного заболевания у 2 939 человек (0,5 %), при этом начальная стадия болезни была диагностирована в 37,3 % (1 097), развитая — 43,0 % (1265), далекозашедшая — 13,2 % (388) и терминальная в 6,5 % (189) случаев. Удельный вес открытоугольной глаукомы составил 82,6 %, закрытоугольной — 11,9 %, смешанной — 5,5 %. Таким образом, в целом, лиц с подозрением на глаукому и с впервые уже установленным диагнозом этого заболевания было всего 9243 человек, что составило 1,6 % от фактически осмотренных лиц в данном году. Стационарное лечение по республике в 2010 году получили всего 4797 человек (19,6 % от всех больных, состоящих на учете), из них по месту жительства — 3112 (64,9 %), в Уфимском НИИ глазных болезней — 1685 (35,1 %). Хирургическое лечение по месту жительства получили 23,6 % пациентов (735), консервативное — 76,4 % (2 377). В консультативнодиагностической поликлинике Уфимского НИИ глазных болезней по поводу глаукомы, было проконсультированно всего 4543 человек (18,5 % из общего числа, состоящих на учете), из них госпитализированно 1 685 (37,1 %), при этом 57,7 % (973) пациентов получили в стационаре института хирургическое лечение, 19,5 % (328) — консервативное и 22,8 % (384) — лазерное лечение. Следует отметить, что 86,0 % (837) больных, получивших хирургическое лечение в стационаре института, были оперированы впервые, а 14,0 % (136) — повторно. Выводы: 1. По данным за 2010 год на диспансерном учете по поводу глаукомы состоит всего 24 536 человек, при этом большинство больных (80 %) находятся в возрасте старше 60 лет и имеют начальную и развитую стадии заболевания (65,6 %). 2. Хирургическим лечением охвачено 27,9 % больных. Число слепых глаукомой (на один и оба глаза) составляет 17,3 %, от общего числа пациентов, состоящих на учете. Большинство (67,6 %) пациентов, находящихся на инвалидности по поводу глаукомы, имеют I и II группы. 3. Наибольший удельный вес (81,8 %) среди пациентов с первичной глаукомой составляют больные с открытоугольной формой заболевания. 4. С целью раннего выявления заболевания в РБ обследовано около 600 тыс. человек (86,0 % от подлежащих осмотру), с подозрением на глаукому было зафиксировано 1,1 %, с впервые установленным диагнозом — 0,5 %. Все еще высок процент больных (19,7 %), выявленных в продвинутых стадиях заболевания, когда значительно утрачены зрительные функции. 5. Стационарное лечение, в целом по республике, получили 19,6 % больных глаукомой. В консультативно-диагностической поликлинике Уфимского НИИ глазных болезней проконсультировано 18,5 % больных глаукомой, от общего числа, состоящих на учете. При этом, 37,1 % пациентов получили стационарное лечение в институте, из них 57,7 % — хирургическое (повторно оперированы — 14,0 %), 19,5 % — консервативное и 22,8 % — лазерное. 164 А. Э. Бабушкин, О. И. Оренбуркина, Е. Н. Матюхина, Н. Г. Саяпов 1, Ф. З. Имангулов 1, А. З. Калентьева Первичная инвалидность вследствие глаукомы в Республике Башкортостан за 2009 год ГУ «Уфимский НИИ глазных болезней» АН РБ, 1 Главное бюро медико-социальной экспертизы, г. Уфа Медико-социальное значение глаукомы определяется ее ведущим значением в формировании неизлечимой слепоты. Статистический анализ первичной инвалидности позволяет объективно оценить качество лечебно-профилактических мероприятий по охране здоровья населения, а также определить первоочередные задачи органов здравоохранения и социального обеспечения по предупреждению и снижению заболеваемости глазными болезнями и, в частности, глаукомой. Ранее проведенные нами исследования показали, что, начиная с 2001 года, глаукома в Республике Башкортостан (РБ) занимает I ранговое место по первичной инвалидности среди различной офтальмопатологии [3]. Проведенный анализ по глаукоме в республике за 2002–2007 гг. свидетельствует об утяжелении групп инвалидности и ежегодном росте первичного выхода на нее [1, 2]. Цель — изучение первичной инвалидности вследствие глаукомы в РБ за 2009 год. Материал и методы. Материалом исследования для изучения динамики первичной инвалидности по глаукоме послужили данные Главного бюро медикосоциальной экспертизы РБ. Всего за анализируемый год впервые был освидетельствован 351 больной глаукомой. Результаты и обсуждение. Анализ показал, что в 2009 г. первично освидетельствованных инвалидов по зрению в РБ всего было 1001 человек. В нозологической структуре первичной инвалидности (табл. 1) глаукома в 2009 г. занимала I место — 35,0 %, опережая заболевания сетчатки и зрительного нерва (25,0 %), миопию (16,7 %), травмы глаз и их последствия (14,2 %). Подавляющее число лиц среди первично освидетельствованных инвалидов вследствие глаукомы составили больные первичной открытоугольной глаукомой (ПОУГ) — 84 % (275 человек). Закрытоугольная форма заболевания в 2009 году была отмечена в 9,7 % (34), на другие формы глаукомы пришлось соответственно 6,3 % (22). Таблица 1 Нозологическая структура впервые освидетельствованных инвалидов по зрению в 2009 году Нозологическая структура 2009 (n=1001) Ранпервичной инвалидности говое абс % по офтальмопатологии место Глаукома 351 35,0 I Заболевания сетчатки и зри250 25,0 II тельного нерва Дегенеративная миопия 167 16,7 III Травмы глаз и их последствия 142 14,2 IV Катаракта 43 4,3 V Заболевания роговицы 23 2,3 VI Увеиты 12 1,2 VII Прочие 13 1,3 VIII Анализ сведений об инвалидах с ПОУГ по полу и возрасту показал, что, в основном, в их числе преобладали мужчины. Так, лиц мужского пола, впервые признанных инвалидами вследствие ПОУГ в 2009 году, было 57,6 % (170 человек), а женщин — 42,4 % (125). При этом, большинство инвалидов были в возрасте старше 55 лет у женщин и 60 лет — у мужчин. Так, в 2009 году их было 88,5 % (261 человек). Среди лиц в возрасте 50–60 лет этот показатель составил 8,8 % (26), а в возрасте до 49 лет — 2,7 % (8 человек). Пенсионеров среди первично освидетельствованных инвалидов ПОУГ в 2009 году было 84,1 % (248 человек), удельный вес работающих — 8,8 % (26), а не работающих — 7,1 % (21). Исследования показали, что подавляющее большинство (90,9 %) инвалидов вследствие ПОУГ имели начальное (55,6 % или 164 человека) или среднеспециальное образование (35,3 % или 104 человека). Высшее образование имели лишь 27 человек (9,1 %) из всех впервые освидетельствованных инвалидов. В 2009 году число инвалидов из городов (145 человек) и районов (150) республики было практически одинаковым: 49,2 % и 50,8 % соответственно. Из представленной ниже таблицы 2 видно, что большинство первично освидетельствованных пациентов с ПОУГ (в 2009 г. — 63,4 %) это наиболее тяжелый контингент — инвалиды I и II групп. 165 Таким образом, в настоящее время большинство впервые освидетельствованных инвалидов с глаукомой в РБ — это преимущественно мужчины с первичной открытоугольной формой заболевания, подавляющее большинство из которых пенсионеры, имеющие I или II группу инвалидности, начальное или средне-специальное образование. Выводы. Анализ первичной инвалидности вследствие заболеваний глаз в Республике Башкортостан за 2009 год показал ведущую роль глаукомы в нозологической структуре различной офтальмопатологии — 35,0 %. При этом, у значительной части пациентов (в 84,0 %) причиной инвалидно- сти явилась первичная открытоугольная форма заболевания. Подавляющее большинство пациентов ПОУГ имели начальное или средне-специальное образование (90,9 %) и при освидетельствовании впервые были признаны инвалидами I или II групп (63,4 %). В качестве одной из задач по реализации мер, направленных на эффективную борьбу с глаукомой, является принятие соответствующих регламентирующих документов на региональном уровне (приказа), а также создание Всероссийского центра и разработка целевой федеральной программы по минимизации слепоты и слабовидения вследствие данного заболевания в РФ. Таблица 2 Распределение впервые освидетельствованных пациентов ПОУГ по группам инвалидности Годы 2009 Число первично освидетельствованных инвалидов ПОУГ 295 I группа абс. % 80 27,1 II группа абс. % 107 36,3 III группа абс. % 108 36,6 Литература 1. Калентьева, А. З. Клинические проявления и диагностика первичной открытоугольной глаукомы с учетом наследственной предрасположенности в Республике Башкортостан: автореф… канд. мед. наук / А. З. Калентьева. — Самара, 2009. — 22 с. 2. Суркова, В. К. Инвалидность вследствие глаукомы в Республике Башкортостан / В. К. Суркова, А. З. Сафина, Н. Г. Саяпов, Л. К. Булатова // Глаукома. — 2007. — № 2. — C. 54–56. 3. Ширяев, В. Е. Анализ работы по выявлению, лечению и инвалидности от глаукомы в Республике Башкортостан / В. Е. Ширяев, А. Э. Бабушкин, Э. Г. Кудоярова [и др.] // Воспалительные заболевания органа зрения (диагностика, клиника и лечение). — Уфа, 2002. — С. 264–268. А. Э. Бабушкин, О. И. Оренбуркина, А. Л. Рахматуллин, О. В. Чайка, Е. Н. Матюхина К ВОПРОСУ О ЛЕЧЕНИИ НЕОВАСКУЛЯРНОЙ ГЛАУКОМЫ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Хирургическое лечение рефрактерной глаукомы представляет собой трудную и, вместе с тем, актуальную проблему практической офтальмологии. Неоваскулярная глаукома (НВГ) — одна из тяжелых форм рефрактерной глаукомы. Известно, что в патогенезе НВГ основное значение принадлежит гипоксии сетчатки, вызывающей выработку вазопролиферативных факторов, развитие неоваскуляризации радужки и угла передней камеры (УПК) с последующим формированием фиброваскулярной мембраны, что приводит к прогрессивному повышению внутриглазного давления (ВГД). Наиболее частыми причинами НВГ являются диабетическая ретинопатия, окклюзирующие процессы в сосудах сетчатки, увеиты и финальные стадии открытоугольной глаукомы. Методом выбора при лечении НВГ считают хирургические вмешательства, в т. ч. циклодеструктивные. Цель — изучить эффективность традиционных фистулизирующих операций и циклокриопексии в лечении неоваскулярной глаукомы. Материал и методы. 27 больным (27 глаз) была выполнена изолированная криоцикло (ретино) пексия. Мужчин было 11, женщин — 16. Далекозашедшая стадия НВГ имела место у 8 пациентов (29,6 %), терминальная — у 19 (70,4 %), в т. ч. с болевым син- 166 дромом — у 10. Причинами, приведшими к развитию НВГ, явились: сахарный диабет (17 пациентов), тромбоз ЦВС и ее ветвей (5), терминальная стадия первичной глаукомы (3), увеит (1), травма (1). I стадия неоваскуляризации радужки отмечена у 1 больного (3,7 %), II — у 16 (59,3 %), III — у 10 (37,0 %). 19 пациентам (19 глаз) была проведена фистулизирующая операция (глубокая склерэктомия или трабекулэктомия). С далекозашедшей стадией НВГ было 12 больных, с терминальной — 7 (в т. ч. 2 — с болевым синдромом). ВГД на максимальном медикаментозном режиме составило в среднем 34,8±5,2 мм рт. ст. Причинами развития НВГ явились: сахарный диабет — 11 больных, тромбоз центральной вены сетчатки или ее ветвей — 4, терминальная стадия ПОУГ у больных с сопутствующей сосудистой патологией — 4. Ранее 6 человек (31,6 %) были прооперированы. Следует отметить, что в большинстве случаев (68,4 %) наблюдалась умеренно выраженная неоваскуляризация радужки. Результаты и обсуждение. В раннем послеоперационном периоде после криоцикло (ретино) пексии гипертензия отмечена в 20 глазах (74,1 %), экссудативная реакция — в 16 (59,3 %). Гипотензивный эффект был достигнут у 26 (96,3 %) из 27 больных, причем в одном случае ВГД удалось нормализовать с помощью местных гипотензивных препаратов. У 1 больного даже на фоне дополнительной медикаментозной терапии офтальмотонус, в случае с терминальной глаукомой, остался умеренно повышенным (26 мм рт. ст.). Болевой синдром был купирован у всех больных. В отдаленные сроки (от 6 месяцев до 2 лет, в среднем 14,1±2,9) удалось проконтролировать 17 больных (17 глаз). Нормализация офтальмотонуса была зафиксирована у 9 (52,9 %) пациентов, из них только у 5 (29,4 %) гипотензивный эффект оказался стойким. В остальных 4 случаях (23,5 %) для нормализации ВГД больные вынуждены были применять дополнительную местную гипотензивную терапию. Острота зрения ухудшилась у 3 (50,0 %) из 6 пациентов с далекозашедшей глаукомой. Рецидив болей имел место у 4 больных с терминальной НВГ, причем в 3 случаях пришлось прибегнуть к энуклеации глаза. После фистулизирующих операций непосредственный гипотензивный эффект был отмечен в 100 % случаев, однако в 1 случае (5,3 %) у больного с терминальной болящей глаукомой потребовалось дополнительное назначение местной медикаментозной терапии. Гифема была отмечена у 14 больных (73,7 %), ЦХО — у 6 (31,4 %). Результаты фистулизирующих операций были прослежены в сроки от 7 до 25 месяцев, в среднем — 14,7. В отдаленные сроки нормализация офтальмотонуса была отмечена только у 6 (42,8 %) пациентов, причем половина из них нуждалась в дополнительной гипотензивной терапии. Следует также отметить, что за указанный период наблюдения 4 (в т. ч. 2 пациента с болящей глаукомой) из 8 больных с рецидивом ВГД были повторно прооперированы, причем 2 из них — дважды, а 1 больному с терминальной болящей глаукомой в итоге все же была произведена энуклеация глаза. Стабилизация остаточных зрительных функций (0,01–0,09) отмечена только у 4 (44,4 %) из 9 больных далекозашедшей НВГ. Вывод. Полученные данные свидетельствуют о достаточно низкой эффективности изолированного применения криопексии (52,9 %) и фистулизирующих операций (42,8 %) в лечении неоваскулярной глаукомы и необходимости дальнейшего поиска и разработки вмешательств, в основе которых лежит комбинированный механизм действия, для лечения этой тяжелой патологии. А. Э. Бабушкин, О. И. Оренбуркина, Э. К. Рыскулова, Э. Ф. Файзуллина, Д. К. Абсаликова, М. Р. Файзуллина 1 отдаленные результаты гипотензивной терапии ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ КОМБИНИРОВАННЫМ АНТИГЛАУКОМНЫМ ПРЕПАРАТОМ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа, 1 МСЧ «Газпром Трансгаз Уфа», г. Уфа Для повышения эффективности медикаментоз- был разработан ряд комбинированных препаратов, ного лечения и улучшения качества жизни пациентов содержащих вещества, которые обладают различным 167 механизмом гипотензивного действия и при одновременном применении которых наблюдается аддитивный эффект. Наибольшее распространение получили комбинации, одной из составляющих которых стали бета-адреноблокаторы, в частности, тимолол малеат. Среди указанных комбинаций важное место, в связи с выраженной гипотензивной активностью, занимает сочетание бета-адреноблокатора и ингибитора карбоангидразы, которое было разработано почти 15 лет назад. В настоящее время такая фиксированная комбинация, известная под названием Косопт (тимолола малеат 0,5 % и дорзоламид 2 %, MSD, США), получила регистрацию в России и положительные отзывы многих офтальмологов, занимающихся медикаментозным лечением глаукомы [1,2 и др]. К сожалению, результаты многих исследований, посвященных Косопту, ограничиваются данными о его эффективности в ближайшие сроки применения. Цель — изучить отдаленные результаты терапевтической эффективности препарата Косопт в лечении первичной открытоугольной глаукомы (ПОУГ). Материал и методы. Исследования проведены у 16 больных (16 глаз) ПОУГ (в т. ч. псевдоэксфолиативная форма — у 7 пациентов). Мужчин было 6 (37,5 %), женщин — 10 (62,5 %). Возраст пациентов: 58–78 лет, в среднем — 65,2+6,2 лет. I стадия ПОУГ установлена у 2 больных (12,5 %), II — у 7 (43,75 %) и III — у 7 (43,75 %). Наблюдение за пациентами в динамике проводилось через 6–12 месяцев. Кратность инстилляций — 2 раза в день. До начала терапии 12 больных (75 %) уже получали местно различные препараты, 4 пациента (25 %) с впервые выявленной глаукомой и высоким внутриглазным давлением (ВГД) ранее не лечились. Результаты и обсуждение. Проведенные исследования показали, что если в ближайшие сроки наблюдения (через 2–4 месяца) нормализация офтальмотонуса наблюдалась у всех больных (среднее снижение — 12,1 мм рт. ст. или 38,7 % от исходного уровня, более эффективное у пациентов с впервые выявленной глаукомой и высокими цифрами ВГД, не использовавших ранее каких-либо гипотензивных средств), то через 6–12 месяцев только 12 (75 %) человек на фоне стабилизации процесса (11 пациентов) продолжали лечение Косоптом (снижение ВГД на 10,5 мм рт. ст. или 33,6 % от исходного уровня). Побочное действие препарата в указанные сроки было зафиксировано у 2 пациентов (13 %), местное — у 1 больного и системное — у 1 пациентки (со стороны сердечно-сосудистой системы, появившееся примерно через полгода использования косопта). Вынуждены отказаться от лечения Косоптом были 4 пациента (из них 3 человека с III стадией и 1 — со II стадией заболевания): 3 больных — в связи с повышением ВГД и дестабилизацией процесса и 1 больная — из-за появившихся у нее системных побочных эффектов (в дальнейшем 2 больных были прооперированы и у 2 пациентов ВГД было нормализовано с помощью медикаментозной коррекции). Вывод. Гипотензивная эффективность Косопта у пациентов с первичной открытоугольной глаукомой при отдаленных сроках наблюдения (до года) составила 75 %. По сравнению с ближайшими результатами лечения, эффективность применения его со временем снижается, возможно, в связи с развивающейся у некоторых больных тахифилаксией к тимололу. Литература 1. Егоров, Е. А. Сравнительное исследование эффективности и безопасности применения фиксированной комбинации дорзоламида и тимолола малеата / Е. А. Егоров, Т. Е. Егорова // Клин. офтальмол. — 2008. — № 2. — С. 51–54. 2. Еричев, В. П. Фиксированные лекарственные формы: современный подход к терапии глаукомы / В. П. Еричев, А. Е. Дугина, Ю. В. Мазурова // Глаукома. — 2010. — № 1. — С. 62–65. А. Э. Бабушкин, Н. Е. Шевчук, О. И. Оренбуркина, Е. Н. Матюхина О Влиянии цитокинов на репаративные процессы и исход антиглаукоматозных операций ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Избыточное рубцевание, связанное с повышен- коллагена в зоне вновь созданных путей оттока, явной пролиферацией фибробластов и выработкой ляется главной причиной неудач в хирургическом 168 лечении глаукомы. В патогенезе избыточного рубцевания после антиглаукоматозных операций важная роль отводится иммунным механизмам. К сожалению, в широкой клинической практике при хирургии глаукомы это обстоятельство практически не учитывается. В последние годы повышенный интерес исследователей к системе цитокинов связан с ключевой ролью этих молекул в развитии патологии у человека. Установлено, что при раннем избыточном рубцевании после антиглаукоматозных операций нарастает дисбаланс в продукции TGF-β1 (увеличение местной продукции при усугублении системной) [6] и TGF-β2 [19]. Благоприятные исходы антиглаукоматозных операций ассоциируются с практически неизменным местным и системным содержанием TGF-β1 и увеличением уровня противовоспалительных цитокинов IL-4 и IL-6 [6], а низкая концентрация IFN-γ в слезной жидкости и высокие уровни TNF-α и IL-6 во внутриглазной жидкости до операции являются прогностически неблагоприятными признаками в отношении высокого риска развития избыточного рубцевания после антиглаукоматозной операции [5, 12]. Прогностическими неблагоприятными признаками являются существенное повышение локального уровня TNF-α и антител к денатурированной ДНК в первую неделю после антиглаукоматозной операции [5]. Выяснилось, что у пациентов с первичной открытоугольной глаукомой (ПОУГ) существенную роль в регуляции репаративных процессов играет IL-17, который влияет на уровень раннего послеоперационного рубцевания [3]. Некоторые авторы [2] отмечают повышенное содержание в слезной жидкости больных глаукомой провоспалительных цитокинов (IL-1β, TNF-α), а также фактора роста (TGF-β), что коррелирует с избыточным рубцеванием созданных путей оттока внутриглазной жидкости. Неблагоприятный исход антиглаукоматозных операций с имплантацией клапана Ахмеда у пациентов с неоваскулярной глаукомой ассоциируется со значительным ростом содержания VEGF при незначительных изменениях концентраций TGF-β1 и TGF-β2 во влаге передней камеры в раннем постоперационном периоде [15]. Предшествующее длительное применение местных гипотензивных препаратов провоцирует рост грануляционной ткани, а содержащийся в их составе консервант — бензалкония хлорид, оказывает токсическое действие на клетки конъюнктивы, что предрасполагает к повышенному местному воспалительному ответу на операционную травму [8, 9]. Кроме того, применение антиглаукомных препаратов приводит к значительному увеличению содержания белка − хемоаттрактанта моноцитов в слезной жидкости, что также способствует более быстрому развитию процессов избыточного рубцевания в раннем послеоперационном периоде [11]. Повышенный воспалительный ответ на фоне трофических изменений и активности свободнорадикальных процессов создает предпосылки для повреждения покровных тканей глаза и грубого рубцевания в зоне оперативного вмешательства, являясь одной из главных причин снижения гипотензивного эффекта антиглаукоматозных операций [10, 24]. В настоящее время отмечается рост числа исследований, направленных на снижение активности послеоперационного воспалительнопролиферативного процесса и минимизацию операционной травмы. Так, проведение микроинвазивной операции, по сравнению с традиционной, вызывает достоверно меньшую местную активизацию IL-1β и TGF-β — основных цитокинов, определяющих воспаление тканей глаза после антиглаукомных вмешательств, и стимулирующих процессы избыточного рубцевания [7]. В эксперименте доказано, что ингибитор альфалипоевой кислоты эффективно подавляет избыточное рубцевание после антиглаукомных фильтрирующих операций путем нарушения связывания активированных рецепторов TGF-β со специфическими сигнальными белками Smad2, что, в свою очередь, препятствует индуцированной TGF-β трансформации фибробластов и уменьшает рубцевание [25]. Перспективным направлением повышения эффективности медикаментозного лечения после антиглаукоматозных операций является цитокинотерапия. Применение в клинике инстилляций препарата Суперлимф способствовало снижению локального содержания провоспалительных цитокинов IL-1β и TNF-α, а также нормализации содержания TGF-β1 и TGF-β2, что привело к снижению числа послеоперационных осложнений и обеспечило стойкую нормализацию ВГД [1]. Интраоперационное подшивание коллагенового импланта, насыщенного цитокинами (препарат Суперлимф), способствовало уменьшению пролиферации фибробластов, локального содержания провоспалительных цитокинов, и соответственно, частоты рецидивов повышения ВГД после антиглаукомных операций [4]. 169 Установлено, что в процессах постоперационного заживления раны при хирургии глаукомы играет роль и VEGF. В частности, доказана эффективность антиVEGF терапии в снижении процесса избыточного рубцевания после оперативного лечения глаукомы [22]. Благоприятный исход трабекулэктомии в сочетании с субконъюнктивальным введением aнти-TGF-β2 препарата наблюдается при пигментной глаукоме и высоком уровне соотношения площади глаукомной экскавации и диска зрительного нерва [14]. Для нейропротекции при глаукоме перспективно использование цитокина эритропоэтина, который к тому же обладает и нейрорегенеративным действием [16, 20, 23]. Установлено также, что статины могут быть использованы для уменьшения избыточного рубцевания после хирургического лечения глаукомы (в частности, Ловастатин ингибирует индуцированную TGF-β дифференциацию фибробластов тенноновой капсулы в миофибробласты) [18]. Синтез проколлагена теноновой капсулы может подавляться некоторыми цитокинами, например, IFN-γ [13, 17]. В последние годы для предотвращения избыточного рубцевания вновь созданных путей оттоков после антиглаукоматозных операций доказана возможность использования дендримеров — химически синтезированных полимеров. Их применение в эксперименте у кроликов после антиглаукоматозной фильтрирующей операции способствовало существенному увеличению числа успешных исходов хирургического лечения [21]. Выводы. Выявление новых иммунологических маркеров риска раннего послеоперационного рубцевания должны являться необходимым условием для разработки современных хирургических методов лечения глаукомы. Литература 1. Василенкова, Л. В. Коррекция репаративных процессов методом локальной цитокинотерапии при антиглаукоматозных операциях: автореф. … канд. мед. наук / Л. В. Василенкова. — М., 2005. — 24 с. 2. Ганковская, Л. В. Цитокинотерапия репаративных процессов при антиглаукоматозных операциях / Л. В. Ганковская, В. П. Еричев // Современные проблемы аллергологии, клинической иммунологии и иммунофармакологии: сб. трудов РГМУ. — М., 1998. — С. 756. 3. Дугина, А. Е. Особенности течения постоперационного периода и роль противомикробных пептидов и интерлейкина-17 в раневом процессе при хирургическом лечении больных первичной открытоугольной глаукомой: автореф. … канд. мед. наук / А. Е. Дугина. — М., 2010. — 23 с. 4. Захидов, А. Б. Комбинированное хирургическое лечение первичной открытоугольной глаукомы с локальной иммунокоррекцией репаративных процессов: автореф. … канд. мед. наук / А. Б. Захидов. — М., 2010. — 20 с. 5. Курышева, Н. И. Иммунологические аспекты избыточного рубцевания тканей глаза после антиглаукоматозных операций / Н. И. Курышева, Л. В. Ганковская, Л. В. Ковальчук [и др.] // Мат-лы III Евро-Азиатской конф. по офтальмохирургии. — Екатеринбург, 2003. — С. 79–80. 6.Ловпаче, Д. Н. Клинико-иммунологическое прогнозирование и хирургическая профилактика избыточного рубцевания после антиглаукоматозных операций: автореф. … канд. мед. наук / Д. Н. Ловпаче. — М., 2000. — 25 с. 7. Тахчиди, Е. Х. Клинико-патогенетическое обоснование микроинвазивной непроникающей глубокой склерэктомии в хирургии первичной открытоугольной глаукомой: автореф. … канд. мед. наук / Е. Х. Тахчиди. — М., 2008. — 23 с. 8. Arici, M. K. Adverse effects of topical antiglaucoma drags on the ocular surface / M. K. Arici, D. S. Arici, A. Topalkara, С. Guler // Clin Exper. Ophthalmol. — 2000. — Vol. 28. — № 2. — P. 113–117. 9. Baudouin, C. Conjunctival epithelial cell expression of interleukins and inflammatory markers in glaucoma patients treated over the long term / C. Baudouin, P. Hamard, H. Liang [et al.] // Ophthalmology. — 2004. — Vol. 111. — № 12. — P. 2186–2192. 10.Bresson-Dumont, H. Clinical factors favoring excessive subconjunctival fibroblastic proliferation after glaucoma surgery \ H. Bresson-Dumont, A. Lehoux, C. Baroux // J. Fr. Ophtalmol. — 2008. — Vol. 31. — № 6. — P. 2574–2577. 11.Chong, R. S. Tear cytokine profile in medicated patients effect of monocyte chemoattractant protein 1 on early posttrabeculectomy outcome / R. S. Chong, Y. Z. Jiang, P. Y. Boey [et al.] // Ophthalmology. — 2010. — Vol. 126. — № 2. — P. 156–168. 12.Cvenkel, В. Inflammatory molecules in aqueous humor and on ocular surface and glaucoma surgery outcome / В. Cvenkel, A. N. Kopitar, A. Ihan // Mediators Inflamm. — 2010. — Vol. 102. — № 7. — P. 902–1007. 13.Dey, A. Gamma interferon induces expression of Madl gene in macrophage, which inhibits colony-stimulating factor-1dependent mitogenesis / A. Dey, L. Kim, W. Li // J. Cell Biochem. — 1999. — Vol. 72. — № 2. — Р. 232–241. 14.Grehn, F. Factors affecting the outcome of trabeculectomy: an analysis based on combined data from two phases III stadies of antybody to transforming growth factor beta 2, CAT-152 / F. Grehn, G. Hollo, P. Khaw [et al.] // Ophthalmology. — 2007. — Vol. 114. — № 10. — Р. 1831–1838. 170 15.Kim, Y. G. Level of vascular endothelial growth factor in aqueous humor and surgical results of ahmed glaucoma valve implantation in patients with neovascular glaucoma / Y. G. Kim, S. Hong, C. S. Lee [et al.] // J. Glaucoma. — 2009. — Vol. 18. —№ 6. — P. 443–447. 16.King, C. E. Erythropoietin is both neuroprotective and neuroregenerative following optic nerve transaction / C. E. King, J. Rodger, C. Bartlett [et al.] // Exp Neurol. — 2007. — Vol. 205. — № 1. — P. 48–55. 17.Lee, C. Effect of gamma-interferon on fibroblasts proliferation and collagen synthesis after glaucoma filtering surgery in white rabbit / C. Lee, D. Park // Korean J. Ophthalmol. — 1991. — Vol. 5. — № 2. — P. 59–67. 18.Meyer-Ter-Vehn, Т. Lovastatin inhibits TGF-beta-induced myofibroblast transdifferentiation in human tenon fibroblasts / Т. Meyer-Ter-Vehn, В. Katzenberger, H. Han [et al.] // Invest. Ophthalmol. Vis. Sci. — 2008. — Vol. 49. — № 9. — P. 3955–3960. 19.Priglinger, S. G. Potential role of tissue transglutaminase in glaucoma filtering surgery / S. G. Priglinger, C. S. Alge, D. Kook [et al.] // Invest. Ophthalmol. Vis. Sci. — 2006. — Vol. 47. — № 9. — P. 3835–3845. 20.Song, B. J. Intravitreal recombinant human erythropoietin: a safety study in rabbits / B. J. Song, H. Cai, J. C. Tsai [et al.] // Curr Eye Res. — 2008. — Vol. 33. — № 9. — P. 750–760. 21.Snaunak, S. Polyvalent dendrimer glucosamine conjugates prevent scar tissue formation / S. Snaunak, S. Thomas, E. Gianasi [et al.] // Nat. Biotechnol. — 2004. — Vol. 22. — № 8. — P. 977–984. 22.Stalmans, I. Vascular endothelial growth factor (VEGF) and modulation of wound healing after glaucoma surgery / I. Stalmans, E. Vandewalle, T. Van Bergen // Verh. K. Acad. Geneeskd Belg. — 2010. — Vol. 72. — № 1–2. — P. 41–53. 23.Tsai, J. C. Erythropoietin: a candidate neuroprotective agent in the treatment of glaucoma / J. C. Tsai, B. J. Song, L. Wu, M. Forbes // J. Glaucoma. — 2007. — Vol. 16. — № 6. — P. 567–571. 24.Wimmer, I. Control of wound healing after glaucoma surgery. Effect and inhibition of the growth factor TGF-beta / I. Wimmer, F. Grehn // Ophthalmologe. — 2002. — Vol. 99. — № 9. — P. 678–682. 25.Xiao, Y. Q. SB-431542 of scar formation after filtration surgeryand its potential mechanism / Y. Q. Xiao, K. Liu, J. F. Shen [et al.] // Invest. Ophthalmol. Vis. Sci. — 2009. — Vol. 50. — № 4. — P. 1698–1706. Ю. А. Белый, А. В. Терещенко, И. А. Молоткова ПРИМЕНЕНИЕ АНТИ-VEGF ПРЕПАРАТОВ В ЛЕЧЕНИИ НЕОВАСКУЛЯРНОЙ ГЛАУКОМЫ Калужский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова», г. Калуга Вторичная неоваскулярная глаукома (НВГ) относится к наиболее тяжелым, прогностически неблагоприятным формам глаукоматозного процесса. Согласно данным литературы, основными причинами ее развития являются пролиферативная диабетическая ретинопатия (30–40 % случаев) и ишемическая форма тромбоза центральной вены сетчатки (ЦВС) (40 % случаев), а также хронические увеиты. Ведущим патогенетическим механизмом развития заболевания считается гипоксия внутренних слоев сетчатки, ведущая к выработке ангиогенных факторов (эндотелиального фактора роста сосудов, VEGF), индуцирующих неоваскулярную пролиферацию. Процесс неоваскуляризации чаще начинается по зрачковому краю радужки, а затем захватывает угол передней камеры (УПК). Новообразованные сосуды имеют тонкую (порозную) стенку, вследствие неполноценного эндотелиального покрытия и характеризуются высокой геморрагической активностью. В дальнейшем, новообразованная фиброваскулярная ткань имеет тенденцию к ретракции, в результате чего образуются гониосинехии. Распространение патологического процесса по всему периметру УПК приводит к его полной органической блокаде, следствием которой является декомпенсация внутриглазного давления (ВГД). Существующие методы хирургического лечения НВГ сопряжены с высоким риском операционных и послеоперационных осложнений сосудистого и геморрагического характера. Общепризнанным методом профилактики неоваскуляризации переднего отрезка глаза при тромбозах ЦВС и диабетической ретинопатии считается своевременное проведение панретинальной лазеркоагуляции (ЛК). Однако выполнение адекватной ЛК сетчатки в необходимом объеме не всегда технически выполнимо, в особенности при помутнении оптических сред. Кроме того, эффект ЛК на глазах с уже развив- 171 шейся неоваскулярной глаукомой (выраженной неоваскуляризации радужной оболочки и УПК) имеет отсроченный характер (4–6 недель), что в свою очередь, сопряжено с высоким риском потери зрительных функций на фоне декомпенсации ВГД. На сегодняшний день эффективные методы лечения прогрессирующего рубеоза радужки практически отсутствуют. Наиболее распространенным является аргон-лазерная коагуляция новообразованных сосудов радужки и УПК. Однако существенными недостатками данного метода являются непродолжительный характер окклюзии новообразованных сосудов, реактивное повышение ВГД и высокий риск воспалительных осложнений. В настоящее время известно несколько лекарственных препаратов, способных предотвращать развитие новообразованных сосудов: неселективный блокатор всех видов VEGF рецепторов — ранибизумаб (Луцентис) и бевацизумаб (Авастин). В литературе имеется ряд публикаций об успешном применении современных антиангиогенных препаратов, в частности бевацизумаба (Авастина), являющегося VEGF-A ингибитором, как этапа в лечении неоваскулярной глаукомы при интравитреальном или внутрикамерном введении. Цель — оценить возможность применения анти-VEGF терапии на этапе перед хирургическим лечением неоваскулярной глаукомы. Материал и методы. Под нашим наблюдением находились 10 пациентов (10 глаз) с диагнозом: Пролиферативная диабетическая ретинопатия, макулярный отек, вторичная неоваскулярная субкомпенсированная глаукома, рубеоз радужки, незрелая осложненная катаракта. Сопутствующее заболевание — сахарный диабет II тип. Среди наблюдаемых пациентов были 6 женщин и 4 мужчин. Возраст больных варьировал от 52 до 76 лет. Всем пациентам проводили стандартные офтальмологические обследования. Внутриглазное давление на максимальной местной гипотензивной терапии составило от 25 до 32 мм рт ст. Острота зрения составила от 0,05 до 0,2 с коррекцией. Толщина сетчатки в макулярной области составила в среднем 347мкм. При офтальмоскопии во всех случаях — рубеоз радужки, распространяющийся по всей поверхности, различной степени выраженности: от единичных сосудов, до густой сети. При гониоскопии — в 5 случаях определялась формирующаяся передняя плоскостная синехия на отдельных участках, в 5 случаях — выявлялись еди- ничные новообразовванные сосуды, при сохранившемся открытом профиле угла передней камеры. Всем пациентам была проведена панретинальная лазеркоагуляция сетчатки. Сохраняющийся отек сетчатки в центральной области, а также попытка сохранить зрительные функции, позволили нам предложить пациентам интраокулярное введение препарата Луцентис (Новартис, Швейцария). Операция проводилась в операционной по стандартной методике. В полость стекловидного тела вводилось 0,5 мг препарата. Оценка результатов лечения проводилась первые 5 дней ежедневно, затем каждую неделю в сроки до 1 месяца и далее каждые 2 недели, в последующий месяц, с 3 месяца — 1 раз в 4 недели. Всем больным в связи с некомпенсируемым ВГД через 1 неделю были проведены фистулизирующие операции — лазерное трансцилиарное дренирование задней камеры (ТДЗК) по методике Х. П. Тахчиди с соавт. (1998). Результаты и обсуждение. После интраокулярного введения Луцентиса на 3 день наблюдения отмечено значительное уменьшение количества новообразованных сосудов на радужке. Тонкостенные сосуды совсем «исчезали», запустевали. Более крупные сосуды становились тоньше, в некоторых случаях их ход прерывался. К 7 дню наблюдения отмечалось значительное изменение внешнего вида радужки, по сравнению с до операционным. При гониоскопии мы констатировали полное запустение тонкостенных сосудов. Во всех случаях ВГД оставалось субкомпенсированным на максимальной локальной гипотензивной терапии и составили 25–32 мм рт. ст. На 7 сутки проводился и контроль состояния толщины сетчатки, но в отличии от выраженного клинического эффекта в переднем сегменте в сетчатке таких значительных изменений мы не отметили. Послеоперационный период у 10 пациентов после ТДЗК протекал без геморрагических и воспалительных осложнений. В 2 случаях была выявлена отслойка сосудистой, которая купировалась медикаментозно. ВГД нормализовалось в послеоперационном периоде во всех случаях с составило от 12 до 16 мм рт. ст. При осмотре переднего отрезка глаза в послеоперационном периоде отмечалось практически полное редуцирование сосудов радужки уже к 3 суткам после операции. Все пациенты были выписаны с нормотонусом без гипотензивной терапии с практически полным отсутствие новообразованных сосудов на радужке. 172 В дальнейшем при наблюдении пациентов в сроки до 1 месяца ВГД оставалось в пределах нормы от 19 до 23 мм рт. ст. При оценке толщины сетчатки выявлялось уменьшение отека до 190–210 мкм. Отмечалось также улучшение зрительных функций от 0,16 до 0,3 с коррекцией. При наблюдении в сроки до 3 месяцев отмечалось незначительное повышение ВГД до 26 мм рт. ст. у 4 пациентов, вследствие чего которым была назначена гипотензивная терапия. Клиническая картина сохраняющегося макулярного отека в 4 случаях потребовала дополнительного введения Луцентиса через 1 месяц после ТДЗК. Выводы. Наши клинические наблюдения позволили определить еще один наглядный эффект применения анти-VEGF препаратов при лечении неоваскулярной глаукомы. Воздействуя на патогенетическое звено данного процесса, а именно на неоангиогенез, особенно на начальных его стадиях, позволяет значительно снизить риск геморрагических осложнений при хирургическом лечении НВГ. Бесспорно, отмеченный нами эффект редукции новообразованных сосудов переднего отрезка глаза является одним из клинических проявлений действия анти-VEGF терапии, что говорит о ее целесообразности в качестве 1 этапа лечения неоваскулярной глаукомы. Двухэтапное хирургическое лечение неоваскулярной глаукомы включает в себя: 1 этап — введение анти-VEGF препарата Луцентиса, а 2 — фистулизирующая антиглаукоматозная операция задней камеры глаза с учетом формирующихся передних синехий. Дальнейшее изучение механизмов патогенеза неоваскулярной глаукомы позволит разрабатывать и проводить адекватное и своевременное лечение данного заболевания. А. Е. Галиева, О. И. Оренбуркина Эффективность использования клонидина у больных с открытоугольной глаукомой ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Пациенты офтальмохирургических отделений, поступающие на оперативное лечение по поводу глаукомы — преимущественно, лица пожилого и старческого возраста, которые в 50–80 % случаев страдают артериальной гипертонией [1, 2, 4]. Некомпенсированное артериальное давление (АД) в ходе операции по поводу глаукомы является причиной серьезных интра- и послеоперационных осложнений — гифемы, гемофтальма и даже экспульсивной геморрагии, которая может привести к функциональной гибели глазного яблока [3, 5]. Учитывая тесную взаимосвязь между церебральным и орбитальным кровотоком, была определена цель исследования. Цель — изучение гемодинамики у больных открытоугольной глаукомой с сопутствующей гипертонической болезнью. Материал и методы. Было обследовано 22 больных открытоугольной глаукомой (развитая стадия) в возрасте от 49 до 78 лет. У всех пациентов в анамнезе имелась гипертоническая болезнь II-III ст. Больные были разделены на три группы. В первой группе (7 пациентов, 31,8 %) в пред- и интраоперационном периоде использовали нейролеп- тики, центральные анальгетики, транквилизаторы. Во второй группе (7 человек, 31,8 %) получали миогенные спазмолитики. В третьей группе (8 пациентов, 36,4 %) вводился клонидин 0,5–1,0 мл внутривенно в сочетании с транквилизаторами, на фоне субтеноновой анестезии раствором лидокаина 1 % 0,7–0,8 мл. Исследовали систолическое, диастолическое давление, частоту сердечных сокращений (ЧСС), внутриглазное давление (ВГД). Результаты и обсуждение. У пациентов первой и второй группы снижение артериального давления и внутриглазного давления было незначительным (на 5–7 % мм Hg и 10–12 % мм рт. ст. соответственно). ЧСС снизилась на 10–20 % от исходного уровня и составило в среднем 75±1,7 ударов в минуту. Желаемый эффект (снижение АД на 20–25 %, ВГД — на 25–30 %) наблюдалось у всех больных третьей группы, которым вводился клонидин — агонист α—адренорецепторов, который за счет подавления вазомоторного центра уменьшает симпатическую импульсацию в ЦНС и подавляет активность адренергических систем на периферии. ЧСС у пациентов в данной группе снизилась на 25–30 % и составило в среднем 65±1,5 ударов в минуту. По- 173 мимо гипотензивного эффекта данный препарат понижает внутриглазное давление за счет уменьшения секреции и улучшения оттока водянистой влаги, что способствует стабилизации гемодинамики у больных глаукомой с сопутствующей артериальной гипертонией. Выводы. Гипертоническая болезнь неблагоприятно влияет на регионарную гемодинамику у больных с открытоугольной глаукомой. Интраоперационное управление гемодинамикой глаза и офтальмотонусом на фоне гипертонической болезни возможно с помощью нейровазогенных средств. Литература 1. Алексеев, Б. Н. О некоторых причинах неудач при антиглаукоматозных операциях / Б. Н. Алексеев // Вестн. офтальмол. — 1983. — № 4. — С.18–23. 2. Бунатян, А. А. Рациональная фармако-анестезиология / А. А. Бунатян, В. М. Мизиков. — М., 2006. — 795 с. 3. Тахчиди, Х. П. Анестезия в офтальмологии / Х. П. Тахчиди, С. Н. Сахнов, П. А. Галенко-Ярошевский. — М., 2007. — 552 с. 4. Gurevich, M. A. Arterial hypertension in elderly / M. A. Gurevich. — M.: Universum publishing, 2005. — 144 p. 5. Staessen, J. A. For the systolic hypertension in Europe (SYST‑EUR) Trial Investigators. Randomised double-blind comporison of placebo and active treatment for older patients with isolated systolic hypertension / J. A. Staessen // Lancet. — 1997. — 350. — 757–764. С. Г. Гумерова, О. И. Оренбуркина ПЕПТИДНЫЕ РЕГУЛЯТОРЫ В ЛЕЧЕНИИ БОЛЬНЫХ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМОЙ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Долгие годы гипотензивное лечение глаукомы являлось основной терапевтической стратегией. Однако в последнее время, в связи с изменившимися представлениями о сути заболевания и его патогенезе, все большее значение приобретает нейропротекторная терапия глаукомы, которая в ближайшие годы может стать основополагающим методом в лечении этого тяжелого заболевания [Курышева Н. И., 2006]. На базе Санкт-Петербургского института биорегуляции и геронтологии разработана оригинальная методика выделения из органов и тканей молодых животных полипептидов с молекулярной массой 1000–10000 ДА (дальтон), обладающих высокой тканеспецифичностью после многоступенчатой очистки с целью получения заданной молекулярной массы. Биорегулирующая терапия, основанная на использовании таких пептидов, отличается рядом существенных достоинств, и, в первую очередь, патогенетической обоснованностью. Проведенные исследования позволили выработать ретиналамин, выделенный из сетчатки крупного рогатого скота, и кортексин, представляющий собой комплекс пептидов, выделенных из коры головного мозга крупного рогатого скота и свиней. Ретиналамин уменьшает деструктивные процессы в пигментном эпителии сетчатки, улучшает функциональное взаимодействие пигментного эпителия и наружных сегментов фоторецепторов. Кортексин обладает тропным действием в отношении коры головного мозга и регулирует процессы метаболизма в коре головного мозга, зрительном нерве и нейронах сетчатки [Еричев В. П., Шамшинова А. М., Ловпаче Дж. Н., 2005]. Цель — изучение влияния Ретиналамина и Кортексина на функциональное состояние сетчатки у больных открытоугольной глаукомой (ПОУГ). Материал и методы. В исследование были включены 18 пациентов (18 глаз) с ПОУГ II–III стадиями. Возраст пациентов составлял от 49 до 82 лет. Больные были разделены на 2 группы. Первую (основную) составили 10 пациентов (10 глаз), которым препарат Ретиналамин в количестве 5,0 мг вводился в теноново пространство однократно в сочетании с антиглаукомной операцией (синустрабекулэктомией или глубокой склерэктомией). Затем, начиная с 1 дня после операции, больным, наряду с местной профилактической противовоспалительной терапией, проводились внутримышечные иньекции препарата Кортексин 5,0 мг. Вторую группу (контрольную) составили 8 человек (8 глаз), которым была произведена синустрабекулоэктомия 174 по стандартной методике без медикаментозной нейропротекции. Всем пациентам до и после лечения проводили комплексное обследование по стандартной методике, включающей визометрию, биомикроскопию, офтальмоскопию, тонометрию, периметрию, тонографию, объективную оценку состояния диска зрительного нерва (ДЗН) на компьютерном ретинотомографе (Heidelberg Retina Tomograph — HRT III). Методика операции. Под сочетанной анестезией производили разрез конъюнктивы в нижненаружном квадранте в 4–5 мм от лимба и разрез теноновой капсулы, выполняли заднюю трепанацию склеры. Шпателем формировали карман в теноновом пространстве до зрительного нерва. В карман вводили тупоконечную канюлю. На разрез накладывали кисетный шов. Через канюлю вводили Ретиналамин, одновременно с этим затягивали кисетный шов. Затем выполнялась синустрабекулоэктомия или глубокая склерэктомия по стандартной методике. Накладывали стерильную повязку на 4–5 ч. Клиническую эффективность оценивали через 14 дней и через 1 мес после лечения по данным визометрии, периметрии, компьютерной томографии. Средние показатели внутриглазного давления (ВГД) у пациентов обеих групп до операции составили 37,0±0,8 мм рт. ст. Острота зрения с коррекцией — 0,4 ±0,04. Результаты и обсуждение. Побочные эффекты от использования как самих препаратов Ретиналамин и Кортексин, так и от способов их введения не определялись ни у одного пациента. У 1 пациента (5,6 %) контрольной группы на 7 день была диагностирована цилиохориоидальная отслойка, купи- рованная медикаментозно (подконъюнктивальным введением 0,1 % атропина — 0,3 мл, 1 % мезатона — 0,2 мл, кофеина — 0,3 мл) в течение 3 дней. Через 14 дней после операции внутриглазное давление у пациентов основной и контрольной групп составило в среднем 11,8±0,8 и 12,1±0,8 соответственно. Острота зрения с коррекцией — 0,6±0,04 и 0,5±0,04. ВГД через 1 мес. оставалось в пределах нормы у всех пациентов. Острота зрения оставалась стабильной на 10 глазах (100 %) у пациентов основной группы и у 6 пациентов (75,0 %) контрольной группы. Анализ структурных изменений зрительного нерва по данным HRT-III через 1 мес. показал стабилизацию средней толщины ретинальных нервных волокон в основной группе пациентов и некоторое уменьшение — у пациентов контрольной группы. Таким образом, нашей основной задачей являлось достижение оптимального давления в послеоперационном периоде. Эта задача была успешно выполнена в обеих исследуемых группах. Однако, учитывая перепад внутриглазного давления в ходе фистулизирующей операции, мы считаем необходимым поддержать трофические процессы в зрительном нерве путем сочетанного введения препарата Ретиналамин при антиглаукомной операции и внутримышечного введения препарата Кортексин в раннем послеоперационном периоде. Вывод. Препараты Ретиналамин и Кортексин эффективны и безопасны в лечении больных с ПОУГ в сочетании с фистулизирующими операциями при повышенном внутриглазном давлении и являются перспективным направлением в лечении больных с данной патологией. И. В. Запускалов, О. И. Кривошеина, Ю. И. Хороших РОЛЬ ПЛОСКОСТНОГО ДАВЛЕНИЯ В ПАТОГЕНЕЗЕ ГЛАУКОМНОЙ ОПТИЧЕСКОЙ НЕЙРОПАТИИ Сибирский государственный медицинский университет, г. Томск В последние годы, наряду с общепринятым сосудистым фактором патогенеза глаукомной оптической нейропатии (ГОН), большое внимание уделяют роли метаболических и биомеханических нарушений, развивающихся в зрительном нерве. Однако практически отсутствуют работы по изучению структур, окружающих преламинарную часть зрительного нерва и оказывающих на неё механическое воздействие, — витреоретинальной пограничной области и входящей в её состав внутренней пограничной мембраны сетчатки [1, 2]. Цель — изучить особенности формирования глаукомной оптической нейропатии под воздействием внутренней пограничной мембраны сетчатки. Материал и методы. Клинические исследования проведены среди пациентов, составивших 175 2 группы наблюдения: 1 группа — 30 соматически здоровых пациентов-добровольцев; 2 группа — 12 пациентов с внутричерепной гипертензией различного генеза (5 человек — ушиб головного мозга, 4 человека — опухоль головного мозга, 3 человека — закрытый перелом костей черепа с субдуральной гематомой). Пациентам обеих групп последовательно выполняли регистрацию пульсации центральной вены сетчатки (ЦВС) и центральной артерии сетчатки (ЦАС) на диске зрительного нерва (ДЗН), после чего осуществляли синхронную запись реоофтальмограммы (РОГ) и электрокардиограммы (ЭКГ). При этом после предварительного медикаментозного мидриаза пациенту, находящемуся в горизонтальном положении, записывали ЭКГ в I стандартном отведении с одновременной фиксацией момента закрытия просвета ретинальных сосудов на ДЗН под контролем непрямой бинокулярной офтальмоскопии. Запись пульсации ретинальных сосудов осуществляли последовательно: сначала для ЦВС, затем для ЦАС. Отдельно проводили РОГ совместно с ЭКГ. Регистрацию момента спадения ветвей ЦАС проводили с помощью офтальмодинамометра Байяра. Результаты и обсуждение. У пациентов 2 группы пульсация ЦВС отсутствовала. Это связано с уменьшением градиента давления между ВГД и внутричерепным давлением вследствие имеющейся внутричерепной гипертензии, поскольку растягивающая сила внутрисосудистого давления при этом превышает сжимающую силу сосудистой стенки. Как известно, артериальный кровоток отражает фазы сердечного цикла: пульсовое расширение сосуда соответствует систолической фазе сердечного цикла и с учётом времени распространения пульсовой волны происходит через 0,13 секунд после сердечного выброса; в диастолическую фазу кровоток спадает. Проведение синхронной ЭКГ с регистрацией пульсации ЦВС и ЦАС на ДЗН позволило установить, что закрытие просвета ЦВС на ДЗН происходило в систолическую фазу при заполнении артериальных сосудов глаза кровью и повышении ВГД. Просвет ЦАС во время систолы расширялся, а во время диастолы суживался. Результаты записи пульсовых колебаний ветвей ЦАС свидетельствуют о том, что момент расширения артерии по времени и продолжительности соответствовал показателям РОГ. Согласно результатам записи пульсовых колебаний ЦВС, вена суживалась во время анакроты РОГ и расширялась в конце катакроты. При проведении офтальмодинамометрии наблюдались пульсовые колебания ветвей ЦАС над ДЗН. При этом закрытие просвета ЦАС в ходе офтальмодинамометрии не соответствовало трансмуральному давлению крови, поскольку сжимающая сила сосудистой стенки в этот момент значительно превосходила растягивающую силу. Кратковременные спадения ветвей ЦАС появлялись при повышении ВГД, создаваемом искусственным путем с помощью склерокомпрессии, до 41±1 мм рт. ст. и соответствовали самой низкой точке РОГ — перед анакротой. При дальнейшем повышении ВГД происходило увеличение продолжительности времени спадения артерии за счёт более раннего появления в катакротическую фазу РОГ. При увеличении ВГД до 63±2 мм рт. ст. оставалось кратковременное раскрытие ветви ЦАС, соответствующее началу анакротической фазы РОГ. При этом средне-динамическое давление у пациентов составляло 92±0,9 мм рт. ст. Полученные в ходе исследования результаты могут быть объяснены следующим образом. В норме во время распространения систолической пульсовой волны происходит наполнение артериальных сосудов глаза кровью. При этом ВГД повышается. Венозные коллекторы на выходе из глазного яблока пульсируют в соответствии с фазами сердечного цикла. Закрытие просвета ЦВС на ДЗН, возможно, обусловлено дополнительным давлением, которое оказывает на данный сосуд внутренняя пограничная мембрана сетчатки (ВПМС) в момент повышения ВГД. ВПМС состоит из коллагена I и IV типов, протеогликанов, ламинина и фибронектина, богата карбогидратными остатками, что обусловливает её гидрофобность [3]. Толщина мембраны в зависимости от области расположения варьирует. Над ДЗН ВПМС идёт непрерывным слоем толщиной 84–167 nm [9, 10] и является зоной раздела между ВГД (в среднем около 20 мм рт. ст.) и давлением ретробульбарной части зрительного нерва (в среднем около 10 мм рт. ст.). Можно предположить, что на данном участке возникает трансмуральное давление, за счёт которого ВПМС оказывает механическое воздействие на сосуды сетчатки, прижимая их к решетчатой пластинке склеры. Градиент ТД может, как увеличиваться за счёт повышения давления по одну сторону мембраны в случае высокого ВГД, так и уменьшаться за счёт повышения давления по другую сторону мембраны в результате внутричерепной гипертензии. Механическое воздействие ВПМС на центральный отдел ДЗН, на наш взгляд, является одним из 176 факторов, способствующих развитию и прогрессированию глаукомной оптической нейропатии. За счёт увеличения трансмурального давления на фоне повышения ВГД ВПМС куполообразно продавливается в сторону решетчатой пластинки (рис.), сдавливая аксоны ганглиозных клеток и блокируя аксональный транспорт. Этот эффект назван нами «эффектом плоскостного давления». Выводы. В результате проведенного исследования установлено, что закрытие просвета центральной вены сетчатки на диске зрительного нерва происходит в систолическую фазу при заполнении артериальных сосудов глазного яблока кровью и повышении внутриглазного давления под влиянием внутренней пограничной мембраны сетчатки. Закрытие просвета центральной артерии сетчатки при офтальмодинамометрии не соответствует трансмуральному давлению крови, поскольку сжимающая сила в этот момент значительно превосходит растягивающую силу. Механическое воздействие внутренней пограничной мембраны сетчатки на центральный отдел диска зрительного нерва обусловливает сдавление аксонов ганглиозных клеток за счет «эффекта плоскостного давления». Рис. 1. Схема деформации внутренней пограничной мембраны сетчатки при увеличении градиента трансмурального давления: Р1 — внутричерепное давление; Р2 — внутриглазное давление; ∆Р — градиент давления Литература 1. Faulborn, J. Combined macroscopic, light microscopic, scanning, and transmission electron microscopic investigation of the vitreous body. 3. The structure of the anterior border layer of the vitreous / J. Faulborn // Ophthalmic Res. — 1983. — Vol. 15. — № 1. — P. 11–18. 2. Heegaard, S. Structure of the human vitreoretinal border region / S. Heegaard // Ophthalmologica. — 1994. — Vol. 208. — № 2. — P. 82–91. 3. Heegaard, S. Structure and composition of the inner limiting membrane of the retina / S. Heegaard // Graefe’s Arch. Clin. Exp. Ophthalmol. — 1986. — Vol. 224. — № 8. — P. 355–360. С. Г. Игнатьев 1, С. Г. Игнатьева 2, И. Х. Аль-Дандан 1, Н. Н. Бабошина 3 АКТИВНАЯ И ПАССИВНАЯ ВНУТРИГЛАЗНАЯ СЕКРЕЦИЯ В НОРМЕ И ПРИ ВОЗРАСТНОЙ КАТАРАКТЕ 1 АНО НИЦ «Биофизика ангионейропротекции», 2 3 кафедра офтальмологии МГСМУ, ЦАХ ФГУЗ ЦМСЧ №119 ФМБА России, г. Москва Секреция внутриглазной влаги имеет два механизма: пассивный, или ультрафильтрацию, и активный, продукция безпигментного эпителия цилиарных отростков [1]. Соотношение этих фракций остается пока малоизученным. По данным Millor C. и Kaufman P. L. (1997 г.), пассивная секреция составляет 25 % от всего объема внутриглазной жидкости [2]. 177 Вопрос представляется нам важным, т. к. баланс этих составляющих определяет качество внутриглазной влаги (химический состав, электролитный баланс, рН и т. д.), что отражается на состоянии всех структур глаза. Цель — исследовать возможность количественной диагностики фракций внутриглазной секреции в клинике. Считаем, что решение этой проблемы приблизит нас к решению вопроса клинического изучения качества формирования ВЖ. Нами разработан и апробирован в клинической практике метод диагностики долей пассивной и активной составляющих секреции внутриглазной влаги. В основе его — фармакологическое подавление активной секреции. Для этого используем бетоптик («ALCON», США), который воздействует селективно на β1-адренорецепторы эпителия цилиарного тела, не влияя на другие рецепторы глаза, сосудов и органов. Техника проведения исследования 1. Производим тонографию с определением показателя общей секреции влаги F. 2. Инстилируем в исследуемый глаз раствор бетоптика. 3. После наступления максимального фармакологического действия препарата (30минут) происходит выключение потока активной секреции Fa, повторяем тоногафию, определяя при этом показатель пассивной секреции Fp. 4. Рассчитываем показатель Fa по формуле Fa = = F – Fp. 5. Пересчитываем все полученные данные в относительные величины ( %), исходя из того, что F = = 100 %. Получаем уровень активной и пассивной секреции в сопоставимых, конкретных показателях, позволяющих сделать клинические выводы относительно конкретного клинического случая. Материал и методы. Нами обследованы 40 человек (66 глаз) в возрасте 50–70 лет. Пациенты были разделены на две группы: I группа — условно здоровые люди (12 человек, 24 глаза); II группа — пациенты с незрелой катарактой (28 человек, 42 глаза). Всем проводились: авторефкератометрия, визометрия, тонометрия, периметрия, биометрия, биомикроскопия, офтальмоскопия прямая и обратная, гониоскопия. Гидродинамические показатели глаза определялись на тонографе Glau Test-60 (Россия). После первого проведения тонографии во II группе выделились 3 подгруппы с различной скоростью образования внутриглазной влаги: IIa — с низким коэффициентом F; IIб — с нормальным коэффициентом F; IIв —с высоким коэффициентом F. Результаты и обсуждение. Полученные данные исследований систематизированы в таблицах 1 и 2. После расчетов уровня пассивной Fa и активной Fp фаз секреции ВЖ по формуле F = Fa+Fp, где показатель общей продукции F = 100 %, нами получены данные, характеризующие фракции активной и пассивной секреции в исследуемых группах (табл. 3). Данные, полученные в I группе, характеризуют нормальный уровень внутриглазной секреции, а, следовательно, нормальный в % соотношении баланс фракций активной и пассивной секреции внуТаблица 1 Средние значения показателей гидродинамики (первое исследование) Группы Кол-во чел./ глаз I IIa IIб IIв 12/24 20/32 6/7 2/3 Po (мм Hg) 17,2 15,5 18,0 21,0 Показатели гидродинамики C (мм3/мин/мм F ΔV (мм3) Hg) (мм3/мин) 0,33 2,36 12,39 0,15 0,67 6,9 0,25 1,9 10,08 0,43 4,95 13,3 КБ 55,7 144 83 50 Таблица 2 Средние значения тонографических коэффициентов после применения бетоптика (второе исследование) Коэф. Po C F ∆V KБ I группа 14, 1 0,27 1,06 11,45 55,6 IIа группа 12,3 0,19 0,52 8,8 92 IIб группа 15 0,22 1,12 9,1 84 178 IIв группа 16 0,28 1,68 11,06 59 Таблица 3 Изменение коэффициента F до и после закапывания бетоптика Группы I IIa IIб IIв мм3/мин 2,36 0,67 1,09 4,95 Fp F % 100 100 100 100 мм3/мин 1,06 0,52 1,12 1,68 триглазной жидкости. Этот баланс составил: 45 % активной секреции и 55 % пассивной секреции в отличии от данных Millor C. и Kaufman P. L. (1997 г.). Во всех подгруппах II группы, баланс активной и пассивной фракций внутриглазной секреции отличается от показателей I группы. Особенно сильный дисбаланс в Ia и Iб подгруппах. Следовательно, можно предполагать что, качество внутриглазной жидкости (её химический состав, электролитный баланс, pH и т. д.) будут различаться в норме и при катаракте. Fa % 55 77,6 59 34 мм3/мин 1,3 0,15 0,78 3,27 % 45 22,4 41 66 Выводы. При катаракте нарушен баланс фракций активной и пассивной секреции внутриглазной влаги. Клиническое исследование баланса активной и пассивной секреции внутриглазной жидкости позволяет косвенно судить о качестве внутриглазной влаги при каждом конкретном клиническом случае. Учитывая общепринятый факт, что метаболизм хрусталика всецело зависит от состояния внутриглазной жидкости, можно предполагать, что количество и качество её формирования являются одним из определяющих моментов формирования и прогрессирования катаракты. Литература 1. Нестеров, А. П. Глаукома / А. П. Нестеров. — М.: Медицинское информационное агентство, 2008. — 360 с. 2. Millor, C. Fgucouse humor: secretion and dynamics / C. Millor, P. L. Kaufman // Duanes Ophthalmology, 1997. — CD-ROM Edition. С. Г. Игнатьев 1, С. Г. Игнатьева 2, И. Х. Аль-Дандан 1, Н. Н. Бабошина 3 ЭФФЕКТИВНОСТЬ ВНУТРИГЛАЗНОЙ ГИДРОДИНАМИКИ КАК ПОКАЗАТЕЛЬ ФУНКЦИОНАЛЬНЫХ НАРУШЕНИЙ ВНУТРИГЛАЗНОГО ГОМЕОСТАЗА 1 АНО НИЦ «Биофизика ангионейропротекции», 2 3 кафедра офтальмологии МГСМУ, ЦАХ ФГУЗ ЦМСЧ №119 ФМБА России, г. Москва Имеется мнение, что сохранение динамки обмеТаблица 1 Распределение пациентов на внутриглазной влаги имеет большое значение для на возрастные группы жизнеобеспечения безсосудистых структур глазного яблока [1–3, 5]. Не исключается так же зависимость № группы Возраст Кол-во человек Кол-во глаз 1 14–16 10 20 состояния сетчатки и зрительного нерва от состоя2 17–25 10 20 ния внутриглазной жидкости [5]. 3 26–35 15 30 Учитывая важность вопроса мы решили изучить 4 36–45 17 34 коэффициенты внутриглазной гидродинамики, обе5 46–60 20 40 6 61–83 10 20 спечивающие нормальный обмен веществ в тканях ВСЕГО 14–83 лет 82 164 глазного яблока. Материал и методы. Нами обследовано 82 челоИсследование тонографических коэффициенвек (164 глаза). Возраст пациентов был от 14 до 83 лет. Мы разделили их на 6 возрастных групп (табл. 1). тов проводилось утром с 1000 до 1200 тонографом 179 «GlauTest60» (Россия). Пациенты предупреждались о необходимости хорошего отдыха перед обследованием. Всем пациентам проводили стандартный офтальмологический осмотр: визометрия, офтальмометрия, тонометрия (по Маклакову), периметрия, биомикроскопия, прямая офтальмоскопия, бинокулярная обратная офтальмоскопия. Полученные данные соответствовали общепринятым понятиям нормы. В анамнезе не было общесоматических хронических заболеваний, кроме случаев компенсированной гипертонической болезни в зрелых возрастных группах. Результаты и обсуждение. Нами получены средние значения коэффициентов внутриглазной гидродинамики в разных возрастных группах. Полученные данные изложены в таблице 2. При этом можно отметить, что разница между средними значениями, полученными в возрастных группах, незначительная. Видимо особенных возрастных норм для внутриглазной гидродинамики не существует. Таблица 2 Средние значения тонографических коэффициентов в группах Возрастные группы 14–16 лет 17–25 лет 26–35 лет 36–45 лет 46–60 лет 61–83 года Средние значения Р0 С F ∆V КБ 19,5 17,7 18,4 18,8 18,8 20,2 18,9 0,30 0,33 0,33 0,21 0,33 0,28 0,29 2,27 2,55 2,78 1,87 3,05 3,01 2,59 9,56 11,90 11,31 8,40 11,20 10,33 10,45 75 62 70 98 75 103 80 Учитывая, что нас интересуют конкретные границы нормы, мы решили пользоваться критериями, определяющими уровень разнообразия признаков по всем группам. К таким критериям относится л и м и т (lim), который определяется крайними значениями вариант в вариационном ряду [4] lim = vmax ÷ vmin. При обработке результатов таблицы 2, мы взяли минимальные и максимальные значения полученных результатов, используя среднестатистические значения в каждой группе. Получились границы нормы для коэффициентов внутриглазной гидродинамики (табл. 3). Таблица 3 Крайние значения тонографических показателей в норме Границы Р0 С Нижняя 17,7 0,21 Верхняя 20,2 0,33 Средние значения 18,95 0,27 F ∆V 1,87 8,4 3,05 11,90 2,46 10,15 КБ 62 103 83 Уместно предположить, что именно такие величины коэффициентов гидродинамики обеспечивают нормальный гомеостаз глазного яблока. При этом обеспечивается оптимальный обмен веществ в хрусталике, эндотелии роговицы и трабекулярной зоны, в стекловидном теле. Такие коэффициенты динамики внутриглазной влаги и их баланс можно назвать оптимальной внутриглазной гидродинамикой. При отклонении значений коэффициентов от этих границ внутриглазную гидродинамику можно назвать дисбалансированной. Обнаружение в клинике случаев с дисбалансированной гидродинамикой, даже без каких либо клинических проявлений, должно настораживать офтальмолога в отношении возможности постепенного влияния ситуации на развитие глазных заболеваний (катаракты, глаукомы и пр.). Возможно, в этих случаях, это вопрос времени. Выводы. Границами нормы для коэффициентов внутриглазной гидродинамики, по нашим данным, являются: Ро = 17,7–20,2 мм Hg; С = 0,21–0,3 мм3/ мин/мм Hg; F = 1,9–3,0 мм3/мин; V = 8,4–12,0 мм3; Кб = 62–100. Такой баланс коэффициентов обеспечивает нормальную физиологию внутриглазных структур. Поэтому его можно трактовать как «оптимальная внутриглазная гидродинамика», а отклонение от этих границ — как «дисбаланс внутриглазной гидродинамики». Дисбаланс внутриглазной гидродинамики свидетельствует о нарушении гомеостаза глаза, и, следовательно, либо сопровождает то или иное заболевание глаза, либо предполагает его развитие. Литература 1. Нестеров, А. П. Глаукома / А. П. Нестеров . — М.: Медицина, 1982. — 286 с. 2. Нестеров, А. П. Глаукома / А. П. Нестеров. — М.: Медицинское информационное агентство, 2008. — 360 с. 3. Светлова, О. В. Биомеханические особенности регуляции продукции и оттока водянистой влаги / О. В. Светлова, А. В. Суржиков, К. Е. Котляр [и др.] // Глаукома. — № 2. —2004. — С. 66–67. 4. Серенко, А. Ф. Социальная гигиена и организация здравоохранения / А. Ф. Серенко, В. В. Ермакова. — 2-е изд. — М.: Медицина, 1984. — 638 с. 180 5. Шилкин, Г. А. Роль внутриглазной жидкости как фактора питания сетчатки / Г. А. Шилкин, Н. С. Ярцева, А. Н. Андрейцев [и др.] // Офтальмохирургия. — 1990. — № 1. — С. 60–64. А. З. Калентьева, В. К. Суркова, Р. Т. Габсаликова К вопросу о наследственных факторах в диагностике первичной открытоугольной глаукомы ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Первичная открытоугольная глаукома (ПОУГ) относится к группе заболеваний с наследственной предрасположенностью, развитие которых определяется взаимодействием определенных наследственных и средовых факторов. По литературным данным около 10 % случаев глаукомы взрослых обусловлено наследуемыми мутациями в генах миоцилина и гена цитохрома P 450. Кодируемые этими локусами белки миоцилин и одна из белковых фракций цитохрома Р450 важны для нормального функционирования обменных процессов переднего отдела глаза, однако их роль в патогенезе глаукомы до настоящего времени не вполне ясна. Идентификация мутаций в этих генах позволяет выявлять лица с высоким риском развития глаукомы и своевременно начинать лечение. Спектр описанных мутаций является специфичным для отдельных популяций и этнических групп, что делает невозможным в целях диагностики опираться на данные, полученные в других регионах. В Респуб­ лике Башкортостан (РБ), характеризующейся полиэтническим составом населения и своеобразием генофонда отдельных этнических групп, подобных исследований ранее не проводилось. Цель — изучение спектра и частоты изменений нуклеотидной последовательности генов миоцилина и цитохрома Р450 у больных ПОУГ из Республики Башкортостан и определение диагностического значения выявленных изменений. Материал и методы. Всего было обследовано 257 человек. Из них 138 пациентов с ПОУГ, 39 членов их семей и 80 человек группы контроля. Все пациенты были разделены на 2 группы. Первую группу составили 37 пациентов с ПОУГ с предположительно наследственной этиологией. В эту группу включали больных, если в родословной имелось хотя бы два случая ПОУГ при степени родства не менее 50 %. Вторую группу (101 больной), составили пациенты с ПОУГ без отягощенного семейного анамнеза. Контрольную группу составили 80 человек в возрасте 70–80 лет с неосложненной возрастной катарактой без признаков глаукомы. Среди пациентов с ПОУГ мужчин 85 (61,6 %), женщин 53 (38,4 %) в возрасте от 31 до 82 лет. Офтальмологическое обследование проводилось при помощи общепринятых методов. Молекулярногенетические исследование, включающее выделение геномной ДНК, амплификацию исследуемых участков генов методом полимеразной цепной реакци, анализ конформационного полиморфизма однонитевых фрагментов ДНК (SSCP-анализ), секвенирование проводилось совместно с сотрудниками лаборатории молекулярной генетики человека Института биохимии и генетики Уфимского научного центра РАН. Был проведен SSCP-анализ 1,2,3 экзонов гена миоцилина, скрининг мутации Q368X в гене миоцилина и мутации R368H в гене цитохрома Р 450 в 257 образцах ДНК. Были проанализированы те участки генов, где по литературным данным было выявлено наибольшее количество мутаций и которые были ассоциированы с клинической формой первичной открытоугольной глаукомы. Результаты и обсуждение. SSCP-анализ 1 и 2 экзонов гена миоцилина не выявил изменений подвижности одноцепочечной ДНК в нашей выборке. В экзоне 3 гена миоцилина наблюдались два изменения подвижности одноцепочечной ДНК у двух пациентов с семейным анамнезом ПОУГ. Однако последующий секвенционный анализ не выявил каких-либо изменений в нуклеотидной последовательности ни в самом экзоне, ни в прилегающих к нему интронных областях. При молекулярно-генетическом исследовании образцов ДНК больных нашей выборки в третьем экзоне гена миоцилина у одного пациента с ПОУГ обнаружена нонсенс-мутация — Q368X. Пациент — 50 лет, башкир по этнической принадлежности, с семейным анамнезом заболевания. Впервые обратился за помощью к офтальмологу по месту жительства в январе 2006 года, после того как 181 ослеп левый глаз. Установлен диагноз: OU — Открытоугольная глаукома IVC. Острота зрения OD p. l.incerta, OS-0. Постепенное снижение зрения заметил 2 года назад. К офтальмологам не обращался. Брат пробанда 54 лет ослеп на оба глаза в возрасте 48 лет вследствие глаукомы. На мутацию Q368X приходится 40 % от всех найденных в мире. Мутантный белок становится нерастворимым, накапливается внутри клеток трабекулярной сети, вызывая их дистрофические изменения и последующую гибель посредством апоптоза. Следствием этих процессов является увеличение сопротивления оттоку внутриглазной жидкости и повышение внутриглазного давления. Ген цитохрома 450, картированный в 1996 году, содержит 3 экзона и 2 интрона, из которых только экзоны 2 и 3 кодируют мультифункциональный фермент — цитохром Р450, относящийся к классу монооксигеназ, участвующий в создании новых функциональных групп (–OH, –NH2, –COOH) в сложных органических молекулах многих органов и тканей. Предполагается, что ген цитохрома Р450 может действовать как модификатор гена миоцилина. В 2002 году была идентифицирована мутация R368H гена цитохрома Р450, которая в гетерозиготном состоянии в сочетании с различными мутациями в гене миоцилина является причиной возникновения ПОУГ, причем манифестация заболевания происходит в конце первой — начале второй декады жизни. ПОУГ, вызванная мутацией R368H, характеризуется более тяжелым течением (ранее начало заболевания, быстрое прогрессирование). Был проведен скрининг мутации R368H в 138 образцах ДНК больных ПОУГ, а так же их родственников и в 80 образцах ДНК группы контроля. Мы не выявили мутацию гена цитохрома Р450 ни у одного из обследованных. Видимо, причиной развития ПОУГ у больных из РБ могут быть какиелибо другие мутации в гене цитохрома Р450. Выводы. Выявленная частота мутации Q368X гена миоцилина указывает на целесообразность её тестирования у лиц с семейным анамнезом ПОУГ. Отсутствие выявленной мутации R368H диктует необходимость продолжения поиска мутаций в гене цитохрома Р450, характерных для населения республики Башкортостан. О. А. Киселева, Л. В. Якубова ТРУДНОСТИ В РАЗВИТИИ НОВЫХ ТЕОРЕТИЧЕСКИХ КОНЦЕПЦИЙ ПАТОГЕНЕЗА ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ (ОБЗОР ЛИТЕРАТУРЫ) ФГУ «МНИИ глазных болезней им. Гельмгольца» Минздравсоцразвития России, г. Москва Феноменологические проявления первичной открытоугольной глаукомы (ПОУГ) хорошо известны, однако, патогенез этого заболевания остается не до конца ясным. Выделены отдельные звенья, не позволяющие выстроить стройную систему. Помимо повышения ВГД, имеются доказательства участия сосудистых и иммунологических факторов [1, 6, 7, 9, 11]. Помимо этого, установлена взаимосвязь глаукомы с различными эндокринными расстройствами и повреждением автономной нервной системы, прослеживаются также параллели с нейродегенеративными заболеваниями нервной системы, такими как, болезнь Альцгеймера и Паркинсона [13]. Если учитывать все факторы, влияющие на развитие ПОУГ, можно предположить, что глаукома является не только проявлением патологии зрительной системы, но часто служит манифестацией более генерализованной системной дисфункции. Однако, при этом нельзя не учитывать противоречивость результатов некоторых исследований, посвященных участию системных факторов в патогенезе ПОУГ [2]. У большинства больных ПОУГ повышенное ВГД является основным фактором риска развития заболевания. Однако, у значительного количества пациентов снижение офтальмотонуса не предотвращает прогрессирование ГОН [14, 15]. Вероятно, это связано с независимыми от уровня ВГД механизмами, которые могут иметь место при нейродегенеративных заболеваниях. Нейродегенеративные заболевания представляют собой гетерогенную группу заболеваний, отличающихся клиническим разнообразием. Фундаментальным процессом при 182 нейродегенеративных заболеваниях является потеря специфической популяции нейронов. Нейродегенеративные заболевания проявляются медленно прогрессирующим нарушением функций параллельно с потерей специфических нейронов. Клиническое течение ПОУГ у большого числа больных аналогично [12, 13]. Транссинаптическая дегенерация, при которой поврежденные нейроны оказывают неблагоприятное влияние на здоровые нейроны через синаптические связи анатомических и функциональных нейрональных путей, является основным патофизиологическим механизмом при нейродегенеративных заболеваниях [4]. В настоящее время экспериментальные и клинические данные позволяют предполагать наличие подобных механизмов при прогрессировании ГОН: наличие структурных изменений латерального коленчатого тела и функциональных изменений зрительной коры, изменение экспрессии цитокинов глиальными клетками и накопление патологических протеинов в сетчатке [3, 5, 8]. Гипотеза, заключающаяся в том, что глаукома может быть одним из нейродегеративных заболеваний, проявляющихся зрительными нарушениями, требует дальнейших подтверждений. В глаукомную нейродегенерацию вовлекаются тела и дендриты ганглиозных клеток в сетчатке, аксоны в зрительном нерве и синапсы в головном мозге. Находящееся в стрессе тело и (или) аксоны ГК могут подавать инициирующие аутодеструкцию сигналы другим субклеточным структурам, вызывая раннее нарушение нейрональной функции, и участие нескольких механизмов развития нейродегенеративного каскада при ПОУГ [1]. Причина, инициирующая смерть ГКС при глаукоме, неизвестна, хотя было предложено множество гипотез. Обзор современной литературы показывает, что многие из идей получены из общего исследования нервной системы [10]. Быстрое накопление новых нейробиологических данных к концу второго тысячелетия привело к изменению взглядов на функционирование ГКС в норме и при глаукоме. Необходимым помощником ГКС при их развитии и функционировании является нейроглия. Через соответствующие рецепторы она непрерывно информируется о состоянии нейронов и участвует в синтезе и инактивации нейротрансмиттеров. Сложная картина межнейронных коммуникаций, включающая множественные синаптические, пресинаптические и парасинаптические взаимодействия, еще более усложняется интимным участием нейротрофических веществ и «медиаторов иммунной системы» — цитокинов в этих процессах. В нормальных физиологических условиях они согласованно осуществляют взаимные регуляторные влияния. Общая тенденция, которая становится ясной при знакомстве с современной литературой по патогенезу ПОУГ — это функциональное взаимодействие нейротрансмиттерной, нейротрофической и нейроиммунной регуляции, где нейротрансмиттеры могут действовать как трофические вещества и иммунорегуляторы, и наоборот, нейротрофины и цитокины могут либо непосредственно влиять на активность нейронов, либо модулировать действие нейротрансмиттеров. К этому следует добавить и влияния нейроэндокринной системы [2,3]. Выводы. Многочисленные экспериментальные исследования свидетельствуют, что состояние ГКС, аксонов ЗН и РПС при глаукоме зависит от постоянно возрастающего количества факторов. Разнообразие данных, полученных молекулярной биологией и иммуногистохимией, затрудняет их синтез в единое целое. Это приводит к снижению надежности многих гипотетических теорий патогенеза ПОУГ и создает новые трудности в развитии новых теоретических концепций. Литература 1. Вит, В. В. Строение зрительной системы человека / В. В. Вит. — Одесса, 2003. — 664 с. 2. Волков, В. В. Типичные для открытоугольной глаукомы структурно-функциональные нарушения в глазу — основа для построения современной классификации / В. В. Волков // Вестн. офтальмол. — 2005. — № 4. — С. 35–39. 3. Зуева, М. В. Структурно-функциональная организация клеток Мюллера: роль в развитии и патологии сетчатки / М. В. Зуева, И. В. Цапенко // Клиническая физиология зрения: очерки / под ред. А. М. Шамшиновой. — М.: Т. М. Андреева, 2006. — С. 128–191. 4. Крыжановский, Г. Н. Общая патофизиология нервной системы: руководство / Г. Н. Крыжановский. — М.: Медицина, 1997. — 352 с. 5. Bonne, C. The glaucoma excitotoxicity theory / C. Bonne, A. Muller // Nitric Oxide and Endotelin in the Pathogenesis of Glaucoma. — Philadelphia, 1998. — P. 205–212. 183 6. Flammer, J. Pathogenesis of Glaucomatous Optic Neuropathy (GON) / J. Flammer // Adv. Clin. Exp. Med. — 2004. — Vol. 13. — № 3. — P. 389–394. 7.Haefeli, W. E. Assessment of peripheral vascular responsiveness in patients with glaucoma / W. E. Haefeli // Vascular risk factors and neuroprotection in glaucoma. — Update 1996. — Kugler Publicatios, Amsterdam. — 1997. — P. 87–95. 8.Haefliger, I. O. Nitric Oxide and Endotelin in the Pathogenesis of Glaucoma: An Overview / I. O. Haefliger, E. S. Dettmann // Nitric Oxide and Endotelin in the Pathogenesis of Glaucoma. — Philadelphia: Lippincott-Raven Publishers, 1998. — P. 22–33. 9.Hayreh, S. S. Anterior ischaemic optic neuropathy. Differentiation of arteritic from non-arteritic type and its management / S. S. Hayreh // Eye. — 1990. — № 4. — Pt. 1. — P. 25–41. 10.Hitchings, R. Neurological associations with glaucoma / R. Hitchings // International Glaucoma Review. Suppl. — 2006. — Vol. 8. — № 3. — P. 25–26. 11.Grieshaber, M. Blood Flow in glaucoma / M. Grieshaber, J. Flammer // Curr. Opin. Ophthalmol. — 2005. — Vol. 16. — № 2. — P. 79–83. 12.Gupta, N. Depth perception deficits in glaucoma suspects / N. Gupta, N. Krishnadev, S. J. Hamstra, Y. H. Yücel // Br. J. Ophthalmol. — 2006. — Vol. 90. — № 8. — P. 979–981. 13.Gupta, N. Glaucoma as a neurodegenerative disease / N. Gupta, Y. H. Yücel // Curr. Opin. Ophthalmol. — 2007. — Vol. 18. — P. 110–114. 14.Killer, H. E. The optic nerve: a new window into cerebrospinal fluid composition? / H. E. Killer, G. P. Jaggi, J. Flammer [et al.] // Brain. — 2006. — Vol. 129. — Pt. 4. — P. 1027–1030. 15.Osborne, N. N. A hypothesis to explain ganglion cell death caused by vascular insults at the optic nerve head: possible implication for the treatment of glaucoma / N. N. Osborne, J. Melena, G. Chidlow, J. P. Wood // Br. J. Ophthalmol. — 2001. — Vol. 85. — № 10. — P. 1252–1259. 16.Pashe, M. A Sisk Eye in a Sick Body? Systemic Findings in Patients with Primary Oprn-angle Glaucoma / M. Pashe, G. Flammer // Survey of Ophthalmol. — 2006. — Vol. 51. — № 3. — P. 179–212. Е. В. Козина, Н. Э. Вахитова, В. Т. Гололобов К ВОПРОСУ ОБ ЭФФЕКТИВНОСТИ МЕСТНОЙ МЕДИКАМЕНТОЗНОЙ ГИПОТЕНЗИВНОЙ ТЕРАПИИ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ (ПРЕДВАРИТЕЛЬНОЕ СООБЩЕНИЕ) ГОУ ВПО «Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого», г. Красноярск Известно, что по мере старения организма мобилизуются его адаптационные механизмы, которые во многом определяют уровень жизнедеятельности саморегулирующихся живых систем. Первичная открытоугольная глаукома (ПОУГ) относится к заболеваниям, развивающимся на фоне возрастных изменений, и частота ее выявления с возрастом прогрессивно повышается [4]. Согласно имеющимся рекомендациям, лечение ПОУГ должно начинаться с гипотензивной терапии [3]. Однако в ряде случаев местная медикаментозная гипотензивная терапия при лечении ПОУГ не дает необходимого эффекта. Обычно это связывают с видом проводимого лечения, его длительностью, стадией глаукомного процесса, исходным уровнем внутриглазного давления (ВГД) и пр. Вместе с тем, с позиции процессов адаптации нельзя исключить влияние характера неспецифиче- ских приспособительных реакций организма [1] на уровень ВГД и эффективность его медикаментозного снижения при ПОУГ. Цель — оценить выраженность гипотензивного лечения больных ПОУГ в зависимости от характера их адаптационного состояния. Материал и методы. Первую группу составили 23 пациента, страдающих ПОУГ I стадии с исходно высоким ВГД, которым были назначены ежедневные однократные инстилляции травопроста. Исследование ВГД проводили по окончанию 2 месяцев лечения. Во II группу — группу контроля вошли 45 условно здоровых пациентов, обратившихся к офтальмологу для подбора очков. Офтальмологическое обследование пациентов было традиционным. Оценку адаптационных состояний организма проводили по данным лейкограммы перифериче- 184 ской крови (анализировалось соотношение форменных элементов лейкоцитарной формулы крови с учетом общего количества лейкоцитов) с помощью компьютерной программы НЕМ [2]. По возрасту, полу, характеру сопутствующей патологии, состоянию рефракции, глазным морфометрическим показателям пациенты обеих групп были сопоставимы. Статистическую обработку полученных данных проводили с помощью пакета программ Statistica 6.0. Использовали значения медианы (Ме), 10-й и 90-й процентили [10р; 90р]. При сопоставлении двух выборок по частоте встречаемости признака использовался метод углового преобразования Фишера. Результаты и обсуждение. При оценке распределения адаптационных состояний среди больных начальной ПОУГ и условно здоровых лиц было выявлено, что у последних в 35,6 % случаев (16 чел.) выявлено состояние сбалансированной патологии (СПБ) — когда внутренняя патология или стабильное неблагоприятное влияние окружающей среды компенсировано; в 26,6 % случаев (12 чел.) состояния с риском развития патологии (РРП) — функциональные системы организма работают в режиме повышенной активности; в 22,2 % случаев (10 чел.) определено здоровое функционирование организма (ЗФО). В 8,9 % (4 чел.) и 6,7 % (3 чел.) случаев выявлено состояние острого (ОС) и хронического стресса (ХС) соответственно. В группе лиц с начальной ПОУГ распределение адаптационных состояний отличалось большим количеством пациентов с состоянием острого стресса — 9 человек (39,1 %), предполагающим «аварийный режим» работы функциональных систем организма. В равных долях встречались состояния СПБ и ХС — по 5 пациентов (по 21,7 % случаев). У 4 больных (17,4 %) выявлено здоровое функцио- нирование организма. Состояний РРП не определено. То есть у больных I группы по показателям лейкограммы крови достоверно чаще встречались состояния острого (р<0,01) и хронического стресса (р<0,05). Среднее значение исходного уровня ВГД у больных глаукомой составило 36 [29; 40] мм рт. ст. При этом наиболее высокими значения ВГД были у пациентов в состоянии хронического стресса — 38 [34; 42] мм рт. ст., наиболее низкими — в группе с ЗФО — 31 [28; 34] мм рт. ст. (р=0,048). На фоне лечения травопростом ВГД у больных I группы снизилось в среднем на 6 [1,0; 8,0] мм рт. ст. При этом компенсация ВГД достигнута у всех больных с состоянием ЗФО (21 [19; 23] мм рт. ст.), у трех пациентов с состоянием сбалансированной патологии (23 [20; 25] мм рт. ст.), у одного пациента с состоянием хронического и у двух больных с состоянием острого стресса, что составило 23 и 21 мм рт. ст., соответственно. У 13 больных глаукомой компенсации ВГД не наступило. Для подавляющего большинства этих пациентов было характерным наличие состояний ОС и ХС (7 и 4 пациента, соответственно). При состоянии острого стресса у пациентов с ПОУГ на фоне проводимого лечения ВГД снизилось до 32 [28; 41] мм рт. ст. При состоянии хронического стресса существенного снижения ВГД отмечено не было — к моменту повторного обследования его уровень составил 35 [31; 39] мм рт. ст. Выводы. Основываясь на результатах предварительного этапа исследования можно предположить, что состояния острого и хронического стресса, диагностируемые по лейкоцитарной формуле крови, могут оказывать негативное влияние на эффективность местной гипотензивной терапии. По нашему мнению, полученные данные требуют дальнейшего уточнения и изучения. Литература 1. Гаркави, Л. Х. Активационная терапия. Антистрессорные реакции активации и тренировки и их использование для оздоровления, профилактики и лечения / Л. Х. Гаркави. — Ростов н/Д.: Изд-во Ростовского ун-та, 2006. — 256 с. 2. Копанев, В. А. Использование лейкоцитарной формулы крови при оценке резистентности организма: пособие для врачей / В. А. Копанев, Л. Г. Коваленко, Е. А. Герасимов. — Новосибирск, 1999. — 13 с. 3. Национальное руководство по глаукоме (путеводитель) для поликлинических врачей / под ред. Е. А. Егорова, Ю. С. Астахова, А. Г. Щуко. — М., 2008. — 135 с. 4. Офтальмогериатрия / под ред. Н. А. Пучковской. — М.: Медицина, 1982. — 304 с. 185 М. А. Колесникова, А. В. Колесников, М. В. Соломатина Эффективность антиглаукомных операций фильтрующего типа при глаукоме нормального давления ГОУ ВПО «РязГМУ Минздравсоцразвития России», ГУЗ «РКБ им. Н. А. Семашко», г. Рязань Многие годы роль повышенного внутриглазного давления (ВГД) в патогенезе глаукомы считалась доминирующей, однако, в последние годы к глаукоме также относят заболевания, сопровождающиеся характерными изменениями ДЗН без повышения ВГД. Механизм развития глаукомной оптической нейропатии при статистически нормальном внутриглазном давлении, несмотря на большое количество исследований, остаётся не до конца изученным [1, 2, 3, 5], поэтому взгляды на принципы ее лечения неоднозначны. Несмотря на статистически нормальное ВГД, оно является интолерантным для данного глаза, поэтому большинство офтальмологов считает целесообразным снижение ВГД до толерантного и целевого уровня (до14–15 мм рт. ст.). Однако, результативность хирургического лечения глаукомы нормального давления изучена недостаточно [1, 2, 4], что определяет актуальность данного исследования. Цель — анализ эффективности фистулизирующих операций при нормотензивной глаукоме. Материал и методы. Проанализированы результаты хирургического лечения 108 человек (112 глаз) с глаукомой нормального давления. Показанием к хирургическому лечению было наличие признаков прогрессирования глаукомного процесса и отсутствие эффекта от консервативной терапии. Всем больным были проведены операции фистулизирующего типа: синустрабекулэктомия с иридэктомией, глубокая склерэктомия с иридэктомией, фильтрующая ангулопластика по собственной методике (свидетельство на изобретение № 1289481 от 15.10.1986). Количество операций по годам наблюдения было следующим: в 2004 г. — 10 операций, в 2005 г. — 9, в 2006 г. — 13, в 2007 г. — 22, в 2008 г. — 24, в 2009 г. — 34 операции. Среди обследованных было 58 женщин (54 %) и 50 мужчин (46 %) в возрасте от 45 до 85 лет. В большинстве случаев диагностирована развитая стадия глаукомы — 71 больной (65,7 %), у 25 больных (23,2 %) отмечалась далекозашедшая стадия и у 12 пациентов (11,1 %) — началь- ная стадия глаукомы. Величина ВГД колебалась от 20 до 25 мм рт. ст. (20–21 мм рт. ст. был отмечен в 7,3 % случаев, 22–23 мм рт. ст. — в 25,5 % случаев, 24–25 мм рт. ст. — в 67,2 % случаев). Дооперационная острота зрения у большинства пациентов составляла 0,7–1,0 (39,4 %) и 0,5–0,6 (22,4 %). Острота зрения 0,3–0,4 отмечалась в 12,7 %, 0,1–0,2 — в 11,2 % и 0,01–0,09 — в 14 % случаев. Срок наблюдения за больными составил от 6 мес. до 4 лет. Отдаленные результаты прослежены у 69 человек (71 глаз). Динамика глаукомного процесса оценивалась по следующим показателям: снижение остроты зрения, сужение полей зрения, выраженность оптической нейропатии, а также контролировалась величина ВГД. Результаты и обсуждение. Осложнений и особенностей в ходе выполнения антиглаукомных операций не наблюдалось. В послеоперационном периоде у двух пациентов развилась ЦХО, которая была купирована консервативно, в остальных случаях послеоперационный период протекал гладко на фоне традиционного противовоспалительного лечения. В раннем послеоперационном периоде во всех глазах отмечалось снижение ВГД относительно исходного. К моменту выписки из стационара ВГД в 37,2 % составляло 15–17 мм рт. ст, в 29,4 % — 12–14 мм рт. ст, в 21,6 % — 18–20 мм рт. ст, в 9,9 % — 21–22 мм рт. ст. и в 1,9 % случаев было меньше 12 мм рт. ст. Через 6 месяцев после операции наблюдались все 69 человек (71 глаз- 100 %). Снижение остроты зрения в пределах 0,1–0,2 было выявлено у 4 пациентов (5,8 %) в основном за счёт прогрессирования имевшейся в начале наблюдения катаракты, и только в одном случае (1,4 %) за счёт прогрессирования глаукомы. Сужение полей зрения (ПЗ) с носовой стороны на 5 ̊ отмечено у 1 пациента (1,4 %), что оставалось в пределах развитой стадии. Повышение ВГД до 24–25 мм рт. ст. зафиксировано у 2 больных (2,8 %), которым была назначена местная гипотензивная терапия. 186 Через год после операции наблюдался 41 человек (43 глаза — 60,6 %). Острота зрения на 0,1–0,2 снизилась у 5 человек (5 глаз), что составило 11,6 %. Только у 2 пациентов (4,6 %) ухудшение остроты зрения было обусловлено глаукомой, а у остальных потеря зрения была связана с сопутствующей катарактой. У 2 пациентов (4,6 %) отмечено сужение полей зрения на 5-10 ,̊ однако, перехода в более продвинутую стадию в этих случаях не наблюдалось. Изменения на глазном дне не прогрессировали. Повышение ВГД до 25 мм рт. ст. было отмечено у 2 человек (4,6 %), а у остальных оно сохранялось на уровне послеоперационных цифр. Через два года после операции обследовано 25 человек (27 глаз —38 %). Снижение остроты зрения в пределах 0,2–0,6 ед. отмечено у 6 человек (7 глаз), что составило 25,9 % от общего числа обследованных. В половине случаев это было обусловлено сопутствующими заболеваниями (катаракта, макулодистрофия, атрофия зрительного нерва), а у 4 человек (4 глаза —14,8 %) — развитием глаукомного процесса. Сужение полей зрения с носовой стороны на 5-10 ̊ было выявлено у 2 пациентов (7,4 %), что не повлияло на стадию процесса, а в 1 случае (3,7 %) изменение ПЗ соответствовало переходу в более продвинутую стадию (из начальной в развитую). На глазном дне за 2 года диспансерного наблюдения у 4 больных (5 глаз — 18,5 %) отмечалось усиление сдвига сосудистого пучка в носовую сторону, расширение глаукоматозной экскавации, изменение соотношения Э/Д в сторону увеличения, усиление деколорации ДЗН. Переход начальной стадии глаукомы в развитую был отмечен у одного пациента (3,7 %), из развитой в далекозашедшую стадию — также в одном случае (3,7 %). Повышение ВГД до 24–25 мм рт. ст. было зарегистрировано у 2 пациентов (2 глаза — 7,9 %), одному из которых потребовалась реоперация. Через три года было обследовано 24 человека (26 глаз — 36,6 %). Снижение остроты зрения в пределах 0,1–0,6 было выявлено у 5 человек (5 глаз), что составило 19,2 % от общего числа обследованных за этот срок. У 4 пациентов (15,4 %) снижение остроты зрения происходило за счёт прогрессирования глаукомы, в остальных случаях — из-за развития катаракты. Сужение поля зрения с носовой стороны на 5–10̊ зарегистрировано у 3 обследуемых (11,5 %), у двух из которых (7,7 %) оставалась развитая стадия глаукомы, а в 1 случае (3,8 %) отмечался переход в следующую стадию (из развитой в далекозашедшую). На глазном дне признаки прогрессирования глаукомного процесса были выявлены у 3 человек (11,5 %). Повышение ВГД до 25 мм рт. ст. отмечено у 3 пациентов (11,5 %). Через четыре года после операции под наблюдением осталось 15 человек (16 глаз — 22,5 %). Снижение остроты зрения на 0,2–0,3 ед. зарегистрировано у 5 человек (6 глаз), что составило 37,5 % от общего числа обследованных за этот срок. У 3 человек (18,7 %) снижение остроты зрения было обусловлено глаукомным процессом, у 2 человек (12,5 %) — прогрессированием катаракты. Сужение поля зрения зафиксировано у 2 человек (12,5 %), в одном случае изменение ПЗ было в пределах далекозашедшей стадии, в другом случае — соответствовало переходу из начальной стадии в развитую. Прогрессирование изменений на глазном дне выявлено у 3 пациентов (18,7 %), что заключалось в резком сдвиге сосудистого пучка в носовую сторону, расширении глаукомной экскавации, большей выраженности оптической нейропатии. Повышение ВГД отмечено у 3 человек (18,7 %). Выводы: 1. Фистулизирующие операции, проведённые при нормотензивной глаукоме, позволили в большинстве случаев достичь стабилизации глаукомного процесса и снизить ВГД до 12–17 мм рт. ст. 2. Гипотензивный эффект сохранялся на протяжении 4 лет наблюдения и отмечался через 6 месяцев в 97,2 % случаев, через 1 год — в 95,4 %, через 2 года — в 92,1 %, через 3 года — в 88,5 %, через 4 года — в 87,5 % случаев. 3. Границы поля зрения оставались на дооперационном уровне через 6 месяцев в 98,6 % случаев, через 1 год — в 95,4 %, через 2 года — в 92,6 %, через 3 года — в 88,5 %, через 4 года — в 87,5 %. 4. Острота зрения сохранялась на исходном уровне через 6 месяцев в 98,6 % случаев, через 1 год — в 95,4 %, через 2 года — в 85,2 %, через 3 года — в 84,6 %, через 4 года — в 81,3 % случаев. 5. Полученные результаты свидетельствуют о целесообразности хирургического лечения глаукомы нормального давления при отсутствии стабилизации зрительных функций. Литература 1. Волков, В. В. Глаукома при псевдонормальном давлении: руководство для врачей / В. В. Волков. — М.: Медицина, 2001. 187 2. Нестеров, А. П. // Клин. офтальмол. — 2003. — Т. 4. — № 2. 3. Нестеров, А. П., Алябьева, Ж. Ю. // Глаукома. — 2005. — № 6. — С. 66–70. 4. Шмырева, В. Ф., Шмелева-Демир, О. А., Мазурова Ю. В. // Вестн. офтальмол. — 2003. — № 6. — С. 3–6. 5. Григорьева, Е. Г. // Вестн. офтальмол. — 2004. — № 6. — С. 38–40. 6. Краснов, М. М. // Клин. офтальмол. — 2003. — Т. 4. — № 2. А. В. Куроедов, В. Ю. Огородникова 1, В. В. Городничий, А. А. Эркенова 1 позиционирование прогрессирования перипапиллярной атрофии у пациентов с разными формами открытоугольной глаукомы ФГУ «2-й Центральный военный клинический госпиталь им. П. В. Мандрыка», 1 ГОУ ВПО «Российский государственный медицинский университет», г. Москва Характеристики перипапиллярной хориоретинальной атрофии (ППА) были достаточно широко изучены при глаукоме. ППА встречается как в здоровых глазах (наиболее часто в пожилом возрасте и у пациентов с аметропиями), так и у больных глаукомой. Большинство авторов согласны, что выраженность бета-зоны ППА увеличивается вместе со стадией болезни [1, 2]. Цель — определение особенностей прогрессирования перипапиллярной атрофии у пациентов с разными формами открытоугольной глаукомы. Материал и методы. В результаты ретроспективного исследования (метод «случай-контроль») были включены данные пациентов, которые обследовались в офтальмологическом отделении ФГУ «2-й ЦВКГ им. П. В. Мандрыка МО РФ» (Москва) с апреля по июнь 2010 года. Всего было обследовано 65 пациентов (106 глаз, средний возраст — 64,72±14,16 лет) с ПОУГ и ГНД. Пациенты были разделены на подгруппы в соответствии с формой глаукомы и стадией болезни. Средний возраст всех мужчин (34, 52,3 %) составил 66,7±12,89 лет; женщин (31, 47,7 %) — 62,24±15,47 лет, p<0,05. Помимо общепринятого офтальмологического обследования выполнялись исследования топографической структуры ДЗН на компьютерном ретинотомографе (HRT 3, версия программного обеспечения 3.1.2., Heidelberg Engineering, Германия). Для оценки морфометрических параметров ППА был выполнен расчет исходных показателей площади ДЗН и площади ДЗН с ППА, после чего путем вычитания была рассчитана собственно площадь бета-зоны ППА. Результаты сканирований обрабатывались при помощи встроенных программных комплексных решений, поставляемых совместно с диагностической техникой, и вносились в память персонального компьютера с последующим статистическим анализом (программа Statistica, версия 6.0, StatSoft, Inc., Австралия-США), с использованием лицензионного программного обеспечения. Результаты и обсуждение. Было установлено, что площадь ДЗН пациентов с начальной стадией глаукомы (1,25–2,40 мм2) достоверно меньше, чем у больных с развитой стадией болезни (мин. 1,23 — макс. 2,49 мм2), p=0,02, а различия в площади ППА при сравнении в этих же группах были недостоверными (p>0,05). В то же время статистически достоверных различий между площадью ДЗН у больных с начальной и далеко зашедшей стадий болезни (мин. 1,28 — макс. 2,70 мм2) обнаружено не было (p>0,05), а изменения площади ППА были статистически значимыми (0,73±0,32 и 1,21±0,37 мм2, p<0,0002). Помимо этого различия были обнаружены в параметрах бета-зоны ППА у больных со 2 и 3 стадиями болезни (0,82±0,34 и 1,21±0,37 мм2, p<0,002). Программные особенности HRT определяют темпоральный и назальный сектора равными 90 , по сравнению с остальными — 45°. Соответственно этому, их обнаруженные абсолютные размеры были больше, чем площадь ППА в других секторах (0,22±0,11; 0,21±0,09; 0,32±0,09 мм2 и 0,23±0,11; 0,21±0,08; 0,35±0,11 мм2, для начальной, развитой и далеко зашедшей стадий глаукомы, p<0,002), но не имели достоверно значимых различий на одной стадии болезни между собой (p>0,05). Таким образом, установлено, что выраженная трансформация размеров ДЗН между начальной и развитой стадией болезни происходит, 188 в первую очередь за счет изменения темпорального и назального секторов. Изменения ППА становятся статистически значимыми при сравнении данных 1 и 3 стадии болезни, в первую очередь за счет темпорального сектора ДЗН (p<0,008). При сравнении показателей ППА в нижне- и верхнетемпоральных отделах было установлено, что у больных с развитой стадией болезни изменения верхне-темпорального отдела выражены сильнее (0,17±0,42 мм2 и 0,09±0,04 мм2, p<0,05), а не наоборот, как было обнаружено ранее некоторыми исследователями. В то же время обнаруженные различия в этом секторе нивелируются у больных с далеко зашедшей стадией болезни (p>0,05), что может свидетельствовать в пользу равномерного поражения указанной структуры ДЗН на этой стадии болезни. Все остальные сектора ДЗН претерпели статистически значимые изменения (темпоральный — p<0,0009; нижнетемпоральный — p<0,00002; нижненазальный — p<0,001; назальный — p<0,0002; верхненазальный — p<0,0001). При сравнении площади ДЗН больных с ГНД единственным статистически значимым стал параметр назального сектора у пациентов 1 и 3 стадии болезни: 0,45±0,1 и 0,55±0,12 мм2 (p<0,02). Площадь ППА постепенно изменялась за счет увеличения в верхнетемпоральном и нижненазальном секторах (p<0,03, при сравнении между начальной и развитой стадиями глаукомы и p<0,01 при сравнении между развитой и далеко зашедшей стадиями болезни). Такие изменения присущи вертикальной трансформации ДЗН за счет увеличения продольного компонента экскавации. Помимо этого был проведен перекрестный анализ: сравнение площади ППА у больных ПОУГ и ГНД. Статистически значимые различия были обнаружены в нескольких случаях: верхненазальный сектор больных начальной глаукомой низкого давления был достоверно шире, чем аналогичный у больных ПОУГ (0,1 против 0,07, p<0,05), а назальный и темпоральный сектора больных развитой стадией ГНД были шире аналогичных больных ПОУГ (p<0,05). Вторым этапом исследования стало изучение статистической связи (коэффициент корреляции Пирсона, r) показателей, характеризующих состояние ППА и соответствующего сектора ДЗН. Для пациентов с ПОУГ была установлена следующая взаимосвязь: у больных с начальной глаукомой отрицательная корреляция была установлена в тем- поральных (–0,51; p<0,05) и назальных (–0,59; p<0,05) секторах. У пациентов с ГНД были обнаружены следующие статистически значимые корреляции: развитая стадия — в нижнетемпоральном секторе (0,54; p<0,05); верхне- и нижненазальных (0,63 и 0,68; p<0,05). Обращает внимание разное направление связи в исследуемых группах. Так, для пациентов с ГНД присуща положительная корреляция, т. е. большему значению площади сектора ДЗН соответствует большее значение размера ППА. В то время, как для ПОУГ была характерна обратная сила связи: большему значению сектора диска присуще меньшее значение площади бетазоны. Выводы. Метод компьютерной ретинотомографии может быть предложен для расчета площади ППА (бета-зоны) у больных глаукомой. Установлено достоверно значимое увеличение площади ППА у пациентов с развитой и далеко зашедшей стадиями различных форм глаукомы, по отношению к больным с начальной стадией болезни. Для пациентов с начальной ПОУГ характерны изменения ППА в темпоральном секторе, которые затем перемещаются в верхнетемпоральный сектор (развитая стадия болезни), и далее (далеко зашедшая стадия) — равномерно по всему периметру ДЗН, с более выраженными поражениями в нижнем полюсе. Для развитой стадии болезни больных ПОУГ также определено большее стандартное отклонение анализируемых данных в верхнетемпоральном секторе ДЗН, свидетельствующее о большей вариабельности ширины ППА у больных данной группы. Для пациентов с ГНД характерны изменения двух противоположных секторов: верхненазального и нижнетемпорального, что свидетельствует о вертикальном компоненте прогрессировании поражений. Для больных ГНД с продвинутыми стадиями болезни также характерна более широкая бета-зона перипаппиллярной атрофии в темпоральном, назальном и верхненазальном секторах. Такие изменения диктуют необходимость более пристального внимания к назальной полусфере при офтальмоскопических оценке состояния ДЗН. Для больных продвинутыми стадиями ПОУГ характерны больше размеры площади ДЗН, что может быть как независимым фактором риска развития заболевания, так и свидетельством трансформации происходящей в структуре диска от стадии к стадии (патологический «эффект расплющивания»). 189 Литература 1. Pan, Y. Z. Comparison of peripapillary atrophy in eyes with unilateral visual field defect in patients with primary open-angle glaucoma and normal tension glaucoma / Y. Z. Pan, Z. Q. Ren, M. Li, R. H. Qiao // Zhonghua Yan Ke Za Zhi. — 2007. — Vol. 43. — № 9. — Р. 784–787. 2. Rockwood, E. J. Acquired peripapillary changes and progression in glaucoma / E. J. Rockwood, D. P. Anderson // Graefe’s Arch. Clin. Exp. Ophthalmol. — 1988. — Vol. 226. — № 6. — Р. 510. Н. И. Курышева, Е. В. Топольник, В. Н. Трубилин СЕЛЕКТИВНАЯ ЛАЗЕРНАЯ ТРАБЕКУЛОПЛАСТИКА У БОЛЬНЫХ С АРТИФАКИЕЙ: ОСОБЕННОСТИ ПОСЛЕОПЕРАЦИОННОГО ПЕРИОДА И ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ Центр офтальмологии ФМБА России, г. Москва Проблема выбора метода хирургического вмешательства у больных глаукомой в сочетании с катарактой по-прежнему не имеет однозначного решения. До сих пор звучат мнения как в пользу поэтапного лечения (антиглаукомная операция, а далее — факоэмульсификация катаракты, ФЭК), так и в пользу комбинированных операций. В ряде случаев у больных глаукомой с нормализованным офтальмотонусом, ВГД повышается спустя некоторое время после прошедшей без осложнений ФЭК. Альтернативным решением (вместо антиглаукомной операции или усиления местного гипотензивного режима) может быть лазерная трабекулопластика. Роль ее усилилась в последние годы благодаря появлению нового метода лазерного воздействия на трабекулу — селективному фототермолизису, или СЛТ. Параметры лазера подобраны таким образом, что при выполнении процедуры не происходит коагулирующего разрушения структуры трабекулярной сети или непигментированных клеток [3]. По данным зарубежных исследователей, лазерная трабекулопластика в настоящее время выполняется в два раза чаще, чем антиглаукомные операции [4]. Это объясняется рядом преимуществ лазерного лечения перед хирургическим: более высокой доступностью лечения и меньшим риском послеоперационных осложнений [1]. Вместе с тем, данные литературы об эффективности СЛТ весьма разноречивы, а результаты ее в артифакичных глазах практически не встречаются в научных публикациях. Цель — изучение особенностей раннего послеоперационного периода и эффективности СЛТ у больных глаукомой, ранее оперированных по поводу катаракты. Материал и методы. Под наблюдением находились 35 больных развитой глаукомой (35 глаз), которые в течение последних пяти лет перенесли факоэмульсификацию (ФЭ) катаракты в глазу с компенсированным ВГД. После операции ВГД удерживалось в пределах нормы. Впоследствии (в среднем спустя 2 месяца), офтальмотонус стал повышаться, а глаукома имела тенденцию к прогрессированию. Это явилось основанием для выполнения СЛТ. Группу сравнения составили 29 больных развитой глаукомой (38 глаз), у которых также имелись признаки прогрессирования глаукомной оптиконейропатии (ГОН) на фоне недостаточной компенсации ВГД при максимальной местной гипотензивной терапии. В семи случаях (в 5 — в основной группе и в 2 — в группе сравнения) имела место псевдоэксфолиативная глаукома (ПЭГ). СЛТ выполнялась на приборе Laserex «Solo» на 180◦ в нижнем и частично — в височном и носовом секторах. Энергия одного импульса колебалась от 0,7 до 1,2 мДж в зависимости от степени пигментации угла передней камеры (УПК), общая энергия составила 77 мДж и не превосходила 90 мДж. В случаях обнаружения гониосинехий, последние тщательно оставлялись в стороне от зоны вмешательства. Все пациенты были осмотрены в сроки 1 сутки, 1 неделя, три месяца и 2 года после СЛТ. Результаты и обсуждение. У всех больных проводимое лечение не сопровождалось какимилибо серьезными осложнениями. Легкая гиперемия слизистой в первые сутки после СЛТ встречалась у 15 пациентов основной группы и у 5 больных группы сравнения. В основной группе в 5 случаях мы наблюдали умеренно выраженные преципитаты 190 в первые сутки поле СЛТ, которые исчезли уже на следующий день. Отмечался симптом Тиндаля легкой степени, реакция зрачка на свет была снижена у трех пациентов, у двух она отсутствовала. В группе сравнения лишь в двух случаях наблюдались преципитаты и снижение реакции зрачка на свет в первые сутки после операции. Следует подчеркнуть, что все семь пациентов, у которых были зарегистрированы описанные выше признаки воспаления с преципитатами и снижением зрачковой реакции в ближайшем послеоперационном периоде, страдали ПЭГ. Как показали результаты настоящего исследования, снижение офтальмотонуса имело место у всех больных. Примечательно, что в первые сутки после операции уровень снижения ВГД был, сопоставим в обеих группах и составил в среднем 30 % от исходного. У больных с признаками воспаления, выявленными при биомикроскопии, снижение ВГД было более значимым и составило 40 % от исходного (в среднем 15±3,2 мм рт. ст). Спустя неделю после СЛТ подъем ВГД был отмечен у 25 % больных основной группы (9 глаз) и 15 % (5 глаз) в группе сравнения, что требовало назначения местных гипотензивных препаратов. Во всех упомянутых случаях имела место ПЭГ, а в 19 глазах выявлялись гониосинехии. У больных основной группы офтальмотонус через неделю составил в среднем 21,5±2,3 мм рт. ст, что было на 2 мм рт. ст. выше, чем в группе сравнения. Через пять недель, т. е. в срок, когда можно оценивать эффективность СЛТ [4], офтальмотонус в основной группе составил 18,4±4,2 мм рт. ст. без назначения местных гипотензивных препаратов только в 8 случаях, а 6 больным для достижения нормального ВГД был назначен ксалатан. В группе сравнения офтальмотонус составил 16,7±3,8 мм рт. ст. без назначения местных гипотензивных препаратов (p<0,05). В отдаленном периоде (в среднем спустя 20 месяцев после СЛТ) ВГД в основной группе составило 21,2±3,1 мм рт. ст., а в группе сравнения 18,5±4,9 мм рт. ст. (p<0,05). 25 пациентов (70 %) основной группы вынуждены были применять один или два местных гипотензивных препарата, в то время как в группе сравнения эта цифра составила 50 % (16 глаз). Результаты настоящего исследования показали, что в артифакичных глазах эффективность СЛТ ниже, чем в группе сравнения (в факичных глазах). Мы полагаем, что важной причиной тому явились гониосинехии, нередко присутствующие в глазах, ранее оперированных по поводу катаракты. Возникновение гониосинехий при столь деликатной операции как ФЭ катаракты вызвано не столько операционной травмой, как неблагоприятным фоном, а именно — наличием глаукомы, которая, как известно, сопровождается нарушением гематоофтальмического барьера (ГОБ), а также длительным (порой годами) применением препаратов, которые поддерживают хроническое воспаление в глазу (например, миотики). Действительно, часть больных основной группы в течение длительного времени до выполнении ФЭ катаракты применяла такие местные гипотензивные препараты как пилокарпин, фотил или простагландины. Следует подчеркнуть, что гониосинехии чаще всего выявлялись в артифакичных глазах с псевдоэксфолиациями. Известно, что псевдоэксфолиативный синдром (ПЭС) сам по себе способствует нарушению проницаемости ГОБ, что еще более усиливается на фоне хирургического или лазерного вмешательства. Это ограничивает возможности СЛТ: операция, как правило, выполнялась не равномерно на протяжении выбранного сегмента (классически — это половина окружности снизу), а в различных наиболее доступных секторах. Именно этим обстоятельством можно объяснить более низкую эффективность СЛТ в артифакичных глазах. Существует и другое объяснение. Известно, что биологическое действие СЛТ сводится в активизации цитокинов, макрофагов и фагоцитов, а также самих трабекулярных клеток. Иными словами, необходимым условием действия СЛТ является создание воспалительной реакции на клетки трабекулярной сети, особенно на внутреннюю стенку Шлеммова канала. В послеоперационном периоде при СЛТ происходит усиленная продукция цитокинов и матричных металлопротеиназ (MMPs), расщепляющих межклеточный матрикс. Для того, чтобы действие MMPs не было чрезмерным, оно контролируется особыми ингибиторами, получившими название ТIMPs. Известно, что в результате лазерного воздействия особенно активируется MMP-2, ингибитором которой является ТIMP-2. В том случае, когда концентрация самих ферментов (MMP-2) преобладает над концентраций их ингибиторов (ТIMP-2), расщепление межклеточного вещества возрастает (в том числе и в трабекулах), следовательно, ВГД снижается. Этот процесс ограничен в глазах с ПЭГ. В недавних исследованиях M. Cellini и соавт. (2008 г.), проанализировавших результаты СЛТ у больных с артифакией, было по- 191 казано, что недостаточный эффект лазерного лечения был отмечен у тех пациентов с ПЭГ, у кого было нарушено соотношение MMP-2 и ТIMP-2 в пользу преобладания ингибиторов металлопротеиназ [2]. По данным этих авторов, спустя месяц после СЛТ концентрация в камерной влаге ТIMP-2 в два раза преобладала над концентрацией ТIMP-2. Несмотря на более скромные результаты СЛТ у больных с артифакией, которые мы наблюдали в данном исследовании, следует признать, что в большинстве случаев офтальмотонус был снижен, а глаукомный процесс стабилизирован. Это позволяет рассматривать СЛТ как альтернативный (повторному хирургическому вмешательству) метод лечения глаукомы у больных с артифакией. Выводы. Селективная лазерная трабекулопластика является эффективным методом снижения офтальмотонуса у больных глаукомой, ранее оперированных по поводу катаракты. Прогноз СЛТ хуже у больных, страдающих ПЭГ. Литература 1. Курышева, Н. И. Селективная лазерная трабекулопластика как процедура выбора при повторных вмешательствах при первичной открытоугольной глаукоме / Н. И. Курышева, Е. В. Топольник, М. А. Царегородцева // Сб. науч. ст. международной конф. «Глаукома: теории, тенденции, технологии». — М., 2008. — С. 401–406. 2. Cellini, M. Matrix metalloproteinases and their tissue inhibitors after selective laser trabeculoplasty in pseudoexfoliative secondary glaucoma / M. Cellini, P. Leonetti, E. Strobbe // BMC Ophthalmology. — 2008. — Vol. 3. — P. 485–493. 3. Latina, M. Selective Targeting of trabecular meshwork cells: in vitro studies of pulsed and CW laser interactions / M. Latina, C. Park // Exp. Eye Res. — 1995. — Vol. 60. — P. 359–372. 4. Shazly, T. Long-term safety and efficacy of selective laser trabeculoplasty as primary therapyfor the treatment of pseudoexfoliation glaucomacompared with primary open-angle glaucoma / T. Shazly, J. Smith, M. Latina // Clinical Ophthalmology. — 2011. — Vol. 5. — P. 5–10. Б. Э. Малюгин, Е. В. Ковшун, В. А. Власова, Д. Г. Узунян, И. Н. Шормаз Возможности оптической когерентной томографии переднего отрезка глаза и ультразвуковой биомикроскопии в диагностике вторичной глаукомы у пациентов с сосудистыми бельмами ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова Росмедтехнологии», г. Москва Ожоговые бельма являются исходами комбинированных, многокомпонентных органических поражений всех структур глаза, что сопряжено со стойким повышением внутриглазного давления (ВГД), развитием катаракты и т. п. Особого внимания заслуживает диагностика вторичной глаукомы, т. к. она у больных с ожоговыми бельмами встречается, по данным литературы, в 27–43 % случаев [2, 6] и значительно усложняет лечебную тактику, ухудшая прогноз предстоящей кератопластики или кератопротезирования [3, 5] и являясь основной причиной необратимой слепоты. Глаукома, возникающая у больных после ожогов, как правило имеет ретенционный характер [2, 3, 4, 6] вследствие возникающих препятствий на путях оттока внутриглазной жидкости: образование иридохрусталикового блока (заращение зрачка, набухающая катаракта); рубцевания угла передней камеры (образование передних синехий, ретрокорнеальной и/или предрадужной мембраны), рубцевания интрасклеральных путей оттока. Поэтому, с целью восстановления зрительных функций важным является своевременное, комбинированное хирургическое лечение. Однако, сложности диагностики и лечения вторичной глаукомы связаны с часто наблюдающейся бессимптомностью процесса; а также с тем, что существующие методы определения ВГД у больных с последствиями ожогов глаз, особенно если рубцовые изменения роговицы сочетаются с рубцовыми изменениями или сращениями век с глазным яблоком, представляют значительные трудности. Проведение традиционных способов диагностики — биомикроскопии, 192 офтальмометрии, тонометрии, тонографии, гониоскопии и др. затруднено, а результаты часто бывают недостоверными из-за изменения прозрачности, кривизны, формы и биохимических свойств роговицы. В то же самое время, своевременная и объективная оценка состояния переднего отрезка глаза позволяет выбрать наиболее оптимальные способы хирургического лечения. Исходя из этого, возникает необходимость поиска методов диагностики вторичной глаукомы, применимых при наличии изменений в оптических средах глаза — нарушении прозрачности роговицы, наличии осложненной катаракты с целью раннего выявления изменений в переднем отрезке глаза и определения хирургической реабилитации данных пациентов. На современном этапе дать прижизненную оценку состояния структур переднего отрезка глаза при сосудистых бельмах позволяет ультразвуковая биомикроскопия (УБМ) и оптическая когерентная томография переднего отрезка глаза (ОКТ) [1]. Цель — определить диагностические возможности применения ОКТ и УБМ для оценки изменений переднего отрезка глаза у больных с вторичной глаукомой при сосудистых бельмах 4–5 категории (по классификации Филатова-Бушмича с изм. Н. А. Пучковской с соавт.). Материал и методы. Проведено обследование 20 глаз (10 пациентов) с основным диагнозом «сосудистое бельмо, исход ожога», из которых было 8 мужчин, 2 женщины, в возрасте от 23 до 80 лет. На 12 глазах ранее были выполнены различные оперативные вмешательства: антиглаукоматозные операции (АГО) с имплантацией клапана Ahmed (8 глаз), традиционные АГО (циклодиатермопунктура, глубокая склерэктомия) (4 глаза), экстракция катаракты (10 глаз). ОКТ выполняли на аппарате Visante OCT (Carl Zeiss, Meditec, USA), УБМ — на аппарате «UBM-840» фирмы «Humphrеy» (США) по общепринятой методике. Методом УБМ и ОКТ были обнаружены и оценены следующие параметры — сферичность, прозрачность, толщина, наличие перфорации, изменения десцеметовой мембраны роговицы; наличие ретрокорнеальной и/или предрадужной мембран; равномерность и глубина передней камеры; величина угла передней камеры; наличие синехий; состояние цилиарного тела; наличие заращения зрачка; состояние и положение радужки и хрусталика. Результаты и обсуждение. У пациентов с сосудистыми бельмами на основании анализа УБМ- и ОКТ-сканограмм во всех 100 % случаев была отмечена облитерация угла передней камеры (УПК). Иридокорнеальные сращения и рубцы образующие узкий угол обнаружены на 4 глазах (20 %), в остальных случаях диагностировали закрытие угла передней камеры, при этом гониосинехии обнаруживали секторально на 8 глазах (53 %) и тотально на 7 глазах (47 %). Иридокорнеальные сращения были ограничены в пределах одного квадранта на 2 глазах (25 %), распространены на 2–3 квадранта на 6 глазах (75 %). У пациентов с закрытым УПК также были выделены следующие особенности глаз: неравномерная толщина роговицы на 20 глазах — от 0,22 мм до 1,47 мм, из них на 17 глазах (85 %) выявлено уплощение роговицы. Методом УБМ на 3 глазах (15 %) были обнаружены изменения десцеметовой мембраны и передней капсулы хрусталика: утолщение и рубцовые складки, на 17 глаз (85 %) обнаружена ретрокорнеальная мембрана, на 1 глазу (5 %) — предрадужная мембрана. При этом данные структуры при бельмах методом ОКТ не визуализировались. На 4 глазах (20 %) передняя камера отсутствовала, радужка и передняя капсула хрусталика прилежали к роговице. В данном случае метод ОКТ не позволил по оптической плотности отдифференцировать структуру ткани. В остальных случаях глубина передней камеры колебалась от 0,35 мм до 3,18 мм в центральных отделах. Методом УБМ афакия выявлена на 6 глазах (30 %), артифакия — на 4 глазах (20 %), факия — на 10 глазах (50 %). В одном случае артифакии наблюдалась дислокация интраокулярной линзы (ИОЛ) кверху; на 6 факичных глазах наблюдалось увеличение передне-заднего размера хрусталика (от 4,46 до 5,48 мм), в остальных случаях факии (4 глаза) наблюдалась сублюксация хрусталика, характеризующаяся наибольшим сужением УПК в зоне смещения хрусталика. При этом метод ОКТ не дифференцировал структуры хрусталика и ИОЛ во всех 100 % случаях. При УБМ и ОКТ на всех 4 глазах после традиционных АГО, выполненных ранее за 2–6 месяцев до проведения исследований, фильтрационную подушку, склеральный лоскут и интрасклеральную полость выявить не удалось, видимо, ввиду фиброзного перерождения всех структур дренажной системы. Методом УБМ на 7 глазах (35 %) были обнаружены клапанные дренажи Ahmed в передней камере глаза в правильном положении, на 1 глазу — в зад- 193 ней камере. При этом методом ОКТ визуализировать дренажи не удалось. Выводы. При исследовании глаз с ожоговыми бельмами методом УБМ и ОКТ во всех 100 % случаях была отмечена облитерация УПК, диагностировать которую ранее традиционными методами обследования не удалось. При этом непрозрачные среды не являются препятствием для детального проведения УБМ и ОКТ. Обе методики позволяют верифицировать изменения роговицы, равномерность и глубину передней камеры, уточнить наличие синехий и их протяженность, выявить иридодиализ. УБМ позволяет также верифицировать наличие ре- трокорнеальной и/или предрадужной мембраны, оценить состояние цилиарного тела, хрусталика или ИОЛ. Однако, степень снижения прозрачности роговицы при сосудистых бельмах 4–5 категории не позволила визуализировать данные структуры при помощи метода ОКТ. Таким образом, УБМ следует рассматривать как базовый по информативности метод диагностики самой различной патологии переднего отрезка глаза, включая патологию, связанную со вторичной глаукомой, при сосудистых бельмах 4–5 категории. Целесообразно включить данный метод в комплекс обследования пациентов с ожоговыми бельмами. Литература 1. Имшенецкая, Т. А. Оптическая когерентная томография переднего отрезка глаза у пациентов с язвенными поражениями и помутнениями роговицы / Т. А. Имшенецкая, Г. В. Ситник // Офтальмодиагностика. — 2007. — № 3. — С. 66–74. 2. Керимов, К. Т. Ожоги глаз: патогенез и лечение / К. Т. Керимов, А. И. Джафаров, Ф. С. Гахраманов. — М.: Изд-во РАМН, 2005. — 464 с. 3. Науменко, В. В. Отдаленные результаты одномоментных комбинированных вмешательств на глазах с бельмом и глаукомой / В. В. Науменко, Е. В. Томилова // Глаукома. — 2007. — № 1. — С. 38–43. 4. Пучковская, Н. А. Ожоги глаз / Н. А. Пучковская, С. А. Якименко, В. М. Непомящая. — М.: Медицина, 2001. — 272 с.: ил. 5. Слонимский, А. Ю. Глаукома и сквозная кератопластика / А. Ю. Слонимский // Глаукома. — 2004. — № 2. — С. 45–50. 6. Федоров, С. Н. Кератопротезирование / С. Н. Федоров, З. И. Мороз, В. К. Зуев. — М.: Медицина, 1982. — 144 с. С. А. Петров, Т. Н. Тезелашвили, С. А. Рухлова, Т. С. Клиндюк ДИСТРОФИЧЕСКИЕ ИЗМЕНЕНИЯ РОГОВИЦЫ ПРИ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЕ ГОУ ВПО «Тюменская государственная медицинская академия Минздравсоцразвития РФ», г. Тюмень По мнению А. П. Нестерова (2008), этиологическая и патогенетическая цепь первичной глаукомы складывается из нескольких звеньев: 1) генетические факторы, 2) изменения общего характера, 3) первичные местные функциональные и дистрофические изменения, 4) нарушения гидростатики и гидродинамики глаза, 5) повышение ВГД, 6) вторичные сосудистые расстройства, дистрофия и дегенерация тканей. B. Tengroth, T. Ammitzboll, изучая состав коллагена в трабекулярной ткани, решетчатой пластине и склере здоровых глаз больных глаукомой и с подозрением на нее, выявили различия в содержании в нем гидроксипролина, пролина, гидроксилизина — свидетельство наличия первичных дистрофических изменений в молекулах коллагена в заднем отрезке глазного яблока. Избыточное рубцевание после антиглаукомных операций показывает наличие местных трофических изменений в переднем отрезке глаза [Добрица Т. А., 1988; Захаров И. А., 1988; Краморенко Ю. С., 1992; Журавлева А. Н., 2007]. В. В. Волков (2001) среди причин развития дистрофических процессов при глаукоме важную роль уделяет апоптозу (атрофии) различных клеток глаза. В литературе приводятся некоторые факторы индукции апоптоза при глаукоме: повышение внутриглазного давления [Minckler D. S., Bunt A. H., 1977], уменьшение доставки к телу ганглиозной клетки сетчатки нейротрофических факторов [GarciaValenzuela E., Shareef S., Walsh J., 1995]. Апоптоз 194 в этом случае идентифицирован по следующим специфическим признакам: конденсации хроматина, дроблению геномной ДНК, обнаружению апоптозных телец [Quigley H. A., 1995; Negoescu A. Et al., 1998]. Безусловно, дистрофические процессы структур глазного яблока играют важную роль в формировании слепоты и инвалидизации от этого заболевания. При этом вопросам дистрофических изменений роговицы при глаукоме практически не уделяется никакого внимания. Решение данного вопроса позволит изучить новые аспекты патогенеза первичной глаукомы и расширят возможности для диагностики, профилактики и лечения этого заболевания. Цель — установление возможных дистрофических процессов переднего отрезка глазного яблока, в частности, эндотелия роговицы, при открытоугольной глаукоме (ОУГ). Материал и методы. Обследовано 50 человек (97 глаз) с различными стадиями первичной глаукомы в возрасте от 38 до 82 лет, в том числе мужчины составили 20 %, женщины — 80 %. Контрольная группа составила 12 человек (24 глаза). Офтальмологические методы исследования включали в себя клиническо-анамнестическое обследование, визометрию, периметрию, биомикроскопию, офтальмоскопию, рефрактометрию, определение цветоощущения, тонометрию, тонографию, гониоскопию. Для исследования количества эндотелиальных клеток, их плотности и размеров, толщины рогови- цы использовался метод зеркальной микроскопии с помощью эндотелиального микроскопа EM-3000 (Tomey, Япония), который позволяет проводить прижизненное исследование эндотелия роговицы. При этом пределяли форму и расположение эндотелиальных клеток. Количественный метод позволяет установить число клеток на единицу площади. Всех обследованных пациентов мы разделили на две группы: лица с клинические признаками вторичных иммунодефицитных состояний (ВИДС) — 9 чел. (18 %); лица без клинических проявлений ВИДС — 41 чел. (82 %). Статистическая обработка полученных результатов проводилась на ПЭВМ IBM/РС при помощи стандартных статистических пакетов «SPSS 11,5 for Windows» (среднее значение, дисперсия средних, непараметрическое сравнение по критерию Стьюдента, коэффициента корреляций Спирмена с определением коэффициентов ранговой корреляции, частотный анализ, многофакторный регрессивный анализ). Результаты и обсуждение. Установлено, что морфофункциональное состояние иммунной системы оказывает существенное влияние на состояние периферического зрения у пациентов с глаукомой, т. е. изменяет способность ориентироваться в пространстве (рис. 1). Так, в группе лиц с клиническими признаками ВИДС достоверно чаще встречается сужение полей зрения с височной и нижневисочной стороны, а в группе больных с первичной глаукомой без кли- Рис. 1. Характеристика полей зрения у лиц с первичной глаукомой в зависимости от наличия клинических признаков ВИДС 195 нических признаков ВИДС — с носовой стороны. Последнее является общеизвестным фактом при глаукоме. При этом у больных с ОУГ наблюдаются признаки, указывающие на наличие дистрофических процессов клеток эндотелия роговицы (табл.). Это выражается в уменьшении плотности эндотелиальных клеток в 1мм2 (cd/mm2: 2295,6±67,1 по сравнению с 2868,1±34,92 — в контроле). При этом средний размер анализируемых клеток был достоверно больше (avg/um2: 447,82±14,45 по сравнению с 349,83±4,13 — в контроле). Кроме этого, коэффициент вариации (cv) анализируемых эндотелиальных клеток, определяемый делением стандартного отклонения (sd) на средний размер (avg/um2), также был значительно больше (52,63±3,92 по сравнению с 40,25±0,97 — в контроле). При наличии признаков ВИДС у лиц с ОУГ наблюдается значимое уменьшение как размеров самой большой эндотелиальной клетки (max/um2: 1051,5±52,94 по сравнению с 1271,13±74,14 при p<0,05), так и самой маленькой (min/um2: 115,5±5,25 по сравнению с 142,26±6,61 при p<0,01). На рисунке 2 показано распределение размеров (Area) и формы (Apex) эндотелиальных клеток у пациентов с диагнозом ОУГ. Как видно из представленного рисунка, у пациентов с глаукомой наблюдается выраженный полиморфизм и плеоморфизм эндотелиальных клеток. При этом их средний размер преимущественно (71,75 %) составляет от 200 до 600 μm2, а по форме преобладают 5- и 6-угольные клетки (29,28±2,22 % и 32,28±2,6 % соответственно). Проведенный корреляционный анализ показал, что увеличение числа клеток, имеющих размер 400–500 μm2, сопряжено с увеличением внутриглазного давления (КК=0,58 при p<0,05). Выводы. Открытоугольная глаукома сопровождается развитием дистрофических процессов не только заднего отдела глазного яблока (зрительного нерва и сетчатки), но и роговой оболочки — уменьшается количество эндотелиальных клеток, разви- Морфологическая характеристика эндотелиальных клеток роговицы при ОУГ Показатели cd/mm2 avg/um2 sd cv max/um2 min/um2 40,25 984,92 117,67 Контрольная группа, n=24 Mean (M) 2868,1 Std. Error of Mean (m) Std. Deviation 349,83 140,8 34,92 4,13 4,32 0,97 39,05 3,95 171,08 20,23 21,2 4,76 191,29 19,37 Minimum 2616 307 116 34 704 88 Maximum 3257 382 174 48 1422 160 ОУГ, n=25 Mean (M) Std. Error of Mean (m) Std. Deviation Minimum 2295,6 447,82 231,13 52,63 1256,77 140,86 67,1 14,45 20,98 3,92 96,55 8,1 335,49 67,77 102,76 19,19 452,86 37,99 1779 340 119 30 698 83 Maximum 2945 562 529 100 2444 221 Достоверность различия (p) 0,001 0,001 0,001 0,001 0,01 0,001 Area Apex Рис. 2. Распределения размеров и формы клеток при ОУГ, % 196 вается выраженный полиморфизм и плеоморфизм, дистрофических изменений структур глаза зависит что прямо пропорционально коррелирует с повы- от морфофункционального состояния иммунной сишением внутриглазного давления. Выраженность стемы. В. М. Петухов, Л. Г. Сеннова Дифференцированный подход к местной гипотензивной терапии при первичной открытоугольной глаукоме ГОУ ВПО «Самарский государственный медицинский университет» Минздравсоцразвития России, кафедра глазных болезней ИПО, г. Самара Проблема лечения больных первичной открытоугольной глаукомой не утратила своей актуальности, несмотря на все достижения последних десятилетий в вопросах медикаментозного, лазерного и микрохирургического лечения, поскольку до настоящего времени эта патология органа зрения является наиболее частой причиной слепоты и инвалидности. Основополагающим фактором стабилизации глаукоматозного процесса и соответственно сохранения зрительных функций является нормализация внутриглазного давления и восстановление до физиологических значений показателей гидро- и гемодинамики. Однако, в пресбиопическом возрасте, когда нарушается функция аккомодации, создаются предпосылки для развития целого ряда заболеваний дистрофического характера, одним из которых является первичная открытоугольная глаукома. Одним из основных факторов риска возникновения глаукоматозной оптической нейропатии, на который ориентированы врачи поликлинического звена, является повышенное внутриглазное давления (ВГД). Непосредственной причиной его повышения является ухудшение оттока внутриглазной жидкости, в основе которого лежат изменения дренажной системы глаза [2]. Подбор местной гипотензивной терапии — первый этап в лечении больных глаукомой и он индивидуален для каждого больного [1]. В распоряжении врача — офтальмолога большой арсенал гипотензивных препаратов, однако, при выборе того или иного препарата необходимо учитывать уровень ВГД, характер изменений угла передней камеры (УПК), стадию глаукоматозного процесса, возраст, сопутствующую сосудистую патологию. Цель — разработка дифференцированного подхода к назначению местной гипотензивной терапии больным первичной открытоугольной глаукомой в зависимости от уровня ВГД и данных гониоскопии. Материал и методы. Исследованы три группы больных — 328 пациентов с разным режимом миотиков. Всем проводилось стандартное обследование, включающее визометрию, статическую и кинетическую периметрию, прямую офтальмоскопию, гониоскопию, тонографию, тонометрию по Маклакову. Результаты и обсуждение. Первую группу составили 117 больных (190 глаз), получающих монотерапию — ксалатан или траватан на ночь в течение нескольких месяцев — двух лет. Средний возраст пациентов — 62±2,5 года. Общая сопутствующая патология отмечена у 42 больных (гипертоническая болезнь, ИБС). В основном, это были больные с начальной стадией глаукомы — 89 глаз (46,8 %) и развитой — 101 глаз (53,2 %). Исходное ВГД составило 29,7±0,5 мм рт. ст. При гониоскопии отмечено, что угол передней камеры открыт, широкий, с неравномерной, слабовыраженной эндогенной пигментацией и очаговой атрофией корня радужной оболочки. В результате местной гипотензивной терапии ВГД снизилось до 20,0±0,9 мм рт. ст. Во вторую группу вошли 129 больных (197 глаз), которым были назначены ß-адреноблокаторы (бетоптик или арутимол) 2 раза в день, а на ночь ксалатан или траватан, от нескольких месяцев до двух лет. Средний возраст соответствовал 65±2,1 лет. В этой группе больных чаще отмечалась общая сосудистая патология; гипертоническая болезнь (62), ИБС (7), сахарный диабет (8). Начальная стадия глаукомы установлена на 42 глазах (21,3 %), развитая — на 93 (47,2 %), далекозашедшая — на 62 глазах (31,5 %). Исходное ВГД было выше, чем в пер- 197 вой группе больных и составило 30,5±0,5 мм рт. ст. Гониоскопическая картина УПК была аналогична таковой в первой группе больных, однако, эндогенная пигментация была более выраженной и равномерной. В результате лечения ВГД снизилось до 22,5±0,4 мм рт. ст. В третью группу вошли 82 больных (135 глаз), получающих максимальный режим миотиков: фотил два раза в день и ксалатан или траватан на ночь в течение нескольких месяцев. Средний возраст больных — 69,0±2,3 лет, чаще отмечалась общая сосудистая патология: гипертоническая болезнь, ИБС — у 57 больных, сахарный диабет — у 6 больных, гинерализованный атеросклероз — у 6 больных. Что касается стадии глаукомы, то в данной группе преобладали развитая стадия на 81 глазах (60 %), далекозашедшая — на 54 глазах (40 %). До лечения среднее ВГД составило 34,6±0,5 мм рт. ст. При гониоскопии отмечено, что УПК клювовидного профиля, узкий, при гониокомпрессии открывался до склеральной шпоры, выраженная эндогенная пигментация. После местной гипотензивной терапии ВГД снизилось до 24,3±0,6 мм рт. ст. Выводы. Монотерапия препаратами ксалатан или траватан эффективна при открытом УПК и слабо выраженной пигментации элементов дренажной зоны глаза, при исходном уровне ВГД не более 31 мм рт. ст., в основном при начальной и развитой стадиях заболевания. При исходном уровне ВГД 32–35 мм рт. ст. и выраженной эндогенной пигментации трабекулы наиболее эффективно сочетание ß-адреноблокаторов с ксалатаном или траватаном. При исходном ВГД более 35 мм рт. ст. и клювовидном профиле УПК показано назначение комбинированных препаратов: фотил и ксалатан. Литература 1. Еричев, В. П. Современные принципы гипотензивной терапии глаукомы / В. П. Еричев // Глаукома: реальность и перспективы: cб. науч. тр. — М., 2008. — С. 220–223. 2. Нестеров, А. П. Глаукома / А. П. Нестеров. — М., 2008. — 350 с. 3. Национальное руководство по глаукоме. — М., 2011. Е. С. Пшеницына Улучшение гемодинамики и гидродинамики глаза под влиянием отдельных физиотерапевтических факторов ГОУ ВПО «СамГМУ Минздравсоцразвития России», г. Самара В структуре первичной инвалидности в России доля пациентов, страдающих глаукомой, и имеющих стойкую необратимую утрату зрительных функций вследствие указанного заболевания, увеличилась более чем в два раза [6]. Поэтому разработка инновационных методов в комплексном лечении первичной открытоугольной глаукомы становится одним из приоритетных направлений терапевтической офтальмологии. Значительное количество исследований последних лет свидетельствуют о важности сосудистых факторов риска развития и прогрессирования глаукомы [1, 3, 4]. Поэтому изучение влияния отдельных физиотерапевтических факторов на общую гемодинамику организма человека и, в частности, на гемодинамику и гидродинамику глазного яблока, возможно считать актуальной проблемой. Инновационной разработкой в этом направлении стали научные достижения коллектива ученых Самарского государственного медицинского университета под руководством академика РАМН, лауреата Государственной премии, лауреата премии Правительства РФ, заслуженного деятеля науки РФ, профессора Г. П. Котельникова, предложивших новый физиотерапевтический фактор лечения — повышенную гравитацию [5]. Цель — изучение влияния повышенной гравитации при воздействии на пациента центробежными силами в краниокаудальном направлении на состояние гемодинамики и гидродинамики глазного яблока при отсутствии его патологии, определению корреляционной связи гемодинамики общей сонной артерии и гидродинамики глаза. Материал и методы. Обследованная нами группа состояла из 19 человек (15 мужчин и 4 женщины), 198 не страдавших заболеваниями глаза и его придаточного аппарата, в возрасте от 42 до 65 лет, с травмами опорно-двигательного аппарата, в комплексном лечении которых использовалась гравитационная терапия. Перед началом сеансов гравитационной терапии у пациентов собирался офтальмологический анамнез, включающий и семейный анамнез. Всем обследуемым проводилось определение остроты зрения вдаль и вблизи без коррекции и с коррекцией, выполнялся наружный осмотр, осмотр переднего отдела глаза и оптических сред, офтальмоскопия. Возрастные изменения рефракции (пресбиопия), а также признаки начальной возрастной катаракты (помутнения периферических отделов хрусталика) расценивались нами как нормальное состояние глаза, позволяющее включить пациента в группу, планируемую нами как контрольную. Пациенты получали курс лечения гравитационной терапии, состоящий из 5–10 сеансов. Физиотерапевтическая процедура проводилась ежедневно. Каждый сеанс продолжался в течение 10 минут. Скорость вращения составляла 33 об. мин. на первых процедурах с последующим ее увеличение до 42 об. мин. Направление вращения пациента — по часовой стрелке, против часовой стрелки — чередовалось при отсутствии отмечаемой пациентом разницы в субъективных ощущениях при изменении направления вращения. Если пациент отмечал при вращении в какую-либо из сторон более комфортное состояние, то именно это направление вращения сохранялось в течение всего курса лечения. Тонометрия и тонография обоих глаз была проведена всем пациентам до и после курса сеансов гравитационной терапии. Проводилось исследование [2] влияния сеансов гравитационной терапии на объемную скорость кровотока и индекс регионарной перфузии на общих сонных артериях. При этом обнаружено незначительное увеличение показателей объемной скорости кровотока и статистически достоверное увеличение индекса регионарной перфузии. Результаты и обсуждение. При выполнении исследований мы установили снижение внутриглазного давления на обоих глазах за счет активации оттока внутриглазной жидкости. Степень активации оттока не зависела от направления вращения пациента. Коэффициент легкости оттока возрастал и достигал максимальных величин к 5–6 процедуре. Затем этот показатель оставался стабильно сниженным. По результатам проведенного нами исследования получен патент на изобретение «Способ снижения внутриглазного давления» (Г. П. Котельников, Е. С. Пшеницына, 2009). Выводы. Включение в комплексное лечение пациентов с первичной открытоугольной глаукомой курсов гравитационной терапии даст возможность улучшить показатели гемодинамики глаза, активизировать отток внутриглазной жидкости и приблизить показатели внутриглазного давления к толерантному уровню. Улучшение перечисленных показателей даст возможность стабилизировать зрительные функции пациентов (как центральное, так и периферическое зрение) на более длительные сроки. Литература 1. Алексеев, В. Н. Роль индивидуального ВГД в прогнозе развития ПОУГ / В. Н. Алексеев // Глаукома. — 2009. — № 1. — С. 9–11. 2. Галкин, Р. А. Гравитационная терапия в лечении больных облитерирующими заболеваниями артерий нижних конечностей / Р. А. Галкин, И. В. Макаров. — Самара, 2006. — 198 с. 3. Зимина, М. Г. Показатели внутриглазного кровотока у больных с открытоугольной глаукомой в Забайкальском крае / М. Г. Зимина, К. А. Деревцова, Л. А. Голубина // Сб. науч. тр. конф. «Глаукома: теория и практика». — СПб., 2011. — С. 29–31. 4. Козлова, И. В. Показатели гемодинамических нарушений при глаукоматозной оптической нейропатии / И. В. Козлова // Мат-лы IХ съезда офтальмологов России. — 2010. — С. 156. 5. Котельников, Г. П. Гравитационная терапия / Г. П. Котельников, А. В. Яшков. — М., 2003. — 227 с. 6. Либман, Е. С. Эпидемиологическая характеристика глаукомы / Е. С. Либман // Глаукома. — 2009. — № 1. — С. 2–3. 199 Т. В. Рязанцева, Г. Н. Маслякова, Л. И. Кравец 1 Экспериментальное обоснование применения нового эксплантодренажа с наноструктурированной поверхностью при антиглаукоматозных операциях ГОУ ВПО «Саратовский ГМУ им. В. И. Разумовского», г. Саратов 1 Объединенный институт ядерных исследований, г. Дубна Наноструктурирование поверхности (НСП) материалов и нанокомпозитныенсистемы на их основе являются отдельным классом наноматериалов. Управляя параметрами НСП (энергия, состав и рельеф поверхности) можно предавать материалам совершенно новые функциональные характеристики. Формирование НСП является одним из наиболее оправданных подходов к решению основной задачи медицинского материаловедения — созданию материалов с заданными биомедицинскими характеристиками. В связи с этим мы решили использовать эти возможности в клинической практике. Хорошо известно, что хирургия рефрактерной глаукомы часто оказывается неэффективной из-за интенсивного рубцевания и быстрой облитерации вновь созданных путей оттока внутриглазной жидкости. Сохранность гипотензивного эффекта обеспечивается имплантацией различных дренажей. На сегодняшний день наибольшее распространение получили дренажи из полимерных материалов медицинского класса чистоты — эксплантодренажи. Современные нанотехнологии делают возможным наноструктурирование поверхностного слоя полимерных материалов посредством обработки в плазме неполимеризующихся газов. В связи с этим нам представилось актуальным продолжить поиск более совершенных полимерных эксплантодренажей именно в этом направлении. Цель — исследовать местное действие нового полимерного наноструктурированного дренажа на живую ткань на макро- и микроскопическом уровнях. Материал и методы. Исследовалась реакция на дренажи (24 образца), представляющие собой трековые мембраны толщиной 10 мкм из поликарбоната и полиэтилентерефталата с наноструктурированной поверхностью, которая достигалась обработкой в плазме азота, воздуха или кислорода при давлении газа в вакуумной камере от 0,06 до 0,35 торр и мощности разряда от 200 до 440 Ватт. Диаметр пор мембран варьировал от 0,2 до 0,4 мкм. Наноструктурирование поверхности дренажа привело к развитию шероховатости поверхности и увеличению содержания карбоксильных групп в поверхностном слое. Последнее в свою очередь обусловило повышение отрицательного заряда поверхности мембран. Оба эти качества в дальнейшем способствовали уменьшению адсорбции белков — клеток крови, экссудата на поверхности дренажа. Данный результат обусловлен отталкиванием молекул белков, имеющих также отрицательный заряд. Антибактериальная активность трековых мембран исследовалась по стандартной методике с использованием штаммов грамположительного Staphylococcus aureus и грамотрицательного Pseudomonas aeruginosa. В качестве методики in vivo был использован метод интраокулярной имплантации фрагментов эксплантодренажа размером 1×3 мм в переднюю камеру 10 кроликов породы шиншилла. Антиглаукоматозное вмешательство проводилось с имплантацией дренажа у 30 кроликов породы шиншилла (30 глаз). Для моделирования глаукомы нами был выбран способ, описанный Ю. А. Чеглаковым (1989). Введение 1 % раствора Януса зеленого в переднюю камеру глаза приводит к развитию вторичной глаукомы в течение одного месяца. При гистологическом исследовании серийные срезы глаз окрашивали гематоксилин — эозином и по Ван-Гизон. Результаты и обсуждение. При клиническом наблюдении за глазами экспериментальных животных воспалительная реакция по шкале Л. С. Чабровой соответствовала 0 и 1 степени воспаления. Воспалительная реакция полностью купировалась на 7 день на фоне стандартного противовоспалительного лечения. Во всех случаях определялись плоские разлитые фильтрационные подушечки. Слизистая обо- 200 лочка над фильтрационной подушкой была хорошо васкуляризирована. Не было выявлено избыточного рубцевания или формирования псевдокистозных полостей. Спустя две недели уровень внутриглазного давления составил 17,6±2,6 мм рт. ст. Эта тенденция сохранялась в течение 12 месяцев. Анализ показал, что наибольшая бактерицидная активность выявлена у образцов, имеющих максимально развитый рельеф. Корреляция результатов исследования заряда и анализ данных позволяют утверждать, что один из механизмов, по которому протекает взаимодействие наноструктурированной поверхности с микроорганизмами, связан с электростатическим взаимодействием, а интенсивность второго механизма связана со степенью дисперсности наноструктурированной поверхности. При морфологическом исследовании через 2 недели определялась умеренная клеточная реакция в ткани, окружающей дренаж, отсутствовали выраженные реактивные воспалительные изменения. Через 4 недели вокруг дренажа сформировалась тончайшая соединительно-тканная капсула с единичными фибробластами и фиброцитами. В случаях имплантации дренажей, обработанных в плазме кислорода, между имплантатом и склерой капсула отсутствовала, определялись единичные участки нежной волокнистой соединительной ткани и свободное пространство между дренажом и склерой на всем протяжении. Инфильтрация гистиоцитами и единичными фибробластами была слабо выражена. Через 1 год после имплантации признаков биодеструкции не обнаружено. Дренаж сохранял свои функциональные свойства. Выводы. Предлагаемый дренаж не обладает местно-раздражающим, сенсибилизирующим действием и соответствует требованиям, предъявляемым к изделиям, постоянно контактирующим с внутренней средой глаза. Имплантация полимерного наноструктурированного эксплантодренажа позволяет добиться стойкой нормализации ВГД и длительного сохранения сформированных путей оттока внутриглазной жидкости. А. В. Терещенко, Ю. А. Белый, И. А. Молоткова, Е. В. Ерохина ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ С ПРИМЕНЕНИЕМ Т-ОБРАЗНОГО ДРЕНАЖА Калужский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова», г. Калуга В современной офтальмохирургии существует немало способов, направленных на предупреждение избыточного рубцевания вновь созданных в ходе антиглаукоматозных операций путей оттока внутриглазной жидкости. Широкое распространение получили различные дренажи из биологических и синтетических материалов. Однако эффективность антиглаукоматозной операции часто снижается из-за развития грубой соединительнотканной капсулы вокруг дренажа и облитерации вновь сформированных путей оттока. Данное обстоятельство объясняет актуальность поиска новых материалов, а также методик имплантаций дренажей на этапе непроникающей глубокой склерэктомии (НГСЭ) и микроинвазивной НГСЭ (МНГСЭ) в лечении первичной открытоугольной глаукомы (ПОУГ). Цель — оценка эффективности применения Т-образного гидрогелевого дренажа в модификации микроинвазивной непроникающей хирургии первичной открытоугольной глаукомы. Материал и методы. Клинические исследования включали 15 пациентов (15 глаз) с ПОУГ, которые были разделены на 2 группы. В основной группе МНГСЭ по модифицированной методике с имплантацией Т-образного дренажа выполнили 8 пациентам (8 глаз) с ПОУГ различных стадий: 1 стадия — 3 глаза, 2 стадия — 2 глаза, 3 стадия — 3 глаза. В контрольной группе МНГСЭ с имплантацией прямоугольного дренажа выполнили 7 пациентам (7 глаз) с ПОУГ, из них с 1 стадией — 2 глаза, со 2 стадией — 3 глаза и с 3 стадией — 2 глаза. Пациентам обеих групп проводили стандартные офтальмологические исследования. С целью исключения реактивных изменений сосудистой оболочки в раннем послеоперационном периоде всем больным проводили В-сканирование на приборе «UltraScan» (Alcon, США). 201 Контроль за состоянием процессов регенерации тканей дренажного пути в послеоперационном периоде осуществляли при помощи ультразвуковой биомикроскопии (УБМ), выполняемой на приборе «Paradigm- P60» (Humphrey, США) с частотой датчика 50 мГц, осевым и поперечным разрешением 50 мкм, проникающей способностью 5 мм. УБМ проводили на 7 и 14 сутки раннего послеоперационного периода, а также в сроки 1, 3 и 6 месяцев. Техника операции. Разрез конъюнктивы выполняли от лимба длиной 2 мм на 12 часах, отсепаровывали эписклеру, проводили щадящий гемостаз. Поверхностный склеральный лоскут выкраивали размером 1,5 х 2,5 мм, причем в основной группе глубина его составляла ⅓ склеры, а в контрольной — ⅔, как при традиционной методике. Лоскут отсепаровывали с заходом на 0,7–1,0 мм в прозрачные слои роговицы. Формировали и отсепаровывали глубокий склеральный лоскут с сохранением тонкой полоски склеры над сосудистой оболочкой и с обнажением десцеметовой мембраны в области роговицы, который затем отсекали. Далее пинцетом удаляли наружную стенку Шлеммова канала и получали фильтрацию внутриглазной жидкости, оценку интенсивности фильтрации проводили тупфером. Протяженность фильтрационной зоны трабекулодесцеметовой мембраны составляла 1,0 мм. У основания склерального лоскута тонкий слой склеры иссекали до хориоидеи. Этап имплантации дренажа имел различия по группам. У пациентов основной группы у дистального основания склерального лоскута продолжали перпендикулярный разрез склеры в обе стороны на 0,5 мм и формировали карманы в виде перевернутой буквы «Т» глубиной на 3/4 склеры до обнажения тонкого глубокого листка склеры над хориоидеей. Далее из гидрогелевой имплантной заготовки моделировали Т-образный дренаж. Количественные характеристики дренажа: длина — 2,5 мм, толщина — 0,3 мм, размеры горизонтальной части — 2,0 х 0,5 мм, вертикальной — 1,5 х 1,0 мм. Полученный дренаж укладывали в сформированное склеральное ложе и не фиксировали. Дренаж удерживался в ложе за счет шовной фиксации к слоям склеры поверхностного склерального лоскута, укладываемого на место. Конъюнктиву ушивали двумя узловыми швами. В контрольной группе в сформированном интрасклеральном ложе подшивали одним узловым швом гидрогелевый дренаж прямоугольной формы размерами 1,0 х 2,5 х 0,4 мм. Поверхностный скле- ральный лоскут укладывали на место и не фиксировали к склере. На конъюнктиву накладывали два узловых шва. Результаты и обсуждение. В первые сутки после операции у пациентов обеих клинических групп при осмотре визуализировалась фильтрационная подушечка (ФП) без признаков воспаления. Значительно выраженной ФП, тем более кистозно-измененной, не было отмечено ни в одном случае в сроки наблюдения до 8 месяцев. В раннем послеоперационном периоде уровень ВГД соответствовал умеренно выраженной гипотонии — 12–14 мм рт. ст. В последующие 3 месяца ВГД оставалось в пределах 19–22 мм рт. ст. у пациентов обеих клинических групп. В сроки до 6 месяцев у пациентов основной клинической группы ВГД диагностировали в пределах 21–23 мм рт. ст., а у 2 пациентов контрольной группы оно повысилось до 25 мм рт. ст., что потребовало применения медикаментозной терапии с последующей ЙАГ-лазерной десцеметогониопунктурой (ДГП). По данным В-сканирования, на 3 сутки в одном случае в основой группе и 2 случаях в контрольной отмечалась реакция сосудистой оболочки в виде умеренно выраженного отека, не проявляющая себя клинически и купировавшаяся медикаментозно. По данным УБМ, на 7 и 14 сутки после операции у всех исследуемых пациентов определялась хорошо выраженная фильтрационная подушка, высота которой колебалась в диапазоне 0,6–0,8 мм. ФП имела неоднородную акустическую плотность при выраженной гипоэхогенной структуре. Контур склерального лоскута был размытым за счет низкой акустической плотности. В основной группе его толщина варьировала в пределах 0,15–0,2 мм, в контрольной — 0,3–0,37 мм. Интрасклеральная полость (ИСП) на всех сканограммах имела комбинированную локализацию. Ее высота колебалась в пределах 0,4–0,6 мм. В дистальной части ИСП отмечалось небольшое количество пристеночных включений низкой акустической плотности. Дренаж определялся в виде гиперэхогенной линейной структуры, занимал стабильное положение в ИСП. ТДМ во всех случаях имела низкую акустическую плотность и линейный профиль, толщина ее не превышала 0,09 мм. Хорошо определялись следовые тоннели, огибающие склеральный лоскут. Однако в основной группе они были более выражены и переходили в субконъюнктивальные анэхогенные полости в дистальной части операционной зоны. 202 В сроки 1–3 месяца в основной группе ФП была более выражена (0,72–1,0 мм), чем в контрольной (0,58–0,86 мм) и отличалась гипоэхогенностью и неоднородностью структуры. Склеральный лоскут приобрел более четкий контур за счет увеличения акустической плотности, увеличилась и его толщина: до 0,20–0,25 мм в основной группе и до 0,35–0,40 мм в контрольной. Параметры ИСП и ТДМ не изменялись, отмечалось незначительное увеличение акустической плотности ТДМ. В ИСП отмечалось стабильное положение дренажа без выраженных признаков склерального сращения с поверхностным лоскутом на всем протяжении. Дислокации и прорезывания дренажей из-под конъюнктивы не наблюдалось ни в одном случае. Следовые тоннели определялись более четко. В основной группе сохранялись анэхогенные полости в дистальной части операционной зоны с небольшим количеством гипоэхогенных пристеночных включений. В срок 6 месяцев у пациентов основной группы происходило незначительное уменьшение высоты ФП (до 0,5–0,7 мм) и ее акустической плотности. Отмечалось также увеличение акустической плотности склерального лоскута без увеличения толщины. ИСП во всех случаях сохраняла комбинированную локализацию, умеренно выраженную высоту (0,4–0,5 мм) и низкую акустическую плотность содержимого. Формирования оптически плотной ткани не наблюдалось на всем протяжении Т-образного дренажа. Хорошо определялись следовые тоннели и полости в дистальной части дренажной зоны. ТДМ сохраняла нормальные параметры, умеренную акустическую плотность и линейный профиль во всех случаях. У пациентов контрольной группы в срок 6 месяцев наблюдалось более выраженное уменьшение ФП (до 0,32–0,5 мм) и высоты ИСП (до 0,2–0,35 мм). ИСП сохраняла комбинированную локализацию, однако, в ней происходило увеличение включений и их акустической плотности, что связано с развитием соединительной ткани. В одном случае ИСП была заполнена акустически плотными структурами на ⅔. В 2 случаях наблюдалось утолщение ТДМ до 0,11–0,13 мм и втягивание ее в ИСП. Клинически у этих пациентов отмечено повышение ВГД, потребовавшее медикаментозной коррекции с последующей ЙАГ-лазерной ДГП. Выводы. Предложенная методика проста в техническом исполнении, не требует дополнительных материальных затрат, имеет хороший клинический эффект и, наряду с другими антиглаукоматозными операциями, может применяться в микроинвазивной непроникающей хирургии глаукомы. Р. Р. Файзрахманов, Н. А. Собянин 1 ВЛИЯНИЕ ЦЕНТРАЛЬНОЙ ТОЛЩИНЫ РОГОВИЦЫ НА ВНУТРИГЛАЗНОЕ ДАВЛЕНИЕ В НОРМЕ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа, 1 МУЗ «Городская клиническая больница № 2», г. Пермь На сегодняшний день глаукома является основной причиной необратимой слепоты во всем мире. Поэтому исследования многих офтальмологов посвящены этой проблеме [5, 6]. В последнее время большое значение уделяется корреляции внутриглазного давления (ВГД) и центральной толщины роговицы (ЦТР) [1, 2, 10]. Такая зависимость учитывается при определении «давления цели» [4]. Часто ЦТР играет важную роль при постановке диагноза первичная глаукома, так как прямо влияет на параметры напряжения роговой оболочки глаза. Недостаточность учета фактора напряжения приводит к ошибочному диагностированию глаукомы с одной стороны и/или неполной диагностики заболевания с другой стороны [7, 8]. Это может сопровождаться необоснованным назначением гипотензивной терапии лицам с высокими показателями пахиметрии и наоборот, отсутствием гипотензивного лечения при низких показателях пахиметрии. Ключевым моментом является индивидуальная корреляция ВГД и напряжения оболочек глаза. В работах Алексеева В. Н. отражена цифровая зависимость офтальмотонуса от ЦТР в здоровой популяции [3]. Учитывая определенную зависимость ВГД от ЦТР, не исключена прямая математическая закономерность этих параметров. Подобные изменения теоретически наиболее оптимально можно бы было проследить у одного и того же индивидуума при ис- 203 кусственном изменении толщины роговой оболочки. На практике это можно сделать при проведении рефракционной операции, основанной на процессе кератомилеза. Подобное исследование позволит выявить роль роговицы в поддержании тургора глаза. Актуальность данной разработки основывается на отсутствии данных нормального ВГД при той или иной толщине роговицы в каждом случае отдельно. Цель — определение математической зависимости изменения офтальмотонуса и толщины роговицы в здоровой популяции. Материал и методы. Проведен ретроспективный анализ карт 425 пациентов (500 глаз). Средний возраст составил 20±7 лет. Всем пациентам проведена рефракционная операция по коррекции миопии методом LASIK. Всем пациентам проведены стандартные методы исследования (визометрия, компьютерная периметрия, биомикроофтальмоскопия). Толщина роговицы определялась с помощью ультразвукового пахиметра (TOMY) по общепринятой методике в 5 точках (в центре и на периферии). Всем пациентам до и после операции проводилось измерение ВГД методом пневмотонометрии (KOWA, KT500) и аппланационной тонометрии по Маклакову. Пациенты подобраны таким образом, что рефракционная операция проводилась только по коррекции сферы, без затрагивания астигматического компонента. Сформированы следующие группы по данным пахиметрии: 1 группа — толщина роговицы менее 450 мкм, 2 группа — толщина роговицы от 450 до 500 мкм, 3 группа — толщина роговицы от 501 до 550 мкм, 4 группа — толщина роговицы от 551 до 600 мкм, 5 группа — толщина роговицы более 601 мкм. Каждая группа включала по 100 наблюдений. Алгоритм исследования. Сбор данных тонометрии до рефракционной операции. Сбор данных тонометрии после рефракционной операции. Сравнительный анализ в зависимости от зоны абляции. Анализ изменения ВГД при снижении тургора роговицы по остаточной величине. Отражение зависимости ВГД от данных пахиметрии в математической форме. Результаты и обсуждение. При суммарном исследовании всех групп выявлено, что при уменьшении толщины роговицы на 1 мкм ВГД уменьшается на 0,03265±0,00047 мм рт. ст (VΣ). Измерение величины VΣ проводили следующим образом: ции, R — толщина удаляемой части стромы роговицы. При вычислении VΣ разграничение по группам не проводили. При нормальном функционировании дренажной системы глазного яблока, можно предположить, что 1 мкм стромальной части роговицы удерживает ВГД до величины, равной VΣ, т. е. VΣ — теоретическое внутриглазное давление при толщине роговицы в 1 мкм. Анализ ВГД в каждой группе проводился при специфической выборке по данным пахиметрии. Для этого рассчитывалась величина V(1–5) для каждой группы индивидуально с перерасчетом на толщину роговицы исследуемой группы. Для сравнительной оценки и определения закономерности изменения ВГД проводилась оценка относительно величины VΣ. Подобный сравнительный анализ отражает вид прогрессии при изменении толщины роговицы. Перерасчет VΣ в каждой группе проводился в зависимости от данных пахиметрии (VΣp). При условии, что VΣ — показатель ВГД при толщине роговицы в 1 мкм, то VΣp — показатель ВГД с заданной толщиной роговицы. Измерение величины VΣp проводили следующим образом: , где Р — толщина роговицы в определенной группе. В 1-й группе ВГД (V1) соответствовало — 14,853 мм рт. ст. При перерасчете VΣp изменение составляло менее 14,693 мм рт. ст. Во 2-й группе ВГД (V2) соответствовало 15,144– 16,523 мм рт. ст. При перерасчете VΣp изменение составляло 14,927–16,327 мм рт. ст. В 3-й группе ВГД (V3) соответствовало 16,292– 17,582 мм рт. ст. При перерасчете VΣp изменение составляло 16,533–17,959 мм рт. ст. Во 4-й группе ВГД (V4) соответствовало 17,368– 19,274 мм рт. ст. При перерасчете VΣp изменение составляло 17,839–19,591 мм рт. ст. Во 5-й группе ВГД (V 5) соответствовало 21,458 мм рт. ст. При перерасчете VΣp изменение составляло более 21,224 мм рт. ст. При сравнении показателей V1–5 и VΣp статистических различий в одноименных группах не выявлено (p<0,05). При построении зависимости V1–5 от показателя Р определяется линейная зависимость, что определяет корреляцию ВГД и ЦТР кратную VΣ , (0,03265). где ВГД1 — внутриглазное давление до операции, Подобная геометрическая прогрессия отражаВГД2 — внутриглазное давление после опера- ет сущность изменения ВГД при разной толщине 204 роговицы, что позволят прогнозировать возможность появления глаукомы с низким давлением, когда индивидуальное ВГД укладывается в среднестатистическую норму. Так при повышении ВГД в 5-й группе на 10 мм рт. ст. появляются явные тонометрические признаки офтальмогипертензии (31,5 мм рт. ст.). При повышении ВГД в 1-й группе на эту же величину (24,9 мм рт. ст.) тонометрические признаки офтальмогипертензии будут отсутствовать, несмотря на то, что ДЗН будет претерпевать изменения, аналогичные подобному случаю в 5-й группе. Полученные нами данные позволяют выявить формулу определения ВГД при заданной толщине роговицы (VΣp = VΣ ∙ P) или При нормальном функционировании дренажной системы глазного яблока ВГД пациента, полученное методом аппланационной тонометрии, должно быть не больше ВГДт. Это связано с тем, что ВГДт — допустимый индивидуальный уровень офтальмотонуса при определенной ЦТР. Если ВГД определенного индивидуума больше ВГДт, то необходимо исключать глаукому или офтальмогипертензию, так как напряжение оболочек глаза в конкретном случае выше, чем оно должно быть при данной ЦТР. Это может быть косвенным отражением нарушения функционирования дренажной системы глаза. Выводы: 1. Определена линейная зависимость офтальмотонуса от толщины роговицы. , 2. Математически зависимость выражается геогде ВГДт — индивидуальное внутриглазное давле- метрической прогрессией с шагом 0,03265. ние при определенной толщине роговицы (тео3. Получена формула расчета индивидуальноретическая величина), ЦТР — толщина рогови- го внутриглазного давления в зависимости от ценцы у конкретного пациента. тральной толщины роговицы. Литература 1. Аветисов, С. Э. Возможное влияние толщины роговицы на показатель внутриглазного давления / С. Э. Аветисов, С. Ю. Петров, И. А. Бубнова, К. С. Аветисов // Сб. тр. конф. «Современные методы диагностики и лечения заболеваний роговицы и склеры». — М., 2007. — С. 240–242. 2. Аветисов, С. Э. Исследование влияния биомеханических свойств роговицы на показатели тонометрии / С. Э. Аветисов, И. А. Бубнова, А. А. Антонов // Бюллетень со РАМН. — 2009. — № 4 (138). — С. 30–33. 3. Алексеев, В. Н. Влияние толщины роговицы на уровень внутриглазного давления и прогноз при первичной открытоугольной глаукоме / В. Н. Алексеев, И. Б. Литвин // Русский медицинский журнал. Клин. офтальмол: Глаукома. — 2008. — Т. 9. — № 4. — С. 23–24. 4. Алексеев, В. Н. К вопросу о методиках определения давления цели / В. Н. Алексеев, Т. Г. Лобова // Глаукома: проблемы и решения: Всероссийская науч.-практ. конф.: сб. науч. ст. — М., 2004. — С. 19–21. 5. Либман, Е. С. Современные позиции клинико-социальной офтальмологии / Е. С. Либман // Вестн. офтальмол. — 2004. — Т. 120. — № 1. — С. 10–12. 6. Нестеров, А. П. Первичная открытоугольная глаукома: диагностика и мониторинг / А. П. Нестеров // III Всерос. школа офтальмолога: сб. науч. тр. — М., 2004. — С. 10–15. 7. Kruse-Hansen, F., Ehlers, N. // Acta Ophthalmol. — 1971. — Vol. 9. — P. 775–778. 8. Hansen, F. K. // Acta Ophthalmol. — 1971. — Vol. 49. — P. 82–89. 9. Iliev, M. E., Goldblum D., Katsoulis K. et al. // Br. J. Ophthalmol. — 2006. — Vol. 90. — № 7. — P. 833–835. 10.Montes-Mico, R., Charman, W. N. // Ophthalmic. Physiol. Opt. — 2001. — Vol. 21. — P. 228–235. Х. Г. Файзуллина ЭФФЕКТИВНОСТЬ КОНСЕРВАТИВНОГО ЛЕЧЕНИЯ БОЛЬНЫХ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМОЙ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Заболеваемость первичной открытоугольной глаукомы в Республике Башкортостан составляет в среднем 10,9 на 10000 населения у лиц старше 40 лет. В структуре первичной инвалидности от гла- укомы отмечается тенденция к увеличению её доли с 24,6 % в 2002 г. до 39,5 % в 2008 г. [5]. Поэтому актуальным является исследование различных способов лечения глаукомы. Среди клинических форм за- 205 болевания на первичную открытоугольную глаукому (ПОУГ) приходится до 72 % всех случаев глаукомы. Наличие высокого внутриглазного давления (ВГД) ведёт к развитию глаукомной оптической нейропатии и снижению зрения. Применение адекватного гипотензивного лечения уменьшает риск развития и прогрессирования ПОУГ. В традиционном алгоритме комплексного лечения первичной глаукомы местным гипотензивным препаратам придается первостепенное значение. Как правило, препараты назначаются на длительный период и применение их эффективно при тщательном соблюдении пациентом рекомендации врача и режима дозирования (Compliance). Гипотензивные средства должны обладать длительной и стойкой эффективностью, хорошей переносимостью, отсутствием побочных эффектов, удобством применения. Со времени своего появления в конце 70 годов ХХ века неселективные бета-блокаторы играли ведущую роль в качестве препаратов первого выбора при лечении глаукомы. Эти препараты оказывают гипотензивное действие путём снижения продукции внутриглазной жидкости. Бета-блокаторы (тимолол, арутимол и др.) снижают уровень ВГД только на 20–25 %, и половина пациентов к концу второго года монотерапии нуждается в коррекции лечения [3, 4]. Спектр терапевтических мероприятий расширился в последние несколько лет. Эффективными гипотензивными средствами являются аналоги простагландинов (ксалатан, траватан), усиливающие увеосклеральной отток водянистой влаги и обладающие нейропротекторным действием, при этом снижение ВГД достигается на 30 % от первоначального уровня [1, 2]. Однако, при высоком офтальмотонусе даже аналоги простагландинов далеко не всегда способствуют достаточному снижению ВГД. Подобные обстоятельства вынуждают начать терапию двумя антиглаукоматозными препаратами в надежде добиться желаемого уровня ВГД. В последние годы для повышения эффективности медикаментозного лечения и улучшения качества жизни пациентов разработан ряд препаратов с фиксированной комбинацией, при одновременном применении которых наблюдается аддитивный эффект [6]. К таким препаратам относится Ксалаком, содержащий 0,005 % Латонопроста + 0,5 % Тимолола, ВГД снижается за счёт увеличения увеосклерального оттока водянистой влаги и уменьшения продукции внутриглазной жидкости. Цель — провести сравнительную оценку гипотензивной эффективности Ксалакома в качестве комбинированной терапии ПОУГ и сочетанного применения неселективного бета-блокатора Арутимола и аналога простагландина Ксалатана. Материал и методы. Применяли общепринятые клинико-офтальмологические методы, визометрию, пневмотонометрию, тонографию, HRT, компьютерную периметрию. Всего исследовано 64 больных (87 глаз) с различными стадиями ПОУГ. Эффективность лечения оценивалась по динамике снижения уровня ВГД в различные сроки от начала применения препарата, наличию жалоб и объективных данных. В исследование включены больные ПОУГ с различными стадиями заболевания и степенью компенсации ВГД. В зависимости от использования нефиксированной или фиксированной комбинации антиглаукоматозных препаратов, больные были разделены на 2 группы. В первую группу вошли 30 пациентов (42 глаза): с 1 стадией глаукомы было 9 пациентов (11 глаз), со 2 стадией — 11 (16 глаз), с 3 стадией —10 (15 глаз). Пациенты получали Арутимол и Ксалатан. Вторую группу составили 34 пациента (45 глаз), из которых с 1 стадией глаукомы было 10 больных (12 глаз), со 2 стадией — 13 (17 глаз), с 3 стадией — 11 (16 глаз), они получали Ксалаком. До начала исследования все ранее применяющиеся пациентами гипотензивные препараты отменялись на 2–3 дня. В первой группе кратность инстилляций 0,5 % Арутимола составила 2 раза в день, 0,005 % Ксалатана — 1 раз вечером, во второй группе инстилляция ксалакома — 1 раз утром. Наблюдение проводилось в течение 12 месяцев. Результаты и обсуждение. Средний уровень офтальмотонуса до начала лечения у пациентов обеих групп с 1 стадией глаукомы равнялся 24,10±0,30, со 2 стадией — 30,40±0,15, и с 3 стадией — 34,15± 31 мм рт. ст. У всех пациентов первой группы с 1, 2 и 3 стадиями глаукомы через один месяц на фоне комбинированной терапии отмечено значимое снижение ВГД на 7,95±0,2, 9,72±9,1 и 10,92±0,3 мм рт. ст. соответственно. При этом офтальмотонус снизился до 16,15±1,5, 20,68±1,0, 23,23±1,5 мм рт. ст, что составило в среднем 32,5 % от исходного уровня. Через 4–6 месяцев ВГД снизилось до 19,8±1,4 мм рт. ст., при среднем снижении 9,75 мм рт. ст., что составило 33 % от исходного уровня офтальмотонуса. У пациентов с 1 стадией глаукомы наблюдалась полная компенсация ВГД (100 %), со 2 стадией — стойкая нормализация офтальмотонуса достигнута 206 у 11 человек (93,7 %), с 3 стадией — у 9 человек (86,6 %). На фоне лечения Ксалакомом у пациентов второй группы через один месяц гипотензивной терапии с 1, 2 и 3 стадиями глаукомы отмечено снижение ВГД на 8,4±0,2, 10,83±0,3, 11,61±0,5 мм рт. ст., офтальмотонус снизился до 15,7±0,5, 19,57±0,7, 22, 54±1,0 мм рт. ст. соответственно, что составило 35 % от исходного уровня. Через 4–6 месяцев было отмечено понижение ВГД до уровня 18,9±1,2 мм рт. ст., при среднем снижении 10,64 мм рт. ст., что составило 36 % от исходного уровня офтальмотонуса. У пациентов с 1 стадией глаукомы наблюдалась полная компенсация ВГД (100 %), со 2 стадией — стойкая нормализация офтальмотонуса достигнута у 11 человек (93,7 %), с 3 стадией — у 9 человек (86,6 %). У пациентов с 1 стадией глаукомы наблюдалась полная компенсация ВГД (100 %), со 2 стадией — стойкая нормализация офтальмотонуса достигнута у 13 человек (16 глаз, 94,1 %), с 3 стадией — у 11 человек (15 глаз, 93,7 %). За период наблюдения стабилизация ВГД достигнута: в 1 группе — в 39 глазах, что составляет 92,8 % от общего числа; во 2 группе — в 43 глазах (95,5 %). За весь период наблюдения во всех случаях, где была достигнута стойкая нормализация офтальмотонуса, не было отмечено ухудшение зрения и сужение поля зрения. В обеих группах ни у одного из пациентов не было отмечено каких-либо серьезных побочных эффектов, в связи с которыми могло бы потребоваться прекращение лечения. Местные побочные эффекты в виде гиперимии конъюнктивы, жжения, зуда наблюдались у 2 пациентов каждой группы, пациенты были предупреждены об этом, они спокойно переносили и подавляли кратковременное чувство дискомфорта. Степень выраженности этих жалоб была незначительной и не требовала отмены препарата. Выводы. Препарат Ксалаком с фиксированной комбинацией 0,005 % Ксалатана + 0,5 % Тимолола и сочетанное применение 0,5 % Арутимола + 0,005 % Ксалатана является высокоэффективным гипотензивным средством для лечения ПОУГ. Проведенные исследования показали комфортность и удобство в применение Ксалакома. Эффективность последнего выше при ПОУГ (снижение офтальмотонуса в среднем на 36 % от исходного уровня), чем при сочетанном использовании Арутимола и Ксалатана (снижение офтальмотонуса на 33 % от исходного уровня). Литература 1. Егорова, Т. Е. Простагландины и лечение глаукомы / Т. Е. Егорова // Клин. офтальмол. — 2004. — Т. 5. — № 3. — С. 127–132. 2. Егоров, Е. А. Гипотензивная активность и переносимость препаратов простагландинового ряда: результаты независимых исследований / Е. А. Егоров, Ж. Г. Оганезова // Клин. офтальмолог. — 2007. — № 4. — С. 173–174. 3. Нестеров, А. П. Глаукома / А. П. Нестеров. — М., 1995. — С. 3. 4. Файзуллина, Х. Г. Медикаментозная коррекция глаукомы / Х. Г. Файзуллина, О. В. Вавилова // Современные технологии лечения заболеваний переднего и заднего сегментов глаза. — Уфа, 2008. — С. 324–327 5. Каленьева, А. З. Клинические проявления и динамика ПОУГ с учетом наследственной предрасположенности в Рес­ публике Башкортостан: автореф. дис. … канд. мед. наук / А. З. Каленьева. — Уфа, 2009. — 24 с. 6. Куроедов, А. В. Перспективы применения комбинированных антиглаукомных препаратов / А. В. Куроедов // Клин. офтальмол. — 2007. — Т. 8. — № 4. — С. 176–181. М. А. Фролов, Н. С. Морозова, А. М. Фролов ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ПЕРОРАЛЬНОЙ ФОРМЫ ЦИТИКОЛИНА (CDP — CHOLINE) В ЛЕЧЕНИИ ГЛАУКОМАТОЗНОЙ ОПТИЧЕСКОЙ НЕЙРОПАТИИ Российский университет дружбы народов, кафедра глазных болезней, г. Москва Глаукома — одно из наиболее тяжелых заболе- 10]. Глаукоматозная оптическая нейропатия (ГОН) ваний в офтальмологии, занимающее лидирующее рассматривается как мультифакторное заболевание, место среди причин слепоты и слабовидения [9, в патогенезе которого лежит дегенеративный про207 цесс, поражающий нервную ткань, как в подкорковых центрах, так и в аксонах, а затем и в теле ганглиозных клеток сетчатки (ГКС) [8]. Причиной гибели ГКС является апоптоз [8–10]. Достичь успеха в стабилизации зрительных функций можно путём повышения уровня метаболизма в ГКС с помощью нейропротекторов [8–10]. Список лекарственных средств, применяемых в комплексной терапии первичной открытоугольной глаукомы, насчитывает сегодня множество наименований, среди которых выделяется сравнительно небольшая группа препаратов, оказывающих нейропротекторное действие на зрительный нерв [1, 2, 4, 6, 8]. О чрезвычайной важности ноотропов свидетельствуют данные об их широком применении в медицине. Так, статистические данные показали, что данные средства принимает треть взрослого населения Европы и Японии, в связи с чем, их можно с полным основанием отнести к группе жизненно важных препаратов [3]. С этой точки зрения несомненный интерес представляют данные об использовании цитиколина (CDP — choline) — лекарственного средства, широко изученного при различных формах цереброваскулярной патологии в странах Западной Европы, США и Японии в течение последних 30 лет. Цитиколин (CDP — choline) имеет широкую доказательную базу: общее число пациентов, включённых в различные исследования его эффективности, составляет около 12 тысяч. Цель — изучить влияние перорального применения ноотропного препарата цитиколин (CDP — choline) в виде сиропа на зрительные функции, периметрические индексы статической автоматической периметрии и морфометрические показатели ретинальной томографии у пациентов первичной открытоугольной глаукомы I–III стадий с нормализованным офтальмотонусом. Материал и методы. Пролечено 40 пациентов (66 глаз) с ПОУГ I–III стадий с нормализованным офтальмотонусом в возрасте 67±8,4 года (женщин — 21, мужчин — 19). Целевое внутриглазное давление (ВГД) было достигнуто оперативным вмешательством и/или местной гипотензивной терапией. Больные были разделены на 2 группы: основную и контрольную. Все пациенты получали комплексную терапию: вазоактивные средства, ви- тамины, антиоксиданты. Больным основной группы дополнительно назначался ноотропный препарат «CERAXON®» — препарат фирмы «Nycomed», Аustria. Препарат принимался в сиропе в дозе 200 мг 3 раза в день ежедневно per os в течение 3 месяцев. МНН (международное непатентованное название): Цитиколин [5, 11, 12]. Всем пациентам выполняли: визометрию, кинетическую периметрию, определение суммарной границы поля зрения, проводилась оценка световой чувствительности сетчатки по программе G1X/G2 на периметре «Octopus 101» с оценкой индексов MS, MD, CLV. Определяли электрическую чувствительность зрительного нерва, а также критическую частоту исчезновения фосфена (КЧИФ). Лазерная сканирующая ретинотомография проводилась на аппарате HRT III до и после курса терапии [7]. Оценивались наиболее значимые параметры ретинотомографии: площадь экскавации — CA (cup area), площадь нейроретинального пояска — RA (rim area), объём экскавации — CV (cup volume), объём нейроретинального пояска — RV (rim volume), средняя толщина слоя нервных волокон сетчатки — mean RNFL [7]. Исследование пациентов проводилось до лечения и через 3 месяца после завершения курса терапии. Результаты и обсуждение. С помощью анализа полученных результатов были произведены расчёты t-критерия Стьюдента. У пациентов обеих групп, на фоне проведённого лечения, выявлено достоверное (p<0,05) повышение остроты зрения и КЧИФ, расширение суммарных границ полей зрения, показателя MS, отражающего общую светочувствительность сетчатки. Снижение индексов MD и CLV, отражающих глубину дефектов в поле зрения, а также параметров ретинотомографии CA и CV явилось благоприятным фактором результата терапии. Анализ структурных изменений зрительного нерва показал достоверное (p<0,05) увеличение средней толщины нервных волокон сетчатки (показатель RNFL) в группе пациентов, принимавших цитиколин. Выводы. Проведённое исследование даёт основания рекомендовать добавление сиропа цитиколина в консервативное лечение пациентов с нестабилизированной глаукомой. Препарат обладает выраженным нейропротекторным действием, осуществляя эффективную защиту нервной ткани, предотвращая апоптоз [5]. 208 Литература 1. Анисимова, С. Ю. Современные подходы к нейропротекторной терапии при глаукоме / С. Ю. Анисимова [и др.] // Фёдоровские чтения. — 2003. — С. 192–198. 2. Астахов, Ю. С. Результаты применения ретиналамина у больных с первичной открытоугольной глаукомой / Ю. С. Астахов [и др.] // Глаукома. — 2006. — № 2. — С. 43–47. 3. Ахапкина, В. И. Спектр фармакологических эффектов Фенотропила / В. И. Ахапкина, Т. А. Воронина // Фарматека. — 2005. — № 13 (108). — С. 19–25. 4. Важенков, С. Н. Патогенез прогрессирования глаукомной оптической нейропатии при нормализованном внутриглазном давлении: обзор / С. Н. Важенков // Офтальмология. — 2008. — Т. 5. — № 3. — С. 10–12. 5. Бойко, А. Н. Цитиколин: новые возможности нейропротекции и фармакотерапии при заболеваниях нервной системы / А. Н. Бойко, А. А. Кабанов // Фарматека. — 2007. — № 15. — С. 57–63. 6. Коломейцева, Е. М. Результаты применения пикамилона в лечении больных открытоугольной глаукомой / Е. М. Коломейцева, В. Н. Ермакова, М. Ж. Абдулкадырова // Вестн. офтальмол. — 1994. — № 4. — С. 4–7. 7. Куроедов, А. В. Компьютерная ретинотомография (HRT): диагностика, динамика, достоверность / А. В. Куроедов, В. В. Городничий. — М.: Издательский центр МНТК «Микрохирургия глаза», 2007. — 236 с. 8. Курышева, Н. И. Глаукомная оптическая нейропатия / Н. И. Курышева. — М., 2006. — 136 с. 9. Нестеров, А. П. Первичная открытоугольная глаукома, патогенез и принципы лечения / А. П. Нестеров // Клин. офтальмол. — 2000. — Т. 1. — № 1. — С. 4–5. 10.Нестеров, А. П. Патогенез и проблемы патогенетического лечения первичной открытоугольной глаукомы / А. П. Нестеров // Фёдоровские чтения. — 2003. — С. 13–14. 11.Han, Y. S. Neuroprotective effect of citicoline on retinal cell damage induced by kainic acid in rats / Y. S. Han, I. Y. Chung, J. M. Park [et al.] // Ophthalmol. — 2005. — Vol. 19. — P. 219–226. 12.Parisi, V. Cytidine-5'-diphosphocholine (citicoline) improves retinal and cortical responses in patients with glaucoma / V. Parisi, G. Manni, G. Colacino [et al.] // Ophtalmology. — 1999. — Vol. 106. — P. 1126–1134. О. В. Чайка, О. И. Оренбуркина РЕЗУЛЬТАТЫ КОМБИНИРОВАННОЙ ХИРУРГИИ КАТАРАКТЫ И ГЛАУКОМЫ У БОЛЬНЫХ С УМЕРЕННО ПОВЫШЕННЫМ ОФТАЛЬМОТОНУСОМ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Глаукома и катаракта, являясь одними из основных причин слепоты и слабовидения, часто носят сочетанный характер — в 17–38,6 % случаев [Курмангалиева М. М., 2002; Должич Г. И., 2003; Егорова Э. В., 2004]. В зависимости от степени компенсации офтальмотонуса, стадии и формы глаукомного процесса возможно проведение поэтапного или комбинированного хирургического лечения. При наличии частично мутного хрусталика, умеренно повышенного офтальмотонуса, невозможности 2-этапного лечения по общему состоянию пациента предпочтение отдается комбинированным вмешательствам [Галимуллин Ф. А., 2007; Джиндоян Г. Т., 2009]. Одномоментная факоэмульсификация катаракты с гипотензивной операцией и имплантацией искусственного хрусталика более экономична для больного, так как не требует повторных обследований и госпитализаций. Кроме того, удается избежать двух восстановительных периодов с сопутствующим интенсивным закапыванием капель и ограничением физической активности, что снижает качество жизни пациентов, особенно трудоспособного возраста [Филиппова О. М., 2001; Ходжаев Н. С., 2004]. Катарактальный и антиглаукоматозный компоненты при комбинированной хирургии могут быть выполнены единым или разными доступами. Большинство авторов предпочитают разные доступы, ссылаясь на то, что при таком подходе манипуляция с тканями сводится к минимуму, а хирург выполняет операцию, применяя привычную для него технику [Кумар В., 2003; Малюгин Б. Э., 2006; Jampel H. D., 2006]. Цель — изучить непосредственные и отдаленные результаты комбинированной одномоментной факоэмульсификации катаракты (ФЭК) и непроникающей глубокой склерэктомии (НГСЭ) у больных первичной открытоугольной глаукомой с умеренно повышенным офтальмотонусом. 209 Материал и методы. Под нашим наблюдением находились 19 пациентов (19 глаз) с открытоугольной глаукомой I–III стадией и неполной осложненной катарактой. Женщин было 11 (57,9 %), мужчин — 8 (42,1 %). Возраст пациентов варьировал от 43 до 86 лет и составил в среднем 69,2±2,2. Острота зрения до операции составила от 0,01 до 0,3 с коррекцией. Подвывих хрусталика I степени выявлен в 3 случаях (15,8 %), II степени — в одном случае (5,3 %). Псевдоэксфолиативный синдром различной степени выраженности отмечен на 4 глазах (21 %). Среднее значение внутриглазного давления (ВГД) при дооперационном обследовании было равно 27,7±0,5 мм рт. ст. (на бесконтактном пневмотонометре «NIDEK» NT 2000) или Po >32,0. Срок течения заболевания глаукомой составил от впервые выявленной до 11 лет. Оценка офтальмологического статуса включала в себя общепринятые клинические исследования, а также электротонографию (на тонографе ТНЦ, Россия). Факоэмульсификацию проводили на аппарате Legacy ALCON (США). Во всех случаях использовалась субтеноновая анестезия — 2 мл 2 % раствора лидокаина и лимбальный тоннельный самогерметизирующийся доступ. Микроинвазивную НГСЭ выполняли в модификации Тахчиди Х. П. В послеоперационном периоде все пациенты получали стандартную терапию: инстилляции и субконъюнктивальные инъекции антибиотиков и кортикостероидов. Результаты и обсуждение. Серьезных осложнений во время операции и в раннем послеоперационном периоде не наблюдали. Лишь в 2 случаях на следующий день после операции была выявлена гифема с уровнем не более 2 мм, купированная в течение 2–4 дней медикаментозно. Периметрические и офтальмологические исследования в послеоперационном периоде позволили детально оценить степень выраженности глаукоматозного процесса. Начальная стадия ПОУГ выявлена на 8 глазах (42,1 %), развитая — на 9 (47,4 %) и далекозашедшая — на 2 (10,5 %). При выписке нормализация ВГД отмечена во всех случаях, офтальмотонус был равен в среднем 18,6±0,8 мм рт. ст. Острота зрения более 0,4 установлена у 13 пациентов (68,4 %). В отдаленные сроки наблюдения у 16 пациентов (84,2 %) ВГД оставалось компенсированным без применения гипотензивных средств и составило через 6 месяцев 19,7±0,7 мм рт. ст., через 1 год — 17,2 ± 0,68 мм рт. ст. Трем больным (15,8 %) компенсации ВГД удалось достичь назначением β–блокаторов. Острота зрения через 6 месяцев после операции составила выше 0,4 у 12 пациентов (63,2 %), менее 0,1 — у 3 (15,7 %). Относительно невысокая острота зрения была связана с наличием и прогрессированием глаукоматозной атрофии ДЗН. Острота зрения в 2 случаях (10,5 %) снизилась через год после операции на 0,1–0,2 в результате развития вторичной катаракты, по поводу чего была успешно выполнена лазерная дисцизия. В отдаленные сроки наблюдения биомикроскопические и гониоскопические исследования показали, что фильтрационная подушка во всех случаях была умеренно выражена, угол передней камеры открыт, положение ИОЛ правильное. Тонографические исследования больных подтвердили факт статистически достоверного повышения легкости оттока камерной влаги и снижения ВГД (p≤0,05). До проведения комбинированного вмешательства показатель легкости оттока С был равен 0,08±0,01 мм3/мин/мм рт. ст., через 6–12 мес. повысился до 0,20±0,02 мм3/мин/мм рт. ст. Показатель истинного ВГД (Pо) соответственно снизился с 31,56±0,86 мм рт. ст. до 18,4±0,69 мм рт. ст. Вывод. Комбинированная одномоментная операция — факоэмульсификация катаракты с имплантацией ИОЛ и непроникающая глубокая склерэктомия — является эффективным, безопасным и рекомендуемым методом хирургического лечения катаракты у больных первичной открытоугольной глаукомой с умеренно повышенным офтальмотонусом. Полученные результаты свидетельствуют о стойком гипотензивном и длительном эффекте в отдаленные сроки после комбинированного вмешательства. 210 А. П. Шахалова ОБЪЕКТИВНАЯ ОЦЕНКА ПАРАМЕТРОВ НЕЙРОРЕТИНАЛЬНОГО ПОЯСКА ПРИ РАЗЛИЧНЫХ СТАДИЯХ ПЕРВИЧНОЙ ОТКРЫТОУГОЛЬНОЙ ГЛАУКОМЫ ПО ДАННЫМ ОПТИЧЕСКОЙ КОГЕРЕНТНОЙ ТОМОГРАФИИ Клиника «Тонус АМАРИС», г. Нижний Новгород Согласно современным представлениям, ведущими критериями в ранней диагностике глаукомы являются специфические морфологические изменения диска зрительного нерва, отражающие развитие глаукомной оптической нейропатии. Офтальмоскопическое исследование состояния диска зрительного нерва недостаточно информативно, так как дает информацию только о линейных показателях (в частности, об отношении диаметра экскавации к диаметру диска зрительного нерва), в то время как сложность архитектуры диска зрительного нерва и нейроретинального пояска требует введения в клиническую практику целой группы трехмерных показателей. Технические достижения последних десятилетий дали офтальмологам новые аппаратные решения, которые позволяют объективно оценивать параметры диска зрительного нерва, перипапиллярного слоя нервных волокон сетчатки и проводить их количественный анализ. Одним из наиболее популярных методов исследования является оптическая когерентная томография (ОКТ). Разрешающая способность метода составляет 5 мкм, что позволяет выявлять мельчайшие изменения структуры исследуемого объекта, до появления функциональных изменений. Метод ОКТ неинвазивен, поскольку использует излучение в ближнем инфракрасном диапазоне с мощностью 5 мВт, которое не оказывает повреждающего воздействия на организм. Сканирующее лазерное видеоизображение обеспечивает «живую» картину глазного дна высокого качества в реальном времени. Существенными достоинствами метода являются также отсутствие необходимости расширения зрачка при достаточно прозрачных оптических средах и короткое время исследования. Цель — количественно оценить объем и площадь нейроретинального пояска при различных стадиях глаукомы по данным оптической когерентной томографии. Материал и методы. Исследование проводилось на базе офтальмологического центра «Тонус АМАРИС» (г. Нижний Новгород). В работе суммированы результаты собственных наблюдений за период с апреля 2010 г. по январь 2011 г. Всего обследовано 82 человека в возрасте от 35 до 69 лет. В исследование были включены 4 группы пациентов: 1 группа — пациенты, направленные на обследование с подозрением на глаукому — 27 человек (54 глаза); 2 группа — пациенты с I стадией глаукомы — 22 человека (44 глаза); 3 группа — пациенты со II стадией глаукомы — 24 человека (48 глаз); 4 группа — пациенты с III стадией глаукомы — 9 человек (18 глаз). Всем пациентам проводилось комплексное офтальмологическое обследование, включающее визометрию, тонометрию (пневмотонометр Tomey FT1000, Япония, и тонометр Маклакова), компьютерную статическую периметрию (периметр Twinfield II фирмы Oculus), гониоскопию и биомикроскопию диска зрительного нерва и сетчатки. Для оценки параметров диска зрительного нерва и толщины слоя перипапиллярных нервных волокон сетчатки всем пациентам проводилось обследование на оптическом когерентном томографе Cirrus HD-OCT фирмы Carl Zeiss (Германия), используемые протоколы сканирования-ONH и RNFL Analysis. Статистическая обработка результатов проводилась с использованием пакета прикладных программ Statistica 6.0 (StatSoft Inc.) Результаты и обсуждение. Данные об объеме и площади нейроретинального пояска в исследуемых группах представлены в таблице. Таким образом, объективная регистрация объема и площади нейроретинального пояска показала их прогрессивное уменьшение от стадии к стадии глаукомы. Различие данного параметра межу всеми группами статистически достоверно (p<0.05). 211 Объем и площадь нейроретинального пояска при различных стадиях первичной открытоугольной глаукомы Группы пациентов Показатели Объем нейро-ретинального пояска (мм³) Площадь нейроретинального пояска (мм²) 1 группа (подозрение на глаукому) n=54 2 группа (ПОУГ I стадии) n=44 3 группа (ПОУГ II стадии) n=48 4 группа (ПОУГ III стадии) n=18 0,412±0,082 0,273±0,061 0,192±0,071 0,118±0,034 1,498±0,118 1, 426±0,108 1,164±0,096 0,794±0,064 Выводы. Оптическая когерентная томография диска зрительного нерва позволяет объективно оценить уменьшение объема и площади нейроретинального пояска уже в начальной стадии первичной открытоугольной глаукомы, и в еще большей степени уменьшение данных параметров во II и III стадиях заболевания. Введение в алгоритм динамического наблюдения пациентов с глаукомой оптической когерентной томографии, позволяющей в микроскопических масштабах наблюдать прогрессирование изменений диска зрительного нерва, позволит практикующему врачу оптимизировать тактику лечения. Литература 1. Гладкова, Н. Д. Оптическая когерентная томография: новый высокоразрешающий метод визуализации тканевых структур / Н. Д. Гладкова, Н. М. Шахова, Б. Е. Шахов, Б. Е. Геликонов // Вестник радиологии и рентгенологии. — 2002. — № 2. — С. 39–47. 2. Куроедов, А. В. Исследование морфометрических критериев диска зрительного нерва в свете возможностей современной лазерной диагностической техники / А. В. Куроедов, С. Ю. Голубев, Г. В. Шафранов // Глаукома. — 2005. — № 2. — С. 7–18. 3. Курышева, Н. И. Глаукомная оптическая нейропатия / Н. И. Курышева. — М.: МЕДПресс-информ, 2006. — 136 с. 4. Мачехин, В. А. Параметры диска зрительного нерва при различных стадиях открытоугольной глаукомы по данным лазерного сканирующего ретинотомографа HRT-II / В. А. Мачехин, Г. Е. Манаенкова // Глаукома. — 2005. — № 4. — С. 3–10. 5. Нестеров, А. П. Глаукома / А. П. Нестеров. — М.: Медицина, 1995. — 256 с. 6. Паштаев, Н. П. Возможности оптической когерентной томографии в диагностике и лечении глаукомы / Н. П. Паштаев, Н. Ю. Горбунова, Н. А. Поздеева, Т. Ф. Артемьева // Мат-лы IV международной конф. «Глаукома: Теории, Тенденции, Технологии* HRT клуб Россия-2006»: сб. науч. ст. / под ред. А. П. Нестерова. — М., 2006. — С. 271–276. 7. Greenfield, D. S. Role of Optic Nerve Imaging in Glaucoma Clinical Practice and Clinical Trials / D. S. Greenfield, R. N. Weinreb // Am. J. Ophthalmol. — 2008. — Vol. 145. — № 4. — Р. 598–603. С. Ю. Щербакова, С. В. Харинцева Эффективность селективной Трабекулопластики в лечении нестабилизированной открытоугольной глаукомы ГУ ВПО «Читинская государственная медицинская академия», г. Чита «Глаукома — это прогрессирующая оптическая нейропатия, характеризующаяся экскавацией ДЗН и соответствующим ей снижением светочувствительности сетчатки» [Flammer, 2001], что является одной из основных причин слабовидения и слепоты во всем мире. В последние годы заболеваемость глаукомой в России в 1,5–2 раза превышает среднеевропейский показатель. Важнейшим условием профилак- тики прогрессирование глаукомы является её своевременная диагностика и лечение. В настоящее время на рынке разработана и внедрена в клиническую практику селективная трабекулопластика диодным инфракрасным лазером (СЛТП) и использование диагностического аппарата (оптический когерентный томограф), который позволяет выявить мельчайшие морфологические изменения структуры ДЗН и сетчатки, которые 212 функционально ещё не определяются до и после лазерного излучения на зону трабекулы в проекции шлеммова канала. При проведении СЛТП не происходит коагулирующего эффекта, что обуславливает щадящее воздействие и его безопасность, и она может быть выполнена амбулаторно. Однако эффективность длится в среднем от 6–12 месяцев. Цель — оценить эффективность СЛТП у пациентов с различными стадиями глаукомы нестабилизированного течения. Материал и методы. Исследование проводилось на базе диагностической поликлиники ГУ ВПО ЧГМА (г. Чита). Всего исследовано 31 человек. У пациентов диагностировано нестабильное течение глаукомы на фоне местной гипотензивной терапии. Всем пациентам проводилось комплексное офтальмологическое обследование: визометрия, тонометрия, компьютерная периметрия, гониоскопия, биомикроскопия ДЗН и сетчатки. Больные были распределены на 3 группы (по стадиям заболевания): 1 стадия — 6 человек; 2 стадия — 7 человек; 3 стадия — 17 человек. У всех больных угол передней камеры (УПК) был открыт, у 25 человек была выраженная пигментация, у 6 человек она была слабой. Трабекулопластику выполняли лазерной установкой «IQ 810 IRIDEX» (США). Энергия 1000–1800 мВт., размер пятна 300 мкм, количество импульсов 180–240 в диапазоне 180° в нижнем сегменте УПК, до появления побледнения зоны воздействия. Для оценки параметров диска зрительного нерва и толщины слоя перипапиллярных нервных волокон сетчатки пациентам проводилось обследование на оптическом когерентном томографе RTVue — 100 фирмы OPTOVUE (США), использовались протоколы сканирования NHM4 и RNFL Thickness 3,45. Все операции прошли без осложнений. До и после воздействия назначались: азопт — 2 раза в день, вольтарен — 4 раза в день в течение 14 дней, затем гипотензивные препараты. Осмотр и измерение внутриглазного давления проводились на следующий день, через 2 недели, через 1 и 3, 6 месяца — осмотр, измерение ВГД, ОКТ. Критерием эффективности являлось снижение и стабилизация внутриглазного давления, данные ОКТ по толщине перипапиллярного слоя нервных волокон сетчатки (RNFL). Результаты и обсуждение. Измерение ВГД после СЛТП на следующий день отмечало его сни- жение на 5 мм рт. ст. с последующим постепенным снижением в течение месяца еще на 2–4 мм рт. ст., что составляло 25–30 % от исходного уровня ВГД при всех стадиях глаукомы (табл.). Это подтверждает гипотензивный эффект данного воздействия на трабекулярную зону. Уровень ВГД и ОКТ RNFL до и через месяц после СЛТП Стадии заболевания глаукомы 1 2 3 Количество глаз 6 7 17 ВГД до СЛТП в мм рт. ст. 22–32 24–29 22–36 Средние показатели ВГД 27 ± 5 27 ± 3 29 ± 7 ВГД после СЛТП в мм рт. ст. 17–21 17–23 16–24 Средние показатели ВГД 19 ± 2 20 ± 3 20 ± 4 Снижение ВГД в мм рт. ст. 7 7 9 ОКТ RNFL до СЛТП, µm 105,5 96 ± 76 ± ± 5,3 4,5 3,5 ОКТ RNFL после СЛТП, µm 106 ± 96,5 ± 76 ± 5,5 4,5 3,5 Показатели У 3 пациентов (10 %) снижение ВГД не было достигнуто в течение месяца. Им была предложена непроникающая глубокая склерэктомия. Двое из них были прооперированы, что дало стойкий гипотензивный эффект. Контрольные наблюдения через 3 и 6 месяца показали, что сохранение достигнутого стабильного ВГД на монотерапии осталось у 20 пациентов — 65 % и у этих же пациентов стабильно сохранялись или незначительно улучшались параметры толщины перипапиллярнонго слоя нервных волокон. У 8 пациентов — 25 % уровень ВГД увеличился в среднем на 3–5 мм рт. ст., показатели RNFL уменьшились в среднем на 5 µm. Их перевели на смешанный режим гипотензивных препаратов, что дало снижение ВГД ещё на 5–7 мм рт. ст. После чего показатели RNFL значительно не изменялись. Выводы: 1. Применение СЛТП позволяет достигнуть толерантного ВГД. Полученно снижение ВГД в среднем на 25–30 % от исходного, что является критерием эффективности данного метода. 2. Полученный стабильный гипотензивный результат сохранялся от 6 до 12 месяцев на монотерапии. Затем у части больных отмечалось незначительное повышение ВГД, которое снизилось и стабильно держалось на смешанном режиме применения гипотензивных препаратов. 213 3. СЛТП можно использовать, как промежуточный этап перед непроникающей глубокой склерэктомией у больных с высоким исходным ВГД или у соматически тяжелых больных. 4. Установлена зависимость изменения показателей толщины перипапиллярного слоя нерв- ных волокон от стабилизации толерантного ВГД и от стадий глаукомного процесса. Отмечается снижение RNFL у нестабилизированной глаукомы и с увеличением стадий глаукомы. Это исследование позволяет объективно оценить эффективность СЛТП. Литература 1. Алешаев, М. И. Селективная лазерная трабекулопластика в лечении больных первичной открытоугольной глаукомой / М. И. Алешаев // Лазеры в офтальмологии: вчера, сегодня, завтра. — М., 2009. — С. 40–43. 2. Арефьева, Ю. А. Спектральная оптическая когерентная томография высокого разрешения в диагностике и мониторинге глаукомы / Ю. А. Арефьева // Глаукома. — 2010. — № 4. — С. 51. 3. Балашевич, Л. И. Лазерное лечение глаукомы / Л. И. Балашевич, М. В. Гацу, А. С. Измайлов, А. Б. Качанов. — СПб., 2004. — С. 29–40. 4. Веснина, Н. А. Комплексное лечение глаукомы / Н. А. Веснина, Т. А. Саар, О. О. Денисова // Глаукома: теории, тенденции, технологии. — М., 2010. — С. 83–86. 214 Раздел V Лечение заболеваний сетчатки и зрительного нерва Helmut G. Sachs Subretinal electronic chips allow blind patients to read letters and combine them to words. Technology and the transchoroidal implantation procedure for the German Subretinal Implant Project (Retina Implant) Light sensitive external powered microchips were surgically implanted subretinally in the macular region of volunteers blind from hereditary retinal dystrophy. The implant consists of a foil bound array of 1500 mic­ ro photodiodes (chip) each with its own amplifier and local stimulation electrode. The size of subretinal active film bound visual prostheses and their necessary connection to extraocular structures for energy supply requires a transchoroidal surgical implantation procedure. A safe surgical transchoroidal subretinal access is mandatory for a successful chronic implantation in humans. The visual scenes are projected naturally (without the need of a camera) in the physiological way through the eye onto the chip under the transparent retina. The chip generates a corresponding pattern of about 1500 pixels each of them stimulating the retina with light intensity dependent electric pulses. Eleven volunteer legally blind patients were implanted with a transdermal cable bound device in a first series. A transchoroidal subretinal implantation of the stimulation device (active implant) was carried out. The implant consisted of a stimulation chip on a polyimide film and additional stimulation electrode array with16 TiN electrodes. The energy which was required for the stimulation was delivered via a retro auricular plug transdermal by a cable and transchoroidal by a polyimide film with supply lines. Thus subretinal stimulation experiments could be carried out successfully in chronic subretinal implanted patients for the first time. According to schedule the implants in the first series had to be removed after 30 days and after 3 month for the last 3 patients. The following patients kept the implants. Careful radiodiathermy with precise adjusted para­me­ ters allowed penetrating the choroid without bleeding. A specially designed guide film was used as an implantation instrument. Silicone oil served as a tamponade. Implantation was successfully performed in all patients. No surgically induced adverse events (choroidal bleeding, retinal detachment, inflammation etc.) were observed during the procedure or the follow up period of up to 3 years. The implants remained stable in all cases. The new developed transchoroidal implantation and explantation procedure was successfully established in humans. This procedure enables a safe chronic stable subretinal implantation and explantation of large scale electronic prostheses which are necessary to create a usable visual percept. With these results a variety of experiments was carried out. Visual percepts were monitored starting with the first implanted patient. Subsequently three previously blind patients could locate objects on a table. One out of these first eleven patients was able to correctly describe and name this objects like knife and fork was able to discern fruits and shades of grey. Without training the regained function enabled him to localize and approach persons in a room and to read large letters and complete words after years of blindness. These results demonstrate for the first time that a subretinal chip with 1500 micro photodiodes can create detailed meaningful visual percepts in previously blind patients. The transchoroidal subretinal implantation surgery which was previously regarded as not manageable is a challenging complex surgical procedure which proved to be a safe strategy and led to these unique visual results. Good surgical results determine the basis for a successful electrical stimulation and are of prime importance for the whole procedure. Technical problems with the chip and the system in the early phase of the project were solved but potential for technical development is obvious. 216 У. Р. Алтынбаев Хирургическое лечение экссудативной отслойки сетчатки, осложненной макулярным разрывом у пациента с врожденной ямкой зрительного нерва ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Врожденная ямка диска зрительного нерва (ДЗН) в 25–75 % случаях осложняется развитием экссудативной отслойки макулярной области сетчатки. В настоящее время нет четкого понимания патогенеза данного процесса. Наиболее эффективным методом лечения экссудативной отслойки макулы является витрэктомия с активным интравитреальным дренированием субретинальной жидкости и тампонадой витреальной полости газо-воздушной смесью. В единичных сообщениях посвященых данной проблеме описаны случаи развития макулярного разрыва после успешной витрэктомии у больных с экссудативной отслойкой макулы на фоне врожденной ямки зрительного нерва. Развитие макулярного разрыва в этих случаях является следствием пролиферативного процесса и тангецальной трации на уровне внутренней пограничной мембраны сетчатки, индуцированного хирургическим вмешательством [1, 2]. Однако в литературе мы не нашли информации о развитии и результатах хирургического лечения первичного макулярного разрыва на фоне экссудативной отслойки макулы у больных с ямкой ДЗН, поэтому считаем актуальным описание подобного клинического случая. В Уфимском НИИ глазных болезней под наблюдением находился пациент Г., 1981 г. р., который обратился 24 декабря 2009 г. с жалобами на ухудшение зрения левого глаза. Объективно: Острота зрения ОД 1,0; OS 0,2 н. к. При офтальмоскопии ОИ оптические среды прозрачные. Глазное дно: ОД без особенностей ОS Ямка ДЗН, ОS экссудативная отслойка центральной области сетчатки, распространяющаяся от височной границы ДЗН до уровня сосудистых аркад. Данные ОСТ выявили в левом глазу ямку ДЗН, экссудативную отслойку сетчатки, разрыв наружных слоев сетчатки (рис. 1 в Приложении). Был установлен диагноз: ОS Врожденная ямка ДЗН. Экссудативная отслойка макулы. Формирующийся макулярный разрыв. Больному было предложено хирургическое лечение, от которого он воздержался. Через 1 месяц пациент повторно обратился в клинику с жалобами на дальнейшее ухудшения зрения левого глаза. Объективно: Острота зрения ОД 1,0; OS 0,09 н. к. При офтальмоскопии ОИ оптические среды прозрачные. Глазное дно: ОД без особенностей ОS Ямка ДЗН, OS экссудативная отслойка центральной области сетчатки, большой макулярный разрыв (510 мкм). Пациенту выполнена операция: субтотальная витрэктомия 25G, удаление внутренней пограничной мембраны сетчатки, интравитреальное дренирование субретинальной жидкости, тампонада витреальной полости 20 % газо-воздушной смесью (SF6). Через 1 месяц после операции острота зрения сохранилась на дооперационном уровне — 0,09 н. к. Объективно: ОS сетчатка прилежит, макулярный разрыв сохраняется. По данным ОСТ обнаружен макулярный разрыв диаметром 586 мкм, с кистозноизмененными краями (рис.2 в Приложении). Пациенту выполнена повторная операция: вакуумный массаж макулы с интраоперационным сближением краев разрыва и тампонада витреальной полости 16 % газо-воздушной смесью (С2F6). Через 1 месяц после повторной операции острота зрения с коррекцией улучшилась до 0,2. При офтальмоскопии глазного дна левого глаза макулярный разрыв закрыт, незначительная дисперсия пигментного эпителия. По данным ОСТ — макулярный разрыв закрыт, частичная атрофия фоторецепторов и пигментного эпителия сетчатки (рис.3 в Приложении). На протяжении всего периода наблюдения (3, 6 мес.) морфофункциональные показатели оперированного глаза оставались стабильными. Выводы. Длительное существование серозной отслойки сетчатки у больных с врожденной ямкой зрительного нерва усуглубляет местные морфологические изменения сетчатки вплоть до развития макулярного разрыва. Своевременная диагностика и раннее хирургическое лечение может снизить риск осложнений и проведение повторных операции. 217 Литература 1. Балашевич, Л. И. Изучение особенностей патологии витреомакулярного интерфейса при отслойке задней гиалоидной мембраны на основе метода оптической когерентной томографии / Л. И. Балашевич, Я. В. Байбородов, Т. М. Джусоев [и др.] // Офтальмохирургия. — 2006. — № 1. — C. 24–27. 2. Shimoda, Y. Full-Thickness Macular Hole After Vitrectomy for Pit-Macular Syndrome / Y. Shimoda, S. Kishi // Invest. Ophthalmol. Vis. Sci. — 2008. — Vol. 49. — P. 4713. Д. И. Беда ЦЕЛЕСООБРАЗНОСТЬ ПРИМЕНЕНИЯ ЭКЗОГЕННЫХ АНТИОКСИДАНТОВ В СОЧЕТАНИИ С ГБО В ЛЕЧЕНИИ ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ Филиал СКЦ ФГУЗ КБ-42 ФМБА России, г. Зеленогорск Инволюционные поражения сетчатки являются одной из основных причин инвалидизации людей старше 65 лет. Из-за этого заболевания потеряли зрение более 30 млн. человек в мире, в том числе более 12 млн. европейцев. Лечение возрастной макулярной дегенерации (ВМД) остается трудной и до конца не решенной задачей. Необходимость разработки эффективных методов лечения ВМД обусловлена высокой социальной и экономической ценой содержания больных с данной патологией. Медикаментозное лечение ВМД малоэффективно. Методы лекарственной терапии не всегда могут обеспечить компенсацию нарушенного метаболизма, поэтому особую актуальность в лечении ВМД приобретают вспомогательные физические лечебные факторы, например, гипербарическая оксигенация (ГБО). Основным этапом в лечении пациентов с неэкссудативной формой ВМД является профилактика перехода ее во влажную форму — борьба с окислительным стрессом, поддержание функционального состояния сосудов хориоидеи и клеток пигментного эпителия. Установлено, что ГБО стимулирует процессы перекисного окисления липидов (ПОЛ) [Ромасенко М. В., 2008; Шевцов В. И., 2008]. Известно, что терапевтическое действие ГБО реализуется посредством физиологических эффектов ПОЛ в тех случаях, когда его активация адекватна компенсаторным возможностям антиоксидантной системы (АОС). Известно, что с возрастом происходит снижение эндогенной антирадикальной активности крови [Киселева Т. Н., 2006; Красногорская В. Н., 2008], поэтому мы сочли целесообразным применить ГБО в сочетании с экзогенными антиоксидантами в лечении неэкссудативной формы ВМД. Цель — повысить эффективность лечения пациентов с возрастной макулярной дегенерацией. Материал и методы. Клинические исследования проведены у 132 пациентов (236 глаз) с неэкссудативной формой ВМД обоего пола, в возрасте от 40 до 82 лет. Все пациенты были поделены на две группы: основную и группу сравнения. Основную группу составили 74 пациента (128 глаз), которые получали медикаментозную терапию, включающую парабульбарное введение 0,02 % раствора гистохрома по 0,5 мл ежедневно в течение 10 дней в сочетании с сеансами гипербарической оксигенации. В группу сравнения были включены 58 пациентов (108 глаз), получавших традиционную консервативную медикаментозную терапию, включающую антиоксиданты, ангиопротекторы, метаболические и вазоактивные препараты. Пациенты каждой группы были подразделены на подгруппы в зависимости от стадии заболевания. В подгруппу с ранней стадией ВМД, согласно определению AREDS, включали пациентов с незначительными изменениями в пигментном эпителии макулярной области либо с начальной атрофией пигментного эпителия, твердыми мелкими или среднего размера друзами, остротой зрения от 0,5 до 1,0. Поля зрения не имели отклонений от нормы либо выявлялись единичные относительные парацентральные и центральные скотомы в пределах 5–7 градусов, а также нормальные или незначительно сниженные показатели критической частоты слияния мельканий. В подгруппы с поздней стадией ВМД были отнесены пациенты с негеографической и географической атрофией пигментного эпителия, значитель- 218 ным снижением остроты зрения (от сотых до 0,4). Вокруг зон атрофии просматривались друзы сливного характера. Осмотры пациентов после проведенного комплексного лечения проводили через три, шесть, двенадцать месяцев и два года. В комплексе с медикаментозным лечением пациентам основной группы назначали сеансы гипербарической оксигенации в одноместном медицинском бароаппарате «БЛКС — 303МК» (завод Мед. техники ГКНПЦ им. М. В. Хруничева, 2005, 2008 гг.) в режиме 1,2 ата со временем изопрессии 45 — 60 мин. Число сеансов — 8 на курс. Результаты и обсуждение. По результатам наблюдения установлено улучшение остроты зрения у пациентов основной группы на 0,3 (p<0,01) и на 0,1 (p<0,01) — у пациентов группы сравнения. При использовании комплексного лечения в 88,4 % случаев у пациентов с ВМД отмечено увеличение остроты зрения, тогда как при медикаментозной терапии этот показатель составлял 46 %. Статистический анализ подтвердил достоверность различий между группами наблюдения, которые оценивались с помощью критерия Манна-Уитни. Различия признавались достоверными при p<0,05. При сравнении проспективных данных выявлено, что достигнутая острота зрения у пациентов основной группы после лечения улучшалась к 3 месяцам наблюдения и сохранялась без достоверного снижения после лечения в течение более длительного периода наблюдения (от 6 до 12 месяцев), чем в группе сравнения. Через 6 месяцев наблюдения острота зрения сохранялась без отрицательной динамики в 93 % (107 глаз) случаев в основной группе и в 80 % (72) — в группе сравнения. К 12 месяцам в группе сравнения этот показатель сократился до 55 % (46). В основной группе острота зрения не имела отрицательной динамики в 80 % (89) обследованных глаз. К 24 месяцем динамического наблюдения острота зрения сохранялась без отрицательной динамики в 73 % (71) случаев в основной группе и лишь в 47 % (47) — в группе сравнения (см. рис.). Динамика повышения остроты зрения в период стационарного лечения (с 1 по 14 дни) отмечалась в более ранние сроки у пациентов основной группы (5±1 сутки), чем у пациентов группы сравнения (9±1 сутки). По данным периметрии у пациентов с ВМД основной группы в 32 % случаев скотомы после лечения полностью купировались, тогда как в группе сравнения уменьшение скотом зафиксировано лишь в 3 % случаев. Количество и сумма градусов скотом через 6 месяцев и до конца динамического наблюдения сохранялись без тенденции к росту, выше исходного значения в основной группе и начинали увеличиваться в группе сравнения. Изменения КЧСМ в основной группе показали эффективность комплексного лечения с применением ГБО в виде увеличения среднего показателя КЧСМ на 3 Гц (в 87 % случаев, 111 глаз) и сохранения этого уровня результата без снижения в течение 12 месяцев. При использовании медикаментозной терапии достигнутый эффект сохранялся лишь до трех месяцев. В дальнейшем наблюдалось достоверное снижение среднего показателя КЧСМ. При анализе результатов прямой офтальмоскопии у пациентов после комплексного лечения было отмечено рассасывание геморрагий в 95,2 %, тогда как после медикаментозной терапии кровоизлияния в макуле купировались лишь в 33,4 % случаев. При дальнейшем наблюдении выявлено, что рецидивы Динамика остроты зрения в исследуемых группах 219 геморрагических изменений в макулярной области чаще возникали у пациентов, которым гипербарическая оксигенация не проводилась. Таким образом, применение гипербарической оксигенации в комплексе с введением экзогенных антиоксидантов приводит к более выраженному и стойкому улучшению зрительных функций у пациентов неэкссудативной формой ВМД, по сравнению с курсом медикаментозной терапии. Более выраженный и продолжительный положительный эффект от лечения следует ожидать у пациентов с ранней стадией заболевания при остроте зрения выше 0,1. Следует учесть, что при лечении пациентов с ВМД с низкими исходными зрительными функциями можно рассчитывать на незначительную стимуляцию функциональной способности сетчатки, хотя возможно достичь стабилизации патологического процесса, улучшения адаптации к зрительным нагрузкам. При более высоких исходных зрительных функциях лечение направлено не только на предотвращение дальнейшего ухудшения, но и на существенное их улучшение. Механизм положительного воздействия гипербарического кислорода на сетчатку заключается в его прямом и непрямом действии. Прямое действие — устранение гипоксии сетчатки, которая стимулирует развитие окислительного стресса и служит пусковым механизмом для избыточной экспрессии пато- логических факторов роста сосудистого эндотелия, способствующих неоваскуляризации. Непрямое действие — усиление адаптационных механизмов в организме в ответ на гипероксию. На основании полученных результатов, мы можем предполагать, что в нашем исследовании основным механизмом воздействия ГБО являлся именно непрямой (неспецифический) ответ организма на гипероксию. Как известно, любое воздействие на организм или изменение его состояния, ведущее к нарушению метаболических и усилению окислительных процессов или накоплению окислительных повреждений, приводит к повышению риска развития ВМД. Воздействуя на весь организм в целом, мы старались улучшить метаболизм и энергетические процессы в клетках сетчатки, как «части целого» и получить положительный результат в лечении. Выводы. На основании полученных результатов можно говорить о некотором преимуществе сочетания антиоксидантов с сеансами ГБО перед медикаментозным лечением ВМД, исключающим баротерапию, что подтверждает целесообразность применения данного вида лечения. Преимущество заключается в улучшении и стабилизации зрительных функций в 80 % случаев в течение года наблюдения после комплексного лечения, наличие «эффекта последействия», который и определяет стойкость лечебного эффекта. М. М. Бикбов, У. Р. Алтынбаев, А. Л. Ярмухаметова, Ф. Р. Амангильдина Динамика функциональных свойств сетчатки на фоне интравитреального введения препарата Луцентис у пациентов с влажной формой возрастной макулярной дегенерации ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Вопрос диагностики влажной формы возрастной макулярной дегенерации (ВМД) является актуальной темой современной офтальмологии. Одной из высокоинформативных методик, позволяющих неинвазивно оценить морфологическую структуру мембраны Бруха, пигментного и нейросенорного эпителиев сетчатки и прилегающего к ним стекловидного тела, является оптическая когерентная томография (ОКТ) [1, 4]. Однако прямо судить о функциональном состоянии сетчатки по данным ОКТ не представляется возможным. Функциональные нарушения в центральном поле зрения при ряде офтальмологических заболеваний выявляются при помощи компьютерной периметрии. Однако при патологии макулярной области данный метод является малоэффективным, что связано со смещением и нестабильностью точки фиксации во времени. С появлением микропериметрии стало возможным определение световой чувствительности макулы у пациентов с нестабильной, смещенной точкой фиксации 220 и низкой остротой зрения [2, 3, 6, 7]. Неоспоримым преимуществом данного вида обследования является возможность наложения данных микропериметрии на цветовую фотографию глазного дна, что дает возможность точного определения функциональных показателей патологического очага. Цель — оценить функциональное состояние сетчатки у пациентов с влажной формой ВМД на фоне инравитреального введения препарата Луцентис. Материал и методы. В зависимости от исходных клинических особенностей патологического процесса пациенты были разделены на 3 группы: 1) c отслойкой пигментного эпителия, 2) с отслойкой нейроэпителия и формированием классической неоваскулярной мембраны, 3) с субретинальной неоваскуляризацией и явлениями фиброза (табл.) [5]. Распределение пациентов с влажной формой ВМД в зависимости от исходных клинических особенностей патологического процесса Отслойка Классическая Субретинальная пимгментнеоваску­ неоваскуляризация ного лярная с явлениями эпителия мембрана фиброза 8 пациентов 13 пациентов 9 пациентов (8 глаз) (16 глаз) (10 глаз) Возраст пациентов варьировал от 57 до 75 лет. Пациентам старше 75 лет обследование не проводилось ввиду замедленной реакции в ответ на подающиеся стимулы, что не достаточно соответствовало бы клиническим критериям достоверности. Всем пациентам выполнялась интравитреальная инъекция препарата Луцентис. Данные стандартного офтальмологического обследования и микропериметрии (Nidek — MP-1 Microperimeter) фиксировались непосредственно до инъекции и через 1 месяц после. При проведении микропериметрии использовался стандартный стимул размером 0,43° (Goldman III) и длительностью 200 мс. Применялась автоматическая программа, тестирующая 45 точек двенадцати градусов с центром в области фиксации, стратегия 4–2. Локализация точки фиксации и стабильность фиксации во времени определялась при помощи фиксационного теста. У пациентов первой группы острота зрения была умеренно снижена и в среднем составляла 0,4±0,06. Офтальмоскопически определялся субфовеальный, проминирующий в сторону стекловидного тела очаг с четкими контурами, вокруг очага в некоторых случаях определялись мягкие и сливные друзы. По данным микропериметрии фиксация у таких пациентов оставалась стабильной, центральной или парацентральной (3 человека) в пределах 2° от фовеа. Незначительное отклонение точки фиксации от центра очевидно было связано с отсутствием фовеолярного углубления и длительностью патологического процесса. Данные световой чувствительности в области отслойки пигментного эпителия были снижены на 12,9 дБ и составили 6,1±0,3 дБ в среднем. При попадании стимулов на область сливных очагов отмечено значительное снижение чувствительности на 4 дБ по сравнению с областью мягких друз. У пациентов второй группы острота зрения в среднем составила 0,1±0,08. Офтальмоскопически определялся экссудативный очаг отслойки нейроэпителия с геморрагиями. Неоваскулярная мембрана была расположена субфовеально, по периферии от нее выявлялась отслойка нейроэпителия с оптически прозрачным содержимым. По данным микропериметрии для этой группы пациентов была характерна нестабильность фиксации, размер области фиксации составлял 5,0–7,0°. Центр области фиксации был расположен в 2–4° от фовеа. Точка фиксации локализовалась в большинстве случаев в верхнем и наружном секторах у края патологического очага. Выявлено грубое снижение световой чувствительности макулярной области на 12,8 дБ с постепенным восстановлением в парацентральных областях. При попадании стимулов на область экссудативной отслойки нейроэпителия и неоваскулярной мембраны показатели световой чувствительности резко снижались до 0–2 дБ. Средние показатели световой чувствительности составили 6,2±0,04 дБ. Смещение точки фиксации происходило на границу между функционально активной тканью и тканью с грубыми нарушениями световой чувствительности. При наложении данных контрастной чувствительности на цифровую фотографию глазного дна эта область соответствовала границе экссудативной отслойки нейроэпителия. У пациентов третьей группы острота зрения в среднем составила 0,06±0,04. Офтальмоскопически субретинально определялась фиброзная ткань, могла выявляться незначительная экссудативная отслойка нейроэпителия. В некоторых случаях офтальмоскопировались геморрагии. По данным микропериметрии фиксация была нестабильной. 221 Размер области фиксации составлял 6,0–8,0°. Центр области фиксации был расположен эксцентрично в 7–10° от фовеа. Было выявлено грубое нарушение световой чувствительности на 18,9 дБ, со средним значением 0,1±0,05дБ. Результаты и обсуждение. У пациентов первой группы после однократной инъекции препарата Луцентис отмечалось незначительное улучшение остроты зрения, которая в среднем составила 0,5±0,04. Точка фиксации оставалась стабильной. Во всех случаях отмечалась центральность фиксации. Показатели световой чувствительности улучшились на 3,2 дБ, средние показатели составили 8,9±0,1 дБ. У пациентов второй группы острота зрения улучшилась и в среднем составила 0,3±0,08. Отмечено более центральное формирование новой точки фиксации, в 2–4° от фовеа. При наложении данных фиксационного теста на цифровую фотографию глазного дна эта область соответствовала границе остаточной экссудативной отслойки сетчатки и классической неоваскулярной мембране. У 5 пациентов (38,5 %) отмечалось усиление нестабильности фиксации, что вероятнее всего было связано с непривычностью месторасположения новой точки фиксации. Такие пациенты не отмечали улучшения качества зрения в послеоперационном периоде, не- смотря на офтальмоскопическую картину уменьшения отека сетчатки. Улучшения средних показателей световой чувствительности поля зрения на 45° с центром в области точки фиксации выявлено не было, что связано со смещением центрального поля зрения и формированием новой точки фиксации на границе функционально активной ткани и ткани с грубыми дефектами световой чувствительности. У пациентов третьей группы острота зрения улучшалась, если до лечения выявлялись признаки активности процесса. У 7 пациентов острота зрения улучшилась и в среднем составила 0,08±0,02. По данным микропериметрии фиксация после лечения оставалась нестабильной. Выявлено смещение точки фиксации к центру при наличии экссудативной отслойки нейроэпителия до лечения. Новая точка фиксации располагалась в 4–6° от фовеа, что соответствовало границе фиброзной ткани. Показатели световой чувствительности улучшились на 0,1 дБ и в среднем составили 0,25±0,06. Выводы. У пациентов с влажной формой ВМД на фоне лечения происходит улучшение функциональных показателей сетчатки. Улучшение качества фиксации и параметров световой чувствительности зависит от исходных клинических особенностей патологического процесса. Литература 1. Либман, Е. С. Состояние и динамика слепоты и инвалидности вследствие патологии органа зрения в России / Е. С. Либман, Е. В. Шахова // Тез. докл. 7 Съезда офтальмологов России. — М., 2000. — Ч. 1. — С. 509–510. 2. Bhatt, N. S. Choroidal neovascular membrane / N. S. Bhatt, J. G. Diamond, S. Jalali // Current ophthalmology. — 1998. — Issue 2. — V. 46. — P. 67–80. 3. Brown, D. M. Comparison of ranibizumab and vereporfin photodynamic therapy for neovascular age-related macular degeneration / D. M. Brown, P. K. Kaiser, M. Michels et al. for the Anchor Study Group // N. Engl. J. Med. — 2006. — V. 355. — P. 1432–1444. 4. Klein, R. Prevalence of age-related maculopathy / R. Klein, B. E. Klein, K. L. Linton // The Beaver Dam Eye Study. Ophthalmology. — 1992. — V. 99. — P. 933–942. М. М. Бикбов, У. Р. Алтынбаев, А. Л. Ярмухаметова, Р. М. Бикбулатов Анализ эффективности хирургического удаления неоваскулярных мембран у больных с влажной формой возрастной макулярной дегенерации ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Влажная форма возрастной макулярной дегенераС начала 90-х годов XX века в лечении влажной ции (ВМД) является ведущей причиной резкого и необ- формы ВМД получили распространение методы ратимого снижения центрального зрения у пациентов субмакулярной хирургии [1, 2, 3]. Однако в литестарше 65 лет в экономически развитых странах [4, 5]. ратуре нет однозначного мнения по поводу эффек222 тивности хирургического удаления неоваскулярных мембран. Необходимо дальнейшее изучение возможности дифференцированного хирургического лечения влажной формы ВМД в зависимости от стадии заболевания, размера и локализации патологического очага. Цель — определить эффективность хирургического удаления cубретинальных неоваскулярных мембран у больных с влажной формой ВМД в зависимости от клинико–морфологических особенностей патологического процесса. Материал и методы. Под наблюдением находились 20 пациентов с влажной формой ВМД. Всем пациентам до и после хирургического лечения проводилось стандартное офтальмологическое обследование. Оптическая когерентная томография (SOCT Copernicus HR Optopol technology) выполнялась до и через 1, 3 месяца после лечения. Показаниями к проведению хирургического лечения являлись клинико-морфологические признаки патологического очага, острота зрения с коррекцией ниже 0,3. Техника оперативного вмешательства заключалась в выполнении субтотальной витрэктомии 25G, дренировании субретинальной жидкости и удалении неоваскулярной мембраны через ретинотомическое отверстие у края экссудативной отслойки сетчатки. В зависимости от исходных клиникоморфологических особенностей патологического процесса пациенты были разделены на 3 группы: 1) с высокой отслойкой пигментного эпителия (4 пациента), 2) с активной классической неоваскулярной мембраной (6 пациентов), 3) с субретинальной неоваскуляризацией и явлениями фиброза (10 пациентов). У пациентов первой группы непосредственно до операции средняя корригированная острота зрения составляла 0,21±0,07. На OCT выявлялась куполообразная экссудативная отслойка пигментного эпителия с оптически прозрачным содержимым. Определялась деструкция слоя пигментного эпите- лия и фоторецепторов, а также очаговая гиперплазия пигментного эпителия (см. табл.). У пациентов второй группы корригированная острота зрения до лечения в среднем составляла 0,15±0,04. По данным OCT выявлялись отслойка нейроэпителия, кистозный отек сетчатки. Под слоем нейроэпителия визуализировался оптически неоднородный очаг — хориоидальная неоваскулярная мембрана (ХНВ), у 4 пациентов патологический очаг располагался экстрафовеально. В месте прорастания ХНВ слой пигментного эпителия и фоторецепторов отсутствовал (табл.). У пациентов третей группы средняя корригированная острота зрения до операции составляла 0,05±0,04. По данным OCT наблюдались незначительная экссудация под нейроэпителием, кистозный отек сетчатки. Под фиброваскулярной мембраной слой пигментного эпителия и фоторецепторов полностью отсутствовал. У 5 пациентов патологический очаг располагался экстрафовеально. Результаты и обсуждение. У пациентов первой группы в ходе оперативного вмешательства после дренирования субретинальной жидкости поверхность сетчатки оставалась неровной, что свидетельствовало о наличии неоваскулярной мембраны. В последующем мембрана мобилизовалась и удалялась пинцетом. К концу 1 месяца наблюдения острота зрения улучшилась и в среднем составила 0,42±0,08. По данным OCT отмечалось анатомическое прилегание слоев сетчатки, частичная деструкция пигментного эпителия и фоторецепторов. Толщина сетчатки в фовеа составила 172±10 мкм. Острота зрения, данные OCT оставались стабильными на всем протяжении периода наблюдения. У 2 пациентов второй группы на этапе удаления неоваскулярной мембраны произошло кровоизлияние в субретинальное пространство. Через 1 месяц после операции средняя коррегированная острота зрения составила 0,2±0,04. На OCT определялось истончение слоев сетчатки до 125±7 мкм, под сло- Клинико-морфологические особенности патологического процесса у пациентов с влажной формой ВМД Высокая отслойка пигментного эпителия Активная классическая ХНВ Субретинальная неоваскуляризация с явлениями фиброза Острота зрения Размер ХНВ (мкм) Высота экссудативной отслойки (мкм) Толщина сетчатки в фовеа (мкм) 0,21±0,07 0,15±0,04 — 535±70 × 1744±702 978±125 115±35 190±5 254±78 0,05±0,04 435±87 × 2537±125 56±25 358±42 223 ем нейроэпителия в местах послеоперационных геморрагий определялись плоские оптически плотные образования, в месте бывшей ХНВ определялся дефект пигментного эпителия и фоторецепторов. Средняя коррегированная острота зрения оставалась стабильной на протяжении всего периода наблюдения. Через 3 месяца по данным OCT на месте послеоперационных геморрагий определялись зоны гипоплазии пигментного эпителия, остальные данные оставались без изменений. Следует отметить, что при экстрафовеально расположенной мембране слой пигментного и нейросенсорного эпителия в фовеа был относительно сохранным, что проявлялось более высокой остротой зрения. У 3 пациентов третьей группы с обширной фиброзной неоваскулярной мембраной размерами 535±45 мкм на 2967±132 мкм и остротой зрения 0,005–0,01 интраоперационно было отмечено развитие массивных геморрагий и повреждений сетчатки, расширение ретинотомического доступа. Через 1 месяц после операции у 5 пациентов острота зрения улучшилась и в среднем составила 0,08±0,02. До операции у этих пациентов выявлялась экстрафовеально расположенная фиброваскулярная мембрана с экссудативной отслойкой нейроэпителия в фовеа. У 5 пациентов с субфовеальной фиброзной неоваскулярной мембраной острота зрения не изменилась. По данным OCT через 1 месяц после операции выявлено истончение слоев сетчатки до 115±15 мкм в фовеа, в месте прорастания мембраны определялось полное отсутствие слоя пигментного эпителия и фоторецепторов. Через 3, 6 месяцев динамического наблюдения не было выявлено ухудшения остроты зрения, рецидива неоваскуляризации, прогрессирования атрофии пигментного эпителия. Выводы. Хирургическое удаление хориоидальных неоваскулярных мембран позволяет улучшить и в дальнейшем стабилизировать зрительные функции у больных с ВМД. В целом прогноз оперативного лечения зависит от исходного размера и расположения неоваскулярной мембраны, активности процесса, целостности нейро- и пигментного эпителия. Литература 1. Казайкин, В. Н. Комбинированное лечение серозной отслойки пигментного эпителия сетчатки в макуле при возрастной макулярной дегенерации / В. Н. Казайкин, И. А. Малов // Современные технологии лечения витреоретинальной патологии: сб. тезисов. — М., 2009. 2. Столяренко, Г. Е. Хирургическое лечение транссудативных макулопатий: автореф. дис. … д-ра мед. наук / Г. Е. Столяренко. — М., 1990. — 40 с. 3. Bhatt, N. S. Choroidal neovascular membrane / N. S. Bhatt, J. G. Diamond, S. Jalali // Current ophthalmology. — 1998. — Issue 2. — V. 46. — P. 67–80. 4. Klein, R. Prevalence of age-related maculopathy / R. Klein, B. E. Klein, K. L. Linton // The Beaver Dam Eye Study. Ophthalmology. — 1992. — V. 99. — P. 933–942. 5. Liebowitz, H. M. The Framingham Eye Study monograph: An ophthalmological and epidemiological study of cataract, glaucoma, diabetic retinopathy, macular degeneration, and visual acuity in a general population of 2631 adults, 1973–1975 / H. M. Liebowitz, D. E. Krueger, L. R. Maunder [et al.] // Surv. Ophthalmol. — 1980. — V. 24. — P. 335–610. Г. Б. Валиева, С. Э. Шамсутдинова Применение антиоксидантных препаратов в терапии сухой формы возрастной макулярной дегенерации ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Возрастная макулярная дегенерация (ВМД) — прогрессирующее заболевание, характеризующееся поражением макулярной зоны, приводящее к снижению остроты зрения и выпадению центральных участков поля зрения. В России заболеваемость ВМД составляет более 15 на 1000 населения [2, 3]. По классификации Wisconsin (1991, США) выделяют следующие формы неэкссудативной ВМД: твердые друзы; мягкие друзы; дегенерация ретинального пигментного эпителия (РПЭ), которая включает в себя гиперпигментацию, гипопигментацию и мелкие очаги атрофии РПЭ; географическая 224 атрофия, представляющая собой обширные зоны гипо– и депигментации с полным отсутствием РПЭ и хориокапилляров [2]. Хронический дегенеративный процесс при ВМД затрагивает пигментный эпителий сетчатки (ПЭС), мембрану Бруха и хориокапиллярный слой. ПЭС принимает участие в метаболизме витамина А, синтезе меланина, транспорте веществ между фоторецепторами. Одной из важнейших функций ПЭС является участие в фагоцитозе, лизисе и удалении сбрасываемых дистальных сегментов фоторецепторов. Существенная роль в патогенезе ВМД принадлежит повреждающему действию окислительных процессов на сетчатку. Последняя постоянно подвергается сочетанному воздействию света и кислорода, что создает идеальные условия для синтеза свободных радикалов; также она содержит в большом количестве чувствительные к окислению полиненасыщенные жирные кислоты. Кроме того, особенностью сетчатки является высокая чувствительность к гипоксии. Под действием кислорода в результате цепи биохимических реакций образуются свободные радикалы, играющие важную роль в развитии ВМД. Перекисное окисление липидов приводит к появлению больших молекулярных цепочек, которые не распознаются ферментами ПЭС, не подвергаются распаду и накапливаются, постепенно приводя к образованию друз. Друзы чаще образуются в макулярной области, чем в парамакулярной или перипапиллярной областях. Они могут быть единичными и множественными, различаться по размеру, форме, степени выстояния и сопутствующим изменениям ПЭС. В зависимости от степени разрушения пигментного эпителия, границы друз могут быть четкими и нечеткими. В системе защиты сетчатки от фототоксичной коротковолновой части спектра видимого света, инфракрасных и ультрафиолетовых лучей участвуют роговица, хрусталик, макулярный пигмент, меланин. По данным гистологического исследования, макулярные пигменты расположены в слое волокон Генле или аксонов фоторецепторов. «Желтый» макулярный пигмент состоит из лютеина и зеаксантина и осуществляет как активную (нейтрализует действие свободных радикалов), так и пассивную защиту сетчатки (ограничивает голубой свет, вызывающий фотооксидантное повреждение, активируя на дорецепторном уровне фильтр для голубого света). Существуют данные, что лютеин и зеаксантин располагаются не только перед фоторецепторами в качестве пассивного оптического фильтра, но обнаружены, хотя и в меньших концентрациях, в наружном сегменте фоторецепторов. Различают следующие группы риска: 1) низкая плотность пигмента макулы: исследования показали, что плотность пигмента макулы гораздо выше в здоровых глазах, чем у тех, кто страдает ВМД; 2) курение: сигаретный дым увеличивает образование вредных свободных радикалов, поэтому у курильщиков риск заболеть ВМД в два раза выше, чем у некурящих; 3) несбалансированная диета: отсутствие или недостаток необходимых витаминов или микроэлементов ослабляет антиоксидантную систему организма; 4) ожирение: у людей с избыточной массой тела обнаружено низкое количество каротиноидов; 5) прямое воздействие солнечных лучей поражает глазную сетчатку, поэтому офтальмологи рекомендуют использовать для защиты глаз солнцезащитные очки; 6) представители этнической группы: люди со светлой кожей и голубым цветом радужной оболочки глаз в большей степени подвержены ВМД; 7) пол: женщины более подвержены ВМД, чем мужчины; 8) наследственность; 9) повышенное артериальное давление: может послужить причиной тромбоза в глазных кровеносных сосудах, и спровоцировать развитие ВМД; 10) при поражении ВМД одного глаза существует большая вероятность поражения другого. Для лечения и профилактики прогрессирования сухой формы ВМД и при высоком риске развития заболевания с целью нормализации обменных процессов в сетчатке рекомендуют проводить курсы антиоксидантной терапии. Среди соединений, способных защитить сетчатку от окислительного стресса и развития ВМД, особая роль отводится каротиноидам. Около 50 каротиноидов обнаружены в желто-оранжевых фруктах и темно-зеленых овощах. Их поступление в организм напрямую связано с питанием, так как в организме человека они не синтезируются. В плазме человека в значительных количествах содержится 6 каротиноидов: a- и b-каротин (из моркови), b-криптоксантин (из цитрусов), ликопин (из томатов), лютеин (из шпината) и зеаксантин (из кукуру- 225 зы). В сетчатку транспортируются только лютеин и зеаксантин, где они формируют «желтый» макулярный пигмент или макулярный ксантофилл. Положительное влияние антиоксидантов на плотность макулярного пигмента было зафиксировано в нескольких исследованиях. Так, например, ежедневное назначение комплекса, включавшего 12 мг лютеина, 1 мг зеаксантина, 120 мг витамина С, 17,6 мг витамина Е, 10 мг цинка и 40 мг селена в течение 6 мес. способствовало увеличению толщины макулярного пигмента. Также наблюдался защитный эффект лютеина и зеаксантина в отношении сетчатки у пациентов с ВМД [7]. В исследовании, проведенном в 2004 г. Johncon E. J., было отмечено положительное влияние на состояние макулярного пигмента при приеме лютеина в дозах 12 мг ежедневно в течение 4 мес. Была изучена эффективность длительного приема (в течение 6 мес.) Окувайта лютеина, в состав которого входят лютеин, зеаксантин, витамины, цинк и селен, у 108 пациентов с ВМД в возрасте 51–87 лет. Прием ежедневной дозы лютеина 12 мг и зеаксантина 1 мг способствовал увеличению плотности макулярного пигмента на 0,5 %. Эффект сохранялся в течение 9 мес. после прекращения приема препарата и поддерживался обычной сбалансированой диетой. Прием высоких доз специфической антиоксидантной добавки, содержащей аскорбиновую кислоту (500 мг), витамин Е (400 МЕ), b–каротин (15 мг) в сочетании с высокой дозой цинка (80 мг в виде цинка оксида) и 2 мг меди в виде оксида меди, сопровождался снижением частоты развития поздней стадии ВМД на 25 %, а риск потери остроты зрения на 3 и более строчек снизился на 19 % [5, 6]. В исследовании CAREDS (Carotenoids in Age– Related Eye Disease) участвовало1787 женщин в возрасте от 50 до 79 лет. Анализ данных показал, что диета, богатая лютеином и зеаксантином, может предотвращать развитие умеренно выраженной ВМД у женщин моложе 75 лет [7, 8]. Также отмечалось, что немаловажная роль в защите сетчатки от токсического поражения отведена ионам цинка. Известно, что цинк препятствует накоплению кадмия в пигментном эпителии сетчатки и предотвращает его токсическое действие. Сравнительная оценка влияния цинка и магния выявила больший протективный эффект цинка. Существуют данные, свидетельствующие о необходимости дополнительного приема ликопина, который также предупреждает последствия окислительного стресса. В лечении сухой формы ВМД также используют препараты, содержащие экстракт черники. В плодах черники в высокой концентрации содержатся антоцианозиды, обладающие противовоспалительным и антиоксидантным действием, улучшающие реологические свойства крови и снижающие сосудистый тонус. Антоцианозиды регулируют биосинтез коллагена, способствуют восстановлению окисленного родопсина и улучшению трофики сетчатки за счет коррекции микроциркуляции, транскапиллярного обмена и восстановления тканевых механизмов защиты. В настоящее время в РФ зарегистрированы витаминно-минеральные комплексы, содержащие каротиноиды и микроэлементы, предназначенные для профилактической и заместительной терапии при сухой форме ВМД. Согласно рекомендациям Российского экспертного совета по ВМД (2009 г.), содержание в препарате лютеина должно быть минимум 2 мг, так как суточная доза для профилактики ВМД в группе риска составляет не менее 6,0 мг. Эффективность усвоения и действия повышают ликопин и b-каротин. Важно получение достаточного количества микроэлементов, в первую очередь таких, как цинк — более 10 мг в день. Этим требованиям наиболее соответствуют лютеинсодержащие препараты: Окувайт Лютеин («Chauvin Ankerpharm», Германия), Фокус («АКВИОН», Россия), Лютеин–Комплекс («Экомир», Россия), Витрум Вижн («Unipharm Inc.», CША). Состав лютеинсодержащих препаратов приведен в таблице. 226 Состав лютеинсодержащих препаратов Действующее Окувайт Лютеин Фо- Витрум вещество лютеин комплекс кус вижн Лютеин, мг 3,0 2,0 2,0 2,5 Зеаксантин, мг 0,25 — — 0,5 Ликопин, мг — — 1 1,5 b-каротин, мг — 1,3 3 1,5 Цинк, мг 2,5 5 15 5 Селен, мкг 10 15 — — Медь, мг — 0,5 — 1 Таурин, мг — 50 — — Вит В2 — 1,7 — — Вит А — 0,5 — — Вит Е, мг 4,4 15 10 36 Вит С, мг 30 — 70 225 Экстр. черники, мг — 130 50 — Заместительная терапия для профилактики и лечения сухой формы ВМД должна применяться у лиц старше 50 лет, а при наличии факторов риска (курение, избыточный вес, отягощенный анамнез, экстракция катаракты) — и ранее. Однако следует помнить, что препараты, содержа- щие b–каротин, нельзя назначать курящим пациентам, так как он способствует увеличению риска развития рака легких. Назначение длительной терапии требует индивидуального подхода и оценки всех возможных факторов риска для пациента. Литература 1. Журавлева, Л. В., Бойко, Э. В., Чурилова, И. В. [и др.] // VI Всероссийск. школа офтальмол.: сб. науч. тр. — М., 2007. — С. 275–283. 2. Кацнельсон, Л. А. Клинический атлас патологии глазного дна / Л. А. Кацнельсон, В. С. Лысенко, Т. И. Балишанская. — 3–е изд., стер. — М., 2004. — 152 с. 3. Либман, Е. С. Состояние и динамика слепоты и инвалидности вследствие патологии органа зрения в России / Е. С. Либман, Е. В. Шахова // Мат-лы VII съезда офтальмологов России. — М., 2000. — С. 209–214. 4. Нащенкова, О. В. Медикаментозное лечение возрастных макулярных дегенераций / О. В. Нащенкова // III Всероссийск. школа офтальмол.: сб. науч. тр. — М., 2004. — С. 281–289. 5. Devaraj, S. A dose-response study on the effects of purified lycopene supplementation on biomarkers of oxidative stress / S. Devaraj, S. Mathur, A. Basu [et al.] // J. Am. Coll. Nutr. — 2008. — Vol. 27. — № 2. — P. 267–273. 6. Tan, J. S. Dietary antioxidants and the long-term incidence of age–related macular degeneration: the Blue Mountains / J. S. Tan, J. J. Wang, V. Flood [et al.] // Eye Study. Ophthalmology. — 2008. — Vol. 115. — № 2. — P. 334–341. 7. Wills, N. K. Copper and zinc distribution in the human retina: relationship to cadmium accumulation, age, and gender / N. K. Wills, V. M. Ramanujam, N. Kalariya [et al.] // Exp. Eye Res. — 2008. — Vol. 87. — № 2. — P. 80–88. 8. Zeimer, M. The macular pigment: short- and intermediate-term changes of macular pigment optical density following supplementation with lutein and zeaxanthin and co-antioxidants. The LUNA Study / M. Zeimer, H. W. Hense, B. Heimes [et al.] // Ophthalmologe. — 2009. — Vol. 106. — № 1. — P. 29–36. З. Н. Валиуллина, В. К. Суркова Пути профилактики ретинальных осложнений у пациентов с сахарным диабетом 2 типа ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Для успешного лечения хронического заболевания, врачу должен помочь сам пациент, который обязан знать причину, течение болезни и ее возможный исход. Осведомленности больного помогает обучение тактики по отношению к заболеванию. Особо это касается сахарного диабета и его осложнений со стороны органа зрения. Школа здоровья — медицинская профилактическая услуга, основанная на совокупности индивидуального и группового воздействия на пациентов, направленная на повышение уровня знаний, информированности и освоение практических навыков по рациональному лечению заболевания, улучшение прогноза и качества жизни. Сахарный диабет (СД) — важная медикосоциальная проблема, т. к. заболевание все чаще развивается у лиц молодого возраста, приводя к частичной, а иногда и полной утрате трудоспособности. СД требует от пациента изменения образа жизни, стратегий своего поведения [2, 4]. Можно утверждать, что при СД результаты лечения всегда опосредованы поведением больного [3]. Наиболее опасны глазные осложнения сахарного диабета, особенно ретинопатия. Медикаментозное лечение органа зрения у больных СД необходимо начинать на стадии диабетической ангиопатии (доклинической стадии ретинопатии), когда возможно не только повышение остроты зрения, но и восстановление до нормы [1]. К сожалению, большинство пациентов не осведомлены о возможных осложнениях СД. Поэтому пациентам необходимы образовательные программы для знания своего заболевания. Цель — повысить эффективность профилактики и лечения ретинопатии у пациентов с сахарным диабетом 2 типа путем создания и проведения образовательной программы. Материал и методы. Нами разработана образовательная программа для пациентов с диабетиче- 227 ской ретинопатией, представленная в виде методических рекомендаций «Организация и проведение образовательной программы врачом-офтальмологом в амбулаторно-поликлинических условиях для больных сахарным диабетом 2 типа». Обучающая программа для пациентов предполагает проведение 2 занятий продолжительностью 60 минут, один раз в неделю. Для обучения больных нами была разработана специальная программа, отражающая коррекцию модифицированных факторов риска, необходимость повышения приверженности к лечению СД и патологии органа зрения. Для проведения образовательной программы были отобраны 43 пациента с СД 2 типа в возрасте от 25 до 50 лет. Средняя длительность сахарного диабета составила 3,3±1,6 года. В первую группу вошли 20 человек без диабетической ретинопатии (ДР), во вторую — 23 пациента с начальной непролиферативной ДР. Оценка эффективности образовательной программы проводилась путем сравнения изучаемых показателей до обучения и через 6 месяцев после обучения. Группу контроля составили 30 человек, которые не прошли обучение. Результаты и обсуждение. Показатели факторов риска и приверженность к лечению у больных СД 2 типа через 6 месяцев после проведения образовательной программы изменились следующим образом. Повысилось число лиц, которые попытались бросить курить: среди пациентов без ДР — на 40 % и с ретинопатией — на 30,4 % (р<0,05). Уменьшили количество выкуриваемых сигарет после обучения 80 % пациентов без ДР и 85,7 % с ретинопатией (р<0,05). Уменьшилась доля лиц, употребляющих алкоголь 2–3 раза в месяц, среди больных без ДР — с 40 % до 25 %, а среди пациентов, имеющих ретинопатию — с 30,4 % до 17,2 % (р>0,05). Возросло число больных, которые увеличили двигательную активность в свободное от работы время: среди больных без ДР — на 15 % (р>0,05), а среди пациентов имеющих ДР — на 26,1 % (р>0,05). После проведения образовательной программы 1 (5 %) пациент без ДР в течение 6 месяцев снизил массу тела, а среди больных с ретинопатией таковых было 4 (17,4 %) человека. В обеих группах отмечалось увеличение числа лиц, которые стали регулярно принимать антигипертензивные препараты, согласно рекомендациям врача, с 30 % до 45 % (р>0,05) в группе без ДР и с 30,4 % до 52,2 % (р>0,05) — в группе больных с ретинопатией. Также мы наблюдали увеличение доли лиц, принимающих гипоглюкоземирующие препараты, в группе без ДР с 65 % до 80 % (р>0,05), в группе, имеющих ДР — с 43,5 % до 78,3 % (р<0,05). Среди пациентов с ретинопатией отмечено достоверное увеличение доли лиц с 4,3 % до 26,1 % (р<0,05), принимающих офтальмологические лекарственные препараты. В результате обучения пациенты стали серьезнее относится к своему состоянию, чаще контролировать АД и уровень глюкозы в крови. Доля пациентов, регулярно измеряющих АД, в группе без ДР возросла с 30 % до 50 % (р>0,05) и в группе больных с ретинопатией — с 30,4 % до 60,9 % (р<0,05). Число больных, регулярно проверяющих уровень глюкозы крови в группе без ретинальной патологии увеличилось с 70 % до 90 % (р<0,05) и в группе больных с ретинопатией — с 60,9 % до 86,9 % (р<0,05). У пациентов с СД 2 типа, имеющих ДР, через 6 месяцев прогрессирование ретинопатии не выявлено, но в группе без ДР у 1 (5 %) пациента диагностирована начальная непролиферативная стадия заболевания (р>0,05). В группе контроля — 30 человек, из числа тех, у кого ранее диагностирована начальная непролиферативная ДР, выявлена умеренная непролиферативная ДР у 3 (10 %) человек (р<0,05) и тромбоз центральной вены сетчатки — у 1 (3,3 %) больного. Выводы. В результате проведения у больных с СД 2 типа обучения по образовательной программе формирования здорового образа жизни и улучшению приверженности к лечению уменьшились негативные поведенческие привычки по отношению к курению, потреблению спиртных напитков, увеличилось число лиц, занимающихся физкультурой, повысилась приверженность к выполнению медикаментозных рекомендаций по профилактике и лечению заболеваний, что отразилось на отсутствии прогрессирования диабетической ретинопатии. Литература 1. Кашинцева, Л. Т. Применение препарата липохромин в лечении ранних стадий диабетических изменений глазного дна / Л. Т. Кашинцева, В. С. Пономарчук, Т. В. Дегтяренко // Офтальмол. журн. — 2001. — № 1. — С. 10–12. 228 2. Сидоров, П. И. Внутренняя картина болезни при сахарном диабете / П. И.Сидоров, И. А. Новикова, А. Г. Соловьев, Н. Н. Мулькова // Проблемы эндокринологии. — 2004. — Т. 50. — № 3. — С. 3–6. 3. Суркова, Е. В. Значение некоторых психологических факторов в контроле и лечении сахарного диабета / Е. В. Суркова // Проблемы эндокринологии. — 2004. — Т. 50. — № 1. — С.44–47. 4. Kleefstra, N. Prediction of Mortality in Type 2 Diabetes From Health-Related Quality of Life (ZODIAC-4) / N. Kleefstra, W. D. Landman, S. T. Houweling [et al.] // Diabetes Care. — 2008. — № 31. — P. 932–933. Р. Т. Габсаликова, А. З. Калентьева Результаты интравитреального введения гемазы в комплексном лечении гемофтальма ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Кровоизлияния в стекловидное тело нередко являются отягощающим фактором различных заболеваний как самого глазного яблока, так и всего организма в целом [2]. Одной из причин неблагоприятных исходов гемофтальма является длительное нахождение и организация крови в полости стекловидного тела. Стекловидное тело при интравитреальных кровоизлияниях выступает в качестве депо токсических продуктов, оказывающих цитотоксическое действие на микроструктуры стекловидного тела и внутренних оболочек глаза [3] и, следовательно, основная цель любой лечебной тактики при гемофтальме состоит в своевременной ликвидации крови из стекловидного тела. Поэтому поиск и использование интенсивных и доступных в широкой клинической практике методов лечения представляются нам достаточно актуальными. Одним из таких препаратов является гемаза — фибринолитик, катализирующий превращение плазминогена в плазмин, тем самым лизирующий фибриновые сгустки. Эффективность использования гемазы в лечении внутриглазных кровоизлияний не вызывает сомнений, а в последнее время препарат активно используется интравитриально [1, 4]. Цель — изучение эффективности интравитреального введения гемазы в комплексном лечении гемофтальма. Материал и методы. Основным материалом для настоящего исследования послужили результаты комплексного обследования и лечения 30 пациентов с гемофтальмом, Находившихся на лечении в IV хирургическом отделении УфНИИ ГБ. Возраст больных вариировал от 51 до 75 лет. Среди них были 19 женщин (63,3 %) и 11 мужчин (36,7 %). Причем у лиц работоспособного возраста (до 60 лет) гемофтальм был выявлен у 63 %. Причинами гемофтальма были: гипертония — 17 пациентов, диабетическая ретинопатия — 13. Пациенты были разделены на 2 группы. Первая группа — 15 больных (50 %) получали общепринятое офтальмотерапевтическое лечение: гемазу, гепарин в сочетании с дексазоном в виде параокулярных инъекций, дицинон внутримышечно, антиоксиданты, лазеротерапию. Вторая группа — 15 пациентов (50 %), наряду с вышеописанной схемой, в комплексном лечении гемофтальма получали однократное введение гемазы в стекловидное тело. Инъекция препарата осуществлялась классическим способом в условиях операционной инсулиновым шприцем в разведении на физиологическом растворе в дозе 0,1 мл гемазы (500 Ед). При необходимости производили парацентез для нормализации внутриглазного давления. Выполняли субконъюнктивальную инъекцию антибиотика и дексаметазона. В послеоперационном периоде назначали антибиотики и нестероидные противовоспалительные препараты. Для оценки эффективности лечения использовали общепринятые клинические офтальмологические методики исследования (визометрия, тонометрия, периметрия, офтальмоскопия, биомикроскопия), УЗВ-сканирование. Результаты и обсуждение. При использовании вышеописанной хирургической методики осложнений, связанных с введением гемазы в стекловидное тело, как во время операции, так и в раннем послеоперационном периоде не отмечалось. Исходная острота зрения была практически одинакова в обеих исследуемых группах. Распределение пациентов по остроте зрения и результаты лечения оценивали на 10-й день (табл.). Из таблицы видно, 229 что 94 % пациентов имели исходную остроту зрения ниже 0,1. Анализ динамики остроты зрения показал, что после лечения зрение ниже 0,1 отмечено уже у 62 % пациентов первой группы и 48 % пациентов второй группы. Примечательна группа пациентов с низким зрением (меньше 0,01), которая до лечения составляла 43 %, после лечения сократилась до 11 % в первой группе и не осталась во второй. Средний прирост остроты зрения составил 0,132±0,02. При биомикроскопии и эхографическомконтроле (В-сканирование) отмечено значительное уменьшение плотности гемофтальма у 78 % пациентов в первой группе и 84,4 % — во второй; с 18Дб до 13,8 Дб соответственно, что позволило уточнить и, в ряде случаев, детализировать состояние сетчатки (офтальмоскопия) для планирования дальнейшего лечения. У части пациентов, несмотря на просветление стекловидного тела, острота зрения оставалась низкой из-за наличия далекозашедшей пролиферативной ретинопатии. Динамика остроты зрения Острота зрения 1\∞ pr cer-0,05 0,01–0,03 0,04–0,09 0,1–0,3 0,4–0,9 До лечения 43 % 34 % 17 % 6 % — Консервативное лечение 11 % 22 % 29 % 36 % 2 % ИВВ гемазы — 21 % 27 % 48 % 4 % Выводы. В ходе проведенного исследования отмечена положительная динамика после использования интравитриального введения гемазы. Данный метод лечения позволяет повысить зрительные функции, способствует стабилизации заболевания. Литература 1. Бойко, Э. В. О перспективах применения проурокиназы для лечения гемофтальма и фибриноидного синдрома после ленсвитрэктомии / Э. В. Бойко, В. Ф. Даниличев, С. В. Кольцова // III Российский национальный конгресс «Человек и лекарство»: тез. докл. — М., 1996. — С. 74–76. 2.Иванов, А. Н. Гемофтальм: ИАГ. — лазерное лечение / А. Н. Иванов, Е. Н. Дегтярева // Проблемы современно офтальмологии: сб. науч. трудов. — Уфа, 2006. — С. 60–61. 3.Логай, И. М., Метелицина, И. П. [и др.] // Офтальмол. журн. —1992. — № 5–6. — С. 304–307. 4. Тахчиди, Х. П. Применение гемазы для стимуляции задней отслойки стекловидного тела на глазах с отслойкой сетчатки / Х. П. Тахчиди, В. Д. Захаров, Л. Э. Бадалова [и др.] // Офтальмохирургия. — 2003. — № 4. — С. 14–16. Р. А. Гундорова Витрэктомия в лечении посттравматической рецидивирующей гифемы ФГУ «МНИИ глазных болезней им. Гельмгольца» Минздравсоцразвития России, г. Москва В отечественной и зарубежной литературе в основном обсуждается вопрос лечения послеоперационной, реже — посттравматической гифемы [Петропавловская Г. А., 1970; Краснов А. М., 1972; Кроль А. Г., 1972; Лебехов П. И., 1972]. Гифемы классифицируются по причинам возникновения, консистенции, размерам. Из методов лечения кровоизлияний в переднюю камеру предлагаются инстилляции химотрипсина и кортикостероидов, субконъюнктивальные инъекции трипсина, фибринолизина, подконъюнктивальное введение кислорода, кортизона, дексаметазона и т. д., лечение гиперосмотическими средствами. Однако в указанных выше работах практически отсутствуют сведения о патогенетических факторах, способствующих рецидиву гифемы, а, следовательно, и о методах терапии данного тяжелого осложнения. В связи с этим представляет интерес разработка методов лечения рецидивирующих кровоизлияний в переднюю камеру, возникновение которых вызывается постоянным поступлением крови из стекловидного тела. Чаще всего кровоизлияние в переднюю камеру и стекловидное тело бывает вызвано контузией глаза, субконъюнктивальными разрывами склеры, проникающим ранением цилиарного тела. При этом не- 230 редко, при наличии травматической катаракты диагноз гемофтальма клинически поставить не удается. В ряде случаев, при грубых изменениях известную помощь оказывает ультразвуковая диагностика. Однако при свежих диффузных процессах в стекловидном теле диагноз гемофтальма окончательно установить не удается. И, пожалуй, единственным симптомом, указывающим на наличие изменений, происходящих в стекловидном теле, в таких случаях являются рецидивирующие кровоизлияния в переднюю камеру. При этом, как правило, имеется и подвывих хрусталика. Очевидно, следует считать, что при рецидивирующей гифеме, вызванной ранением сосудистой оболочки или цилиарного тела (без ранения радужной оболочки), причиной постоянного обновляющегося кровоизлияния в переднюю камеру является поступление крови из стекловидного тела. Кроме того, известно, что «чистая» гифема при контузии глаза и ранении его довольно быстро рассасывается. Если же гифема рецидивирует и поддерживается длительное время, следует считать, что имеется кровоизлияние в стекловидное тело. Эффект терапевтического лечения находится в зависимости от патогенеза возникновения гифемы. В случаях, где кровоизлияние ограничивается только передней камерой, оно довольно быстро рассасывается в первые дни от применения фибринолизина, трипсина, кортикостероидов. Известно, что все вышеуказанные средства не дают быстрого эффекта при кровоизлиянии в стекловидное тело, лечение которого должно проводиться очень длительно. В таких случаях, как показывает наш опыт, только замещение стекловидного тела дает быстрый положительный лечебный эффект. К такому заключению мы пришли на основании наблюдений за 11 больными, у которых было проникающее ранение глаза области цилиарного тела и оболочек. Возраст больных был в пределах 22–40 лет. Клинически у всех больных отмечалась гифема, занимающая половину или три четверти передней камеры. Четырем больным ранее была произведена первичная хирургическая обработка склеральной раны. У четырех других больных клинически была картина субконъюнктивального разрыва склеры, который не был выявлен при ревизии, вследствие локализации разрыва в заднем отделе глазного яблока. Трое больных поступили в отделение института с последствиями тяжелой контузии глаза и рецидивирующей гифемой через 1–1,5 месяца после трав- мы. Этим больным ревизии в свое время произведено не было. У 6 больных была травматическая катаракта, у 5 хрусталик был прозрачен и просматривалась кровь в стекловидном теле. Длительное лечение (до 2 месяцев) всеми рекомендуемыми в настоящее время средствами эффекта не дало. У 4 больных произведен парацентез, который дал временный эффект. Через 4–5 дней после отмены постельного режима гифема появилась вновь. Радикальным методом лечения рецидивирующей гифемы, причиной которой является гемофтальм, является тотальная витрэктомия с осмотром состояния глазного дна. При выявлении сосудистой патологии необходимо проведение эндолазеркоагуляции. Интравитреальная блокада осуществляется воздухом или газовоздушной смесью. В случаях начинающейся субатрофии глазного яблока, когда речь шла о попытке его сохранения, производилось замещение стекловидного тела силиконом. У 3 больных при проведении подобных операций мы встретились с наличием грубых сосудисто-склеральных рубцов, образовавшихся вследствие субконъюнктивальных разрывов склеры, своевременно не обработанных. Возможно, что длительное «вторичное» заживление подобных ран способствовало постоянному поступлению крови в стекловидное тело и переднюю камеру. После введения заменителя стекловидного тела, клинически отмечалось полное рассасывание гифемы на вторые сутки. Рецидивы у всех оперированных больных не наблюдались. Клиническое течение было безреактивным. У двух больных отмечено значительное уменьшение площади имбибиции роговицы кровью в течение последующих двух недель наблюдения. У тех пациентов, у которых просматривалось стекловидное тело, можно было отметить частичное рассасывание крови, у одного больного — появление рефлекса с глазного дна. Острота зрения, которая у всех больных до операции была в пределах светоощущения с правильной проекцией света, повысилась до 0,01 у 4 больных, до 0,1 — у одного больного, у остальных осталась без изменений. Вывод. Операция замещения стекловидного тела может быть рекомендована при рецидивирующих травматических гифемах, сопровождающихся гемофтальмом. 231 И. А. Дашко, И. В. Запускалов, О. И. Кривошеина ЭФФЕКТИВНОСТЬ КОМБИНИРОВАННОЙ ПНЕВМОРЕТИНОПЕКСИИ В ХИРУРГИИ РЕГМАТОГЕННОЙ ОТСЛОЙКИ СЕТЧАТКИ Сибирский государственный медицинский университет, г. Томск Проблема лечения регматогенной отслойки сетчатки является одной из наиболее актуальных в современной офтальмологии. Целью оперативного вмешательства при данной патологии является восстановление нормального анатомотопографического положения сетчатки, которое может быть достигнуто лишь при надежном закрытии ретинального дефекта и устранении тракционного компонента [1, 6, 7]. На современном этапе существует три основных патогенетически ориентированных подхода к хирургическому лечению отслойки сетчатки: склеропластический, витреоретинальный и сочетанный. Склеропластические операции характеризуются относительной простотой технических приемов и малой травматичностью [1, 5]. Тем не менее, в ряде случаев возможно развитие интра- и послеоперационных осложнений, таких как гемофтальм (15,8 %), субретинальные кровоизлияния (57,9 %), разрыв склеры (10,5 %). Рецидивы отслойки сетчатки в различные сроки после операции (от 1 до 6 месяцев) наблюдаются в 3,2–4,9 % случаев и обусловлены неполноценным эффектом вдавления склеры. Тактика и объем витреоретинальных вмешательств, выполняемых при регматогенной отслойке сетчатки, определяются в каждом конкретном случае индивидуально, исходя из особенностей клинической картины [2, 3, 4]. Однако, несмотря на интенсивное развитие микрохирургической техники, частота анатомического прилегания ретинальной ткани при тяжелых формах отслойки не превышает 65 %. Неудовлетворенность результатами оперативных вмешательств, высокая частота развития осложнений обусловливают поиск и разработку новых методов хирургического лечения регматогенной отслойки сетчатки. Цель — повышение эффективности хирургического лечения регматогенной отслойки сетчатки с помощью комбинированной пневморетинопексии. Материал и методы. Разработан новый способ хирургического лечения регматогенной отслойки сетчатки, заключающийся в проведении пневмо- ретинопексии стерильным воздухом в комбинации с эпиретинальным введением раствора коллализина и транссклеральным выведением субретинальной жидкости в ретробульбарное пространство. Суть операции заключается в следующем: предварительно формируется субтенонеальный канал, идущий к заднему полюсу глаза в направлении проекции купола отслойки. Далее через плоскую часть цилиарного тела в области меридиана противоположного ретинальному разрыву под углом 45° к склере вводится инъекционная игла, надетая на шприц, содержащий 0,1 мл изотонического раствора хлорида натрия и коллализин в дозе 2–10 клостридиальных единиц (КЕ) и стерильный воздух. Под контролем бинокулярного офтальмоскопа с лазерной насадкой игла продвигается до области ретинального разрыва. В непосредственной близости к разрыву сетчатки вводится фермент (до прекращения пульсации центральной артерии сетчатки), а игла продвигается вперед через ретинальный разрыв, производится прокол хориоидеи и склеры. После образования сквозного отверстия в фиброзной оболочке игла возвращается в полость глаза, создавая возможность оттока субретинальной жидкости через образовавшуюся склеротомию ретробульбарно за счет вводимого эпиретинально стерильного воздуха, до полного расправления сетчатки. Далее выполняется лазер- или криокоагуляцию вокруг ретинального разрыва или области ретинотомии, после чего поршень шприца продвигается дальше, заполняя полость глаза стерильным воздухом, игла извлекается из глаза. На область конъюнктивотомии накладывается узловой шов, субконъюнктивально вводится антибиотик и кортикостероид в стандартных дозировках. В течение суток больному рекомендуется находиться вниз лицом. Клинические исследования проведены у 34 пациентов с регматогенной отслойкой сетчатки, разделенных в зависимости от способа лечения на 3 группы: 1-я группа (16 человек) — пневморетинопексия с введением коллализина и лазеркоагуляцией сетчатки, 2-я группа (18 человек) — пневморетинопексия с введением коллализина и криопексией, 3-я группа 232 (15 человек) — эписклеральное пломбирование по стандартной методике. Наиболее часто у пациентов исследуемых групп диагностировалась свежая (до 2 недель) экваториальная или парамакулярная регматогенная отслойка сетчатки различной степени выраженности. Результаты и обсуждение. У пациентов 1-й группы удалось достичь стабилизации остроты зрения с коррекцией на исходном уровне в течение полугода (табл.). Однако, в последующие 6 месяцев показатели в среднем уменьшились на 0,07±0,05. Снижение данного показателя связано с рецидивом отслойки сетчатки через 6 месяцев после оперативного вмешательства в связи с прогрессированием у 1-го пациента диабетической пролиферативной витреоретинопатии. Поле зрения в проекции отслойки сетчатки расширилось в среднем от 10° до 60°. Во 2-й группе пациентов среднее значение остроты зрения в течение первого месяца после операции возросли на 0,06±0,03, и в последующем сохранялось на достигнутом уровне в течение 12 мес. наблюдения (табл.). Расширение поля зрения составило до 70° с височной стороны. У пациентов 3-й группы в послеоперационном периоде выявлено незначительное снижение остроты зрения в большей степени из-за рефракционных нарушений. Поле зрения расширилось до 20–30°. Частота полного анатомического прилегания сетчатки в течение 1 месяца после операции была достигнута в 94,12 % случаев. В одном случае из 1-й и 2-й групп удалось достичь лишь частичного прилегания сетчатки. В 3-й группе сетчатка прилегла у всех пациентов, однако на 4-й и 7-й день возник рецидив отслойки сетчатки, потребовавший повторного вмешательства. Таким образом, разработан и внедрен в клиническую практику новый способ хирургического лечения регматогенной отслойки сетчатки, позволяющий существенно уменьшить травматичность оперативного вмешательства и обеспечивающий стабильные клинико-анатомические и функциональные результаты в послеоперационном пе­ри­о­ де. Динамика зрительных функций у больных регматогенной отслойкой сетчатки Группы больных 1 2 3 до лечения 0,74+0,05 0,56+0,01 0,46±0,14 1 месяц 0,74+0,05 0,60+0,02 0,42±0,24 Острота зрения 3 месяца 0,74+0,05 0,61+0,02 0,43±0,24 6 месяцев 0,72+0,04 0,62+0,02 0,43±0,32 12 месяцев 0,67+0,05 0,62+0,02 0,41±0,41 Литература 1. Крейссиг, И. Минимальная хирургия отслойки сетчатки: в 2 т.: пер. с англ. / И. Крейссиг. — М., 2005. 2. Тахчиди, Х. П. Силиконовая тампонада в современной хирургии отслойки сетчатки / Х. П. Тахчиди, В. Н. Казайкин // Вестн. офтальмол. — 2004. — № 2. — С. 41–45. 3 Тахчиди, Х. П. Тампонада витреальной полости силиконовым маслом в хирургии отслойки сетчатки. Осложнения / Х. П. Тахчиди, В. Н. Казайкин // Офтальмохирургия. — 2004. — № 3. — С. 4–7. 4. Ambresin, M. Managment of giant retinal tears with vitrectomy, internal tamponade, and peripheral 360 degrees retinal photocoagulation / M. Ambresin, E. H. Bovey // Retina. — 2003. — Vol. 23. — № 5. — P. 622–628. 5. Mester, U. The role of the vitreous in retinal detachment surgery with external buckling / U. Mester, N. Anteris // Ophthalmologica. — 2002. — № 216. — P. 242–245. 6. Miniham, M. Primary rhegmatogenous retinal detachment: 20 years of change / M. Miniham, V. Tanner // Br. J. Ophthalmol. — 2001. — Vol. 85. — № 3. — P. 546–548. 7. Ross, W. H. Pneumatic retinopexy, scleral buckling and vitrectomy surgery in the managment of pseudophakic retinal detachments / W. H. Ross, A. Lavina // Can. J. Ophthalmol. — 2008. — Vol. 43. — № 1. — P. 65–72. 233 С. Н. Зеленцов 1, В. М. Зеленцова 2 Оптическая когерентная томография в диагностике поражения зрительного анализатора при рассеянном склерозе 1 2 ГУЗ «Вологодская офтальмологическая больница», Поликлиника МСЧ УВД по Вологодской области, г. Вологда Рассеянный склероз (РС) в настоящее время характеризуется как комплекс нейродегенеративных расстройств спинного и головного мозга, сопровождающихся демиелинизацией, глиальной дисфункцией и в конечном счете потерей нейроаксональных функций. Традиционно информативным при диагностике РС считается метод магнито-резонансной томографии, которая обеспечивает достаточно контрастное изображение мягких тканей головного и спинного мозга, орбиты, зрительного нерва и зрительного пути и позволяет выявить имеющиеся патологические очаги. Но поскольку у ряда пациентов с РС в процесс вовлекается зрительный нерв, то актуальным является и выявление патологии зрительного нерва при РС в субклинической и ранней клинической стадии болезни, когда диск зрительного нерва остается нормальным. Особенность картины глазного дна при РС заключается в том, что патологический процесс развивается в основном в зрительном нерве, а остальные структуры глазного дна (сетчатка) остаются визуально нормальными и считались ранее не вовлеченными в патологический процесс. Для своевременной диагностики поражения зрительных проводящих путей при рассеянном склерозе и при атипичном его течении имеют большое значение, помимо МРТ, и другие функциональные методы исследования: статическая компьютерная периметрия, кинетическая хронопериметрия, цветовая компьютерная кампиметрия, визоконтрастометрия, запись зрительных вызванных потенциалов, исследование электрической чувствительности и лабильности зрительного анализатора. Но в последние годы появился новый высокоинформативный способ диагностики — оптическая когерентная томография, которая позволяет детально неизвазивным методом исследовать сетчатку, изменения в которой позволяют судить о процессах, происходящих в ЦНС. Ведь по образному выраже- нию лауреата Нобелевской премии (1906 год) нейроанатома Рамон-и-Кахала «Сетчатка представляет собой часть мозга, вынесенного на периферию». В 1974 году Frisen L. et Hoyt W. впервые при рассеянном склерозе с помощью визуализации ручным офтальмоскопом оценили слой нервных волокон сетчатки. Но это был первый субъективный опыт исследования, который не позволял количественно описать видимые изменения. И только с появлением в 1993 году метода оптической когерентной томографии впервые появилась возможность не только детально визуализировать сетчатку и слой ее нервных волокон, но и количественно на более высоком уровне документировать изменения. Сетчатка является уникальным образованием в пределах ЦНС, поскольку она содержит аксоны и глию, но не содержит миелиновых волокон. Миелиновые волокна окружают аксоны ганглиозных клеток сетчатки лишь при выходе зрительного нерва за пределы склеральной оболочки глаза. Поэтому сетчатка является идеальной структурой, которая позволяет визуализировать нейродегенеративные состояния нервных волокон. Оптическая когерентная томография (ОКТ) позволяет с высоким разрешением исследовать строение и архитектонику сетчатки и оценить слой нервных волокон сетчатки как непосредственно у диска зрительного нерва, так и центральной зоне сетчатки — макуле, которая отвечает за высокие зрительные функции. Самое раннее применение ОКТ при изучении РС сообщили в 1999 году Parisi et al. В этом первом исследовании 14 пациентов было отмечено, что при клиническом выздоровлении после перенесенного неврита зрительного нерва и сопутствующем РС (по сравнению с контролем) толщина слоя нервных волокон сетчатки была снижена на 46 %. В исследованиях 2005 года Trip S. et al отметили, что у пациентов с РС, у которых клинически не было явлений ретробульбарного неврита, уменьшение толщины слоя нервных волокон сетчатки достигало 27 %, так- 234 же отмечалось уменьшение слоя нервных волокон сетчатки в макуле. В одном из последних опубликованных исследований Talman L. et al. (2010), исследовавшие методом ОКТ 299 пациентов с РС, отметили прогрессивное снижение толщины слоя нервных волокон сетчатки в зависимости от сроков наличия у пациентов РС. О роли ОКТ в диагностике РС говорит и тот факт, что профессор неврологии и офтальмологии из США Frohman E. M. и соавторы, длительное время исследующие возможности ОКТ при РС, свою обзорную статью (2008), посвященную данному методу исследования, назвали «Оптическая когерентная томография: окно в механизмы рассеянного склероза». Нами исследование пациентов с рассеянным склерозом методом оптической когерентной томографии проводилось на аппарате RTVue-100 (фирма Optovue Inc., Fremont, США). Длина пучка скана — 810 нм, частота А-скана — 25 000 сканов в секунду, разрешение прибора — 5 мкм. Проведено исследование у 7 пациентов (14 глаз) с клиникой РС. Отмечено уменьшение толщины слоя нервных волокон у диска зрительного нерва и в макуле на 10 глазах, при этом данные изменения отмечались даже у пациентов, в анамнезе которых не было ретробульбарного неврита. Полученные нами данные пока весьма ограничены в силу малого количества наблюдений и делать какие-либо выводы пока преждевременно. Для примера приводим случай возможности динамического наблюдения пациентов с РС методом оптической когерентной томографии и рядом упомянутых выше диагностических методов. Пример. Пациентка П., 47 лет. Заболела остро в январе 2006 г. после перенесения вирусной инфекции, появилась слабость в левой руке и снижение зрения на левый глаз. Обследована амбулаторно, проконсультирована областным иммунологом, офтальмологом, на МРТ головного мозга выявлены мелкие очажки глиоза в белом веществе больших полушарий и наружной капсуле. Пролечена в стационаре и выписана с диагнозом: Демиелинизирующее заболевание ЦНС, тетрапирамидная недостаточность. Частичная атрофия зрительного нерва слева (под?). Смешанная герпес-вирусная инфекция. Лечение кортикостероидам не проводилось. В марте 2006 г. появилось головокружение, слабость в конечностях, неустойчивость при ходьбе. Проконсультирована в «Центре рассеянного склероза», где дополнительно сделана МРТ шейно-грудного отдела позвоночника и выявлены признаки симметричного демиелинизирующего поражения задних столбов спинного мозга на шейном и грудном уровне. Выставлен диагноз: Рассеянный склероз, энцефалоспинальная форма, III ст., вторично — прогредиентное течение, легкий тетрапарез, атаксия. Частичная атрофия зрительного нерва слева. Повторно госпитализирована на курс пульс-терапии метилпреднизолоном, наблюдался регресс неврологической симптоматики. Наблюдается неврологом, ежегодно проводятся курсы метаболической и антиоксидантной терапии. За последние 3 года обострений не было. Исследование органа зрения от июля 2010 г. Острота зрения: Правый глаз = 0,5 сф — 1Д цил-1,5 Д ах25 град = 0,7. Левый глаз = 0,2 сф — 2Д = 0,8. Внутриглазное давление ОД 18 мм рт. ст., ОS — 16 мм рт. ст. Состояние глаз: Оптические среды прозрачные. На глазном дне: ОД — диск зрительного нерва бледно- розовый, границы четкие, сетчатка без видимых изменений. ОS — диск зрительного нерва слегка бледноват, границы четкие, сетчатка без видимых изменений. Статическая компьютерная периметрия: на левом глазу единичная абсолютная парацентральная скотома, периферические границы в пределах нормы. Зрительные вызванные потенциалы: на левом глазу увеличение латентности волны Р-100, т. е. увеличение времени проведения импульса по зрительному нерву, по сравнению с правым глазом, на 15 %. Оптическая когерентная томография: резкое истончение слоя нервных волокон сетчатки и толщины макулы сетчатки на левом глазу В данном случае у пациентки при первоначальном осмотре в 2006 г. не было клиники ретробульбарного неврита. Было установлено поражение зрительного нерва неясного генеза. Несмотря на проводимое лечение, в данном случае увеличение времени латентности волны Р-100 зрительных вызванных потенциалов на 15 %, выявленное на последнем исследовании, говорит о том, что процесс РС не стабилизирован и сохраняется демиелинизирующий процесс в нервных волокнах зрительного нерва. Несмотря на сравнительно хорошие показатели статической компьютерной периметрии, у пациентки резко истончен слой нервных волокон сетчатки, следовательно, в перспективе стоит ожидать заметного сужения границ поля зрения, появления новых скотом и снижения зрительных функций. 235 Литература 1. Parisi, V. Correlation between morphological and functional retinal impairment in multiple sclerosis patients / Parisi V. [et al.] // Invest. Ophthalmol. Vis. Sci. — 1999. — Vol. 40. — P. 2520–2523. 2. Talman, L. S. Longitudinal study of vision and retinal nerve fiber layer thickness in multiple sclerosis / Talman L. S. [et al.] // Ann. Neurol. — 2010. — Vol. 67, is.6. — P. 749–760. 3. Trip, S. Retinal nerve fiber layer axonal loss and visual disfunction in optic neuritis neuritis / Trip S. [et al.] // Ann. Neurol. — 2005. — Vol. 58. — P. 383–391. 4. Frisen, L. Insidious atrophy of retinal nerve fibers in multiple funduscopic identification in patients with and without visual complaints / L. Frisen, W. Hoyt // Arch. Ophthalmol. — 1974. — Vol. 92. — P. 91–97. 5. Frohman, E. M. Optical coherence tomography: a window into the mechanisms of multiple sclerosis / Frohman E. M. [et al.] // Nat. Clin. Pract. Neurol. — 2008. — Vol. 4 (12). — P. 664–675. Л. Х. Исангулова окклюзионные поражения вен сетчатки: оценка гемодинамических, морфометрических, фибринолитических показателей ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Окклюзионные поражения вен сетчатки — одни из наиболее распространенных заболеваний, которые составляют около 60 % всей острой сосудистой патологии глаза и в 15 % случаев являются причиной инвалидности по зрению [4, 6, 10]. Патогенез окклюзионных поражений вен сетчатки изучен не полностью. Предполагается роль механических, емодинамических, гемореологических, коагуляционных, фибринолитических и иммунных факторов в развитии данной патологии [3, 4, 7, 8, 9, 10, 13, 14, 17]. Сегодня не вызывает сомнений тот факт, что при ретинальных венозных тромбозах отсутствует прямая связь между изменениями в коагулограмме и тромбированием сосудов. Ряд авторов полагают, что коагулограмма или ее отдельные компоненты не могут отразить процессы, которые происходят в ретинальных сосудах при их закупорке [2, 3, 8]. Исследования показаний гематокрита при тромбозах вен сетчатки также противоречивы. Ряд ученых указывают на увеличение уровня фибриногена в крови у больных с ретинальными венозными окклюзиями [11, 16], тогда как другие [15] сообщают об отсутствии существенных отличий. Следует заметить, что гемореологические показатели нельзя оценивать изолированно друг от друга, так как повышенная агрегация эритроцитов может предрасполагать к стазу в кровеносном русле и объяснять увеличение вязкости крови, которая находится в прямой корреляционной зависимости с гематокритом [6, 15]. Тканевой активатор плазминогена (ТАП) — присутствующий в организме белок, способный разрушать образующиеся тромбы, является основным активатором фибринолитической системы в крови. ТАП переводит плазминоген в плазмин преимущественно в месте тромбирования [12]. По данным литературы известно, что у 50 % больных с венозными тромбозами обнаружен дефицит ТАП в крови, что может быть связано с нарушением синтеза и высвобождения его из эндотелиальных клеток сосудов [16, 17]. Повышение эффективности диагностических мероприятий, с разработкой критериев дифференциальной диагностики различных типов окклюзионных поражений вен сетчатки обуславливают актуальность настоящей работы. Цель — оценить состояние кровотока в сосудах глаза, изучить морфометрические изменения в макулярной области и содержание тканевого активатора плазминогена в плазме крови при окклюзионных поражениях вен сетчатки. Материал и методы. Обследовано 42 пациента (18 женщин и 24 мужчин в возрасте от 46 до 72 лет) с окклюзионным поражением вен сетчатки (I — основная группа). 20 здоровых лиц (11 женщин и 9 мужчин от 58 до 75 лет) составили контрольную группу (II). 236 В основной группе больные распределялись следующим образом: тромбоз центральной вены сетчатки (ЦВС) — 12 человек, тромбоз ветви ЦВС — 30. Для диагностики, наряду с общепринятыми клинико-офтальмологическими методами исследования (визометрия, тонометрия, периметрия, офтальмоскопия глазного дна, биомикроскопия), использовали ультразвуковое цветовое допплеровское картирование (ЦДК) кровотока в глазной артерии (ГА), центральной артерии сетчатки (ЦАС), верхней глазной вене (ВГВ), центральной вене сетчатки (ЦВС). ЦДК проводили на многофункциональной ультразвуковой системе Sequoia 512 корпорации Асuson (США) с применением датчиков 5–10 МГц. При этом оценивали спектральные скоростные показатели гемодинамики: максимальную систолическую скорость (Vs), конечную диастолическую скорость (Vd), среднюю скорость (Vmed) и индексы периферического сопротивления — резистентности (Ri), пульсации (Pi). Всем больным проведена лазерная сканирующая конфокальная офтальмоскопия на ретинотомографе (HRT III) производства Heidelberg Engineering GmbH (Германия) по программе «Макула». По ретинальным томограммам оценивали степень проминирования участков сетчатки в макулярной области, изменения средних показателей толщины сетчатки и индекса отечности [1, 5]. Количественно определяли концентрацию ТАП антигена в образцах плазмы крови с помощью иммуноферментного анализа по методу ТС Actibind t-PA [12]. Результаты и обсуждение. Допплерографически выявлена зависимость степени гемодинамических нарушений в исследуемых сосудах глаза от локализации и типа окклюзионных поражений вен сетчатки по сравнению с контрольной группой здоровых лиц (табл. 1). При ишемическом типе полного тромбоза ЦВС обнаружено изменение кровотока в ГА с достоверным снижением Vd в 2 раза и Vs — в 1,5 раза, а в ЦАС — в 5 раз в диастоле, и в 1,7 раз — в систоле. В ГА определялось повышение Pi в 2 раза и Ri — в 1,2 раза, в ЦАС — Pi в 2,5 раза и Ri — в 1,3 раза. Отмечалось снижение перфузии в венозных сосудах: в 1,6 раз в ВГВ и в 1,5 раза — в ЦВС (p<0,05). При неишемическом типе полного тромбоза ЦВС выявлялась тенденция к достоверному снижению кровотока как артериального (в ЦАС: Vs в 1,5 раза и Vd — в 1,8 раза), так и перфузии венозного — в ВГВ и ЦВС — в 1,2 раза. Регистрировалось повышение индекса резистентности в ЦАС в 1,2 раза и пульсационности — в 1,4 раза (p<0,05). Показатели снижения кровотока в ГА были не достоверны (p>0,05). При ишемическом типе тромбоза ветви ЦВС наблюдалось достоверное снижение кровотока ГА: Vs — в 1,2 раза и Vd — в 1,6 раза, в ЦАС — в систоле и диастоле в 1,3 раза с достоверным повышениТаблица 1 Допплерографическая характеристика кровотока по сосудам глаза при окклюзионных поражениях вен сетчатки в зависимости от локализации и типа Показатели Vs (см/с) Vd (см/с) Ri Pi Vs (см/с) Vd (см/с) Ri Pi Vmax(см/с) Vmax (см/с) Полный тромбоз ЦВС Тромбоз ветви ЦВС N1 = 12 N2 = 30 Ишемический Неишемический Ишемический Неишемический тип (n1 = 3) тип (n2 = 9) тип (n3 = 8) тип (n4= 22) ГА 21,7±2,7* 31,3±2,3 29,7±0,7* 31,3±2,3 4,6 ±0,9* 8,1±1,4 6,7 ±0,2* 8,1±1,4 0,78±0,03* 0,74±0,05 0,70±0,03 0,69±0,05 3,2±0,3* 1,7±0,09 2,2±0,3* 1,6±0,09 ЦАС 6,87±0,3* 7,2±0,4* 8,1±0,3* 8,9±0,4* 0,56±0,08* 1,28±0,5* 2,2±0,2* 3,2±0,2* 0,92±0,04* 0,84±0,03* 0,76±0,04 0,64±0,03 3,4±0,04* 1,9±0,07* 3,1±0,03* 1,6±0,03* ВГВ 5,2±1,5* 6,9±1,4* 5,1±1,7* 6,3±1,2* ЦВС 2,95±0,27* 3,5±0,5* 2,9±0,03* 3,5±0,15* Примечание:* р < 0,05 — достоверно, по сравнению с контрольной группой 237 Контрольная группа n = 20 32,7±3,7 9,2±2,1 0,72±0,03 1,4±0,06 10,6±0,8 2,9±0,3 0,73±0,03 1,4±0,06 8,3±1,7 4,36±0,7 ем индекса пульсационности в 1,8 раза в ГА и в 2,2 раза — в ЦАС. Регистрировалось достоверное уменьшение перфузии в ВГВ и ЦВС в 1,5 раза. При неишемическом типе тромбоза ветви ЦВС имело место достоверное снижение кровотока ЦАС в систоле в 1,2 раза с повышением индекса пульсационности в 1,2 раза. Выявлялось снижение венозной перфузии в ВГВ в 1,3 и ЦВС в 1,2 раза (p<0,05). Показатели снижения кровотока в ГА были не достоверны (p>0,05). По ретинальным томограммам получены следующие морфометрические параметры макулярной области при окклюзионных нарушениях вен сетчатки (табл. 2): при полном тромбозе ЦВС выявлялось проминирование участков сетчатки до 200 мкм, с увеличением в 1,7 раз толщины макулы и в 2 раза — индекса отечности по сравнению с нормой (p<0,05); при тромбозе верхних ветвей ЦВС регистрировалось проминирование участков сетчатки до 200 мкм, с увеличением в 1,8 раз толщины макулы и в 1,3 раза — индекса отечности (p<0,05); при тромбозе нижних ветвей ЦВС отмечалось достоверно значимое проминирование участков сетчатки до 600 мкм, с увеличением в 2,2 раза толщины макулы и в 1,2 раза — индекса отечности макулярной области (p<0,05). По данным лазерной сканирующей конфокальной офтальмоскопии, индекс отека макулы более 2,0 и утолщение сетчатки больше 400 мкм свидетельствует о развитии макулопатии [1, 5]. Количественные показатели концентрации ТАП антигена в образцах плазмы крови представлены в таблице 3. Исследования показали, что концентрация антигена ТАП в плазме крови пациентов с окклюзией вен сетчатки варьировала от 1,09 до 7,4 нг/мл. При оценке концентрации антигена ТАП в плазме крови в зависимости от локализации и периода заболевания, нами выявлена достоверно более высокая концентрация в раннем периоде полного тромбоза ЦВС — 5,14±2,26 нг/мл и при тромбозе ветви ЦВС — 2,31±1,22 нг/мл (p<0,05). В период заболевания более 3 месяцев отмечалось недостоверное повышение концентрации ТАП: при полном тромбозе ЦВС — 1,43±0,18 нг/мл, а при тромбозе ветви ЦВС — 0,36±0,03 нг/мл (p>0,05). Повышенные концентрации антигена ТАП в плазме крови свидетельствуют об увеличении выброса ТАП, который не сбалансирован соответствующим усилением выброса PAI–1. Это указывает на первичный гиперфибринолиз, что, вероятно, приведет к образованию плазмина, расходу ингибиторов плазмина и деградации других белков плазмы (фибриноген и фактор VIII) и рассасыванию тромба. При снижении концентрации ТАП происходит снижение фибринолитической активности и усиливается склонность к тромбозу [15]. Выводы: 1. Проведение цветового допплеровского картирования сосудов глаза и орбиты позволяет определить гемодинамические критерии для Таблица 2 Морфометрические показатели макулярной области при окклюзионных поражениях вен сетчатки различной локализации Вид Полный тромбоз ЦВС Тромбоз верхних ветвей ЦВС Тромбоз нижних ветвей ЦВС Показатели нормы Степень проминенции (мкм) до 200 до 200 до 600 отсутствует Толщина макулы (мкм) от 385 до 590 от 412 до 647 от 321 до 783 до 350 Индекс отечности от 1,46 до 3,60 от 0,90 до 2,34 от 0,90 до 2,29 от 1,1 до 1,8 Таблица 3 Концентрация ТАП плазмы крови при окклюзионных поражениях вен сетчатки в зависимости от срока заболевания, в нг/мл Вид Полный тромбоз ЦВС (n = 12) Тромбоз ветвей ЦВС (n= 30) Ранний период окклюзии (до 3 мес.) Поздний период окклюзии (более 3 мес.) 5,14 ± 2,26* 1,43 ± 0,18 2,31 ± 1,22 * 0,36 ± 0,03 Примечание: в таб. 3:* р < 0,05 — достоверно по сравнению с контрольной группой. 238 Контрольная группа n = 20 1,26± 0,15 дифференцирования окклюзионных поражений вен сетчатки по локализации и типу. Достоверное снижение скоростных показателей кровотока и индексов периферического сопротивления в ГА, ЦАС и перфузии ВГВ и ЦВС наблюдается при ишемическом типе тромбоза ЦВС и ветви ЦВС (p<0,05). При неишемическом типе окклюзии вен сетчатки достоверно снижение скоростных показателей кровотока и индексов периферического сопротивления отмечается только в ЦАС и перфузии ВГВ и ЦВС. Степень выраженности нарушения кровотока зависит от локализации тромбоза (в большей степени скорость кровотока снижена при полном тромбозе ЦВС). 2. Данные лазерной сканирующей конфокальной офтальмоскопии свидетельствуют о развитии посттромботической макулопатии. Проминенция участков сетчатки в большей степени выражена при тромбозе нижних ветвей ЦВС, тогда как высокий индекс отека макулы определялся при полном тромбозе ЦВС, утолщение макулы было характерным при любой локализации окклюзии ЦВС. 3. Исследование концентрации антигена ТАП в плазме крови характеризует её фибринолитическую активность. Установлено достоверное повышение (p<0,05) концентрации антигена ТАП в плазме крови пациентов с окклюзией вен сетчатки в раннем периоде заболевания. Литература 1. Азнабаев, Б. М. Лазерная сканирующая томография глаза: передний и задний сегмент / Б. М. Азнабаев, З. Ф. Алимбекова, Т. Р. Мухамадеев, А. Р. Габбасов. — М., 2008. — 221 с. 2. Кацнельсон, Л. А. Сосудистые заболевания глаза / Л. А. Кацнельсон, Т. И. Фарафонова, А. Я. Бунин. — М.: Медицина, 1990. — 272 с. 3. Кацнельсон, Л. А. Частота тромбозов ретинальных вен у больных с гипертонической болезнью и их прогностическое значение / Л. А. Кацнельсон, В. Э. Танковский, Л. В. Павленко // 9-й съезд офтальмологов Украины. — Одесса, 1996. — С. 376–377. 4. Киселева, Т. Н. Возможности ультразвуковых методов в диагностике окклюзионных поражений сосудов сетчатки и зрительного нерва / Т. Н. Киселева, С. И. Харлап, А. В. Сашнина // Современные возможности в диагностике и лечении витреоретинальной патологии: сб. науч. тр. — М., 2004. — С. 179–182. 5. Куроедов, А. В. Компьютерная ретинотомография (НRТ): диагностика, динамика, достоверность / А. В. Куроедов, В. В. Городничий. — М., 2007. — 231 с. 6.Лоскутов, И. А. Свертывающая система крови при гемофтальмах и тромбозах вен сетчатки / И. А. Лоскутов, Н. С. Бургова // Клин. вопросы офтальмол. — Ставрополь, 1993. — C. 22. 7.Лысенко, В. С. Тромбоцитопатии и их роль в развитии геморрагического синдрома при сосудистых заболеваниях глазного дна / В. С. Лысенко, А. И. Муха, А. Я. Бунин, Н. В. Федорова // Вестн. офтальмол. — 2001. — № 1. — С. 24–26. 8. Танковский, В. Э. Тромбозы вен сетчатки / В. Э. Танковский. — М., 2000. — 262 с. 9. Харлап, С. И. Гемодинамические характеристики центральной артерии сетчатки и глазничной артерии при атеросклеротическом поражении сонных артерий по данным ультразвуковых методов исследования / С. И. Харлап, В. В. Шершнев // Вестн. офтальмол. — 1998. — № 5. — С. 39–44. 10.Шахсуварян, М. Л. Оценка эффективности патогенетически обоснованной комплексной медикаментозной терапии флеботромбозов сетчатки / М. Л. Шахсуварян // Совр. возможности в диагностике и лечении витреоретинальной патологии: сб. науч. тр. — М., 2004. — С. 380–382. 11.Abu El-Asrar, A. M. Fibrinolytic activity in retinal vein occlusion / A. M. Abu El-Asrar, A. G. Abdel Gader, S. Al-Amro, A. K. Al-Momem // Int. Ophthalmol. — 1998. — Vol. 21. — № 6. — Р. 343–348. 12.Bachmann, F. Tissue plasminogen activator: Chemical and physiological aspects / F. Bachmann // Sem. Thromb. Haemostas. — 1984. — Vol. 10. — № 6. — Р. 17. 13.Chua, В. Homocystein and Retinal Emboli: The Blue Mountains Eye Study / В. Chua, А. Kifley, T. Y. Wong, Р. Mitchell // Am. J. Ophthalmol. — 2006. — Vol. 142. — Р. 322–324. 14.Chen, S. D. Bilateral retinal venous occlusion and unilateral cystoid macular edema in Churg — Strauss syndrome treated with intravitreal triamcinolone / S. D. Chen, J. Lochhead, K. Satchi [et al.] // Retina. — 2005. —Vol. 25. — № 5. — Р. 655–657. 15.Glacet-Bernard, A. Treatment of recent onset central retinal vein occlusion with intravitreal tissue plasminogen activator: a pilot study / A. Glacet-Bernard, D. Kuhn, A. K. Vine [et al.] // Br. J. Ophthalmol. — 2000. — Vol. 84. — № 6. — Р. 609–613. 16.Lippi, G. Platelets and lipoprotein(a) in retinal vein occlusion: mutual targets for aspirin therapy / G. Lippi, M. Franchini, G. Targher // Thromb Haemost. — 2007. — Vol. 97. — № 6. — Р. 1059–1060. 17.Williamson, T. Blood viscosity, coagulation and activated protein C resistance in central retinal vein occlusion / T. Williamson, A. Rumley, G. Lowe // Br. J. Ophthalmol. — 1996. — Vol. 80. — Р. 203–208. 239 С. А. Коротких, Е. С. Князева, Е. С. Червякова Пептидная нейропротекция в лечении возрастной макулярной дистрофии сетчатки Свердловский областной клинический психоневрологический госпиталь для ветеранов войн, Уральская государственная медицинская академия, г. Екатеринбург Возрастная макулярная дегенерация (ВМД) занимает одно из первых мест среди причин слепоты у лиц старше 60 лет и является ведущей причиной потери центрального зрения. Тяжесть заболевания обусловлена центральной локализацией процесса и, как правило, двусторонним поражением, а так же низкой эффективностью стандартной терапии. Существующие сегодня консервативные методы лечения не обеспечивают длительного и стабильного улучшения зрительных функций. Наряду с традиционными методами терапии в настоящее время общепризнанным является применение пептидных биорегуляторов (Ретиналамин). Биорегулирующую терапию от других современных методов лечения отличает патогенетическая обоснованность и тканеспецифическое действие — нормализация функции того органа, из которого выделены полипептиды. Для «адресной» доставки препаратов и пролонгирования их действия при ВМД используется введение лекарственного вещества в теноново пространство. Также для потенцирования действия пептидных биорегуляторов используется электрофизический способ восстановления функции зрительного анализатора, осуществляемый посредством коррекции регуляции мозгового кровообращения с помощью аппарата «Симпатокор-02». Важнейшим исполнительным звеном нейрогенного механизма в процессе регуляции мозгового кровообращения является эфферентная иннервация стенок мозговых сосудов различных калибров: от магистральных артерий до микрососудов. Обеспечивается эта иннервация преимущественно с помощью симпатического констрикторного влияния, ведущая роль в этом процессе принадлежит верхнему шейному и звездчатому ганглиям. Блокирование активности этих ганглиев производят вращающимся полем электрических импульсов, формируемым многоэлементным катодом и одноэлементным анодом. Цель — изучение эффективности введения ретиналамина в теноново пространство в сочетании с последующим курсом симпатокоррекции в сравне- нии с традиционным парабульбарным применением сосудистых препаратов. Материал и методы. Предлагаемый метод — «адресная» доставка пептидного биорегулятора («Ретиналамин®»), которая достигается введением препарата в теноново пространство с последующим использованием корректора активности симпатической нервной системы «Симпатокор-02». Для пролонгирования эффекта «Ретиналамина» использовали введение к заднему полюсу полоски коллагеновой губки. В исследовании участвовали две группы пациентов с «сухой» формой ВМД: исследуемая группа, которой проводилось введение коллагеновой губки с «Ретиналамином» в субтеноновое пространство с последующим 10-дневным курсом лечения прибором «Симпатокор-02», и группа сравнения, где проводился 10-дневный курс общей и местной сосудистой терапии в сочетании с местным применением антиоксидантов и дедистрофических препаратов. Исследуемую группу пациентов составили 28 человек (53 глаза), из них 21 женщина,7 мужчин, средний возраст — 67,8±3,4 лет, Vis=0,32±0,11. Группа сравнения — 29 человек (56 глаз), из них женщин — 23, мужчин — 6, средний возраст — 69,2±5,3 лет, Vis=0,36±0,14. Всем пациентам проводились общепринятые офтальмологические методы обследования: визометрия, тонометрия, периметрия, тест Амслера, а так же биомикроофтальмоскопия (Fundus Camera FF450), исследование показателей световой чувствительности, ультразвуковое допплерографическое исследование глазничной артерии с дуплексным режимом сканирования, оптическая когерентная томография (SOCT Copernicus). Результаты и обсуждение. Осложнений во время и после введения препарата в теноново пространство не отмечено. Все пациенты отметили субъективное улучшение зрения. Результаты по зрительным функциям и по показателям световой чувствительности представлены в табл. 1, 2. 240 Таблица 1 Зрительные функции в динамике лечения Зрительные функции (M±m) Острота зрения Границы поля зрения (°) Скотомы (абс / отн) Исследуемая группа до лечения после лечения 0,48±0,08 0,74±0,11 441,9±13,5 487,0±11,9 11 / 32 6 / 25 Контрольная группа до лечения после лечения 0,47±0,06 0,59±0,08 456,2±9,7 481,3±12,3 12 / 29 10 / 26 Таблица 2 Показатели световой чувствительности в динамике лечения Показатель (M±m) Центральный порог световой чувствительности (дб) Средняя световая чувствительность (дб) Исследуемая группа до лечения после лечения 16,56 10,89 17,86 12,06 Группа сравнения до лечения после лечения 16,84 10,71 17,32 11,34 Таблица 3 Скорость кровотока в ГА Показатель (M±m) Пиковая систолическая скорость (Vmax) Конечная диастолическая скорость (Vmin) Индекс резистентности (RI) Пульсаторный индекс (PI) Исследуемая группа до лечения 24,72±1,34 8,63± 0,31 0,64 ± 0,01 1,17 ± 0,02 Таким образом, после лечения предложенным методом показатели остроты зрения, полей зрения, светочувствительности, скорости кровотока и количества скотом были лучше, чем при стандартной методике лечения. Выводы. Предложенный комбинированный метод лечения ВМД с введением «Ретиналамина» в те- после лечения 33,15±2,86 11,37±0,45 0,69 ± 0,04 1,15± 0,04 Группа сравнения до лечения 23,95±1,12 8,79± 0,28 0,65 ± 0,01 1,16± 0,03 после лечения 28,19±1,73 10,13±0,40 0,67 ± 0,03 1,15± 0,04 ноново пространство и курсом симпатокоррекции показал высокую клиническую эффективность, является перспективным в лечении пациентов с сухой формой ВМД. Осложнений при использовании методики не зафиксировано, то есть метод безопасный. Данная методика может применяться как в условиях стационара, так и в амбулаторных условиях. А. В. Кузнецова, М. А. Александрова, В. Г. Лихванцева, А. В. Васильев, А. В. Карпова Морфологическая характеристика Ретинального пигментного эпителия, культивируемого in vitro, как источника клеточной репарации Институт биологии развития им. Н. К. Кольцова РАН, Учреждение РАН «Центральная клиническая больница РАН», г. Москва Трансплантология сегодня — одно из лидирующих направлений медицины. В офтальмологии клеточные технологии на основе спектра стволовых и малодифференцированных клеток мало изучены и практически не реализованы. Между тем, в перспективе они могут быть использованы для решения проблемы репарации сетчатой оболочки глаза. Многие заболевания глаза, приводящие к потере зрения, такие как пигментный ретинит, возрастная макулодистрофия, диабетическая ретинопатия и глаукома, сопровождаются гибелью нейронов сетчатки. В связи с чем, поиск источника клеточной регенерации 241 является чрезвычайно актуальной задачей современности. Совсем недавно считали, что нейрональные клетки центральной нервной системы (ЦНС) млекопитающих в период эмбрионального и раннего постнатального развития за счет экспрессии большого количества морфогенетически важных факторов имеют высокий регенеративный потенциал. В ходе дифференцировки нервной ткани эти факторы исчезают, а способность к регенерации утрачивается. Сегодня взгляды на регенерацию нервных клеток кардинально изменились. В мозге и сетчатке взрослых млекопитающих, к которым относится и человек, были выявлены клетки, обладающие свойствами стволовых клеток. В сетчатке свойствами стволовости наделяют ретинальный пигментный эпителий (РПЭ). Терапевтический потенциал РПЭ представляет особый интерес. Биологическая эволюция приспособила его для защиты сетчатки. Нейропротекторные свойства РПЭ осуществляет, экспрессируя ряд специфических факторов. Цель — изучить характеристику РПЭ, культивируемого in vitro, как источника клеточной репарации сетчатки. Материал и методы. Источником РПЭ служил аутопсийный материал. Глазные яблоки обрабатывались через 12–48 часов после смерти доноров. После процедуры извлечения РПЭ переносили в стерильную пробирку, пипетировали и центрифугировали 5 минут при 600 об/мин до осаждения клеток. Клетки ресуспендировали в ростовой среде, состоящей из DMEM/F12, 100 U/ml пенициллина и 100 µg/ml стрептомицина (Sigma, USA). Далее РПЭ равномерно распределяли в 1–2 стерильных пластиковых флаконах площадью 25 см2. Первичную культуру РПЭ выращивали на двух средах DMEM/F12 и DMEM/ F12 с добавлением антибиотиков (см выше). Культуры культивировали при 37 °С, влажности воздуха 95 %, 5 %СО2. Через 3–4 дня среду аспирировали и удаляли. Клеточное прикрепление и образование колоний контролировали методом фазовоконтрастной микроскопии. Прикрепление клеток продолжалось в течение 2 недель. Результаты и обсуждение. Свежевыделенные эксплантаты РПЭ состояли из небольших групп и единичных клеток полигональной формы, а также крупных густо пигментированных эпителиоидных клеток. Жизнеспособные клетки РПЭ начинали делиться и создавать пигментированные первичные колонии сразу после прикрепления. Процесс адгезии клеток начинался в конце первых суток (24 часа) и продолжался до двух недель. Распластываясь на дне пластикового флакона, крупные клетки РПЭ принимали плоскую и полигональную форму. Гранулы пигмента собирались глыбками вокруг ядра, содержащего 1 или 2 ядрышка. Цитоплазма на периферии была тонкой и относительно прозрачной. Межклеточные границы были резко очерчены. Деление РПЭ сопровождалось измельчением размеров клеток и депигментацией. По мере созревания колоний в клетках полностью пропадал пигмент. На рост колоний играл факт плотности посадки: при высокой плотности — конфлюэнтный монослой образовывался быстро, при низкой — рост замедлялся. В первом случае клетки приобретали гексагональную форму; а во втором — веретенообразную с отростками или без них. Клетки РПЭ удлинялись при большем пространстве для роста. Достижение конфлюэнтности монослоем РПЭ ассоциировалось с гексагональной формой, характерной для эпителиоподобного типа клеток. Деление и миграцию РПЭ фиксировали исключительно по периферии колонии. В центре колонии клетки оставались статичными и не пролиферировали, т. е. РПЭ дедифференцировался. На скорость роста и плотность РПЭ в пласте влияли добавления в питательную среду различных ростовых факторов. В среде с N2 и bFGF колонии были более плотными и многочисленными по сравнению с культурами без них. При плотной посадке клеток РПЭ наблюдали некую многослойность: один пласт клеток начинал нарастать на другой. Выводы. Нативные клетки РПЭ при культивировании способны формировать неподвижный монослой, сохраняя способность к делению. В условиях in vitro РПЭ дедифференцируется и трансформируется, обретая округлую/веретенообразную клеточную форму, способность к активному делению и миграции, процесс сопровождается утратой способности синтеза пигмента. Таким образом, в зависимости от условий культивирования in vitro РПЭ может менять свою дифференцировку, переходя из состояния эпителиальной дифференцировки в дедифференцированное состояние и обратно. В сравнении с дифференцированными клетками дедифференцированный РПЭ обладает большими потенциями: он более активно пролиферирует, мигрирует, чрезвычайно пластичен. т. е. он может служить источником клеточной репарации сетчатки при повреждении ее различными патологическими процессами. 242 А. В. Кузнецова 1, В. Г. Лихванцева 2, М. А. Александрова 1, А. В. Федоренко 2 КОЛИЧЕСТВЕННАЯ ОЦЕНКА СЕКРЕЦИИ VEGF И PEDF КЛЕТКАМИ РЕТИНАЛЬНОГО ПИГМЕНТНОГО ЭПИТЕЛИЯ ГЛАЗА ВЗРОСЛОГО ЧЕЛОВЕКА В КУЛЬТУРЕ 1 Учреждение РАН «Институт биологии развития им. Н. К. Кольцова РАН», 2 Учреждение РАН «Центральная клиническая больница РАН», г. Москва Дисбаланс про- и антиангиогенных факторов играет важную роль в развитии и прогрессировании ряда дегенеративно-дистрофических заболеваний глаз, включая возрастную макулярную дегенерацию (ВMД). Ключевым проангиогенным фактором, запускающим патологический неоангиогенез признан фактор роста эндотелия сосудов (VEGF). Контроль проангиогенной активности VEGF осуществляет другой пептид: фактор роста пигментного эпителия (PEDF). По влиянию на эндотелиальные клетки сосудов сетчатки эти факторы роста выступают как антагонисты. VEGF, стимулирует пролиферацию и миграцию эндотелиальных клеток, предотвращает их апоптоз, оказывая проангиогенный эффект. PEDF ингибирует VEGF-индуцированную активность эндотелиальных клеток, подавляя передачу сигналов в PI3 K/Akt пути. Показано, что увеличение уровня VEGF и/или уменьшение уровня PEDF в стекловидном теле и во влаге передней камеры коррелирует с прогрессированием ВМД и ПДР. При этом диапазон вариабельности показателей их продукции в норме точно не установлен. Между тем, именно эти параметры показывают отклонения в ту или иную сторону и определяют вид антиангиогенной терапии: блокирование/подавление VEGF-зависимого сигнального пути ангиогенеза или замещение дефицита антиангиогенных факторов роста. Установлено, что основными клеткамипродуцентами VEGF и PEDF является ретинальный пигментный эпителий (РПЭ). Признание этого факта a priore является одним из аргументов в пользу предположения, что трансплантация РПЭ может решить проблему анатомической, морфологической и функциональной сохранности сетчатки при AMD. Известно, что секреция VEGF и PEDF в здоровом глазе осуществляется на противоположных сторонах клеток РПЭ: VEGF секретируется на базальной стороне, а PEDF — на апикальной стороне. Количественная оценка секреции VEGF и PEDF при культивировании клеток РПЭ представляет научно-практический интерес в аспекте изучения их баланса, или вариабельности этих показателей в условиях нормального поддержания жизнедеятельности РПЭ. Цель — количественная оценка секреции VEGF и PEDF клетками РПЭ взрослого человека в условиях культивирования. Материал и методы. Секрецию VEGF и PEDF изучали в кондиционированных средах первичных культур и культур 1-го и 2-го пассажей клеток РПЭ. Для получения адгезивных культур клетки РПЭ из аутопсийного материала от 5 доноров в возрасте от 32 до 58 лет с неизвестным офтальмологическим анамнезом культивировали в пластиковых флаконах площадью 25 см2. В среду для культивирования (DMEM/F12) добавляли 10 % эмбриональную телячью сыворотку, N2, оФРФ и пенициллинстрептомицин до достижения клеточными культурами конфлюэнтного монослоя. Перед пассированием РПЭ клеточные культуры переводили на 48 ч на бессывороточную среду (DMEM/F12 с добавкой N2, оФРФ и пенициллина-стрептомицина). Супернатанты собирали дважды: перед переводом клеточной культуры РПЭ на бессывороточную среду (синоним: кондиционированная сывороточная среда) в течение 72 ч (КСС), и перед непосредственным пассированием клеточной культуры РПЭ (синоним: кондиционированная бессывороточная среда) в течение 48 ч (КБС). Супернатанты забирали, центрифугировали, аликвотировали и хранили при температуре — 80 °C до количественной оценки факторов роста. Для количественного определения PEDF в КСС и КБС использовали твердофазный иммуноферментный анализ. Сэндвич-анализ проводили при помощи набора «Human PEDF ELISA» (BioVendor, Чехия), чувствительного до уровня 0,045 нг/мл, в соответствии с инструкцией производителя без этапа разведения образцов. Образцы оценивали в дубликатах. Измерение оптической плотности образцов проводили при длине волны 450 нм с использованием референс-светофильтра с длиной волны 243 630 нм на микропланшетном фотометре StatFax2100 (Awareness Technology INC, США). VEGF в КБС анализировали методом восьмицветной проточной цитометрии на приборе «FACS Canto-II» (Becton Dickinson, США). Результаты и обсуждение. Уровень PEDF в КСС первичных культур и культур 1-го и 2-го пассажей клеток РПЭ составил: 6,0±1,3; 5,5±2,1 и 5,2±2,0 нг/мл, соответственно. Уменьшение концентрация PEDF в супернатантах культур клеток РПЭ ассоциировалось со снижением их пролиферативной активности и завершением экспоненциальной фазы роста культуры, а также с отсутствием сыворотки в ростовой среде. Увеличение секреции PEDF, напротив, отмечалось при переводе клеточных культур с сывороточной среды на бессывороточную. Так, уровень PEDF в КБС первичных культур и культур 1-го и 2-го пассажей клеток РПЭ составил: 7,20±0,60; 5,50±2,30 и 6,75±0,95 нг/мл, соответственно. Уровень VEGF в КБС первичных культур и культур 1-го и 2-го пассажей сильно варьировал и составил: 578,99±514,54; 330,17±268,74 и 402,55±263,08 пг/мл, соответственно. Выводы. В условиях культивирования клетки РПЭ взрослого человека сохраняют способность к синтезу и секреции PEDF и VEGF. Увеличение уровня секреции PEDF ассоциируется со снижением пролиферативной активности клеток РПЭ и наблюдается в конце экспоненциальной фазы роста культуры. Снижение секреции PEDF отмечается в клеточных культурах РПЭ по мере пассирования, т. е. со старением культуры. Концентрация VEGF в супернатантах первичных культур и культур 1-го и 2-го пассажей клеток РПЭ была умеренной, ее значения были сопоставимы с литературными данными по уровню VEGF в стекловидном теле больных с непролиферативной стадией ДР. По мере пассирования клеточных культур РПЭ прослеживалась тенденция к снижению уровня секреции VEGF. Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (ГК № 11-04-00510) и Министерства образования и науки Российской Федерации (ГК № 16.512.11.2158). А. В. Кузнецова 1, Л. А. Милюшина 1, В. Г. Лихванцева 2, М. А. Александрова 1, А. В. Федоренко 2 МЕТОДИКА ПОЛУЧЕНИЯ КУЛЬТУРЫ КЛЕТОК РЕТИНАЛЬНОГО ПИГМЕНТНОГО ЭПИТЕЛИЯ 1 Учреждение РАН «Институт биологии развития им. Н. К. Кольцова РАН», 2 Учреждение РАН «Центральная клиническая больница РАН», г. Москва Клеточно-регенеративная терапия возрастной макулярной дегенерации рассматривается как возможное решение проблемы сохранности и жизнеспособности сетчатки. Одно из перспективных направлений клеточно-регенеративной терапии — трансплантация ретинального пигментного эпителия (РПЭ). В связи с чем, поиск технологий выделения и культивирования РПЭ является актуальной задачей современности. Цель — разработка методики выделения и получения первичных культур клеток РПЭ из донорских аутопсийных глаз взрослого человека. Материал и методы. Глазные яблоки 27 доноров энуклеировали через 20–24 ч после их exitus. Возраст доноров варьировался от 24 до 73 лет. Клетки РПЭ культивировали в пластиковых флаконах площадью 25 см2. Глазные яблоки освобождали от остатков конъюнктивы и теноновой оболочки, промывали однократно в 70 % спирте и трижды в холодном растворе Хэнкса с добавлением антибиотиков. Передний сегмент глаза удаляли, выполняя круговой разрез позади зубчатой линии, определяемой как граница между темным и светлым участками глаза. Стекловидное тело и нейральный отдел сетчатки отделяли от РПЭ и удаляли, подрезая нейральную сетчатку в области зрительного нерва. Выделенную глазную чашу наполняли холодным раствором Хэнкса с ЭДТА. Спустя 10–15 минут начинали процесс сборки клеток. На время изоляционной процедуры глазную чашу помещали в раствор Хэнкса и держали на льду. Визуальный контроль процесса осуществляли с помощью бинокулярной лупы. 244 Клетки РПЭ осторожно отделяли от мембраны Бруха, проводя по слою и засасывая наконечником дозированной пипетки в 200 мкл. Собранные клетки центрифугировали 5 мин при 600 об/мин и ресуспендировали в полных культуральных средах двух составов. Клеточную суспензию одного глазного яблока из каждой донорской пары глаз ресуспендировали в среде №1, состоящей из питательной среды DMEM/F12, дополненной 10 % эмбриональной телячьей сыворотки (ЭТС), добавки N2 и оФРФ. Клеточную суспензию, полученную из второго глазного яблока того же донора ресуспендировали в среде №2, состоящей из питательной среды DMEM/F12, дополненной 10 % ЭТС. Результаты и обсуждение. Использование ростовой среды №1 позволило получить стабильный конфлюэнтный монослой клеток РПЭ. Морфологические исследования культивированного РПЭ свидетельствовали о его жизнеспособности и пригодности к трансплантации. Количественный выход РПЭ при использовании выше указанной методики культивирования от культуры к культуре был стабилен, а объем РПЭ был достаточен для проведения экспериментальных или клинических исследований. Выводы. Разработанная методика выделения РПЭ взрослого человека позволяет получать клетки РПЭ в стабильном объеме, достаточном для проведения экспериментальных исследований. Описанная методика может быть рекомендована для получения РПЭ при подготовке к последующей трансплантации. В. Г. Лихванцева, Г. Г. Зиангирова, А. В. Федоренко, А. В. Кузнецова, М. А. Александрова, Э. О. Султанова, А. Ю. Салихов, О. В. Белоус Изучение эффективности репарации сетчатки с помощью технологии трансплантации культивированного ретинального пигментного эпителия (Экспериментальные исследования) Учреждение РАН «Центральная клиническая больница РАН», Учреждение РАМН «НИИ глазных болезней РАМН», Институт биологии развития им. Н. К. Кольцова РАН, г. Москва Причиной многих заболеваний сетчатки, приводящих к слепоте, является дисфункция ретинального пигментного эпителия (РПЭ). Она приводит к гибели фоторецепторов, нейронов сетчатки и, в результате, к потере зрения. Принимая a priore ключевую роль РПЭ в обеспечении сохранности и жизнеспособности всей сетчатки, некоторые исследователи считают, что пересадка РПЭ может решить проблему. В эксперименте на мутантных крысах RCS (отличаются ранней дисфункцией РПЭ, приводящей к гибели фоторецепторов) показано, что трансплантация РПЭ позволяет сохранить зрение. Трансплантат РПЭ взрослого человека встраивается в монослой РПЭ глаза крысы-реципиента и начинает функционировать, образуя функциональные контакты. Трансплантат обеспечивает сетчатку трофическими факторами и факторами роста без провокации иммунной реакции и образования злокачественных опухолей. При выборе источника РПЭ предпочтение отдано взрослому РПЭ. Трансплантация культур из эмбрионального и взрослого РПЭ человека пациентам с диагнозом ВМД показала, что трансплантаты взрослого РПЭ сохраняют жизнеспособность, активно пролиферируют, замещая погибшие клетки РПЭ. Трансплантаты эмбрионального РПЭ отличаются слабой выживаемостью и не встраиваются в слой РПЭ реципиента. Авторы объяснили это тем, что клетки эмбрионального РПЭ не имеют необходимого набора адгезионных рецепторов. Многие ученые утверждают, что трансплантация РПЭ в ближайшем будущем станет основным методом клеточной терапии различных заболеваний глаз. Цель — изучить механизмы репарации сетчатки при трансплантации культивированного взрослого РПЭ в глаз кролика. Материал и методы. Формировали экспериментальную модель атрофии РПЭ на обоих глазах 245 кроликов, используя метод фотодинамической терапии фотосенсиблизированных фотодитазином тканей глаза. Серия трансплантаций выполнена 3 кроликам (№ 1, 2, 4) (3 глаза) через 3,5 мес. после воспроизведения модели ретинального повреждения. Трансплантацию культивированных клеток 1-го и 4-го пассажей РПЭ взрослого человека проводили в субретинальное пространство инсулиновым шприцем в дозе 1 млн. кл. в 0,02–0,03 мл физ. раствора. В качестве контроля служили парные глаза без введения РПЭ. Животных выводили из эксперимента на 14, 30 и 45 сутки после трансплантации РПЭ. Глаза энуклеировали и изучали морфологически. Энуклеированные глаза (n=6) префиксировали смесью параформальдегида и глютаральдегида по Карновскому, фиксировали в 1 % растворе тетраоксида осмия, заливали в аралдит. Готовили полутонкие (1 мкм) срезы. Окрашивали метиленовым синим-азуром II и основным фуксином. Трансплантат РПЭ человека в глазу кролика верифицировали иммунофлюоресцентным методом с первичными антителами Human nuclei (маркер ядер человека). Окрашивали каждый 10-й серийный срез (выполнено 10 срезов) глаза кролика. В качестве положительного контроля использовали криостатные срезы глаза взрослого человека. Эффективность трансплантации РПЭ как лечебной клеточной технологии оценивали морфологически. Сравнивали качественные морфологические изменения, развившиеся в контроле и опыте на одном сроке наблюдения. Качественные морфологические изменения анализировали по: — структурным изменениям в слое фоторецепторов; — наличию дефектов в слое фоторецепторов; — изменению структурности наружного зернистого слоя; — состоянию мембраны Бруха в зоне вмешательства; — состоянию хориоидеи. Результаты и обсуждение. В контроле к 30му дню после сеанса ФДТ завершалось формирование модели. На световом уровне в местах лазерного воздействия идентифицировались большие участки дефектов РПЭ. Клеточные элементы, примыкающие к зоне воздействия, претерпевали дегенеративные изменения в виде кист и зон некроза. В субретинальном пространстве выявлялась россыпь обломков клеток РПЭ вместе с пигментными шлаками. Мембрана Бруха (МБ) на большем протяжении зоны ФДТ дифференцировалась слабо, но оставалась сохранной вне зоны воздействия. Хориокапилляры в центре дефекта находились в спавшемся состоянии. Местами выявляли тромбоз хориокапилляров и крупных венул. Эндотелиальные клетки в сосудах отсутствовали. Фоторецепторный слой претерпевал дегенеративно-дистрофические изменения в областях, примыкающих к зоне ФДТ. Они проявлялись участками разрежения (снижения плотности фоторецепторов на единицу площади) и зонами дефектов. В слое ганглиозных клеток развивался кариопикноз. Мюллеровские клетки при этом вытягивались в виде «колонн». В контроле к 60 суткам после ФДТ (или 30-е сутки после трансплантации РПЭ в опытные глаза) наблюдали картину полной атрофии РПЭ в зоне ФДТ без увеличения площади дефекта. Патоморфологические изменения в слое фоторецепторов и слое ганглиозных клеток при этом нарастали. Процессов регенерации не наблюдали. В опытных глазах кролика, энуклеированных на 30-е и 45-е сутки после трансплантации, наблюдали РПЭ человека в виде беспигментных клеток, лежащих в субретинальном пространстве и формирующих монослой равномерной толщины поверх собственного РПЭ реципиента. Морфологически РПЭ человека отличался от кроличьего размерами ядер и клеток, ядерно-цитоплазматическим соотношением, более слабой окраской при окрашивании толуидиновым-синим, отсутствием пигментации и признаков меланосом. Сравнительный аспект морфологического анализа хориоретинального комплекса в зоне воздействия показал, что, благодаря наличию псевдомембранозной структуры, формирующейся в основании имплантированного РПЭ, удается сохранить структурность сетчатки в целом, и ее фоторецепторный слой, в частности. Причем, фоторецепторы дифференцируются более отчетливо и представляются сохранными в большей степени, нежели в контроле. В слое фоторецепторов выявляются единичные клетки РПЭ донора, встроенные в щелевидные промежутки между наружными члениками. Внутренние членики фоторецепторов, при этом, остаются не измененными, интимно примыкают к наружному зернистому слою. К 45 суткам ядра клеток РПЭ донора практически уже не дифференцируются, хотя клетки еще лежат на имитации мембраны Бруха. 246 Выводы. Морфологическая оценка эффективности технологии трансплантации культивированного РПЭ в репарации сетчатки позволяет считать, что имеет место положительный лечебный эффект, направленный на поддержание архитектоники комплекса РПЭ-сетчатка, замедление процессов гибели фоторецепторов. В целом это должно способствовать замедлению естественного течения дегенеративно-дистрофических заболеваний сетчатки. Цель любой клеточной терапии заключается в замене, восстановлении, продлении или увеличении биологической функции поврежденной ткани. Это достигается трансплантацией изолированных и специализированных клеток в целевой орган в достаточном «количестве и качестве», чтобы их выживание было достаточно долгим для восстановления функции. В целом представленные результаты свидетельствуют о том, что используемая нами технология пригодна для этих целей. В. Г. Лихванцева, К. А. Кузьмин, Г. Г. Зиангирова, А. В. Федоренко, А. В. Кузнецова, М. А. Александрова, Э. О. Султанова, А. Ю. Салихов, О. В. Белоус Способ количественной оценки эффективности клеточных технологий при репарации сетчатки Учреждение РАН «Центральная клиническая больница РАН», Учреждение РАМН «НИИ глазных болезней РАМН», Институт биологии развития им. Н. К. Кольцова РАН, г. Москва Основная цель клеточной терапии — замена, восстановление или увеличение сроков биологической функции поврежденной ткани или органа. Это достигается трансплантацией изолированных и специализированных клеток в целевой орган в достаточном «количестве и качестве», чтобы их выживание было достаточно долгим для восстановления функции. К настоящему моменту отсутствуют количественные методы оценки эффективности клеточных технологий. Между тем, они необходимы при подборе адекватной дозы клеточного трансплантата, изучении механизмов, сравнения эффективности разных подходов. Цель — разработка количественных методов оценки эффективности клеточной технологии трансплантации ретинального пигментного эпителия (РПЭ). Материал и методы. Формировали экспериментальную модель атрофии РПЭ на обоих глазах кроликов, используя метод фотодинамической терапии фотосенсиблизированных фотодитазином тканей глаза. Серия трансплантаций выполнена 3 кроликам (№ 1, 2, 4) (3 глаза) через 3,5 мес. после воспроизведения модели ретинального повреждения. Трансплантацию культивированных клеток 1 и 4 пассажей РПЭ взрослого человека проводили в субретинальное пространство инсулиновым шприцем в дозе 1 млн кл. в 0,02–0,03 мл физ. раствора. В качестве контроля служили парные глаза без введения РПЭ. Животных выводили из эксперимента на 14, 30 и 45 сутки после трансплантации РПЭ. Глаза энуклеировали и изучали морфологически. Энуклеированные глаза (n=6) префиксировали смесью параформальдегида и глютаральдегида по Карновскому, фиксировали в 1 % растворе тетраоксида осмия, заливали в аралдит. Готовили полутонкие (1 мкм) срезы. Окрашивали метиленовым синим — азуром II и основным фуксином. Трансплантат РПЭ человека в глазу кролика верифицировали иммунофлюоресцентным методом с первичными антителами Human nuclei (маркер ядер человека). Окрашивали каждый 10-й серийный срез (выполнено 10 срезов) глаза кролика. В качестве положительного контроля использовали криостатные срезы глаза взрослого человека. Количественная оценка терапевтического потенциала технологии трансплантации РПЭ проводили комплексно на основании сравнения в опыте и контроле следующих количественных показателей: 247 — площади дефекта в наружном отделе фоторецепторов; — плотности фоторецепторов на единицу площади в зоне просмотра; — суммарной площади дефектов в наружном зернистом слое; — соотношения площади дефектов к плотности клеточных элементов в зоне воздействия; — плотности клеток в слое наружном зернистом на единицу площади. Таким образом, в целом использовали 5 количественных показателей, позволяющих дать оценку эффективности клеточной технологии Площадь дефекта анализировали с помощью программы анализа эффективности ФДТ на фундус-камере. Индекс плотности фоторецепторов на единицу площади вычисляли колориметрически с помощью программы Photoshop следующим образом. Из микрофотографий одинакового увеличения контроля и опыта вырезались прямоугольные фрагменты одинакового размера с фоторецепторными отростками. Затем с помощью инструмента выделения «Волшебная палочка» с допуском 50 % выделяли пиксели составляющие изображение фоторецепторов и подсчитывали их количество, которое затем делили на количество пикселей всего изображения. Соответственно большему количеству пикселей, со- ставляющих изображение фоторецепторов, соответствовал более высокий индекс плотности. Индекс дефектов в слое фоторецепторов вычислялся аналогичным образом, с той лишь разницей, что выделялись пиксели, составляющие изображение пустых пространств между фоторецепторами. Индекс суммарной площади дефектов в наружном зернистом слое оценивали аналогичным образом. Плотность клеток подсчитывали по количеству ядер на определенном отрезке сетчатки. Результаты и обсуждение. Результаты применения разработанного нами способа количественной оценки эффективности клеточной технологии трансплантации ретинального пигментного эпителия человека в глаз кролика с моделью атрофии РПЭ представлены в таблице. Выводы. Разработанный нами способ количественной оценки позволяет дать комплексную оценку эффективности клеточной технологии трансплантации РПЭ, сформировать доказательную базу на основе статистически достоверной разницы между опытом и контролем для подтверждения выводов, сопоставить результаты одной клеточной технологии с другой, осуществить подбор адекватной дозы вводимых клеток, проследить результаты в динамике. Она может быть рекомендована для практического применения. Результаты количественной оценки эффективности клеточной технологии репарации сетчатки с помощью трансплантации культивированного РПЭ взрослого человека в глаз кролику с моделью атрофии РПЭ Анализируемый показатель Индекс плотности фоторецепторов на единицу площади Индекс дефектов фоторецепторного слоя Соотношение дефектов к плотности в зоне воздействия Суммарная площадь дефектов в наружном зернистом слое Плотность клеток в наружном зернистом слое на единицу площади Контроль (n=30 сканов/cрезов) Опыт (n=30 cканов/срезов) 0,354±0,022* 0,66±0,11* 0,487±0,026 0,48±0,07 1,87±0,03* 0,98±0,01 0,338±0,017* 58 клеток на участке, длиной 32 мкм 0,116±0,012 63 клетки на участке, длиной 32 мкм 248 В. Г. Лихванцева, А. В. Федоренко, Э. О. Султанова, А. Ю. Салихов, О. В. Белоус, Е. В. Ильичова, М. В. Архипова ЭКСПЕРИМЕНТАЛЬНЫЕ МОДЕЛИ ЗАБОЛЕВАНИЙ СЕТЧАТКИ ДЛЯ РАЗРАБОТКИ КЛЕТОЧНЫХ ТЕХНОЛОГИЙ (Экспериментальные исследования) Учреждение РАН «Центральная клиническая больница РАН», Учреждение РАМН «НИИ глазных болезней РАМН», Институт биологии развития им. Н. К. Кольцова РАН, г. Москва Известно, что стратегия экспериментального изучения возможностей и эффективности современных способов лечения заболеваний сетчатки направлена на тщательный выбор экспериментальной модели заболевания и анализ ее адекватности поставленным задачам исследования. На это ориентированы программы поиска новых технологий, лекарств и способов их доклинического изучения. Поскольку наши экспериментальные исследования, по сути, посвящены доклиническим этапом изучения эффективности применения клеточной технологии трансплантации РПЭ при дегенеративнодистрофических заболеваниях глаз, то мы провели поиск уже известных моделей и разработали собственные модели, пригодные для этих целей. При выборе экспериментальных моделей дегенеративнодистрофических заболеваний сетчатки ориентировались на гистогенетическую приближенность к существующим в природе заболеваниям человека. В доступной литературе оказалось всего несколько моделей, используемых в аналогичных целях. Так, Korte с соавторами (1986) использовали системное внутривенное введение экспериментальным животным раствора NaIO3 из расчета дозы 35 мг/кг веса. В качестве экспериментальных животных служили мыши. После инъекции указанного раствора у животных к 14-му дню развилась ретинопатия с частичной атрофией РПЭ. Одним из недостатков этой модели является возможность самопроизвольной реставрации хориоретинального комплекса примерно к 21 дню без лечения. Это существенно затрудняет использование указанной модели для оценки эффективности трансплантации РПЭ в качестве терапевтической технологии. Wang с соавторами (1996) формировали модель жировой дистрофии хориоидеи и сетчатки с атрофией РПЭ у генно-модифицированных мышей, с дефицитом орнитин-дельта-аминотрансферазы. Этот фермент отвечает за переработку и усвояемость липидов разной плотности и молекулярного веса. Третьи авторы формировали модель атрофии хориокапилляров и РПЭ, нанося механическую травму, в ходе которой развивалась отслойка сетчатки и с депонированием в субретинальном пространстве обломков РПЭ. В качестве экспериментального животного предложены кролики. Kuwabara с соавт. (1981) использовали в этих же целях гидрохлорид L-орнитина, вводя его в полость стекловидного тела. В ответ на введение препарата развивался отек РПЭ, нарастающий в течение 4 часов после инъекции и нивелирующийся к 24-м часам. После этого развивалась атрофия РПЭ разной степени выраженности. К указанным изменениям позднее присоединялись дистрофия фоторецепторов. Модель развивалась одинаково хорошо у мышей, крыс, кроликов и обезьян. Как видно из приведенных публикаций, акцент воздействия при формировании модели дегенеративно-дистрофического заболевания сетчатки оказывался преимущественно на РПЭ. Используя этот принцип, мы поставили перед собой цель: разработать собственную модель атрофии РПЭ и хориокапиллярного слоя, а также модель атрофии диска зрительного нерва (ДЗН). Материал и методы. Экспериментальным животным формировали модели заболевания и лечили в полном соответствии с Резолюцией ARVO «По использованию животных в экспериментальных исследованиях», Принципами лечения лабораторных животных (публикация № 86-23 в NIH от 1985 г.) и ныне действующими правилами Good Clinical Practice (GCP). Модели атрофии РПЭ и ДЗН создавали на кроликах с помощью фотодинамического (ФДТ) повреждения сетчатки. Для этого животных предварительно сенсибилизировали фотосенсибилизатором (ФС) хлоринового ряда, в частности, радахлорином. 249 Затем проводили ФДТ лазерным излучением соответствующей длиной волны, находящейся в максимуме поглощения ФС. Дозу излучения подбирали в ходе сеанса. Она была одинаковой на парных глазах. Предполагалось, что один глаз будет контролем — моделью заболевания, а на парном глазу будет выполняться имплантация донорского РПЭ на участок дефекта РПЭ реципиента. Выбор животных определялся размером глаза, что позволяло верифицировать ятрогенную зону на глазном дне с большей точностью и уверенностью. Предоперационная подготовка всех животных выполнена в едином алгоритме. Каждому кролику введено в ягодичную мышцу 0,5 мл/кг 5 % раствора кетамина и 0,5 мл/кг веса 2 % раствора рометара. В комбинации с местной инстилляционной анестезией 1 % раствором алкаина в конъюнктивальные своды устранялись любые болевые ощущения. Такая композиция препаратов позволяла достигать полной обездвиженности экспериментальных животных через 15–20 минут и поддерживать ее в течение 1,5–2 часов. В течение этого времени создавались все условия для проведения эксперимента. Суть эксперимента заключалась в дозированном воздействии на структуры глазного дна лазерным излучением длиной волны 669 нм различной мощности после предварительной фотосенсибилизации радахлорином в дозе 1,0 мг/кг веса. Размер светового пятна в фокальной плоскости также являлся постоянной величиной и составлял 2 мм в диаметре. Эффект контролировали визуально. Фокусировку лазерного воздействия осуществляли с помощью линзы Майнстера 130˚. Мощность излучения была подобрана эмпирически. При этом ориентировались на скорость развития селективного фототромбоза в сосуде сетчатки или ожога сетчатки. Оптимальной оказалась мощность в 300 дж/см2, в дальнейшем она стала величиной постоянной и не менялась в ходе эксперимента. Результаты и обсуждение. Известно, что хлорины обладают тропизмом к эндотелиальным клеткам сосудов, в которых накапливаются в первые 15–45 минут после системного введения. На основании этого факта было сделано предположение о том, что депонирование препарата в указанные сроки произойдет в сосудах хориоидеи или сетчатки, а избирательное дозированное облучение приведет к индукции фототромбозов, которые в ранние сроки приведут к экссудативной отслойке РПЭ или ишемии ЗН, а в более поздние сроки приведут к атрофии РПЭ и ДЗН. С помощью указанной выше методики было сформировано 24 модели у 12 кроликов. При этом в 12 случаях воздействие осуществляли в 1 мм над и под ДЗН. Получали на глазном дне экспериментального животного вначале очаг экссудативной отслойки РПЭ, переходящий в поздние сроки в атрофию РПЭ. Аналогичная картина глазного дна развивается при болезнях географической центральной ползучей атрофии РПЭ, а также при осложненной миопии высокой степени, врожденных абиотрофиях, возрастной форме макулярной дегенерации сетчатки и т. д. Воздействие на магистральные сосуды сетчатки в местах их выхода на ДЗН сопровождалось фототромбозами ЦВС с последующей атрофией ДЗН. Мы получили 12 моделей тромбоза ЦВС у 6 кроликов на парных глазах. Выводы. Разработанные модели заболеваний глазного дна легко воспроизводимы, пригодны для оценки эффективности клеточных технологий и могут быть рекомендованы в этих целях. Н. В. Меркулова, Е. В. Тур, В. С. Рыкун СОСТОЯНИЕ СВЕТОЧУВСТВИТЕЛЬНОСТИ СЕТЧАТКИ И ГЕМОДИНАМИКИ СОСУДОВ ГЛАЗА И ОРБИТЫ ПРИ РАЗЛИЧНЫХ ФОРМАХ ОПТИЧЕСКОЙ НЕЙРОПАТИИ ГОУ ВПО «Челябинская государственная медицинская академия Росздрава», г. Челябинск Сосудистая теория оптической нейропатии (ОН) рассматривает снижение кровотока в головке зрительного нерва вследствие атеросклероза или нарушения сосудистой регуляции, что вызывает снижение перфузии сетчатки глаза при колебаниях офтальмотонуса [3]. Первичная открытоугольная глаукома (ПОУГ) и ишемическая болезнь сердца (ИБС) имеют общие факторы в патогенезе, а имен- 250 но — метаболические, гемодинамические, наследственные. В связи с этим диагностика оптической нейропатии при ПОУГ и ИБС остается актуальной проблемой в офтальмологии и кардиологии. Цель — изучение светочувствительности сетчатки в зависимости от показателей гемодинамики сосудов глаза и орбиты у пациентов с глаукомной оптической нейропатией (ГОН), и ишемической оптической нейропатией (ИОН) у больных постинфарктным кардиосклерозом. Материал и методы. С учетом диагностических критериев нами выделены две группы обследуемых. В 1-ю группу вошли 68 больных ПОУГ отделения микрохирургии глаза, в возрасте от 40 до 70 лет, (средний возраст — 58,9±0,9 лет), вторую группу составили 87 больных кардиохирургического отделения с диагнозом ИБС, постинфарктный кардиосклероз (ПИК) в возрасте от 40 до 70 лет (средний возраст — 57,4±0,5 лет) Челябинской областной клинической больницы. Все обследуемые были мужчины. В группу больных глаукомой мы отбирали пациентов с начальной и развитой стадий развития, компенсированной, без тяжелой соматической патологии. Исключением из исследования служили пациенты со значимыми нарушения в сонных артериях при проведении ультразвуковой допплерографии (УЗДГ). Кровоток в сосудах глаза и орбиты мы исследовали на аппарате Siemens Sonoline G-50 (США) датчиком 10 мГц методом триплексного сканирования с цветным допплеровским картированием. Оценивали показатели кровотока (V max, V med, V min, RI) в глазничной артерии (ГА), центральной артерии сетчатки (ЦАС), задних коротких цилиарных артериях (ЗКЦА). Компьютерную статическую периметрию выполняли на автоматизированном анализаторе поля зрения Humphrey, модель 620 (США). Использовались стандартные условия [1]. Применяли статическую пороговую периметрию для центрального поля зрения — пороговый тест 30-2 и определение пороговой величины светочувствительности макулярной области. На основании полученных протоколов обследования определяли суммарную светочувствительность сетчатки (в децибелах), квадрант с наиболее выраженной депрессией светочувствительности, горизонтальный и вертикальный размеры слепого пятна (в градусах), наличие «прорыва слепого пятна на периферию», пороговую величину светочувствительности макулярной области (в децибелах). Статистический анализ выполнен с использованием пакета прикладных компьютерных программ STATISTICA 6.0. О достоверности межгрупповых различий судили по U-критерию Манна-Уитни. Взаимосвязи изучали путем расчета коэффициента корреляции Спирмена (r). Проверку статистических гипотез проводили при критическом уровне значимости p=0,05. Результаты и обсуждение. Проведенный анализ исходного состояния пациентов выявил сопоставимость сформированных групп по возрасту (критерий Манна-Уитни, p =0,052). Как видно из данных таблицы, у больных с ишемической оптикопатией минимальная скорость (V min) в ГА и максимальная скорость (V max) в ЗКЦА оказалась ниже, чем в сосудах глазах и орбиты у больных с глаукомной оптикопатией. Средняя скорость (V med) в ЦАС была ниже при глаукомной оптикопатии, чем при ишемической оптикопатии. Других статистически значимых различий в параметрах гемодинамики не наблюдалось. Таблица 1 Показатели гемодинамики в сосудах глаза и орбиты Показатель ГА Vmax ГА Vmed ГА Vmin ГА RI ЦАС Vmax ЦАС Vmed ЦАС Vmin ЦАС RI ЗКЦА Vmax ЗКЦА Vmed ЗКЦА Vmin ЗКЦА RI ГОН 26,34 ДИ0,95 [25,16; 27,52] 14,62 ДИ0,95 [13,47; 15,76] 8,43 ДИ0,95 [7,61; 9,26] 0,71 ДИ0,95 [0,69; 0,73] 12,89 ДИ0,95 [12,22; 13,56] 7,32 ДИ0,95 [6,82; 7,82] 4,15 ДИ0,95 [3,46; 4,85] 0,73 ДИ0,95 [0,71; 0,75] 8,13 ДИ0,95 [7,75; 8,52] 5,07 ДИ0,95 [4,78; 5,35] 2,75 ДИ0,95 [2,5; 3] 0,69 ДИ0,95 [0,68; 0,71] ИОН 25,66 ДИ0,95 [24,82; 26,51] 13,83 ДИ0,95 [13,19; 14,46] 6,89 ДИ0,95 [6,32; 7,39] 0,74 ДИ0,95 [0,72; 0,75] 13,35 ДИ0,95 [12,97; 13,73] 8,02 ДИ0,95 [7,75; 8,29] 3,74 ДИ0,95 [3,55; 3,94] 0,72 ДИ0,95 [0,71; 0,73] 7,52 ДИ0,95 [7,35; 7,69] 5,05 ДИ0,95 [4,93; 5,17] 2,35 ДИ0,95 [2,26; 2,44] 0,68 ДИ0,95 [0,67; 0,69] 251 Р 0,30 0,19 0,004 0,07 0,13 0,01 0,53 0,08 0,047 0,47 0,06 0.09 Таблица 2 Показатели светочувствительности сетчатки по данным компьютерной периметрии Показатель Светочувствительность макулярной области, dB Суммарная светочувствительность сетчатки в пределах 30° от центра, dB Горизонтальный размер «слепого пятна», град. Вертикальный размер «слепого пятна», град. ГОН ИОН Р 31,38 ДИ0,95 [30,25; 32,5] 32,04 ДИ0,95 [31,36; 32,73] 0,54 1769,82 ДИ0,95 [1687,14; 1876,96 ДИ0,95 [1828,23; 0,14 1852,49] 1925,69] 8,65 ДИ0,95 [8,44; 8,86] 9,63 ДИ0,95 [8,93; 10,33] 0,003 8,47 ДИ0,95 [8,06; 8,89] 8,48 ДИ0,95 [7,77; 9,19] 0,58 Таблица 3 Распределение скотом по данным компьютерной статической периметрии Отсутствие скотом Верхняя дугообразная скотома Единичные скотомы в верхнем сегменте Нижняя дугообразная скотома Кольцевидная скотома Единичные скотомы в нижнем сегменте «Назальная ступенька» Прорыв скотомы слепого пятна на периферию ГОН, количество глаз ( %) 16 (16,3 %) 10 (10,2 %) 41 (41,8 %) 1 (1,05 %) 1 (1,05 %) 0 (0 %) 10 (10,2 %) 19 (19,4 %) Как видно из таблицы, у больных глаукомой увеличен горизонтальный размер слепого пятна. Суммарная светочувствительность, светочувствительность макулярной области и вертикальный размер слепого пятна статистически не отличались в двух исследуемых группах пациентов. В группе больных с ГОН в подавляющем большинстве случаев присутствовали единичные скотомы в верхнем сегменте (41,8 %), прорыв слепого пятна на периферию наблюдался в 19,4 % случаев, отсутствие скотом наблюдалось только в 16,3 % случаев. В группе больных с ИОН наиболее распространенными скотомами являлись единичные скотомы в верхнем сегменте (25,9 %). Прорыв слепого пятна на периферию встречался менее, чем в 1 % случаев. В более чем половине случаев (55,2 %) скотомы отсутствовали. При ИОН снижение кровотока в ГА и ЗКЦА связаны с атеросклерозом, что в ряде случаев проявляется наличием единичных скотом в основном в верхнем сегменте и расширением скотомы слепого пятна при проведении компьютерной периметрии. При ГОН снижение кровотока в ЦАС, которая обеспечивает кровоснабжение поверхностного слоя диска зрительного нерва и перипапиллярной сетчатки, проявляется наличием дугообразных скотом и единичных скотом в верхнем сегменте в большинстве случаев. Результаты корреляционного анализа, проведенного в отношении интегральной совокупности больных (n=272 глаза), показали значимую обратную зависимость горизонтальных размеров слепого пятна от максимальной скорости кровотока (Vmax) ГА и Vmax в ЗКЦА (r = –0,14, p=0,029; r= –0,15, p=0,02, соответственно), что объясняет расширение скотомы слепого пятна у больных ИОН. По-видимому, атрофия зрительного нерва при ГОН, проявляющаяся выраженным расширением скотомы слепого пятна, в большей степени зависит от прогибания решетчатой пластинки склеры. Выводы. Проведенное исследование поможет облегчить дифференциальную диагностику ИОН и ПОУГ у больных с ИБС. Вид скотомы ИОН, количество глаз ( %) 96 (55,2 %) 14 (8 %) 45 (25,9 %) 5 (2,9 %) 1 (0,6 %) 10 (5,7 %) 2 (1,1 %) 1 (0,6 %) Литература 1. Еричев, В. П. Периметрия: пособие для врачей, интернов, клинических ординаторов / В. П. Еричев. — М., 2009. 2. Clearance of Diagnostic Ultrasound Systems and Transducers. Washington, DC: US Department of Health and Human Services, Food and Drug Administration, Center for Devices and Radiological Health. 2008. 3. Flammer, J. The impact of ocular blood flow in glaucoma / J. Flammer, S. Orgul, V. P. Costa [et al.] // Prog-Retin-Eye-Res. — 2002. — Vol. 21. — № 4. — Р. 359–393. 252 А. Ш. Мухамедьянова, Р. А. Азнабаев ДИНАМИКА ПОКАЗАТЕЛЕЙ ЛАЗЕРНОЙ СКАНИРУЮЩЕЙ ТОМОГРАФИИ СЕТЧАТКИ ГЛАЗ У ПАЦИЕНТОВ С ПРЕДИСЦИФОРМНОЙ СТАДИЕЙ ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ И ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ НА ФОНЕ ЛЕЧЕНИЯ ПРЕПАРАТОМ МЕКСИДОЛ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Учитывая роль гипертонической болезни и активации пероксидазных систем в прогрессировании возрастной макулярной дегенерации (ВМД), для лечения пациентов с предисциформной стадией на фоне гипертонической болезни рекомендовано применение препаратов, обладающих антиоксидантными и антигипоксическими свойствами [Мухамедьянова А. Ш. с соавт., 2008]. Есть сообщения о положительном эффекте применения антиоксидантного препарата Мексидол у пациентов с оптическими нейропатиями [Егоров А. Е. с соавт., 2002]. При лечении Мексидолом пациентов с прогрессирующей первичной открытоугольной глаукомой улучшение зрительных функций наблюдалось в 40 % случаев [Оренбуркина О. И. с соавт., 2008]. Необходимость повышения эффективности лечебных мероприятий, предупреждающих прогрессирование изучаемой возрастной патологии обусловливает актуальность исследования. Цель — оценить динамику показателей лазерной сканирующей томографии сетчатки глаз (толщины и индекса отечности) у пациентов с предисциформной стадией возрастной макулярной дегенерации (ВМД) и гипертонической болезнью на фоне лечения препаратом Мексидол. Материал и методы. Проанализированы результаты лечения 20 человек с предисциформной стадией ВМД и гипертонической болезнью. Возраст пациентов в среднем составил 65,7±4,9 лет. Мужчин было 10 (50,0 %), женщин — 10 (50,0 %). Первую группу составили 10 пациентов с традиционным лечением ВМД на фоне назначенных терапевтом антигипертензивных препаратов, вторую группу — 10 пациентов с добавлением в традиционное лечение Мексидола. Мексидол (этилметилгидроксипиридина сукцинат) представляет собой антиоксидантное, антигипоксическое, мембраностабилизирующее, ноотропное и анксиолитическое средство. Традиционные препараты во всех группах в течении 14 дней применяли по следующей схеме: парабульбарно 1,0 % раствор этилметилпиридина гидрохлорида (Эмоксипин) по 0,5 мл 1 раз в день чередовали с 10,0 % раствором метилгидразиния пропионата (Милдронат) по 0,5 мл 1 раз в день; внутримышечно 5,0 % раствор пиридоксина (витамин В6) по 1,0 мл 1 раз в день №5, внутримышечно 2,5 % раствор тиамина (витамин В1) по 1,0 мл 1 раз в день №5; внутривенно капельно 2,0 % раствор метилгексилксантина (Пентоксифиллин) по 5,0 мл на 200 мл физиологического раствора через день №7 в первой группе; внутрь таблетки метилгексилксантина (Пентоксифиллин) по 100,0 мг 3 раза в день №14 во второй и третьей группах. Во второй группе к указанному лечению были добавлены внутривенно капельные инфузии 2,0 мл 5 % раствора Мексидола на 200 мл физиологического раствора ежедневно 1 раз в сутки №10. Исследование макулярной области (толщины и индекса отечности) до и после лечения во всех группах было проведено с помощью лазерного сканирующего томографа «HRT-III» (Германия). По изображениям, полученным в ходе ретинальной томографии, оценивали толщину и средний индекс отечности в зоне, очерченной окружностью с центром в фовеоле и диаметром 1 мм, 2, 3 мм и непосредственно в макулярной зоне [Астахов Ю. С. и соавт., 2005]. Статистическую обработку полученных данных проводили с помощью стандартных методов статистики в рамках программы Statsoft Windows, версия 5,0. Результаты и обсуждение. После традиционного лечения (первая группа) статистически достоверных изменений толщины макулярной области и индекса отечности не наблюдалось (табл.1). Во второй группе после лечения толщина зоны, очерченной окружностью с центром в фовеоле и диаметром 1 мм, 3 мм, была достоверно ниже, чем до лечения (p<0,05–0,01). Существенное уменьшение 253 Таблица 1 Показатели толщины макулярной области и индекса отечности до и после традиционного лечения (первая группа) Оцениваемая область 1 мм 2 мм 3 мм макулярная зона Исследуемые показатели толщина (µm) индекс отечности до лечения после лечения до лечения после лечения 277,0±9,3 281,0±5,1 1,66±0,03 1,64±0,04 296,0±6,2 300,0±5,1 1,63±0,01 1,61±0,03 319,0±10,4 317,5±3,5 1,68±0,14 1,58±0,07 297,3±11,3 299,5±4,5 1,66±0,07 1,61±0,03 Таблица 2 Показатели толщины макулярной области и индекса отечности до и после традиционного лечения с Мексидолом (вторая группа) Оцениваемая область 1 мм 2 мм 3 мм макулярная зона Исследуемые показатели толщина (µm) индекс отечности до лечения после лечения до лечения после лечения 283,5±6,5 253,5±5,4** 1,65±0,06 1,50±0,03* 299,5±8,5 282,5±2,5 1,69±0,08 1,48±0,05* 319,0±7,1 290,5±6,5* 1,67±0,06 1,43±0,07* 300,7±10,5 275,5±7,2 1,67±0,08 1,47±0,04* * — достоверность различий с показателем до лечения (p<0,05); ** — достоверность различий с показателем до лечения (p<0,01). индекса отечности в макулярной области и зонах, очерченных окружностью с центром в фовеоле и диаметром 1, 2 и 3 мм, также наблюдалось в этой группе (p<0,05) (табл.2). Для иллюстрации приводим клинический пример. Больная Д., 1943 г. р. (м/к 3278–2007), обратилась в клинику с жалобами на снижение центрального зрения левого глаза. В анамнезе жизни пациентки — гипертоническая болезнь. На момент поступления острота зрения составила ОD — 0,8 ск +1,0D=0,9 и OS — 0,3 ск +1,5D=0,6; Tn18,0/Tn15,0. Объективно: OS — роговица прозрачная, передняя камера средней глубины, зрачок круглый, начальные помутнения хрусталика, нежная деструкция стекловидного тела. Офтальмоскопическая картина глазного дна: ДЗН бледнорозовые, границы четкие, артерии склерозированы, вены полнокровны, в макулярной области дистрофические очаги, перераспределение пигмента, периферия сетчатки без особенностей. Выставлен диагноз: ОS — Возрастная макулярная дегенерация, предисциформная стадия. Заключение терапевта: Ишемическая болезнь сердца. Стенокардия напряжения. ФК II. Гипертоническая болезнь II стадии, II степени, риск III. Пациентке назначено традиционное лечение с добавлением Мексидола. Данные «HRT3» до и после традиционного лечения с Мексидолом представлены на рис. 1 и 2 (Приложение). На рис.1а показано, что у пациентки до лечения в макулярной области наблюдались дистрофические очаги, перераспределение пигмента. Средняя толщина макулярной зоны в 9 секторах составила 282,3±10,1 µm, а индекс отечности — 1,46±0,07 (рис. 2а). После проведенного традиционного лечения с Мексидолом острота зрения в OS улучшилась до 0,5 ск +1,5D=0,8. На томографической картине макулярной области отмечались участки просветления и уменьшения площади дистрофических очагов (рис.1б). Средний показатель толщины в 9 секторах исследуемой зоны после лечения был несколько ниже — 264,0±9,5 µm (рис.2б). В свою очередь, средний показатель индекса отечности в макулярной области снизился достоверно и составил 1,12±0,05 (p<0,01). Таким образом, положительное влияние Мексидола на состояние макулярной области у пациентов с предисциформной стадией ВМД и гипертонической болезнью проявилось в нормализации показателей толщины и индекса отечности. Мы полагаем, что клинический эффект Мексидола обусловлен прежде всего его антиоксидантным действием, который напрямую воздействует на один из основных патогенетических механизмов — оксидативный стресс. 254 Остальные известные свойства Мексидола также могут положительно влиять на течение заболевания. Вывод. Включение в традиционное лечение пациентов с предисциформной стадией ВМД на фоне гипертонической болезни препарата Мексидол повышает эффективность лечения, уменьшая в конечном итоге показатели толщины центральной зоны сетчатки и индекса отечности. А. Ш. Мухамедьянова, Р. А. Азнабаев ФУНКЦИОНАЛЬНЫЕ ПОКАЗАТЕЛИ ОРГАНА ЗРЕНИЯ У ПАЦИЕНТОВ С ПРЕДИСЦИФОРМНОЙ СТАДИЕЙ ВОЗРАСТНОЙ МАКУЛЯРНОЙ ДЕГЕНЕРАЦИИ И ГИПЕРТОНИЧЕСКОЙ БОЛЕЗНЬЮ НА ФОНЕ ЛЕЧЕНИЯ ПРЕПАРАТОМ МЕКСИДОЛ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Полученные ранее данные свидетельствуют о роли гипертонической болезни и активации пероксидазных систем в прогрессировании возрастной макулярной дегенерации (ВМД) [Мухамедьянова А. Ш. и соавт., 2008]. Имеются данные о положительном эффекте применения антиоксидантного препарата Мексидол у пациентов с оптической нейропатией и прогрессирующей первичной открытоугольной глаукомой [Егоров А. Е. и соавт., 2002, Оренбуркина О. И. и соавт., 2008]. Поэтому для лечения пациентов с предисциформной стадией ВМД на фоне гипертонической болезни нами рекомендовано применение препарата Мексидол с антиоксидантным, антигипоксическим действием. Необходимость повышения эффективности лечебных мероприятий, предупреждающих переход ВМД во «влажную» форму обусловливает актуальность исследования. Цель — оценить изменение различных функциональных показателей органа зрения (остроты зрения, суммарного поля зрения, определение относительных и абсолютных скотом, общее снижение чувствительности центрального поля зрения, порога электрической чувствительности и электрической лабильности) у пациентов с предисциформной стадией возрастной макулярной дегенерации (ВМД) и гипертонической болезнью до и после лечения препаратом Мексидол. Материал и методы. Проведен анализ результатов лечения 20 человек с предисциформной стадией ВМД и гипертонической болезнью. Возраст пациентов в целом составил 65,7±4,9 лет. Мужчин было 10 (50,0 %), женщин — 10 (50,0 %). Первую группу составили 10 пациентов с традиционным лечением ВМД на фоне назначенных те- рапевтом антигипертензивных препаратов, вторую группу — 10 пациентов с добавлением в традиционное лечение Мексидола. Мексидол (этилметилгидроксипиридина сукцинат) представляет собой антиоксидантное, антигипоксическое, мембраностабилизирующее, ноотропное и анксиолитическое средство. Традиционные препараты во всех группах в течение 14 дней применяли по следующей схеме: парабульбарно 1,0 % раствор этилметилпиридина гидрохлорида (Эмоксипин) по 0,5 мл 1 раз в день чередовали с 10,0 % раствором метилгидразиния пропионата (Милдронат) по 0,5 мл 1 раз в день; внутримышечно 5,0 % раствор пиридоксина (витамин В6) по 1,0 мл 1 раз в день №5, внутримышечно 2,5 % раствор тиамина (витамин В1) по 1,0 мл 1 раз в день №5; внутривенно капельно 2,0 % раствор метилгексилксантина (Пентоксифиллин) по 5,0 мл на 200 мл физиологического раствора через день №7 в первой группе; внутрь таблетки метилгексилксантина (Пентоксифиллин) по 100,0 мг 3 раза в день №14 во второй и третьей группах. Во второй группе к указанному лечению были добавлены внутривенно капельные инфузии 2,0 мл 5 % раствора Мексидола на 200 мл физиологического раствора ежедневно 1 раз в сутки №10. Все пациенты прошли следующие обследования: визометрия, биомикроскопия, офтальмоскопия, периметрия. Определение скотом и чувствительности в определенной точке центрального поля зрения (60°) проводилось с помощью компьютерного периметра «Dicon» (США). Электрофизиологические исследования включали определение порогов электрической чувствительности и электрической лабильности зрительного нерва на аппарате «ЭСОМ» (Россия). 255 Статистическую обработку полученных данных проводили с помощью стандартных методов статистики в рамках программы Statsoft Windows, версия 5,0. Результаты и обсуждение. Проведено исследование средней остроты зрения до и после лечения в представленных группах. Во всех группах после лечения выявлена незначительная тенденция к повышению остроты зрения (р>0,05), однако данные не достоверны (табл. 1). Таблица 2 Суммарное поле зрения по 12 меридианам в исследуемых группах до и после лечения (º) Исследуемые группы Традиционное лечение Традиционное лечение + Мексидол (10 чело(10 человек) век) после лепосле ледо лечения до лечения чения чения 400,1±17,2 420,2±19,4 396,3±17,9 433,3±18,4 Таблица 1 Острота зрения в исследуемых группах до и после лечения Исследуемые группы Традиционное лечение Традиционное лечение + (10 человек) Мексидол (10 человек) после после до лечения до лечения лечения лечения 0,47±0,07 0,54±0,06 0,41±0,08 0,63±0,07 Изучение среднего изменения остроты зрения в результате лечения относительно группы с традиционным лечением (0,07±0,03) показало достоверное его повышение в группе традиционного лечения с Мексидолом (0,22±0,04, p<0,05). Таким образом, наилучшие результаты по остроте зрения получены при сочетании традиционного лечения с Мексидолом. Методом периметрии исследовано суммарное поле зрения по 12 меридианам во всех группах до и после лечения (табл. 2). Во всех группах исследуемый показатель имел тенденцию к повышению после лечения, но данные статистически не достоверны. При изучении среднего изменения значений суммарного поля зрения в исследуемых группах относительно традиционного лечения (20,1±3,4º) статистически достоверные результаты выявлены в группе традиционного лечения с Мексидолом (37,0±3,3º, p<0,01). С помощью компьютерной периметрии проводилось определение относительных и абсолютных скотом, а также чувствительности (в том числе и фовеолярной) в определенной точке центрального поля зрения (60°). Количество видимых точек в каждой группе практически не отличалось от нормы (n=80) (табл. 3). После лечения во второй группе отмечалась тенденция к уменьшению среднего показателя относительных скотом (p>0,05). Анализ среднего изменения количества относительных скотом показал достоверное уменьшение в группе традиционного лечения с Мексидолом в сравнении с группой традиционного лечения (p<0,05). Исследование числа абсолютных скотом, как и фовеальной чувствительности, не показало существенных отличий в группах ни по средним значениям до и после лечения, ни по среднему изменению показателей (табл.3). Общее снижение чувствительности центрального поля зрения в исследуемых группах было одинаковым до и после лечения (до 5 дб) (табл. 4). В группе традиционного лечения с Мексидолом отмечено достоверное повышение чувствительности в нижне- и верхнетемпоральных секторах (p<0,05). Изучение среднего изменения чувствительности во всех группах существенных различий не выявило. Таблица 3 Показатели компьютерной периметрии в исследуемых группах Исследуемые группы Традиционное лечение Традиционное лечение + Мексидол Количество видимых точек до после 79,4± 79,9± 0,3 0,1 79,4± 79,9± 0,4 0,1 Центральное поле зрения Количество относительных скотом Количество абсолютных скотом до 10,3± 2,3 10,7± 1,8 до 0,4± 0,3 0,6± 0,4 после ср. изм. 8,6± 1,8± 2,1 0,5 6,9± 3,8± 1,4 0,7* * — достоверность различий с группой традиционного лечения (p<0,05). 256 после ср. изм. 0,3± 0,2± 0,2 0,1 0,2± 0,3± 0,1 0,2 Фовеальная чувствительность (дб) до после 30± 30± 1,6 1,9 30± 31± 1,5 1,7 Таблица 4 Снижение чувствительности центрального поля зрения (60°) методом компьютерной периметрии Исследуемые группы Традиционное лечение Традиционное лечение + Мексидол Снижение чувствительности центрального поля зрения (дб) НижнеВерхнеНижнеВерхнеОбщее назальное назальное темпоральное темпоральное до после до после до после до после до после 3,9 3,0 4,2 3,9 4,1 2,9 3,9 2,9 3,5 2,2 ±0,5 ±0,6 ±0,6 ±0,7 ±0,4 ±0,5 ±0,5 ±0,5 ±0,5 ±0,5 4,2 3,1 4,6 4,1 3,6 2,8 4,6 3,3 3,8 2,2 ±0,5 ±0,3 ±0,5 ±0,5 ±0,5 ±0,3 ±0,3 ±0,4* ±0,4 ±0,4* * — достоверность различий с показателем до лечения (p<0,05). Таким образом, достоверное улучшение функциональных показателей остроты зрения, суммарного и центрального поля зрения у пациентов с предисциформной стадией ВМД и гипертонической болезнью наблюдалось при сочетании традиционного лечения с Мексидолом: в большей степени повысилась острота зрения, уменьшилось количество относительных скотом. Последнее, по-видимому, связано с функциональной активизацией элементов сетчатки, находящихся в стадии парабиоза вследствие восстановления микроциркуляции. Соответственно, количество абсолютных скотом не изменилось, поскольку в этих зонах сетчатки имеет место функциональная гибель нейроэпителия. Определены пороги электрической чувствительности, характеризующие функциональное состояние внутренних слоев сетчатки во всех группах до и после лечения. Полученные результаты представлены в табл. 5. Выявлено достоверное снижение порога электрической чувствительности после традиционного лечения с Мексидолом (p<0,01). В группе с традиционным лечением существенных изменений не наблюдалось. Значения электрической лабильности, т. е. функционального состояния зрительного нерва, после лечения оставались в пределах нормы (30 Гц) во всех группах до и после лечения. Таким образом, достоверное улучшение функционального состояния внутренних слоев сетчатки наблюдалось в группе традиционного лечения с Мексидолом. Вывод. Наилучшие функциональные показатели органа зрения (повышение остроты зрения, суммарного поля зрения, уменьшение количества относительных скотом, улучшение чувствительности центрального поля зрения, снижение порога электрической чувствительности) у исследуемых пациентов наблюдались после добавления в традиционное лечение препарата Мексидол. Таблица 5 Электрическая чувствительность в исследуемых группах до и после лечения (мкА) Исследуемые группы Традиционное лечение (10 человек) Традиционное лечение + Мексидол (10 человек) до лечения после лечения до лечения после лечения 110,0±4,2 102,0±3,3 109,0±3,8 94,0±1,6** ** — достоверность различий с показателем до лечения (p<0,01). В. В. Нероев, Т. Н. Киселева, М. В. Рябина, Т. Д. Охоцимская, О. В. Золотых Исследование состояния глазного кровотока в эксперименте у крыс допплеровскими методами ФГУ «МНИИ глазных болезней им. Гельмгольца» Минздравсоцразвития России, г. Москва В последние годы ведется активное изучение роли гемодинамических нарушений в патогенезе глазных заболеваний, в том числе при диабетической ретинопатии и возрастной макулярной дегенерации. 257 Для оценки состояния кровотока сетчатки и зрительного нерва при различных заболеваниях глаза широко используются ультразвуковые методы исследования, такие как цветовое допплеровское картирование (ЦДК) и энергетическое картирование (ЭК). Большинство авторов указывают на высокую информативность этих методов в диагностике и прогнозе сосудистой патологии глаза в клинической практике. Для изучения патогенеза и разработки новых методов лечения патологических состояний в медицине, и в том числе в офтальмологии, широко применяется моделирование патологических процессов на животных. В офтальмологии для экспериментальных работ часто применяются крысы, что связано с известной схожестью строения сетчатки и зрительного нерва у крыс и человека, подтвержденной гистологическими исследованиями. Прижизненное исследование этих животных значительно затруднено по причине их малых размеров. Оценка показателей глазного кровотока в литературе носит неполный характер и нуждается в уточнении. Цель — изучение основных показателей кровотока и разработка схемы кровоснабжения глаза крысы in vivo. Материал и методы. Выполнено ультразвуковое исследование на 10 крысах (20 глаз), включающее ЦДК и ЭК с помощью многофункционального ультразвукового диагностического прибора VOLUSION 730 Pro фирмы «Kretz» c использованием линейного датчика частотой от 10 до 16 МГц. Идентификация сосудистых ветвей в ретробульбарном пространстве проводилась по предлагаемому анатомическому прохождению и по направлению тока крови. Поток по направлению к датчику обозначался красным цветом, а от датчика синим цветом. При помощи допплеровского спектрального анализа идентифицировали пульсирующий артериальный кровоток и более непрерывный или минимально пульсирующий венозный кровоток. При оценке допплеровских характеристик потока в артериях регистрировали спектр допплеровского сдвига частот (СДСЧ) и определяли основные количественные показатели кровотока: максимальную систолическую скорость (Vsyst), конечную диастолическую скорость (Vdiast) и индекс резистентности или периферического сопротивления (RI). При проведении ультразвукового исследования идентифицировали максимальный пульсирующий поток крови, расположенный у вершины орбиты, соответствующий по гемодинамическим характеристикам глазной артерии (ГА). Для точного определения ГА сравнивали место локализации потока крови с проекцией зрительного нерва. Если поток крови располагался кнутри от зрительного нерва, то его определяли как верхнюю глазную артерию (ВГА), если кнаружи — как нижнюю глазную артерию (НГА). При проведении плоскости сканирования через задний полюс глаза в проекции зрительного нерва определяли артериальный поток соответствующий центральной артерии сетчатки (ЦАС) и минимально пульсирующий кровоток, соответствующий центральной вене сетчатки (ЦВС). Вблизи заднего полюса глаза регистрировали два потока крови симметричные с обеих сторон от зрительного нерва. Поток крови был направлен в сторону глаза и соответствовал проекции задних длинных цилиарных артерий (ЗДЦА). Результаты и обсуждение. Выявлено, что наибольшие значения максимальной скорости кровотока наблюдались в НГА (V syst=12,25±1,55 см/с, V diast=4,75±0,94 см/с, RI=0,61±0,1). Более низкие параметры скорости кровотока отмечались в ЦАС (Vsyst=6,99±0,89 см/с, V diast=2,91±0,68 см/с) и ЗДЦА (V syst=5,83±0,99 см/с, Vdiast=2,48±0,41 см/с) при невысоком индексе периферического сопротивления (RI=0,59±0,1 и RI=0,65±0,1 соответственно). Показатели венозного кровотока составляли в ГВ — V syst=6,13±0,62 см/с, в ЗЦВ — V syst=4,23±0,73 см/с. Анализ полученных данных показал, что СДСЧ кровотока глаза крысы по качественным и количественным характеристикам в большей степени соответствует СДСЧ кровотока человека в норме, чем СДСЧ кровотока кролика. На основании результатов ультразвукового исследования сосудистой системы глаза и орбиты крысы, а также с учетом данных литературы, нами была разработана схема кровоснабжения глаза крысы. Установлено, что глаз крысы кровоснабжается из системы двух магистральных артерий — ВГА и НГА, являющихся ветвями ГА. НГА дает крупную ветвь ЗЦА, которая, в свою очередь, разделяется на три ветви: ЦАС, медиальная и латеральная ЗДЦА. Венозный отток крови осуществляется по двум основным коллекторам — ЦВС и ЗЦВ, из которых кровь оттекает к глазную вену. Выводы. Выполненная нами экспериментальная работа с использованием доплеровских методов исследования позволила изучить in vivo состояние кровотока в сосудах глаза крысы и разработать уточненную схему его кровоснабжения. Полученные данные будут полезны для оценки гемодинамических нарушений при моделировании сосудистой патологии глаза в эксперименте. 258 А. М. Нугуманова, Г. Х. Хамитова, А. Н. Шавалеев ВОЗРАСТНАЯ МАКУЛОДИСТРОФИЯ У ПАЦИЕНТОВ С МИОПИЧЕСКОЙ РЕФРАКЦИЕЙ Казанский государственный медицинский университет, г. Казань, Республика Татарстан XXI век ознаменовался возрастанием агрессивного влияния окружающей среды на организм человека. Это коснулось, в том числе, и органа зрения. Об этом свидетельствуют работы ряда авторов, посвященные изучению дистрофических процессов в глазу, в частности, возрастной макулодистрофии (ВМД) [5, 6]. На сегодняшний день в структуре заболеваемости в старшей возрастной группе последние занимают 3-место после глаукомы и диабетической ретинопатии [1–3, 8]. Параллельно с этим, на современном этапе отмечается и рост близорукости, которая так же сопровождается дистрофическими изменениями [4, 7]. Цель — изучение сочетания ВМД у пациентов с миопической рефракцией. Материал и методы. Проведен ретроспективный анализ 3900 историй болезней пациентов, находившихся на стационарном лечении в Республиканской клинической больнице Министерства здравоохранения Республики Татарстан, Республиканской клинической офтальмологической больнице и Офтальмологической клинике «Третий глаз» (г. Казань). Из них было выявлено 202 пациента с ВМД и 98 пациентов с ВМД в сочетании с миопией. Полученные данные были обработаны на IBM PC/AT с помощью программного продукта Microsoft Excel с использованием методов параметрической статистики. Результаты и обсуждение. Распространенность ВМД, по данным обращаемости в республиканские лечебные учреждения, составила 5,2 %, что совпадает с результатами других авторов [4, 8]. Изучение распространенности ВМД в сочетании с миопией составило 2,5 %, т. е. их соотношение составило 2:1. Другие состояния рефракции в данной работе не рассматривались. Влияние медико-биологических факторов (пол, возраст) на возникновение ВМД у пациентов с миопией представлены на рисунках 1–3. Из рисунка 1 видно, что женщины преобладали и в группе больных с ВМД, и в группе, где имело место сочетание миопии с ВМД. По сравнению с мужчинами, в обеих группах женщин было больше, особенно это преобладание наблюдалось в группе, где ВМД одновременно сочеталась с миопией (соответственно, в 1,8 раза и в 3,5 раза). мужчины женщины ВМД 73 129 ВМД и миопия 22 76 Рис. 1. Частота ВМД и ВМД с миопией в зависимости от пола больных При изучении возраста пациентов, было выявлено, что и у мужчин, и у женщин при сочетании ВМД с миопией отмечается более раннее начало дистрофии, чем без миопии: у мужчин — на 15 лет раньше, у женщин — на 19. При этом у мужчин пик заболеваемости ВМД пришелся на возраст от 71 года и старше (у 50 % пациентов), а при сочетании ВМД с миопией — на возрастной период от 56 до 65 лет (у 38 % обследованных больных) (рис.2). У женщин так же, как и у мужчин, наибольшее число случаев ВМД было зарегистрировано в возрасте от 71 года (у 46 % больных) (рис.3). При сочетании ВМД с миопией основной пик заболеваемости пришелся у них на возрастной период от 46 до 60 лет (у 52 % больных). Выводы. Полученные данные свидетельствуют об имеющемся патологическом влиянии миопической рефракции на развитие возрастной макулодистрофии, в частности, более раннее ее начало. С учетом имеющихся фактов, у пациентов с миопической рефракцией должна проводиться не только коррекция нарушения зрения, но и профилактика развития ВМД в виде назначения своевременной и полноценной дедистрофической терапии. 259 Рис. 2. Частота встречаемости ВМД и ВМД с миопией у мужчин (в %) Рис. 3. Частота встречаемости ВМД и ВМД с миопией у женщин (в %) Литература 1. Будзинская, М. В. Современные подходы к лечению и профилактике возрастной макулярной дегенерации / М. В. Буд­зинская, М. В. Воробьева, Т. Н. Киселева [и др.] // Клин. офтальмол. — 2007. — Т. 8. — № 2. — С. 78–82. 2. Barondes, M. J. Controlled trial of laser photocoagulation of pigment epithelial detachments in the elderly: 4 year review / M. J. Barondes, S. Pagliarini, I. H. Chisholm [et al.] // Br. J. Ophthalmol. — 1992. — Vol. 6. — Р. 5–7. 3. Clemons, T. E. Risk factors for the incidence of Advanced Age-Related Macular Degeneration in the Age-Related Eye Disease Study (AREDS) AREDS report no. 19 / T. E. Clemons, R. C. Milton, R. Klein [et al.] // Ophthalmology. — 2005. — Vol. 112. — № 4. — Р. 33–99. 4. Dimitova, G. Retrobulbar circulation in myopic patients with or without myopic choroidal neovascularisation / G. Dimitova, Y. Tamaki, S. Kato [et al.] // Br. J. Ophthalmol. — 2002. — Vol. 86. — № 7. — Р. 771–773. 5. Ehrlich, R. Age-related macular degeneration and the aging eye / R. Ehrlich, A. Harris, N. S. Kheradiya [et al.] // Clin. Interv. Aging. — 2008. — Vol. 3. — № 3. — P. 473–482. 6. Friedman, D. S. Prevalence of age-related macular degeneration in the United States / D. S. Friedman, B. J. O'Colmain, B. Munoz [et al.] // Arch. Ophthalmol.— 2004. — Vol. 122. — № 4. — Р. 564–572. 7. Vitale, S. Increased prevalence of myopia in the United States between 1971–1972 and 1999–2004 / S. Vitale, R. D. Sperduto, F. L. Ferris // Arch. Ophthalmol. — 2009. — Vol. 127. — № 12. — Р. 1632–1639. 8. Woo, J. H. The epidemiology of age-related macular degeneration in the Indian subcontinent / J. H. Woo, S. Sanjay, K. G. Au Eong // Acta Ophthalmol. — 2009. — Vol. 87. — № 3. — Р. 262–269. 260 О. И. Оренбуркина, А. Э. Бабушкин ПРИМЕНЕНИЕ НЕЙРОПРОТЕКТОРА РЕТИНАЛАМИН В ЛЕЧЕНИИ ГЛАУКОМНОЙ ОПТИЧЕСКОЙ НЕЙРОПАТИИ (обзор литературы) ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Снижение внутриглазного давления (ВГД) у больных глаукомой не всегда приводит к стабилизации зрительных функций, даже несмотря на достаточно низкие цифровые показатели. В связи с этим весьма важным является поиск новых путей лечения первичной глаукомы. Речь идет, главным образом, о путях сохранения волокон зрительного нерва или, как принято говорить, о нейропротекторном лечении [7,9,12,13]. Некоторый оптимизм в проблеме нейропротекторного лечения глаукомы обусловлен появлением препаратов, получивших название цитомедины, или пептидные биорегуляторы. Термин «цитомедины» был предложен В. Г. Морозовым и В. Х. Хавинсоном в 1983 г. Данные препараты, полученные из различных тканей с помощью метода кислотной экстракции, обладают способностью индуцировать дифференцировку в популяции клеток, являющихся исходным материалом для их получения. Иными словами, после экзогенного введения данных полипептидов происходит выброс эндогенных пептидов, для которых введенный пептид был индуктором [6, 9]. Известно, что Ретиналамин содержит 5 мг активных пептидов сетчатки глаза телят или свиней и 17 мг глицина (как стабилизатора). Ретиналамин регулирует процессы метаболизма в сетчатке, стимулирует функции клеточных элементов, способствует улучшению функционального взаимодействия пигментного эпителия и наружных сегментов фоторецепторов, усиливает активность ретинальных макрофагов, оказывает нормализующее влияние на коагуляцию крови, обладает выраженным протекторным свойством в отношении сосудистого эндотелия [1, 10]. В 2002 году на базе кафедры офтальмологии РГМУ г. Москвы совместно с ООО «ГЕРОФАРМ» (г. Санкт-Петербург) проведены исследования и опубликованы результаты терапевтической эффективности препарата ретиналамин у больных глаукомой с компенсированным офтальмотонусом. Шилова Т. Ю. [14] оценила эффективность операции коллагенопластики склеры заднего отрезка 37 глаз у пациентов с компенсированной открытоу- гольной глаукомой II-III стадий в комбинации с применением препарата ретиналамин. Такой комбинированный метод, по мнению автора, позволяет улучшить биохимические свойства склеры и гемодинамику, а насыщение пористой структуры ксенопласта раствором ретиналамина и создание депо препарата оказывает выраженное и пролонгированное нейропротекторное действие. Так, в 78,4 % случаев через 3 месяца после оперативного лечения было отмечено расширение полей зрения и почти в 40 % — улучшение остроты зрения (на 0,1–0,2), а у 27 % больных — уменьшение площади экскавации ДЗН. Шмырева В. Ф. и Мостовой Е. Н. [15] изучили нейропротекторную эффективность 518 прямых операций на склеральном канале зрительного нерва (СКЗН) при глаукоме в сочетании с клеточной терапией в сроки до 2 лет. Все больные имели нормальное ВГД. Аутологичные активированные лейкоциты в виде суспензии клеток в сыворотке крови вводили в область дисцизии СКЗН (0,1–0,2 мл). В отдаленные сроки после указанного лечения авторы наблюдали расширение или стабилизацию границ периферического поля зрения, повышение перфузионного давления, уменьшение глубины и площади экскавации ДЗН. По мнению Якубовой Л. В. с соавт. [16], основные проблемы, препятствующие широкому распространению нейропротекторной стратегии при лечении больных глаукомой заключаются в том, что до сих пор не установлены точные механизмы, запускающие нейродегенеративные процессы при данном заболевании; не доказана связь результатов экспериментальных исследований in vitro и на модели у животных с заболеванием человека; затруднен выбор основного конечного показателя эффективности лечения; нет убедительных рандомизированных клинических исследований того, что нейропротекторная терапия может быть полезной при глаукоме. Баранов В. И. с соавт. [5] оценили безопасность и эффективность различных способов введения ретиналамина (имплантация коллагеновой губки, пропитанной препаратом, ретробульбарная катетериза- 261 ция и парабульбарные инъекции) в комплексном лечении псевдоэксфолиативной глаукомы. Авторы установили, что все три изученные способа введения ретиналамина безопасны, но наилучшие количественные показатели расширения полей зрения отмечались при субтеноновой имплантации коллагеновой губки и ретробульбарной катетеризации. Полученные Аширматовой с соавт. данные свидетельствуют об эффективности комплексного лечения (антиглаукоматозная операция + традиционная медикаментозная терапия в сочетании с использованием ретиналамина и лимфотропной терапии — анестетик, антиоксидант и метаболик — в область крылонебной ямки и сосцевидного отростка) первичной открытоугольной глаукомы и позволяет добиться стабилизации зрительных функций у больных в развитой и далекозашедшей стадиях заболевания [4]. В исследованиях Нероева В. В. с соват. [11] отмечено, что наиболее эффективным можно считать комбинированное (внутримышечное и парабульбарное по 5 мг.) и местное (только парабульбарное по 5 мг) введение препарата, при этом зафиксирована хорошая общая и местная переносимость препарата, а также отмечено, что повторный курс лечения целесообразно проводить через 6–12 мес. Астахов Ю. С. с соавт. [3] объективными электрофизиологическими исследованиями доказали, что препарат ретиналамин обладает нейропротекторным действием (увеличивает толерантность зрительного нерва к повышенной нагрузке) в начальной, развитой и далекозашедшей стадиях глаукомы. Проведенный анализ структурных изменений зрительного нерва (ЗН) (по данным HRT II) показал достоверное увеличение средней толщины ретинальных нервных волокон, достоверное повышение остроты зрения, уменьшение абсолютных скотом в группах пациентов, получавших ретиналамин в начальной и развитой стадиях глаукомы. В далекозашедшей стадии прослеживалась только положительная динамика изученных показателей полей и остроты зрения от начала лечения. Алексеев В. Н. с соавт. [2] в своих исследованиях отмечают, что максимальный эффект зарегистри- рован при субтеноновом введении ретиналамина. Авторы рекомендуют начинать нейропротекторное лечение с момента постановки диагноза ПОУГ и проводить курсы не реже 1 раза в год. Проблема коррекции метаболических нарушений, вызванных как самой глаукомой, так и перепадом давления в ходе фистулизирующих операций, а также послеоперационной гипотонией, остается повседневной. При любом патологическом процессе происходит нарушение регуляции переноса информационных молекул между клетками, поэтому усиление синтеза регуляторных пептидов в самом организме, а также введение их извне может способствовать восстановлению утраченных функций [2]. Каменских Т. Г. с соавт. [8] отметили, что ретиналамин эффективен в лечении больных ПОУГ как в условиях нормального офтальмотонуса, так и в сочетании с фистулизирующими операциями при повышенном ВГД. Авторами установлено повышение амплитуды пика Р100 корковых зрительных вызванных потенциалов в результате лечения ретиналамином, что свидетельствует об активации работы зрительной системы в целом. Бутин Е. В. в своей диссертационной работе доказал, что парабульбарные инъекции Ретиналамина (по данным вакуум-компрессионной пробы с контролем ЗВКП) по 5,0 мг в сутки в течение 10 дней целесообразно применять для улучшения функциональной активности ганглиозных клеток сетчатки и их аксонов у пациентов с ПОУГ в начальной, развитой и далекозашедшей стадиях глаукомы [7]. Выводы. Высокая клиническая эффективность терапии свидетельствует о том, что назначение пептидных препаратов является не только оправданным, но и необходимым. Следует отметить, что в одних случаях пептиды используются изолированно, а в других — должны применяться в комплексном традиционном лечении. Данный подход позволяет улучшить результаты как консервативного, так и хирургического лечения больных с глаукомой, снизить частоту рецидивов и осложнений, а также увеличить продолжительность ремиссии. Литература 1. Алдашева, Н. А. Система векторной доставки препаратов в нейропротекторном лечении глаукомы / Н. А. Алдашева // IX съезд офтальмологов России. — М., 2010. — С. 132. 2. Алексеев, В. Н. Нейропротекция при первичной открытоугольной глаукоме. Морфология и клиника / В. Н. Алексеев, Е. Б. Мартынова, А. Л. Аксенова // Ретиналамин. Нейропротекция в офтальмологии: сб. науч. ст. — СПб., 2007. — С. 47–62. 3. Астахов, Ю. С. Оценка нейропротекторного действия ретиналамина в лечении больных с первичной открыто­ угольной глаукомой / Ю. С. Астахов, Е. В. Бутин, Н. В. Морозова, В. О. Соколов // Ретиналамин. Нейропротекция в офтальмологии: сб. науч. ст. — СПб., Наука, 2007. — С. 38–46. 262 4. Аширматова, Х. С. Комплексное лечение больных с первичной нестабилизированной глаукомой с «нормализованным» внутриглазным давлением / Х. С. Аширматова, У. Х. Хакимова, Е. А. Пак // IX съезд офтальмологов России: тез. докл. — М., 2010. — С. 135. 5. Баранов, В. И. Варианты адресной доставки пептидных биорегуляторов в нейропротекторной терапии псевдоэксфолиативной глаукомы / В. И. Баранов, А. Ю. Брежнев, О. М. Денисенко, С. М. Горбунов // IX съезд офтальмологов России: тез. докл. — М., 2010. — С. 136. 6. Бутикова, О. В. Возможности нейропротекции в комплексном лечении глаукомы / О. В. Бутикова, Е. Ю. Бузина // IX съезд офтальмологов России. — М., 2010. — С. 139. 7. Бутин, Е. В. Оценка нейропротекторного действия различных препаратов у больных с первичной открытоугольной глаукомой: автореф. дис. … канд. мед. наук / Е. В. Бутин. — СПб., 2008. — 20 с. 8. Каменских, Т. Г. Ретиналамин в лечении больных первичной открытоугольной глаукомой / Т. Г. Каменских, Е. Ю. Мышкина // Ретиналамин. Нейропротекция в офтальмологии: сб. науч. ст. — СПб., 2007. — С. 72–75. 9. Курышева, Н. И. Глаукомная оптическая нейропатия / Н. И. Курышева. — М.: МЕДпресс-информ, 2006. — 136 с. 10.Максимов, И. Б. Ретиналамин в комплексном лечении инволюционных центральных дистрофий / И. Б. Максимов, Л. К. Мошетова, С. А. Савостьянова. — СПб., 2006. — C. 95. 11.Нероев, В. В. Пептиды в нейропротекторной терапии больных первичной открытоугольной глаукомой с нормализованным офтальмотонусом / В. В. Нероев, В. П. Еричев, Д. Ловпаче // Ретиналамин. Нейропротекция в офтальмологии: сб. науч. ст. — СПб., 2007. — С. 32–37. 12.Применение препарата ретиналамин в офтальмологии: пособие для врачей. — СПб., 2003. — 24 с. 13.Сухарева, Л. А. Влияние комплекса нейропептидов на стабилизацию зрительных функций при глаукомной оптической нейропатии с компенсированным внутриглазным давлением / Л. А. Сухарева, Н. В. Душин, В. С. Назарова // Глаукома. — 2008. — № 1. — С. 33–36. 14.Шилова, Т. Ю. Хирургический метод нейропротекции открытоугольной глаукомы с использованием ретиналамина / Т. Ю. Шилова // IX съезд офтальмологов России. — М., 2010. — С. 185. 15.Шмырева, В. Ф. Отдаленные результаты комбинированной нейропротекции при глаукоме / В. Ф. Шмырева, Е. Н. Мостовой // IX съезд офтальмологов России. — М., 2010. — С. 186. 16.Якубова, Л. В. Проблемы нейропротекторной стратегии при глаукоме / Л. В. Якубова, М. Н. Ефимова, Л. В. Василенкова // IX съезд офтальмологов России. — М., 2010. — С. 189. М. С. Петрачкова 1, И. В. Запускалов 2, Д. В. Петрачков 1 Первый опыт применения ферментного препарата «коллализин» при лечении идиопатических макулярных разрывов 1 2 ОГУЗ «Томская областная клиническая больница», ГОУ ВПО «СибГМУ Федерального агентства по здравоохранению и социальному развитию», кафедра офтальмологии, г. Томск Офтальмология, без сомнения, представляет собой одну из наиболее динамично развивающихся отраслей медицины. Технологический взрыв последних лет позволил добиться качественно нового, ранее недостижимого уровня знаний о закономерностях протекающих в глазу патологических процессов и открыл новые возможности в диагностике и лечении заболеваний органа зрения. В настоящее время колоссальное внимание уделяется хирургии переднего отрезка, прежде всего это фоторефракционные вмешательства, факоэмульсификация катаракты, реконструктивные операции на основе сквозной кератопластики. Тем не менее, следует признать, что назначение практически всех отделов глаза состоит в том, чтобы скон- центрировать поступающий извне свет и направить его на макулярную область сетчатки [1]. В последние десятилетия патология макулярной области сетчатки устойчиво занимает ведущие позиции в структуре слабовидения взрослого населения развитых стран. Идиопатические макулярные разрывы (ИМР), как одно из проявлений сенильной макулярной дегенерации, достаточно распространены. У лиц пожилого и старческого возраста этот показатель встречается в 3 % случаев. Многие годы макулярные разрывы оставались медицинской проблемой, заключающейся во внезапно наступившем снижении центрального зрения. Важным шагом в исследовании этой патологии стало развитие ви- 263 треоретинальной хирургии макулярных разрывов, направленной на удаление тракций и тампонаду области макулярного разрыва длительно рассасывающимся газом. В большинстве случаев было достигнуто уменьшение или закрытие разрыва, улучшение зрения пациента [3]. Значительный прогресс в изучении ИМР произошел в последние годы в связи с появлением новых диагностических приборов. В настоящее время стандартной процедурой при лечении ИМР является витрэктомия с удалением задней гиалойдной мембраны стекловидного тела, удаление внутренней пограничной мембраны сетчатой оболочки с послеоперационным газовым тампонированием витреальной полости [2]. Цель — определение эффективность применения ферментного препарата Коллализин в хирургическом лечении идиопатических макулярных разрывов. Материал и методы. Нами разработан новый хирургический метод лечения ИМР, суть которого заключается в удалении стекловидного тела на «сухом глазу» с последующим витреолизом остатков коры стекловидного тела ферментным препаратом Коллализин. По представленной методике прооперировано 6 человек. Диагноз устанавливался на основании офтальмоскопических данных и результатов оптической когерентной томографии. Операция выполнялась под местной анестезией (субтеноновое введение 2 % раствора лидокаина) при помощи витреотома (Accurus 800 CSAlcon) с использованием бесшовной троакарной системы 25G. Выполнялось 2 склеротомии с установлением портов в проекции плоской части цилиарного тела на расстоянии 4 мм от лимба. В один порт устанавливалась канюля с подачей сбалансированного раствора. Под контролем микроскопа удалялись передние отделы стекловидного тела, затем начинали подавать воздух. Под контролем налобного бинокулярного офтальмоскопа выполнялось удаление средних и задних отделов стекловидного тела. Далее, ассистентом выполнялась склерокомпрессия и удалялся базис стекловидного тела. В полость стекловидного тела вводился раствор коллализина в дозе 10КЕ — время экспозиции 1 минута. Затем понижали уровень давления и выполняли массаж краев разрыва силиконовой щеточкой. Полость глаза заполнялась сбалансированным раствором. В завершение проводился повторный обмен жидкость/воздух. В послеоперационном периоде все пациенты находились в положении «лицом вниз». Результаты и обсуждение. У прооперированных пациентов острота зрения в среднем повысилась до 0,3. Интра- и послеоперационные осложнения отсутствовали. Выводы. Разработан новый эффективный способ хирургического лечения ИМР, сочетающий витрэктомию на «сухом» глазу и последующий ферментный витреолиз. Литература 1. Алпатов, С. А. Хирургическое лечение идиопатических макулярных разрывов с использованием жидких ПФОС / С. А. Алпатов, А. Г. Щуко, В. В. Малышев // Офтальмохирургия. — 2002. — № 1. — С. 40–43. 2. Алпатов, С. А. Идиопатические макулярные разрывы / С. А. Алпатов, А. Г. Щуко, В. В. Малышев. — Новосибирск, 2002. — С. 193. 3. Каштан, О. В. Применение воздушной тампонады при хирургическом лечении идиопатических макулярных разрывов / О. В. Каштан, И. Г. Осокин, В. А. Соломин [и др.] // Современные технологии лечения витреоретинальной патологии. — М., 2010. — С. 69–70. Т. А. Свирина, Л. В. Мироненко, А. В. Колесников АНАЛИЗ ПЕРВЫХ РЕЗУЛЬТАТОВ СУБТОТАЛЬНОЙ ВИТРЭКТОМИИ ПРИ РАЗЛИЧНОЙ ОФТАЛЬМОПАТОЛОГИИ ГОУ ВПО «РязГМУ им. акад. И. П. Павлова» Минздравсоцразвития России, ГУЗ «РКБ им. Н. А. Семашко», г. Рязань Современная микрохирургия глаза позволяет выполнить оперативные вмешательства на заднем отрезке глаза с минимальной травматичностью. Цель — проанализировать первые результаты субтотальной витрэктомии при различной патологии переднего и заднего отрезка глаза. 264 Материал и методы. Под нашим наблюдением находилось 16 больных, в возрасте от 47 до 76 лет, из них мужчин было 7 женщин — 9. Тотальный гемофтальм на фоне гипертонической болезни диагностирован у 7 больных; тотальный гемофтальм на фоне пролиферативной диабетической ретинопатии — у 2; тотальный гемофтальм и незрелая катаракта — у 1; тотальный гемофтальм, незрелая катаракта на фоне оперированной ранее отслойки сетчатки — у 1; артифакия, вывих ЗКЛ в стекловидное тело — у 2 пациентов; артифакия, вывих ИКЛ в стекловидное тело — у 1; вывих хрусталика в стекловидное тело — у 2. Дооперационная острота зрения варьировала от неуверенной светопроекции до 0,2. Операции проводили с использованием операционного комплекса «Accurus» фирмы «Alcon». У 9 больных с тотальным гемофтальмом выполнена субтотальная витрэктомия 20G. Двум пациентам с тотальным гемофтальмом и незрелой катарактой — субтотальная витрэктомия с факоэмульсификацией и имплантация ЗКЛ. Трем больным с ИОЛ, расположенным на дне глазного яблока, произведена субтотальная витрэктомия, введение ПФОС, фиксация ЗКЛ проведена в иридоцилиарной борозде закрытым способом, ИКЛ фиксирована к радужной оболочке. Двум больным с вывихом собственного хрусталика в стекловидное тело проведено комбинированное вмешательство — субтотальная витрэктомия, введение ПФОС, выведение хрусталика в переднюю камеру глаза, факоэмульсификация через разрез 2,4 мм и имплантация ЗКЛ с фиксацией в иридоцилиарной борозде. Результаты и обсуждение. Цели оперативного вмешательства были достигнуты во всех случаях. Во время операций в 2 случаях произошел рецидив гемофтальма на фоне пролиферативной диабетической ретинопатии, поэтому острота зрения составила 0,02. У 7 больных с гемофтальмом на фоне гипертонической болезни острота зрения повысилась до 0,1–1,0. Острота зрения повысилась до 0,2–0,8 у троих пациентов с вывихом ЗКЛ и ИКЛ в стекловидное тело. У двух больных с вывихом собственного хрусталика в стекловидное тело острота зрения составила 0,2–0,8. У двух человек с тотальным гемофтальмом и незрелой катарактой острота зрения составила 0,2–0,3. Низкая острота зрения объясняется рецидивом гемофтальма и пролиферативными изменениями на глазном дне у больных сахарным диабетом. Наилучшие результаты достигнуты у больных с гипертоническим гемофтальмом, когда на глазном дне не диагностированы какие-либо изменения. Хорошие результаты получены у больных с вывихами ИОЛ и собственного хрусталика в стекловидное тело. Выводы. Наиболее высокая острота зрения при проведении субтотальной витрэктомии получена у больных с тотальным гемофтальмом гипертонического генеза. В остальных случаях одномоментное микрохирургическое вмешательство на переднем и заднем отрезке глаза показало свою эффективность, безопасность и также привело к повышению остроты зрения. С особой осторожностью необходимо подходить к витрэктомии при сахарном диабете. Л. Г. Сеннова, Т. И. Крикун, О. В. Рыжаева, Е. Е. Гришина, А. А. Суркова, Г. В. Цыгановкина Ретробульбарный неврит как проявление объемных процессов головного мозга ГОУ ВПО «Самарский государственный медицинский университет Минздравсоцразвития России», кафедра глазных болезней ИПО, ГУЗ «СОКБ им. М. И. Калинина», г. Самара Заболевания зрительного нерва, являясь тяжелой офтальмологической патологией, могут быть манифестацией объемных процессов головного мозга. Диагностика опухолей головного мозга основывается на анализе офтальмологических, неврологических, эндокринно-обменных симптомов, данных магнито-резонансной томографии (МРТ) головного мозга. При этом большое значение имеет правильная оценка офтальмологических данных, так как зрительные нарушения являются, как правило, первыми, а зачастую единственными проявлениями опухолей головного мозга. Чаще всего наблюдается клиника частичной атрофии зрительного нерва с постепенным снижением зрения и нарушением полей 265 зрения. Однако, нередко имеет место атипичная манифестация объемного процесса, проявляюшаяся остро, по типу ретробульбарного неврита. При проведении нами анализа 122 историй болезни пациентов (2009–2010 годы), находящихся на лечении в офтальмологическом отделении СОКБ им. Калинина М. И. по поводу ретробульбарного неврита у троих пациентов из этой группы были выявлены опухоли головного мозга. Отмечено, что зрение снижалось в течение двух недель на фоне полного здоровья. Пациенты были молодого возраста (средний возраст — 31 год). Острота зрения составила 0,1–0,2 без коррекции, нарушения полей зрения различного характера отмечались у всех больных. При осмотре невролога очаговая неврологическая симптоматика не была выявлена. Решающими в диагностике оставались данные МРТ головного мозга, проводившиеся с контрастным усилением. Поскольку диагноз объемный процесс головного мозга был впервые поставлен в офтальмологическом отделении, считаем необходимым подробно остановиться на каждом конкретном случае. Больной С., 20 лет, работающий помощником машиниста, заметил снижение зрения левого глаза две недели назад на фоне полного здоровья. С диагнозом — ретробульбарный неврит левого глаза был направлен в стационар. При поступлении острота зрения левого глаза — 0,1 не корригирует, правого глаза — 1,0. При исследовании поля зрения отмечено выпадение его височной половины слева. Картина глазного дна без патологии. При проведении МРТ головного мозга с контрастным усилением в хиазмально-селлярной области в проекции гипофиза с преимущественно супраэндо-параселлярным типом роста выявлено объемное образование неправильной формы, с четкими бугристыми контурами размерами 21,5х27х35 мм, неоднородной структуры. Выражено накапливающееся контрастное вещество, преимущественно по периферии без перифокального отека тканей, перекрест зрительных нервов оттеснен кверху, без смещения срединных структур мозга. Заключение: МР картина соответствовала опухоли хиазмальноселлярной области (больше данных за краниофарингиому). После консультации нейрохирурга больному рекомендовано оперативное лечение в нейрохирургическом отделении Больная А., 36 лет, домохозяйка поступила в глазное отделение с диагнозом ретробульбарный неврит левого глаза. Больная жаловалась на беспричинное снижение зрения в течение двух недель. При поступлении острота зрения левого глаза — 0,2 не корригирует, правого глаза — 1,0. В поле зрения левого глаза определялась абсолютная скотома, на глазном дне отмечалось умеренное полнокровие вен. МРТ головного мозга с контрастным усилением показало, что в проекции крыла основной кости слева с распространением в просвет хиазмальной цистерны визуализируется объемное образование неправильно-овальной формы, с неровными (бугристыми) четкими контурами, размерами 32,3Х40,2х27,5 мм. Образование окружено небольшой зоной перифокальных изменений тканей. Срединные структуры мозга смещены вправо на 3 мм. Воронка гипофиза и левая половина хиазмы поддавлены описанным образованием. Заключение: опухоль (менингиома) в области большого крыла основной кости и хиазмальной цистерны слева. Больная осмотрена нейрохирургом, рекомендована консультация онколога. Больной П., 38 лет, сотрудник МЧС поступил в глазное отделение также с диагнозом — ретробульбарный неврит слева и аналогичными жалобами, на снижение зрения левого глаза в течение двух недель на фоне полного здоровья. При поступлении острота зрения левого глаз — 0,1 не корригирует, правого — 1,0. Исследование поля зрения выявило битемпоральную гемианопсию. Картина глазного дна — не изменена. При МРТ головного мозга с контрастным усилением выявлено массивное, объемное образование овальной формы, размерами 29х46х36 мм, расположенное эндо-супраселлярно, сдавливая хиазму, распространяясь в область правого кавернозного синуса, деформируя правый зрительный бугор, сдавливая оральные отделы 3-его желудочка. Заключение: эндо-супраселлярная опухоль с признаками кистозной дегенерации и параселлярным ростом вправо (аденома гипофиза?). Внутренняя асимметричная окклюзионная гидроцефалия. Больной консультирован нейрохирургом, диагноз — опухоль хиазмальноселлярной области, рекомендовано оперативное лечение. Выводы. Ретробульбарный неврит может быть манифестацией объемного процесса головного мозга. Соблюдение стандартов обследования больных с патологией зрительного нерва, включая МРТ головного мозга, позволит своевременно установить диагноз и направить пациента для дальнейшего адекватного лечения. 266 Литература 1. Никифоров, А. С. Нейроофтальмология / А. С. Никифоров, М. Р. Гусева. — М., 2008. — С. 618. 2. Офтальмология. Национальное руководство. — М., 2008. — С. 940. М. В. Сизова, И. А. Ронзина, Н. С. Галоян, Н. Л. Шеремет Сравнительная оценка структурных и функциональных параметров сетчатки до и после комплексного лечения диабетического макулярного отека Учреждение РАМН «НИИ глазных болезней РАМН», г. Москва Диабетический макулярный отек (ДМО) является самой частой причиной снижения зрения при диабетической ретинопатии (ДР) [3]. ДМО редко приводит к слепоте, но такие пациенты часто утрачивают способность выполнять зрительную работу на близком расстоянии, что значительно снижает качество жизни и социальную адаптацию. По данным широкомасштабных исследований, частота развития ДМО зависит от типа сахарного диабета (СД), длительности его существования и стадии ДР [3]. Значимыми факторами возникновения и прогрессирования ДМО также являются: уровень гипергликемии, артериальная гипертензия и дислипидемия (гиперхолестеринемия, гипертриглицеридемия) [2, 4, 7]. Пациенты с ДМО, развившимся на фоне вышеперечисленных факторов риска, имеют менее благоприятный прогноз как относительно течения заболевания, так и эффективности его лечения. Для детальной характеристики нарушений морфологического и функционального состояния макулярной области сетчатки и оценки эффективности проводимого лечения при ДМО применяют современные методы исследования: флюоресцентную ангиографию глазного дна (ФАГД), оптическую когерентную томографию (ОКТ) сетчатки, статическую компьютерную периметрию (СКП), мультифокальную электроретинографию (мФ-ЭРГ), данные которых взаимно дополняют друг друга [1, 5, 6]. Цель — исследование динамики морфологических и функциональных параметров сетчатки до и после комплексного лечения ДМО. Материал и методы. В исследовании приняли участие 16 пациентов (29 глаз) с ДМО на фоне некомпенсированного СД 2го типа (гипергликемия, HbA1c>7 %), артериальной гипертензией, выраженных метаболических нарушений (гиперхоле- стеринемии, гипертриглицеридемии, гиперфибриногемии). Критериями включения в исследование являлись: наличие ДМО (по данным ФАГД), толщина сетчатки в фовеа не более 400 мкм (по данным ОКТ), отсутствие признаков пролиферативной ДР. Всем пациентам помимо стандартных методов исследования проводились ФАГД, ОКТ, СКП, мФ-ЭРГ, а также анализы биохимических параметров крови (глюкоза, HbA1c, общий холестерин, триглицериды, ЛПНП и другие). ФАГД проводили с применением сканирующего лазерного офтальмоскопа Heidelberg Retinal Angiograph 2, анализировали площадь гиперфлюоресцирующих зон и локализацию точек просачивания красителя. ОКТ проводили с помощью ретинотомографа ОСТ Stratus 3000 (Carl Zeiss) с использованием программ: macular thickness map и fast macular thickness map, оценивали среднюю толщину сетчатки в центральной зоне диаметром 1 мм, а также макулярный объем. СКП выполняли на периметре Octopus 900 (Innerzeag AG, Switzerland), статическая программа 32, анализировали показатели пороговой световой чувствительности MS, MD, sLV. Мф-ЭРГ (FOK) регистрировали на электрофизиологической системе EP-1000 Multifocal («Tomey», Germany), оценивали амплитуду и латентность компонентов N1, P1, плотность биоэлектрического потенциала сетчатки и его топографию. Помимо стандартного лазерного лечения (лазерная коагуляция сетчатки выполнялась по технике «решеткой»), в качестве метода коррекции грубых метаболических нарушений, выявленных у исследуемых пациентов, применялся непрерывный плазмаферез. Плазмаферез проводили после лазерного лечения в количестве 5-ти сеансов с промежутком между сеансами 2–3 дня на сепараторе PCS2 (Haemonetics, USA). 267 Изменения структурных параметров сетчатки (по данным ФАГД и ОКТ) и функционального состояния макулярной области (по данным визометрии, СКП и мф-ЭРГ) оценивали через 3 месяца после лечения. Результаты и обсуждение. При анализе данных офтальмоскопии и ангиографии у всех пациентов после лечения отмечали уменьшение площади липидных отложений, снижение интенсивности просачивания флюоресцеина в макулярной области. По данным ОКТ толщина сетчатки в центральной зоне диаметром 1 мм и объем макулярной зоны до лечения были увеличены у всех пациентов и составляли соответственно 332,6±126,4 мкм и 9,64±1,49 мм³. Через 3 месяца после проведения лечения определяли статистически значимое изменение этих параметров (р<0,05), а именно: уменьшение толщины сетчатки в центральной зоне до 207,9±37,9 мкм и макулярного объема — до 7,89±0,49 мм³. Исходная острота зрения с оптимальной коррекцией составляла в среднем 0,23±0,17, через 3 месяца после лечения — 0,39±0,22 (р<0,05). По данным СКП показатели световой чувствительности были исходно патологично изменены (MS — 17,7±4,5; MD — 8,13±4,4; sLv — 4,21±1,2). При контрольном исследовании через 3 месяца после лечения достоверного улучшения этих показателей не отмечалось (MS — 17,6±4,6; MD — 8,19±4,5; sLv — 4,28±1,3). При регистрации мф-ЭРГ до лечения во всех случаях отмечено резкое нарушение топографии и снижение плотности (до 20–40 % от нормы) биоэлектрического потенциала центральной зоны сетчатки (0–30º), выраженное снижение амплитуды, увеличение латентности и нарушение конфигурации волн N1 и P1 мФ-ЭРГ. Все изменения в наибольшей степени были выражены в фовеальной и перифо- веальной зоне. Через 3 месяца после проведенного лечения не выявлено статистически значимого изменения исследуемых параметров мФ-ЭРГ: лишь в 5 глазах (17,2 %) отмечено увеличение плотности ретинального биопотенциала и тенденция к восстановлению нормальной конфигурации P1 мфЭРГ в фовеальной зоне, во всех остальных случаях (82,8 %) положительная динамика отсутствовала. Таким образом, у наблюдаемых пациентов после комплексного лечения ДМО отмечена положительная динамика остроты зрения, картины глазного дна при офтальмоскопии и ангиографии, выявлено статистически значимое улучшение показателей ОКТ. В то же время при анализе световой чувствительности и биоэлектрического потенциала сетчатки положительная динамика была отмечена в единичных случаях и оказалась статистически недостоверна при суммарном анализе данных всей группы пациентов (p>0,05). Выводы: 1. Современные методы диагностики позволяют оценивать эффективность лечения ДМО на основе морфологического и функционального исследования сетчатки. 2. Достижение анатомического результата (регресс макулярного отека, уменьшение толщины сетчатки и макулярного объема) не всегда сопровождается значимым восстановлением функциональных параметров. 3. Несоответствие анатомического и функционального эффектов лечения ДМО может быть связано с глубокими патофизиологическими нарушениями в фоторецепторах и других клетках сетчатки вследствие СД, что обусловливает устойчивое снижение зрительных функций несмотря на отчетливую положительную динамику морфологических параметров сетчатки по данным ОКТ и ФАГД. Литература 1. Габель, В. П. Диагностика и терапия ДМО / В. П. Габель // IV Всероссийский семинар «Макула 2010»: тез. докл. — Ростов-н/Д., 2010. — С. 179–185. 2. Chew, E. Y. Association of elevated serum lipid levels with retinal hard exudate in diabetic retinopathy. Early Treatment Diabetic Retinopathy Study (ETDRS) Report 22 / E. Y. Chew, M. L. Klein, F. L. Ferris 3rd et al. // Arch. Ophthalmol. — 1996. — Vol. 114. — P. 1079–1084. 3. Klein, R. The Wisconsin Epidemiologic Study of Diabetic Retinopathy XXIII: the 25-year incidence of macular edema in persons with type 1 diabetes / R. Klein, M. D. Knudtson, K. E. Lee // Ophthalmology. — 2009. — Vol. 116. — P. 497–503. 4. Mattews, D. R. UK Prospective Diabetes Study Group. Risks of progression of retinopathy and vision loss related to tight blood pressure control in type 2 diabetes mellitus: UKPDS 69 / D. R. Mattews, I. M. Stratton, S. J. Aldington // Arch. Ophthalmol. — 2004. — Vol. 122. — P. 1631–1640. 5. Otani, T. Correlation between optical coherence tomography and fluorescein angiography findings in diabetic macular edema / T. Otani, S. Kishi // Ophthalmology. — 2007. — Vol. 114. — P. 104–107. 268 6. Yamamoto, S. Morphological and functional analyses of diabetic macular edema by optical coherence tomography and multifocal electroretinograms / S. Yamamoto, T. Yamamoto, S. Hayashi // Graefes Arch Clin Exp Ophthalmol. — 2001. — Vol. 239. — № 2. — P. 96–100. 7. Zander, E. Maculopathy in patients with diabetes mellitus type 1 and type 2: associations with risk factors / E. Zander, S. Herfurth, B. Bohl // Br. J. Ophthalmol. — 2000. — Vol. 84. — P. 871–876. В. С. Стебнев Опыт использования Brilliant Blue G на тяжелой (дейтериевой) воде в хирургии идиопатических макулярных отверстий ГОУ ВПО «Самарский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию», кафедра офтальмологии, г. Самара В 1869 году Herman Knapp впервые клинически описал идиопатическое макулярное отверстие (ИМО). Заболевание в 3 раза чаще встречается у женщин; двустороннее поражение диагностируется не более чем у 10 % больных. В 1991 году N. Kelly и R. Wendel предложили хирургический способ лечения ИМО. Принципиальным и наиболее сложным этапом современной хирургии ИМО является выполнение кругового пилинга внутренней пограничной мембраны (ВПМ) [4], что значительно увеличивает анатомическую результативность операции [12]. Эффективность пилинга ВПМ складывается из нескольких факторов: а) устраняется тангенциальная тракция, б) гарантировано удаляются эпиретинальные мембраны, в) более, чем на 50 % увеличивается эластичность сетчатки, г) улучшается передача сигнала к астроцитам [Charles S., 2010]. Для визуализации ретинальных структур и снижения травматичности пилинга ВПМ используют различные эндовитреальные красители: Indocyanine green [5], Trypan blue [7], Triamcinolone acetonide [8], Infracyanine green [3], Brilliant Blue G [1, 6]. Новейшей разработкой фирмы Fluoron, GmbH (Germany) стало создание нового красителя Brilliant Blue G на основе тяжелой дейтериевой воды (D2O или 2H2O), обеспечивающей равномерное распределение красителя на поверхности сетчатки, без диффузии его в стекловидное тело [2]. Цель — изучить результаты хирургии идиопатических макулярных отверстий (ИМО) с использованием Brilliant Blue G, в состав которого введена тяжелая дейтериевая вода (Д2О). Материал и методы. Изучены результаты хирургического лечения 21 пациента с ИМО, у которых при пилинге внутренней пограничной мембраны (ВПМ) использован Brilliant Blue G на основе тяжелой воды. Возраст пациентов составил от 54 до 72 лет (в среднем 64,9 лет.). Максимально корригированная острота зрения (МКОЗ) до операции составила 0,08±0,02. ИМО по классификации J. Gass (1988) были отнесены к III (11) и IV (4) стадиям заболевания. Средний диаметр ИМО на уровне нейросенсорного эпителия (минимальный диаметр) до операции составлял 484±58 µm (от 260 до 788 µm), средний диаметр на уровне пигментного эпителия (максимальный диаметр) — 1021±101 µm (от 443 до 1650 µm). Пациентов с диаметром ИМО на уровне нейросенсорного эпителия, меньше 400 µm (наиболее благоприятная группа пациентов для анатомического закрытия ИМО), было 3, пациентов с диаметром ИМО более 400 µm — 18. При любом исходном помутнении хрусталика витреоретинальному вмешательству предшествовала факоэмульсификация катаракты с имплантацией интраокулярной линзы (11, 52 %). Одному пациенту экстракция катаракты с ИОЛ проведена в раннем послеоперационном периоде всвязи с ее быстрым прогрессированием. В работе использованы микроскоп «MOLLER WEDEL Hi-R 900»; бесшовная 3D-витрэктомия 23-gauge на аппарате «ACCURUS 800 CS» (Alcon Lab. Inc) с применением широкоугольной оптической системы «EIBOS-200, MOLLER WEDEL» (Germany), стандартный раствор 0,5 мл Brilliant Blue G на тяжелой воде (Fluoron, GmbH, Germany), OCT томограф RTV-100 фирмы Optovue. 269 Результаты и обсуждение. Витреоретинальное вмешательство выполнялось с использованием трех портов по «одношаговой» технологии и стандартных стилетов фирмы «Alcon». Стекловидное тело удалялось максимально полно с ревизией периферических отделов сетчатки. Задняя гиалоидная мембрана удалялась наконечником витреотома в режиме аспирации (у 9 пациентов с использованием Triamcinolone acetonide). Этап хромовитрэктомии начинался с введения в витреальную полость (без замены жидкость/воздух) готового раствора Brilliant Blue G (0,25 мг/мл). Отличительной особенностью окрашивания ВПМ новым красителем было медленное и дозированное напластование его на макулярную область, что вызывало окрашивание ВПМ в голубой цвет избирательно лишь в центральных отделах сетчатки. При этом окрашивание ВПМ достигалось меньшими дозами красителя из-за отсутствия его распыления в витреальную полость. Круговой макулорексис проводили с использованием ILM-пинцета по традиционной технологии. После циркулярного удаления внутренней пограничной мембраны освобожденная от нее область хорошо контрастировала с окружающей окрашенной сетчаткой, указывая на эффективность проведенной процедуры. Во всех случаях проводили ревизию периферии сетчатки на предмет обнаружения дополнительных разрывов сетчатки, на возможное наличие которых указывал еще Sjaarda R et al. [13]. В наших наблюдениях периферический разрыв сетчатки диагностирован у одного пациента; вокруг разрыва была проведена отграничительная эндолазеркоагуляция. Операцию заканчивали дегидратацией области ИМО силиконовой канюлей 27-gauge и воздушной тампонадой витреальной полости. Послеоперационный период у всех пациентов протекал гладко, побочных токсических эффектов не наблюдалось. После операции пациентам рекомендовалось в течении 3 дней лежать лицом вниз по 3–5 часов в день. Положительный анатомический результат — закрытие ИМО — достигнут у 19 (90 %) пациентов однократным вмешательством и был подтвержден методом ОКТ. При этом, согласно классификации Imai et al. (1999), восстановление сетчатки по U-типу (нормальный контур фовеа) и V-типу (погружной контур фовеа) отмечен у 19 пациентов, восстановление по W-типу (остаточный дефект в проекции фовеа нейросенсорной сетчатки на фоне ее уплощения) — у 2 пациентов. У 2 пациентов, в связи с неполным закрытием разрыва, на 5 сутки выполнено повторное вмешательство — ревизия сетчатки с повторной тампонадой витреальной полости воздухом, что привело к полному закрытию разрыва, подтвержденному методом ОКТ. Повышение МКОЗ носило статистически значимый характер (р<0,05) и увеличилось с 0,08±0,02 до 0,29±0,02. ВГД составило 13,1±4,1 мм рт. ст. Наблюдение за пациентами в течение последующих 6-ти месяцев выявило стабильность полученных результатов, клиническое отсутствие какихлибо токсических проявлений от использования нового эндоокулярного красителя BBG на основе тяжелой воды Д2О. Выводы. Физико-химические свойства нового красителя позволяют проводить направленное и дозированное окрашивание ВПМ в проекции макулярной области меньшим объемом красителя без распыления его в витреальную полость, снижая тем самым токсическую нагрузку на структуры заднего отдела глаза. Использование нового эндоокулярного красителя Brilliant Blue G на основе тяжелой (дейтериевой) воды оптимизирует хирургию идиопатических макулярных отверстий, способствует ее анатомической и функциональной эффективности. Литература 1. Стебнев, С. Д. Хромовитрэктомия / С. Д. Стебнев, В. С. Стебнев // IX Съезд офтальмологов России: тез. докл. — М., 2010. — С. 243. 2. Стебнев, В. С. Особенности и результаты хирургии идиопатических макулярных отверстий с использованием «Brilliant Blue G» на тяжелой воде Д2О / В. С. Стебнев, С. Д. Стебнев // Современные технологии лечения витреоретинальной патологии. — 2011. — М., 2011. — С. 160–162. 3.Van De Moere, Ann. Anatomical and visual outcome of macular hole surgery with infracyanine green-assisted ILM peeling, endodrainage and silicone oil tamponade / Ann Van De Moere // Am. J. Ophthalmol. — 2003. — Vol. 136. — P. 879–887. 4. Brooks L. ILM peeling in full thickness macular hole surgery / L. Brooks // Vitreoretinal Surgery and Technology. — 1995. — Vol. 7. — P. 211–212. 5. Burk, S. Indocyanine green-assisted peeling of the retinal internal limiting membrane / S. Burk, A. Da Mata, M. Snyder, R. Rosa // Ophthalmology. — 2000. — Vol. 107. — P. 2010–2014. 270 6. Enaida, H. Brilliant blue G selectively stains the internal limiting membrane. Brilliant blue G-assisted membrane peeling / H. Enaida, T. Hisatomi, Y. Hata // Retina. — 2006. — Vol. 26. — P. 631–636. 7. Feron, E. Trypan blue staining of epiretinal membranes in proliferative vitreoretinopathy / E. Feron, M. Veckeneer, R. Van Ginderdeuren, A. Van Lommel // Arch. Ophthalmol. — 2002. — Vol. 120. — P. 141–144. 8. Fraser, E. Triamcinolone acetonide — assisted peeling of retinal internal limiting membrane for macular surgery / E. Fraser, R. Cheema, M. Roberts // Retina. — 2003. — Vol. 23. — № 6. — P. 883–884. 9. Imai, M. Optical coherence tomography of successfully repaired idiopathic macular holes / M. Imai, H. Iijima, T. Gotoh // Am. J. Ophthalmol. — 1999. — Vol. 128. — P. 621–627. 10.Kelly, N. Vitreous surgery for idiopathic macular holes: results of a pilot study / N. Kelly, R. Wendel // Arch. Ophthalmol. — 1991. — Vol. 109 — P. 654–659. 11.Knapp H. Ueber isolirte zerreissungen der aderhaut in folge von traument auf dem augapfel / H. Knapp // Arch. Augenheilkd. — 1869. — Bd. 1 — S. 6–29. 12.Smiddy, W. Internal limiting membrane peeling in macular hole surgery / W. Smiddy, W. Feuer, G. Cordahi // Ophthalmology. — 2001. — Vol. 108. — P. 1471–1476. 13.Gass, J. Idiopathic senile macular hole. Its early stages and pathogenesis / J. Gass // Arch. Ophthalmol. — 1988. — Vol. 106. — P. 629–639. 14.Sjaarda, R. Distribution of iatrogenic retinal breaks in macular hole surgery / R. Sjaarda, B. Glaser, J. Thompson // Ophthalmology. — 1995. — Vol. 102. — P. 1387–1392. В. С. Стебнев Хромовитрэктомия и интравитреальный краситель «Brilliant Blue G» (краткий обзор литературы) ГОУ ВПО «Самарский государственный медицинский университет Федерального агентства по здравоохранению и социальному развитию», кафедра офтальмологии, г. Самара Термин «хромовитрэктомия» был впервые использован в 2002 году Peter Kroll в работе «The magic colors in chromovitrectomy», в которой он предложил называть этим термином витрэктомию с использованием любого эндовитреального красителя (vital dyes). Первый камень в фундамент формирования будущей хромовитрэктомии был заложен в 1932 году работой Lobeck E. et al., которые впервые в эксперименте ввели краситель «India Ink» в витреальную полость для визуализации преретинальных структур. Спустя более трех десятилетий были продолжены экспериментальные работы по изучению интравитреального использования красителей. В 1964 году Niedermeier S., используя краситель «Evans blue» на животных с экспериментальной отслойкой сетчатки, описал движение красителя из стекловидного тела в субретинальное пространство через ретинальный разрыв. В 1969 году исследователь Kutschera E. обратил внимание на то, что ряд красителей, введенных интравитреально, может быть токсичен для структур сетчатки. Он изучил и предложил целую серию безопасных интравитреальных красителей (Benzopurpurine 4B, Trypan red, Chicago blue) для визуализации не только ретинальных разрывов, но и других структур глазного дна. Серия этих замечательных работ сыграла огромную роль во внедрении эндовитреальных красителей в клиническую практику. В 1978 году три выдающихся витреоретинальных хирурга — Abrams G., Topping T., Machemer R. — впервые использовали в клинической практике интравитреальный краситель «Ffluorescein» для идентификации стекловидного тела во время витрэктомии. Но после этого идея интравитреального использования красителей была забыта на несколько десятилетий. 2000 год ознаменовался новыми исследовательскими и практическими работами по применению эндовитреальных красителей в витреоретинальной хирургии. Burk S. et al. (2000) предложили введение Indocyanin Green (ICG) в витреальную полость для контрастирования внутренней пограничной мембраны (ВПМ) во время витрэктомии, что особенно широко стало использоваться в хирургии идиопатических макулярных разрывов. В 2000 году Peyman G. et al. предложили использовать интравитреальное введение Triamcinolone 271 acetonide (его современный аналог — Triesence, фирмы «Alcon») для визуализации стекловидного тела и задней гиалоидной мембраны в процессе витрэктомии. Несколько позже этот препарат стали использовать и для визуализации внутренней пограничной мембраны при хирургии идиопатических макулярных разрывов [Burk S. et al., 2003; Fraser E. et al., 2003; Tognetto D. et al., 2005]. В 2002 году Feron E. et al. предложили использовать в витреальной хирургии краситель Trypan Blue, ранее с успехом применяемый в катарактальной хирургии [Melles G. et al., 1999]. Более эффективно этот краситель контрастирует эпиретинальне мембраны и стекловидное тело и в меньшей степени — ВПМ [Стебнев С. Д. с соавт., 2010; Wong K. et al., 2003]. Перечисленные выше красители, как и Trypan Blue, изначально были созданы для хирургии переднего отрезка глаза, и выбор их для применения в витреоретинальной хирургии был эмпирическим. Немного было известно о том, какие молекулярные компоненты витреоретинального интерфейса связываются со многими из красок. Доказанная позже ретинальная токсичность некоторых красителей и практическая потребность в новых нетоксичных и эффективных красителях структур заднего отрезка глаза закономерно привели к целенаправленному поиску и созданию других препаратов: Patent Blue V, Evans Blue, Chicago Blue, Bromophenol Blue, Infracyanine Green, Crystal Violet, Sodium Fluorescein, Fluorometholone Acetate, Indigo Carmine, Light Green, Brilliant Blue G. «Brilliant Blue G» (BBG) относится к последнему поколению интравитреальных красителей, используемых в хромовитрэктомии. Он обеспечивает достаточно высокую степень окрашивания внутренней пограничной мембраны при его минимальной концентрации, объеме и экспозиции [Стебнев С. Д. с соавт., 2009–2011; Enaida H. et al., 2006; Akifumi U., et al., 2007; Meyer C. et al., 2007; Mennel S. et al., 2008; Mieler W., 2009; Costa E. et al., 2009; Rodrigues E. et al., 2005–2009; Farah M. et al., 2009; Haritoglou C., 2009; Henrich P. et al., 2009]. BBG для контрастирования внутренней пограничной мембраны начал использоваться в витреоретинальной хирургии с 2006 года [Enaida H. et al., 2006]. Brilliant Blue G (Brilliant Peel, FLUORON) — синий краситель, который, связываясь с большинством белков, вызывает их прокрашивание. Он имеет химическую формулу C47H48N3O7S2Na и молекулярную массу 854. По своему химическому составу относится к группе Triarylmethane. За счет своей осмолярности (300–310 mOsm), близкой к ирригационным растворам, Brilliant Blue G вызывает минимальное повреждение клеток внутриглазных структур [Hisatomi T. et al., 2006; Costa E. et al., 2009]. Новейшей разработкой фирмы Fluoron, GmbH (Germany) стало создание нового варианта красителя Brilliant Blue G на основе тяжелой воды (Д2О), обеспечивающей равномерное распределение красителя на поверхности сетчатки, без диффузии его в стекловидное тело [Стебнев В. С. с соавт., 2011; Kaymak H., 2010]. Тяжелая, или дейтериевая вода (D2O или 2H2O), была впервые обнаружена в природной воде Гарольдом Юри в 1932 году, а в 1933 году Гильберт Льюис получил чистую тяжелую воду путём электролиза обычной воды. По своим свойствам тяжелая вода заметно отличается от обычной воды: молекулярная масса — 20 (Н2О — 18), плотность 1,104 г/см (Н2О — 0,997 г/см), температура замерзания — 3,8 °С, температура кипения — 101,4 °С. Экспериментальные исследования по изучению возможного токсического влияния интравитреальных инъекций BBG на морфологию и функции сетчатки показали отсутствие токсичности в отношении клеточных структур сетчатки и отсутствие отклонений на электроретинограмме в дозировках 0,01 и 0,1 мг/мл [Lüke M. et al., 2008; Farah M., et al., 2009; Creuzot-Garcher C. et al., 2010]. При более высоких концентрациях (1,0 и 10,0 мг/мл) была зафиксирована вакуолизация в клетках ганглия и Мюллера [Hiebl W. et al., 2005; Enaida H. et al., 2006; Mennel S. et al., 2008; Yuen D. et al., 2009; Schumann R. et al., 2009]. Экспериментальные исследования Remy M. et al. (2008), Rodrigues E. et al. (2009) на глазах кроликов с использованием флюоресцентной ангиографии и гистологии с электронной микроскопией показали безопасность интравитреальных инъекций малых доз (0,05 мл 0,5 % и 0,05 %) Brilliant Blue G. Субретинальные экспериментальные инъекции Brilliant Blue G в дозе 0,25 мг/мл также не оказывали токсического влияния на структуры сетчатки [Ueno A. et al., 2007; Akifumi U., et al., 2007]. Спектрофотометрические исследования in vitro интравитреальных красителей, в том числе и BBG, показали зависимость степени их токсичности от характера и уровня используемого источника эндоиллюминации [Costa E. et al., 2009]. Интересная особенность была отмечена в экспериментальных работах Zhang X. et al. (2005) 272 и Kawahara S. et al. (2007): помимо красящего эффекта Brilliant Blue G, была выявлена его способность ингибировать клеточную пролиферацию. Электронная микроскопия не выявила грубой патологии ни на витреальной, ни на сетчаточной стороне ВПМ после окрашивания ее Brilliant Blue G при последующем пилинге (Schumann R. et al., 2008). В клинической практике BBG используется при пилинге ВПМ у пациентов с диабетическим макулярным отекем, цистоидным макулярным отеком, идиопатическими макулярными разрывами, регматогенной отслойкой сетчатки, сопровождающейся макулярными разрывами, и другой макулярной патологией [Enaida H. et al., 2008; Remy M. et al., 2008; Mochizuki Y. et al., 2008; Farah M. et al., 2009; Henrich P. et al., 2009]. Наблюдения Enaida H. et al. (2006, 2008) за пациентами, у которых был использован краситель Brilliant Blue G, показали его высокую интраоперационную контрастирующую эффективность и гладкий послеоперационный период. Mochizuki Y. et al. (2008) использовал Brilliant Blue G для окрашивания ВПМ у пациентов с отслойкой сетчатки, связанной с макулярным разрывом. Авторами отмечено отсутствие токсического влияния на сетчатку BBG при его попадании в су- бретинальное пространство, в отличие от используемых ранее Indocyanin Green и Typan Blau. Клинические исследования Henrich P. et al. (2009) подтвердили достаточную визуализацию ВПМ при ее пилинге с использованием BBG, а примененный метод ОКТ показал сокращение ретинального профиля у всех оперированных пациентов. Препарат Brilliant Blue G удобно расфасован и готов к применению, не требует дополнительного обмена жидкость/воздух. Благодаря своей избирательной способности прокрашивать внутреннюю пограничную мембрану и отсутствию токсичности, является, по мнению многих авторов, реальной альтернативой Indocyanine Green. Выводы. Хромовитрэктомия — новый, перспективно развивающейся раздел витреоретинальной хирургии, предусматривающий использование во время операции эндовитреальных красителей для лучшей визуализации преретинальных и ретинальных структур и стекловидного тела. Brilliant blue G — новый безопасный интравитреальный краситель для хромовитрэктомии, обладает выраженными контрастирующими свойствами, значительно оптимизирует процесс выполнения макулорексиса при различной витреоретинальной патологии. О. А. Степушина РАННЯЯ ДИАГНОСТИКА И МОНИТОРИНГ ДИАБЕТИЧЕСКОЙ АНГИОРЕТИНОПАТИИ И ГИПЕРТОНИЧЕСКОЙ АНГИОПАТИИ С ИСПОЛЬЗОВАНИЕМ МЕТОДА КАЛИБРОМЕТРИИ СОСУДОВ СЕТЧАТКИ В СОЧЕТАНИИ С АДАПТИВНОЙ ОПТИКОЙ И ФЛЮОРЕСЦЕНТНОЙ АНГИОГРАФИЕЙ У ПАЦИЕНТОВ С АНОМАЛИЯМИ РЕФРАКЦИИ ГУЗ «НОКБ им. Н. А. Семашко», г. Нижний Новгород В настоящее время наиболее распространенными сосудистыми заболеваниями глазного дна являются диабетическая ретинопатия и гипертоническая ангиопатия. Около 30–90 % [3, 6, 11, 12] больных сахарным диабетом страдают диабетической ретинопатией различной степени выраженности и у 63 % больных гипертонической болезнью имеются признаки гипертонической ангиопатии [4]. Современные методы диагностики сосудистой патологии глазного дна, такие как биомикроофтальмоскопия, фоторегистрация картины глазного дна при помощи фундус-камеры, флюоресцентная ангиография глазного дна с флюоресцеином, имеют такой недостаток, как невозможность получения изображения с высоким пространственным разрешением, что связано с аберрациями оптической системы глаза [5, 8, 13]. Адаптивная мультиспектральная фундус-камера (АМФК) — прибор, позволяющий регистрировать аберрации глаза, корригировать эти аберрации и получать снимки глазного дна с высоким простран- 273 ственным разрешением [5]. Для точной оценки состояния сосудистого русла используется метод калиброметрии сосудов сетчатки, позволяющий производить измерение внутреннего диаметра последних [1, 2]. Изучение функционального состояния ретинальных сосудов имеет большое значение, как для ранней и дифференциальной диагностики сосудистых расстройств сетчатки, так и для выявления некоторых сторон их патогенеза [1,6]. Цель исследования: изучение возможности комбинированного использования калиброметрии в сочетании с АМФК и ФАГ с флюоресцеином в ранней диагностике диабетической ретинопатии и гипертонической ангиопатии у пациентов с аномалиями рефракции. Материал и методы. Под наблюдением находилось 15 пациентов (всего 25 глаз) в возрасте от 42 до 65 лет. Стаж пациентов страдающих, сахарным диабетом, составлял от 5 до 20 лет, а стаж пациентов с гипертонической болезнью — от 3 до 15 лет. Исследование включало визометрию, авторефрактометрию, биомикроскопию тканей глазного дна, фоторегистрацию тканей глазного дна с использованием АМФК, фоторегистрацию тканей глазного дна с помощью фундус-камеры фирмы Topcon (Япония) TRS-NW200, ФАГ с флюоресцеином, калиброметрию сосудов глазного дна, проводимую с использованием собственного алгоритма калиброметрии, а также компьютерной программы Image J (США). Диаметр сосудов измеряли по методике А. А. Трясковой [9]. Исследовали разветвления центральной артерии и центральной вены сетчатки после второй бифуркации, т. к. микрососуды этой градации наиболее подвержены патологическим изменениям [10]. Соотношение притока и оттока крови в системе микрососудов оценивали по величине артериоловенулярного коэффициента (АВК), равного отношению площади поперечного сечения артериолы к площади поперечного сечения венулы [7]. В норме отношение диаметра артериол к диаметру венул этой градации составляет 1:1,2, т. е. норматив АВК составляет 0,83 [7, 9]. Статистическую обработку полученных данных проводили с использованием программного продукта Microsoft Excel и пакета прикладных программ STATISTICA 6.0. Результаты и обсуждение. В зависимости от вида патологии больные были разделены на 3 группы: 1-я — 5 глаз с начальными проявлениями гипертонической ангиопатии (ГА), 2-я — 12 глаз с начальными проявлениями диабетической ангиоретинопатии (ДР) и 3-я — 8 глаз пациентов, у которых на глазном дне диагностировали начальные признаки как ДР, так и ГА. В каждой группе все пациенты были разделены на 2 подгруппы: а) пациенты с эмметропической рефракцией и б) пациенты с аметропией (миопией, гиперметропией) и астигматизмом. Результаты калиброметрии сосудов сетчатки с использованием АМФК и фундус-камер фирмы Topcon TRS-NW200, а также ФАГ с флюоресцеином представлены в таблице. Как следует из таблицы, АВК у пациентов всех трех групп оказался ниже нормы, что свидетельствовало о наличии ангиопатии у всех обследованных пациентов. Изменение калибра сосудов диагностировали уже при начальных стадиях ДР и ГА. При этом сочетание ГА и ДР явилось взаимоотягощающим фактором. Сравнительный анализ результатов калиброметрии, выполненной при помощи АМФК и фундус-камеры TRС-NW200 показал, что использование адаптивной оптики позволяет выявить более выраженную степень ангиопатии, по сравнению с данными, полученными с помощью стандартной серийной фундус-камеры. Так, величина АВК, рассчитанного по снимкам глазного дна, выполненным Результаты калиброметрии сосудов сетчатки Группы Вид патологии 1 ГА 2 ДР 3 ГА + ДР АВК, рассчитанный по АВК, рассчитанный по АВК, рассчитанный снимкам глазного дна, снимкам глазного дна, Вид по снимкам глазного выполненным выполненным рефрации дна, выполненным при помощи фундуспри помощи ФАГ при помощи АМФК камеры TRС-NW200 с флюоресцеином а) Em 0,68 0,75 0,68 б) Am+Ast 0,67 0,79 0,7 0,67 0,76 0,68 а) Em б) Am+Ast 0,66 0,77 0,69 а) Em 0,63 0,73 0,63 б) Am+Ast 0,61 0,69 0,63 p<0,05 274 при помощи АМФК, оказалась ниже величины АВК, рассчитанного с использованием фундус-камеры TRС-NW200 во всех группах обследованных пациентов. Данные калиброметрии, полученные с использованием АМФК, приближены к результатам калиброметрии в сочетании с ФАГ у пациентов с эмметропической рефракцией. Однако, у пациентов с аметропией и астигматизмом величина АВК, рассчитанного по снимкам глазного дна, выполненным при помощи АМФК, оказалась значительно ниже величины АВК, рассчитанного с использованием ФАГ во всех группах обследованных пациентов, что свидетельствовало о более высокой чувствительности адаптивной оптики в визуализации начальных признаков гипертонической и диабетической ангиопатии. Выводы. Сочетанное использование калиброметрии и фоторегистрации картины глазного дна при помощи АМФК является информативным методом ранней диагностики и мониторинга начальных проявлений диабетической ангиоретинопатии и гипертонической ангиопатии. Преимуществом метода является неинвазивность и возможность многократных повторных исследований. Литература 1. Агаева, Т. С. Исследование состояния региональной гемодинамики глаза при диабетической ретинопатии: дис. ... канд. мед. наук / Т. С. Агаева. — М., 1989. 2. Астафьева, Н. В. Метод калиброметрии в оценке гемодинамики ретинальных сосудов / Н. В. Астафьева, Э. Г. Елисеева, В. Ф. Шмырева // Вестн. офтальмол. — 1992. — № 4–6. — С. 38–40. 3. Балаболкин, М. И. Патогенез и механизмы развития ангиопатий при сахарном диабете / М. И. Балаболкин, Е. М. Клебанова, В. М. Креминская // Кардиология. — 2000. — T. 40. — № 10. — С. 74–87. 4. Кански, Д. Клин. офтальмол: системный подход / Д. Кански. — М.: Логосфера, 2006. 5. Каталевская, Е. А. Офтальмоскопия — от офтальмоскопа Гельмгольца до адаптивной оптики / Е. А. Каталевская, С. Э. Аветисов, А. В. Большунов // Вестн. офтальмол. — 2007. — № 3. — С. 52–55. 6. Кацнельсон, Л. А. Сосудистые заболевания глаза Л. А. Кацнельсон, Т. И. Форофонова, А. Я. Бунин. — М.: Медицина, 1990. — 272 с. 7. Перепеч, Н. А. Применение калиброметрии сосудов сетчатки для диагностики пограничной артериальной гипертензии и ранних стадий гипертонической болезни / Н. А. Перепеч // Кардиология. — 1990. — Т. 30. — № 1. — С. 78–79. 8. Симонова, К. К. Флюоресцентная ангиоскопия и ангиография глазного дна: автореф. дис. ... канд. мед. наук / К. К. Симонова. — М., 1973. 9. Трясков, А. А. Фотометрические и фотокалиброметрические исследования глазного дна / А. А. Трясков // Вестн. офтальмол. — 1966. — № 2. — С. 60–63. 10.Трясков, А. А. Фотографическая калиброметрия как объективный метод оценки состояния сосудов сетчатки при динамическом нарушении мозгового кровообращения и гипертонических кризах / А. А. Трясков // Невропатология и психиатрия. — 1968. — Т. 68. — № 9. — С. 1280–1283. 11.Early Treatment Diabetic Retinopathy Study Research Group, report number 13 // Ophthalmology. — 1991. — Vol. 98. — № 5. — P. 834–840. 12.Kristinsson J. K. Diabetic Retinopathy. Screening and prevention of blindness / J. K. Kristinsson // Acta Ophthalmol. Scand. Suppl. — 1997. — Vol. 223. — P. 1–74. 13.Sato, K. Quantitative evaluation on fluorescein leakage in fluorescein fundus angiography / K. Sato, T. Ikeda, Y. Hayashi [et al.] // Invest. Ophthalmol. Vis. Sci. — 1994. — Vol. 35. — № 4. — P. 1502. М. А. Фролов, Э. М. Альдиева Эффективность применения комплексного лечения возрастной макулярной дегенерации Российский университет дружбы народов, кафедра глазных болезней, ГКБ № 12, г. Москва Возрастная макулярная дегенерация (ВМД) — активной зоны сетчатки. ВМД — одно из самых хроническое прогрессирующее заболевание, ха- распространенных заболеваний глаз, угрожающих рактеризующееся поражением центральной фото- значительным снижением зрения и инвалидностью 275 у людей старше 60 лет. В настоящее время обозначены несколько основополагающих теорий патогенеза сенильной макулярной дегенерации: первичное старение ретинального пигментного эпителия и мембраны Бруха, окислительный стресс, заключающийся в повреждении тканей глаза вследствие дисбаланса в системе образования свободных радикалов и антиоксидантной защиты, повреждение продуктами ПОЛ, первичные генетические дефекты, патологические изменения кровоснабжения глазного яблока. ВМД — мультифакторное заболевание и подход к его лечению должен быть комплексным. В современной офтальмологии биорегулирующая терапия является перспективным направлением патогенетического воздействия. В этом отношении особый интерес представляет препарат пептидной структуры «ретиналамин». Однако медикаментозная терапия не всегда может обеспечить компенсацию нарушенного метаболизма, и результаты ее нестабильны, поэтому особую актуальность приобретает физиотерапевтическое лечение. Гипербарическая оксигенация (ГБО) является одним из наиболее эффективных и перспективных немедикаментозных методов лечения ВМД. Цель — анализ клинико-функциональных результатов комплексного лечения включающего пептидный биорегулятор «ретиналамин» и ГБО в сравнении с традиционной лекарственной терапией, включающей антиоксидант «эмоксипин». Материал и методы. В рамках инновационной образовательной программы по приоритетному национальному проекту « Образование» на кафедре глазных болезней РУДН на базе ГКБ № 12 было проведено исследование, включающее 33 пациента (63 глаза) в возрасте от 61 до 82 лет с сухой атеросклеротической формой ВМД. Среди этих пациентов 9 человек (17 глаз) получали комплексное лечение (курс ретиналамина п/б по 0,5 мл №10 и сеансы ГБО в одноместной барокамере в режиме 1,2–1,3 ата со временем изопрессии 30–45 мин.), 24 человека (46 глаз) получали курсы эмоксипина п/б по 0,5 мл №10. Пациентов осматривали через 1, 3, 6 месяцев после проведенного лечения. Клинико-функциональные исследования включали стандартное офтальмологическое обследование с регистрацией глазного дна на цифровой фундус камере. Результаты и обсуждение. Среди пациентов, получавших комплексное лечение в сочетании с баротерапией, острота зрения улучшилась в среднем на 0,1–0,2 в 70 % случаев. Уменьшение количества центральных относительных скотом было отмечено в 60 % случаев. КЧСМ увеличилась в среднем на 2,0 Гц от исходного в 76 % случаев. В группе пациентов, получавших традиционное лечение, острота зрения улучшилась в среднем на 0,05–0,15 в 50 % случаев. Уменьшение количества центральных относительных скотом было отмечено в 35 % случаев. КЧСМ увеличилась у 55 % больных в среднем на 1,0–2,0 Гц от исходного. В обеих группах отмечалось улучшение картины глазного дна. Выводы. Комплексное лечение ВМД, включающее пептидный биорегулятор «ретиналамин» в сочетании с гипербарической оксигенацией, позволяет достичь наиболее эффективных результатов по сравнению с традиционной терапией. Проведенные исследования указывают на эффективность данного лечения и целесообразность дальнейшего исследования. Литература 1. Алпатов, С. А. Возрастная макулярная дегенерация: руководство / С. А. Алпатов, А. Г. Щуко, Е. М. Урнева, В. В. Малышев. — М., 2010. 2. Либман, Е. С. Слепота, слабовидение и инвалидность по зрению в Российской Федерации / Е. С. Либман, Е. В. Шахова // Ликвидация устранимой слепоты. Всемирная инициатива ВОЗ: сб. науч. тр. — Уфа, 2003. — С. 38–42. 3. Максимов, И. Б. Инволюционные центральные хориоретинальные дистрофии: применение пептидных биореогуляторов в комплексном лечении / И. Б. Максимов, Г. В. Анисимова. — СПб., 2002. — 88 с. 4. Пурескин, Н. П. Эффективность гипербарической оксигенации в комплексном лечении больных атеросклеротической дистрофией сетчатки / Н. П. Пурескин, Ф. М. Ермоленко, А. А. Донских, М. Г. Истомин // Воен.-мед. журн. — 1989. —№ 10. — С. 29–31. 5. Рябцева, А. А. Применение метода гипербарической оксигенации в офтальмологии / А. А. Рябцева, А. И. Кодырева. — М.: Медицина, 2005. — 30 с. 6. Шпак, Н. И. Тауфон и эмоксипин в комплексном лечении склеротических макулодистрофии / Н. И. Шпак, Н. Л. Нарицына, Н. В. Коновалова // Офтальмол. журн. — 1989. — № 8. — С. 463–465. 7. Шустеров, Ю. А. Применение гипербарической оксигенации в комплексном лечении офтальмологических больных / Ю. А. Шустеров, Е. В. Елисеева, Д. Г. Магзумова [и др.] // Российский общенациональный офтальмологический форум: сб. науч. тр. — М., 2009. — С. 458–462. 8. Ястребов, А. П. Гипербарическая оксигенация в комлексном лечении атеросклероза / А. П. Ястребов // Бюл. гипербарической биологии и медицины. — 1999. — № 1–4. — С. 95–117. 276 Т. А. Чехова, В. И. Братко КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ ОСТРОЙ ФОРМЫ ЦЕНТРАЛЬНОЙ СЕРОЗНОЙ ХОРИОРЕТИНОПАТИИ Новосибирский филиал ФГУ «МНТК „Микрохирургия глаза“ им. акад. С. Н. Федорова Росмедтехнологии», г. Новосибирск Центральная серозная хориоретинопатия (ЦСХРП) — заболевание, при котором происходит локальная серозная отслойка нейросенсорного слоя сетчатки, как правило, ограниченная областью заднего полюса глаза. Заболевание развивается у лиц молодого возраста (20–50 лет), чаще у мужчин, чем у женщин. Известно, что основными предрасполагающими факторами могут служить: эмоциональный стресс, прием стероидных гормонов, простудные или вирусные заболевания, беременность. ЦСХРП может протекать как идиопатическое состояние. С момента первого описания ЦСХРП прошло около 150 лет, однако некоторые вопросы, касающиеся этиологии, патогенеза, прогноза различных форм ЦСХРП остаются неясными до сих пор. Открытым остается и вопрос лечения ЦСХРП. Цель работы: анализ результатов комбинированного лечения острой формы центральной серозной хориоретинопатии (ЦСХРП). Материал и методы. Группа наблюдения составила 27 пациентов (27 глаз): мужчин — 22, женщин — 5. Группа контроля включала 15 пациентов (15 глаз): мужчин — 13, женщин — 2. Возраст от 23 до 55 лет. Во всех случаях имел место односторонний характер поражения, первая атака заболевания. Срок наблюдения 12 месяцев. Всем пациентам было проведено стандартное офтальмологическое обследование, включающее визометрию, рефрактометрию, биометрию, периметрию, тонометрию, биомикроофтальмоскопию, ЭФИ, ОКТ. Все наблюдаемые пациенты предъявляли жалобы на ощущение пятна перед глазом, дискомфорт во время выполнения зрительной работы на близком расстоянии, искажение контуров предметов, снижение остроты зрения в разной степени. Объективно имело место: снижение остроты зрения от 0,7 до 0,9 с коррекцией, сдвиг рефракции в гиперметропическую сторону, наличие отека в макулярной области, не всегда четко определяемое офтальмоскопически, отслойка нейро- и пигментного эпителия, во всех случаях подтвержденная данными ОКТ. Пациентам основной группы было назначено комбинированное лечение, включающее в себя лимфотропную терапию, озонотерапию, а так же физиолечение — магнитофорез с индоколиром. Одним из важных условий использования метода лимфотропной терапии является принцип регионального, направленного введения лекарственных веществ в точки, обеспечивающие поступление их в соответствующие лимфоциркулирующие бассейны. Лимфотропная терапия выполняется посредством крылонебных блокад, в результате которых лекарственная смесь попадает в крылонебную ямку, создавая депо лекарственных препаратов. Курс блокад — 7 процедур ежедневно с использованием лекарственной смеси, содержащей лидокаин 10 % — 100 мг, ретиналамин — 5 мг, даларгин — 0,001 мг, милдронат — 100 мг, лидаза — 16 ЕД. Лечебный эффект реализуется за счет рецептуры блокады и топографии ее выполнения. Пациенты контрольной группы в качестве базовой терапии получали эмоксипин в инъекциях, физиолечение с НПВС, диуретические средства, антиоксиданты, антигистаминные препараты в течение 10 дней. По окончании базового курса пациенты основной группы получали окувайт-лютеин по 1 таблетке 2 раза в день в течение 3 месяцев. Результаты и обсуждение. У пациентов основной группы через полтора месяца от начала лечения имело место восстановление остроты зрения до исходных цифр и полное прилегание отслойки пигментного эпителия сетчатки (ПЭС) в 79 % случаев, тогда как у пациентов контрольной группы через аналогичный промежуток времени восстановление остроты и полное прилегание отслойки ПЭС наблюдалось лишь в 60 %. Также в основной группе в течение 12-ти месяцев рецидив ЦСХРП имел место лишь в 3,7 % случаев, тогда как в контрольной группе — в 6,6 % случаев. Уменьшение количества рецидивирующих, хронических форм является очень важным, так как данные формы сопровождаются диффузным повреждением пигментного эпителия, которое приводит к необратимому снижению зрительных функций 277 и увеличению риска хориоидальной неоваскуляризации. Очень важной в результатах лечения ЦСХРП является субъективная оценка пациентами своего состояния. В основной группе имело место более быстрое исчезновение жалоб на «пятно» перед глазом, дискомфорт при выполнении зрительной работы, искажение предметов. В контрольной группе вышеназванные жалобы сохранялись дольше, в некоторых случаях полного их исчезновения не было, имело место лишь улучшение. Различия в результатах лечения связано с основными эффектами лимфотерапии: усиление лимфоциркуляции и лимфодренажа региона; улучшение микроциркуляции, регионарного кровотока; ретинопротекция; элиминация продуктов метоболизма; снижение аутотоксикоза; высокая концентрация препарата в пораженной зоне. Озонотерапия оказывает мощное бактерицидное, антиоксидантное воздействие. Окувайт-лютеин рекомендуется в качестве поддерживающей терапии после базового курса лечения благодаря своему комплексному, прицельному воздействию именно на макулярную область сетчатки и влиянию на патологические процессы, возникающие при ЦСХРП. Выводы. Метод лечения, предусматривающий комплексное воздействие на орган зрения с помощью лимфотропной терапии в сочетании с озонотерапией, фармакотерапией, физиолечением, позволяет восстановить функцию сетчатки в макулярной зоне, исходные зрительные функции, воздействуя на патогенетический механизм данного заболевания. Комбинированный метод лечения способствует более быстрой реабилитации пациентов молодого, трудоспособного возраста и уменьшению перехода острых форм заболевания в хронические, рецидивирующие. Т. В. Шелковникова, Д. А. Савин БАРЬЕРНАЯ ЛАЗЕРКОАГУЛЯЦИЯ В ПРОФИЛАКТИКЕ ОСЛОЖНЕНИЙ РЕТИНОШИЗИСА ГУЗ «Кемеровская областная клиническая офтальмологическая больница», ГОУ ВПО «Кемеровская государственная медицинская академия», г. Кемерово В последние годы офтальмологи уделяют большое внимание диагностике и лечению ретиношизиса (РШ) [Астахов Ю. С., Луковская Н. Г., 2008]. Распространенность РШ в популяции, по разным данным, составляет 0,4 — 4,6 % [Шамшинова А. М. и соавт., 2001]. У пациентов с периферическим РШ существует риск возникновения значительной потери зрения вследствие кровоизлияния или отслойки сетчатки. Для профилактики возможных осложнений, с целью остановки прогрессирующего расслоения сетчатки, предлагается создание локального барьера по краю РШ с помощью лазера [Иванишко Ю. А. и соавт., 2003]. Цель — изучить эффективность барьерной лазеркоагуляции в профилактике осложнений периферического РШ у пациентов ГУЗ КОКОБ. Материал и методы. В отделении лазерной хирургии ГУЗ КОКОБ в течение последних трех лет наблюдалось 36 пациентов (72 глаза) с диагнозом РШ. Возраст колебался от 10 до 68 лет. Мужчин — 13, женщин — 23. Проводимое офтальмологическое обследование включало визометрию, офтальмоме- трию, эхографию, биомикроскопию, прямую и обратную офтальмоскопию, осмотр глазного дна с зеркальной линзой Гольдмана в условиях максимального медикаментозного мидриаза. В своей работе мы руководствовались классификацией и показаниями к лазерному лечению РШ, разработанными Астаховым Ю. С., Луковской Н. Г. (2008). Профилактическая барьерная лазеркоагуляция (БЛК) была выполнена, на всех глазах с РШ и проводилась с помощью Nd: YAG-лазера с удвоением частоты, λ=532 нм, фирмы «NIDEK» (Япония), по стандартной методике вдоль внешних границ РШ. Диаметр коагулятов составил 200–300 мкм, экспозиция — 0,1 с, мощность — 60–80 мВт. Критерием эффективности БЛК считали отсутствие распространения края РШ за пределы внешнего ряда коагулятов. Результаты и обсуждение. Из 72 глаз обследованных пациентов периферический РШ выявлен на 45 глазах (62,5 %). Односторонний — 41,7 %, двухсторонний — 58,3 %. В большинстве случаев РШ сочетался с различными видами перифериче- 278 ской витреохориоретинальной дистрофии (ПВХРД) («инеевидная», «след улитки», «решетчатая», «микрокистоз»), так же ПВХРД по смешанному типу была обнаружена на парных глазах без РШ. РШ встречался на 6 эмметропических глазах, 10 —гиперметропических глазах и 29 глазах с миопической рефракцией, из них миопия слабой степени — на 5 глазах (17,2 %), средней степени — на 3 глазах (10,3 %), высокой степени — на 21 глазу (72,5 %). По этиопатогенезу выделена группа наследственного РШ — 2 глаза (4,4 %); группа приобретенного РШ — 40 глаз (88,9 %), из них — 7 глаз (17,5 %) с сенильным и 33 глаза (82,5 %) с миопическим РШ; группа вторичного РШ — 3 глаза (6,7 %). РШ располагался преимущественно в нижненаружном квадранте — на 41 глазу (91,1 %), в верхненаружном — на 3 глазах (6,7 %), в нижневнутреннем — на 1 глазу (2,2 %). Показаниями к лазеркоагуляции служили: плоский периферический РШ с единичными дырчатыми разрывами во внутреннем листке без отслоения сетчатки, без линии самоотграничения — 12 глаз (26,7 %); плоский периферический РШ без разрывов — 18 глаз (40,0 %); 3) буллезный РШ — 15 глаз (33,3 %). Дальнейшее наблюдение за этими пациентами (1–3 года) показало, что на 8 глазах (17,7 %) потребовалась повторная БЛК, т. к. граница РШ вышла за пределы лазерного барьера. Только у 2 пациентов на 2 глазах (4,4 %) РШ осложнился отслойкой сетчатки, им было проведено хирургическое лечение. Выводы. РШ чаще встречался на глазах у пациентов с миопией высокой степени — 72,5 %. ПВХРД по смешанному типу обнаружена как на глазах с РШ, так и на парном глазу. По этиопатогенезу преобладает группа приобретенного ретиношизиса — 88,9 %. Локализация РШ в нижненаружном квадранте превалирует, и составила, по нашим данным, 91,1 %. Стабилизация процесса прогрессирования РШ достигнута в 95,6 % случаев. Барьерная лазеркоагуляция является эффективным методом профилактики такого грозного осложнения РШ, как отслойка сетчатки. Т. В. Шелковникова, Д. А. Савин ПРОФИЛАКТИЧЕСКАЯ ЛАЗЕРКОАГУЛЯЦИЯ У ПАЦИЕНТОВ С ОДНОСТОРОННЕЙ ДЕГЕНЕРАТИВНОЙ ОТСЛОЙКОЙ СЕТЧАТКИ ГУЗ «Кемеровская областная клиническая офтальмологическая больница», ГОУ ВПО «Кемеровская государственная медицинская академия», г. Кемерово Периферические витреохориоретинальные дистрофии (ПВХРД) являются одной из причин, приводящих к развитию отслойки сетчатки. Клинические исследования и данные аутопсий показали, что ПВХРД и разрывы сетчатки обнаруживаются в общей популяции в 5–13 % случаев [Большунов А. В. и соавт., 2009]. Значительная частота двусторонней отслойки сетчатки (от 9 до 35 %) определяет важность её профилактики на парном глазу у больных с односторонней отслойкой сетчатки [Саксонова Е. О. и соавт., 1981]. Общепринятым методом профилактики ОС при ретинальных разрывах и опасных формах ПВХРД является отграничивающая лазерная коагуляция (ЛК) [Либман Е. С., 1973; Линник Л. А. с соавт., 1977; Волков В. В., Балашевич Л. И., 1978; Большунов А. В. и соавт., 2009]. Цель — изучить клинические формы ПВХРД, на парном глазу с отслойкой сетчатки, проанализировать результаты профилактической лазеркоагуляции сетчатки. Материал и методы. За период 2004–2006 гг. в отделении лазерной хирургии ГУЗ КОКОБ осмотрено 180 пациентов с односторонней отслойкой сетчатки, у которых ПВХРД на парном глазу выявлена в 70 % случаев (126 глаз). Из них 57 % мужчин, 43 % женщин. Возраст больных составлял от 19 до 67 лет. Из них с гиперметропией — 3 %, эмметропией — 13 %, миопией высокой степени — 13 %, средней степени — 30 %, слабой степени — 41 %. Проводимое офтальмологическое обследование включало визометрию, офтальмометрию, эхографию, биомикроскопию, прямую и обратную офтальмоскопию, осмотр глазного дна с зеркальной 279 линзой Гольдмана в условиях максимального медикаментозного мидриаза. Профилактическая периферическая лазеркоагуляция сетчатки (ППЛКС) проведена у 92 % пациентов с опасными формами ПВХРД (решётчатая формы, ретиношизис, разрывы сетчатки) с помощью Nd: YAG-лазера с удвоением частоты, λ=532 нм, фирмы «NIDEK» (Япония), по стандартной методике вдоль внешних границ ПВХРД. Диаметр коагулятов составил 200, экспозиция — 0,1 с, мощность — 60–80 мВт. Результаты и обсуждение. По результатам осмотра периферии глазного дна пациентов выявлены различные формы ПВХРД: 1) комбинированные виды ПВХРД (инеевидная, микрокистозная, патологическая гиперпигментация, хориоретинальная атрофия) — 45,2 %; 2) решётчатая дистрофия — 20,7 %, (из них 3,2 % — с разрывами, 3,2 % — дистрофия по типу «След улитки»); 3) комбинированные виды ПВХРД с периферическими разрывами — 17,4 %; 4) патологическая гиперпигментация — 10,3 %; 5) хориоретинальная атрофия («Булыжная мостовая») — 3,2 %; 6) ретиношизис — 3,2 %. Опасные формы ПВХРД на парном глазу с отслойкой сетчатки, встречались у пациентов с миопией слабой степени в 39,5 %, средней степени — в 27 %, высокой степени — в 19 % и при эмметропии — в 14,5 %. Срок наблюдения после ППЛКС составил 5 лет. Стабилизация прогрессирования ПВХРД достигнута в 97,6 % случаях. Отслойка сетчатки произошла на трех глазах (2,4 %) с миопией высокой и средней степени, решётчатой формой ПВХРД с разрывами сетчатки. Выводы. Опасные формы ПВХРД на парном глазу с отслойкой сетчатки встречаются в 41,3 % случаев. Проведение ППЛКС является эффективной мерой профилактики отслойки сетчатки. Н. Л. Шеремет, Т. В. Смирнова, И. Ю. Разумова ВОПРОСЫ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ОПТИЧЕСКОГО НЕВРИТА И ИШЕМИЧЕСКОЙ ОПТИЧЕСКОЙ НЕЙРОПАТИИ У ЛИЦ МОЛОДОГО И СРЕДНЕГО ВОЗРАСТА Учреждение РАМН «НИИ глазных болезней РАМН», г. Москва Оптический неврит и ишемическая оптическая нейропатия — наиболее часто встречающиеся заболевания зрительного нерва среди всех оптических нейропатий неглаукомного генеза. Оптический неврит (ОН) — полиэтиологичное заболевание, наблюдающееся у лиц молодого и среднего возраста от 16 до 55 лет (средний возраст 32 года по данным Optic Neuritis Treatment Trial), связанное чаще всего с демиелинизирующим заболеванием. Клинически рассеянный склероз выявляется у 15–20 % пациентов с первым приступом ОН, у 35–40 % пациентов демиелинизирующая этиология ОН изначально неустановленной этиологии выявляется только в последующие годы наблюдения [1]. Таким образом, при первичном обращении в 80–85 % случаев этиология ОН неизвестна и может оцениваться только на основании анамнеза и симптомокомплекса заболевания. Ишемическая оптическая нейропатия (ИОН) — заболевание, возникающее в результате ишемии пе- редней или задней части зрительного нерва, наиболее часто встречающееся у пациентов старше 50 лет. Однако ИОН может наблюдаться и у молодых людей. Так, в работе Hayreh S. S. из 406 пациентов с неартериитной передней ИОН (средний возраст 60±14 лет, разброс от 11 до 91 лет) 11 % пациентов были моложе 45 лет [2]. ОН и ИОН имеют ряд специфичных симптомов заболевания, позволяющих в большинстве случаев безошибочно дифференцировать генез оптической нейропатии. Однако в некоторых случаях клинические проявления заболеваний могут быть схожими [3]. Кроме того, часто молодой возраст пациентов ошибочно ассоциируют с воспалительной природой заболевания зрительного нерва. Учитывая необходимость незамедлительного назначения корректного лечения в этих ситуациях, оценка этиологии заболевания зрительного нерва должна быть своевременной. Цель — изучить частоту встречаемости и причины развития ОН и ИОН у пациентов молодого и среднего возраста. 280 Материал и методы. Обследовано144 пациента (180 глаз) с передней и задней ИОН в возрасте от 21 до 85 лет (медиана возраста 60 лет), 81женщина, 63 мужчины, а также 76 пациентов (105 глаз) с ОН в возрасте от 13 до 64 лет (медиана возраста 31 год), 48 женщин, 28 мужчин. Всем пациентам наряду с традиционными офтальмологическими исследованиями проводилась компьютерная периметрия с применением статической неврологической и кинетической программы (периметр «Octopus 900», Interzeag AG, Switzerland), по показаниям пациентам проводилась флуоресцентная ангиография, ультразвуковое исследование глаза и орбиты, а также оценка кровотока глаза в режиме цветового допплеровского картирования (VOLUSON 730 PRO, Kretz), мультифокальная электроретинография, зрительные вызванные потенциалы (ЗВП) («Tomey», ЕР1000 Multifocal, Germany), магнитно-резонансная томография головного мозга. По показаниям проводились биохимические, иммунологические, генетические исследования крови. Результаты и обсуждение. Исследование распределения пациентов по возрасту выявило, что ИОН встречается наиболее часто в возрасте после 51 года — 79,5 % случаев. Однако и в возрасте до 50 лет в 20,5 % случаев были отмечены случаи ишемического поражения зрительного нерва (16 глаз — передняя ИОН, 21 глаз — задняя ИОН), большая часть из которых была изначально ошибочно расценена как ОН. У этих пациентов в 54 % была выявлена мультигенная форма тромбофилии, в т. ч. в 10,8 % — первичный антифосфолипидный синдром; в 24,4 % в качестве вероятной причины развития ИОН были обнаружены системная артериальная гипер- или гипотония, ночная гипотония, выраженные нарушения липидного обмена, сахарный диабет. В 5,4 % глаз ИОН произошла на фоне друз ДЗН, в 1 случае — на фоне постоперационной офтальмогипертензии. В 13,5 % случаев пациенты отказались от обследования для выявления провоцирующих факторов заболевания. Основная часть пациентов с ОН (75 % случаев) — люди до 40 лет. Среди всех пациентов с ОН демиелинизирующий генез заболевания был выявлен в 53,3 % случаев, постинфекционный ОН — в 6,6 %, ОН на фоне саркоидоза — 5,7 %, нейрохориоретинит — в 4,8 %, аутоиммунный ОН — в 3,8 %, риногенный ОН — в 2,9 %. В 22,9 % случаев этиологию ОН не удалось установить, однако в половине случаев заболевание клинически протекало как изолированный демиелинизирующий процесс зрительного нерва. У пациентов после 40 лет ОН как дебют демиелинизирующего заболевания не был выявлен ни в одном случае. Таким образом, несмотря на то, что ОН является наиболее частым заболеванием зрительного нерва у лиц молодого и среднего возраста, в нетипичных клинических случаях у этих пациентов следует исключать ИОН. Дифференцирование этих заболеваний важно как для выработки правильной терапевтической тактики лечения глазного заболевания, так и для определения зрительного прогноза и прогноза здоровья пациентов. Выводы. Наиболее частое заболевание зрительного нерва у лиц молодого и среднего возраста — оптический неврит. Ишемическая оптическая нейропатия у пациентов до 50 лет встречается в 20,5 % случаев среди всех пациентов с ишемической оптической нейропатией. В 54 % случаев ишемическая оптическая нейропатия у лиц молодого и среднего возраста происходит на фоне мультигенной формы тромбофилии. Проведение современного системного обследования пациента позволяет выявить генез заболевания зрительного нерва, что является гарантом улучшения не только зрительного, но и терапевтического, неврологического прогноза. Литература 1. Cantore, W. A. Optic neuritis / W. A. Cantore // Pa. Med. — 1996. — Vol. 99. — P. 96–104. 2. Hayreh, S. S. Acute ischemic disorders of the optic nerve: pathogenesis, clinical manifestations and management / S. S. Hayreh // Ophthalmol. Clin. North Am. — 1996. — Vol. 9. — P. 407–442. 3. Rizzo, J. F. Optic neuritis and ischemic optic neuropathy / J. F. Rizzo, S. Lessell // Arch. Ophthalmol. — 1991. — Vol. 109. — P. 1668–1672. 281 О. Г. Шивелёва Результаты применения ретиналамина при лечении возрастной макулярной Дегенерации в амбулаторных условиях МУ «Городская больница», г. Салават, Республика Башкортостан Дистрофические заболевания сетчатки являются одними из основных причин слабовидения и слепоты. Важной и актуальной задачей современной офтальмологии является поиск лекарственных средств, которые обеспечили бы повышение эффективности лечения пациентов с патологией сетчатки. Ретиналамин, как один из ярких представителей препаратов группы биогенных пептидов, обладает тканеспецифическим действием на сетчатку глаза. Опыт использования ретиналамина при заболеваниях сетчатки различной этиологии показал высокую клиническую эффективность данного препарата в качестве ретинопротектора. Цель — изучить эффективность применения ретиналамина при возрастной макулярной дегенерации сетчатки на фоне традиционной терапии в амбулаторных условиях. Материал и методы. Обследовано 20 больных (40 глаз) с возрастной макулярной дегенерацией (ВМД) в условиях офтальмологического кабинета МУ « Городская больница» г. Салават на протяжении 3 лет (2008–2010 гг.). Пациенты составили 2 группы. Пациенты 1-й группы (9 человек) получали парабульбарные инъекции ретиналамина на фоне традиционного лечения, которое включало в себя комплексную терапию (ангиопротекторы, ретинопротекторы, антиоксиданты, антисклеротические препараты, витамины). Использовалась методика применения ретиналамина, рекомендованная МЗ РФ, Московским НИИГБ им. Гельмгольца, которая заключалась в парабульбарном введении 5 мг сухого вещества, растворенного в 1,0 мл 0,5%-го раствора новокаина, в течение 10 дней ежедневно. Возраст больных составил в среднем 62 года. Все пациенты имели диагностированные сопутствующие заболевания, среди которых основными были гипертоническая болезнь II–III ст. (77,8 %), ишемическая болезнь сердца (66,7 %), сахарный диабет (11,1 %). Также, у пациентов диагностированы начальная (55,6 %) и незрелая (22,2 %) возрастная катаракта, миопия высокой степени (11,1 %). Пациенты 2-й группы (контрольная группа) — 11 человек, получали традиционное комплексное ле- чение. Средний возраст — 61 год. Из соматической патологии, как и в основной группе, доминировали гипертоническая болезнь II–III ст. (88,9 %), ишемическая болезнь сердца (77,8 %), сахарный диабет (22,2 %). Из сопутствующей глазной патологии у пациентов были выявлены начальная (77,8 %) и незрелая (11,1 %) возрастная катаракта, первичная открытоугольная компенсированная глаукома (11,1 %). Для оценки эффективности лечения использовалась стандартная визометрия, определение периферических полей зрения, биомикроофтальмоскопия, офтальмоскопия при медикаментозном мидриазе до лечения (табл. 1), после окончания лечения, а также спустя 1, 3 и 6 месяцев после проведенного курса. Таблица 1 Острота зрения до проведения первого курса консервативного лечения у пациентов основной и контрольной групп Острота зрения Основная группа Контрольная группа 0,05– 0,1 2 3 0,2– 0,4 5 6 0,5– Всего 0,7 пациентов 2 9 2 11 Все пациенты основной группы получили повторные 10-дневные курсы лечения ретиналамином на фоне традиционного лечения по описанной методике через 6 месяцев после предыдущего курса, на протяжении 3 лет. Результаты и обсуждение. К концу курса лечения ретиналамином у всех 9 больных отмечено повышение остроты зрения различной степени (табл. 2). 282 Таблица 2 Острота зрения после проведения первого курса консервативного лечения у пациентов основной и контрольной групп 0,05– 0,1 Основная группа 1 Контрольная группа 2 Острота зрения 0,2– 0,4 4 7 0,5– Всего 0,7 пациентов 4 9 2 11 Полученные результаты повышения остроты зрения у больных, пролеченных ретиналамином, сохранялись в течение 3–5 месяцев. К 6 месяцам острота зрения начала снижаться, но все-таки превосходила первоначальную остроту зрения (до начала применения ретиналамина). После повторного курса лечения (спустя 6 мес. после первого курса) также наблюдался положительный эффект, который также сохранялся в течении 5–6 месяцев. Более быстрое повышение остроты зрения (в среднем на 0,2) отмечалось при ранней стадии возрастной макулярной дегенерации у больных в возрасте до 60 лет. С увеличением возраста и выраженности дистрофических изменений лечебный эффект был значительно менее выражен. Снижения остроты зрения ниже первоначального уровня не происходило. Иные результаты наблюдались в контрольной группе. Как видно, эффект традиционного лечения был менее выраженным. Повышение остроты зрения после первого курса наблюдалось у 7 человек, у 4 человек острота зрения осталась прежней. Спустя 1 месяц результаты обследования были идентичны тем, что были получены сразу после курса лечения. После повторного курса положительная динамика отмечалась у 9 человек. У 2 пациентов, несмотря на терапию, процесс прогрессировал, сопровождаясь дальнейшим снижением остроты зрения. Острота зрения в основной группе достигла максимальных величин после 3 курсов парабульбарных инъекций ретиналамина. При всех последующих курсах увеличение остроты зрения не происходило, а снижение в перерыве между курсами не превышало 0,1. После каждого последующего курса лечения острота зрения возвращалась к максимально достигнутому уровню. Заметные различия между пациентами основной и контрольной групп выявлены также при анализе результатов периметрии. У всех больных основной группы, имевших до лечения сужение периферических границ поля зрения, зарегистрировано расширение границ поля зрения. В контрольной группе значимого расширения периферических границ поля зрения в динамике не отмечено. Выводы: 1. Применение пептидного препарата ретиналамина совместно с традиционной терапией у пациентов с ВМД приводит к выраженному положительному клиническому эффекту: повышению остроты зрения, расширению границ полей зрения и улучшению офтальмоскопической картины. Снижения зрительных функций не зарегистрировано. 2. Положительный эффект от применения ретиналамина проявлялся в полную силу по истечении одного месяца после первого курса. Терапевтический эффект оставался относительно стабильным в течение полугода. Практически все пациенты с ВМД, получавшие ретиналамин, отмечали субъективное улучшение зрения и общего самочувствия. 3. Побочных эффектов, осложнений и аллергических реакций при применении ретиналамина не зарегистрировано. 4. Доказана возможность успешного проведения терапии ВМД препаратом «Ретиналамин» в широкой офтальмологической практике, в том числе в амбулаторных условиях, без значительных экономических затрат. Проведённое исследование показало, что применение пептидного биорегулятора ретиналамина на фоне традиционной комплексной терапии в амбулаторных условиях является наиболее эффективным способом консервативного лечения ВМД на современном этапе. Литература 1. Гармаева, А. Ш. Регуляторные пептиды в норме и при патологии (цитомедины) / А. Ш. Гармаева // Сб. науч. тр. — Чита, 1991. — С. 72–73. 2. Максимов, И. Б. Инволюционные центральные хориоретинальные дистрофии: применение пептидных биорегуляторов в комплексном лечении / И. Б. Максимов, Г. В. Анисимова. — СПб., 2002. — 88 с. 3. Применение препарата ретиналамин в офтальмологии: пособие для врачей. — СПб.: ИКФ «Фолиант», 2003. — 20 с. 4. Ретиналамин. Нейропротекция в офтальмологии / под ред. И. Б. Максимова, В. В. Нероева. — СПб.: Наука, 2007 — 160 с. 5. Хавинсон, В. Х. Пептидные биорегуляторы в офтальмологии / В. Х. Хавинсон, С. В. Трофимова. — СПб., 2003. — 48 с. 283 М. М. Шишкин, Н. М. Юлдашева, К. Т. Гаджиева, М. Мустафа Хадж Осман ФАРМАКОТЕРАПИЯ В СИСТЕМЕ ЩАДЯЩЕЙ ВИТРЕОРЕТИНАЛЬНОЙ ХИРУРГИИ ПРОЛИФЕРАТИВНОЙ ДИАБЕТИЧЕСКОЙ РЕТИНОПАТИИ Национальный медико-хирургический центр им Н. И. Пирогова, г. Москва Современная витреоретинальная хирургия (ВРХ) является патогенетически обоснованным методом лечения далеко зашедшей стадии пролиферативной диабетической ретинопатии (ПДР). Известно, что в патогенезе ПДР значительную роль играют воспалительные процессы, кроме того, сама ВРХ сопровождается специфическими осложнениями, с последующей воспалительной реакцией тканей на операционную травму [Adamiec-Mroczek J. et al., 2008, 2010]. В настоящее время с целью уменьшения отрицательного воздействия приведенных выше факторов в витреоретинальной хирургии получили развитие два основных направления: совершенствование техники ВРХ (хирургия малых калибров (23–27 G, другие методики щадящей ВРХ) [Шишкин М. М. и др., 2006; Тахчиди Х. П., 2007] и применение фармакотерапии [Солонина С. Н., 2003; Шишкин М. М., Ирхина А. В., 2007]. Одним из первых фармакопрепаратов, применяемых в ходе ВРХ, стал Триамцинолона ацетонид (ТА). Его кристаллическая структура позволяла улучшить визуализацию волокон стекловидного тела (СТ) и тем самым оптимизировала его удаление [Peyman G. A. etal., 2000]. Несколько позже, в связи с открытием новых механизмов развития и прогрессирования ДР, была переоценена роль стероидов в терапии этого заболевания [Adamis A. P. 2002; FerraraN., 2004]. На сегодняшний день уже получены положительные результаты применения ТА при лечении ДМО как изолированно, так и в комбинации с лазеротерапией [Нероев В. В. и др., 2006]. Имеются также публикации о применении ТА как дополнительного метода профилактики поствитрэктомических геморрагий при ПДР [Sun Young Lee et al., 2007]. В тоже время известно о специфических осложнениях, связанных с интравитреальным введением стероидов (офтальмогипертензия, катаракта), кото- рые порой обуславливают необходимость повторных вмешательств. Появившиеся сообщения о возможности снижения риска подобных осложнений с помощью антиоксидантов дают надежду на более результативное применение комплексного фармакологического сопровождения витреоретинальной хирургии при пролиферативной ДР [Солонина С. Н., 2003; Dan Yi Wang et al., 2008]. Цель — оценить эффективность комплексной фармакотерапии в системе щадящей ВРХ далеко зашедшей ПДР. Материал и методы. Под нашим наблюдением с 2007 по 2010 гг. находилось 95 пациентов (107 глаз) с далеко зашедшей ПДР в возрасте от 23 до 75 лет (64,7±14,7). Длительность СД составила в среднем 16,9±5,2 лет. Во всех случаях пациентам проводили ВРХ по методике щадящей хирургии [Шишкин М. М. и др., 2006]. В зависимости от дополнительных препаратов, включенных в фармакологическое сопровождение (стероиды, антиоксиданты) пациентов разделили на 3 группы наблюдения. I группа (контрольная) (n=29) — пациенты, которым была проведена щадящая ВРХ, с применением в послеоперационном периоде только инстилляций антибиотиков и нестероидных противовоспалительных препаратов. II группа (n=37) — пациенты, которым в ходе щадящей ВРХ и на ее завершающем этапе вводили ТА (4 мг). III группа (n=41) — пациенты, которым введение ТА в ходе и на завершающем этапе ВРХ дополняли приемом в послеоперационном периоде витаминного комплекса Фокус (Аквион, Россия) и антиоксиданта Танакан 120 мг/сут. (Beaufour Ipsen Int., Франция). Группы анализа были идентичны по возрасту, уровню зрительных функций, длительности основного заболевания и выраженности клинических проявлений далеко зашедшей ПДР. Методы исследования включали визометрию, тонометрию, периметрию, биомикроскопию, В-ска­ 284 ни­рование и оптическую когерентную томографию (ОКТ). Сроки наблюдения составили 6 месяцев. Результаты и обсуждение. Применение ТА в ходе ВРХ у пациентов II и III групп обеспечивало лучшую визуализацию структур СТ и более оптимальное его удаление. Время оперативного пособия у пациентов этих групп составило в среднем 101,4±11,6 и 98,7±12,1 минут соответственно, в то время как у пациентов I группы длительность вмешательства составила 119,4±17,3 минут. В ходе вмешательства мы не отметили достоверной разницы в частоте интраоперационных геморрагий во всех группах наблюдения (62,1 %; 59,5 % и 58,5 % соответственно). Также как в частоте применения интраокулярной диатермии (27,8 %; 22,7 % и 25,0 % соответственно) и силиконовой тампонады при завершении ВРХ (58,6 %; 54,1 % и 53,6 %). В сроки 1–10 дней после ВРХ у пациентов I группы в 24,1 % случаев регистрировали кровоизлияния в витреальную полость из остатков ФВМ. У пациентов II и III групп в эти же сроки данное осложнение наблюдали несколько реже (18,9 % и 17,1 % соответственно), однако разница в показателях была статистически недостоверной. В 1–3 сутки у 6,9 % пациентов I группы наблюдалась фибриноидная реакция, которая была купирована к концу 2 недели полностью. У пациентов II и III групп подобное осложнение не регистрировали ни в одном случае. У пациентов II и III групп послеоперационная воспалительная реакция в 1 сутки после вмешательства была менее выраженная, чем в I группе. Сроки полного купирования воспалительной реакции у пациентов II и III групп составили 12 и 11 суток соответственно, в то время как в I группе — только 14–15 суток. В большинстве случаев причиной развития геморрагических осложнений в сроки более 2 месяцев явилась репролиферация в области склеростом. В I группе ее регистрировали в 20,7 % наблюдений, у пациентов II группы — только в 13,5 % наблюдений. А у пациентов III группы этот показатель составил лишь 9,8 %. В отдельных случаях в каждой из групп обнаружить источник кровотечения не удалось. Отек макулы (по данным ОКТ) в отдаленном послеоперационном периоде достоверно чаще отмечали также у пациентов контрольной группы (20,7 %). У пациентов II и III групп данное осложнение не зарегистрировано. Повышение ВГД у пациентов II группы регистрировали несколько чаще (21,6 %), чем в I (10,3 %) и III группах (12,2 %). Однако, у пациентов I группы повышение ВГД происходило на фоне усиления рубеоза радужки, и применение гипотензивных препаратов в большинстве случаев не давало должного эффекта. При этом в 66,7 % случаях потребовалось проведение хирургического вмешательства. У 92,3 % пациентов II и III групп офтальмогипертензию удалось купировать применением гипотензивных средств. Развитие осложненной катаракты наблюдали у пациентов всех трех групп. В большинстве случаев это было связано с силиконовой тампонадой. Достоверно чаще это осложнение регистрировалось во II (40,5 %) группе, против 31,0 % и 29,3 % в I и III группах. Применение дополнительной фармакотерапии у пациентов II и III способствовало более быстрому восстановлению зрительных функций прооперированного глаза. К 3 месяцу наблюдения средняя острота зрения в I группе составила 0,22±0,03 и продолжала сохраняться в течение всего периода наблюдения (6 месяцев). В то время как средняя острота зрения во II и III группах была достоверно выше и составила 0,32±0,04 и 0,41±0,03 соответственно. Кроме того, она имела тенденцию к улучшению вплоть до 6 месяца наблюдения, достигнув в среднем 0,4±0,03 и 0,43±0,05 соответственно. Достоверность разницы в показателях до и после лечения в группах анализа составила p≤0,01. Положительное действие ТА на течение и результаты ВРХ у больных с далеко зашедшей ПДР обусловлено поливалентным действием стероида. Применение его как диагностического средства облегчает удаление СТ и сокращает время оперативного пособия. Однако, в нашем исследовании основной целью его применения был его противовоспалительный эффект, способность подавлять выработку VEGF и укреплять гематоретинальный барьер [Edelman J. L. et al., 2005]. Это проявилось, в первую очередь, в выраженности послеоперационного воспалительного ответа, а также в скорости его купирования. Что обусловлено подавлением воспалительных процессов, участвующих в патогенезе самой ДР, а также подавлением воспалительных реакций интраокулярных структур на интраоперационную травму [Mańkowska A. et al., 2008]. Длительное действие ТА позволяет сохранять достигнутый эффект до 6 месяца наблюдения, предотвращая раз- 285 витие геморрагических осложнений, поствитрэктомических отеков макулы и репролиферации в области сетчатки и склеростом [Kamppeter B. A. et al., 2008]. Применение комплекса витаминов, с выраженными антиоксидантными свойствами, а также антиоксиданта Танакан, в нашем исследовании было обусловлено не только многочисленными исследованиями, подтверждающими роль антиоксидантного стресса в развитии и прогрессировании ПДР, но и сообщениями о возможности предотвращения побочных эффектов ТА на трабекулярную ткань [LiYunJiaetal., 2008]. Уменьшение частоты развития стероид индуцированной глаукомы и катаракты у па- циентов III группы может служить подтверждением этому. С нейропротекторным действием витаминного комплекса и антиоксиданта Танакан на сетчатку и зрительный нерв мы связываем получение более высоких функциональных показателей у пациентов III группы уже концу 1 месяца наблюдения. Выводы. Комплексное фармакологическое сопровождение витреоретинальной хирургии далеко зашедшей ПДР, включающее в себя интраоперационное применение Триамциналона ацетонида и длительное применение антиоксидантов, оптимизирует течение послеоперационного периода и способствует более быстрому восстановлению зрительных функций. 286 Раздел VI Воспалительные заболевания глаз и придаточного аппарата Д. К. Абсаликова, В. Б. Мальханов, Н. Е. Шевчук ИЗУЧЕНИЕ ЛОКАЛЬНОГО СОДЕРЖАНИЯ ПРОСТАГЛАНДИНА Е2 ПРИ ЭКСПЕРИМЕНТАЛЬНОМ ИММУНОГЕННОМ УВЕИТЕ КРОЛИКОВ ГУ «Уфимский НИИ глазных болезней» АН РБ, г. Уфа Увеиты, являясь одними из самых тяжелых воспалительных заболеваний глаз, встречаются у 15– 38 человек на 100 000 населения. Удельный вес данного заболевания в структуре глазной патологии достигает 5–15 % [1, 3]. В основном поражаются лица молодого и трудоспособного возраста, чем и определяется социальная значимость. Важно также, что заболевание часто имеет тяжелое и рецидивирующее течение, нередко приводящее к инвалидности по зрению [3, 4]. Известно, что основная роль в развитии воспалительного процесса сосудистой оболочки глаза принадлежит медиаторам воспаления, а именно простагландинам (ПГ) — группе липидных физиологически активных веществ [7]. Наиболее важным биологическим медиатором у человека является ПГЕ2, который синтезируется в различных клетках, стимулируемых как физиологическими, так и патологическими факторами [6]. Учитывая вышеизложенные данные, актуальным является дальнейшее углубленное изучение патогенеза увеита, а именно участие ПГЕ2 в развитии воспалительного процесса сосудистой оболочки глаза. Цель — определить содержание простагландина Е2 во влаге передней камеры при экспериментальном иммуногенном увеите кроликов в динамике развития забол