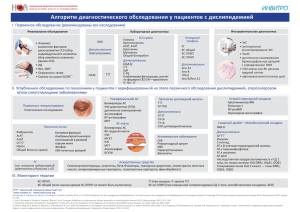
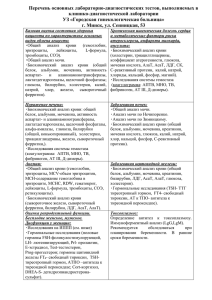
Роль антиспермальных антител в лечении бесплодия методом
реклама

Роль антиспермальных антител в лечении бесплодия методом ЭКО В. С. Корсак, С. А. Сельков, Т. Н. Шляхтенко, Э. В. Исакова, Ю. М. Пайкачева (НИИАГ им. Д. О. Отта РАМН, Международный Центр Репродуктивной Медицины, Санкт-Петербург) В успехе программы экстракорпорального оплодотворения особое значение имеет иммунологическая реактивность организма женщины, от состояния которой зависит имплантация перенесенных в полость матки эмбрионов и нормальное развитие беременности. Вопрос о роли антиспермальных антител (АсАт) в бесплодии и репродуктивных потерях обсуждается в литературе с начала 80-х годов. В физиологических условиях АсАт не формируются, прежде всего, благодаря существованию супрессорных механизмов как в сперме, так и в репродуктивном тракте женщины. К нарушению физиологической супрессии антигенов спермы могут приводить воспалительные заболевания гениталий, прием оральных контрацептивов, аборты и другие хирургические вмешательства на органах половой сферы. Антиспермальные антитела у женщин могут быть обнаружены во всех отделах репродуктивной системы от влагалища до фолликулярной жидкости и в крови. Выявляемые АсАт в основном относятся к двум классам Ig A и Ig G. Повреждающие эффекты их многообразны и могут быть классифицированы как префертилизационные и постфертилизационные. Префертилизационные эффекты АсАт состоят в: подавлении миграции сперматозоидов через цервикальный канал нарушении поступательно-прогрессивного движения сперматозоидов и гибели сперматозоидов подавлении акросомальной реакции у сперматозоидов блокировании прикрепления и пенетрации блестящей оболочки ооцита сперматозоидами блокировании слияния сперматозоидов с вителлиновой мембраной ооцита подавлении формирования пронуклеасов. Постфертилизационные эффекты АсАт заключаются в: нарушении дробления эмбрионов неблагоприятном пре- и постимплантационном исходе прямом отрицательном действии на жизнеспособность развивающегося эмбриона. Таким образом, наличие АсАт имеет двоякое значение: во-первых, АсАт - маркер нарушения иммунорегуляции в целом, во-вторых, АсАт сами по себе способны оказывать отрицательное влияние на процессы оплодотворения, развития эмбриона и имплантации. В настоящее время существуют различные методы коррекции иммунных нарушений. Эффективным и доступным способом лечения АсАт является иммуноцитотерапия аллогенными лейкоцитами, которая индуцирует клеточно-опосредованную иммуносупрессию. На наличие АсАт проведено обследование у 112 женщин с неудачной попыткой ЭКО в анамнезе. Определение АсАт проводилось с помощью иммуноферментного метода с использованием тест-системы «Seravac» (Германия). По условиям метода, при исследовании коллекции сывороток фертильных лиц в 95% случаев концентрация антител класса Ig G к сперме не превышала 70 Е/мл. Это значение принято в качестве пограничного. Антиспермальные антитела были выявлены у 23 (20,5%) из 112 обследованных женщин. Концентрация АсАт в сыворотке крови в этой группе женщин колебалась от 237 Е/мл до 172 Е/мл и в среднем равнялась 204,5 Е/мл. Нам не удалось обнаружить каких-либо существенных различий в основных характеристиках групп женщин с АсАт и теми, у которых они не были обнаружены. Всем пациенткам, у которых были выявлены АсАт, назначалась иммуноцитотерапия по методу В.И. Говалло. Иммуноцитотерапию прошли 18 пациенток. Аллогенные лейкоциты вводились в течение 3 менструальных циклов. В результате лечения у 14 женщин АсАт в сыворотке крови перестали определяться, у 4 пациенток их концентрация резко снизилась и стала ниже или незначительно превышала значения пограничного уровня. После завершения лечения новая попытка ЭКО проведена 13 женщинам. У 12 пациенток был повторен длинный протокол индукции суперовуляции с введением а-ГнРГ с 21-го дня менструального цикла. Протоколы ЭКО этих женщин в попытках до и после иммуноцитотерапии были подвергнуты нами сравнительному анализу для выявления возможных после нейтрализации АсАт изменений в результатах оплодотворения ооцитов и развития эмбрионов в культуре (таблица 2). Все циклы ЭКО после иммуноцитотерапии были закончены переносом в полость матки от 2-х до 4-х эмбрионов, в среднем 3-х эмбрионов. Беременность наступила у 7 пациенток (53,8%), из них многоплодная у 4 (57,1%). Частота имплантации составила 43,5%. В период проведения исследования среднегодовая частота наступления беременности составила 33,3%, частота имплантации - 20,1% и частота многоплодия 26,2%. Срочными родами завершилась 1 беременность, преждевременными родами- 2 беременности двойней. Продолжают вынашивать беременность 3 женщины. У 1 пациентки беременность замерла на раннем сроке. Таким образом, все обследованные 112 женщин с неудачной попыткой ЭКО в анамнезе имели одну или несколько причин для появления АсАт (бесплодие, воспалительные заболевания или генитальный эндометриоз, оперативные вмешательства на органах половой сферы или невынашивание в анамнезе). Тем не менее АсАт были выявлены только у 20,5% пациенток этой группы. Допустимо предположить, что у остальных женщин супрессорные механизмы не были нарушены. В результате иммуноцитотерапия аллогенными лейкоцитами АсАт перестали определяться у 77,8% пациенток, а у остальных пациенток их концентрация резко снизилась. В попытках проведенных после иммуноцитотерапии частота наступления беременности оказалась в 1,6 раза, а частота имплантации в 2,2 раза выше аналогичных средних показателей в нашем центре в период проведения исследования. Можно предположить, что наблюдавшиеся после лечения некоторое увеличение частоты фертилизации (71% против 65,5%, p>0,05) и достоверно большая частота дробления и большее количество эмбрионов (p<0,05), являются эффектами, связанными с элиминацией АсАт . Полученные результаты позволяют рассматривать определение АсАт в крови у пациенток ЭКО и иммуноцитотерапию аллогенными лейкоцитами при их обнаружении как факторы, влияющие на исход процедуры ЭКО.