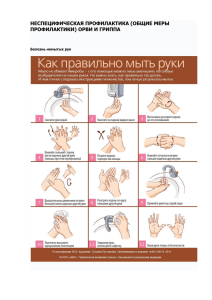
Учебно-методическое пособие 3 курс ЗО ДВ
реклама

ГБОУ ВПО Министерства здравоохранения Российской Федерации ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ФАРМАЦЕВТИЧЕСКОЙ И ТОКСИКОЛОГИЧЕСКОЙ ХИМИИ НОВИКОВ М.С. СОЛОДУНОВА Г.Н. под редакцией профессора ОЗЕРОВА А.А. УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ ДЛЯ ВЫПОЛНЕНИЯ КОНТРОЛЬНОЙ РАБОТЫ ПО ДИСЦИПЛИНЕ ВАРИАТИВНОЙ ЧАСТИ ФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ для студентов III курса заочного отделения фармацевтического факультета Волгоград 2014 2 УДК 578 Рецензенты: Ганичева Л.М. – док. фарм. наук, доцент, заведующая кафедрой управления и экономики фармации, медицинского и фармацевтического товароведения. Симонян А.В. – док. фарм. наук, заведующий кафедрой фармацевтической технологии и биотехнологии. Составили: док. фарм. наук, доцент Новиков М.С., док. хим. наук, проф. Озеров А.А., канд.фарм.наук., доцент Солодунова Г.Н. УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ ДЛЯ ВЫПОЛНЕНИЯ КОНТРОЛЬНОЙ РАБОТЫ ПО ДИСЦИПЛИНЕ ВАРИАТИВНОЙ ЧАСТИ ФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ Представленное учебно-методическое пособие включает в себя краткое содержание дисциплины, требования и указания по выполнению курсовой контрольной работы, варианты и номера заданий. Учебнометодическое пособие предназначено для студентов III курса фармацевтического факультета обучающихся по специальности 060301 «Фармация» (VI cеместр, заочная форма обучения). Волгоградский государственный медицинский университет 400131, г. Волгоград, пл. Павших борцов,1. 3 СОДЕРЖАНИЕ 1 Список сокращений 4 2 Введение 5 3 Общие указания по оформлению контрольной работы 7 4 Вопросы по содержанию контрольной работы 12 5 Лекарственные препараты для лечения инфекционных заболеваний 16 6 Противовирусные препараты – ингибиторы ВИЧ-инфекции 21 Характеристика вируса иммунодефицита человека Ингибиторы входа ВИЧ-1 в клетку Ингибиторы обратной транскриптазы ВИЧ-1 Ингибиторы интегразы ВИЧ-1 Ингибиторы протеазы ВИЧ-1 21 22 25 30 31 7 Препараты для лечения инфекции, вызванной вирусом гепатита С 33 6.1 6.2 6.3 6.4 6.5 7.1 Характеристика вируса гепатита С 7.2 Ингибиторы РНК-зависимой РНК полимеразы 7.3 Ингибиторы протеазы вируса гепатита С 33 36 38 8 Препараты для лечения инфекций, вызываемых герпесвирусами 39 8.1 Общая характеристика герпесвирусов 8.2 Противогерпесные препараты в клинической практике 39 40 9 Препараты для лечения инфекций, вызванных вирусом гриппа 9.1 Характеристика вируса гриппа 9.2 Ингибиторы ионного канала М2 9.3 Ингибиторы сиалидазы 41 41 42 44 10 Препараты для лечения инфекции, вызванной респираторносинцитиальным вирусом 46 11 Препараты для лечения инфекций, вызванных вирусом гепатита В 47 12 Тематический план лекций 50 13 Тематический план занятий 50 14 Вопросы к зачётному занятию 51 15 Список литературы 53 4 СПИСОК СОКРАЩЕНИЙ ВААРТ ВГВ ВГП ВГС ВЗВ ВИЧ ИН НИОТ ННИОТ ОТ ПВ ЛС ПР ПЭГ РСВ СПИД ТК ЦМВ ЭБВ AZT CD81 CLDN1 GAG HTLV IDU LDLR OCLN PEPT1 RdRp SR-BI – высокоактивная антиретровирусная терапия. – вирус гепатита В. – вирус герпеса простого. – вирус гепатита С. – вирус ветряной оспы вариселлы-зостер. – вирус иммунодефицита человека. – интеграза. – нуклеозидные ингибиторы обратной транскриптазы ВИЧ-1. – ненуклеозидные ингибиторы обратной транскриптазы ВИЧ-1. – обратная транскриптаза ВИЧ-1. – противовирусные лекарственные средства. – протеаза. – полиэтиленгликоль. – Респираторно-синцитиальный вирус. – синдром приобретенного иммунодефицита. – тимидин-киназа. – цитомегаловирус. – вирус Эпштейна-Барра. – 3’-азидотимидин. – тетраспанин. – клаудин-1. – глюкозаминогликан. – Т-лимфотропный вирус человека (human T-lymphocytic virus). – иодоксуридина. – липопротеиновый рецептор низкой плотности. – окклюдин. – пептидный транспортер. – РНК-зависимая РНК полимераза. – липопротеиновый рецептор высокой плотности класса В типа I. 5 ВВЕДЕНИЕ Доля вирусных инфекций в структуре общей инфекционной заболеваемости составляет до 90%. «Фармацевтический анализ лекарственных соединений для лечения инфекционных заболеваний» это дисциплина, изучающая теорию происхождения инфекционных вирусных частиц различной этиологии, их классификацию, строение и лекарственные соединения для лечения вирусных заболеваний на различных стадиях жизненного цикла вирусов. Лекарственные препараты, используемые для лечения инфекционных заболеваний, имеют различную химическую структуру в зависимости от вида инфекций, вызывающих ту или иную инфекционную болезнь. Профилактика инфекционных болезней и борьба с ними во все времена и у всех народов представляли собой самую серьезную общественную проблему. Следует подчеркнуть, что инфекционный процесс - один из самых сложных в природе биологических процессов, а инфекционные болезни являются грозными разрушительными факторами для человеческого общества, наносящими ему колоссальный экономический ущерб. Ведётся постоянная работа по синтезу новых лекарственных веществ для лечения инфекционных заболеваний. Дисциплина «Фармацевтический анализ лекарственных соединений для лечения инфекционных заболеваний» является дисциплиной вариативной части профессионального цикла ВПО по специальности 060301 «Фармация» квалификации «специалист», специального звания «Провизор». Цель курса: Сформировать знания в области строения и структурных особенностей лекарственных веществ для лечения инфекционных заболеваний вирусной этиологии. Задачи курса: Сформировать общие представления о биологических мишенях химиотерапевтического воздействия на инфекционные агенты, методах синтеза и фармацевтическом анализе лекарственных соединений для лечения вирусных инфекций с учетом постоянно возрастающих требований к эффективности и безопасности лекарственных средств. Привить навыки и умения, необходимые для деятельности провизора в области организации и осуществления контроля качества лекарственных средств с учетом их постоянного обновления. 6 СОДЕРЖАНИЕ ДИСЦИПЛИНЫ ВАРИАТИВНОЙ ЧАСТИ ФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ СОЕДИНЕНИЙ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ для студентов заочной формы обучения III курс 6 семестр 1. Вирусы, классификация, жизненный цикл, место заболеваний вирусной этиологии в современной медицине. История открытия противовирусных средств. Принципы современной противовирусной терапии. Проблемы терапии – причины поиска новых ПВ средств. История открытия ПВ ЛС. 2. Характеристика семейства ретровиридае. ВИЧ. Жизненный цикл вируса. Мишени химеотерапии ВИЧ. Ингибиторы слияния. 3. Обратная транскриптаза ВИЧ, её функции. Ингибиторы обратной транскриптазы: нуклеозидные, ненуклеозидные, смешанного типа, РНКазной активности. Ингибиторы интегразы, ингибиторы протеазы. 4. Краткая характеристика флавивиридае. эпидемиология. Ингибиторы протеазы. Вирус гепатита 5. Ингибиторы слияния вируса с клеткой, полимеразы (нуклеозидные и ненуклеозидные). ингибиторы С, вирусной 6. Характеристика семейства Герпесвиридае. Вирус герпеса простого тип 1 и тип 2, зостер-вирус, Эпштейн-Барр вирус, цитомегаловирус, герпесвирус человека тип 6. Анти-герпесные препараты: иодоксуридин, ацикловир, бровудин (БВДУ), валцикловир. 7. Анти-цитомегаловирусные препараты: ганцикловир, фоскарнет, цидофовир, валганцикловир. Современные направления поиска антиЦМВ агентов 8. Краткая характеристика вируса гриппа. Жизненный цикл. Ингибиторы М2 (римантадин, амантадин), ингибиторы сиалидазы. 9. Краткая характеристика респираторно-синцитиального Жизненный цикл. Ингибиторы слияния. вируса. 10.Краткая характеристика вируса гепатита В. Ингибиторы репродукции вируса 11.Современное понимание проблемы. Разработка новых концепций химеотерапии вирусных инфекций. 7 ОБЩИЕ УКАЗАНИЯ по выполнению и оформлению контрольных работ Основополагающим условием успешного освоения курса вариативной части Фармацевтический анализ лекарственных соединений для лечения инфекционных заболеваний является правильно организованная самостоятельная работа студента-заочника по методической литературе, прилагаемой в конце данного пособия. Изучение материала рекомендуется вести в соответствии с выше изложенной программой в следующем порядке: 1. Ознакомиться с литературными источниками, содержащими изучаемый раздел. 2. Внимательно прочитать изучаемый раздел и составить общее представление о материале, выделив трудные и непонятные моменты. 3. Тщательно изучить раздел в соответствии с задачами фармацевтической химии (получение, подлинность, доброкачественность, количественное определение, хранение, и т.д.). 4. Составить краткий конспект изучаемого материала. 5. Проверить усвоение по вопросам темы. 6. Письменно ответить на вопросы контрольной работы. Ответы на вопросы должны быть краткими, конкретными, логичными, содержать исчерпывающие пояснения (исключить механическое переписывание материала). 7. Ответы должны иллюстрироваться схемами, уравнениями химических реакций. 8. Контрольная работа выполняется в школьной ученической тетради. Для замечаний оставляются поля не менее 3 см. Каждый вопрос нумеруется в соответствии с номером задания, полностью переписывается, подчеркивается и отделяется от ответа интервалом 1,5 - 2 см. Титульный лист оформляется следующим образом: КОНТРОЛЬНАЯ РАБОТА дисциплине вариативной части Фармацевтический анализ лекарственных соединений для лечения инфекционных заболеваний студента III курса заочного отделения фармацевтического факультета _________________________________________________ (Ф.И.О. полностью) Группа № Зачетная книжка № вариант № Домашний адрес (полностью) Подается (впервые, повторно) 8 9. В конце контрольной работы приводится список используемой литературы. Правило записи используемой литературы: порядковый номер, фамилия и инициалы автора, полное название книги, место и год издания, том, страницы. Далее ставится подпись студента и дата сдачи контрольной работы. 10.Контрольная работа отправляется в адрес деканата в соответствии с графиком. При зачтённой работе и зачтённой "условно" она отдаётся на руки студенту для выполнения работы над ошибками. После исправления работа приносится на зачётную сессию и отчитывается преподавателю. 11.Если контрольная работа не зачтена, студент выполняет не зачтенные задания и предоставляет их на повторное рецензирование вместе с не зачтенной первоначально контрольной работой. 12.Если в процессе выполнения работы возникают затруднения или неясности, он может обратиться к рецензенту за разъяснениями (дни и время консультаций указаны на кафедре). При этом, студенту необходимо владеть основным материалом учебника по данной теме, кратко и четко формулировать вопросы. 13.Работа выполняется в соответствии с выше указанными требованиями. Работа, не соответствующая требованиям, проверке не подлежит. 14.К сдаче зачёта допускаются студенты, имеющие зачет по контрольной работе. 15.Номер контрольной работы определяется двумя последними цифрами зачётной книжки (столбец по вертикали). Номера заданий по темам горизонтали) против номера вариантов. Римскими цифрами обозначены номера тем. Например, номер зачётной книжки 1035, следовательно, номер варианта 35: 35 I II III IV V VI VII 6 3 8 5 1 4 7 VIII IX Х 2 10 1 Следовательно, номера заданий по темам следующие: 6,3,8,5,1,4,7,2, 10,1. Номера заданий по вариантам меняются каждый учебный год. 9 Варианты I II III IV V VI VII VIII IX Х 01 02 03 04 05 06 07 08 09 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 1 2 3 5 6 7 8 4 5 3 6 7 2 8 1 4 7 3 8 5 1 2 4 6 3 1 8 2 4 5 7 6 1 2 3 6 7 8 5 4 2 1 7 2 8 4 5 1 6 3 1 6 2 7 5 8 3 4 7 6 1 2 3 8 4 5 8 7 6 2 4 7 5 1 8 3 2 6 4 8 7 5 3 1 6 8 1 5 2 7 4 3 5 1 2 7 3 4 8 6 4 2 3 2 5 3 1 4 3 1 5 3 2 4 5 3 1 4 2 5 3 1 3 1 2 5 3 4 2 1 5 3 2 5 1 3 4 1 2 6 3 5 8 7 9 3 4 1 6 2 9 5 1 8 7 2 6 3 1 7 9 1 4 8 2 1 5 6 3 1 1 6 2 3 8 7 1 9 4 2 7 6 3 8 4 1 4 9 6 2 8 1 9 3 2 4 7 3 6 8 7 2 9 6 2 1 5 3 4 2 5 1 2 3 4 3 5 1 2 4 5 1 4 2 3 5 1 2 4 3 5 2 1 4 2 5 3 1 4 6 1 2 7 3 4 5 6 7 2 3 1 6 5 2 4 3 7 1 5 4 2 3 6 7 1 4 5 6 3 1 7 2 5 2 6 1 3 4 6 6 5 2 1 4 3 2 6 5 1 6 4 3 1 5 6 1 2 4 3 5 6 2 1 4 3 6 8 7 9 10 2 6 3 4 1 5 10 2 4 3 7 3 9 1 5 8 9 6 7 8 1 5 10 3 4 2 8 9 6 7 10 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 I 5 3 6 4 8 7 3 2 4 8 5 7 6 1 4 2 6 3 5 7 3 8 2 4 1 7 3 8 6 5 4 2 7 1 6 8 5 II 6 5 3 4 2 1 6 7 3 2 5 1 8 4 2 8 6 7 4 1 5 3 7 3 6 1 5 1 8 4 2 6 1 8 3 2 7 III 5 3 7 1 8 6 2 4 8 1 3 6 6 7 1 7 2 5 6 3 4 8 1 7 8 3 2 4 5 6 4 5 7 3 6 8 2 IV 4 1 1 2 4 3 5 1 3 4 1 5 2 4 2 5 3 3 1 5 2 4 3 1 3 5 4 2 3 1 2 3 3 5 1 4 2 V 6 3 4 8 7 1 9 2 3 1 4 6 6 1 2 5 8 7 9 5 1 9 6 2 3 8 1 4 9 5 3 4 1 6 8 5 1 VI 2 3 7 6 4 9 8 4 3 6 1 8 2 6 9 7 8 2 3 1 6 4 9 8 3 4 6 7 2 1 8 1 9 6 4 7 8 VII 1 2 3 4 5 3 1 2 5 4 1 3 2 4 5 1 3 2 5 4 3 2 1 3 5 4 1 2 3 4 5 3 2 1 4 5 3 VIII 5 1 2 3 4 6 7 5 1 2 7 3 4 6 1 5 6 4 2 7 3 1 5 6 4 3 2 4 6 7 1 2 4 6 3 1 5 IX 5 3 4 6 1 3 2 6 5 3 4 6 1 2 3 6 3 5 4 6 1 3 6 2 5 6 1 4 6 3 5 1 4 2 6 4 6 X 2 10 6 3 4 1 5 10 2 4 3 7 3 9 1 5 8 9 6 7 8 1 5 10 3 4 8 2 9 6 7 8 7 9 10 5 1 11 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 I 3 8 2 5 7 3 6 4 1 2 7 1 6 8 5 3 4 7 2 5 8 6 3 4 1 3 5 7 8 II 6 1 5 8 4 7 6 4 2 3 1 8 5 1 6 8 3 4 8 6 1 7 2 3 4 8 7 3 2 III 1 6 7 4 8 5 2 1 3 7 4 6 2 3 1 5 2 4 5 8 3 8 7 5 6 7 4 1 8 IV 4 1 5 2 4 3 4 2 5 5 4 1 2 5 3 4 3 2 4 3 1 4 5 3 5 1 3 4 2 V 8 4 4 6 9 4 1 8 4 7 2 3 5 9 7 8 4 1 6 5 9 1 2 4 3 8 5 7 1 VI 4 1 8 3 2 7 3 9 1 4 6 2 7 4 8 3 1 4 2 7 5 3 6 1 4 8 7 2 9 VII 3 2 1 3 5 4 2 1 3 5 4 5 1 3 4 1 2 3 5 4 1 2 3 4 2 3 1 5 4 VIII 7 2 1 6 4 3 5 1 2 3 6 5 4 2 7 3 5 4 2 3 6 1 5 7 4 2 6 1 3 IX 2 4 6 5 4 1 3 4 6 2 1 3 6 5 2 3 4 4 1 6 2 5 6 4 5 1 2 4 6 X 8 7 9 10 2 6 3 4 1 5 10 2 4 3 7 3 9 1 5 8 9 6 7 8 1 5 10 3 4 12 ВОПРОСЫ ПО КОНТРОЛЬНОЙ РАБОТЕ ТЕМА 1: Вирусы, классификация, жизненный цикл, место заболеваний вирусной этиологии в современной медицине. История открытия противовирусных средств. Принципы современной противовирусной терапии. Проблемы терапии – причины поиска новых ПВ средств. История открытия ПВ ЛС. 1. 2. 3. 4. 5. 6. 7. 8. Вирус – определение. Теории происхождения вирусов. Пути распространения вирусов. Строение вириона оболочечнго вируса и вириона не имеющего липидного бислоя. Классификация вирусов по Балтимору. Жизненный цикл вирусов. Противовирусный препарат – ациклонуклеотид фосфатной природы – Цидофовир, Адефовир. Синтез. Нуклеозидный ингибитор РНК-зависимой РНК полимеразы вируса гепатита С и других флавивирусов. ТЕМА 2: Характеристика семейства ретровиридае. ВИЧ. Жизненный цикл вируса. Мишени химеотерапии ВИЧ. Ингибиторы слияния. 1. 2. 3. 4. 5. 6. 7. 8. Характеристика ретровирусов: Семейство Подсемейство Род Филогенетическое дерево семейства Retroviridae Строение вириона ВИЧ-1 (рис), жизненный цикл ВИЧ-1. Ингибиторы входа ВИЧ-1 в клетку. Гликопротеиновый комплекс. Этапы входа (рис). Ингибиторы прикрепления вируса к клетке. ВМС-378806 и циклотриазасульфонамид). Их синтез. Ингибиторы связывания вируса с со-рецепторами ССR5. Синтез Маровирака Ингибиторы связывания вируса с со-рецепторами ССR5. Синтез Викривайрока. Ингибиторы слияния - Энфувиртидом. ТЕМА 3: Обратная транскриптаза ВИЧ, её функции. Ингибиторы обратной транскриптазы: нуклеозидные, ненуклеозидные, смешанного типа, РНК-азной активности. 13 1. Обратная транскриптаза (ОТ). Её назначение, функции, строение. 2. Нуклеозидные ингибиторы ОТ – как ЛС для лечения ВИЧ-1. Азидотимидин, Диданозин. Механизм ингибиторного действия АZТ. 3. Синтез азидотимидина (зидавудин). Недостатки НИОТ. Депо-формы – Никавир. Преимущества. 4. Фармацевтический анализ Азидотимидина. 5. Ненуклеозидные ингибиторы ОТ (ННИОТ), механизм действия. ННИОТ 1 и 2 поколения (1: Ниверапин, Делавирдин, Эфавиренц; 2: Этравирин, Рилпивирин). Недостатки ННИОТ. 6. Синтез Рилпивирина: через 2,6-диметил-4-галоген анилин. 7. Синтез Рилпивирина: через этиловый эфир 4-амино-3,5-диметил бензойной кислоты. 8. Анти-ВИЧ-1 агенты, проходящие в настоящий момент клинические испытания. ТЕМА 4: Ингибиторы интегразы ВИЧ-1, ингибиторы протеазы ВИЧ-1. 1. Интеграза ВИЧ-1, её строение, функции. Ингибиторы интегразы, механизм ингибирования. 2. Релтегравир – ингибитор ИН ВИЧ-1. Синтез. 3. Ингибиторы второго поколения (Элвитегравир, Долутегравир, МК – 2048), достоинства. 4. Вирусная протеаза ВИЧ-1. Функции протеазы ВИЧ-1. Ингибиторы протеазы, механизм ингибирования, недостатки. Даруновир. 5. Высокоактивная анти-ретровирусная терапия (ВААРТ) ВИЧ-1. Направленность действия, цели, недостатки. ТЕМА 5: Краткая характеристика флавивиридае. Вирус гепатита С, эпидемиология. Ингибиторы протеазы. Ингибиторы слияния гепатита С. Нуклеозидные ингибиторы полимеразы гепатита С. Ненуклеозидные ингибиторы полимеразы гепатита С. Ингибиторы другого механизма действия. 1. Характеристика семейства Flaviviridae и вируса гепатита С. Строение вириона ВГС. 2. Генотип вируса гепатита С. Современные протоколы терапии. Рибаверин, интерферон. 3. Строение РНК-зависимой РНК полимеразы. Нуклеозидные нгибиторы РНК-зависимой РНК полимеразы. 4’-Азидоцитидин и его пролекарственная форма – Балапиравир. РSI 6130 и его пролекарственная форма RG 7128. 4. Спицефический блокатор ВГС – Балапиравир, его синтез. Механизм действия. 14 5. Спицефический блокатор ВГС - RG 7128, его синтез. Механизм действия. 6. Ненуклеозидные ингибиторы РНК-зависимой РНК полимеразы бензотиадиазинового ряда. Структура, характеристика. 7. Строение природного субстрата (полипептид) для вирусной протеазы. 8. Ингибиторы протеазы вируса гепатита С: телапривир, Боцепривир, Силупревир, Данопревир, Симепревир. 9. Схема входа вируса гепатита С в клетку. ТЕМА 6: Характеристика семейства препараты: иодоксуридин, валцикловир. 1. 2. 3. 4. 5. 6. 7. 8. 9. Герпесвиридае. Антигерпесные ацикловир, бровудин (БВДУ), Общая характеристика семейства герпесвирусов (альфа-, бета- и гамма). Строение вириона герпес-вируса. Рисунок и описание. Жизненный цикл герпес-вируса. Рисунок и описание. Строение вирусной ДНК полимеразы. Анти-герпесные препараты. Ацикловир – синтез, механизм противовирусного действия. Фармацевтический анализ. Пролекарственная форма Ацикловира. Цели создания. Анти-герпесные препараты. Строение, характеристика, назначение. Противогерпетический агент – Йодоксуридин. Синтез. Характерис-тика препарата. Препараты, обладающие противогерпетической активностью: Видарабин, Трифлуридин, Бривудин. Строение, характеристика. ТЕМА 7: Анти-цитомегаловирусные препараты. Современные направления поиска анти-ЦМВ агентов. 1. Анти-цитомегаловирусные препараты. Ганцикловир: строение. Механизм противовирусного действия. Недостатки использования ГЦВ. 2. Ганцикловир – синтез, фармацевтический анализ. Пролекарственная форма ГЦВ – синтез, характеристика. 3. Цидофовир. Строение, характеристика. Пролекарственная форма Цидофовира. 4. Фоскарнет. Строение. Модификация. 5. Препарат широкого спектра противовирусной активности – Фамцикловир. Строение. Биотрансформация Фамцикловира до Пенцикловира. ТЕМА 8: Краткая характеристика вируса гриппа. Жизненный цикл. Ингибиторы М2 (римантадин, амантадин), ингибиторы сиали- 15 дазы. Краткая характеристика респираторно-синцитиального вируса. Ингибиторы слияния. Характеристика семейства Orthomyxoviridae и вируса гриппа. Строение вириона гриппа. Жизненный цикл вируса гриппа. Понятие об антигенного сдвига вируса гриппа. Ингибиторы ионного канала М2 вируса гриппа (Амантадин и Ремантадин). Недостатки в использовании Амантадина и Ремантадина. 6. Схема синтеза Амантадина. 7. Схема синтеза Ремантадина. 1. 2. 3. 4. 5. ТЕМА 9: Краткая характеристика вируса гепатита В. Ингибиторы репродукции вируса. Современное понимание проблемы. Разработка новых концепций химеотерапии вирусных инфекций. 1. Сиалидаза. Ингибиторы сиалидазы: Занамивир и Осельтамивир. 2. Характеристика семейства Paramyxoviridae и респираторно-синцитиального вируса. 3. Характеристика вируса гепатита B и его строение. 4. Характеристика инфекции гепатита В. 5. Препараты, применяемые для лечения хронической инфекции гепатита В. 6. Энтекавир. Синтез. Механизм действия. ТЕМА 10: Фармацевтический анализ лекарственных соединений для лечения инфекционных заболеваний. Предложите схемы реакций для определения подлинности лекарственного соединения исходя из его структуры: 1. Цидофовира (для лечения ВИЧ-1). 2. Адефовира (для лечения ВИЧ-1). 3. Циклотриазо-сульфонамида (для лечения ВИЧ-1). 4. Маровирака (для лечения ВИЧ-1). 5. Викривайрока (для лечения ВИЧ-1). 6. Рилпавирина (для лечения ВИЧ-1). 7. Занамавира (для лечения ВИЧ-1). 8. Рибаверина (для лечения гипатита С) 9. Ацикловира (для лечения герпесвируса). 10.Амантадина (для лечения вируса гриппа). 16 ЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ Период с первого десятилетия до девяностых годов прошлого века характеризовался значительным снижением смертности от инфекционных болезней. Тем не менее, борьба с такими заболеваниями остается актуальной задачей и в настоящее время. Доля вирусных инфекций в структуре общей инфекционной заболеваемости составляет до 90%. Примерами наиболее известных заболеваний человека вирусной природы могут служить: простуда (она может иметь и бактериальную этиологию), грипп, ветряная оспа и простой герпес. Многие серьёзные болезни, например, геморрагическая лихорадка Эбола, СПИД, птичий грипп и тяжёлый острый респираторный синдром также вызываются вирусами. Некоторые вирусы могут вызывать пожизненные или хронические инфекции, при которых вирус продолжает размножаться в теле организма, несмотря на его защитные механизмы. Так происходит, например, при инфекциях, вызванных вирусами гепатита B и C. Вирусы могут вызывать рак. К вирусам, способным вызывать онкологические заболевания у человека, относят некоторых представителей папилломавируса человека, вируса гепатита B и C, вируса Эпштейна-Барр, герпесвируса саркомы Капоши и человеческого T-лимфотропного вируса. Вирусы гепатита могут вызвать хроническую вирусную инфекцию, которая приводит к карциноме печени. Заражение человеческим T-лимфотрофным вирусом может привести к спастическому парапарезу и лейкозу Т-клеток. Человеческие папилломавирусы могут вызывать рак шейки матки, кожи. Из герпесвирусов герпесвирус саркомы Капоши вызывает саркому Капоши, вирус ЭпштейнаБарр – лимфому Беркитта, лимфогранулематоз и назофарингеальную карциному. Вирус (лат. virus – яд) – неклеточный инфекционный агент, который может воспроизводиться только внутри живых клеток. Вирусы поражают все типы организмов, от растений до животных. Недавно были обнаружены также вирусы, поражающие другие вирусы (вирусы-сателлиты). Открытие вирусов принадлежит российскому ученому Дмитрию Ивановскому, который в 1892 г. опубликовал статью, в которой описал небактериальный патоген растений табака. К настоящему времени детально описаны более 5 тысяч видов вирусов, предполагается, что их существует гораздо больше. Вирусы обнаружены почти в каждой экосистеме на Земле. Они являются самой многочисленной биологической формой. Вирусные частицы – вирионы – состоят из двух или трёх компонентов: генетического материала в виде ДНК или РНК; белковой оболочки (капсида), защищающей эти молекулы, и, в некоторых случаях, — дополнительных липидных оболочек. Таким образом вирусы делятся на оболочечные вирусы (т.е. имеющие дополнительный липидный бислой) и не содержащие дополнительной оболочки. Размеры среднего вируса составляют около одной сотой размеров средней бактерии. 17 История открытий противовирусных лекарственных средств Более чем 60 лет назад было описан синтез иодоксуридина – аналога тимидина. Это вещество позднее – в 1959 г. – стало первым противовирусным препаратом, разрешенным для местного применения в офтальмологии для лечения ВГП инфекций. Появление IDU ознаменовало рождение эпохи противовирусных препаратов. Иодоксуридин Рибавирин Следующим этапом явилось открытие Сидуэллом (в 1972 году) рибавирина – первого низкомолекулярного соединения с широким спектром противовирусного действия. Позднее рибавирин в комбинации с ПЭГилированным α-интерфероном стал применяться для лечения хронического гепатита С. 1977 год был ознаменован появлением анти-гепретического средства ацикловира что позволило лечить инфекции ВГП без вреда для клетокхозяина. Через два года после открытия ВИЧ (в 1985 г) был открыт первый антиретровирусный агент – AZT, который был в 1987 г одобрен для лечения ВИЧинфекции и СПИД. AZT дал толчок к поиску и разработке множества родственных 2’,3’-дидезоксинуклеозидов, также обладающих мощной ингибиторной активностью в отношении ОТ ВИЧ-1 и применяющихся наряду с AZT в клинике в качестве компонента ВАРТ. Все они относятся к одной группе НИОТ. Ацикловир AZT 18 В 1986 г. был описаны первые ациклонуклеотиды фосфонатной природы, обладающие широким спектром противовирусного действия – цидофовир, адефовир и тенофовир. Данное соединение было активно в отношении ОТ ВИЧ и гепатита В, вследствие чего было названо нуклеотидным ингибитором ОТ. Цидофовир Адефовир Тенофовир В 1989 и 1990 гг. были открыты первые ННИОТ ВИЧ-1 – ГЭФТ и ТИБО – что послужило появлению новой концепции ингибирования ОТ ВИЧ-1. ГЭФТ ТИБО В 1990 г. был также ознаменован открытием первого ингибитора протеазы ВИЧ-1. Появились предпосылки для разработки ВАРТ. В 1992 г. был описан необычный класс соединений – бицикламы – ингибиторов слияния ВИЧ с клеткой. 1993 год был ознаменован открытием занамивира – первого ингибитора нейраминазы ингибитора репликации вируса гриппа. Занамивир 19 В 1998 г. было сделано наблюдение, что репликация ВГП может подавляться 2-аминотиазолом на уровне ДНК-геликазы, что позже дало толчок к развитию ингибиторов праймазы в качестве потенциальных антиВГП препаратов. Хотя интеграза ВИЧ всегда являлась привлекательной мишенью для ХТ воздействия, реальностью для этого стала работы Хазуды в 2000 г., где было показано возможность ингибирования интегразы ВИЧ препаратами на основе дикетокислот – ралтегравир и элвитегравир. Ралтегравир Элвитегравир В 2003 г. Ламарр опубликовал свое пионерское наблюдение о том, что репликацию вируса гепатита С можно ингибировать препаратом цилупревир (ciluprevir). И хотя само соединение не получило дальнейшего развития, оно дало толчок к поиску других ингибиторов ВГС. Цилупревир В том же 2003 г. Малльячио обнаружил, что 2’-метил-замещенные рибонуклеозиды ингибируют репликацию ВГС и других флавивирусов. Это дало толчок к поиску нуклеозидных аналогов – ингибиторов РНК-зависимой РНК полимеразы. 20 Несмотря на то, что к настоящему времени в клинике применяется большое количество противовирусных средств, исследователи осуществляют активный поиск новых ингибиторов вирусной репродукции. Основные причины этого следующие: - не все заболевания вирусной природы излечимы, а для некоторых вообще не существует лекарственных средств; - поиск более эффективных; - проблема резистенции вирусов к используемым ЛС; - все известные на современном этапе ПВ ЛС не удаляют вирус из организма. Человек вынужден в отдельных случаях пожизненно принимать ЛС. 21 ПРОТИВОВИРУСНЫЕ ПРЕПАРАТЫ – ИНГИБИТОРЫ ВИЧИНФЕКЦИИ Характеристика вируса иммунодефицита человека Семейство Retroviridae – это большая группа вирусов, которые способны инфицировать позвоночных. Они являются оболочечными вирусами и имеют уникальный репликативный цикл, который коренным образом отличается от репликации других вирусов. Вирионы содержат нуклеиновую кислоту в виде одноцепочечной РНК, которая попадая в клетку-мишень превращается в двуцепочечную ДНК посредством процесса, называемого обратной транскрипцией. Эта ДНК-версия вирусного генома затем интегрируется в ДНК клетки, что позволяет вирусу персистировать и продуцировать потомство в течение всей жизни клетки. Ретровирусы это древняя группа вирусов. Есть доказательства, говорящие о том, что предки современных ретровирусов существовали 10 млн. лет назад. Из числа человеческих патогенов в семейство ретровирусов входят всего два: ВИЧ, являющийся этиологическим агентом СПИД, и Т-лимфотропный вирус человека, который индуцирует у человека Т-клеточные лимфомы (HTLV-I) и дегенеративные заболевания нервной системы, например, спастические парапарезы (HTLV-II). Строение вириона ВИЧ-1: Рисунок 1. Вирион ВИЧ-1 22 Ингибиторы входа ВИЧ-1 в клетку Вход ВИЧ-1 в клетку-мишень является сложным и запутанным процессом, в результате которого генетический материал вируса доставляется в цитоплазму клетки. Участие в этом событии принимает гликопротеиновый комплекс ВИЧ-1, который включает gp41, состоящий из шести трансмембранных полипептидных цепей, которые нековалентно связаны с тремя субъединицами gp120, и клеточные рецепторы. В частности, CD4 (рисунок 2). Рисунок 2. Гликопротеиновый комплекс ВИЧ-1 СD4 – это мономерный трансмембранный гликопротеин, который является маркёром T-хелперов. Он участвует во взаимодействии клеток между собой и являющимися компонентами каскада определённых сигнальных путей иммунной системы. Экспрессируется на тимоцитах, зрелых T-лимфоцитах, моноцитах, макрофагах, клетках Лангерганса и дендритных клетках. В 1996 г было обнаружено, что наряду с рецептором СD4 важнейшую роль в проникновении вируса в клетку играют также со-рецепторы ССR5 и CXCR4. Это стало причиной широкого поиска новых лигандов для подавления ВИЧ-1 и позволило предложить новые методы лечения. (ССR5 и CXCR4 являются хемокинными рецепторами. Известно, что CCR5 экспрессируется преимущественно Т-клетками, макрофагами, дендритными клетками и клетками микроглии. CCR5 играет роль при воспалительной реакции на инфицирование. Однако роль этого белка в иммунном ответе до конца не ясна. Рецептор CXCR4 специфичнен для стромального фактора SDF-1, который регулирует активность хемотаксиса лимфоцитов.) Вход вириона в клетку начинается с прикрепления вирусной частицы к клеточной поверхности. Рецептором служит клеточный антиген CD4. При этом с gp120 происходят конформационные изменения и открывается высококонсервативный сайт связывания с со-рецепторами ССR5 или CXCR4. 23 В этом есть большое преимущество ВИЧ-1 над другими вирусами, поскольку это защищает его от узнавания иммунной системой. На следующим этапе происходит связывание gp120 с со-рецепторами ССR5 или CXCR4 что ведет к дальнейшим конформационным изменениям гликопротеинового комплекса и тренсмембранный gp41 «протыкает» клеточную мембрану что и опосредует последующее слияние мембран вириона и клетки. Ингибиторы прикрепления вируса к клетке. Ингибиторы прикрепления вируса к клетке включают полимерные соединения, несущие легкоионизируемые функциональные группы. К таким соединениям относятся природные сульфатированные полисахариды, например, декстрансульфат или пентозансульфат. Они взаимодействуют с вирионами и индуцируют диссоциацию комплекса gp120-gp41 и тем самым устраняют их инфекционность. Однако клинические исследования не дали положительного эффекта. В основе другого подхода было использование синтетических пептидов, имитирующих клеточный рецептор CD4. Данные соединения были эффективны in vitro, но клинически также оказались малоэффективными. Еще один подход затрагивает малые молекулы синтетической природы, которые связываются с gp120, препятствуя его связыванию с рецептором CD4. Однако ВИЧ-1 довольно быстро вырабатывает к ним резистентность, что сильно ограничивает их терапевтический потенциал. В качестве примера можно привести соединение BMS-378806. BMS-378806 Перспективным классом ингибиторов, которые препятствуют связыванию вируса с CD4, являются циклотриаза-сульфонамиды, противовирусные свойства которых были открыты в 2006 г.: 24 Ингибиторы связывания вируса с со-рецепторами ССR5 и CXCR4. Открытию того факта, что входа ВИЧ-1 в клетку помимо рецептора CD4 требуется со-рецептор, предшествовало обнаружение существования в человеческой популяции лиц, устойчивых к инфекции ВИЧ-1. Изучение их генома показало отсутствие клеточного рецептора ССR5. Следовательно, его отсутствие существенно не сказывается на росте и развитии людей. По этой причине использование малых молекул, нацеленных на ингибирование этого рецептора, должно быть безопасно. Маровирак И благодаря скринингу, последующему дизайну, доклинических и клинических исследований в 2007 г FDA одобрил препарат маровирак для лечения ВИЧ-инфицированных пациентов. Соединение ССR5 связывается с гидрофобным карманом со-рецептора в непосредственной близости с сайтом связывания со-рецептора с gp120. Как результат этого в структуре сорецептора происходят конформационные изменения, которые не позволяют связываться вирусу с со-рецептором. Другим ССR5-ингибитором явился викривайрок, который показал ингибиторный эффект в наномолярных концентрациях. В настоящий момент данный препарат проходит клинические исследования. 25 Викривайрок Ингибиторы слияния. Слияние мембран является результатом рецепторных взаимодействий. Первым ингибитором этой стадии является энфувиртидом – пептид, состоящий из 36 аминокислот. Известно, что энфурвиртид связывается с gp41. Несмотря на эффективность in vivo, к ингибитору быстро вырабатывается резистентность. Кроме того, его нельзя использовать перорально. Ингибиторы обратной транскриптазы ВИЧ-1 Обратная транскриптаза ВИЧ-1 является прекрасной мишенью для химеотерапевтического воздействия на вирус. ВИЧ – это ретровирус и его геном в вирионе представлен в виде одноцепочечной РНК. В инфицированной клетке вирусная РНК посредством обратной транскрипции превращается в двухцепочечную провирусную ДНК. Обратная транскрипция осуществляется вирусным ферментом – ОТ, который выполняет следующие каталитические функции: - РНК-зависимая ДНК полимеризация, приводящая к образованию РНК:ДНК-гибрида; - деградация цепи РНК в РНК:ДНК-гибриде; - ДНК-зависимая ДНК полимеризация, приводящая к образованию провирусной ДНК. ОТ ВИЧ-1 является гетеродимером, состоящим из двух субъединиц р66 и р51. В субъединице р66 содержит полимеразный домен и С-конец РН-азный домен, ответственный за деградацию цепи РНК в РНК:ДНК-гибриде. Кристаллическая структура ОТ ВИЧ-1 показала, что субъединица р66 имеет сходство с правой рукой и состоит из следующих областей: «пальцы», «ладонь» и «большой палец». Щель, благодаря которой фермент связывает нуклеиновую кислоту, простирается от сайта с полимеразной активности до сайта с РН-азный активностью в субъединице р66. Полимеразная активность определяется тремя остатками аспарагиновой кислоты, расположенных в области «ладонь». Субъединица р51 образуется или из р66 путем отщепления РН-азного домена или в результате протеолитического расщепления протеазой ВИЧ полипептида-предшественника и, следовательно, имеет ту же аминокислотную последовательность, что и субъединица р66. Субъединица р51 имеет в своем составе такие же области, что и субъединица р66: «пальцы», 26 «ладонь», «большой палец» и «сустав», но отсутствует домен с РН-азной активностью. Так же, как и р66, р51 имеет полимеразный домен, но он за счет сжатия закрыт и не активен. Субъединица р51 не вовлечена в каталитические процессы напрямую, однако она оказывает структурную помощь, которая позволяет субъединице р66 осуществлять полимеразную и РН-азную функции (см. рисунок 3). Рисунок 3. Строение обратной транскриптазы ВИЧ-1. Отмечены области fingers - «пальцы», palm - «ладонь», thumb - «большой палец», connection – «сустав», а также область с РНазной активностью. Показаны области связывания НИОТ и ННИОТ. Нуклеозидные ингибиторы ОТ (НИОТ) ВИЧ-1. НИОТ явились первыми одобренными FDA лекарственными средствами для лечения ВИЧинфекции и СПИД. По механизму действия они являются терминаторными субстратами. По строению они напоминают природные нуклеозиды. Например, азидотимидин (AZT) имитирует нуклеозид тимидин, в котором 3'ОН заменен на 3'-азидо (N3) группу. Однако для того, чтобы НИОТ были активны необходимо, чтобы НИОТ проник в клетку, подвергся там фосфорилированию клеточными киназами до 5'-трифосфатной формы, связался с полимеразным центром ОТ и только тогда он проявит себя как имитатор субстрата, который мог бы быть включен в вирусную ДНК при помощи вирусной ОТ. После включения НИОТ в растущую цепь ДНК происходит блокирование ее дальнейшей элонгации что приводит к прекращению синтеза ДНК, и как следствие к остановке репродукции вируса. 27 O H3C NH N HO O O N3 AZT, Зидавудин Ненуклеозидные ингибиторы ОТ (ННИОТ) ВИЧ-1. Вторым классом ИОТ являются ННИОТ. Они, в отличие от НИОТ, попадая в клетку, не участвуют в метаболических процессах, обладают заметно меньшей токсичностью, их использование сопровождается минимумом побочных эффектов. ННИОТ ВИЧ-1 являются высокоспецифичными в отношении вирусного фермента ОТ. Они связываются с гидрофобным «карманом» ОТ ВИЧ-1, расположенным в 10 Å от полимеразного сайта фермента и блокируют его активность Известно, что ОТ подвергается конформационным изменениям во время выполнения ею ферментных функций. Такие действия включают связывание РНК, ДНК и 2’-дезоксинуклеозид-5’-трифосфатов, включение нуклеотидов и транслокация субстрата нуклеиновой кислоты и могут влиять на конформацию ОТ. В частности, области «большой палец» и «пальцы» субъединицы р66 двигаются при связывании нуклеиновой кислоты и 2’дезоксинуклеозид-5’-трифосфатов. Гидрофобный карман, благодаря которому ННИОТ связываются с вирусным ферментом, расположен в области «ладонь» субъединицы р66. Этот карман лежит в непосредственной близости с сайтом с полимеразной активностью и основанием области «большой палец» субъединицы р66, который служит в качестве шарнира для движения «большой палец». Этот карман образуется благодаря торсионному вращению боковых цепей Y181 и Y188 и перемещению полипептидных цепей, содержащих W229 и F227. ННИОТ, попадая в гидрофобный карман, блокируют процесс полимеризации или конформационные изменения ОТ, необходимые для процесса катализа. Регион фермента, в котором связываются ННИОТ, динамичен. Гидрофобного кармана не существует, пока ННИОТ не свяжется с ОТ ВИЧ-1. Изменяя свою конформацию ОТ создает гидрофобный карман, который своими размерами «приспосабливается» к размерам ННИОТ. В настоящее время, для клинического применения одобрено пять препаратов принадлежащих к классу ННИОТ. ННИОТ первого поколения: невирапин, делавердин и эфавиренц – чувствительны к развитию лекарственной устойчивости, даже при одной мутации аминокислоты в гидрофобном кармане ОТ. ННИОТ второго поколения: этравирин и рилпивирин – сохраняют противовирусную активность в отношении большинства клинически важных мутантов ВИЧ. Предполагают, что 28 потребуется не менее трех мутации аминокислот в «гидрофобном кармане» ОТ для проявления клинически значимой резистентности. H3C N H3C O H N N CH3 H N SO2CH3 NH CF3 N N N O N O Невирапин N H O Делавердин N H Эфавиренц CN CN Cl CN CN H3C O Br CH3 NH N N NH2 Этравирин H3C HN CH3 NH N N Рилпивирин Рисунок 9. Ненуклеозидные ингибиторы обратной транскриптазы ВИЧ-1. Барьером для развития резистентности к данной группе препаратов, являетсяется высокая конформационная подвижность фрагментов молекулы. Это ведет к тому, что препарат принимает наиболее выгодную конформацию в гидрофобном кармане, что способствует более тесному контакту ННИОТ с вирусным ферментом даже при мутации аминокислот, образующих поверхность сайта связывания ННИОТ. Исследования, связанные с дизайном анти-ВИЧ препаратов привели к открытию нескольких классов соединений, которые потенциально превосходят ННИОТ второго поколения. В частности, компанией GlaxoSmithKline был открыт класс соединений, способные ингибировать не только дикий штамм, но и большинство значимых с клинической точки зрения изоляты вируса. Один из наиболее перспективных соединений – GW678248 – проявил ингибиторные свойства в культуре клеток Н93В в наномолярных концентрациях как в отношении дикого штамма, так и в отношении большинства известных мутантов ВИЧ-1. 29 SO2 NH2 C H3C H O N O Линкер O NC A B Cl Cl GW678248 Компания Merck Research Laboratories открыла целое семейство высокоактивных ингибиторов ОТ ВИЧ-1, который блокировали репродукцию вируса в культуре клеток МТ-4 как дикого штамма ВИЧ-1, так и большинства его мутантных изолятов. Наиболее перспектривным пиразоло[3,4b]пиридином оказался MK-4965. Cl NH2 CN N A O O B NH N Cl MK-4965 Кристаллографические исследования комплексов соединения-ОТ дикого типа и мутантных вариантов ОТ K103N и Y181C показали, что строение комплексов, а также способы связывания ингибитора, практически идентичны и напоминают ранее описанный. Имеют лишь очень тонкие различия в конформации дифенилового эфира (кольца А и В) и отмечены незначительные смещения положения ингибитора в гидрофобном кармане вирусных ферментов. В Y181C мутанте ОТ соединение не взаимодействует с 181 аминокислотным остатком поскольку не имеет с ним каких-либо прямых контактов. Ранее было сделано предположение, что способность ННИОТ к конформациональной подвижности является чрезвычайно важным для их профиля резистентности. Исследования противовирусной активности в клеточной культуре и в отношении ОТ дикого типа и мутантных вариантов соединений данной серии находятся в соответствии с этой гипотезой. Вероятно, что соединения этой группы способны образовывать прямые взаимодействия с полипептидным амидом остатка 103 и способны избегать прямого взаимодействия с Y181, что является важнейшими факторами в 30 установлении ингибиторной активности в отношении мутантных вариантов ВИЧ-1 Ингибиторы интегразы ВИЧ-1 Репликативный цикл ВИЧ-1 условно можно разделить на две фазы. На ранней фазе частицы ВИЧ-1 связываются специфично только с клетками, несущими на поверхности белок CD4, ответственный за иммунное узнавание клетки. Вслед за проникновением вируса в клетку следуют процессы «раздевания» вируса и высвобождения внутриклеточного предтранскрипционного комплекса. Обратная транскрипция геномной РНК осуществляется вирусным ферментом – обратной транскриптазой – в цитоплазме. Результатом этого процесса является получение ДНК-копии вирусной РНК. Эта двухцепочечная вирусная ДНК транспортируется в ядро в составе прединтеграционного комплекса, включающего ряд вирусных и клеточных белков. После транспорта в ядро вирусная ДНК ковалентно встраивается в геном зараженной клетки благодаря каталитической активности вирусного фермента – интегразы. Таким образом, интеграция вирусной ДНК в клеточную является ключевой стадией репликативного цикла ВИЧ. Понятно, что подавление репликации вируса разумно вести на ранних этапах его развития – обратной транскрипции и интеграции, которые осуществляются вирусными ферментами. Направление, связанное с подавлением стадии обратной транскрипции ВИЧ-1, широко развито. На сегодняшний день комплексная терапия, основанная на использовании ингибиторов обратной транскриптазы и другого вирусного фермента – протеазы, рассматривается как наиболее действенная и доступная. Строение интегразы ВИЧ-1 ИН ВИЧ-1 содержит 288 аминокислотных остатков, молекулярная масса фермента составляет 32 кДа. Частичным протеолизом и направленным мутагенезом было показано, что в структуре фермента можно выделить три домена: короткий N-концевой, в состав которого входят аминокислотные остатки с 1 по 50; каталитический, который образуют аминокислотные остатки с 51 по 212; C_концевой, состоящий из аминокислотных остатков с 220 по 270. Найдено, что в состав активного центра фермента входят катионы Mg2+. Ингибиторы ИН способны образовывать комплексы с этими катионами и тем самым блокировать стадию переноса цепи вирусной ДНК (рисунок 4). 31 Рисунок 4. Интеграза ВИЧ-1 Ингибиторы протеазы ВИЧ-1 Во время репликации ВИЧ-1, продукты генов gag и gsg-pol транслируются в полипептиды-предшественники. Эти белки процессируются вирусной протеазой в структурные белки и основные вирусные ферменты: протеаза, обратная транскриптаза и интеграза. Таким образом, ингибирование ПР ВИЧ-1 является важнейшей мишенью химеотерапевтического воздействия на вирус. Известно, что полипептидная цепь содержит амидный фрагмент –NHCO-. Ингибиторы ПР являются пептидомиметиками поскольку содержат в своем составе гидроксиэтиленовую группу (-CH2-CH(OH)-) вместо амидной. Вирусная протеаза не способна расщепить этот фрагмент. Первый ингибитор ПР был одобрен в 1995 г. В настоящее время одобрено для лечения СПИД и ВИЧ-инфекции 9 препаратов – ингибиторов вирусной ПР. Появление ингибиторов ПР и внедрение в клинику высокоактивной антиретровирусной терапии (ВААРТ) ознаменовал начало новой эпохи химиотерапии СПИДа. Использование ВААРТ привело к существенному снижению прогресса СПИДа и значительно сократило смертность от СПИДа в США и других промышленно развитых странах. Однако, несмотря на это несомненный успех, существуют серьезные ограничения существующих схем лечения с использованием ингибиторов ПР. Первое поколение ингибиторов ПР имело плохие фармакокинетические свойства, множественные побочные эффекты и быстрое развитие устойчивости вируса. У ингибиторов ПР второго поколения эти недостатки выражены в значительно меньшей степени. Наличие в клинике большого количества разнообразных по механизму действия анти-ВИЧ-1 препаратов позволило еще в середине 90-х годах ХХ 32 века разработать новый принцип лечения ВИЧ-инфекции и СПИД, который называется высокоактивная антиретровирусная терапия (ВААРТ). Этот метод заключается в приёме трёх или четырёх препаратов, различающихся по механизму действия, одновременно. Благодаря ВААРТ большинство ВИЧинфицированных могут в настоящее время вести нормальный образ жизни. Основная цель ВААРТ состоит в том, чтобы остановить репродукцию вируса в организме. Это позволяет восстановить состояние иммунной системы. Когда вирусная нагрузка резко снижается, организм получает возможность постепенно восстановить количество CD4 лимфоцитов и, соответственно, адекватный иммунный ответ. Это, в свою очередь, позволяет увеличить продолжительность и качество жизни больного. Одной из проблем подавления вируса иммунодефицита человека является его высокая мутагенность. Основой ВААРТ является метод применения нескольких препаратов одновременно для подавления различных стадий репродукции вируса. До разработки ВААРТ использовался лишь один препарат, к которому вирус быстро вырабатывал резистенцию. Комбинация препаратов собирается из трёх или четырёх компонентов. По механизму действия все компоненты делятся на следующие группы: ингибиторы обратной транскриптазы двух видов — нуклеозидные и ненуклеозидные, ингибиторы протеазы, ингибиторы интегразы, ингибиторы слияния. 33 ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ ВИРУСОМ ГЕПАТИТА С Характеристика вируса гепатита С Инфекция вируса гепатита С (ВГС) является глобальной проблемой современного здравоохранения. В настоящее время по приведенным в литературе оценкам ежегодно около 3-4 миллиона человек инфицируются вирусом гепатита С, около 3% мирового населения (180 млн. человек) инфицировано ВГС. У 3–10% инфицированных в течение примерно 20 лет развивается цирроз печени с возможным последующим развитием гепатоцеллюлярной карциномы. Кроме того, с данным вирусом ассоциировано большое количество проявлений, непосредственно не связанных с печенью и затрагивающих кровь (напр. криоглобулинемия), почки (например, гломерулонефрит) и т.п. ВГС-инфекция также является ведущей причиной отторжения органов при трансплантации печени. ВГС представляет собой небольшую частицу, с размером вириона 30-60 нм. ВГС относится к семейству Flaviviridae, к которому также относятся вирус жёлтой лихорадки, вирус Западного Нила, вирус денге, вирус клещевого энцефалита и др. Существует значительное вариации нуклеотидной последовательности распределенных по всему геному вируса гепатита С. Анализ последовательностей РНК многочисленных изолятов ВГС, полученных в различных регионах мира, выявил существование основных групп вируса. Идентифицировано, как минимум, шесть основных генотипов вируса. Кроме того, исследования изолятов ВГС, полученных в Юго-Восточной Азии, позволили дополнительно выявить 5 генотипов (см. рисунок 5). 34 Рисунок 5. Распределение генотипов (60-70% гомологии) и квазивидов (97-98% гомологии). Филогенетический анализ РНК ВГС позволил предположить, что разделение ВГС на генотипы могло произойти от 500 до 2000 лет назад, а разделение генотипа 1 на субтипы 1а и 1б более 300 лет назад. Причем, следует отметить тот факт, что генетическое разнообразие ВГС увеличивается с течением времени и в конечном итоге может привести к появлению более вирулентных или терапевтически резистентных штаммов вируса. Клеточные модели для исследования вируса гепатита С. Основным фактором, ограничивающим исследование вируса гепатита С и его патогенеза в течение долгого времени, является отсутствие адекватных лабораторных моделей развития инфекции. В свою очередь это объясняется тем, что вирус не инфицирует практически никакие лабораторные линии клеток или лабораторных животных. Первая клеточная модель – репликон вируса - была создана в 1999 г. Ее создателями была найдена уникальная линия Huh7 гепатомы человека, которая в состоянии поддерживать репликацию геномной РНК вируса или ее фрагментов. При этом такой способностью обладает лишь ничтожная доля клеток в популяции (впоследствии выделенных и обозначенных как Huh7.5). Более того, в самом геноме вируса для успешной репликации должны появиться некие адаптивные мутации, делающие вирус неинфекционным для человека и шимпанзе. Соответственно, репликоны вируса позволяют изучать лишь центральные стадии его жизненного цикла: репликацию и трансляцию. Полноценная инфекционная клеточная модель развития инфекции была создана в 2005 г на основе обнаруженного незадолго до этого уникального изолята вируса генотипа 2а. Данный изолят был получен от японского больного крайне редкой, фульминантной формой гепатита С, при которой происходит некроз печени уже при острой инфекции, сопровождающийся аномальными показателями аланин-амино-трансферазы, аспартат-аминотрансферазы и других маркеров гепатитов. Данный изолят получил название JFH (Japanese Fulminant Hepatitis). Попытка создания субгеномного и полноразмерного репликона HCV на его основе показала не только резко повышенную эффективность репликации генома в клетках Huh7.5, но и отсутствие необходимости для вируса в выработке адаптивных мутаций для успешной репликации. Более того, в клетках Huh7.5, несущих полноразмерный репликон вируса, наблюдалось и образование полноценных вирионов, которые могли заново инфицировать клетки. Такая инфекционная система получила обозначение HCVcc (cell culture). Несмотря на то, что у исследователей впервые появилась модель, пригодная для исследования различных стадий жизненного цикла вируса, признаются и ее недостатки, связанные с как с необходимостью использования определенного, 35 аномального изолята вируса, так и линии клеток Huh7, которая сильно отличается от нормальных гепатоцитов. Еще до создания инфекционной системы была предложена еще одна модель, предназначенная исключительно для изучения взаимодействия вирионов с клеточными рецепторами. Она была создана на основе лентивирусной системы доставки генов в эукариотические клетки путем замены белков оболочки ВИЧ или широко используемого белка вируса везикулярного стоматита на гликопротеины оболочки HCV. В литературе такая система получила обозначение HCVpp (псевдовирусные частицы HCV). Терапия гепатита С. Рибавирин С момента открытия вируса было предложено множество подходов к терапии хронического гепатита С. До 2011 г лечение было основано на использовании комбинации двух неспецифических агентов: модифицированного интерферона альфа (регулярные инъекции) и нуклеозидного аналога рибавирина (ежедневный пероральный прием). Однако данный вид лечения был малоэффективным, длительным и токсичным. Так, излечение достигалось в зависимости от генотипа вируса лишь у 40-60% больных и сопровождалось побочными эффектами, во многих случаях требующих прекращения терапии. Разработка первого поколения анти-ВГС агентов была сосредоточена на комбинации их с интерферон/рибавирин с целью повысить процент излечения и снижения продолжительности лечения. Так, 2011 г в данную схему были добавлены два ингибитора вирусной протеазы NS3/4 – телапревир и боцепревир, в сочетании с интерферон/рибавирин были одобрены для лечения гепатита С у пациентов с генотипом 1. Обе эти комбинации лечения показали улучшенный вирусингибиторный эффект, сокращение продолжительности лечения и повысить эффективность терапии до 70-75%. Тем не менее, они ограничены в лечении пациентов с генотипом 1, по-прежнему требуют дополнительной терапии интерферон/рибавирином, и сопровождаются дополнительными побочными эффектами, которые требуют медицинского наблюдения. Таким образом, продолжается поиск новых препаратов, которые могут быть объединены с существующими, способные улучшить безопасность и эффективность лечения. Ингибиторы РНК-зависимой РНК полимеразы 36 Одной из привлекательных мишеней для химиотерапевтического воздействия на ВГС-инфекцию является вирусный фермент NS5B РНКзависимая РНК полимераза (RdRp). Это ключевой фермент, который играет важную роль в жизненном цикле ВГС. На основе РНК-матрицы он синтезирует копии РНК. RdRp представляет собой белок массой 66 kDa, состоящий из 590 аминокислотных остатков (рисунок 6). На сегодняшний момент известно два типа ингибиторов RdRp: нуклеозидной природы и ненуклеозидной. Каждый из этих классов имеет свои достоинства и недостатки. Рисунок 6. Структура NS5B РНК-зависимой РНК полимеразы, сайты связывания и активный центр фермента. Нуклеозидные ингибиторы RdRp Важной вехой в создании инструментов для открытия новых препаратов для лечения ВГС-инфекции было создание РНК-конструкта, который называется репликоном. Это позволило моделировать репликацию ВГС в клетках гепатомы человека линии Huh7. Система репликон ВГС оказалась 37 очень удобной, она позволила четко прогнозировать клиническую эффективность препаратов, проходящие доклинические испытания. Система репликон ВГС была использована компанией Roche для скрининга библиотеки нуклеозидных аналогов. Большинство нуклеозидов тестируемых не ингибировали репликацию ВГС в клеточной культуре Huh7. Вероятно, подобные соединения не могут фосфорилироваться, или могут быть метаболически нестабильным, или обладать высокой цитотоксичностью. Тем не менее, была обнаружена группа соединений, которые специфически блокируют репликацию ВГС в системе репликона без влияния на жизнеспособность клеток или клеточную пролиферацию. 4'-Азидоцитидин (R1479) и PSI-6130 были выбраны для дальнейших исследований. NH2 NH2 N N N O O HO N3 N O H3C HO OH OH O OH F R1479 PSI-6130 Однако доклинические исследования показали низкую биодоступность данных соединений. По этой причине для них были разработаны пролекарственные формы. В настоящий момент R1479 в виде балапиравира проходит клинические испытания, а PSI-6130 в виде RG7128 проходит доклинические исследования. NH2 NH2 N O N O O O N3 O N O Балапиравира O N O H3C O O O O O O F RG7128 Механизм действия R1479 и PSI-6130 являются отличными субстратом для клеточных киназ и фосфорилируется до соответствующих 5'-трифосфатов (R1479-ТФ и PSI6130-ТФ). Оба этих 5'-трифосфата являются субстратами для RdRp. Вирусный фермент включает их в растущую цепь вирусной РНК. Ингибирование репликации связано со значительными конформационными изменениями, которые возникают в РНК после включения в нее R1479 и PSI-6130. В результате чего РНК уже не может более реплицироваться. Константа ингибирования Кi для R1479-ТФ составляет 40 ± 25 nМ. 38 Ki для PSI-6130-TP составила 59 ± 11 nМ Ненуклеозидные ингибиторы RdRp Благодаря изучению структуры RdRp обнаружены три аллостерических сайта связывания малых молекул вирусным ферментом. Эти аллостерические сайты находятся в доменах «ладонь» (Palm) и «большой палец» (Thumb). Аллостерические сайт домена «ладонь» является, по сути, одним длинным и глубоким гидрофобный карманом, расположенным рядом с активным центром фермента. Домен «большой палец» имеет два четко определенных аллостерических сайта связывания (см. рис. 6). В 2001 г. в результате широкомасштабного скрининга компанией GlaxoSmithKline был описан первый ингибитор RdRp ненуклеозидной природы, относящийся к классу бензотиадиазинового ряда – 1, который показал 50% защитный эффект в концентрации ИК50 0.2 μM. Дальнейший его дизайн привел к многочисленным аналогам, активность которых лежала в наномолярном диапазоне. Однако к настоящему моменту еще ни один ненуклеозидный ингибитор не прошел стадии доклинических или клинических исследований. Это связано с двумя основными проблемами, одна из которых связана с быстрым развитием резистенции вируса к ненуклеозидным ингибиторам, а другая – с генотипом, от которого также зависит чувствительность вируса к ингибиторам. 1 Ингибиторы протеазы вируса гепатита С Неструктурный белок 3 (или NS3) ВГС является бифункциональным ферментом, состоящим из 631-аминокислотного остатка. N-Концевой домен этого белка проявляет протеазную активность, C-концевой домен – хеликазную активность. Данный фермент «нарезает» полипептид на белки: NS3, RdRp и др. По этой причине данный фермент является отличной мишенью для химиотерапевтического воздействия на ВГС-инфекцию. Однако поиск соединений, блокирующих активность протеазы ВГС, оказалась не простой задачей. Поскольку строение ингибиторов протеазы является сложным, то первое препятствие в решении этой задачи связана со сложностью в изучении закономерностей структура-активность. Кроме того, не было надежной клеточной культуры для оценки эффективности. После 39 внедрения в практику системы репликона ВГС многие трудности были преодолены. ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ, ВЫЗЫВАЕМЫХ ГЕРПЕСВИРУСАМИ Общая характеристика герпесвирусов Герпесвирусы включают в себя большое семейство ДНК-вирусов, инфицирующих большинство, если не все, виды позвоночных. Вирусные частицы имеют около 100 нм в диаметре и состоят из икосаэдрического нуклеокапсида, окруженного внешней липидной мембраной (рисунок 14). Критически важным и характеристическим свойством герпесвирусов является их способность к развитию латентной инфекции, которая играет роль части их жизненного цикла (рисунок 15). Семейство подразделяется на три основные группы, а именно альфа-, бета- и гамма-герпесвирусы. Это подразделение было изначально основано на аспектах их биологии, таких как тропизм к определенным типам клеткок или патологии инфекционного процесса, но в последнее время анализ последовательности дезоксирибонуклеиновой кислоты (ДНК) служит основанием для консолидации этой классификации. В человеческой популяции идентифицировано восемь типов вируса, а именно вирус простого герпеса типа 1 (ВПГ-1), простого герпеса типа 2 (ВПГ2), вирус ветряной оспы-зостер (ВЗВ), вирус Эпштейна-Барра (ВЭБ), цитомегаловируса человека (ЦМВ) и вирусом простого герпеса 6, 7 и 8 (ВПГ6, -7, и -8). Около 70% человеческой популяции заражено ВПГ, который несет ответственность за развитие орального герпеса (обычно ВПГ-1) или генитального герпеса (обычно ВПГ-2). Тем не менее, они также могут быть причиной поражений центральной нервной системы (ЦНС) – различных инфекций, включая энцефалита. Оба вируса (ВПГ-1 и ВПГ-2) способны вызывать латентную инфекцию в тройничных или цервикальных ганглиях соответственно. Первичная инфекция ВЗВ обычно встречается у детей и является причиной ветрянки после чего вирус персистирует в шейном ганглии. Реактивация ВЗВ-инфекции происходит, когда иммунный ответ организмахозяина уменьшается естественным путем из-за старости или из-за иммуносупрессивных состояний. Реактивированный вирус вызывает опоясывающий лишай, изнурительную болезнь, которая в случай пациентов с низким иммунным статусом может быть фатальной. ВЭБ является основной причиной инфекционного мононуклеоза у подростков (обычно с высоким социально-экономическим фоном, у тех, кто бы избежал инфекции в детском возрасте). ВЭБ формирует латентную инфекцию в В-лимфоцитах. ВЭБ-инфекция высоко ассоциирована с двумя формами рака человека: лимфомой Беркитта, наиболее распространенным опухолевым заболеванием среди африканских детей, и карциномой 40 носоглотки, наиболее распространенной опухолью китайских мужчин и второй наиболее распространенной опухоли китайских женщин. Противогерпесные препараты в клинической практике Полимераза герпесвирусов обладает ДНК-зависимой ДНКполимеразной активностью, а также 3’-5’ экзонуклеазной активностью (см. рисунок 7). Подобно другим ДНК-полимеразам, она состоит из доменов, называемых ладонь, пальцы и большой палец, которые вместе осуществляют функцию полимеризации нуклеотидтрифосфатов. Кристаллическая структура ДНК-полимеразы ВПГ-1 установлена, однако строение ее комплекса с ингибиторами до сих пор не описано. Рисунок 7. Строение ДНК-зависимой ДНК-полимеры герпесвирусов Основными антигерпетическими препаратами, применяемыми в настоящее время в клинической практике, являются ингибиторы вирусной ДНК-полимеразы, которые блокируют репликацию вирусной ДНК. Среди ингибиторов вирусной ДНК-полимеразы большинство составляют нуклеозиды, реже нуклеотиды, которые должны пройти этап фосфорилирования для образования активных трифосфатных форм, как собственно противовирусных агентов. Данные трифосфаты являются конкурентными ингибиторами вирусной ДНК-полимеразы, однако, они также способны включаться в цепь вирусной ДНК, предотвращая ее дальнейший рост благодаря своей модифицированной структуре. Именно это последнее свойство представляет собой механизм, с помощью которых нуклеозидные аналоги ингибируют репликацию вируса. 41 К таким препаратам относятся Ацикловир (1), Ганцикловир (2), Фоскарнет (3), Цидофовир (4): O N HO N NH N O O N NH 2 HO O NH N N NH 2 HO 1 2 NH2 N O O OH HO P HO HO P HO O N O O 3 4 ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ, ВЫЗВАННЫХ ВИРУСОМ ГРИППА Характеристика вируса гриппа Грипп – высококонтагиозное инфекционное заболевание, известное с античных времен. Ежегодные эпидемии гриппа затрагивают 10-20% человеческой популяции. В результате насчитывается порядка 3-5 млн. случаев с тяжелым течением заболевания и до 500 тыс. летальных исходов ежегодно. Наиболее массовой из известных является пандемия «испанского гриппа» (H1N1) 1918-1919 гг., когда было заражено порядка 550 млн. человек (29,5% населения планеты), количество погибших оценивается в 20-100 млн. человек (2,7-5,3% населения планеты). К другим крупным вспышкам инфекции относятся: Для «свиного гриппа» 2009 г. характерна высокая вирулентность, но низкая патогенность. Особую тревогу вызывает т.н. «птичий грипп» (штамм А H5N1), впервые зарегистрированный в 2003 г. Он проявил низкую вирулентность (зоонотический характер: передача от домашней птицы человеку), но крайне высокий уровень патогенности (30-59%), и считается наибольшей пандемической опасностью в наше время. Таблица 1. Крупнейшие пандемии, вызванные вирусом гриппа. Пандемия Годы Смерти Летальность Штамм вируса Азиатский грипп 1889–1890 1 млн. 0.15% H3N8 или H2N2 42 Испанский грипп 1918–1920 20 - 100 млн. 2% H1N1 Азиатский грипп 1957–1958 2 млн. 0.13% H2N2 Гонконгский грипп 1968–1969 0.75 - 1 млн. <0.1% H3N2 Свиной грипп 2009–2010 18 000 0.03% H1N1 Строение вириона и цикл репликации вируса гриппа Вирус гриппа является РНК-содержащим вирусом и принадлежит к семейству Orthomyxoviridae. Серологически выделяют вирусы гриппа типов A, B и C. Известно, что грипп типа А инфицирует птиц и некоторых других животных, в то время как тип В распространен только в человеческой популяции. Грипп типа С не обладает существенной патогенностью. Наиболее опасный для человека вирус гриппа А далее классифицируют по антигенным свойствам поверхностный гликопротеинов – гемагглютинина (HA, H1-16) и нейраминидазы, или сиалидазы (NA, N1-9). Наибольшее эпидемиологическое значение имеют варианты вируса, содержащие гемагглютинин типов H1, H2 и H3 и нейраминидазу типов N1 и N2. Кроме гемагглютинина и сиалидазы в липопротеиновую оболочку вириона включен белок М2, представляющий собой ионный канал. Матричные белки М1 соединяют оболочку с восемью рибонуклеопротеинами (РНП) – комплексами вирусной РНК с РНКполимеразой. Репликация вируса инициируется при взаимодействии гемагглютинина со специфическими рецепторами на поверхности эпителиальных клеток дыхательных путей. Вирион проникает в клетку путем эндоцитоза. В кислой среде эндосомы открывается ионный канал М2, протоны проникают в вирион, что ведет к его раздеванию и диссоциации комплексов М1-РНП. Вирусный геном встраивается в ядерный аппарат клетки. После репликации геномная и мРНК мигрируют в цитоплазму, ассоциируются с вирусными белками и клеточной мембраной. После отпочкования дочерние вирионы остаются связанными с наружной клеточной мембраной и слипаются между собой за счет взаимодействия вирусного гемагглютинина с гликопротеинами, захваченными вместе с мембраной клетки-хозяина. Высвобождение вирионов становится возможным после отщепления остатков сиаловой кислоты от клеточных гликопротеинов под действием сиалидазы. Кроме того, она способствует распространению вирионов в слизистом секрете эпителиальных клеток, который богат содержащими сиаловую кислоту макромолекулами. Ингибиторы ионного канала М2 Трансмембранный домен ионного канала М2 является мишенью адамантановых противовирусных препаратов. Амантадин (Symmetrel) был первым специфическим для гриппа противовирусным препаратом и лицензирован в США с 1966 г. для лечения и профилактики гриппа А. Римантадин (Flumadine) получил лицензию в 1993 году. Адамантиламины аллостерически блокируют ионный канал М2, в результате ингибируя раздевание вирионов и высвобождение РНК, что приводит к ингибированию 43 репликации вируса. Эти препараты эффективны только относительно гриппа типа А, т.к. тип В содержит ионные каналы типа NB. Амантадин ингибирует репликацию гриппа в инфицированных клетках MDCK с IC50 от 1,1 до >25 мкМ. Римантадин в 4–10 раз более активен. Оба препарата биодоступны при пероральном и интраназальном введении. Оба одинаково эффективны при условии начала лечения в течение 48 часов после появления симптомов. Большинство исследований показывают снижение оценки симптомов лихорадки в течение 1–2 дней, а также уменьшение выделения вируса. Они также полезны в качестве профилактики, хотя нет никаких убедительных доказательств того, что эти препараты уменьшают частоту и тяжесть осложнений гриппозной инфекции. Способ получения амантадина был запатентован в 1967 г. Он заключается в получении 1-бромадамантана, который при взаимодействии с ацетонитрилом в серной кислоте дает 1-ацетиламиноадамантан, гидролизуемый до 1-адамантиламина – основания амантадина. В 1976 г. было установлено, что вместо 1-бромадамантана может быть использован нитрат 1адамантола. Рисунок 8. Связывание препаратов группы адамантиламинов с ионным каналом М2 44 Ингибиторы сиалидазы Если открытие антивирусных свойств амантадинов было случайным, разработка ингибиторов сиалидазы представляет собой пример успешной реализации рационального структурно-ориентированного подхода. Структура сиалидазы гриппа типа A/N9 и B была расшифрована с помощью рентгеновской кристаллографии в начале 1990-х гг. Сиалидаза, или нейраминидаза, представляет собой гомо-тетрамерный гликозилированный белок. Четыре идентичных протомера соединены в виде квадрата и связаны с оболочкой вириона длинной белковой ножкой. Активный центр расположен в углублении на верхней поверхности каждого протомера. Несмотря на высокую изменчивость нейраминидазы, строение активного центра остается высококонсервативным не только для штаммов гриппа А, но и для гриппа типа В. Это делает данный фермент крайне привлекательной мишенью для действия противовирусных средств. Рисунок 9. Трехмерная модель сиалидазы вируса гриппа Исходной предпосылкой создания ингибиторов фермента было предположение, что соединения, имитирующие конформацию полу-кресла предполагаемого переходного состояния субстрата фермента («сиалозиловый катион»), смогут нарушить его функционирование. В результате был обнаружен неселективный ингибитор фермента – ненасыщенное производное сиаловой кислоты Neu5Ac2en. 45 -9 -10 -6 K 210 K 410 M i Осельтамивир (Tamiflu™) 1999 Занамивир (Relenza™) 1999 Neu5Ac2en i IC 1,310 M M 50 Рисунок 10. Каталитический механизм сиалидазы и разработка ингибиторов фермента Методы компьютерного моделирования позволили в дальнейшем получить более активные и высокоселективные ингибиторы, из которых в настоящее время для клинического использования одобрены два: осельтамивир (Relenza) и занамивир (Tamiflu). Краткая сравнительная характеристика этих препаратов представлена в Таблице 2. Оба препарата применяются как для лечения, так и для профилактики гриппа. Таблица 2. Сравнительная ингибиторов сиалидазы Препарат Спектр Удобство характеристика Занамивир используемых в клинике Осельтамивир Активны в отношении вирусов типа А и В Ингалляционный путь введения – не рекомендуется при склонности к бронхоспазму Биодоступен орально, являясь пролекарством Резистентность Единичные случаи резистентности (A H7N9) Существенная резистентность (в том числе, сезонный и пандемический A H1N1, H5N1) Безопасность Недостаточно изучено воздействие на психику и нейропсихиатрические побочные эффекты Токсические эффекты не выявлены 46 ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИИ, ВЫЗВАННОЙ РЕСПИРАТОРНО-СИНЦИТИАЛЬНЫМ ВИРУСОМ Респираторно-синцитиальный вирус (РСВ) человека является важным респираторным патогенном и вызывает инфекции дыхательных путей. Респираторный синцитиальный вирус является основной причиной инфекций нижних дыхательных путей у новорожденных и детей. Как правило, инфекция ограничивается верхними дыхательными путями и не является длительным патологическим процессом, но прогрессирование к более тяжелым формам инфекции нижних дыхательных путей не является редкостью. Так, вирус является основным возбудителем инфекций нижних дыхательных путей, таких как бронхит и пневмония, у младенцев и маленьких детей. Недоношенные младенцы, младенцы в возрасте до 6 недель или детей с бронхо-легочной дисплазией, врожденным пороком сердца или иммунодефицитом подвергаются особому риску развития тяжелой формы инфекции. Кроме того, тяжелые РСВ инфекции в первый год жизни ребенка является фактором риска развития астмы. Хотя практически все дети инфицируются РСВ по крайней мере раз в возрасте до 2 лет, реинфекция является частым явлением. У здоровых взрослых людей инфекция РСВ обычно вызывает симптомы, похожие на простуды, однако смертность у госпитализированных пожилых лиц или пациентов с пониженным иммунным статусом от РСВ-пневмонии может достигать 20 и 70%, соответственно. От данного вируса не существует вакцины. Профилактические варианты лечения ограничиваются пассивной иммунизации моноклональными антителами. Однако использование антител ограничено и не используется для детей в возрасте до 2 лет в связи с риском побочных эффектов. Терапия противовирусным препаратом рибавирином является единственным вариантом, но его использование ограничено в связи с тем, что препарат применяется в виде аэрозоля что существенно понижает его эффективность. Кроме того, рибавирин имеет ряд серьезных побочных эффектов, в частности, он обладает тератогенностью. Следовательно необходимы эффективные лекарственные средства для лечения в групп риска населения, в том числе взрослых и пожилых людей. РСВ является оболочечным вирус с одноцепочечной (-)-РНК. Он относится к семейству Paramyxoviridae к подсемейству Pneumovirinae. К этому же семейству относятся и другие вирусы, вызывающие респираторные заболевания, например, вирус кори и парагриппа. Для оболочечных вирусов процесс слияния является решающим в проникновении вируса в клетку и ключевую роль в слиянии вируса с клеткой играет белок слияния F. Именно этот белок является хорошей мишенью для химиотерапевтического воздействия на вирус. Благодаря последовательному дизайну различных частей молекулы были синтезированы соединения, некоторые из которых в настоящий момент проходят клинические исследования. Это соединение TMC353121 (Tibotec и Johnson & Johnson), которое было эффективно как на клеточных культурах, 47 так и на моделях на животных. Кроме того, соединение имеет хорошую биодоступность и фармакокинетические свойства. Второе соединение, проходящее в настоящий момент клинические исследования является BMS433771 (Bristol-Myers Squibb). TMC353121 BMS-433771 ПРЕПАРАТЫ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИЙ, ВЫЗВАННЫХ ВИРУСОМ ГЕПАТИТА В Вирус гепатита B (ВГВ) это ДНК-содержащий вирус из семейства гепаднавирусов. Выделяют 8 генотипов вируса: A, B, C, D, E, F, G и H. Различия между генотипами составляют более 8 %. Генотипы A и D распространены повсеместно; генотипы C и B характерны для Юго-Восточной Азии и Японии. Генотип Е распространен преимущественно в Африке. Генотип F был найден среди коренного населения Южной Америки и на Аляске. Генотип G спорадически встречается в различных частях света, в частности в Соединенных Штатах Америки и во Франции. Генотипы Е и G характеризуются низкой вариабельностью в последовательности нуклеотидов в геноме, по сравнению с другими генотипами. Генотипы вируса гепатита В могут обладать различными биологическими свойствами. В последнее время все большое значение придаётся генотипу вируса в клинических аспектах течения вирусной инфекции, а также чувствительности к антивирусным препаратам. На сегодняшний день установлено, что инфекция, вызванная вирусом гепатита В генотипов В и С, коррелирует с повреждением печени; а инфекция, обусловленная вирусом гепатита В генотипа А, эффективно излечивается терапевтическими методами с использованием интерферона Вирион ВГВ состоит из нуклеопротеина, капсида и суперкапсида. Капсид — икосаэдр размером 28 нм, внутри которого заключена ДНК вируса (нуклеопротеин). В состав капсида входит основной белок ядра (HBcAg — от «Hepatitis B core Antigen»). Суперкапсид представляет собой липидную мембрану, в которую встроены белки наружной оболочки — поверхностные антигены L, S и M (L-, S- и M-HBsAg — от «Hepatitis B surface Antigen»). Диаметр вирусной частицы — 30-42 нм 48 Первый протокол лечения хронической ВГВ инфекции был основан на использовании интерферона α-2b. У значительного числа пациентов было достигнуто снижение уровня HBeAg в крови после 16-недельного курса подкожных инъекций. Однако лечение интерфероном было связано с широким спектром побочных эффектов, таких как гриппоподобные симптомы, усталость, отсутствие аппетита и потеря веса. В 1998 году ламивудин стал первым нуклеозидным аналогом , который был одобрен для лечения хронической ВГВ инфекции. Клинические исследования показали наличие гистологических улучшений клеток и подавление репликации ДНК ВГВ. Однако при этом было обнаружено появление резистенции вируса к ламивудину у 70% пациентов через 5 лет после начала терапии. В 2002 г. был одобрен адефовир для лечения HBeAg-позитивных и HBeAg-негативных пациентов с хронической ВГВ инфекцией. Устойчивость вируса к адефовиру развивается более медленными темпами, чем к ламивудин. Через пять лет терапии наличие резистенции отмечено у 29% пациентов с с хронической ВГВ инфекцией. 2005 г. был одобрен энтекавир, а затем в 2006 г – телбивудин и в 2008 г. тенофовир. O O N N NH N HO NH2 CH3 HN O N O OH Энтекавир OH OH Телбивудин Тенофовир Несколько последних достижений в области изучения хронической ВГВ инфекции привели к более глубокому пониманию природы этого состояния. Введение чувствительной полимеразной цепной реакции для обнаружения ДНК ВГВ показало, что многие пациенты, у которых ранее считалось имеется неактивная форма хронической ВГВ инфекции, на самом деле имеют определяемые уровни репликации ВГВ. В связи с этим были внесены существенные изменения в подходах в лечении хронической ВГВ инфекции. В результате лекарственной интервенции начинает проводиться на ранних бессимптомных стадиях заболевания что заметно снижает риск возникновения цирроза печени и гепатоцеллюлярной карциномы. Открытие энтекавира было сделано фармацевтической компанией Bristol-Myers Squibb (BMS) в результате в результате широкомасштабного скрининга разнообразных нуклеозидных аналогов. Изначально внимание ВМS фокусировалось на поиске ингибиторов репродукции вирусов семейства Herpesviridae, в частности, в отношении вируса герпес простого типа 1 и 2, вируса вариселлы-зостер и цитомегаловируса. Было признано, с самого начала, что аналоги нуклеозидов обладают потенциалом ингибировать значительно больший спектр патогенных вирусов. Было обнаружено, что 49 соединения способны ингибировать репродукцию не только герпесвирусов, но и другие вирусы, включая вирус иммунодефицита человека типа 1, вирус гепатита С и ВГВ. Таблица 3. Анти-ВГВ активность энтекавира и его аналогов в культуре клеток гепатоцитов ЕС50 (µМ) Соединение O N NH N N NH2 HO 0.003 OH Энтекавир NH2 N N N N HO 0.13 OH O H3 C NH N O > 100 HO OH O I NH N HO OH O 10 50 ТЕМАТИЧЕСКИЙ ПЛАН ЛЕКЦИЙ по дисциплине ФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ для студентов 3 курса фармацевтического факультета заочной формы обучения (6 семестр) № 1 2 3 Кол-во часов Тема Вирусы, классификация, жизненный цикл, место заболеваний вирусной этиологии в современной медицине. История открытия противовирусных средств. Принципы современной противовирусной терапии. Проблемы терапии – причины поиска новых ПВ средств. История открытия ПВ ЛС. Характеристика семейства ретровиридае. ВИЧ. Жизненный цикл вируса. Ингибиторы слияния. Обратная транскриптаза ВИЧ, её функции. Ингибиторы ОТ. Всего лекционных часов 2 1 3 ТЕМАТИЧЕСКИЙ ПЛАН ПРАКТИЧЕСКИХ ЗАНЯТИЙ по дисциплине ФАРМАЦЕВТИЧЕСКИЙ АНАЛИЗ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ для студентов 3 курса фармацевтического факультета заочной формы обучения (6 семестр) № 1 Тема Форма проведения Вирусы, классификация, жизненный цикл, Лаборатономесто заболеваний вирусной этиологии в практическо современной медицине. История открытия е занятие противовирусных средств. Принципы современной противовирус-ной терапии. Проблемы терапии – причины поиска новых ПВ средств. Классификация ПВ препаратов. Кол-во часов 2 51 2 3 4 Характеристика семейства лентивиридае. ВИЧ. Жизненный цикл вируса. Ингибиторы слияния, ингибиторы ОТ. Ингибиторы интегразы ВИЧ. Функции интегразы ВИЧ. Ингибиторы протеазы ВИЧ. Функции протеазы ВИЧ-1. Зачётное занятие. Лаборатонопрактическо е занятие Лаборатонопрактическо е занятие Лаборатонопрактическо е занятие Всего аудиторных часов 2 2 1 7 ВОПРОСЫ К ЗАЧЕТНОМУ ЗАНЯТИЮ 1. Что такое вирус. 2. Строение вириона (два типа). 3. Классификация вирусов по Балтимору. 4. Основные этапы жизненного цикла вирусов. 5. Теории происхождения вирусов. 6. Способы распространения вирусов. 7. История открытий противовирусных лекарственных средств. 8. Основные причины поиска новых ингибиторов вирусной репродукции. 9.Характеристика семейства Retroviridae и вируса иммунодефицита человека. 10. Жизненный цикл ВИЧ-1. 11. Вход ВИЧ-1 в клетку-мишень: краткое описание процесса. 12. Ингибиторы прикрепления ВИЧ-1 к клетке-мишени. 13. Ингибиторы связывания ВИЧ-1 с со-рецепторами ССR5 и CXCR4 и ингибиторы слияния. 14.Характеристика обратной транскриптазы ВИЧ-1 как мишени для химеотерапевтического воздействия на вирус. 15. Классы ингибиторов ОТ ВИЧ-1. 16. Нуклеозидные ингибиторы ОТ (НИОТ) ВИЧ-1: механизм действия. 17. Никавир. Преимущества перед зидовудином (AZT). 18. Ненуклеозидные ингибиторы ОТ (ННИОТ) ВИЧ-1: механизм действия. 19. Отличие 1-го поколения ННИОТ от 2-го поколения. 20. Недостатки НИОТ и ННИОТ. 21. ННИОТ, находящиеся на стадии клинических испытаний. 22. Характеристика процесса интеграции провирусной ДНК к ДНК клеткихозяина. Интеграза как мишень для блокирования репродукции вируса. 23. Ингибиторы интегразы. 24. Ингибиторы протеазы ВИЧ-1: 1-е и 2-е поколение. 25. Недостатки использования ингибиторов протеазы ВИЧ-1. 26. ВААРТ. Сущность, цель, недостатки. 27. Характеристика семейства Flaviviridae и вируса гепатита С. 52 28. Генотип вируса гепатита С. 29. На чем основаны современные протоколы терапии, используемые для лечения ВГС-инфекции? Недостатки. 30. Ингибиторы РНК-зависимой РНК полимеразы. Механизм действия. 31. Ингибиторы протеазы вируса гепатита С. 32. Характеристика семейства Herpesviridae. 33.Полимераза герпесвирусов как мишень химиотерапевтического воздействия. 34. Ацикловир. Механизм действия. 35. Валацикловир. Механизм действия. Пролекарственная форма. 36. Фамцикловир и пенцикловир. Механизм действия. 37. Ганцикловир. Механизм действия. Пролекарственная форма. 38. Цидофовир. Механизм действия. Пролекарственная форма. 39. Фоскарнет. Механизм действия. Аналоги. 40.Нуклеозидные аналоги, используемые в клинике для лечения герпесвирусных инфекций. 41. Характеристика семейству Orthomyxoviridae и вируса гриппа. 42. Строение вириона гриппа. 43. Жизненный цикл вируса гриппа. 44. Понятие об антигенного сдвига вируса гриппа. 45.Ингибиторы ионного канала М2 вируса гриппа (Амантадин и ремантадин). 46. Схема синтеза амантадина. 47. Схема синтеза ремантадина. 48. Недостатки в использовании амантадина и ремантадина. 49. Сиалидаза. Ингибиторы сиалидазы: Занамивир и Осельтамивир. 50. Характеристика семейства Paramyxoviridae и респираторно-синцитиального вируса. 51. Характеристика вируса гепатита B и его строение. 52. Характеристика инфекции гепатита В. 53. Препараты, применяемые для лечения хронической инфекции гепатита В. 54. Энтекавир. Механизм действия. 53 СПИСОК ЛИТЕРАТУРЫ ОСНОВНАЯ ЛИТЕРАТУРА 1. Беликов, В. Г. Фармацевтическая химия : учеб. пособие / В. Г. Беликов 4-е изд., перераб. и доп. - М. : МЕДпресс-информ, 2007. - 622 с. 2. Государственная фармакопея Российской Федерации / МЗ и СР РФ,ФА по здрав. и СР, Фед. служба по надзору в сфере здрав. и СР,ФГУ "НЦ эксперт. средств мед. применения "Росздравнадзора". - ХII-е изд. - М.: НЦ эксперт. средств мед. применения, 2008. – 696 с.:ил. - Ч.1. - 2007. 696 с. ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА 1. Петров В.И., Белан Э.Б. Противовирусные средства / М.: ГЭОТАРМедиа, 2012. – 244. (серия «Библиотека врача специалиста») 2. Ершов Ф.И. Антивирусные препараты / Ф.И. Ершов. – М. : ГЭОТАРМедиа, 2006. - 306 с. 3. Букринская, А.Г. Вирусология / А.Г. Букринская. – М.: Медицина, 1986. – 336 с. : ил. 4. Коротяев, А. И. Медицинская микробиология, иммунология и вирусология : учебник для мед. вузов / А. И. Коротяев, С. А. Бабичев. СПб. : СпецЛит, 2010. - 5-е изд., испр. и доп. - 760 с. : ил. – [электронный ресурс]. – Режим доступа: studmedlib.ru 5. Медицинская микробиология, вирусология и иммунология: том 2 : учебник / Под ред. В.В. Зверева, М.Н. Бойченко. - М. : ГЭОТАР-Медиа, 2010. – [электронный ресурс]. – Режим доступа: studmedlib.ru 6. Медицинская микробиология, вирусология и иммунология: учебник. В 2-х томах. Том 1. / Под ред. В.В. Зверева, М.Н. Бойченко. 2011. - 448 с.: ил. – [электронный ресурс]. – Режим доступа: studmedlib.ru