Физико-химические основы действия ИИ. взаимодействия
реклама
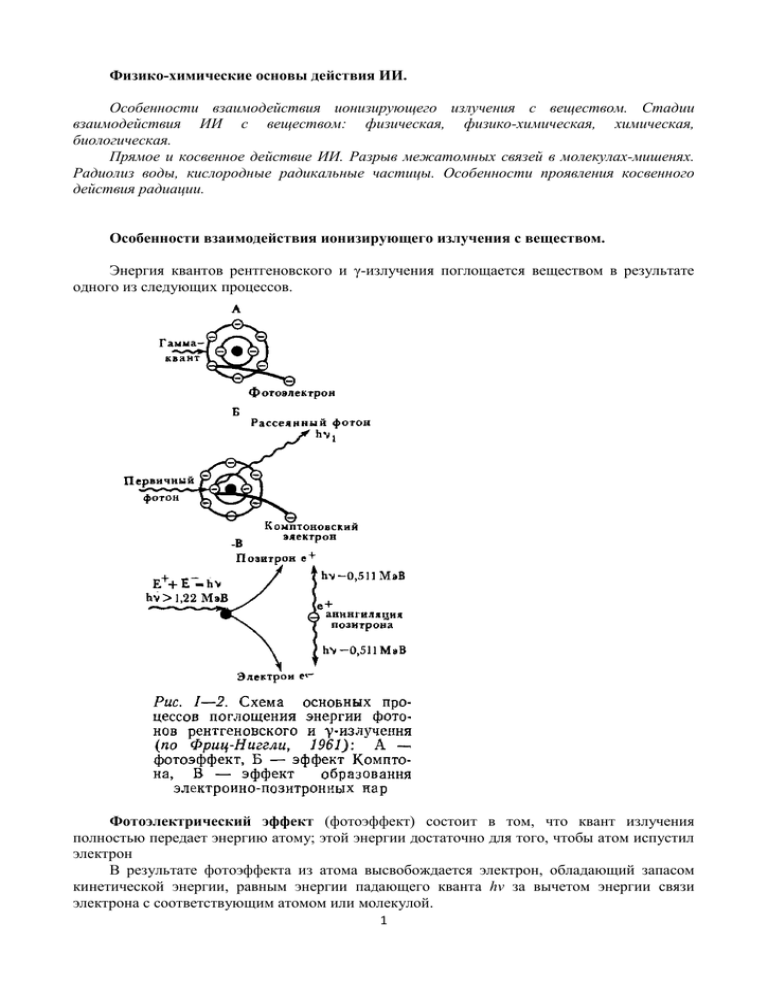
Физико-химические основы действия ИИ. Особенности взаимодействия ионизирующего излучения с веществом. Стадии взаимодействия ИИ с веществом: физическая, физико-химическая, химическая, биологическая. Прямое и косвенное действие ИИ. Разрыв межатомных связей в молекулах-мишенях. Радиолиз воды, кислородные радикальные частицы. Особенности проявления косвенного действия радиации. Особенности взаимодействия ионизирующего излучения с веществом. Энергия квантов рентгеновского и γ-излучения поглощается веществом в результате одного из следующих процессов. Фотоэлектрический эффект (фотоэффект) состоит в том, что квант излучения полностью передает энергию атому; этой энергии достаточно для того, чтобы атом испустил электрон В результате фотоэффекта из атома высвобождается электрон, обладающий запасом кинетической энергии, равным энергии падающего кванта hv за вычетом энергии связи электрона с соответствующим атомом или молекулой. 1 Эффект Комптона можно рассматривать как результат упругого соударения кванта излучения со свободным электроном. При этом квант отдает электрону не всю энергию, а лишь некоторую ее часть, причем сам он продолжает движение в качестве рассеянного кванта в новом направлении и с меньшей энергией. В отличие от фотоэлектрона комптонэлектрон (его еще называют электроном отдачи) приобретает не всю энергию первичного кванта. В воде и биологических тканях поглощение излучения с энергией квантов более 300 кэВ в основном происходит за счет эффекта Комптона. В результате нескольких последовательных комптоновских взаимодействий энергия кванта снижается настолько, что он уже может полностью поглотиться в результате фотоэффекта. Если энергия падающего кванта превышает 1,022 МэВ, становится возможным третий тип взаимодействия — эффект образования пар. Электронно-позитронные пары возникают в результате взаимодействия кванта излучения с ядерными полями. Квант высокой энергии, приближаясь к полю ядра атома, исчезает, и одновременно возникает пара элементарных частиц позитрон—электрон Вся энергия падающего кванта используется на образование пары, причем энергия, равная 1,022 МэВ, всегда преобразуется в «массу покоя» элементарных частиц, а остаток — в их кинетическую энергию. Облучение тканей косвенно ионизирующими частицами, в конечном счете, заканчивается появлением заряженных частиц: фотоны рентгеновского и γ-излучения высвобождают в тканях высокоэнергетические электроны, нейтроны вызывают появление в тканях протонов отдачи, а-частиц и ядер других элементов. Все эти заряженные частицы обладают значительной энергией и способны многократно вызывать ионизацию я возбуждение атомов и молекул. Особенности взаимодействия заряженных частиц с веществом. Ускоренные заряженные частицы, которыми облучают ткани, вызывают возбуждение и ионизацию атомов точно так же, как и те заряженные частицы, которые высвобождаются нейтронами или фотонами рентгеновского и у-излучения (различие, естественно, связано с неодинаковой энергией и зарядом высвобождающихся в каждом отдельном случае ионизирующих частиц). Важно знать, как зависит ионизирующая способность заряженных частиц от величины их энергии, от массы и величины заряда, который они несут. Ускоренную заряженную частицу можно рассматривать как перемещающийся в пространстве источник электрического поля. За счет взаимодействия электрического поля частицы с полем орбитального электрона последний приобретает определенный запас энергии. Если заряженная частица пролетает достаточно близко от орбитального электрона, то перенесенной энергий достаточно для ионизации: электрон отрывается от соответствующего атома или молекулы, и в результате образуются положительно заряженный ион и свободный электрон. Если же частица значительно удалена от электронных оболочек, то электрон приобретает запас энергии, недостаточный для ионизации, и переходит на более удаленную энергетическую орбиту в состоянии возбуждения. Такая схема, основанная на принципе упругого и неупругого соударений, еще не позволяет определить зависимость характера поглощения энергии ускоренной заряженной частицы от ее параметров — заряда, массы, скорости. Для медленной частицы это поле существует длительное время, для быстрой оно сначала резко возрастает, а затем быстро уменьшается. Значит, медленная частица будет вызывать возмущение в атоме в течение длительного времени и передаст ему гораздо больше энергии, чем быстрая частица. 2 Модель, поясняющая характер взаимодействия ускоренных заряженных частиц с атомом (по Дертингеру и Юнгу): А — частица проходит через некоторую совокупность атомов, производя несколько ионизации и возбуждений; Б — атом и частица, проходящая мимо него; В — зависимость величины поля, создаваемого в атоме быстрой заряженной частицей, от положения частицы; Г — зависимость того же поля от времени Рассмотрение такой модели позволяет сформулировать ряд следствий, к которым приведет наложение на атом дополнительного поля заряженной частицы: 1 — действие поля ускоренной частицы вызывает временное возмущение каждого атома, вблизи которого эта частица проходит; 2 — это возмущение существует тем дольше, чем медленнее движется частица; 3 — частицы, несущие несколько зарядов, вносят большее возмущение, чем однозарядные; 4 — величина массы движущейся частицы не влияет на количество перенесенной энергии, т. е. при равных скоростях электроны и протоны переносят веществу одинаковое количество энергии, хотя массы их различаются почти в две тысячи раз. Большая часть энергии тяжелой заряженной частицы переносится к вторичным электронам, «малыми порциями», т. е. образуются свободные электроны с энергией менее 100 эВ. Вызванная ими ионизация происходит в непосредственной близости от места первичной ионизации, на расстоянии порядка нескольких десятков нанометров от трека частицы. Таким образом, в относительно небольшом объеме вдоль трека частицы возникает некоторое число пар ионов (положительные ионы и электроны), порожденных первичной ионизацией и вторичными электронами с энергией менее 100 эВ. Эти скопления получили название «рой ионов», они и формируют трек частицы. Термины «первичная ионизация», «рой ионов» и «событие потери энергии» можно считать эквивалентными. 3 Стадии взаимодействия ИИ с веществом: физическая, физико-химическая, химическая, биологическая. В течение физико-химической стадии поглощенная молекулами энергия реализуется разрывами химических связей и образованием свободных радикалов, которые характеризуются наличием неспаренного электрона, что является причиной их чрезвычайно высокой химической активности. Как уже говорилось, в живых системах около 75% энергии излучения поглощается водой. В результате этого образуются продукты радиолиза воды: Н2О + hv = H2O* = Н* + НО*; Н2О + hv = H2O + е--. Содержание физической стадии составляют процессы поглощения энергии и образования ионизированных и возбужденных молекул. В облученной клетке возбужденными и ионизированными могут в равной степени оказаться белки и углеводы, нуклеиновые кислоты и липиды, молекулы воды и различных низкомолекулярных органических и неорганических соединений. В живых клетках органическими и неорганическими (кроме воды) молекулами поглощается около 25% энергии, а водой - 75%. Процессы, протекающие на физической стадии, осуществляются в течение короткого времени - 10-16-10-15 с. Они завершаются образованием возбужденных и ионизированных молекул. Н2О + е- = Н2О = Н*+ ОН*; Н2О = Н+ + ОН*; е- + Н+ = Н*; Н2О + ОН- = Н2О + ОН*; Н2О + Н2О = Н3О + ОН*; Н2О + е- = Н2О + Н*. Химическая стадия. Во время химической стадии, образовавшиеся ранее высокоактивные свободные радикалы, вступают в реакции между собой и с интактными молекулами, в результате чего возникают разнообразные повреждения молекул. Продолжительность химической стадии составляет 10-6-10-3 с. 4 Прямое и косвенное действие ИИ. Разрыв межатомных связей в молекулахмишенях. Радиолиз воды, кислородные радикальные частицы. Особенности проявления косвенного действия радиации. Ионизация атомов и молекул является только первым «актом драмы», разыгрывающейся в клетке. В радиобиологии его рассматривают как «прямое» действие радиации. Его результатом является изменение макромолекул, в первую очередь такой громадной структуры, как ДНК, а также образование нескольких высокореакционных продуктов из молекул воды, составляющей основную (80—90% вещества) массу клетки. Продукты радиолиза воды реагируют как между собой, так и с органическими компонентами клетки, приводя к разрушению их молекулы. Этот путь лучевого поражения жизненно-важных структур клетки носит в радиобиологии название косвенного механизма действия излучения. Итак, под прямым действием понимают такие изменения, которые возникают в результате утери или приобретения электрона самими рассматриваемыми молекулами («мишенями»). Под косвенным действием понимают изменения этих мишеней, вызванные продуктами радиационного разложения (радиолиза) окружающей эти молекулы воды и растворенных в ней низкомолекулярных соединений, а не энергией излучения, поглощенной самими исследуемыми молекулами К химически высокореактивным продуктам, образовавшимся на физико-химической стадии, относятся, прежде всего, радикалы ОН* и Н* и гидратированный электрон (егидр). Так, гидратированный электрон способен присоединяться к органическим молекулам с образованием анион-радикала R, который характеризуется относительно высокой стабильностью. При воздействии продуктов радиолиза воды на аминокислоты, белки, углеводы, нуклеотиды, ДНК, фосфолипиды могут образовываться радикалы растворенных веществ. В частности, при взаимодействии биомолекул с гидроксильным радикалом НО* происходит отщепление водорода от органического вещества: RH + ОН* = R* + Н2О или, при наличии двойных ненасыщенных связей в веществе, их разрыв: R1HC=CHR2 + ОН* = R1HC*(ОН)-CHR2*. В результате реакций с участием ОН образуются нестабильные продукты, включая радикалы с большой реакционной способностью. При взаимодействии с органическими веществами радикала водорода Н * происходит отщепление водорода: RH + Н * = R*+ H2, а при наличии свободной аминогруппы все завершается дезаминированием: RNH2 + Н * = R* + NH3. Образующиеся в результате как прямого, так и непрямого действия радиации органические радикалы обладают высокой реакционной способностью. Они могут вступать в реакции: гидроксилирования - R* + OH = ROH; гидрирования - R* + H = RH; образования гидроперекисных радикалов - R* + O2 = ROO*; ROO* + RH = ROOH + R*. Соединяясь с кислородом, органические радикалы образуют пероксидные радикалы типа RO2, которые, в свою очередь, могут переходить в гидроперекиси, отщепляя водород от других соединений: RO2 + RSH = ROOH+ RS *. Органические радикалы, вступая в разнообразные реакции, чаще всего инактивируются. Однако образовавшийся в результате облучения свободный радикал может прореагировать с нормальным радикалом, участвующим в важной ферментативной реакции, и инактивировать его. В этом случае повреждающее действие радикалов может быть связано с ингибированием соответствующей реакции. 5 Лекция 11. Биологические эффекты ИИ, воздействие на биополимеры. Действие ИИ на живые объекты. Теория мишени и попаданий. Радиационная гибель. Стохастический механизм радиационного поражения. Воздействие на различные биополимеры. Радиационное повреждение ДНК. Репарация ДНК. Мутагенное воздействие ИИ впервые установили отечественные ученые Г.А. Надсон и Г.С. Филиппов в 1925 г. в опытах на дрожжах. В 1927 году это открытие было подтверждено Г. Меллером на классическом генетическом объекте - дрозофиле. ИИ способны вызывать все виды наследственных изменений - генные, хромосомные, геномные. Эти изменения носят дозозависимый характер и современными представлениями считается, что любая дополнительная выше природного радиационного фона (ПРФ) доза ИИ, независимо от величины и мощности приводит к опасности кумулятивного генетического эффекта и способна вызвать генетические изменения, поскольку биологическая репарация мутации невозможна. Таким образом, прямое и косвенное действие ионизирующего излучения на биологические молекулы приводит к тому, что в живом организме отмечается много разных биологических эффектов, которые представлены в таблице Тип биологической Важнейшие радиационные эффекты организации Молекулярный Повреждение макромолекул - ферментов, РНК, ДНК, воздействие на обменные процессы Субклеточный Повреждение клеточных мембран, ядер, хромосом митохондрий и лизосом, высвобождение их ферментов Клеточный Нарушения деления клеток, их гибель и трансформация, в т.ч. злокачественная Ткани, органы Нарушения в красном костном мозге, желудочно-кишечном тракте, центральной нервной системе могут привести к радиационным повреждениям и гибели, отдаленным последствиям Организм Различные виды радиационных последствий, вплоть до летального исхода Популяции Изменение генетических характеристик вследствие генных, хромосомных мутаций у индивидуумов Теория мишени и попаданий. В стремлении объяснить радиобиологический парадокс уже на заре радиобиологии были сформулированы два принципа, лежащие в основе, так называемой теории мишени. Первый из них — принцип попаданий — характеризует особенности действующего агента — дискретность поглощения энергии и вероятностный характер «попадания»; второй — принцип мишени — характеризует важную особенность облучаемого объекта — клетки, ее высокую структурированность и гетерогенность в морфологическом и функциональном отношениях. В начале 20-х годов Ф. Дессауэр предположил, что большой биологический эффект при ничтожном суммарном поглощении энергии объясняется тем, что она концентрируется в крайне малых объемах, приводя их к микролокальному разогреву; отсюда и название предложенной им гипотезы — гипотеза точечного тепла. 6 Учитывая наличие в клетке более важных и менее существенных для жизни структур и микрообъемов, а также случайное распределение «точечного тепла», Ф. Дессауэр пришел к выводу о том, что исход клеточной реакции зависит от вероятности случайных попаданий дискретных порций энергии именно в эти жизненно важные микрообъемы — мишени. Стохастический механизм радиационного поражения. Если при анализе зависимости эффекта от дозы принять в качестве регистрируемой реакции долю пораженных объектов, то легко обнаружить две специфические черты действия ионизирующих излучений. 1. Большинство клеточных реакций протекает практически при отсутствии порога, с нарастанием эффекта при увеличении дозы. 2. С повышением дозы кривые выживания отражают не столько степень проявления эффекта у отдельных клеток, сколько увеличение количества (доли) пораженных единиц, т. е. возрастание вероятности проявления регистрируемой реакции. Иными словами, летальный эффект ионизирующих излучений имеет вероятностный характер вследствие случайного распределения элементарных актов первичного взаимодействия частиц с чувствительными объемами облученных объектов. Исходя из принципов классической теории мишени, количество попаданий должно быть прямо пропорциональным дозе излучения. Поэтому в определенном диапазоне малых доз число пораженных мишеней строго пропорционально дозе, или числу попаданий, так как поражается лишь небольшая их часть из общего количества, в связи с чем зависимость эффекта от дозы имеет вид прямой линии, с повышением дозы излучения вероятность попадания в одну и ту же мишень увеличивается, и хотя общее число попаданий остается пропорциональным дозе, их эффективность (на единицу дозы) уменьшается, количество пораженных мишеней возрастает медленнее, асимптотически приближаясь к 100%. 7 Зависимость биологического эффекта or дозы облучения: А — гибель инфузорий Colpidium colpoda через 2 часа после облучения (Кроутер, 1926), Б — гибель яиц аскариды после облучения в аэробных условиях (Браун, Хольтузен, 1929), В — инактивация вируса табачной мозаики γ-лучами (Ли, Смит, 1940), Г — инактивация сухой рибонуклеазы (Ли др., 1944) Отсутствие нижнего порога на кривой «доза—эффект» означает, что в пределах генетически однородной популяции существуют объекты, которые гибнут при самых малых дозах, тогда как другие выживают при действии огромных доз облучения. Естественная вариабельность (минимальная для клеток одного клона) не может служить причиной этого эффекта. Разнообразны объекты, различны диапазоны использованных доз излучения, но во всех случаях наблюдается интересная закономерность: при самых малых дозах облучения уже обнаруживаются инактивированные клетки, вирусные частицы или макромолекулы (все кривые надежно экстраполируются к нулевой точке), а при дозах, в сотни и тысячи раз больших, все еще удается обнаружить объекты, сохранившие исходные биологические свойства, т. е. не пораженные излучением. Представим, что эта же система (суспензия клеток, препарат вирусных частиц или макромолекул) получает энергию иным путем, например за счет нагревания от какого-либо источника тепла. В этом случае кривая «доза—эффект» примет иной вид. Вплоть до некоторой температуры не обнаруживаются инактивированные объекты, после этой пороговой температуры число пораженных объектов возрастает до максимального значения, и, если процесс термоинактивации необратим, при достижении некоторой температуры мы не обнаружим ни одного вируса, макромолекулы и тем более клетки, оставшихся непораженными. Таким образом, решающее влияние оказывают не особенности объектов, а способ сообщения энергии. Воздействие на различные биополимеры. При каждом акте взаимодействия к атому или молекуле переносится такая дискретная порция энергии, которая может заведомо привести к разрыву любой химической связи. Поэтому можно было рассматривать каждый акт такого одиночного переноса энергии как событие попадания, приводящее к поражению определенной структуры. Акты попадания статистически распределяются по всей облучаемой системе, так же статистически будут распределены микрообъемы, поврежденные излучением. В результате облучения макромолекул их биологические функции могут полностью или частично утрачиваться. В этом случае говорят об инактивации макромолекул ионизирующей радиацией. Инактивация макромолекулы может произойти вследствие прямого и опосредованного действия ионизирующего излучения. Прямое действие состоит в том, что инактивированными оказываются те молекулы, которые непосредственно поглотили энергию излучения. Если молекула была поражена активными реакционноспособными продуктами, возникшими за счет поглощения энергии излучения ее окружением, то говорят о непрямом действии радиации. Определенные типы структурных повреждений, например разрушение ряда аминокислотных остатков в белковой молекуле иди нуклеотидов в молекуле ДНК, влекут за собой изменения функциональных свойств соответствующих макромолекул. Прямое действие ионизирующей радиации на макромолекулы исследуют на обезвоженных или кристаллических препаратах ферментов и нуклеиновых кислот. В этом случае большинство молекул инактивируются в результате прямого поглощения энергии излучения. Обычно в качестве критерия радиочувствительности выбирают такую же дозу излучения, которая необходима для инактивации 63% молекул в облученном препарате фермента. Так как при этом 37% молекул сохраняют нативные свойства, эта доза получила название «доза 37%-ной сохранности», или доза D37. 8 К наиболее биологически значимым повреждениям должны быть отнесены в первую очередь нарушения структуры ДНК. Аналогичные радиационно-химические изменения наблюдаются и в облученной РНК. Разница состоит лишь в том, что в РНК, в связи с ее однонитчатой структурой, не может быть двунитевых разрывов. Не менее значимыми для жизнедеятельности клетки являются и вызванные прямым или непрямым действием радиации повреждения белка. В белковых молекулах участками, в которых чаще всего реализуется поглощенная энергия, являются тиоловые и дисульфидные группировки, а также аминокислоты, содержащие спаренные циклы (триптофан, фенилаланин, тирозин). В результате, хотя все аминокислоты поглощают энергию облучения с равной вероятностью, в конце физико-химической стадии некоторые из них оказываются избирательно пораженными. Образующиеся в присутствии кислорода и воды свободные радикалы могут приводить к разрыву пептидной связи, образованию амида, кетокислоты и гидроперекисного радикала. Все это приводит к нарушению структуры белка: разрыву дисульфидных мостиков, водородных связей, пептидной цепи, образованию сшивок между пептидными цепями, отщеплению аммиака, сероводорода, окислению сульфгидрильных групп и ароматических аминокислот, к конформационным изменениям вторичной и третичной структуры белка. В частности, возникают реакции окисления белковых SH-групп, которые нередко протекают по цепному механизму с образованием дисульфидов: R-SH + НО* — R-S* + Н2О; R-SH + HO2 — R-S* + Н2О2; Продукты перекисного окисления ненасыщенных жирных кислот вследствие обнаруженных у них радиомиметических свойств (способность вызывать разрывы цепей ДНК, возникновение хромосомных аберраций, подавление репарации повреждений ДНК) получили наименование первичных или липидных радиотоксинов, и им отводится существенная роль в дальнейшем развитии лучевого поражения клетки. К первичным радиотоксинам относят также обнаруживаемые в облучаемых клетках хиноны и семихиноны - продукты окисления фенолов. Изменения структуры углеводов наблюдаются преимущественно при воздействии высоких доз ионизирующих излучений. Они сводятся к деполимеризации и окислению полисахаридов, что приводит к распаду углеводородной цепи и образованию кислоты формальдегида. Радиационно-химические повреждения структуры белка могут возникать и в результате реакций дезаминирования: H3N+ - СН2 - СОО- + НО* — НО - СН2 - COO- + N+H2. В липидной фракции первичные изменения при воздействии ионизирующих излучений состоят в образовании свободных радикалов, которые, взаимодействуя с кислородом, являются источником возникновения перекисных соединений. Последние в свою очередь могут вступать в реакцию с жирами, в результате чего образуются гидроперекиси: LH — L* + Н*; L* + О2 — LO2 + LH — LOOH + L*; L* + HO2 — LOOH, где L радикал липида. Образовавшиеся радикалы могут дать толчок к развитию цепных реакций окисления, в том числе перекисного окисления липидов. При облучении большими дозами радиации происходит декарбоксилирование жирных кислот, и даже их распад. Важные последствия лучевых повреждений структуры липидов проявляются в нарушении строения клеточных мембран. Вовлечение липидов мембран в процессы перекисного окисления может вызывать деструкцию липопротеидных комплексов, что служит причиной изменения проницаемости мембран, смещения ионных градиентов в клетке, нарушения процессов адсорбции и активного транспорта ряда веществ. Нарушаются также процессы окислительного фосфорилирования, нормальное течение которых обеспечивается упорядоченной локализацией ферментов на мембранах. Повреждение мембран лизосом приводит к выходу и активации гидролитических ферментов. 9 Радиационное повреждение ДНК. При облучении клетки поражаются все ее структуры. Вероятность поражения тех или иных молекул определяется их размером: чем крупнее молекула, тем больше вероятность ее повреждения. Именно поэтому в качестве основной мишени радиационного поражения клетки рассматривается ДНК. В результате прямой ионизации самой молекулы ДНК и ее атаки радикалами ОН* происходит разрыв химических связей между атомами. Разрыв связей в сахарофосфатном скелете нарушает непрерывность нити ДНК. Если разорвана одна из нитей, говорят об однонитевом или одиночном разрыве. Совпадение разрывов противоположных нитей ДНК в одной точке приводит к появлению двойных (двунитевых) разрывов. Известно, что одиночные разрывы постоянно возникают в клетке и без всякой связи с облучением, просто вследствие тепловой нестабильности ДНК, а также в результате некоторых окислительных и ферментативных процессов. Двойные разрывы образуются как при случайном пространственном совпадении одиночных разрывов в противоположных нитях ДНК (вероятность которого возрастает с увеличением накопленной дозы редкоионизирующего излучения), так и вследствие одномоментного повреждения обеих нитей при выделении в данном микрообъеме клетки большого количества энергии. При действии плотноионизирующих излучений общее число разорванных межатомных связей будет таким же, однако они будут менее равномерно распределены по длине молекулы ДНК. Общее число очагов поражения будет меньшим, зато «тяжесть» (концентрация разорванных межатомных связей на единицу микрообъема) каждого из них будет больше. Таким образом, при действии плотноионизирующих излучений число двойных разрывов на единицу дозы оказывается выше, чем при действии редкоионизирующих видов радиации. Так как одиночные разрывы репарируются гораздо лучше, чем двойные, тяжесть поражения клетки с увеличением доли двойных разрывов возрастает. Именно это и служит причиной более высокой относительной биологической эффективности плотноионизирующих излучений. Разрыв межатомных связей в сахаро-фосфатном скелете ведет к нарушению непрерывности молекулы ДНК, что препятствует считыванию с нее генетической информации (если разрыв приходится на транскрибируемый участок генома), а также нормальной репликации ДНК и последующему распределению генетического материала между клетками. Разрыв скелета может сопровождаться разрывом связей в той части молекулы дезоксирибозы, которая не участвует в построении скелета ДНК. Если в молекуле дезоксирибозы разорвана одна из связей, не участвующих в построении скелета ДНК, то принято говорить о повреждении нуклеотида, а если в нуклеотиде повреждена одна из связей в пуриновом или пиримидиновом основании, то говорится о повреждении основания (а не нуклеотида, хотя основание является частью нуклеотида). Поврежденные основания и нуклеотиды подвергаются дальнейшим химическим изменениям. Примером является окисление гуанина до 8-оксогуанина. Атака ДНК высокоактивными радикалами воды приводит к модификации оснований, например, присоединение радикала ОН* к тимину превращает его в тимингликол. Разрывы скелета ДНК частично элиминируются самостоятельно, частично с помощью систем ферментативной репарации. Репарация не всегда заканчивается восстановлением исходной молекулы. Вместо воссоединения разорванной связи может возникнуть связь между свободными концами двух противоположных нитей молекулы ДНК, между свободными концами в местах разных разрывов одной и той же нити ДНК и даже между свободными концами разных молекул ДНК. Такое разнообразие новых связей является следствием того, что нити ДНК в ядре упакованы весьма плотно. Неправильное воссоединение разрывов приводит к возникновению хромосомных перестроек (аберраций). 10 Разрывы молекулы ДНК и окружающих ее белков при неправильном воссоединении приводят к образованию ДНК-белковых сшивок. Неверная репарация оснований, а также их химическая модификация ведет к еще одному дефекту молекулы — появлению так называемых неспаренных (англ.— mismatch) оснований. В молекуле ДНК в норме существуют только две пары комплементарных оснований — аденин-тимин и гуанин-цитозин. Замена одного из оснований каждой пары ведет к изменению генетического кода. При появлении в молекуле 8-оксогуанина вследствие окисления гуанина, во время репликации ДНК в синтезируемой цепи вместо комплементарного к гуанину цитозина напротив 8-оксогуанина будет вставлен аденин. При синтезе информационной РНК неверное основание приведет к неправильной кодировке и последующему включению в белковую молекулу ошибочного аминокислотного остатка. При воздействии редкоионизирующего излучения в дозе 2 Гр, вызывающем гибель от 10 до 90% клеток разных тканей человека, в ДНК одной клетки образуется около 2000 однонитевых и 80 двуни-тевых разрывов, повреждается 1000 оснований и формируется 300 сшивок с белком. Именно эти поражения и лежат в основе радиационной гибели клетки, длительного нарушения эффективности деления ее потомков и злокачественного перерождения, а в случае воздействия на половые клетки — и генетических последствий облучения родителей для потомства. Репарация ДНК. Эксцизионная репарация. Репарация одиночных и двойных разрывов ДНК. При эксцизионной репарации поврежденных или измененных (неспаренных) оснований первым шагом является их удаление ДНК-гликозилазами. Эксцизионная репарация оснований – универсальный механизм устранения повреждений ДНК, первым шагом которого является распознавание и удаление поврежденных или некомплементарных нуклеотидов, разрезание гликозильной связи между основанием и остатком сахара, при этом на цепи остается сайт, не содержащий основания (AP-сайт). Затем следует вырезание и репарация AP-сайта, осуществляемая фосфодиэстеразами, ДНК-полимеразами и ДНКлигазами. В процессе ЭРО может происходить удаление и других производных, образующихся под действием химических мутагенов, и вырезание этонопуриновых производных оснований, образующихся под действием винилхлорида, а также С8-аддуктов аминофлуорена с остатками гуанина. АР-дезоксирибоза (apurinic/apyrimidinic deoxyribose), образовавшаяся в результате удаления модифицированного азотистого основания AP-сайта, далее вырезается с помощью АР-лиазы, которая освобождает ее 3'-конец, и АРэндонуклеазы, гидролизующей ее 5'-концевую фосфодиэфирную связь в АР-сайте, далее разрыв заполняется ДНК-полимеразой. Особенностью эксцизионной репарации нуклеотидов (ЭРН) является сопряженность с транскрипцией, что позволяет осуществлять репарацию в наиболее важных для клетки транскрибируемых районах генома. Если повреждение в транскрибируемой нити ДНК задерживает продвижение РНК-полимеразы, то специальный белковый фактор TRCF (transcription-repair coupling factor) сменяет РНК-полимеразу и связывает с этим участком комплекс ферментов репарации. ЭРН удаляет объемные ДНК-аддукты, образующиеся под воздействием УФ-излучения, окислителей, алкилирующих агентов и ароматических углеводородов. Репарация одиночных и двойных разрывов ДНК. Простые одиночные разрывы ДНК элиминируются ДНК-лигазами, восстанавливающими связи между атомами сахарофосфатного скелета. Лигазы — ферменты, которые постоянно восстанавливают связи в скелете ДНК, рвущиеся в результате тепловых процессов или атаки ДНК радикалами, образующимися в процессе нормального метаболизма. При воздействии излучений часть одиночных разрывов сопровождается более глубоким повреждением дезоксирибозного кольца и/или потерей основания. В этом случае 11 воссоздание непрерывной нити ДНК производится уже не ДНК-лигазами, а идет по более сложной схеме — механизму эксцизионной репарации нуклеотидов. Репарация двойных разрывов ДНК осуществляется двумя путями — за счет негомологичного воссоединения концов и методом гомологичной рекомбинации. При негомологичном воссоединении концов две части каждой из разорванных нитей ДНК воссоединяются лигазами. Этот вид репарации двойных разрывов идет на всех стадиях цикла, но он недостаточно эффективен в плане восстановления непрерывности нити и, кроме того, приводит к неправильному сращению нитей, следствием чего являются хромосомные перестройки. Репарация путем гомологичной рекомбинации в основном происходит при разрыве той части молекулы ДНК, которая уже реплицировалась, так что для нее имеется неповрежденный аналог. Вместе с тем может использоваться и неповрежденная другая молекула ДНК, имеющая гомологичную последовательность оснований. При гомологичной рекомбинации один конец разорванной нити ДНК встраивается в неповрежденный гомолог, на котором, как на матрице, проходит синтез недостающих участков нитей ДНК. Новые части затем «подшиваются» лигазами к основной части молекулы ДНК. В условиях плотной пространственной упаковки молекул ДНК в клетке неверная репарация разрывов молекулы приводит транслокации участков ДНК по ее длине, соединению двух различных молекул, относящихся к разным хромосомам (образованию мостов), и ряду других хроматидных и хромосомных аберраций. Отсутствие репарации приводит к отделению участка ДНК от основной молекулы — образованию ацентрического фрагмента. Ясно, что чем выше доза радиации, тем больше вероятность сохранения повреждений, а потому последствия облучения больше сказываются на жизнедеятельности клетки. Вместе с тем для некоторых видов клеток в диапазоне низких уровней (0,1 —0,5 Гр) установлены факты большего снижения выживаемости, чем при облучении в более высоких (на несколько десятых грея) дозах, что связывают с нечувствительностью репаративных систем клетки к совсем малым повреждениям ДНК. Предполагается, что в таких клетках работа репаративных систем нуждается в индукции, которая происходит после накопления в ДНК определенного количества повреждений. 12 РЕЗЮМЕ • Основной молекулярной мишенью действия ионизирующей радиации в клетке является ДНК. В клетке человека 46 хромосом, в каждой из которых находится одна молекула ДНК длиной от 1,7до8,5мм. Общая длина ДНК в клетке человека — 2 м. • Поражение ДНК соматических клеток лежит в основе радиационной гибели самой облученной клетки, а также длительного нарушения деления ее потомков и их злокачественного перерождения, а при поражении ДНК зародышевых клеток — и генетических последствий в потомстве. • Облучение в дозе 2 Гр вызывает утрату способности к неограниченному делению у 10—90% клеток (такова вариабельность радиочувствительности клеток различных нормальных тканей и злокачественных опухолей). При этой дозе в ДНК одной клетки повреждаются около 1000 оснований, образуются 2000 однонитевых и 80 двунитевых разрывов, а также формируются 300 сшивок с белком. • В клетке имеются энзиматические системы репарации ДНК. Они осуществляют выщепление и замену поврежденных оснований и нуклеотидов, а также репарацию однонитевых разрывов ДНК. • Двунитевые разрывы ДНК, возникающие вследствие одного акта ионизации, захватывающего обе цепи ДНК, а также появляющиеся за счет совпадения одиночных разрывов в противоположных нитях, репарируются менее эффективно и с бблыпим числом ошибок, чем однонитевые разрывы. • Неотрепарированные или ошибочно репарированные повреждения приводят к снижению клоногенной активности клетки (способности клетки к неограниченному делению с образованием жизнеспособных потомков), аберрациям хромосом и различного рода мутациям. • Нарушение структуры молекулы ДНК выявляется при прохождении клеткой сверочных точек, расположенных в периодах G1 и G2. При обнаружении структурных нарушений клетка замедляет продвижение по циклу. Предполагается, что увеличение времени до момента деления позволяет клетке более полно восстановить нативную структуру ДНК. • В клетках лимфоидного происхождения, а также у части клеток другого генеза обнаружение специальными белками 13
