ИНФЕКЦИИ в онкологии
реклама

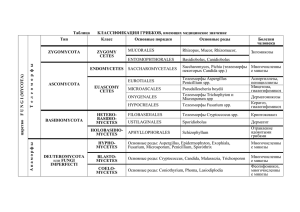
ИНФЕКЦИИ в онкологии под редакцией М. И. Давыдова, Н. В. Дмитриевой Москва • 2009 infection_onco-03reclama.indd 1 27.10.2008 15:10:20 Коллектив авторов: Алексеева Тамара Рубеновна — доктор Давыдов Михаил Иванович — доктор медицинских наук, профессор, академик РАН и РАМН, президент РАМН, директор ГУ РОНЦ им. Н. Н. Блохина медицинских наук, ведущий научный сотрудник отделения рентгенодиагностики НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Белобородов Владимир Борисович — доктор медицинских наук, профессор кафедры инфекционных болезней РМАПО Дмитриева Наталья Владимировна — доктор медицинских наук, профессор, руководитель лаборатории микробиологической диагностики и лечения инфекций в онкологии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Бабичева Лали Галимовна — кандидат медицинских наук, ассистент кафедры онкологии РМАПО Долгушин Борис Иванович — доктор медицинских наук, профессор, член-корр. РАМН, руководитель отдела лучевой диагностики и рентгенохирургических методов лечения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Багирова Наталия Сергеевна — доктор медицинских наук, ведущий научный сотрудник лаборатории микробиологической диагностики и лечения инфекций в онкологии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Жуков Николай Владимирович — кандидат медицинских наук, ведущий научный сотрудник отделения клинической онкологии ФГУ НКЦ детской гематологии, онкологии и иммунологии Росздрава Варлан Геннадий Валентинович — доктор медицинских наук, руководитель отделения химиотерапии ГКБ № 33 г. Москвы Григорьевская Злата Валерьевна — кан- Кадагидзе Заира Григорьевна — доктор медицинских наук, профессор, руководитель лаборатории клинической иммунологии опухолей НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН дидат медицинских наук, старший научный сотрудник лаборатории микробиологической диагностики и лечения инфекций в онкологии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН 3 infection_onco-03reclama.indd 3 27.10.2008 15:10:20 Карахан Владислав Борисович — доктор медицинских наук, профессор, руководитель отделения нейрохирургии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Миненко Светлана Владимировна — кандидат медицинских наук, старший научный сотрудник отделения клинической онкологии ФГУ НКЦ детской гематологии, онкологии и иммунологии Росздрава Кассиль Владимир Львович — доктор медицинских наук, профессор, ведущий научный сотрудник отделения госпитальной терапии и функциональной диагностики НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Морхов Константин Юрьевич — кандидат медицинских наук, врач гинекологического отделения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Нечушкина Валентина Михайловна — Кононец Павел Вячеславович — кандидат кандидат медицинсикх наук, старший научный сотрудник гинекологического отделения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН медицинских наук, старший научный сотрудник хирургического торакального отделения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Котельников Алексей Геннадьевич — Нуммаев Батыр Гульмурадович — кандидат медицинских наук, врач гинекологического отделения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН доктор медицинских наук, ведущий научный сотрудник отделения опухолей печени и поджелудочной железы НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Панкратенко Олег Анатольевич — кандиКропотов Михаил Алексеевич — доктор дат медицинских наук, врач-хирург отделения рентгенохирургических методов диагностики и лечения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН медицинских наук, руководитель отделения опухолей черепно-челюстно-лицевой области НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Петухова Ирина Николаевна — доктор медицинских наук, ведущий научный сотрудник лаборатории микробиологической диагностики и лечения инфекций в онкологии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Кузнецов Виктор Васильевич — доктор медицинских наук, профессор, руководитель гинекологического отделения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Кукушкин Андрей Всеволодович — кандидат медицинских наук, старший научный сотрудник отделения рентгенохирургических методов диагностики и лечения НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Поддубная Ирина Владимировна — доктор медицинских наук, профессор, член-корр. РАМН, руководитель кафедры онкологии РМАПО Ларионова Вера Борисовна — доктор ме- Птушкин Вадим Вадимович — доктор ме- дицинских наук, профессор, ведущий научный сотрудник отделения химиотерапии гемобластозов НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН дицинских наук, профессор, руководитель отделения клинической онкологии ФГУ НКЦ детской гематологии, онкологии и иммунологии Росздрава Масчан Алексей Александрович — доктор Рябов Андрей Борисович — кандидат медицинских наук, старший научный сотрудник отделения абдоминальной онкологии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН медицинских наук, профессор, ФГУ НКЦ детской гематологии, онкологии и иммунологии Росздрава 4 infection_onco-03reclama.indd 4 27.10.2008 15:10:20 Стилиди Иван Сократович — доктор ме- Цветков Денис Сергеевич — кандидат ме- дицинских наук, профессор, член-корр. РАМН, руководитель отделения абдоминальной онкологии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН дицинских наук, старший научный сотрудник отделения реанимации НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Шильникова Ирина Ивановна — кандидат биологических наук, старший научный сотрудник лаборатории микробиологической диагностики и лечения инфекций в онкологии НИИ КО ГУ РОНЦ им. Н. Н. Блохина РАМН Сулейманов Эльхан Абдуллаевич — кандидат медицинских наук, врач-хирург ГКБ № 1 г. Москвы 5 infection_onco-03reclama.indd 5 27.10.2008 15:10:20 Оглавление Предисловие ..................................................................................................................................9 Список сокращений .............................................................................................................11 Часть 1. Инфекции и иммунологическая защита ................................... 13 Глава 1. Нозокомиальные инфекции у онкологических больных ................................................................................................... 15 Дмитриева Н. В. Глава. 2. Инфекция и иммунитет ................................................................... 22 Кадагидзе З. Г. Часть 2. Этиология инфекций у онкологических больных ........... 41 Глава 3. Бактериальная микрофлора человека в норме и патологии ......................................................................... 43 Дмитриева Н. В., Григорьевская З. В., Цветков Д. С. Глава 4. Анаэробные инфекции ................................................................... 55 Шильникова И. И. Глава 5. Грибковые инфекции ....................................................................... 87 Багирова Н. С. Глава 6. Вирусные инфекции ....................................................................... 115 Жуков Н. В. 6 infection_onco-03reclama.indd 6 27.10.2008 15:10:20 Часть 3. Основные виды инфекций у онкологических больных. Диагностика, лечение и профилактика ................................. 125 Глава 7. Неопухолевые заболевания и поражения легких у онкологических больных .........................................................127 Кассиль В. Л. Глава 8. Бактериемия и сепсис ...................................................................161 Белобородов В. Б. Глава 9. Фебрильная нейтропения. Рациональные подходы к профилактике и лечению .....193 Дмитриева Н. В., Петухова И. Н., Варлан Г. В. Глава 10. Мукозиты и диарея у онкологических больных .............. 237 Жуков Н. В. Глава 11. Катетер-ассоциированные инфекции кровотока .......... 258 Багирова Н. С. Глава 12. Хирургические раневые инфекции. Антибиотикопрофилактика ........................................................271 Петухова И. Н. Часть 4. Инфекционные осложнения при различных опухолевых заболеваниях и некоторых лечебных пособиях .............................................................................................................. 299 Глава 13. Инфекции при раке пищевода, желудка и толстой кишки ............................................................................... 301 Стилиди И. С., Рябов А. Б., Кононец П. В., Панкратенко О. А., Сулейманов Э. А. Глава 14. Инфекционные осложнения при раке печени и органов билиопанкреатодуоденальной зоны ...............310 Котельников А. Г., Долгушин Б. И., Кукушкин А. В. Глава 15. Инфекции при опухолях органов женской репродуктивной системы ............................................................327 Кузнецов В. В., Нечушкина В. М., Нуммаев Б. Г., Морхов К. Ю. Глава 16. Инфекции при опухолях головы и шеи ................................340 Кропотов М. А. 7 infection_onco-03reclama.indd 7 27.10.2008 15:10:20 Глава 17. Инфекции при опухолях центральной нервной системы ............................................................................. 353 Карахан В. Б. Глава 18. Инфекции у больных гемобластозами ................................. 379 Поддубная И. В., Ларионова В. Б., Бабичева Л. Г. Глава 19. Инфекционные осложнения после трансплантации стволовых кроветворных клеток ......... 401 Миненко С. В., Птушкин В. В. Глава 20. Инвазивный аспергиллез у детей с онкогематологическими заболеваниями. Клиника, диагностика и лечение ..............................................410 Масчан А. А. Глава 21. Лучевая диагностика грибковых инфекций у онкологических больных ........................................................ 438 Алексеева Т. Р. Приложение. Основные антимикробные препараты, используемые для профилактики и лечения инфекций у онкологических больных.................................. 461 8 infection_onco-03reclama.indd 8 27.10.2008 15:10:20 Глава 5 Грибковые инфекции Н. С. Багирова В течение последних 20 лет во всех странах регистрируется значительный рост частоты грибковых инфекций [8, 9]. Например, в США на 1 млн населения приходится 178 случаев микозов (из них 73 — кандидозы). Для сравнения: случаи менингококковой инфекции составляют только 5, а стрептококковой (группы В) — до 10 на 1 млн населения [12]. В основном, микозы — это нозокомиальные инфекции, и их увеличение регистрируется как в зарубежных клиниках, так и в стационарах различного профиля в нашей стране. Микозы занимают седьмое место в структуре причин летальных исходов от инфекций [11]. В США только за 1992 г. зарегистрировано 2300 смертельных случаев, обусловленных грибами, из них 70 % были вызваны Candida spp., Aspergillus spp., Cryptococcus neoformans. Летальный исход при грибковых инфекциях чаще имеет место при микозах, обусловленных плесневыми грибами, нежели дрожжеподобными [11]. Факторы, предрасполагающие к развитию грибковых инфекций у онкологических больных Современные возможности лечения онкологических больных неизбежно сопряжены с развитием вторичных осложнений, среди которых инфекции занимают значительное место, причем доля грибковых инфекций в последние годы существенно увеличилась. Онкологические больные являются группой риска развития микозов [3], а больные гемобластозами выделяются как основная группа риска. Онкогематологические больные подвержены грибковым инфекциям вследствие совокупности особенностей основного заболевания и целого ряда факторов риска, связанных со специфическим лечением: иммуносупрессивная терапия, предше- 87 infection_onco-03reclama.indd b2:87 27.10.2008 15:10:28 Этиология инфекций у онкологических больных 5 ствующая длительная терапия антибактериальными препаратами, внутрисосудистые катетеры, парентеральное питание, гранулоцитопения, терапия кортикостероидами [5, 17]. Росту частоты микозов, по-видимому, способствуют ужесточение режимов противоопухолевой терапии, включающей в себя как агрессивные режимы химиотерапии, так и лучевое воздействие; трансплантация костного мозга; частое проведение терапии антибиотиками широкого спектра действия; широкое и нередко необоснованное назначение противогрибковых препаратов не только с лечебной, но и с профилактической целью. Риск развития глубоких микозов у онкологических больных обусловлен двумя группами факторов, при этом каждая из этих групп важна, а их сочетание еще более усиливает этот риск [5]: 1. Факторы окружающей среды: присутствие спор мицелиальных (плесневых, например Aspergillus spp.) грибов в воздухе при проведении строительных или ремонтных работ в стационаре; присутствие грибов на листьях комнатных растений и в горшечной земле; присутствие грибов в продуктах питания (например, в черном перце, чае, салатах, хлебе и т.д.); присутствие дрожжеподобных грибов, в частности кандид, на предметах окружающей больного обстановки и на руках медперсонала. 2. Факторы, обусловленные состоянием больного: как правило, риск возникновения грибковой инфекции определяется сочетанием нескольких факторов. У онкологических больных основные предрасполагающие к развитию микозов факторы следующие: хроническое истощение, голодание; кортикостероидная терапия; антибиотикотерапия; дефицит количества Т-клеток или их функций; дефицит количества нейтрофилов или их функций; гипергликемия; ацидоз; парентеральное питание; обширные хирургические вмешательства; гемобластозы; снижение функций или количества макрофагов или моноцитов; 2 повреждение анатомических защитных барьеров — кожи и слизистых оболочек; повреждение тканей вследствие предшествующей бактериальной инфекции; колонизация тканей пациента грибами. До 50 % нозокомиальных грибковых инфекций приходится на отделения интенсивной терапии. Риск развития микоза высок у больных с мочевыми и сосудистыми катетерами, у пациентов старше 65 лет, у детей в возрасте до одного года, у лиц негроидной расы любого возраста. Онкогематологические больные, как упоминалось ранее, являются группой повышенного риска возникновения инфекционных осложнений грибковой этиологии. Так, микозы у больных острыми лейкозами и у реципиентов костного мозга развиваются в 20–30 % случаев, у больных лимфомами — в 10–20 % случаев и только в 1–5 % случаев — при солидных опухолях [3, 4]. Кроме того, в онкологии именно у больных гемобластозами в последние годы регистрируется значительный рост частоты грибковых инфекций в большинстве стран мира, в том числе в России [4]. Нейтрофилы у здоровых людей, захватывая и уничтожая клетки Candida spp. и гифы Aspergillus spp., являются первой линией защиты от инвазии и диссеминации грибов. Неповрежденные макрофаги, в свою очередь, обеспечивают защиту от спор (конидии) аспергилл. В условиях онкологической клиники нейтропения является наиболее важным предрасполагающим фактором развития микозов [4, 5], особенно при кандидозе и аспергиллезе, а также при фузариозе и геотрихозе, и в меньшей степени — при криптококкозе и гистоплазмозе [5]. Критическим признано состояние, когда количество нейтрофилов ниже 500 клеток в 1 мм3 крови. При глубокой и длительной нейтропении (менее 100 клеток в 1 мм3 крови более 2 нед.) у онкогематологических больных почти всегда развиваются диссеминированные грибковые осложнения [7], которые в 73 % случаев заканчиваются смертью больного. Летальность при глубоких микозах у онкогематологических больных составляет 50 %, при нейтропении — более 80 %. Добавочным фактором риска развития диссеминированной грибковой инфекции является применение высоких доз кортикостероидов, поскольку эти 88 infection_onco-03reclama.indd b2:88 27.10.2008 15:10:28 Грибковые инфекции 2 препараты вызывают нарушение функции макрофагов, снижение выработки антител, подавление воспалительной реакции. Неповрежденные эпителиальные клетки поверхностных тканей здоровых людей препятствуют бактериальной и грибковой инвазии. Колонизация кожи и слизистых оболочек у онкологических больных является существенным фактором риска развития глубоких микозов, поскольку терапия противоопухолевыми препаратами и лучевая терапия повреждают естественные механизмы защиты от инвазии грибами. Длительная (более 2 нед.) терапия антибактериальными препаратами широкого спектра действия приводит к элиминации (выведению) чувствительных к антибиотикам бактерий с последующим массивным ростом грибов на слизистых оболочках ЖКТ, который является входными воротами, источником возбудителей диссеминированных грибковых осложнений в случае повреждения слизистой оболочки вследствие химиотерапии [3, 5]. В условиях онкологического стационара неизбежны ситуации, когда необходимо длительное использование мочевых, внутрисосудистых катетеров, которые также могут быть входными воротами грибковых инфекций [4, 5]. Возбудители грибковых инфекций у онкологических больных Грибы, вызывающие микозы у онкологических больных, можно разделить на три основные группы [5, 8, 15]: 1. Наиболее часто вызывающие грибковые инфекции: — дрожжеподобные — Candida spp., Cryptococcus spp.1; — мицелиальные — Aspergillus spp., Fusarium spp. 2. Патогенные грибы, которые обычно вызывают локализованные поверхностные микозы у пациентов без нарушений иммунитета, но у иммунокомпрометированных больных часто бывают причиной диссеминированных форм: 1 См. фотографии из личного архива Н. С. Багировой в конце главы. — мицелиальные — Histoplasma capsulatum, Blastomyces dermatitidis, Coccidioides immitis, Paracoccidioides braziliensis. 3. Редко регистрируемые возбудители микозов: — мицелиальные — Acremonium spp., Paecilomyces spp., Pseudoalesheria boydii, Scedosporium prolificans, Scopulariopsis brevicaulis, Bipolaris spp., Cladophialophora bantiana,Dactylaria gallopava, Exophilia spp., Alternaria spp., Trichosporon spp., Microsporium spp., Zygomycetes (Mucor spp., Rhizopus spp., Absidia spp. и др.), Penicillium marneffei, Sporothrix spp.; — дрожжеподобные — Blastoshizomyces capitatus, Malassezia spp., Rhodotorula rubra et glutinis, Saccharomyces cerevisiae, Hansenula anomala, Cryptococcus laurentii, Geotrichum spp. Итак, этиологическая структура нозокомиальных микозов у онкологических больных, в основном, представлена дрожжеподобными грибами рода Candida и мицелиальными (плесневыми) грибами рода Aspergillus [8, 9] с преимуществом Candida spp. В среднем до 86 % всех грибковых инфекций и до 10 % инфекций кровотока составляют кандидозы [15]. По кооперированным данным, 58 % всех микозов, обнаруженных при аутопсиях, обусловлены Candida spp., 30 % — Aspergillus spp. [3]. При гемобластозах до 85 % всех микозов вызваны дрожжеподобными грибами рода Candida (чаще всего C. albicans и C. tropicalis) и плесневыми грибами рода Aspergillus (чаще всего A. fumigatus и A. flavus). У больных с нейтропенией более 80 % микозов вызывают Candida spp., Aspergillus spp. и Mycor spp. [17]. В последнее время в группе иммунокомпрометированных, в основном у онкогематологических больных, грибы рода Fusarium считаются вторыми по частоте после Aspergillus spp. возбудителями плесневых микозов. К настоящему времени отмечается тенденция к росту случаев аспергиллеза и снижению частоты кандидоза [15]. Кроме того, с каждым годом спектр возможных возбудителей грибковых осложнений у онкологических, и главным образом у онкогематологических больных, расширяется за счет редких и необычных видов грибов [8], в отношении которых еще не накопле- 5 89 infection_onco-03reclama.indd b2:89 27.10.2008 15:10:28 Этиология инфекций у онкологических больных но достаточно данных по их чувствительности к антимикробным препаратам, не отработана эффективная клинико-лабораторная диагностика. Инфекции, вызванные Candida spp. (кандидозы) 5 Кандиды занимают шестое место в ряду лидирующих нозокомиальных патогенов в США, вызывая до 86 % всех грибковых инфекций [15]. Род Candida — это только часть представителей царства грибов, включающих более 200 000 разновидностей, многие из которых недостаточно изучены как потенциальные патогены для человека. В настоящее время насчитывается более 160 видов кандид, из них не более 20 видов регистрируются как возбудители инфекций у человека. Род Candida относится к микробам-оппортунистам. Они обычно слабовирулентные и не способны вызывать микозы у пациентов без нарушения защитных барьерных функций организма. В развитии кандидозов немаловажную роль играет предшествующая колонизация слизистых оболочек. Слизистые оболочки полости рта, желудочно-кишечного и мочевыводящего трактов онкологических больных, колонизированные грибами, в условиях значительного количества факторов риска могут стать источником диссеминации грибов. К сожалению, дифференциальный диагноз между колонизацией и кандидозом провести трудно [17, 18]. Пятнадцать лет назад вид Candida albicans был причиной более 60 % нозокомиальных грибковых инфекций, но в последние годы все чаще при кандидозах стали выделяться так называемые Candida non-albicans — то есть прочие виды рода Candida [4, 15]. По данным ГУ РОНЦ им. Н. Н. Блохина РАМН [1], в течение многих лет наблюдения кандиды составляют более 90 % всех штаммов дрожжеподобных грибов, выделяемых из биоматериалов онкологических больных. По нашим данным, у онкологических больных в целом по клинике C. albicans выделяется из различных патологических материалов в 58 % случаев, на втором месте по частоте — C. glabrata (11,1 %), на третьем — C. parapsilosis (8,7 %). В отделении реанимации 63 % кандидозов обусловлены C. albicans. По данным мониторинга, в отделении 2 химиотерапии гемобластозов для взрослых в течение последних нескольких лет наблюдается постепенное увеличение частоты выделения группы non-albicans Candida. Так, в 2000 г. эта группа составила 23 %, в 2001 г. — 29 %, в 2002 г. — 30 %, а к 2004 г. группа nonalbicans Candida уже составила 49 % (достоверно чаще, чем в 2002 г.; p < 0,05). Опасность такой тенденции заключается в том, что микозы, обусловленные некоторыми видами этой группы, трудно поддаются лечению, порой обладая природной резистентностью к наиболее широко используемым противогрибковым препаратам [3, 13]. Кандидозы — это в основном эндогенная инфекция, но кандиды в условиях стационара могут передаваться от больного к больному и от здорового медперсонала к больным [17, 18], поэтому для предупреждения кандидозов так важен хорошо организованный контроль над инфекциями в клинике. Candida albicans считается обычным микроорганизмом здорового человека, а вот другие виды рода Candida нечасто обнаруживаются в эндогенной микрофлоре человека и являются строго нозокомиальными возбудителями. Некоторые виды рода Candida обнаруживаются при вспышках заболеваний, например C. parapsilosis, C. glabrata, C. tropicalis, C. inconspicua [9]. Меры инфекционного контроля, направленные против этих видов, могут иметь особое значение в профилактике нозокомиальных грибковых инфекций. Атрибутивная (т. е. непосредственно связанная с грибковой инфекцией) летальность при инфекциях, обусловленных грибами рода Candida, выше, чем при каких-либо других лидирующих бактериальных нозокомиальных патогенах, и варьирует при различных локализациях кандидозной инфекции. Например, при пневмонии — нередкое осложнение у онкологических больных — летальность может составлять более 80 %. Различают поверхностные и глубокие кандидозы. К поверхностным относятся кандидозы видимых слизистых оболочек, кожи и ее придатков: кандидоз кожи, ротоглотки, кандидозный вульвовагинит, эзофагит. При поверхностном кандидозе возбудитель, как правило, не проникает глубже базального слоя эпите- 90 infection_onco-03reclama.indd b2:90 27.10.2008 15:10:28 Грибковые инфекции 2 Фотографии из личного архива Н. С. Багировой 5 Рис. 5.4. Окраска по Граму, ×1000, септированный мицелий Aspergillus flavus. Мокрота Рис. 5.1. Окраска по Граму, увеличение ×1000, септированный мицелий Aspergillus flavus. Экссудат, полученный при пункции лимфоузла Рис. 5.2. Окраска по Граму, ×1000, септиро- Рис. 5.5. Окраска по Граму, ×1000, септиро- ванный мицелий Aspergillus flavus. Мокрота ванный мицелий Aspergillus flavus. Мокрота Рис. 5.3. Окраска по Граму, ×1000, септированный мицелий Aspergillus flavus. Отделяемое из области распада (некроз тканей верхней челюсти и тканей носоглотки) 105 infection_onco-03reclama.indd b2:105 27.10.2008 15:10:29 Этиология инфекций у онкологических больных 2 5 Рис. 5.6. Окраска по Граму, ×1000, септированный мицелий Aspergillus flavus. Мокрота Рис. 5.9. Окраска по Граму, ×200, септированный мицелий Aspergillus flavus. Мокрота Рис. 5.7. Окраска по Граму, ×1000, конидии и септированный мицелий Aspergillus flavus. Мокрота Рис. 5.10. Окраска по Граму, ×100, септиро- Рис. 5.8. Окраска по Граму, ×400, конидии и септированный мицелий Aspergillus flavus. Мокрота Рис. 5.11. Окраска по Граму, ×1000, септированный мицелий Aspergillus fumigatus. Отделяемое из области распада (некроз тканей верхней челюсти и тканей носоглотки) ванный мицелий Aspergillus flavus. Мокрота 106 infection_onco-03reclama.indd b2:106 27.10.2008 15:10:30 Глава 6 Вирусные инфекции Н. В. Жуков К линически значимые вирусные инфекции у онкологических больных, в основном, встречаются после интенсивных курсов химиотерапии, приводящих к выраженной иммуносупрессии. Достаточно часто вирусные инфекции наблюдаются у больных после высокодозной химиотерапии с трансплантацией клеток-предшественников гемопоэза и у больных лейкозами и лимфомами. При солидных опухолях вирусные инфекции (за исключением вирусных гепатитов) встречаются незначительно чаще, чем в общей популяции, и редко сопровождаются клинически значимыми проявлениями. Наиболее частыми возбудителями вирусных инфекций у онкологических больных являются вирусы герпеса (вирус простого герпеса, вирус varicella-zoster и ЦМВ). У пациентов после трансплантации костного мозга и у больных острыми лейкозами банальные респираторные вирусы (РСВ, вирусы гриппа А и В, вирус парагриппа) также могут представлять опасность для жизни. Среди этих больных обычные вирусные инфекции верхних дыхательных путей могут прогрессировать с развитием пневмонитов, которые обычно ассоциируются с высокой смертностью. Другими вирусами, которые могут вызывать серьезные заболевания у онкологических больных, являются вирусы Эпштейна—Барр, вирус герпеса типа 6, аденовирусы, вирусы гепатита и полиомы. Вирус простого герпеса Вирус простого герпеса (ВПГ) является наиболее частым возбудителем вирусных инфекций у онкологических больных (пациентов с лимфомами и острыми лейкозами). Данный ДНКсодержащий вирус (как и все вирусы, относящиеся к этому семейству) характеризуется тем, что после острой первичной инфекции вирусный геном персистирует в нейрональных ганглиях на протяжении всей жизни инфицированного человека (латентная фаза). Дальнейшие эпизоды герпетической инфекции являются реактивацией латентного вируса, находившегося в организме с момента первичного контакта. Противовирусный иммунитет реализуется за счет вирусспецифичных Т-лимфоцитов (хелперов и цитотоксичных). В связи с этим вероятность реактивации вируса и тяжесть клинических проявлений зависят от степени подавления Т-клеточного звена иммунитета. У онкологических больных герпетическая инфекция чаще всего является реактивацией эндогенной латентной инфекции, а не «свежим» инфицированием. Надежным методом определения латентной инфекции является выявление наличия в крови антител к ВПГ. 115 infection_onco-03reclama.indd b2:115 27.10.2008 15:10:34 Этиология инфекций у онкологических больных 6 Как показывают исследования, при наличии латентной инфекции, более 80 % больных, получающих высокодозную химиотерапию или индукционную химиотерапию при остром лейкозе, имеют реактивацию латентного ВПГ. Вирус простого герпеса отличается от остальных представителей семейства герпесвирусов тем, что у пациентов, получающих цитостатическую терапию, его проявления обычно совпадают по времени с развитием нейтропении. При остальных герпесвирусных инфекциях разгар клинических проявлений наблюдается позже. При герпетической инфекции очаги вирусного поражения наиболее часто локализуются на слизистой оболочке полости рта и губах. Локализованные проявления инфекции, обусловленной ВПГ, могут также отмечаться на других областях тела (гениталии, перианальный регион, туловище и т. д.) и сопровождаться деструкцией тканей. У пациентов, получающих цитостатическую и/или иммуносупрессивную терапию, герпетические очаги обычно характеризуются большими размерами и выраженной болезненностью. У некоторых пациентов могут наблюдаться хронические локализованные герпетические язвы, вовлекающие различные структуры лица (нос, губы и т. д.). Эти язвы обычно вначале имеют вид маленьких папуловезикулярных очагов, которые в последующем (на протяжении нескольких недель) постепенно увеличиваются. Возможно поражение ВПГ слизистой оболочки полости рта. При этом обычно наблюдается картина выраженного мукозита с обширными изъязвлениями. Поражение слизистой оболочки полости рта ВПГ клинически практически неотличимо от тяжелого постцитостатического стоматита. Достаточно часто стоматит, обусловленный ВПГ, осложняется вторичной бактериальной и/или грибковой инфекцией. Заподозрить герпетическую природу стоматита позволяет его длительное и упорное течение, несоответствие выраженности и интенсивности проведенной терапии у больных с положительными антителами к ВПГ. У пациентов с глубокой тромбоцитопенией могут наблюдаться кровотечения. Со слизистой оболочки ротоглотки герпетический процесс может распространяться на слизистую оболочку пищевода или при- 2 водить к непосредственному ее поражению (без предшествующего поражения слизистой оболочки полости рта). Симптомы эзофагита, вызываемого ВПГ, клинически неотличимы от поражения слизистой оболочки пищевода, вызываемого грибами рода Candida. Для подтверждения вирусной природы эзофагита необходимо эндоскопическое исследование с биопсией. Кроме того, ВПГ (особенно у пациентов с герпетическим эзофагитом) может поражать слизистую оболочку гортани и трахеи. Крайней степенью выраженности такого поражения является развитие некротизирующего трахеобронхита. Это достаточно редкое поражение обычно протекает крайне тяжело и требует быстрой диагностики. Развитие некротизирующего трахеобронхита необходимо заподозрить у больных с наличием герпетической инфекции (в настоящее время или в анамнезе), имеющих клинику дыхательной недостаточности без выраженных изменений на рентгенограмме. Обычно при этой патологии аускультативно определяются сухие проводные средне- и крупнокалиберные хрипы. Диссеминированная герпетическая инфекция встречается довольно редко. При прочих равных условиях (химиотерапия и т. д.) у больных лимфомой Ходжкина она отмечается наиболее часто в связи с исходной иммуносупрессией. Вирус простого герпеса может поражать печень, почки, поджелудочную железу, легкие, мозг и ЖКТ. Ацикловир, фамцикловир и валацикловир имеют высокую эффективность при лечении больных с инфекцией, обусловленной ВПГ. В связи с высокой частотой поражения ВПГ кожи и слизистых оболочек у больных острыми лейкозами, получающими индукционную терапию и высокодозную химиотерапию с аутологичной трансплантацией клеток-предшественников гемопоэза, при наличии в крови антител к ВПГ, назначение противовирусной профилактики считается оправданным. Диссеминированная инфекция, энцефалит и инфекция у иммунокомпрометированных больных обычно требуют назначения ацикловира внутривенно. У больных с выраженной иммуносупрессией, даже в случае поражения только слизистых оболочек, более надежным является назначение ацикловира внутривенно (5 мг/кг каждые 116 infection_onco-03reclama.indd b2:116 27.10.2008 15:10:34 Вирусные инфекции 2 8 часов) с последующим переходом на пероральный прием (200 мг каждые 4 часа) в случае эффективности внутривенного лечения. У больных с умеренными проявлениями инфекции и иммуносупрессии изначально может проводиться пероральная терапия (ацикловир в вышеуказанных дозах или валацикловир по 1 г 3 раза в сутки). Диссеминированная инфекция, обусловленная ВПГ, требует назначения ацикловира внутривенно в дозе 10 мг/кг каждые 8 часов. Резистентность к ацикловиру (исходная или в процессе лечения) требует назначения альтернативного противовирусного препарата — фоскарнета. Вирус varicella-zoster Первичное инфицирование вирусом varicella-zoster обычно происходит в раннем детстве и проявляется в виде ветряной оспы. После этого вирус сохраняется в сенсорных ганглиях на протяжении всей жизни человека. Примерно у 15 % людей, не страдающих онкологическими заболеваниями, происходит реактивация вируса с развитием опоясывающего герпеса [4]. Первичная инфекция, вызванная вирусом varicella-zoster (ветряная оспа) является потенциально фатальной у детей, получающих противоопухолевую химиотерапию. В связи с тем, что вирус varicella-zoster является крайне контагиозным, необходимы строгие противоэпидемические мероприятия в детских онкологических отделениях в коллективе детей, не переносивших данной инфекции. Серьезные осложнения наблюдаются примерно у 5 % здоровых детей, однако частота смертельных осложнений не превышает 0,5 %. У детей, получающих противоопухолевую терапию, частота тяжелых осложнений возрастает до 30 %, при этом смертность составляет 7 %. Наибольшее количество тяжелых осложнений и смертей отмечается у детей с онкогематологическими заболеваниями. Выраженность инфекции и осложнений значительно зависит от распространенности опухолевого процесса и интенсивности противоопухолевой терапии. У онкологических пациентов, ранее перенесших ветряную оспу, реактивация вируса varicella-zoster также может приводить к развитию тяжелой инфекции. Латентный вирус varicella-zoster контролируется Т-клеточным и гуморальным звеньями иммунитета, и, соответственно, реактивация вируса происходит при их ослаблении вследствие опухолевого процесса или его лечения. Наиболее часто она отмечается у больных с лимфопролиферативными заболеваниями, у которых наблюдается сочетание факторов риска (исходная иммуносупрессия, обусловленная опухолью, и интенсивная химиотерапия). Инфекция проявляется односторонней везикулярной сыпью в пределах одного или нескольких сенсорных дерматомов. Наиболее часто поражаются дерматомы в области груди, шеи и поясницы. Примерно у 20 % больных с опухолевыми заболеваниями проявления опоясывающего герпеса наблюдаются в областях, где опухоль расположена вблизи от нервных стволов. Изначально области поражения покрываются экзантематозной или макулопапулярной сыпью, которая достаточно быстро становится везикулярной. Везикулы могут сливаться, образуя большие буллезные очаги. Иногда очаги поражения у онкологических пациентов имеют тенденцию к медленному заживлению с образованием некрозов и рубцов. У других больных новые очаги могут образовываться на протяжении 10–15 дней, а образование корочек и подсыхание очагов могут наблюдаться лишь через 3–4 нед. от начала заболевания. Иногда изначально наблюдается генерализованная варицеллоподобная сыпь без тенденции к локальному течению. Сыпь сопровождается выраженной болезненностью, которая обычно наблюдается за 2–3 дня до появления очагов, и может длиться в течение нескольких недель или даже месяцев после ее исчезновения. Если боль сохраняется более одного месяца после исчезновения сыпи, ее принято называть постгерпетической невралгией. Кожная диссеминация очагов за пределы исходных дерматомов наблюдается у 35 % больных со злокачественными новообразованиями, в то время как в общей популяции — менее чем в 4 %. Терапия с включением кортикостероидов, лучевая и химиотерапия увеличивают риск диссеминации. Локализованный процесс, обусловленный вирусом varicella-zoster, может предшествовать генерализованному поражению кожи 6 117 infection_onco-03reclama.indd b2:117 27.10.2008 15:10:34 Глава 7 Неопухолевые заболевания и поражения легких у онкологических больных В. Л. Кассиль Н еопухолевые заболевания и поражения легких (в том числе инфекционные) играют исключительно большую роль в судьбе онкологических больных. Непосредственной причиной смерти многих из них является легочная инфекция. У умерших больных гемобластозами, у которых диагноз злокачественного процесса был верифицирован при жизни, нередко на аутопсии наличие онкологического заболевания не обнаруживается, что свидетельствует о высокой эффективности противоопухолевого лечения. Причинами летального исхода у подавляющего большинства из них были различные поражения легких — как правило, инфекционные. Онкологические больные особенно предрасположены к легочной инфекции по следующим причинам: 1. Нарушение иммунитета в результате агрессивной химиотерапии, лучевой терапии и применения иммунодепрессантов при трансплантации костного мозга. Кроме того, определенная степень иммуносупрессии вообще характерна для больных со злокачественными новообразованиями, особенно при заболеваниях крови, вызывающих угнетение кроветворения. При последних у 43 % пациентов поражение легких приводит к острой дыхательной недостаточности. 2. Пожилой и преклонный возраст большинства пациентов, у которых часто встречаются сопутствующие заболевания легких (эмфизема, пневмосклероз, бронхоэктатическая болезнь и др.). Они более склонны к гиподинамии, и среди них много курильщиков. 3. Наличие первичной или метастатической опухоли легких может вызвать сдавление дыхательных путей с развитием обтурационных ателектазов, в которых легко возникают воспалительные процессы. Сдавление легких может развиться также при обширном выпоте в плевральную полость и высоком стоянии и нарушении функции диафрагмы (асцит, ранний период после оперативных вмешательств на органах брюшной полости, ранение диафрагмальных нервов во время операций на органах средостения и др.). Особо следует остановиться на тех иммунных нарушениях у онкологических больных, которые играют наиболее важную роль в развитии инфекции нижних дыхательных путей у этого контингента больных. Объем лимфоидной ткани органов дыхания последовательно уменьшается от полости носа, где лимфоидная ткань наиболее развита, к бронхоальвеолярной области. В норме паренхима легких имеет слабораз- 127 infection_onco-03reclama.indd b2:127 27.10.2008 15:10:48 Основные виды инфекций у онкологических больных… 7 витую лимфоидную ткань, и иммунный ответ в этой части осуществляется за счет как локальных иммуноактивных лимфоцитов и макрофагов, так и местно-синтезированных и пришедших из кровотока специфических антител-иммуноглобулинов. Растворимые антигены поглощаются макрофагами, которые затем запускают локальный специфический клеточный и гуморальный иммунный ответ. Нерастворимые антигены эвакуируются наружу мукоцеллюлярным аппаратом слизистых оболочек дыхательных путей. Исход воспалительного процесса в легких во многом зависит от нормального функционирования лимфоидного аппарата кишечника, который физиологически связан с местным лимфоидным аппаратом легких и часто поражается при химиотерапии. Именно пост упление в органы дыхания специфических иммунокомпетентных Т- и В-лимфоцитов из лимфатической системы кишечника влияет на состояние легочного лимфоидного аппарата и, в конечном счете, на иммунокомпетентность всей иммунной системы органов дыхания. Поражение легких — основное инфекционное осложнение у онкологических больных, оно чаще всего является полиэтиологичным, отрицательно сказывается на выживании, длительности госпитализации и стоимости лечения [1, 16]. Пневмония у онкологических больных Внебольничная пневмония Возбудителями внебольничной пневмонии, как и у неонкологических больных, в большинстве случаев являются Streptococcus pneumoniae, Haemophilus influenzae или Moraxela cattaralis. Реже встречаются Mycoplasma pneumoniae, Legionella pneumophila или Chlamydia pneumoniae. Стафилококковая пневмония бывает редко, обычно она возникает на фоне вирусной инфекции. Больные с внебольничной легионеллезной пневмонией болеют особенно тяжело и часто нуждаются в интенсивной терапии. У онкологических больных чаще выделяется более одного воз- 3 будителя (в общей популяции это бывает редко и более характерно для аспирационной пневмонии). У больных с иммуносупрессией нередко наблюдается орофарингеальная колонизация кишечной грамотрицательной флорой. Сопровождающая пневмонию бактериемия является относительно ранним проявлением внебольничной пневмонии и не служит плохим прогностическим фактором. Описан случай пневмонии, вызванной Bacillus cereus, у больного острым лимфобластным лейкозом (ОЛЛ). Начало было острым, сопровождалось респираторными нарушениями и плевральными болями. B. cereus чаще всего является контаминантной микрофлорой, может вызывать желудочно-кишечную интоксикацию и, реже, тяжелое системное поражение. Тяжесть последнего связана с тканевыми некрозами, вызванными высвобождением токсина. Пневмония, вызванная B. cereus, поражает в основном иммунокомпрометированных пациентов и имеет плохой исход. Нозокомиальная пневмония (госпитальная) Онкологические больные предрасположены к нозокомиальной легочной инфекции, особенно ИВЛ-ассоциированой1 кроме того, у них чаще выявляется связанная c нозокомиальной пневмонией бактериемия. Бактериемия Pseudomonas aeruginosa более характерна для больных с солидными опухолями, чем для пациентов с нейтропенией, в связи с более ранним эмпирическим применением антибиотиков у последних [16]. Нередко к бактериальной инфекции присоединяется грибковая (почти в 50 % случаев представлена Candida albicans, но могут быть C. krusei, C. tropicalis, плесневые грибы). Для грибковых поражений легких характерно прогрессирование процесса на фоне активной антибиотикотерапии. Нозокомиальная пневмония часто имеет рецидивирующее течение, при этом «вторая волна» бывает обусловлена либо P. aeruginosa, либо Acinetobacter spp. [1]. 1 ИВЛ-ассоциированная пневмония – син. вентиляторассоциированная пневмония (ВАП) 128 infection_onco-03reclama.indd b2:128 27.10.2008 15:10:48 3 Неопухолевые заболевания и поражения легких у онкологических больных Абсцессы легких и абсцедирующая пневмония Частый механизм развития абсцесса легких — аспирация микрофлоры из верхних дыхательных путей. Множество факторов могут привести к развитию абсцесса легких: бронхоэктазы, эмболия легочной артерии, экстра- или интрабронхиальная обструкция, часто сопряженная с новообразованием в легких. У неонкологических пациентов абсцессы легких обычно вызываются анаэробами полости рта (бактероиды, фузобактерии, актиномицеты), а также аэрофильными и микроаэрофильными кокками и такими патогенными возбудителями, как Haemophilus influenzae и Streptococcus pneumoniae. У онкологических больных возбудителями могут быть кишечные грамотрицательные аэробы (в частности, Pseudomonas spp.), Legionella spp., S. aureus, Nocardia spp. и грибы. Факторами плохого прогноза являются большие размеры абсцесса или наличие множественных абсцессов, вовлечение нижней доли правого легкого, присутствие S. aureus, K. pneumoniae, P. aeruginosa, а также пожилой возраст. Летальность при абсцессе легкого достигает 30 %. Нередко абсцедирующая пневмония вызывается синегнойной палочкой (P. aeruginosa), при этом на рентгенограмме и компьютерной томограмме видны множественные полости, преимущественно в нижних долях легких. Пневмония у больных с нейтропенией Пневмония у больных с нейтропенией, в первую очередь сопровождающаяся бактериемией, является основной причиной их смерти, особенно при инфицировании Pseudomonas aeruginosa, Klebsiella spp. и другими энтеробактериями, а также Streptococcus pneumoniae. Рентгенологические проявления могут отставать от клинических. Факторами повышенного риска возникновения стафилококковой пневмонии являются постоянные венозные катетеры, орофарингеальная колонизация стафилококками и мукозиты, вызванные химиотерапией. Последние могут повысить способность грамотрицательных бактерий проникать в дыхательный эпителий. У пациентов с глубокой нейтропенией (менее 100 кл/мм3) риск развития пневмонии, резистентной к антибактериальной терапии, намного выше, чем у больных с числом клеток более 500 в 1 мм3 [1]. При кратковременной нейтропении (менее 1 нед.) самая частая микрофлора, как и в общей популяции, — грамотрицательные бактерии, которые находятся в ЖКТ и колонизируют ротоглотку больных в стационаре. Обычно это P. aeruginosa, Klebsiella pneumoniae и Enterobacter spp., но могут быть и Legionella spp. и Aspergillus spp. Клинические и рентгенологические изменения в легких при этом обычно развиваются одновременно с лихорадкой, часто не поддаются лечению в начале эмпирической антибактериальной терапии. Такие «резистентные» пневмонии могут быть вызваны Stenotrophomonas maltophila, Alcaligenes xylosoxidans, Corynebacterium spp. и Bacteroides fragilis, а также Legionella spp., Mycobacterium spp., Nocardia spp., Cryptococcus spp. и диморфными грибами. Легочный аспергиллез. Клиническими особенностями инвазивного легочного аспергиллеза являются лихорадка, одышка, сухой непродуктивный кашель, сухие хрипы, плевральные боли в грудной клетке. Трахеобронхиальный аспергиллез проявляется хроническим кашлем, одышкой, кровохарканьем, вызванным тромбозом сосудов малого круга кровообращения и инфарктами легких. На рентгенограмме у больных с ФН, которая сохраняется несмотря на лечение антибиотиками, обычно появляются периплевральные очаговые тени, иногда можно видеть полости, а также диссеминированное поражение. Однако признаки аспергиллеза часто отсутствуют на обычной рентгенограмме, но хорошо выявляются при спиральной КТ легких. На компьютерной томограмме видны утолщения стенки крупных бронхов и мелкие инфильтраты в легочной паренхиме. Для установления окончательного диагноза необходима бронхоскопия, при которой часто виден специфичный пенистый экссудат на стенках бронхов (см. также гл. 21). Легионеллез. Проявления легионеллеза варьируют от субфебрильной температуры до дыхательной и полиорганной недостаточности. Обычны малопродуктивный кашель, 7 129 infection_onco-03reclama.indd b2:129 27.10.2008 15:10:48 3 Неопухолевые заболевания и поражения легких у онкологических больных переходит в трахею и бронхи, вызывая пневмонию. Через кишечную стенку микробы на 3–4-е сутки после развития ОРДС перемещаются в брюшную полость, вызывая иногда воспалительные изменения, абсцессы, перитониты, особенно у оперированных больных. Важно отметить, что этот процесс может происходить без участия экзогенной инфекции. У онкологических больных с дефицитом иммунитета и снижением резистентности к инфекции этот процесс развивается особенно быстро и значительно ухудшает прогноз лечения. Морфологические легких при ОРДС изменения в Развитие ОРДС можно разделить на пять стадий, для каждой из которых описаны свои проявления, в том числе морфологические. Кроме того, для морфологической картины легких характерна негомогенность поражения, т. е. одновременное присутствие изменений различной выраженности и различных стадий в отдельных, иногда соседних участках легких. Макроскопически масса легких значительно увеличена (в 1,5–2 раза), они становятся жесткими на ощупь, имеется гнойный трахеобронхит, множественные ателектазы различной величины и давности, кровоизлияния под плевру и в периферические отделы паренхимы. На разрезе — ткань легкого темно-красного цвета с кровоизлияниями, подчеркнутым долько- вым рисунком; с поверхности разреза обильно стекает жидкость и кровь. При микроскопии в I стадии ОРДС видно полнокровие капилляров, красные и белые микротромбы в них, мелкие фокусы ателектазов, интерстициальный отек, расширение межэндотелиальных капиллярных промежутков (рис. 7.2). Во II стадии ОРДС микроскопически, наряду с увеличением интерстициального отека, становится больше спавшихся альвеол, наблюдается деформация бронхиол и неспавшихся альвеол; появляются участки опеченения легочной ткани, в альвеолах не только отечная жидкость, но и эритроциты, слущенные альвеолоциты (рис. 7.3). В III стадии ОРДС видны кровоизлияния в альвеолы и периваскулярно, еще больше выражены полнокровие и интерстициальный отек; увеличено число коллабированных альвеол, воздух содержится лишь в расширенных бронхиолах; тромбы и агрегаты из клеток крови находятся не только в микрососудах, но и в сосудах среднего калибра. Во многих участках отмечается разрушение межальвеолярных перегородок, очаги воспалительной инфильтрации. Образуются гиалиновые мембраны в стенках неспавшихся альвеол (рис. 7.4). В IV стадии ОРДС происходит увеличение плотности и безвоздушности легочной ткани. На разрезе легкое — пестрого цвета, жесткое на ощупь, с него стекает мутная жидкость 7 Рис. 7.2. Морфологические изменения легких при Рис. 7.3. Морфологические изменения в легких ОРДС I стадии (ИВЛ не проводилась). Выражен интерстициальный отек, фибрин в альвеолах, слущивание альвеолоцитов, тромб в артериоле, ×140 при ОРДС II стадии (ИВЛ не проводилась). Разрывы межальвеолярных перегородок, альвеолы заполнены отечной жидкостью с нитями фибрина, ×140 151 infection_onco-03reclama.indd b2:151 27.10.2008 15:10:49 Основные виды инфекций у онкологических больных… 7 3 и кровь. Обнаруживаются только небольшие воздушные участки розового цвета, много зон серого цвета (воспалительная инфильтрация) на фоне темной безвоздушной ткани («мраморное легкое»). Микроскопически — диффузные кровоизлияния, увеличение числа и толщины гиалиновых мембран, много тромбов, очагов воспаления с нагноением и распадом (рис. 7.5). В V стадии ОРДС под микроскопом видно разрастание соединительной ткани с полным замещением ею коллабированных и разрушенных альвеол — фиброз легких (рис. 7.6). В целом, если на ранних этапах развития синРис. 7.4. Морфологические изменения легких при дрома коллагеновые волокна в легких сохраОРДС III стадии (ИВЛ не проводилась). Разрывы меняют свою структуру, примерно к III–IV стадии жальвеолярных перегородок, заполнение альвеол ОРДС они деградируют. Ателектазы и интерслущенными альвеолоцитами, фибрином и форстициальный отек преобладают в раннем пеменными элементами крови; появление гиалинориоде ОРДС, а в позднем они имеют меньшее вых мембран вдоль стенок неспавшихся альвеол, значение, на первый план выступают процессы ×140 фиброза. На поздних этапах синдрома к описанным неспецифическим изменениям присоединяются очаги банального воспаления (пневмонии), имеющие склонность к абсцедированию. Следует отметить, что при ОРДС, вызванном различными причинами, морфологические изменения в легких носят весьма схожий характер. Именно это нарастание и углубление структурных поражений легочной паренхимы и определяют клиническую картину ОРДС. Рис. 7.5. Морфологические изменения в легких Клинические и рентгенологические проявления острого респираторного дистресс-синдрома при ОРДС IV стадии (проводилась длительная ИВЛ). Сформированная гиалиновая мембрана, ×160 Клиническое течение ОРДС также можно условно разделить на пять стадий. I стадия ОРДС. Для ОРДС характерен некий «светлый промежуток» мнимого благополучия — от нескольких часов до 1–2 сут от момента улучшения гемодинамики в процессе лечения до появления первых симптомов повторного ухудшения состояния больных. НаРис. 7.6. Морфологические изменения в легких при ОРДС V стадии (ИВЛ не проводилась). Фиброз альвеол с их облитерацией, фиброз альвеолярных стенок, гиалиновые мембраны (окраска по ВанГизону, ×140) 152 infection_onco-03reclama.indd b2:152 27.10.2008 15:10:50 3 Неопухолевые заболевания и поражения легких у онкологических больных Рис. 7.7. Рентгенограмма легких больного В., 47 лет. Диагноз: рак левой доли печени, резекция печени, массивная кровопотеря, 2-е сутки после операции, ОРДС II стадии (исследование в условиях самостоятельного дыхания) 7 стораживающими признаками являются сохранение тахикардии до 100–110 уд/мин, наклонность к артериальной гипертонии и умеренная гипервентиляция за счет увеличения дыхательного объема со снижением РаСО2 до 34–30 мм рт. ст.; РаО2 может быть 85–90 мм рт. ст., а SpO2 — 90–92 %, особенно если больному проводят ингаляции кислорода. На рентгенограммах никаких патологических изменений чаще всего не обнаруживают, однако у отдельных больных первые признаки поражения легких появляются еще до клинических проявлений дыхательной недостаточности. II стадия ОРДС. Обычно ухудшение состояния, иногда очень резкое, происходит в конце первых — начале вторых суток. Первыми признаками чаще являются изменения психики: сонливость или беспокойство, у части больных — неадекватность поведения. При нормальной температуре тела дыхание учащается до 24–26 в минуту, у некоторых больных в дыхании начинают принимать участие дополнительные мышцы. Больные начинают жаловаться на нехватку воздуха, речь становится прерывистой. Выслушивается жесткое дыхание над всеми легочными полями, иногда сухие хрипы в заднебоковых отделах. Тахикардия до 110–120 уд/мин, если больной не получает лекарственные средства, урежающие пульс (бета-блокаторы, блокаторы каль- циевых каналов и др.). Артериальное давление чаще всего повышено, но это также зависит от проводимой терапии. У большинства больных ЦВД имеет тенденцию к возрастанию. Гипоксемия (SpO2 ниже 92–91 % и РаО2 ниже 80 мм рт. ст.), легко устраняемая ингаляцией кислорода, но отношение PaO2/FIO2 уменьшено до 190–170; РаСО2, как правило, умеренно снижено (30–32 мм рт. ст.). На рентгенограмме легких — усиление и ячеистая деформация легочного рисунка, могут появляться мелкоочаговые тени в периферических отделах (рис. 7.7). Провести четкую грань между I и II стадиями по клиническим признакам бывает трудно. Поскольку больным, как уже упоминалось, чаще всего проводят кислородную терапию, оценка состояния по степени оксигенации крови может быть ошибочной. III стадия ОРДС. Обычно развивается на 2–3-и сутки, но иногда немного раньше или позже. Появляются четкие признаки острой дыхательной недостаточности, в этой стадии больные уже нуждаются в респираторной поддержке. Пациенты возбуждены, иногда апатичны, сознание спутано. Частота дыхания 30–40 в минуту, участвуют вспомогательные мышцы. В легких жесткость дыхания нарастает, возникает бронхиальный оттенок и даже амфорическое дыхание. В условиях ИВЛ в боковых и задних отделах легких создается впечат- 153 infection_onco-03reclama.indd b2:153 27.10.2008 15:10:50