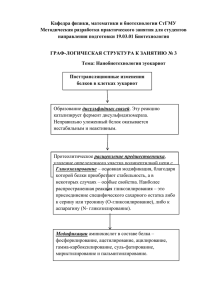
АА - акриламид - Российский онкологический научный центр им
реклама

ФГБУ «РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ НАУЧНЫЙ ЦЕНТР ИМ. Н.Н. БЛОХИНА» РАМН на правах рукописи ЧЕСНОКОВ МИХАИЛ СЕРГЕЕВИЧ ВЛИЯНИЕ ЭКСПРЕССИИ ИЗОФОРМ ЯДЕРНОГО РЕЦЕПТОРА HNF4α НА СВОЙСТВА КЛЕТОК ПРОТОКОВОЙ АДЕНОКАРЦИНОМЫ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА Специальность 14.01.12 – Онкология Диссертация на соискание ученой степени кандидата биологических наук Научный руководитель: профессор, доктор биологических наук Н.Л. Лазаревич МОСКВА 2014 2 ОГЛАВЛЕНИЕ 1. ВВЕДЕНИЕ ............................................................................................................................ 6 1.1. Актуальность темы ..................................................................................................... 6 1.2. Цели и задачи исследования ..................................................................................... 8 1.3. Научная новизна и практическая значимость работы ....................................... 9 1.4. Основные положения, выносимые на защиту ....................................................... 10 1.5. Апробация работы ....................................................................................................... 11 2. ОБЗОР ЛИТЕРАТУРЫ ....................................................................................................... 11 2.1. Канцерогенез и опухолевая прогрессия .................................................................. 11 2.1.1. Особенности опухолевой клетки ........................................................................ 11 2.1.2. Эпителиально-мезенхимальный переход ........................................................... 13 2.2. Поджелудочная железа ............................................................................................... 15 2.2.1. Поджелудочная железа: строение и функции ................................................... 15 2.2.2. Эмбриональное развитие поджелудочной железы ........................................... 18 2.2.3. Патологии поджелудочной железы .................................................................... 20 2.3. Протоковая аденокарцинома поджелудочной железы (ПАКПЖ) ..................... 22 2.3.1. Патогенез и этапы развития ПАКПЖ ................................................................ 22 2.3.2. Биомаркеры ПАКПЖ ........................................................................................... 24 2.4. Основные регуляторы дифференцировки клеток поджелудочной железы .... 26 2.4.1. PDX1 ...................................................................................................................... 27 2.4.2. PTF1α ..................................................................................................................... 29 2.4.3. Гепатоцитарные ядерные факторы ..................................................................... 30 2.5. Транскрипционный фактор HNF4α ........................................................................ 37 2.5.1. Строение гена HNF4A и его изоформы .............................................................. 37 2.5.2. Транскрипционная активность HNF4α .............................................................. 39 2.5.3. HNF4α в развитии и функционировании эпителиальных органов и тканей .. 40 2.5.4. Другие представители семейства HNF4 ............................................................. 43 2.5.5. Механизмы регуляции экспрессии HNF4α ....................................................... 44 2.6. Роль HNF4α в канцерогенезе .................................................................................... 46 2.6.1. HNF4α в развитии гепатоцеллюлярной карциномы ......................................... 46 2.6.2. HNF4α в опухолях других органов ..................................................................... 48 2.7. Заключение обзора литературы ............................................................................... 50 3 3. МАТЕРИАЛЫ И МЕТОДЫ ............................................................................................... 51 3.1. Растворы, среды и реактивы .................................................................................... 51 3.2. Олигонуклеотидные праймеры ................................................................................ 53 3.3. Ферменты ...................................................................................................................... 55 3.4. Плазмидные векторы ................................................................................................. 55 3.5. Клеточные линии ........................................................................................................ 56 3.6. Клинические образцы ткани ..................................................................................... 56 3.7. Наращивание и выделение плазмид ....................................................................... 57 3.8. Лентивирусная инфекция клеток линий ПАКПЖ .............................................. 57 3.9. Выделение суммарной клеточной РНК .................................................................. 58 3.10. Обратная транскрипция .......................................................................................... 59 3.11. Полимеразная цепная реакция ............................................................................... 59 3.12. Количественная полимеразная цепная реакция с детекцией в реальном времени ...................................................................................................................... 60 3.13. Белковый ДСН-электрофорез в ПААГ.................................................................. 61 3.14 Электроперенос белков из ПААГ на PVDF-мембрану ........................................ 62 3.15. Иммуноблоттинг ........................................................................................................ 62 3.16. Фиксация клеток ....................................................................................................... 63 3.17. Иммунофлюоресцентная окраска клеток на HNF4αTOT и E-кадхерин ........ 63 3.18. Определение интенсивности синтеза ДНК ........................................................... 64 3.19. Клоногенный тест ..................................................................................................... 64 3.20. Измерение кинетики роста клеточных культур in vitro .................................... 65 3.21. Миграционный тест .................................................................................................. 65 3.22. Статистическая обработка данных ....................................................................... 66 4. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ ................................................................................... 67 4.1. Выбор модельной системы для исследования роли изменения экспрессии HNF4α в клетках ПАКПЖ ....................................................................................... 67 4.2. Выбор исследуемых тканеспецифических генов, связанных с уровнем дифференцировки и функциями поджелудочной железы ................................ 70 4.3. Характеристика экспрессии генов в культурах клеток ПАКПЖ с различным уровнем дифференцировки ............................................................... 72 4.4. Исследование влияния экзогенной экспрессии HNF4α на злокачественный потенциал культур низкодифференцированных клеток ПАКПЖ Panc1 и MiaPaCa ....................................................................................................................... 74 4 Получение 4.4.1. клеточных культур Panc1 и MiaPaCa2, экзогенно экспрессирующих изоформы HNF4α1 и HNF4α7 ........................................... 74 4.4.2. Определение уровней экспрессии изоформ и групп изоформ HNF4α в клетках Panc1-HNF4α и MiaPaCa2-HNF4α ...................................................... 74 4.4.3. Определение уровней синтеза белка HNF4α в клетках Panc1-HNF4α и MiaPaCa2-HNF4α ................................................................................................ 77 4.4.4. Изменения экспрессии тканеспецифических транскрипционных факторов в клетках Panc1-HNF4α и MiaPaCa2-HNF4α ...................................................... 78 4.4.5. Изменения экспрессии функциональных панкреатических генов в клетках Panc1-HNF4α и MiaPaCa2-HNF4α .................................................................... 83 4.4.6. Влияние экзогенной экспрессии HNF4α на биологические характеристики клеток Panc1 и MiaPaCa2 ................................................................................... 86 4.4.6.1. Определение скорости роста клеточных культур Panc1-HNF4α и MiaPaCa2-HNF4α .................................................................................... 87 4.4.6.2. Исследование интенсивности синтеза ДНК в клетках Panc1-HNF4α и MiaPaCa2-HNF4α ................................................................................. 89 4.4.6.3. Снижение колониеобразующей способности клеток Panc1 и MiaPaCa2 при экзогенной экспрессии HNF4α .................................... 91 4.4.6.4. Усиление способности клеток Panc1-HNF4α и MiaPaCa2-HNF4α к направленной миграции ......................................................................... 94 4.5. Исследование влияния подавления синтеза HNF4α на злокачественный потенциал культуры высокодифференцированных клеток ПАКПЖ CaPan2. 99 4.5.1. Получение клеточных культур CaPan2 с подавленным синтезом HNF4α ..... 99 4.5.2. Определение уровней синтеза белка HNF4α в клетках CaPan2-shHNF4α ...... 100 4.5.3. Определение уровней экспрессии изоформ и групп изоформ HNF4α в клетках CaPan2-shHNF4α .................................................................................. 101 4.5.4. Изменения экспрессии тканеспецифических транскрипционных факторов в клетках CaPan2-shHNF4α .................................................................................. 102 4.5.5. Изменения экспрессии функциональных панкреатических генов в клетках CaPan2-shHNF4α ................................................................................................. 106 4.5.6. Влияние подавления синтеза HNF4α на биологические характеристики клеток CaPan2-shHNF4α .................................................................................... 108 4.5.6.1. Повышение скорости роста клеточных культур CaPan2-shHNF4α ..... 109 4.5.6.2. Усиление интенсивности синтеза ДНК в клетках CaPan2-shHNF4α .. 110 5 4.5.6.3. Увеличение колониеобразующего потенциала клеток CaPan2 при подавлении синтеза HNF4α ................................................................... 111 4.5.6.4. Повышение способности клеток CaPan2-shHNF4α к направленной миграции .................................................................................................. 112 4.6. Исследование влияния подавления синтеза HNF4α на злокачественнй потенциал культуры умереннодифференцированных клеток ПАКПЖ AsPC1 ........................................................................................................................... 116 4.6.1. Получение клеточных культур AsPC1 с подавленным синтезом HNF4α ...... 116 4.6.2. Определение уровней синтеза белка HNF4α в клетках AsPC1-shHNF4α ....... 117 4.6.3. Определение уровней экспрессии изоформ и групп изоформ HNF4α в клетках AsPC1-shHNF4α .................................................................................... 118 4.6.4. Изменения экспрессии тканеспецифических транскрипционных факторов в клетках AsPC1-shHNF4α .................................................................................... 120 4.6.5. Изменения экспрессии функциональных панкреатических генов в клетках AsPC1-shHNF4α .................................................................................................. 123 4.6.6. Влияние подавления синтеза HNF4α на биологические характеристики клеток AsPC1 ...................................................................................................... 126 4.6.6.1. Замедление роста культур AsPC1-shHNF4α in vitro ............................. 126 4.6.6.2. Ослабление ДНК-синтетической активности клеток AsPC1 при подавлении синтеза HNF4α ................................................................... 4.6.6.3. Снижение колониеобразующего потенциала клеток 127 AsPC1- shHNF4α .................................................................................................. 128 4.6.6.4. Усиление способности клеток AsPC1 к направленной миграции при подавлении синтеза HNF4α ................................................................... 129 4.7. Исследование уровней экспрессии HNF4α и других тканеспецифических генов в клинических образцах ткани ПАКПЖ человека ................................................ 132 4.7.1. Анализ уровней экспрессии HNF4α и групп его изоформ в панели клинических образцов ПАКПЖ ........................................................................ 132 4.7.2. Исследование корреляции между экспрессией изоформ HNF4α и панкреаспецифических генов в клинических образцах ПАКПЖ ............................... 136 5. ЗАКЛЮЧЕНИЕ .................................................................................................................... 140 6. ВЫВОДЫ ............................................................................................................................... 143 7. СПИСОК СОКРАЩЕНИЙ ................................................................................................ 144 8. СПИСОК ЛИТЕРАТУРЫ .................................................................................................. 147 6 1. ВВЕДЕНИЕ 1.1. АКТУАЛЬНОСТЬ ТЕМЫ Протоковая аденокарцинома поджелудочной железы (ПАКПЖ) является наиболее распространенной формой опухолевых заболеваний поджелудочной железы (ПЖ). Она отличается чрезвычайно высокой агрессивностью, высокой скоростью прогрессии, бессимптомным течением ранних стадий заболевания. Из-за этих особенностей ПАКПЖ, как правило, диагностируется на поздних стадиях развития и плохо поддается лечению с использованием большинства современных терапевтических подходов. На сегодняшний день молекулярные механизмы развития этого типа опухолей остаются плохо исследованными, достаточно эффективных диагностических и предиктивных биомаркеров этого типа опухолей также не описано. Ввиду перечисленных фактов исследование механизмов возникновения и прогрессии ПАКПЖ является одной из наиболее актуальных проблем современной фундаментальной онкологии. Закладка и формирование ПЖ в ходе эмбрионального развития регулируется сложным каскадом транскрипционных факторов, среди которых важную роль играет группа гепатоцитарных ядерных факторов (ГЯФ). Эта группа включает 5 неродственных семейств транскрипционных факторов (HNF1, FOXA, HNF4, ONECUT, C/EBP), экспрессирующихся в различных сочетаниях в клетках печени, ПЖ, кишечника, желудка, почки и ряда других эпителиальных органов. Факторы этих пяти семейств образуют в клетках комплексную регуляторную сеть, контролирующую различные этапы развития тканей и их функции. Ряд исследований показал, что в гепатоцитах центральную роль в регуляции этой сети играет фактор HNF4α. Транскрипция гена HNF4A происходит с двух альтернативных промоторов (P1 и P2), в результате чего образуется две группы изоформ, HNF4αP1 и HNF4αP2, отличающихся транс-активирующей способностью, что позволяет им регулировать различные наборы генов. Соотношение уровней экспрессии изоформ групп HNF4αP1 и HNF4αP2 имеет определяющее значение для дифференцировки гепатоцитов и может влиять на дифференцировку других клеток; для разных органов характерны специфические спектры экспрессии изоформ HNF4α. Нарушения экспрессии изоформ HNF4α тесно связаны с возникновением и прогрессией гепатоцеллюлярной карциномы – самой распространенной формы первичных опухолей печени. HNF4α в гепатоцитах выполняет роль опухолевого супрессора, восстановление утраченной экспрессии HNF4αP1 в дедифференцированных клетках гепатоцеллюлярной карциномы приводит к частичной реверсии злокачественного фенотипа этих клеток. Противоопухолевая 7 функция HNF4α описана также в клетках кишечного эпителия, почки, эмбриональной карциномы, инсулиномы. Роль HNF4α в возникновении и прогрессии ПАКПЖ на сегодняшний день остается практически не исследованной. Данная работа посвящена исследованию возможного влияния изменений экспрессии изоформ HNF4α в ПАКПЖ на уровень дифференцировки и биологические свойства клеток, отвечающие за развитие их злокачественного фенотипа. В качестве модельной системы для исследования функций HNF4α в клетках ПАКПЖ мы использовали панель из четырех клеточных линий ПАКПЖ человека, отличающихся друг от друга уровнями дифференцировки и спектрами экспрессии изоформ HNF4α. В зависимости от исходных уровней экспрессии HNF4α в исследуемых клеточных культурах, в них либо экзогенно экспрессировали изоформы HNF4α1 или HNF4α7, либо подавляли эндогенную экспрессию HNF4α с помощью малых шпилечных РНК (мшРНК). Анализ изменений спектров экспрессии панкреа-специфических генов и биологических параметров клеток при изменениях в них уровней синтеза изоформ HNF4α позволил установить основные закономерности влияния HNF4α на дифференцировочный статус и злокачественный потенциал клеток ПАКПЖ. Обнаруженные изменения активности тканеспецифических генов, вызванные изменениями экспрессии HNF4α, были верифицированы на панели клинических образцов ткани ПАКПЖ, полученных при проведении гастропанкреатодуоденальных резекций в отделении опухолей печени и поджелудочной железы ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН. 8 1.2. ЦЕЛИ И ЗАДАЧИ ИССЛЕДОВАНИЯ Целью настоящей работы является анализ роли изменений экспрессии изоформ фактора HNF4α в клетках протоковой аденокарциномы поджелудочной железы и исследование влияния этого фактора на экспрессию генов и основные биологические характеристики опухолевых клеток, определяющие выраженность их злокачественного фенотипа. Для достижения этой цели нами были поставлены следующие задачи: 1. С помощью лентивирусных конструкций получить культуры дедифференцированных клеток ПАКПЖ человека, экзогенно экспрессирующие изоформы HNF4α1 и HNF4α7. 2. Исследовать влияние экзогенной экспрессии изоформ HNF4α в дедифференцированных клетках ПАКПЖ на уровни экспрессии регуляторов дифференцировки и функциональных генов ПЖ, а также на биологические свойства этих клеток. 3. С помощью мшРНК, комплементарных к последовательности мРНК HNF4α, получить культуры высоко- и умереннодифференцированных клеток ПАКПЖ с подавленной экспрессией HNF4α. 4. Исследовать влияние подавления синтеза HNF4α в высоко- и умереннодифференцированных клетках ПАКПЖ на уровни экспрессии регуляторов дифференцировки и функциональных генов ПЖ, а также на биологические свойства этих клеток. 5. Провести верификацию обнаруженных закономерностей экспрессии панкреа- специфических генов на панели клинических образцов ткани ПАКПЖ и неопухолевой панкреатической ткани тех же пациентов. 9 1.3. НАУЧНАЯ НОВИЗНА И ПРАКТИЧЕСКАЯ ЗНАЧИМОСТЬ РАБОТЫ Научная новизна исследования определяется тем, что в представленной работе впервые произведен анализ роли изменений экспрессии изоформ HNF4α в клетках ПАКПЖ человека. Ранее роль нарушений экспрессии HNF4α в канцерогенезе была исследована в опухолях печени, кишечника и клетках инсулиномы. Антипролиферативное действие HNF4α описано также в клетках почки и эмбриональной карциномы. Однако на сегодняшний день ни одной работы, направленной на исследование нарушений экспрессии HNF4α в клетках ПАКПЖ, в научной литературе не опубликовано. В работе исследованы изменения уровней экспрессии важнейших регуляторов дифференцировки панкреатических клеток (PDX1, PTF1α, факторов семейств HNF1, FOXA, HNF4, ONECUT), которые наблюдаются при активации или подавлении экспрессии изоформ HNF4α в клеточных линиях ПАКПЖ человека. Параллельно в этих же культурах проанализированы изменения экспрессии функциональных генов ПЖ (α-амилаза-2a, эластаза2a), регулятора пролиферации p21CIP1/WAF1 и белков межклеточных адгезионных контактов Eкадхерина и N-кадхерина. Показано, что изменения экспрессии HNF4α могут оказывать значительное влияние на уровень дифференцировки клеток ПАКПЖ. Другой важной частью работы является исследование влияния изменений экспрессии HNF4α на биологические характеристики клеток ПАКПЖ, определяющие уровень их злокачественности: пролиферативную активность, способность к колониеобразованию и миграционный потенциал. В результате исследований обнаружено, что фактор HNF4α в клетках ПАКПЖ может выполнять функции опухолевого супрессора и оказывать ингибирующий эффект на их пролиферативную и колониеобразующую активность, а также регулировать способность этих клеток к миграции. Более того, впервые описано ослабление пролиферативного и клоногенного потенциала при подавлении гиперэкспрессированного HNF4α в умереннодифференцированных клетках ПАКПЖ. Обнаруженные при исследовании клеточных культур закономерности экспрессии HNF4α и других тканеспецифических генов верифицированы на панели клинических образцов ПАКПЖ человека. Впервые произведен анализ нарушений экспрессии изоформ HNF4α в ткани ПАКПЖ и корреляций этих нарушений с экспрессией маркеров дифференцировки клеток ПЖ. Исследование взаимосвязей между экспрессией групп определенных генов и прогрессией ПАКПЖ представляет перспективное направление в современной онкологии. Установление роли отдельных факторов в развитии злокачественного фенотипа опухолевых клеток ПЖ позволит обнаружить новые биомаркеры этого типа опухолей, которые можно будет использовать для разработки новых диагностических и прогностических подходов. Выявление молекулярных механизмов, ответственных за первоначальную трансформацию протоковых 10 клеток ПЖ и их дальнейшую прогрессию, может дать ключ к разработке новых высокоэффективных методов таргетной терапии этого типа опухолей. 1.4. ОСНОВНЫЕ ПОЛОЖЕНИЯ, ВЫНОСИМЫЕ НА ЗАЩИТУ 1. Нарушения экспрессии изоформ ядерного рецептора HNF4α играют важную роль в формировании злокачественного фенотипа ПАКПЖ; 2. Получены и охарактеризованы культуры низкодифференцированных клеток ПАКПЖ человека, экзогенно экспрессирующие изоформы HNF4α1 и HNF4α7, а также культуры высоко- и умереннодифференцированных клеток ПАКПЖ человека с подавленной экспрессией HNF4α; 3. Экзогенная экспрессия изоформ HNF4α в низкодифференцированных клетках ПАКПЖ приводит к их частичной редифференцировке и снижению их злокачественного потенциала; 4. В высокодифференцированных клетках ПАКПЖ при подавлении в них синтеза HNF4α снижается уровень дифференцировки и усиливается злокачественный потенциал; 5. Подавление синтеза HNF4α в умереннодифференцированных клетках ПАКПЖ приводит к неоднозначным изменениям их дифференцировочного статуса и биологических свойств; 6. Нарушения экспрессии изоформ HNF4α часто наблюдаются в клинических образцах ПАКПЖ человека; 7. Закономерности экспрессии HNF4α и ряда других панкреа-специфических генов в клинических образцах ПАКПЖ человека сходны с наблюдаемыми в исследованных моделях культур клеток in vitro. 1.5. АПРОБАЦИЯ ДИССЕРТАЦИИ Апробация диссертации состоялась 26 сентября 2013 года на объединенной конференции лабораторий механизмов прогрессии эпителиальных опухолей, механизмов гибели опухолевых клеток, цитогенетики, регуляции клеточных и вирусных онкогенов и механизмов канцерогенеза НИИ канцерогенеза ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН. Результаты представленной работы доложены и обсуждены на международной конференции FEBS Advanced Lecture Course «Spetses Summer School on Nuclear Receptor Signalling in Physiology and Disease» (о. Спеце, 2011), I Всероссийской конференции «Внутриклеточная сигнализация, транспорт, цитоскелет» (Санкт-Петербург, 2011), международной конференции «The 38th FEBS Congress: Mechanisms in Biology» (Санкт-Петербург, 2013). 11 2. ОБЗОР ЛИТЕРАТУРЫ 2.1. КАНЦЕРОГЕНЕЗ И ОПУХОЛЕВАЯ ПРОГРЕССИЯ Проблема идентификации молекулярных механизмов, лежащих в основе развития злокачественных новообразований, на сегодняшний день является одной из самых актуальных в биологии и медицине. Смертность от злокачественных опухолей во многих странах мира занимает 2-е – 3-е место среди общей смертности населения. Исследования причин возникновения и закономерностей прогрессии опухолей на сегодняшний день ведутся по очень многим направлениям. Открытие генов, изменение функций которых является определяющим для развития различных типов опухолей, положило начало новому направлению в биохимии и молекулярной биологии, изучающему молекулярные основы канцерогенеза и возможные пути борьбы со злокачественными новообразованиями на молекулярном уровне. 2.1.1. Особенности опухолевой клетки Развитие злокачественных новообразований – сложный многостадийный процесс, включающий в себя как появление опухолевых клеток, так и дальнейшее изменение их свойств. Для исследования процессов канцерогенеза на сегодняшний день используется несколько подходов: индукция опухолевой трансформации в нормальных клетках, исследование клеточных линий, полученных из опухолевых тканей, и образцов тканей, взятых у больных, исследование онкогенных вирусов и другие. При исследовании экспериментальных моделей химического канцерогенеза была разработана концепция инициации и промоции опухолей, согласно которой в результате инициации клетка претерпевает необратимые генотипические изменения, но этих изменений еще не достаточно для ее превращения в опухолевую. На стадии промоции в клетке происходят дальнейшие процессы, такие как накопление соматических мутаций, делеции и амплификации генов и их участков, перестройки хромосом, которые приводят к формированию опухолевого фенотипа. После появления первичных опухолевых клеток начинается процесс опухолевой прогрессии - постепенного изменения морфологических, биохимических и физиологических характеристик клеток опухолевой ткани, приводящего к повышению способности клетки к выживанию и усиленной пролиферации, что приводит к усилению злокачественности клеточного фенотипа. В настоящее время выделяют следующие основные изменения, сопровождающие развитие опухоли: 12 Нарушение контроля пролиферации; Появление независимости от внешних ростовых факторов; Уклонение от иммунологического надзора; Отключение программы апоптоза и активация теломеразы; Стимуляция ангиогенеза; Индукция воспалительного ответа в прилежащих к опухоли областях; Увеличение генетической нестабильности; Нарушения энергетических систем клетки; Нарушение межклеточных контактов; Нарушение контактов с внеклеточным матриксом; Утрата дифференцировки; Увеличение клеточной подвижности, появление способности к инвазии и метастазированию [Hanahan and Weinberg, 2000; Заридзе, 2004; Hanahan and Weinberg, 2011]. В основе этих процессов лежит изменение активности множества генов и кодируемых ими белков, участвующих в регуляции функций и биологических свойств клетки. По той роли, которую играют эти изменения в формировании злокачественного фенотипа клетки, выделяют следующие типы генов: Онкогены – клеточные или вирусные гены, активация которых повышает вероятность опухолевого перерождения клеток; Протоонкогены – гены, активность которых свойственна нормальным клеткам, однако изменение их активности или функции в результате мутаций превращает их в онкогены; Опухолевые супрессоры – клеточные гены, инактивация которых резко увеличивает вероятность малигнизации клеток. Изменения уровней экспрессии или нуклеотидной последовательности этих генов приводят к нарушению нормальных функций кодируемых ими белков, вовлеченных в регуляцию клеточного деления, дифференцировки, подвижности и многих других свойств. Исследование механизмов влияния этих белков на состояние клетки в целом и закономерностей взаимодействия между ними может дать ключ к пониманию общей схемы появления и развития злокачественных опухолей, и, следовательно, указать возможности терапии этих заболеваний. Для опухолей эпителиального происхождения, составляющих большую часть всех злокачественных новообразований, крайне важным комплексом изменений свойств является эпителиально-мезенхимальный переход. 13 2.1.2. Эпителиально-мезенхимальный переход «Эпителиально-мезенхимальный переход» (ЭМП) – общее совокупное название изменений, при которых эпителиальные клетки утрачивают характерный фенотип и приобретают признаки мезенхимальных. ЭМП характеризуется определенными биохимическими и морфологическими изменениями. Это довольно распространенный процесс, наблюдающийся в ходе нормального эмбриогенеза: превращение эпителиальных клеток в мезенхимальные наблюдается при гаструляции, а также во время закладки мышечной ткани и периферической нервной системы [Thiery, 2002]. В определенных условиях может быть осуществлен и обратный процесс мезенхимально-эпителиального перехода (МЭП) [Locascio and Nieto, 2001]. Схематически цикл ЭМП и МЭП представлен на Рисунке 1: Рисунок 1. Последовательные этапы ЭМП и МЭП [адаптировано из Thiery and Sleeman, 2006]. ЭМП наблюдается также при прогрессии эпителиальных опухолей, что приводит к утрате дифференцировки клеток и возникновению более злокачественного фенотипа. Одним из ключевых событий ЭМП является подавление экспрессии белка Е-кадхерина, основного компонента адгезионных межклеточных контактов, наблюдаемое при воздействии на клетки таких факторов, как трансформирующий фактор роста (TGF), фактор роста фибробластов, и 14 других [Thiery, 2002; Christofori and Semb, 1999]. Подавление экспрессии E-кадхерина часто опосредуется действием транскрипционного репрессора SNAI1, связывающегося с промоторным участком гена CDH1 [Cano et al., 2000]. Кроме SNAI1, достаточно значимую роль в ЭМП играют такие транскрипционные факторы как SNAI2 (SLUG), ZEB1 и ZEB2, E47. Их связывание с промотором CDH1 подавляет экспрессию не только этого, но и близлежащих генов, что приводит к запуску генетической программы дедифференцировки клеток [De Craene et al., 2005; Moreno-Bueno et al., 2006; Vandewalle et al., 2005]. Сходные эффекты вызывает действие факторов TWIST1 и FOXC2, хотя прямого связывания этих белков с регуляторными районами гена CDH1 описано не было [Yang et al., 2004; Mani et al., 2007]. Необычным в данной регуляторной схеме является отсутствие какой-либо иерархии среди факторов, репрессирующих экспрессию E-кадхерина: в опухолевых клетках, экспрессирующих одновременно несколько ЭМП-индуцирующих генов, подавление экспрессии только одного из них сопровождается сильным изменением клеточного фенотипа в сторону эпителиального [Casas et al., 2011; Olmeda et al., 2008; Spadema et al., 2008]. В последнее время появляется все больше свидетельств в пользу того, что малые некодирующие РНК (микроРНК) также играют важную роль в индукции ЭМП и МЭП; наиболее значимым является понижение уровней экспрессии семейств miR-200 и miR-34, регулирующих экспрессию E-кадхерина и SNAI1 [Park et al., 2008; Siemens et al., 2011]. Снижение экспрессии Е-кадхерина приводит к освобождению из адгезионных контактов -катенина, который транслоцируется в ядро и изменяет экспрессию ряда генов, связанных с клеточной адгезией и пролиферацией [Morali et al., 2001]. В дальнейшем влияние β-катенина опосредуется Wnt-сигнальным каскадом за счет активации экспрессии гена LEF/TCF4 [Korinek et al., 1998]. В результате прекращается экспрессия клаудинов, десмоплакина и цитокератинов8, -9 и -18, являющихся маркерами эпителиальных клеток; во внеклеточном матриксе появляется фибронектин, а в цитоскелете – виментин и витронектин, характерные для подвижных мезенхимальных клеток [Thiery and Sleeman, 2006]. Частым событием при ЭМП является активация другого представителя семейства кадхеринов, N-кадхерина, однако она наблюдается не во всех случаях ЭМП и не оказывает существенного влияния на морфологию клеток [Maeda et al., 2005]. Для приобретения клетками подвижности необходимо также изменение взаимодействия клетки с внеклеточным матриксом (ВКМ). Контакты клеток с ВКМ обеспечиваются белкамиинтегринами клеточной мембраны, изменение спектра экспрессии которых может влиять на специфичность связывания клеток с различными типами ВКМ, а также активировать протеолитические ферменты, воздействующие на белки ВКМ (например, матриксные металлопротеиназы (MMP) -2 и -9) [Hood and Cheresh, 2002]. 15 Таким образом, в результате ЭМП нарушаются межклеточные контакты и контакты с внеклеточным матриксом, формируемые опухолевыми клетками, клетки приобретают подвижность и утрачивают дифференцировку. Эти новые свойства позволяют им перемещаться в соседние ткани (инвазия) или в кровяное русло. Во втором случае трансформированные клетки могут с током крови переноситься в удаленные органы и ткани и локализоваться там, образуя метастазы. Именно инвазия и метастазирование являются наиболее опасными процессами при развитии опухолей; самые злокачественные из всех типов опухолевых новообразований отличаются высоким метастатическим потенциалом. Одним из ярких представителей таких опухолей с очень ранним и агрессивным проявлением метастатической активности является протоковая аденокарцинома поджелудочной железы (ПАКПЖ). Для понимания ее характерных свойств и особенностей необходимо детально рассмотреть строение и функции нормальной поджелудочной железы. 2.2. ПОДЖЕЛУДОЧНАЯ ЖЕЛЕЗА 2.2.1. Поджелудочная железа: строение и функции Поджелудочная железа (ПЖ) – орган смешанной секреции, вторая по величине железа человеческого организма после печени (у взрослого человека длина ПЖ составляет 14-18 см, масса – до 80 г). Анатомически она подразделяется на четыре отдела: головку, тело, хвост и выводной проток (Рисунок 2). Выводной проток ПЖ проходит через весь орган от хвоста к головке и впадает в просвет двенадцатиперстной кишки, предварительно соединившись с желчным протоком. Утолщение стенки двенадцатиперстной кишки в месте ее соединения с протоком ПЖ носит название фатерова соска [Сапин, 1993]. Рисунок 2. Анатомическое строение ПЖ. 1. Головка; 2. Крючковидный отросток; 3. Борозда; 4. Тело; 5. Передняя поверхность; 6. Нижняя поверхность; 7.Верхняя граница; 8. Передняя граница; 9. Нижняя граница; 10. Сальниковый бугор; 11. Хвост; 12. Двенадцатиперстная кишка [Standring, 2008]. 16 В соответствии с выполняемыми функциями выделяют два отдела ПЖ: экзокринный, продуцирующий пищеварительные ферменты, и эндокринный, секретирующий различные гормоны. Экзокринная часть ПЖ составляет основную долю ее объема (около 97%). Она подразделяется на ацинарную часть, выполняющую основную секреторную функцию, и систему выводных протоков. Ацинусы имеют округлую форму и образованы ациноцитами и центроацинарными клетками (Рисунок 3). Рисунок 3. Схема строения ацинусов и протоков ПЖ [Хендерсон, 1997]. Ациноциты – крупные клетки пирамидальной формы, синтезирующие и секретирующие во внутреннее пространство ацинуса гранулы, содержащие набор ферментов, предназначенных для переваривания пищи в тонкой кишке. В состав секреторных гранул входят трипсин, химотрипсин, карбоксипептидазы, липазы, эластаза 2a и α-амилаза 2. Параллельно выделяются ингибиторы этих ферментов, которые предотвращают их преждевременную активацию и повреждение клеток самой ПЖ; Центроацинарные клетки – мелкие клетки, расположенные ближе к середине ацинуса, рядом с выводящим канальцем. Регулируя просвет канальца, центроацинарные клетки контролируют скорость поступления панкреатического сока в выводящий проток. Выводные протоки ПЖ разделяется на группы соответственно их диаметру и расположению. Выделяют вставочные, внутридольковые, междольковые и общий протоки. 17 Основной функцией протоковых эпителиальных клеток ПЖ является выделение в панкреатический сок ионов бикарбоната, которые нейтрализуют кислую реакцию пищи, попадающей в двенадцатиперстную кишку из желудка [Быков, 1999]. Также протоковые клетки являются мультипотентными и обладают способностью к частичной дедифференцировке, связанной с повышением их пролиферативного потенциала, и последующей редифференцировке в другие типы клеток ПЖ. Таким образом, эпителий протоков представляет собой своеобразный пул панкреатических клеток-предшественников [Bonner-Weir and Sharma, 2002; Grapin-Botton, 2005]. Эндокринная часть ПЖ составляет около 2% объема всего органа и представлена островками Лангерганса, разбросанными по всему телу железы в виде округлых скоплений эндокринных клеток, находящихся между ацинусами. Островки Лангерганса образованы 5 типами клеток (α-, -, δ-, ε- и PP-клетки), секретирующих различные гормоны, регулирующие как пищеварение, так и многие другие процессы в организме (Рисунок 4). Рисунок 4. Основные типы клеток островка Лангерганса. Методом иммунофлюоресценции с антителами к инсулину, глюкагону и соматостатину окрашены α-клетки (зеленый), -клетки (красный) и δклетки (синий) [адаптировано из Caicedo, 2013]. 18 α-клетки расположены по периферии островков и составляют до 25% всех эндокринных клеток. Секретируемый ими гормон глюкагон стимулирует процессы расщепления гликогена и липидов, тем самым повышая содержание глюкозы в крови; -клетки составляют основную массу панкреатических эндокринных клеток (6070%). Их главной функцией является синтез инсулина, необходимого для поглощения клетками организма глюкозы из кровотока и ее последующего включения во внутриклеточные запасы гликогена. Нарушение функций -клеток вследствие повреждения гена инсулина или отсутствия его секреции из-за нечувствительности к свободной глюкозе крови приводит к развитию сахарного диабета I типа; δ-клетки синтезируют соматостатин, подавляющий секрецию многих гормонов, в том числе инсулина и глюкагона. Отдельный подтип δ-клеток (часто обозначается как δ1) секретирует вазоактивный интестинальный полипептид, вызывающий снижение артериального давления и усиливающий секрецию ациноцитов. Этот тип панкреатических клеток составляет 5-10%; ε-клетки составляют малую часть клеток островков (около 1%) и секретируют грелин – гормон, вызывающий чувство голода; PP-клетки расположены на границе островков Лангерганса и вплотную прилегают к клеткам ацинусов. Их основной функцией является синтез и секреция панкреатического полипептида, подавляющего секреторную активность экзокринных клеток ПЖ [Быков, 1999]. Таким образом, ПЖ является важнейшим органом внешней и внутренней секреции. Нарушение функций как экзокринной, так и эндокринной ткани этого органа сопровождается тяжелейшими расстройствами пищеварительной системы и гормонального баланса в организме. 2.2.2. Эмбриональное развитие поджелудочной железы Развитие ПЖ начинается на стадии 20-25 сомитов эмбриона, что у мыши соответствует примерно 9-9,5 дню эмбрионального развития. На этом этапе из эпителия первичной кишки начинает формироваться дорсальная панкреатическая почка. Несколько позже, на стадии 30 сомитов (10 панкреатическая день эмбрионального почка [Slack, развития 1995]. В у ходе мыши), формируется дальнейшего развития вентральная вентральная панкреатическая почка оказывается рядом с дорсальной и сливается с ней благодаря повороту двенадцатиперстной кишки; из вентрального зачатка формируются головка и крючковидный отросток, из дорсальной – тело и хвост железы [Slack, 1995; Suckale and Solimena, 2008]. После 19 слияния зачатков ПЖ начинается активный процесс их роста и ветвления, что приводит к образованию обширной сети выводящих протоков; первые протоки в ПЖ мыши могут быть обнаружены на 14,5 день эмбрионального развития, в это же время в экзокринных клетках формирующихся ацинусов начинает синтезироваться панкреатическая амилаза. Эндокринные островки формируются в последнюю очередь, на поздних стадиях эмбрионального развития ПЖ [Slack, 1995]. Дифференцировка клеток и выполняемые ими функции, характерные для определенных органов и тканей, главным образом определяются активностью тканеспецифических генов. Поэтому механизмы, контролирующие активность специфических функциональных генов, играют значительную роль как в развитии тканей во время эмбриогенеза и поддержании их нормального функционирования во взрослом состоянии, так и в процессах возникновения и прогрессии злокачественных образований. Большая часть этих механизмов работает на уровне транскрипции и представлена тканеспецифическими транскрипционными факторами (ТФ). Тщательно скоординированное включение и выключение экспрессии различных ТФ задает программу работы клетки в определенные периоды онтогенеза. Наибольшее значение имеют так называемые «ключевые» ТФ, регулирующие экспрессию большого числа генов, характерных для данного периода жизнедеятельности клетки (в том числе кодирующих другие ТФ). Нарушение функций ключевого ТФ может приводить к комплексным изменениям физиологических и биохимических свойств клетки; активация же в клетках ТФ, в норме характерных для другой ткани, может привести к частичному приобретению этими клетками фенотипа данной ткани – это явление известно под названием транс-дифференцировки [Eguchi and Kodama, 1993]. Так, экзогенная экспрессия фактора PDX1, специфического для панкреатических клеток, в клетках печени приводит к активации в них промотора гена инсулина, специфичного для -клеток ПЖ [Sapir et al., 2005]. Эмбриональное развитие и поддержание функций ПЖ контролируется большим количеством тканеспецифических генов, в основном представленных транскрипционными факторами (ТФ). На ранних стадиях эмбриогенеза основную роль в дифференцировке панкреатических клеток играют факторы PDX1, PTF1α, HLX9, ISL1, HEX; последующая дифференцировка различных типов клеток обеспечивается активностью факторов PDX1, PTF1α, PAX4, PAX6, NKX2.2, NKX6.1, MAFA, MAFB, 2/NEUROD и NRG3 [Habener et al., 2005]. Важное значение для регуляции работы этих и многих других панкреа-специфических генов имеет группа гепатоцитарных ядерных факторов (ГЯФ, HNF), определяющих эмбриональное развитие и поддержание функций ряда органов желудочно-кишечного тракта [Yamagata, 2003]. Наиболее значимые ТФ и их значение в развитии ПЖ будут детально рассмотрены в Разделе 1.4. 20 2.2.3. Патологии поджелудочной железы Как и любой другой орган, ПЖ может подвергаться разнообразным патологическим изменениям, которые могут носить как спорадический, так и наследственный характер. Болезни ПЖ могут затрагивать как одну конкретную ее часть (только экзокринную или эндокринную), так и всю железу в целом, что приводит к достаточно большому разнообразию наблюдаемых симптомов – от нарушения процессов пищеварения до гормональных расстройств. Поскольку различные заболевания могут затрагивать одни и те же панкреатические системы и вызывать схожие симптомы, их точная диагностика становится сложной проблемой. Отдельным пунктом стоят злокачественные панкреатические опухоли, о которых будет подробно рассказано ниже. Сахарный диабет является наиболее распространенным видом нарушений функций ПЖ. При этом необходимо учитывать, что в большинстве случаев диабет не является первичной патологией, а вызывается нарушениями гормональной регуляции других тканей (диабет II типа) или следствием развития у пациента других заболеваний ПЖ, например, панкреатита или опухоли. С другой стороны, в некоторых случаях диабет может быть следствием генетических нарушений в β-клетках ПЖ и иметь наследственную форму. Выделяют несколько типов диабета: диабет I типа – составляет 10-15% всех случаев, вызывается недостаточностью синтеза инсулина в островках Лангерганса. Этот тип диабета рано проявляется и может быть вызван другими заболеваниями ПЖ, либо обусловлен генетическими нарушениями и передаваться по наследству; диабет II типа – составляет до 80% всех случаев. При диабете II типа выработка инсулина не нарушена, однако чувствительность к нему инсулин-зависимых тканей значительно снижена. Таким образом, диабет II типа не является патологией непосредственно ПЖ. Его симптомы обычно проявляются у лиц старше 40 лет, склонных к ожирению; диабет взрослого типа у молодых (maturity-onset diabetes of the young, MODY) – наблюдается в 5% случаев. Является генетическим заболеванием, наследуется по аутосомно-доминантному типу. По проявлениям близок к диабету II типа, но диагностируется в намного более раннем возрасте. Основными симптомами развития диабета являются полиурия, постоянная жажда и голод. Методов излечения диабета на сегодняшний день не найдено. В случае диабета I типа и MODY основным способом терапии является регулярное введение пациенту инсулина, в случае 21 II типа применяют препараты, снижающие эффективность синтеза гликогена и поглощения глюкозы в кишечнике [Уоткинс, 2006]. Панкреатит. Частым нарушением функций ПЖ является панкреатит – острое или хроническое заболевание, связанное с развитием в ткани органа воспалительных процессов. Вследствие воспаления повреждаются главным образом ацинарные клетки экзокринной части ПЖ; реже, как правило, в случае хронической формы заболевания, возникают патологические изменения протоков и эндокринных островков, происходит атрофия ткани ПЖ с замещением ее на соединительную фиброзную ткань или возникают очаги некроза. На фоне хронического панкреатита значительно повышается риск возникновения опухолей ПЖ. У больных как острой, так и хронической формой панкреатита наблюдаются нарушения пищеварения и боль в абдоминальном отделе. В более тяжелых случаях возникают расстройства гормональной регуляции и диабет I типа. Основными факторами риска являются алкоголь и курение, более слабыми – отравления химическими веществами и наследственность [Маев и Кучерявый, 2009]. Опухоли ПЖ. Опухолевые новообразования являются не самым частым типом патологий ПЖ, но из-за чрезвычайно высокой злокачественности они занимают первое место по смертности среди всех заболеваний ПЖ. Доброкачественные опухоли ПЖ встречаются достаточно редко и представлены в основном гемангиомой, шванномой и муцинозной цистаденомой. Частота возникновения злокачественных опухолей намного выше; по тому, из каких панкреатических клеток они происходят, выделяют протоковую аденокарциному, нейроэндокринные опухоли и ацинарную карциному. Все эти типы опухолей отличаются трудностью диагностики (особенно на ранних этапах) и неблагоприятным прогнозом для пациентов. Основными факторами риска развития опухолей ПЖ являются хронический панкреатит, курение (как фактор риска развития панкреатита), в чуть меньшей степени – генетическая предрасположенность и рацион с большим содержанием мяса и животных жиров. Развитие заболевания в течение достаточно долгого времени проходит без ярко выраженных симптомов, наблюдаются недомогание, нарушения пищеварения. Среди терапевтических подходов наибольшей эффективностью до сегодняшнего дня обладает хирургическое удаление опухоли и прилежащих тканей ПЖ, реже более обширная операция – гастропанкреатодуоденальная резекция (ГПДР), при которой удаляются как сам орган, так и двенадцатиперстная кишка, часть желудка, иногда селезенка. Но даже в случае настолько радикального хирургического 22 вмешательства выживаемость пациентов остается крайне низкой [Патютко и Котельников, 2007; Маев и Кучерявый, 2009] Наиболее актуальной мишенью исследования закономерностей развития опухолей ПЖ является протоковая аденокарцинома поджелудочной железы (ПАКПЖ). Этот тип опухолей ПЖ является наиболее распространенным и агрессивным. Современные методы диагностики и противоопухолевой терапии оказываются малоэффективными в случае ПАКПЖ. Более подробно отличительные характеристики этого типа опухолей разобраны в следующем разделе. 2.3. ПРОТОКОВАЯ АДЕНОКАРЦИНОМА ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ 2.3.1. Патогенез и этапы развития ПАКПЖ Протоковая аденокарцинома поджелудочной железы (ПАКПЖ) является наиболее злокачественным вариантом панкреатических опухолей и развивается из протоковых клеток, которые изначально обладают высоким пролиферативным потенциалом и способностью к дедифференцировке [Bonner-Weir and Sharma, 2002; Grapin-Botton, 2005]. Этот тип опухолей по частоте встречаемости превалирует над всеми другими новообразованиями ПЖ и составляет до 85-90% случаев [Warshaw and Fernández-del Castillo, 1992]. На сегодняшний день ПАКПЖ считается самой агрессивной из всех форм опухолей различных органов: занимая десятое место по частоте диагностики (около 3% случаев), она является четвертой по частоте причиной смертности от опухолей, имея показатель летальности (отношение количества умерших от ПАКПЖ пациентов к количеству человек с опухолью, диагностированной de novo) 85%. Пятилетняя выживаемость пациентов с ПАКПЖ не превышает 6% [Siegel et al., 2013]. Развитие ПАКПЖ представляет собой сложный ступенчатый процесс, в котором можно выделить этап аденокарциномы. неинвазивных Преинвазивные неоплазий и возникновение собственно образования, происходящие из инвазивной протоковых клеток, представлены панкреатическими внутрипротоковыми неоплазиями (Pancreatic Intraepithelial Neoplasia, PanIN) и внутрипротоковыми панкреатическими муцинозными неоплазиями (Intraductal Pancreatic Mucinous Neoplasia, IPMN) [Singh and Maitra, 2007]. PanIN являются более исследованной моделью развития ПАКПЖ. Выделяют четыре стадии PanIN: PanIN-1A, PanIN-1B, PanIN-2 и PanIN-3, для каждой из которых характерны определенные мутации и изменения клеточных свойств. По мере накопления мутаций происходит последовательная смена этих стадий, заканчивающаяся формированием опухоли с инвазивным фенотипом (Рисунок 5). По мере прогрессии PanIN у клеток протокового эпителия нарушается полярность, возникает атипия ядер и значительно повышается частота митозов [Singh and Maitra, 2007]. 23 Рисунок 5. Стадии неопластической трансформации клеток протокового эпителия ПЖ. Указаны гены, мутации которых наиболее типичны для каждой стадии [Wilentz et al., 2000]. ПАКПЖ отличается чрезвычайно высокой степенью агрессивности и скоростью прогрессии, а также отсутствием ярко выраженных симптомов, которые позволили бы уверенно диагностировать опухолевый процесс на ранних этапах развития. Сложность диагностики также обусловлена трудностью обнаружения развивающейся опухоли на фоне хронического панкреатита и других неопухолевых заболеваний ПЖ, которые в то же время являются факторами риска развития опухоли. Из-за поздней диагностики и высокого инвазивного потенциала клеток ПАКПЖ от 40 до 70% пациентов, у которых обнаруживают опухоли, уже имеют метастазы в печени, брюшине, легких и других отдаленных органах. Из-за этих особенностей развития опухоли хирургическая резекция, даже проведенная в большом объеме с удалением прилежащих органов (ГПДР), оказывается малоэффективной. Дополнительным фактором является огромная сложность таких операций, вследствие чего риск послеоперационной летальности оказывается значительно выше, чем при других опухолях, и составляет около 12-13%. Клетки ПАКПЖ обладают высокой резистентностью к современным химиотерапевтическим распространенной препаратам опухоли с и методам метастазированием радиотерапии, адъювантная поэтому в случае химиолучевая терапия оказывается практически бесполезной. В редких случаях (наследственные формы ПАКПЖ) эффективной оказывается таргетная химиотерапия, направленная на опухолевые клетки с определенными генетическими дефектами [Chalasani et al., 2008; Lowery et al., 2011]. Но, несмотря на постоянное поступление информации об особенностях ПАКПЖ, на сегодняшний день достаточно эффективных методов терапии этого новообразования не найдено [Маев и Кучерявый, 2009]. Поэтому поиск новых способов ранней диагностики, прогнозирования развития и терапии остается остроактуальной областью исследований ПАКПЖ. В последние 24 годы наибольших успехов удалось добиться в исследованиях, направленных на поиск специфических молекулярных биомаркеров панкреатических опухолей. 2.3.2. Биомаркеры ПАКПЖ Все известные на сегодняшний день биомаркеры можно классифицировать по их молекулярной природе и по клиническому значению. По структуре маркеры делят на генетические (изменение структуры ДНК), белковые (изменение уровня синтеза или структуры белка) и РНК-маркеры (изменение уровня экспрессии кодирующих и микроРНК). В зависимости от клинического значения выделяют диагностические (выявление заболевания у пациента), прогностические (предсказание длительности жизни пациента) и предиктивные (предсказание эффективности методов терапии в исследуемом случае) биомаркеры. Описанные ниже биомаркеры ПАКПЖ подробно рассмотрены в обзоре [Чесноков и соавт., 2013]. Генетические маркеры: К генетическим маркерам относятся любые изменения нуклеотидной последовательности генов: точечные мутации, делеции, амплификации и т. д. Многочисленные исследования позволили установить набор основных генов, мутации и изменения активности которых наиболее характерны для клеток ПАКПЖ – KRAS, TP53, CDKN2A и SMAD4 [Hruban et al., 1999; Talar-Wojnarowska et al., 2004; Salek et al., 2007]. Мутации генов KRAS и CDKN2A наблюдаются в 90-95% всех опухолей ПЖ, что теоретически может быть использовано для их ранней диагностики, однако на сегодняшний день эффективных методов для их использования в клинической практике не разработано [Almoguera et al., 1988; Schutte et al., 1997]. Клетки, несущие мутации CDKN2A, обладают пониженной чувствительностью к химиотерапии, эти мутации являются неблагоприятным прогностическим фактором [Halloran et al., 2004; Chang et al., 2010]. В то же время нарушения гена SMAD4 ассоциированы с большей продолжительностью жизни пациентов после операции и повышенной эффективностью действия гемцитабина – химиотерапевтического препарата, уингибирующего синтез ДНК [Biankin et al., 2002; Bachet et al., 2012]. Мутации гена TP53, хотя и наблюдаются в опухолях ПЖ с высокой частотой (50-75%), практически не имеют диагностического или прогностического значения [Scarpa et al., 1993; Pantalone et al., 2004; Wu et al., 2006; Salek et al., 2009]. Мутации гена BRCA2 наблюдаются всего у 10% пациентов с ПАКПЖ, однако они являются эффективным предиктивным маркером, указывающим на высокую чувствительность таких опухолей к ингибиторам поли-(АДФ-рибоза)-полимеразы (PARP) и ДНК-повреждающим веществам (митомицин C, соединения платины) [Chalasani et al., 2008; Lowery et al., 2011]. Белковые маркеры: Белковые биомаркеры можно разделить на две большие группы: секретируемые и тканевые. Основное отличие этих групп заключается в невозможности 25 использования тканевых маркеров для массовой рутинной диагностики (скрининга) опухолевых заболеваний ввиду сложности получения образцов. Поэтому наибольший интерес представляют специфические изменения синтеза секретируемых белков. На сегодняшний день единственным маркером, официально одобренным для клинического использования, является сывороточный гликопротеин CA 19-9, содержание которого в крови пациентов с патологиями ПЖ значительно повышено по сравнению со здоровыми людьми. Из-за невысокой специфичности его диагностическая ценность невелика, однако определение его уровня в сыворотке крови может быть эффективно использовано в качестве прогностического фактора, а также для отслеживания послеоперационного состояния пациентов [Montgomery et al., 1997; Ballehaninna and Chamberlain, 2012]. В последнее время охарактеризованы гликопротеины CA 242 и CA 50, которые обладают большей эффективностью и диагностической ценностью, чем CA 19-9 [Haglund et al., 1994; Lundin et al., 1995]. Другим семейством гликопротеинов, изменения которых часто наблюдаются в опухолях, являются муцины, синтезирующиеся эпителиальными клетками. Изменяться может как экспрессия отдельных генов муцинов, так и структура белкового и полисахаридного компонентов гликопротеинов. Для ПАКПЖ в качестве наиболее характерных были описаны изменения MUC1, MUC4 и MUC5AC. Определение гликозильного эпитопа PAM4, являющегося специфическим для ПАКПЖ производным MUC1, обладает высоким диагностическим потенциалом благодаря своей высокой чувствительности и специфичности при определении в образцах сыворотки крови [Gold et al., 2006; Gold et al., 2007; Gold et al., 2013]. Повышение уровня синтеза MUC4 характерно для PanIN-3, IPMN и инвазивной карциномы и может расцениваться как негативный прогностический фактор, а также сопряжено со снижением эффективности действия гемцитабина и повышением чувствительности к бортезамибу [Swartz et al., 2002; Saitou et al., 2005; Wissniowski et al., 2012]. В случае MUC5AC наибольший интерес представляет использование антител к эпитопу NPC-1C, характерному для опухолей ПЖ и прямой кишки, поскольку его определение характеризуется относительно высокой чувствительностью в образцах сыворотки крови пациентов [Luka et al., 2011]. МикроРНК: МикроРНК – особый класс регуляторных некодирующих РНК, отличающихся малой длиной (17-25 нуклеотидов). Они специфически взаимодействуют с последовательностями на 3’-конце определенных мРНК, кодирующих белки, и, в зависимости от степени комплементарности, пост-транскрипционно регулируют их стабильность или эффективность трансляции. В последнее время исследованию роли микроРНК в развитии опухолей уделяется все больше и больше внимания. Различные исследователи описывают около 100 микроРНК, уровни экспрессии которых существенно отличаются в опухолевых и 26 нормальных протоковых клетках ПЖ [Jamieson et al., 2012]. Для ПАКПЖ наиболее характерны изменения экспрессии miR-21, miR-142-5p, miR-143, miR-155, miR-196a, miR-204. Значительное повышение уровней экспрессии miR-21 и miR-155 наблюдается в образцах ткани опухоли пациентов с ВПМН по сравнению с неопухолевой панкреатической тканью тех же пациентов, а также в образцах панкреатического сока и сыворотки крови пациентов с IPMN [Habbe et al., 2009; Kong et al., 2011]. Повышенный уровень экспрессии miR-21 в ПАКПЖ является также неблагоприятным прогностическим и предиктивным фактором, он коррелирует с низкой продолжительностью жизни пациентов после резекции опухоли и устойчивостью опухолевых клеток к действию гемцитабина [Giovannetti et al., 2010; Jamieson et al., 2012]. Высокий уровень экспрессии miR-196a характерен для пациентов с нерезектабельными опухолями ПЖ (III-IV стадия) и ассоциирован с низкой продолжительностью жизни после операции [Kong et al., 2011]. Экспрессия miR-142-5p и miR-204 понижается в клетках ПАКПЖ, обладающих пониженной чувствительностью к химиотерапевтическим препаратам [Ohuchida et al., 2011]. Итак, в последние годы активный поиск биомаркеров ПАКПЖ позволил выявить несколько генов, белков и РНК, специфичных для опухолей ПЖ и позволяющих в известной степени предсказать характер их развития и чувствительности к химиотерапии. Однако для разработки новых, более эффективных методов диагностики и терапии необходим поиск наиболее важных, так называемых «ключевых» биологических молекул, вовлеченных в регуляцию основополагающих механизмов прогрессии опухолевых клеток. Как правило, в роли таких «ключевых» факторов выступают регуляторы клеточной дифференцировки – транскрипционные факторы и элементы контролирующих их сигнальных путей. Далее мы подробно остановимся на главных транскрипционных регуляторах дифференцировки клеток ПЖ. 2.4. ОСНОВНЫЕ РЕГУЛЯТОРЫ ДИФФЕРЕНЦИРОВКИ КЛЕТОК ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Как уже упоминалось ранее, различным стадиям развития ПЖ соответствует экспрессия различных генов, следовательно, успешное прохождение этих стадий контролируется различными транскрипционными факторами. Наибольшее значение имеет активность факторов PDX1 и PTF1α [Burlison et al., 2008]. В настоящее время эти факторы рассматриваются как «ключевые» регуляторы дифференцировки панкреатических клеток. 27 Соотношение уровней экспрессии PDX1 и PTF1α в клетках-предшественниках эмбриональной ПЖ, по-видимому, является одним из решающих параметров в определении пути их дальнейшей дифференцировки [Burlison et al., 2008]. Совместная экспрессия PTF1α и PDX1 сохраняется на протяжении всего процесса формирования органа в панкреатических клетках-предшественниках [Zhou et al., 2007]. В процессе дифференцировки клеткипредшественники сохраняют экспрессию только одного из этих ТФ, определяющих экзокринный (PTF1α) или эндокринный (PDX1) пути дальнейшей дифференцировки. В последнее время появляется все больше свидетельств в пользу того, что факторы группы ГЯФ также являются важными регуляторами дифференцировки панкреатических клеток. Сайты связывания ГЯФ обнаружены в промоторных районах генов PDX1 и PTF1a, а также многих других панкреа-специфических генов. Нарушения функций ряда ГЯФ ассоциированы с различными патологиями ПЖ. 2.4.1. PDX1 PDX1 является основным регуляторным фактором как эмбрионального развития ПЖ в целом, так и дифференцировки клеток-предшественников в -клетки островков Лангерганса [Stoffers et al., 1997; Habener and Stoffers, 1998]. Он принадлежит к кластеру ParaHox-генов, экспрессия которых наблюдается в клетках ПЖ и двенадцатиперстной кишки [Brooke et al., 1998; Rosanas-Urgell et al., 2005]. В процессе формирования органа экспрессия PDX1 в различных клетках сильно меняется в зависимости от стадии развития. Активация экспрессии PDX1 впервые происходит в клетках дорсального и вентрального зачатков, появляющихся на первичной кишке эмбриона мыши на 8,5-9,5 день развития. PDX1 является самым ранним маркером клетокпредшественников ПЖ [Guz et al., 1995; Deutsch et al., 2001]. Позднее PDX1 экспрессируется в клетках формирующихся протоков ПЖ. У мышей, нокаутных по гену PDX1, не происходит развития протоков в зачатках ПЖ и последующего формирования инсулино- и амилазосинтезирующих клеток [Jonsson et al., 1994; Offield et al., 1996]. Таким образом, экспрессия PDX1 необходима для формирования эндокринных клеток ПЖ. С другой стороны, PDX1 сам по себе не является достаточным фактором для дифференцировки панкреатического предшественника из клеток эндодермы [Spagnoli, 2007]. В ходе дальнейшего развития ПЖ экспрессия PDX1 постепенно ослабевает, а затем и полностью исчезает в клетках экзокринной части, но сохраняется в -клетках эндокринной части [Guz et al., 1995; Offield et al., 1996]. Показано, что экспрессия PDX1 частично сохраняется в протоковых клетках, но ее уровень относительно низок по сравнению с -клетками; экзогенная экспрессия PDX1 в протоковых 28 клетках и ациноцитах приводит к их дифференцировке в -клетки [Guz et al., 1995; Liu et al., 2007a; Liu et al., 2007b; Yang et al., 2011]. PDX1 впервые был идентифицирован и клонирован как фактор, активирующий транскрипцию гена инсулина [Ohlsson et al., 1993]. На основании исследования механизма PDX1-зависимой регуляции гена инсулина было установлено, что активирующее действие PDX1 опосредуется белками p300 и Set9, изменяющими структуру хроматина с месте связывания комплекса [Mosley et al., 2004; Francis et al., 2005]. Позже были получены данные о PDX1-зависимой регуляции генов переносчика глюкозы GLUT-2, глюкокиназы и островкового амилоидного полипептида [Waeber et al., 1996; Watada et al., 1996a; Watada et al., 1996b]. Другими важными мишенями фактора PDX1 являются гены Ngn3, HNF1β и FOXA2, являющиеся регуляторами дифференцировки клеток островков Лангерганса. В комплексе с транскрипционным фактором HNF6, PDX1 необходим для активации промотора Ngn3 [OliverKrasinski et al., 2009]. Партнерами PDX1 являются белки семейства Pbx; комплексы PDX1 с Pbx и рядом других коактиваторов участвуют в индукции экспрессии генов соматостатина и эластазы 1, что указывает на возможную роль PDX1 в регуляции функций не только эндокринных клеток, но и ациноцитов [Swift et al., 1998; Goudet et al., 1999]. Исследования с применением метода иммунопреципитации хроматина с последующим секвенированием показали, что число генов-мишеней PDX1 в клетках островков может быть очень высоким (до нескольких тысяч генов, вовлеченных в самые разнообразные системы регуляции клеточных свойств) [Khoo et al., 2012]. Активность PDX1 модулируется, главным образом, уровнем глюкозы в крови; изменения уровня глюкозы влияют на фосфорилирование фактора и на его локализацию в клетке [MacFarlane et al., 1997; Rafiq et al., 1998; Humphrey et al., 2010]. Глюкозо-зависимая регуляция фосфорилирования PDX1 в основном осуществляется киназами GSK3 и AKT [Humphrey et al., 2010]. В то же время описаны киназы, активность которых необходима для поддержания функций PDX1 на всех стадиях дифференцировки эндокринных клеток ПЖ [Boucher et al., 2009]. На молекулярном уровне экспрессия гена PDX1 регулируется большим количеством тканеспецифических транскрипционных факторов. В промоторной области гена выявлены сайты связывания факторов HNF1α, FOXA1 и FOXA2, HNF6, KLF11 и PTF1α [Gerrish et al., 2000; Gerrish et al., 2001; Jacquemin et al., 2003; Miyatsuka et al., 2007; Wiebe et al., 2007; Fernandez-Zapico et al., 2009; Gao et al., 2009]. Также показана возможность авторегуляции экспрессии PDX1, так как промотор гена связывает белок PDX1 in vitro и in vivo [Gerrish et al., 2001]. Нарушения функции большинства перечисленных транскрипционных факторов описаны при развитии диабета II типа, что еще раз подтверждает ключевую роль PDX1 в регуляции функций β-клеток. 29 2.4.2. PTF1α PTF1α, как и PDX1, является мастер-геном, регулирующим процессы эмбрионального развития ПЖ [Krapp et al., 1998; Kawaguchi et al., 2002]. На поздних стадиях эмбриогенеза и во взрослом органе PTF1α регулирует дифференцировку экзокринных клеток [Krapp et al., 1996; Zecchin et al., 2004]. PTF1α входит в состав активного гетеротримерного белкового комплекса PTF1, являющегося регулятором транскрипции. Комплекс PTF1 состоит из трех белков HLHтипа; два белка (TCF3/р75 и TCF12/р64) представлены во многих тканях, а третий (собственно PTF1α/р48) является панкреаспецифичным [Krapp et al., 1996]. PTF1α является одним из самых ранних панкреатических белков-регуляторов. Его экспрессия наблюдается уже на ранних стадиях образования зачатка ПЖ из эпителия первичной кишки. Экспрессия гена PTF1A детектируется в клетках энтодермы эмбриона мыши на 9 сутки эмбрионального развития, сборка активного комплекса PTF1 происходит на 15 сутки развития [Bort and Zaret, 2002]. Локализация PTF1α на этой стадии совпадает с локализацией PDX1 [Afelik et al., 2006]. В дальнейшем одновременная экспрессия PTF1α и PDX1 сохраняется в панкреатических клетках-предшественниках, находящихся на ранних стадиях дифференцировки [Zhou et al., 2007]. Во взрослом состоянии PTF1α в норме продолжает экспрессироваться только в ацинарных клетках [Kawaguchi et al., 2002]. Инактивация гена PTF1α на ранних стадиях эмбрионального развития ПЖ приводит к полному отсутствию экзокринных и значительному уменьшению количества эндокринных клеток в образующемся панкреатическом зачатке [Kawaguchi et al., 2002; Sellick et al., 2004]. Инактивация PTF1α в клетках эмбриона до формирования панкреатических почек приводит к отсутствию вентральной почки при нормально развитой дорсальной; клетки вентральной области первичной кишки в этом случае приобретают фенотип, сходный с клетками кишечного эпителия [Kawaguchi et al., 2002]. Высокий уровень экспрессии PTF1α индуцирует дифференцировку по пути экзокринных клеток, активируя гены амилазы, эластазы и трипсина [Cockell et al., 1989; Dong et al., 2008]. Подавление активности PTF1α во взрослых ациноцитах сопровождается их частичной редифференцировкой по типу эндокринных клеток, в частности, активацией синтеза инсулина [Hesselson et al., 2011]. Для PTF1α также показана способность активировать экспрессию генов PDX1, HNF6, NKX6-1 и MNX1, с промоторами которых он связывается напрямую [Miyatsuka et al., 2007; Wiebe et al., 2007; Thompson et al., 2012]. Таким образом, PTF1α, являясь определяющим фактором развития ациноцитов, по всей видимости, также необходим для нормального прохождения ранних стадий дифференцировки клеток островков Лангерганса. Регуляция экспрессии PTF1α на сегодняшний день исследована недостаточно. Описано три регуляторных участка гена PTF1A: 5'-энхансерный район, собственно промотор и 3'- 30 регуляторный участок. Два первых участвуют в регуляции спорадической экспрессии PTF1α в эмбриогенезе ПЖ, в то время как для 5'-энхансера показана возможность связывания PTF1комплекса [Masui et al., 2008]. Таким образом, единственным известным на данный момент механизмом регуляции транскрипции гена PTF1α является авторегуляционная петля. Немного подробнее исследована регуляция трансляции PTF1α. Регуляцию определяет нетранслируемый 3'-участок мРНК: в клетках ПЖ мыши описана активация трансляции PTF1α при связывании с ним белка RBMS3 и репрессия трансляции при связывании микроРНК miR-18a [Lu et al., 2012; Yang et al., 2012]. 2.4.3. Гепатоцитарные ядерные факторы. Гепатоцитарные ядерные факторы (ГЯФ) – одна из наиболее полно охарактеризованных на сегодняшний день систем тканеспецифической регуляции активности генов. Впервые ГЯФ и их регуляторные взаимосвязи были описаны в клетках печени, позже появилась информация об экспрессии и функциях ГЯФ в других органах и тканях. Скоординированное действие различных представителей этой группы транскрипционных факторов необходимо для развития, дифференцировки и поддержания функций печени, ПЖ, кишечника, желудка и других органов пищеварительного тракта. В настоящее время к ГЯФ относят 5 неродственных семейств, которые классифицируют по строению ДНК-связывающих доменов. Белки этих семейств образуют сложную регуляторную сеть, контролирующую развитие и функции печени. Ниже приведена Таблица 1, обобщающая основные сведения о представителях каждого из семейств ГЯФ: 31 Таблица 1. Гепатоцитарные ядерные факторы [адаптировано из Лазаревич и Флейшман, 2008]: Фактор (синоним) HNF1α (HNF1) Транскрипционные регуляторы HNF4, FOXA, HNF1 Специфичность экспрессии во взрослом организме Печень, кишечник, ПЖ, почка HNF1 (vHNF1) COUP-TFI и II, FOXA3, HNF6 Печень, почка, ПЖ, щитовидная железа, легкое, яичник, семенники, простата FOXA1 (HNF3α) FOXA2 FOXA2 (HNF3) FOXA, C/EBP, HNF6, FTF, GATA6 Печень, кишечник, ПЖ, почка, легкое, желудок, простата Печень, кишечник, ПЖ, желудок, легкое FOXA3 (HNF3) HNF4α HNF1 Печень, желудок, легкое, кишечник, семенники Нет данных Гиперэкспрессия, мутации, метилирование промотора Нет данных Печень, кишечник, ПЖ, почка HNF4 HNF1, FOXA, C/EBP, HNF6, HNF4, OC-2, FTF, GATA6, COUP-NF нет данных Гепатоцеллюлярная карцинома, рак почки, гепатоидная аденокарцинома желудка Нет данных Изменение уровня экспрессии, снижение ДНКсвязывающей активности Нет данных HNF6 (OC-1) HNF4, C/EBPα, HNF1β Рак ПЖ Изменение уровня экспрессии OC-2 Нет данных Нет данных Нет данных OC-3 HNF6 Печень, ПЖ, мозг, желудок, кишечник Мозг, желудок, кишечник Нет данных Нет данных C/EBPα C/EBP Печень, жировая ткань, кишечник, ПЖ, легкое, кожа, мышцы, молочная железа и др. Снижение экспрессии, цитоплазматическая локализация C/EBP PDX1 Печень, легкое, кишечник, жировая ткань, почка и др. Гепатоцеллюлярная карцинома, рак молочной железы, рак легкого, карцинома кожи Рак молочной железы, рак толстой кишки, рак почки ПЖ, почка, кишечник, семенники Печень, мозг, ПЖ, семенники Примеры опухолей, в которых нарушена функция ТФ Гепатоцеллюлярная аденома, гепатоцеллюлярная карцинома, светлоклеточный рак почки Гепатоцеллюлярная карцинома, рак яичников, светлоклеточный рак почки Рак молочной железы, рак простаты Рак простаты, рак легкого Выявленные нарушения Мутации, нарушения уровня экспрессии Мутации, нарушения уровня экспрессии, метилирование гена Гиперэкспрессия Гиперэкспрессия 32 Как видно из таблицы, почти все ГЯФ обнаруживаются не только в печени, но и в других тканях и органах. Экспрессия каждого из ГЯФ регулируется как минимум одним из остальных ГЯФ, что приводит к образованию сложной и разветвленной сети. Эта сеть становится еще сложнее, если принять во внимание, что в ней существует как позитивная, так и негативная регуляция, которая может изменяться в зависимости от стадии развития ткани (эмбриональные и взрослые изоформы ГЯФ). Такая сеть требует очень тонкой координации отдельных элементов, поэтому нарушение функции большинства из них может создать риск возникновения или прогрессии опухоли. Далее будет подробнее охарактеризовано каждое из пяти семейств ГЯФ. Семейство HNF1. ДНК-связывающий участок факторов этого семейства представлен гомеодоменом. Описано два гомологичных фактора этого семейства – HNF1α (HNF1) и HNF1 (vHNF1), отличающиеся строением транс-активационного домена; взаимодействие с ДНК сопровождается образованием гомо- или гетеродимеров [Tronche and Yaniv, 1992]. Фактор HNF1α экспрессируется на поздних стадиях эмбрионального развития и во взрослой печени, ПЖ, кишечнике, почке [De Simone et al., 1991]. Он осуществляет регуляцию активности многих гепатоспецифических генов, таких как альбумин, α-фетопротеин, плазминоген и др. Методом хроматиновой иммунопреципитации было показано, что количество генов-мишеней HNF1α в гепатоцитах, превышает 200 [Tronche et al., 1997; Odom et al., 2004]. Инактивация HNF1α не вызывает нарушений в развитии эмбриона, однако после рождения его отсутствие приводит к нарушению работы печени, почек, ПЖ, развитию диабета MODY, фенилкетонурии и синдрома Фанкони [Pontoglio et al., 1996; Pontoglio et al., 1998; Welters et al., 2006]. Эксперименты на мышах, дефектных по гену HNF1α, показали, что нарушение функций β-клеток и развитие MODY связано с нарушением работы сигнальной системы, обеспечивающей секрецию инсулина в ответ на повышение уровня глюкозы [Dukes et al., 1998; Pontoglio et al., 1998]. В частности, HNF1α регулирует активность гена GLUT2, кодирующего мембранный переносчик глюкозы, посредством связывания с кофактором p300 [Ban et al., 2002]. Это далеко не единственный механизм влияния HNF1α на функции эндокринных клеток ПЖ: HNF1α связывается с промоторными участками более чем 100 генов и регулирует экспрессию таких важных ТФ, как PDX1, HNF4α и HNF4γ [Boj et al., 2001; Gerrish et al., 2001; Odom et al., 2004]. Экспрессия HNF1 выявляется на ранних стадиях эмбриогенеза, при формировании висцеральной энтодермы [Barbacci et al., 1999]. HNF1 необходим для нормального формирования и функционирования печени, желчного пузыря и желчных протоков, ПЖ [Coffinier et al., 2002; Haumaitre et al., 2005]. Экспрессия HNF1 в клетках этих органов, как правило, предшествует экспрессии HNF1α и быстро падает на поздних этапах эмбриогенеза [Ott 33 et al., 1991]. Так, на поздних стадиях эмбриогенеза ПЖ HNF1 детектируется только в активно пролиферирующих протоковых клетках [Maestro et al., 2003]. В клетках эмбриональной ПЖ HNF1-зависимая регуляция транскрипции тесно связана с экспрессией фактора HNF6: эти два белка способны регулировать гены друг друга, то есть образуют реципрокную регуляторную петлю [Clotman et al., 2002; Maestro et al., 2003; Poll et al., 2006]. Впервые HNF1 был описан как ген, мутации которого вызывают MODY [Horikawa et al., 1997]. Инактивация HNF1 в эмбриогенезе мыши приводит к невозможности дифференцировки эндокринных клеток и серьезным нарушениям развития ацинарной части ПЖ [Haumaitre et al., 2005]. У взрослых пациентов, страдающих MODY, связанным с мутациями HNF1, часто также наблюдается гипоплазия ткани ПЖ, что частично компенсируется повышенной секреторной активностью экзокринных панкреатических клеток [Bellanné-Chantelot et al., 2004; Tjora et al., 2013]. Гетерозиготные мутации HNF1 ассоциированы также с патологиями почек, желчного пузыря и мочеполовой системы [BellannéChantelot et al., 2004; Beckers et al., 2007]. Семейство FOXA включает три белка (FOXA1, FOXA2 и FOXA3), отличительной особенностью которых является ДНК-связывающий домен типа «крылатая спираль», обеспечивающий взаимодействие мономеров с ДНК [Clark et al., 1993]. Такая структура ДНКсвязывающего домена очень близка к структуре гистоновых белков H1 и H5, что позволяет факторам семейства FOXA изменять организацию хроматина, что влияет на активность других ТФ [Cirillo and Zaret, 2007]. Хроматин-модулирующая функция FOXA наблюдается при обособлении клеток зачатков печени и ПЖ при эмбриональной индукции [Cirillo et al., 2002]. ТФ семейства FOXA осуществляют регуляцию экспрессии множества генов как во время эмбриогенеза, так и во взрослом состоянии. Как правило, факторы FOXA1, FOXA2 и FOXA3 действуют координировано, некоторые функции каждого из них дублируются другими факторами семейства. FOXA2, по-видимому, играет наибольшее важную роль на ранних стадиях эмбриогенеза, обеспечивая координацию процессов гаструляции, формирования нотохорда, первичной кишки. Совместное действие FOXA1 и FOXA2 на стадии органогенеза необходимо для формирования печени, легких, дифференцировки панкреатических клеток. После рождения все три ТФ семейства FOXA отвечают за экспрессию белков, поддерживающих функции тканей пищеварительного тракта (ферменты метаболизма глюкозы в печени и ПЖ, α-амилаза и субъединицы АТФ-чувствительного К+-канала в клетках ПЖ) [Cockell et al., 1989; Sund et al., 2001; Lee et al., 2005; Friedman and Kaestner, 2006]. Факторы FOXA1 и FOXA2 начинают экспрессироваться в клетках эндодермы первичной кишки еще до начала спецификации панкреатических почек [Monaghan et al., 1993]. Позже, во время эмбриогенеза ПЖ, FOXA2 активирует ген PDX1, тем самым индуцируя 34 дифференцировку эндокринных клеток [Gerrish et al., 2000; Gao et al., 2008]. Параллельно с этим процессом FOXA3 индуцирует синтез проглюкагона в эндокринных α-клетках [Liu et al., 2002]. С другой стороны, совместное действие FOXA2, FOXA3 и PTF1α необходимо для активации гена панкреатической α-амилазы в ацинарных клетках ПЖ [Cockell et al., 1995]. Аналогично, активность FOXA1 и FOXA2 необходима для поддержания дифференцированного состояния β-клеток [Gao et al., 2010]. Описаны нарушения экспрессии глюкагона и секреции инсулина в ПЖ мышей, несущих гомозиготные мутации гена FOXA1; такие мыши погибают на 2-12 день постнатального развития [Kaestner et al., 1999; Vatamaniuk et al., 2006]. Снижение уровней экспрессии FOXA1 и FOXA2 часто наблюдается в дедифференцированных клеточных линиях ПАКПЖ. TGFβ- и HGF-индуцированный ЭМП в этих клетках сопряжен с дальнейшим подавлением экспрессии факторов семейства FOXA, в то время как реэкспрессия FOXA2 ослабляет выраженность мезенхимального фенотипа клеток [Song et al., 2010]. Аналогичные эффекты наблюдаются при подавлении или гиперэкспрессии FOXA2 в опухолевых клетках легкого, что подтверждает ЭМТ-супрессорную роль FOXA2 [Tang et al., 2011]. Семейство HNF6 (ONECUT). Фактор HNF6 (OC-1) является первым описанным представителем класса ТФ, ДНК-связывающий домен которых представлен гомеобоксом и одним CUT-доменом [Lemaigre et al., 1996]. Позже были открыты родственные ему факторы OC-2 и OC-3 [Jacquemin et al., 1999; Vanhorenbeeck et al., 2002]. Наиболее изученным представителем семейства является фактор HNF6. Описано две изоформы, HNF6α и HNF6β, различающиеся на 21 аминокислотный остаток, обладающие близкими свойствами и образующиеся в результате альтернативного сплайсинга [Rastegar et al., 1998]. В клетках печени и островков ПЖ описано около 200 генов-мишеней HNF6 [Odom et al., 2004]. Экспрессия HNF6 во время пренатального развития стимулирует дифференцировку гепатоцитов и панкреатических клеток, подавление его активности приводит к аномалиям развития желчного пузыря и панкреатических протоков [Landry et al., 1997; Clotman et al., 2002; Pierreux et al., 2006]. Во взрослом состоянии HNF6 экспрессируется в основном в гепатоцитах, островках Лангерганса и протоковых клетках ПЖ [Vaisse et al., 1997; Jacquemin et al., 1999; Pierreux et al., 2006]. Связываясь с промоторными районами активируемых генов, HNF6 образует комплекс с C/EBPα, который может выступать в качестве индуктора пролиферации, ингибитора клеточной миграции и воспалительных процессов [Tan et al., 2006; Yoshida et al., 2006; Lehner et al., 2007; Margagliotti et al., 2007; Wang et al., 2008]. В промоторе гена HNF6 описан сайт связывания HNF1. В свою очередь, HNF6 активирует экспрессию самого раннего маркера панкреатических клеток PDX1. Таким образом, обособление клеток-предшественников ПЖ зависит от активности каскада HNF1-HNF6-PDX1 35 [Jacquemin et al., 2003; Poll et al., 2006]. На более поздних стадиях развития ПЖ HNF6 осуществляет контроль дифференцировки эндокринных и протоковых клеток [Pierreux et al., 2006; Vanhorenbeeck et al., 2007]. Подавление экспрессии HNF6 является необходимым условием окончательной дифференцировки эндокринных клеток, в противном случае чувствительность к глюкозе и эффективность секреции инсулина β-клетками значительно снижаются [Tweedie et al., 2006]. Нокаут HNF6 у мышей приводит к их ранней гибели из-за нарушения работы печени и развития диабета, вызванного недостатком эндокринных клеток ПЖ. При этом функции экзокринной части ПЖ не нарушаются; возможно, потеря функции HNF6 до некоторой степени компенсируется активностью его паралога OC-2 [Jacquemin et al., 2000; Vanhorenbeeck et al., 2007]. Тканеспецифический инактивация гена HNF6 в клетках ПЖ сопровождается нарушением формирования протоков, усилением пролиферационной активности протоковых клеток и подавлением экспрессии дифференцировочных маркеров [Zhang et al., 2009]. Предполагается, что нарушение функции HNF6 может играть важную роль в развитии опухолей ПЖ. Как говорилось выше, его экспрессия характерна для протоковых клеток, опухолевая трансформация которых приводит к возникновению ПАКПЖ. Образцы ткани ПАКПЖ характеризуются пониженными уровнями экспрессии HNF6 и регулируемого им HNF1β по сравнению с нормальной тканью ПЖ. Аналогичная закономерность наблюдается в большинстве клеточных линий ПАКПЖ. Экзогенная реэкспрессия HNF6 в клетках Panc1 сопровождается ослаблением их способности к инвазии и восстановлением экспрессии HNF1β [Jiang et al., 2008]. С другой стороны, активация экспрессии HNF6 в дифференцированных ациноцитах ассоциирована с их редифференцировкой по типу протоковых клеток и развитием ацинарно-протоковой метаплазии – одного из типов неизвазивных панкреатических неоплазий [Prévot et al., 2012]. Семейство C/EBP. К семейству C/EBP относят 6 белков (α, β, γ, δ, ε, ζ), для которых характерно наличие «лейциновой застежки», обеспечивающей димеризацию при связывании ДНК [Schrem et al., 2004]. Белки семейства C/EBP могут образовывать гетеродимеры, благодаря чему возможна тонкая регуляция экспрессии генов, содержащих в промоторе C/EBPсвязывающие элементы. Как правило, C/EBP являются активаторами транскрипции, поскольку все изоформы семейства способны связывать коактиваторы p300/CBP [Mink et al., 1997; Erickson et al., 2001]. В различных тканях транс-активационное действие C/EBP определяется набором экспрессирующихся факторов этого семейства. Так, в нормальных гепатоцитах активны белки C/EBPα, C/EBP и C/EBPδ, регулирующие процессы глюконеогенеза и детоксикации [Schrem et al., 2004]. В гепатоцитах и во многих других тканях C/EBPα и C/EBP контролируют процессы 36 пролиферации и апоптоза [Ramji and Foka, 2002]. При этом в норме поддерживается определенное соотношение уровней C/EBPα и C/EBP. Регенерация печеночной ткани сопровождается резким повышением экспрессии C/EBP при одновременном падении активности C/EBPα. Общий уровень экспрессии C/EBP при этом остается практически неизменным [Greenbaum et al., 1995]. Как и другие ГЯФ, факторы семейства C/EBP регулируют ранние стадии развития печени; экспрессия C/EBPα и C/EBP в гепатобластах является одним из наиболее ранних отличий клеток печени от панкреатических клеток-предшественников [Westmacott et al., 2006]. Специфичность экспрессии C/EBP именно для клеток печени подчеркивает также тот факт, что гиперэкспрессия PDX1 в гепатоцитах, приводящая к их дедифференцировке, сопровождается подавлением экспрессии C/EBP [Meivar-Levy et al., 2007]. Нарушения экспрессии любого из этих белков оказывают серьезное влияние на пролиферацию гепатоцитов: у мышей, нокаутных по C/EBPα, наблюдается гиперплазия печени, в то время как нокаут C/EBP очень сильно замедляет регенерацию печеночной ткани [Flodby et al., 1996; Greenbaum et al., 1998]. В обоих случаях продолжительность жизни мышей очень мала из-за критических нарушений синтеза гликогена [Wang et al., 1995]. В клетках ПЖ факторы семейства C/EBP в норме не экспрессируются, однако активация экспрессии C/EBP может наблюдаться при патологических изменениях и сопровождается подавлением синтеза инсулина и повышением чувствительности β-клеток к дисфункции эндоплазматического ретикулума (ER-стресс) [Plaisance et al., 2009; Matsuda et al., 2010]. Семейство HNF4. Белки семейства HNF4 относятся к группе ядерных рецепторов подсемейства NR2, сходных по своему строению с рецептором Х ретиноевой кислоты. В структуре этих белков можно выделить пять функциональных доменов (Рисунок 6): Домен A/B отвечает за транс-регуляторные свойства рецептора, поскольку содержит сайты связывания кофакторов; Домен C представляет собой ДНК-связывающую структуру и состоит из двух мотивов типа «цинковые пальцы»; Домен D выполняет функцию гибкой связки между ДНК- и лиганд-связывающей частями рецептора; Домен E отвечает за связывание лигандов и димеризацию транскрипционных факторов; Домен F участвует в контроле транскрипционной активности рецептора, оказывая ингибирующее воздействие на транс-активационные сайты (характерен только для факторов семейства HNF4) [Sladek et al., 1990; Hadzopoulou-Cladaras et al., 1997; Robinson-Rechavi et al., 2003; Lu et al., 2008]. 37 Предполагаемыми лигандами, связывающимися с факторами семейства HNF4 in vitro и изменяющими их сродство к ДНК и способность к димеризации, являются ацил-КоА-тиоэфиры жирных кислот; однако влияние их связывания на функции HNF4 in vivo пока достоверно не описано [Petrescu et al., 2002; Ruse et al., 2002]. Показано, что в клетках млекопитающих HNF4α, наиболее исследованный представитель семейства, селективно связывает молекулы линолевой кислоты, но наличие лиганда в связывающем центре не оказывает значительного эффекта на транскрипционную активность фактора [Yuan et al., 2009] Cемейство HNF4 представлено тремя ТФ: HNF4α, HNF4 и HNF4; факторы HNF4α и HNF4γ экспрессируются в клетках многих органов млекопитающих, гомологичный им фактор HNF4β описан у амфибии Xenopus laevis. В настоящее время наиболее изученным является HNF4α. Многочисленные исследования показали, что HNF4α является центральным регулятором сети ГЯФ в гепатоцитах, определяет дифференцировку многих органов пищеварительного тракта и часто может играть роль опухолевого супрессора. Строение, свойства и функции HNF4α подробно разобраны в следующей главе. 2.5. ТРАНСКРИПЦИОННЫЙ ФАКТОР HNF4α 2.5.1.Строение гена HNF4A и его изоформы Описано 12 изоформ фактора HNF4α, образующихся в результате альтернативного сплайсинга (Рисунок 6). Транскрипция гена HNF4A на различных стадиях развития печени осуществляется с двух альтернативных промоторов - Р1 и Р2 (Рисунок 7) [Nakhei et al., 1998]. С промотора Р1 транскрибируется группа изоформ HNF4αP1, включающая изоформы с первой по шестую; транскрипция изоформ α7-α12 происходит с промотора P2 [Torres-Padilla et al., 2001]. Транс-активационные способности этих двух групп различны; соотношение уровней экспрессии групп изоформ HNF4αP1 и HNF4αP2 на разных стадиях развития органов и тканей играет чрезвычайно важную роль в регуляции дифференцировки и последующего функционирования клеток. Благодаря существованию двух групп изоформ, контролирующих функционально различные группы генов, возможна тонкая регуляция активности геновмишеней на всех этапах развития организма. Так, в печени изоформы группы HNF4αP2 экспрессируются во время эмбрионального развития и индуцируют экспрессию регуляторов ранних этапов дифференцировки гепатоцитов, а изоформы группы HNF4αP1 характерны для взрослой печени и регулируют активность генов, поддерживающих дифференцированное состояние клеток печени [Duncan et al., 1997; Li et al., 2000; Hayhurst et al., 2001; Torres-Padilla et al., 2001; Parviz et al., 2003; Battle et al., 2006]. 38 Рисунок 6. Схема строения различных изоформ HNF4α. Слева указаны названия отдельных изоформ. Буквами обозначены отдельные домены. Разными цветами обозначены вариабельные участки доменов. Числами над схемами указаны границы доменов и длины вставок в аминокислотных остатках. В верхней части рисунка указаны функции отдельных доменов [адаптировано из Makarova et al., 2014]. 39 Рисунок 7. Схема альтернативной транскрипции и альтернативного сплайсинга гена HNF4A. Числами указаны номера доменов, первый домен имеет дополнительные обозначения вследствие вариабельности, разными цветами выделены вариабельные участки, соответствующие доменам на Рисунке 6. Пунктирные линии обозначают возможные варианты сплайсинга [Makarova et al., 2014]. Большое количество изоформ HNF4α обусловлено разнообразием вариантов альтернативного сплайсинга РНК гена. Ген HNF4A состоит из 10 экзонов, при этом есть два основных варианта экзона 1 (транскрибирующиеся с промоторов P1 и P2), а также вариабельные участки в экзонах 1, 8 и 9 (Рисунки 6 и 7). Изоформы α4-α6 отличаются от изоформ α1-α3 наличием 30-аминокислотной вставки в N-концевом A/B-домене. Изоформы α10, α11 и α12 образуются в том случае, если при сплайсинге из последовательности РНК изоформ, транскрибирующихся с промотора P2, не вырезается экзон 1E, содержащий терминирующий кодон, сайт связывания рибосомы и стартовый кодон трансляции. В этом случае белок несет укороченный P2-вариант домена A/B [Huang et al., 2011]. Особенностью изоформ α2, α5 и α8 является С-концевая вставка в F-домене длиной 10 а. о. [Nakhei et al., 1998]. Для изоформ α3, α6 и α9 характерен укороченный вариант F-домена, последовательность которого отличается от последовательности F-домена других изоформ [Kritis et al., 1996]. 2.5.2. Транскрипционная активность HNF4α HNF4α осуществляет функции регулятора транскрипции, связываясь с промоторными участками генов в виде гомодимера. Сайтом связывания HNF4α служит DR1-мотив, имеющий последовательность AGGTCAxAGGTCA [Jiang and Sladek, 1997]. Различие транс- активационных свойств групп HNF4αР1 и HNF4αР2 обусловлено различиями в строении Nконцевого домена (Рисунок 6), отвечающего за образование комплекса с белкамикоактиваторами или корепрессорами, поэтому разные изоформы могут оказывать различное влияние на одни и те же гены. Белковые молекулы HNF4α содержат один или два сайта связывания транскрипционных кофакторов: сайт связывания AF-2 расположен в домене E и необходим для регуляторной активности всех изоформ HNF4α, в то время как сайт AF-1 находится в домене A/B и обладает полной функциональностью только в изоформах группы 40 HNF4αP1. Изоформы α7-α12 несут укороченный вариант A/B- домена, возможности связывания кофакторов у которого сильно ограничены по сравнению с A/B-доменом изоформ α1-α6. По всей видимости, отличия функций этих изоформ обусловлены взаимодействием с различными видами гистондеацетилазных комплексов и других кофакторов [Dell and Hadzopoulou-Cladaras, 1999; Malik et al., 2002; Torres-Padilla et al., 2002]. Переключение экспрессии изоформ HNF4α, таким образом, приводит к изменению уровней экспрессии многих функциональных генов. 2.5.3. HNF4α в развитии и функционировании эпителиальных органов и тканей. HNF4α играет значительную роль во время эмбрионального развития организма. Экспрессия HNF4α в эмбриогенезе впервые обнаруживается в клетках висцеральной эндодермы бластоцисты на стадии, непосредственно предшествующей гаструляции [Duncan et al., 1997]. Мышиные эмбрионы, дефектные по гену HNF4α, погибают на 10,5 день эмбрионального развития в результате аномального прохождения гаструляции [Chen et al., 1994]. Показано, что HNF4α не влияет на образование зачатка печени, но обеспечивает правильное развитие гепатоцитов: у эмбрионов мышей с инактивированным в период формирования печени геном HNF4α наблюдалось нарушение морфологии и функций клеток печени [Li et al., 2000; Parviz et al., 2003]. Во взрослой печени этот ТФ регулирует экспрессию широкого спектра белков, отвечающих за метаболизм аминокислот, липидов, углеводов и ксенобиотиков, транспорт ионов, системы протеолиза. Сайты связывания HNF4α обнаружены в регуляторных элементах 12% генов, экспрессирующихся в гепатоцитах человека; последние исследования показывают, что количество нуклеотидных последовательностей, способных связывать HNF4α, может достигать 10000 [Odom et al., 2004; Bolotin et al., 2010]. HNF4α непосредственно контролирует экспрессию ряда сывороточных белков – транстиретина, некоторых аполипопротеинов [Sladek et al., 1990]. У человека описано по крайней мере три гена, мутации в HNF4α-связывающем сайте которых приводят к серьезным заболеваниям. Два гена кодируют факторы свертываемости крови –VII и IX, мутации в промоторах этих генов ассоциированы с гемофилией [Carew et al., 2000]. Третий ген – транскрипционный фактор HNF1α; активность гена HNF1α на 95% регулируется за счет HNF4α [Tian and Schibler, 1991]. По последним данным, HNF4α также напрямую регулирует значительное количество генов, участвующих в регуляции клеточного цикла, иммунного ответа, апоптоза и других процессов [Bolotin et al., 2010]. Кондиционный нокаут гена HNF4α в эмбриональных мышиных гепатоцитах приводит к падению уровней экспрессии части гепатоспецифических генов и развитию стрессового ответа [Hayhurst et al., 2008]. В гепатоцитах взрослой мыши подобный нокаут приводит к отложению 41 липидов внутри клеток, нарушению транспорта желчных кислот [Hayhurst et al., 2001], нарушению межклеточных контактов [Battle et al., 2006] и многим другим изменениям. Открытые в клетках печени, ГЯФ впоследствии были также обнаружены в других органах пищеварительного тракта и тканях, напрямую с ним не связанных (Таблица 1). Экспрессия HNF4α была выявлена в эпителии ПЖ, почки, желудка, кишечника, а также в яичниках. При этом в разных органах во взрослом состоянии могут экспрессироваться как изоформы группы HNF4αP1, так и изоформы группы HNF4αP2 (Таблица 2) [Tanaka et al., 2006]. Однако на сегодняшний день функции и спектры генов, регулируемые HNF4α в клетках этих тканей, исследованы значительно хуже по сравнению с гепатоцитами. Таблица 2. Экспрессия изоформ HNF4α в различных органах взрослого организма. Орган Печень Семен- Почка Поджелудочная ники Желудок железа Тонкая Толстая кишка кишка HNF4αP1 + + - ± - + + HNF4αP2 - - + + + + + Экспрессия HNF4α необходима для эмбрионального развития толстой кишки и является важным регулятором дифференцировки клеток эпителия тонкой кишки мыши [Garrison et al., 2006; Babeu et al., 2009]. Кондиционный нокаут гена HNF4A в эпителии кишечника мыши сопровождается подавлением синтеза клаудина-15, регулятора ионного обмена в клетках толстой кишки, развитием хронического воспаления, разнообразными нарушениями метаболизма и транспорта липопротеинов и изменением экспрессии ряда генов, характерным для опухолевой трансформации клеток кишечного эпителия [Darsigny et al., 2009; Marcil et al., 2010]. HNF4α-дефицитные клетки кишечного эпителия отличаются повышенной пролиферативной активностью и нарушением барьерной функции [Cattin et al., 2009]. Экспрессия группы изоформ HNF4αP1 характерна для развивающихся нефронов почки, после окончательной дифференцировки клеток почечного эпителия она сохраняется только в проксимальных канальцах [Kanazawa et al., 2009]. HNF4α необходим для мезенхимальноэпителиального перехода, происходящего в мезенхимальных клетках развивающейся почки и приводящего к формированию нефронов [Kanazawa et al., 2011]. Подавление экспрессии HNF4α в клетках почечной мезенхимы приводит к нарушению формирования областей конденсированной мезенхимы, индукции апоптоза и невозможности развития почечных канальцев [Kanazawa et al., 2010]. 42 Для всех типов клеток как эмбриональной, так и взрослой ПЖ характерна экспрессия группы изоформ HNF4αP2 [Boj et al., 2001; Tanaka et al., 2006; Nammo et al., 2008]. Во время эмбрионального развития в клетках ПЖ также экспрессируются изоформы группы P1, во взрослом состоянии низкий уровень экспрессии HNF4αP1 сохраняется в клетках островков [Harries et al., 2008; Huang et al., 2008]. Уровни экспрессии HNF4α могут сильно различаться в разных типах панкреатических клеток на разных стадиях эмбрионального развития ПЖ [Nammo et al., 2008]. На сегодняшний день некоторые функции HNF4α описаны только в βклетках островков Лангерганса, роль HNF4α в других типах панкреатических клеток остается неясной. HNF4α способен регулировать ряд генов, экспрессия которых специфична для βклеток, среди них гены инсулина, GLUT2, альдолазы B и других. HNF4α связывается с промотором гена HNF1a, который является важным регулятором дифференцировки клеток ПЖ; возможно, что часть HNF4α-зависимых изменений экспрессии панкреатических генов опосредованы действием фактора HNF1α [Wang et al., 2000]. С другой стороны, показано, что HNF4α способен напрямую связываться с промотором гена инсулина; подавление активности HNF4α в клетках инсулиномы INS-1 приводит к значительному снижению уровня синтеза инсулина [Bartoov-Shifman et al., 2002]. Поиск возможных генов-мишеней HNF4α в клетках островков выявил более 1000 сайтов связывания этого фактора, находящихся в промоторах генов, кодирующих компоненты многих клеточных систем; количество генов, потенциально регулируемых HNF4α, в несколько раз превосходит аналогичные значения, полученные для HNF1α и HNF6 [Odom et al., 2004]. Таким образом, HNF4α может обладать значительно большей регуляторной ролью в клетках островков Лангерганса, чем другие ГЯФ. Нарушение функции фактора HNF4α в клетках ПЖ приводит к развитию нескольких достаточно распространенных заболеваний, связанных с нарушениями гормональной регуляции и метаболическими расстройствами. Наиболее известными из них являются сахарный диабет гиперинсулинизм. MODY, Описано гиперинсулинемическая несколько гипогликемия полиморфизмов и и мутаций наследственный промотора P2, ассоциированных с повышенным риском развития MODY [Yamagata et al., 1996; Silander, 2004; Pearson et al., 2005]. Раннему развитию диабета II типа могут способствовать мутации не только промотора P2, но и промотора P1, активного в эмбриональной ПЖ [Harries et al., 2008]. По всей видимости, причиной развития заболевания при инактивации HNF4α являются общее понижение синтеза инсулина и нарушение работы систем, регулирующих его трансмембранный перенос [Miura et al., 2006]. Наследственный гиперинсулинизм и гиперинсулинемическая гипогликемия – две взаимосвязанные болезни, причем вторая часто развивается как производное первой. Обе они вызваны повышенным уровнем секреции инсулина, из-за чего уровень глюкозы в крови пациентов постоянно понижен. Так как HNF4α 43 является важным регулятором экспрессии гена инсулина, повышение его активности может приводить к гиперсекреции инсулина [Wang et al., 2000]. Мутации HNF4α часто ассоциированы с неонатальной гипогликемией и макросомией [Fajans and Bell, 2007; Pearson et al., 2007]. В последнее время появляется информация о более тяжелых случаях наследственного гиперинсулинизма, связанных с мутациями HNF4α [Kapoor et al., 2008]. Таким образом, HNF4α является важнейшим регулятором развития и функционирования органов пищеварительного тракта, а нарушения его функций сопровождаются развитием тяжелых болезней, связанных с нарушениями метаболизма и эндокринной регуляции. Роль HNF4α в развитии злокачественных новообразований будет рассмотрена ниже. 2.5.4. Другие представители семейства HNF4 Факторы HNF4 и HNF4 исследованы значительно хуже, чем HNF4α. Экспрессия HNF4 обнаружена только в тканях Xenopus Laevis [Holewa et al., 1997], характеристики этого фактора практически не изучены, поэтому здесь он рассматриваться не будет. Экспрессия HNF4 описана в ПЖ, кишечнике, почках и семенниках млекопитающих [Drewes et al., 1996]. Аминокислотная последовательность HNF4 на 70-80% гомологична последовательности HNF4α, существенные отличия наблюдаются для доменов A/B и F (Рисунок 8) [Taraviras et al., 2000; Интернет-сервис NCBI BLAST]. Рисунок 8. Схема строения факторов HNF4α и HNF4 мыши. Справа указаны названия факторов; буквами обозначены отдельные домены; числа на схемах обозначают степень гомологии внутри доменов, числами под схемами обозначены граничные аминокислоты доменов [адаптировано из Taraviras et al., 2000]. В связи с высокой гомологией ДНК-связывающего домена (С-домен) HNF4 может связываться с теми же последовательностями, что и HNF4α, однако его транскрипционная активность значительно ниже, чем активность HNF4α [Drewes et al., 1996; Taraviras et al., 2000]. Получены данные о повышении уровня экспрессии HNF4 в клетках эпителия тонкого кишечника мыши при кондиционном нокауте HNF4α [Cattin et al., 2009]. Таким образом, в некоторых тканях HNF4 может выполнять те же функции, что и HNF4α; возможно, он осуществляет компенсаторное действие в случае повреждения гена HNF4α. Мутации гена HNF4, в отличие от HNF4α, не ассоциированы с развитием диабета, что также свидетельствует 44 в пользу гипотезы о второстепенной роли HNF4 по отношению к HNF4α, по крайней мере, в клетках печени и ПЖ [Plengvidhya et al., 1999; Hara et al., 2000]. Таким образом, функции и особенности регуляции HNF4 на данный момент изучены достаточно слабо, определение его роли в организме требует дальнейших исследований. 2.5.5. Механизмы регуляции экспрессии HNF4α Как уже говорилось ранее, ГЯФ образуют сложную сеть взаимной регуляции. Каждый из элементов этой сети находится под контролем со стороны других ее элементов; в случае HNF4α, являющегося одним из «ключевых» ТФ, системы регуляции отличаются особенной сложностью и скоординированностью. Следует, однако, заметить, что данные, полученные о системах регуляции как in vitro, так и in vivo, нельзя считать точными и окончательными, так как они отражают возможность взаимодействий между белками и ДНК вообще и в конкретной живой системе при физиологических условиях могут никогда не наблюдаться. Система регуляции HNF4α в настоящее время лучше всего изучена для клеток печени. Существует два регуляционных блока ТФ, контролирующих экспрессию двух групп изоформ, Р1 и Р2 [Nakhei et al., 1998]. Экспрессия группы HNF4αP1 определяется регуляторными элементами в самом промоторе P1 и в энхансерном участке, расположенном примерно в 6,5 тысячи пар оснований выше промотора [Bailly et al., 2001]. В промоторе Р1 обнаружены консервативные сайты, связывающие факторы HNF1α, HNF1β, HNF6, Sp-1, COUP-TFII и GATA6. На ранних стадиях развития активация Р1 происходит при совместном действии HNF1 и GATA6; во взрослой печени активация Р1 обеспечивается взаимодействием HNF1α и HNF6. COUP-TFII и SNAI1 являются прямыми репрессорами транскрипции гена HNF4A [Hatzis and Talianidis, 2001; Cicchini et al., 2006]. Описана негативная ауторегуляция акивности гена HNF4A изоформой HNF4α1, связывающейся в промоторном районе [Magenheim et al., 2005]. Связывание C/EBPα, HNF4α, FOXA2, HNF1α и - в энхансерном участке приводит к дальнейшему повышению экспрессии HNF4αP1 во взрослой печени [Bailly et al., 2001; Kyrmizi et al., 2006]. Промотор Р2 находится под контролем факторов HNF1α и - и фактора PDX1, определяющего дифференцировку клеток в направлении -клеток [Thomas et al., 2001]. Также получены данные о его активации факторами HNF6 и OC-2 и репрессии фактором HNF4αP1 в гепатоцитах эмбриона мыши [Briancon et al., 2004]. HNF4α1 способен подавлять активность промотора P2 посредством прямого связывания с ним; этот механизм может отвечать за подавление экспрессии HNF4αP2 и его замену на HNF4αP1 в гепатоцитах на поздних стадиях их дифференцировки [Briancon et al., 2004]. 45 Иерархия тканеспецифических ТФ в клетках ПЖ может существенно отличаться от наблюдаемой в гепатоцитах, ряд исследований указывает на регуляторные схемы, характерные именно для панкреатических клеток [Duncan et al., 1998; Pontoglio et al., 2000; Wang et al., 2000; Boj et al., 2001]. На Рисунке 9 приведена предполагаемая схема взаимной регуляции различных представителей ГЯФ и других панкреа-специфических ТФ в клетках ПЖ. При построении данной схемы были использованы данные о прямом связывании ТФ с промоторными или энхансерными участками генов. Рисунок 9. Предполагаемая схема регуляторных взаимодействий ГЯФ и других транскрипционных факторов в ПЖ. Системы регуляции экспрессии HNF4α, не связанные с ГЯФ, изучены в меньшей степени. Одним из главных регуляторов, воздействующих на экспрессионную программу клетки, является трансформирующий фактор роста TGF [Pardali and Moustakas, 2007]. Основным TGF-зависимым путем, по которому внешние сигналы передаются к HNF4α, является Smad-путь [Feng and Derynck, 2005; Massagué et al., 2005]. Активированный комплекс 2Smad2∙Smad4 или 2Smad3∙Smad4 может напрямую взаимодействовать с C- и N-доменами HNF4α, что приводит к дополнительной активации обоих ТФ [Kardassis et al., 2000; Chou et al., 2003]. Получены данные, свидетельствующие о возможности прямой индукции экспрессии изоформ HNF4αP2 в клеточных линиях гепатокарцином Smad4 [Макарова и соавт., неопубликованные данные]. комплексом факторов Smad2/3 и 46 Активность HNF4α может регулироваться через TGF-зависимый MAPK-Erk-каскад, в перитонеальных клетках мезотелия приводящий к активации факторов NF-κB и Snail [Peinado et al., 2004; Strippoli et al., 2008]. На линии мышиных гепатоцитов MHH продемонстрирована возможность подавления экспрессии HNF4αР1 фактором SNAI1, который связывается с Р1 промоторным участком гена и тем самым делает невозможной инициацию транскрипции [Cicchini et al., 2006]. Кроме того, в клетках гепатомы HepG2 регуляторную активность HNF4α может напрямую подавлять фактор NF-κB, связывающийся с его активирующими доменами, которые в результате не могут взаимодействовать с белками-коактиваторами [NikolaidouNeokosmidou et al., 2006]. Таким образом, HNF4α является центральным регулятором чрезвычайно сложной и разветвленной сети тканеспецифической регуляции транскрипции генов. Он играет роль посредника сигналов, приходящих от огромного количества внутри- и внеклеточных регуляторных каскадов и путей. Количество потенциальных генов-мишеней HNF4α в несколько раз превышает описанное для других представителей ГЯФ. Все эти факты позволяют с большой долей уверенности считать HNF4α «ключевым» регулятором развития, дифференцировки и функций органов пищеварительного тракта и ряда других тканей. Нарушения функции «ключевых» регуляторных элементов часто приводят к развитию злокачественных новообразований и метаболических синдромов; для HNF4α это подтверждается связью его дисфункций с развитием MODY-диабета. Поэтому исследование роли HNF4α и нарушений его функций в развитии опухолевых заболеваний представляет собой актуальное и многообещающее направление современной фундаментальной онкологии. 2.6. РОЛЬ HNF4α В КАНЦЕРОГЕНЕЗЕ 2.6.1. HNF4α в развитии гепатоцеллюлярной карциномы. Нарушение экспрессии HNF4α является частым событием при развитии опухолей печени. Так, многие дедифференцированные клеточные линии гепатом характеризуются потерей экспрессии HNF4α [Faust et al., 1994]. При экспрессии экзогенного HNF4α в клетках культуры дедифференцированной гепатомы Н5 восстанавливается эпителиальная морфология, активируется экспрессия белков-маркеров дифференцировки (Е-кадхерина, цитокератинов), восстанавливаются межклеточные контакты и поляризация клеток [Späth and Weiss, 1997; Späth and Weiss, 1998]. Нарушения экспрессии изоформ HNF4α также были описаны в образцах ткани опухолей печени у крыс и человека [Flodby et al., 1995; Tanaka et al., 2006]. 47 Подавление экспрессии HNF4α является одним из ключевых моментов прогрессии гепатоцеллюлярной карциномы (ГК). Одно из наиболее детальных исследований роли нарушений HNF4α в клетках ГК было проведено в нашей лаборатории. При химической индукции диэтилнитрозамином и фенобарбиталом была получена медленнорастущая опухоль (мГК), из которой при перевивке одномоментно выщепилась быстрорастущая форма (бГК), отличающаяся низкой степенью дифференцировки клеток, высокой скоростью роста и способностью к образованию метастазов, изменением морфологии и нарушением контактов с ВКМ и межклеточных контактов. Клетки бГК обладали способностью к росту in vitro, что позволило получить из них культуру H33, использованную в дальнейших исследованиях. В клетках бГК и культуры H33 наблюдалось повышение активности теломеразы и потеря экспрессии большого количества тканеспецифических генов: альбумина, альдолазы В, пируваткиназы L-типа, глюкокиназы, аполипопротеинов А, В и С, α-фетопротеина и других [Lazarevich et al., 2004]. Такое одномоментное подавление экспрессии позволило сделать предположение о нарушении работы одного или нескольких из упоминавшихся выше «ключевых» ТФ. Исследование изменений экспрессии ТФ показало, что при возникновении мГК произошла активация экспрессии HNF4αP2, характерного для эмбриональных гепатоцитов. В клетках бГК произошло одновременное падение уровней экспрессии целого блока ТФ, контролирующих поддержание дифференцированного состояния гепатоцитов: HNF4α, HNF1α, HNF1, FOXA3, HNF6, FTF и Х рецептора прегнана (PXR) [Lazarevich et al., 2004]. Дальнейшие эксперименты, направленные на выяснение роли каждого из вышеперечисленных факторов в наблюдаемой прогрессии клеток ГК, показали, что экзогенная реэкспрессия фактора HNF4α1 в клетках Н33 приводит к восстановлению транскрипции части ТФ и белков-маркеров дифференцированного состояния. Восстановление экспрессии HNF4α1 привело также к восстановлению эпителиальной морфологии клеток, межклеточных контактов и контактов с ВКМ. Скорость пролиферации клеток Н33 также значительно понизилась, а опухоли, образовавшиеся при подкожной перевивке этих клеток мышам, росли значительно медленнее исходных бГК и не образовывали метастазов. Таким образом, восстановление экспрессии HNF4α1 вызвало реверсию опухоли к менее злокачественному фенотипу [Lazarevich et al., 2004]. В дальнейшем ряд исследований подтвердил опухоле-супрессорную роль HNF4α в гепатоцитах. Так, временное подавление экспрессии HNF4α в гепатоцитах индуцирует развитие ГК за счет активации каскадов микроРНК, индуцирующих воспалительный ответ [Hatziapostolou et al., 2011]. Кондиционный нокаут гена HNF4A в клетках печени взрослых мышей сопровождается повышением пролиферативной и снижением апоптической активности 48 гепатоцитов [Bonzo et al., 2012; Walesky et al., 2013]. Соответственно, экзогенная экспрессия HNF4α в культурах клеток ГК ассоциирована с ослаблением их пролиферативного, миграционного и инвазивного потенциала [Cozzolino et al., 2013; Walesky et al., 2013]. Более того, аденовирус-опосредованная экспрессия HNF4α в опухолях печени мышей оказывает на трансформированные гепатоциты выраженный антипролиферативный и антиметастатический эффект [Yin et al., 2008; Ning et al., 2010]. Возможным механизмом противоопухолевого действия HNF4α в клетках печени является подавление экспрессии генов SNAI1 и SLUG, что индуцирует в клетках мезенхимально-эпителиальный переход [Santangelo et al., 2011]. 2.6.2. HNF4α в опухолях других органов Установление опухоле-супрессорной роли HNF4α в клетках печени дало стимул к изучению его функций в других органах и тканях: ПЖ, толстом и тонком кишечнике, желудке, почке. Накопление информации о необходимости экспрессии HNF4α для правильной дифференцировки и развития этих органов подкрепляло предположения о его возможной противоопухолевой активности. На сегодняшний день связь нарушений экспрессии HNF4α с развитием опухолей описана, кроме печени, в кишечнике, почке, желудке и панкреатических βклетках. Развитие колоректальной карциномы часто ассоциировано с подавлением экспрессии группы HNF4αP1 или обеих групп изоформ, которое наблюдается как в клеточных культурах, так и в образцах опухолевой ткани [Tanaka et al., 2006; Oshima et al., 2007]. Содержание белков группы HNF4αP1 снижается чаще, чем HNF4αP2 (до 80% всех случаев), что, по всей видимости, связано с фосфорилированием тирозина-14 в P1-варианте A/B-домена киназой Src [Chellappa et al., 2012]. У пациентов с HNF4αP1-негативными колоректальными опухолями повышена вероятность формирования метастазов в печени [Oshima et al., 2007]. Исчезновение экспрессии HNF4α в эпителии кишечника ассоциировано с индукцией пролиферативной активности эпителиальных клеток и нарушением их архитектуры и барьерных функций [Cattin et al., 2009]. Таким образом, HNF4α может выступать в качестве опухолевого супрессора в клетках кишечного эпителия. Однако в некоторых случаях высокие уровни экспрессии HNF4α оказывают обратное действие на клетки опухолей кишечника: нокаут гена HNF4A в клетках кишечного эпителия мышей линии ApcMin (характеризуются повышенной частотой развития кишечных полипов) приводит к уменьшению количества развивающихся кишечных неоплазий [Darsigny et al., 2010]. Также было описано снижение скорости роста колоректальной карциномы HT29 при подавлении экспрессии HNF4α с помощью РНК-интерференции [Schwartz et al., 2009]. Поэтому роль изменений экспрессии HNF4α в развитии опухолей кишечника до сих пор представляется неоднозначной: по данным полногеномного скрининга 49 генов-мишеней HNF4α в клетках колоректальной карциномы Caco-2, HNF4α связывается с промоторами генов, как подавляющих, так и стимулирующих прогрессию опухолей [Weltmeier and Borlak, 2011]. Подавление экспрессии HNF4α наблюдается в значительной доле образцов карциномы эпителия почки [Sel et al., 1996]. Экзогенная экспрессия изоформы HNF4α2 в культуре клеток эмбриональной почки человека HEK293 сопровождается подавлением пролиферативной активности и изменением уровней экспрессии многих генов, вовлеченных в регуляцию неопластической трансформации клеток почки [Lucas et al., 2005; Grigo et al., 2008]. Информации о нарушении экспрессии HNF4α в клетках карциномы желудка на сегодняшний день немного. В норме в клетках желудка экспрессируются только изоформы группы HNF4αP2, однако в 57% образцов желудочных карцином наблюдается активация экспрессии изоформ HNF4αP1 [Tanaka et al., 2006]. С другой стороны, отсутствие экспрессии HNF4αP1 в клетках опухолей желудка ассоциировано с повышенной вероятностью их инвазии в прилежащие ткани [Uozaki et al., 2011]. Роль изменений экспрессии HNF4α в опухолях ПЖ исследована в наименьшей степени по сравнению с опухолями других HNF4α-экспрессирующих органов и тканей. Экспрессия HNF4α в клетках ПЖ позволяет предположить, что закономерности канцерогенеза, описанные ранее для клеток печени и других органов, могут реализовываться и при трансформации клеток поджелудочной железы. В клетках инсулиномы INS-1 уровни экспрессии обеих групп изоформ HNF4α значительно понижены по сравнению с нормальными островковыми клетками, экспрессия HNF4αP1 почти не детектируется [Huang et al., 2008]. Экзогенная экспрессия изоформ HNF4α2 и HNF4α8 в клетках INS-1 приводит к замедлению их пролиферации и индукции апоптоза [Erdmann et al., 2007]. Нокаут гена HNF4α в клетках панкреатических островков сопровождается развитием у них устойчивости к апоптозу; этот эффект опосредуется белком Anks4b, ген которого является прямой мишенью HNF4α [Sato et al., 2012]. Однако сведений о нарушении экспрессии HNF4α в протоковых клетках ПЖ, неопластическая трансформация которых приводит к возникновению наиболее распространенного типа панкреатических опухолей, ПАКПЖ, на сегодняшний день в мировой литературе практически нет. Только одна работа описывает повышение уровня синтеза HNF4α в PanIN-2 и PanIN-3 и исчезновение экспрессии HNF4α в дедифференцированной ПАКПЖ [Kim et al, 2013]. 50 2.7. ЗАКЛЮЧЕНИЕ ОБЗОРА ЛИТЕРАТУРЫ Итак, развитие опухолей – комплексный процесс, сопровождающийся значительными генетическими изменениями, проявляющимися в приобретении клетками неопластического фенотипа. Причиной глобального изменения спектров экспрессии генов в опухолевых клетках могут стать нарушения функций тканеспецифических транскрипционных факторов – регуляторов клеточной дифференцировки. Многочисленные исследования показывают, что в случае опухолей печени, кишечника, почки и некоторых других эпителиальных органов нарушение функций ГЯФ семейств FOXA, ONECUT, HNF4 играет существенную роль в канцерогенезе. Появляется все больше свидетельств того, что центральную роль в регуляции сети ГЯФ играет фактор HNF4α, который обладает опухолесупрессорной функцией в гепатоцитах, клетках эпителия кишечника, желудка и почки. Подавление экспрессии HNF4α является важным событием в процессе развития опухолей печени, а также ассоциировано с нарушениями функций клеток эпителия кишечника. Однако на сегоняшний день в мировой литературе не описано исследований, направленных на выяснение роли HNF4α в развитии ПАКПЖ. Большое значение в регуляции дифференцировки и функций клеток вышеперечисленных органов играет соотношение уровней экспрессии разных изоформ фактора HNF4α, экспрессирующихся с промоторов P1 и P2, так как эти группы изоформ обладают различной транс-активирующей способностью. Скоординированное изменение экспрессии групп изоформ HNF4αP1 и HNF4αP2 необходимо для правильного развития органов во время эмбриогенеза. В опухолевых клетках печени и кишечника также описаны нарушения экспрессии отдельных групп изоформ HNF4α, например, активация экспрессии нехарактерной группы HNF4αP2 в высокодифференцированных гепатоцеллюлярных карциномах или избирательное подавление изоформ HNF4αP1 в клетках колоректальной карциномы. Данная работа посвящена исследованию возможной роли различных изоформ HNF4α в прогрессии ПАКПЖ. Используя панель из четырех клеточных линий ПАКПЖ человека, отличающихся уровнями дифференцировки и спектрами экспрессии изоформ HNF4α, мы получили низкодифференцированные экспрессирующие изоформы HNF4α1 клеточные и HNF4α7, культуры а также ПАКПЖ, высоко- и экзогенно умеренно- дифференцированные культуры ПАКПЖ с подавленной экспрессией изоформ HNF4α. Мы исследовали изменения спектров экспрессии генов и биологических характеристик полученных культур с целью выявить HNF4α-зависимые изменения уровня дифференцировки и фенотипа этих клеток. 51 3. МАТЕРИАЛЫ И МЕТОДЫ 3.1. РАСТВОРЫ, СРЕДЫ И РЕАКТИВЫ 1) ТАЕ (трис-ацетатный буфер), буфер для электрофореза нуклеиновых кислот в агарозном геле: 0,04 М трис-ацетат, 1 мМ этилендиаминтетраацетат натрия (ЭДТА) (Sigma-Aldrich, США), рН 8,0; 2) PBS (фосфатно-солевой буфер): 137 мМ NaCl (Химмед, Россия), 2,7 мM KCl (Химмед, Россия), 13 мM Na2HPO4 (Химмед, Россия), 1,5 мM KH2PO4 (Химмед, Россия), рН 7,35; 3) Реактив Брэдфорд: 0,1%-й раствор кумасси G-250 (Helicon, Россия) в 10%-м растворе концентрированной H3PO4, содержащем 5% этилового спирта; 4) Разделяющий полиакриламидный гель (ПААГ): 10% акриламид (АА) (Bio-Rad Laboratories, США), 375 мМ трис-HCl (рН 8,8) (Amresco, США), 0,1% додецилсульфат натрия (ДСН) (Amresco, США), 0,1% персульфат аммония (ПСА) (Amresco, США), 0,04% тетраметилэтилендиамин (ТЕМЕД) (Amresco, США); 5) Концентрирующий полиакриламидный гель: 5% АА (Bio-Rad Laboratories, США), 130 мМ трис-HCl (рН 6,8) (Amresco, США), 0,1% ДСН (Amresco, США), 0,1% ПСА (Amresco, США), 0,1% ТЕМЕД (Amresco, США); 6) Буфер для электрофореза белков в полиакриламидном геле (трис-глициновый буфер): 25 мМ трис-ацетат (Amresco, США), 192 мМ глицин (Amresco, США), 0,1% ДСН (Amresco, США), рН 8,3; 7) Буфер для электропереноса белков с полакриламидного геля на мембрану: 25 мМ трисацетат (Amresco, США), 192 мМ глицин (Amresco, США), рН 8,3; 8) PVDF-мембрана для электропереноса белков «Immobilon-P» (Merck Millipore, США); 9) Набор для проявления иммуноблотинга «Immobilon Western Chemiluminescent HRP Substrate» (Merck Millipore, США); 10) 5’-бромдезоксиуридин (5’-BrdU, Sigma-Aldrich, США), 10 мМ раствор; 11) Набор для определения пролиферации «CyQUANT NF Cell Proliferation Assay Kit» (Invitrogen, США); 12) Метанол (Химмед, Россия); 13) HCl, 4 н. раствор (Химмед, Россия); 14) Triton X-100 (Amresco, США); 15) Tween-20 (Amresco, США); 16) BSA (сывороточный альбумин быка, Sigma-Aldrich, США), 3%-й раствор на PBS; 52 17) Краситель для электрофореза нуклеиновых кислот в агарозных гелях: 1 мМ ЭДТА, 0,25% ксиленцианол, 50% глицерин (Sigma-Aldrich, США); 18) Краситель для электрофореза белков в ПААГ: 62,5 мM трис-HCl, pH 6,8, 2%-й ДСН, 25%-й глицерин, 0,01%-й бромфеноловый синий (Bio-Rad Laboratories, США), 5%-й βмеркаптоэтанол (Promega, США); 19) Набор для выделения суммарной клеточной РНК «RNeasy Plus Mini Kit» (QIAGEN, Германия); 20) Набор для приготовления компетентных клеток E.coli «Z-competent E.coli transformation kit» (Zymo Research, США); 21) Набор для выделения плазмид «Plasmid Midi Kit» (QIAGEN, Германия); 22) Дезоксиаденозин-трифосфат, 100 мМ раствор (Силекс, Россия); 23) Дезокситимидин-трифосфат, 100 мМ раствор (Силекс, Россия); 24) Дезоксигуанозин-трифосфат, 100 мМ раствор (Силекс, Россия); 25) Дезоксицитидин-трифосфат, 100 мМ раствор (Силекс, Россия); 26) Дитиотритол, 40 мМ раствор (Sigma, США); 27) Буфер для проведения ПЦР с Taq-полимеразой, х10: 300 mM Трис-HCl, pH 8,6, 166 mM (NH4)2SO4, 25 mM MgCl2 (Силекс, Россия); 28) Набор реагентов для проведения ПЦР-РВ в присутствии красителя SYBR Green I (Синтол, Россия); 29) Буфер для лизиса клеток RIPA: 50 мM трис-HCl pH 7,4, 150 мM NaCl, 1% NP40, 0,25% дезоксихолат Na, 1 мM фенилметансульфонилфлюорид (PMSF), ингибиторы протеаз (Roche, Швейцария); 30) Среда DMEM (Sigma-Aldrich, США) с добавлением 10% эмбриональной телячьей сыворотки (Gibco, США) и 0,03% глутамина (ПанЭко, Россия); 31) Среда RPMI-1640 (Gibco, США) с добавлением 10% эмбриональной телячьей сыворотки (Gibco, США) и 0,03% глутамина (ПанЭко, Россия); 32) Среда LB (Gibco, США); 33) Агар LB (Gibco, США); 34) Кристаллвиолет, 0,1% раствор (ПанЭко, Россия); 35) Трипановый синий, 0,4% раствор в 0,81% растворе NaCl с добавлением 0,06% K2HPO4 (Bio-Rad Laboratories, США); 36) 4,6-диамидино-2-фенилиндола дигидрохлорид (DAPI) (Sigma, США); 37) Моноклональные антитела мыши к 5’-BrdU (Zymo Research, США); 38) Моноклональные антитела мыши к глицеральдегид-3-фосфатдегидрогеназе (GAPDH) (клон ZG003, Invitrogen, США); 53 39) Моноклональные антитела мыши к HNF4αTOT, клон H1415 (R&D Systems, США); 40) Моноклональные антитела мыши к HNF4αP1, клон K9218 (R&D Systems, США); 41) Моноклональные антитела мыши к HNF4αP2, клон H6939 (R&D Systems, США); 42) Моноклональные антитела мыши к E-кадхерину, клон 36, изотип IgG2a (BD Transduction Laboratories, США); 43) Моноклональные антитела козы к гамма-глобулинам мыши, конъюгированные с зеленой флуоресцентной меткой AlexaFluor 488 (Invitrogen, США); 44) Моноклональные антитела козы к гамма-глобулинам мыши, конъюгированные с пероксидазой хрена (Jackson ImmunoResearch Laboratories Inc., США); 45) Эльванол (Sigma-Aldrich, США). 3.2. ОЛИГОНУКЛЕОТИДНЫЕ ПРАЙМЕРЫ Для поиска праймеров использовали последовательности из генного банка NCBI [Интернет-сервис NCBI GenBank]. Подбор праймеров проводили при помощи программы Primer3 [Интернет-сервис Primer3]. Праймеры для HNF4α подбирали таким образом, чтобы фланкируемые участки гена принадлежали разным изоформам HNF4α (Рисунок 5). Последовательности праймеров приведены в Таблице 3. Рисунок 10. Схема связывания праймеров с разными участками изоформ HNF4α. Слева указаны изоформы, стрелками обозначены сайты связывания праймеров с кДНК, указаны названия праймеров и длины ПЦР-продуктов. Цветовые обозначения соответствуют вариабельным элементам на Рисунках 6 и 7. 54 Синтез праймеров осуществляла фирма «Синтол», Москва. Рабочие растворы праймеров содержали прямой и обратный праймеры в концентрации 100 мкг/мл каждый. Таблица 3. Использованные в работе праймеры к кДНК: Ген Последовательность прямого праймера Последовательность обратного праймера Размер продукта (п. н.) Температура отжига PPIA acgggtcctggcatcttgtc tgctggtcttgccattcctg 184 65ºС HNF4ATOT gcgtgcggaagaaccaca tgatccggtcccgctcat 153 65ºС HNF4AP1 atgtgcaggtgttgacgatg ctcgaggcaccgtagtgttt 139/229 62ºС HNF4AP2 ggccatggtcagcgtgaa ctcgaggcaccgtagtgttt 164/386 62ºС HNF4A2 tgcccactcacctcagcaa gcagagaggggcttgacga 133/163 64ºС HNF4A3 aagatcaagcggctgcgttcc ctgggcttggcacggacct 228 68ºС PDX1 aaagctcacgcgtggaaagg cggcggttttggaaccagat 218 65ºС PTF1A ctcgtgcctggcctaccc ggcgtcgttgatggactgc 190 65ºС HNF1A tctaagctgagccagctgcagacg gctgaggttctccggctctttcag 273 65ºС HNF1B gaaagcaacgggagatcctccgac cctccactaaggcctccctctcttcc 279/201 65ºС FOXA1 ggcctactcctctgtccctgtcag gccgcagtcatgctgttcat 225 65ºС FOXA2 agccccaacaagatgctgacg gggtgcagggtccagaaggag 187 67ºС HNF6 caggggaccctctcggacct gggctttttgggtgtgttgcctc 195 65ºС OC2 atgccggtctcaggggactctc tgcatgctgccaggcgtaag 152 68ºС HNF4G ccgcaacagctgtgaagttg tcctccaaaccgatctgcac 204 65ºС AMY2A tggggagaaggttggggttt cagacccagtcattgccacaa 314 65ºС ELA2A tggctggagccctcagttgt gaccctccgcaggtgtggta 151 65ºС CDH1 cggaggagagcggtggtc ggcagggcggggaagata 213 65ºС CDH2 acccaggaaaggtggcaggt gcgggatgacccagtctct 163 65ºС CDKN1A gctgtccctcccccttgtct tgttccgctgctaatcaaaag 363 60ºС 55 3.3. ФЕРМЕНТЫ. 1) Ингибитор рибонуклеаз «RNasin Ribonuclease Inhibitor» (Promega, США). 2) Обратная транскриптаза «MMLV Reverse Transcriptase» (Promega, США). 3) Taq-полимераза (Силекс, Россия). 3.4. ПЛАЗМИДНЫЕ ВЕКТОРЫ. В работе использовали следующие плазмидные векторы: 1) Лентивирусные вектора для упаковки вирусных частиц pLP1, pLP2 и pCMV-VSVg (Invitrogen, США). 2) Лентивирусный вектор pLenti6/V5-D-TOPO, содержащий ген устойчивости к бластицидину (Invitrogen, США). 3) Экспрессирующие лентивирусные вектора рLenti-HNF4α1-FLAG и рLenti-HNF4α7FLAG, полученные при клонировании в вектор pLenti6/V5-D-TOPO (Invitrogen, США) кДНК HNF4α1-FLAG или HNF4α7-FLAG из плазмидных векторов рCMV-HNF4α1FLAG и рCMV-HNF4α7-FLAG, были получены и протестированы в лаборатории ранее (Д.А. Овчинников, Д.И. Флейшман, неопубликованные данные). Плазмиды рCMVHNF4α1-FLAG и рCMV-HNF4α7-FLAG, в которых под контролем промотора цитомегаловируса находятся кДНК изоформ HNF4α1 и HNF4α7 соответственно, несущие на С-конце пептидную метку FLAG (ранее было показано, что такая метка не влияет на биологические свойства HNF4α), были любезно предоставлены проф. S.A. Duncan. Все экспрессирующие вектора были ранее проверены секвенированием. 4) Лентивирусный вектор pLKO.1-Puro, содержащий ген устойчивости к пуромицину (Sigma, США). 5) Лентивирусный вектор pLKO.1-shGFP, экспрессирующий малую шпилечную РНК (мшРНК), комплементарную последовательности мРНК зеленого флюоресцентного белка GFP, и содержащий ген устойчивости к пуромицину (Sigma, США). 6) Лентивирусные вектора pLKO.1-shHNF4α-1-5, экспрессирующие 5 вариантов мшРНК, комплементарных различным участкам молекулы мРНК HNF4α, и содержащие ген устойчивости к пуромицину (Sigma, США). 56 3.5. КЛЕТОЧНЫЕ ЛИНИИ В работе использовали линии ПАКПЖ человека Panc1, MiaPaCa2, CaPan2 и AsPC1, полученные из Российской коллекции клеточных культур позвоночных НИИ Цитологии РАН. Линия Panc1 получена в 1975 году из ткани дедифференцированной ПАКПЖ мужчины 56 лет; линия MiaPaCa2 получена в 1975 году из ткани дедифференцированной ПАКПЖ мужчины 65 лет; линия CaPan2 получена в 1975 году из ткани высокодифференцированной ПАКПЖ мужчины 56 лет; линия AsPC1 получена в 1982 году из ксенографтов мышей, которым были привиты клетки из асцитной жидкости мужчины 62 лет, больного ПАКПЖ. Также в работе была использована линия пакующих клеток HEK293Т (Invitrogen, США), предназначенная для получения лентивирусов. Клетки культур Panc1, MiaPaCa2 и HEK293 культивировали в среде DMEM (SigmaAldrich, США), содержащей 10% фетальной телячьей сыворотки (Gibco), 300 мг/л глутамина (ПанЭко) и 10 мг/л антибиотика ципрофлоксацина. Клетки культур CaPan2 и AsPC1 культивировали в среде RPMI-1640 (Gibco, США), содержащей 10% фетальной телячьей сыворотки (Biological Industries, Израиль), 300 мг/л глутамина (ПанЭко, Россия) и 10 мг/л антибиотика ципрофлоксацина. Культивирование проводили в атмосфере 5% СО 2 при температуре 37°С. Приблизительно раз в 5-7 дней клетки обрабатывали трипсином и пересевали. Для проведения функциональных тестов клетки подсчитывали в процессе пересева. Суспензию пересеваемых клеток в среде инкубации смешивали с 0,4% раствором трипанового синего в 0,81% растворе NaCl в пропорции 1:1. 10 мкл смеси переносили в камеры-слайды для подсчета клеток (Bio-Rad Laboratories, США), после чего подсчитывали количество живых клеток с помощью автоматического счетчика «Bio-Rad TC10» (Bio-Rad Laboratories, США). 3.6. КЛИНИЧЕСКИЕ ОБРАЗЦЫ ТКАНИ Для исследования использовали клинические образцы ткани ПАКПЖ человека и прилежащей к опухоли неопухолевой ткани ПЖ тех же пациентов, а также образцы условно нормальной ткани ПЖ, полученные во время проведения гастропанкреатодуоденальных резекций пациентов с ПАКПЖ в отделении опухолей печени и поджелудочной железы ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН. Сразу после ГПДР взятые образцы замораживали в жидком азоте, после чего хранили их при -70°С. 57 3.7. НАРАЩИВАНИЕ И ВЫДЕЛЕНИЕ ПЛАЗМИД В работе использовали замороженные компетентные клетки E. сoli, приготовленные с помощью набора для создания компетентных клеток «Z-competent E.coli transformation kit» (Zymo Research). Использованный штамм E. coli X10 Gold обладает пониженной способностью к рекомбинации и лишен системы dam метилирования. Клетки размораживали на льду, добавляли к ним 5-15 нг плазмидной ДНК и оставляли на 40 минут на льду. Затем клетки рассевали на предварительно нагретые до +37° С чашки Петри с LB-агаром, содержащим ампицилин в концентрации 50 мг/мл, и инкубировали в течение ночи при +37° С. Бактериальные клоны отбирали и помещали в раствор LB с селективным антибиотиком на ночь. Из полученного раствора с бактериями выделяли плазмиды, а затем тестировали их с помощью рестрикционного анализа плазмидной ДНК. Клетки E. сoli, трансформированные определенными плазмидами, наращивали в течение ночи в 50 мл среды LB с добавлением ампициллина при +37° С и 180 об/мин. Ночную культуру бактерий центрифугировали при +4° С на скорости 3000 об/мин в течение 15 минут. Далее плазмиды выделяли с помощью системы «QIAGEN Plasmid Midi Kit» в соответствии с протоколом производителя, и осадок ДНК растворяли в 150-300 мкл теплой (65°С) деионизованной воды. Качество выделенных плазмид определяли по результату проведенного электрофореза в 1% агарозном геле. Концентрацию полученных плазмид определяли на спектрофотометре «NanoDrop 1000» (Thermo Scientific, США). 3.8. ЛЕНТИВИРУСНАЯ ИНФЕКЦИЯ КЛЕТОК ЛИНИЙ ПАКПЖ Инфекцию клеток линий Panc1, MiaPaCa2, CaPan2 и AsPC1 лентивирусными векторами проводили по следующей методике. Клетки HEK293Т рассевали в количестве 1х106 клеток на 6-ти сантиметровые чашки Петри и через 6 часов проводили трансфекцию клеток смесью из четырех плазмид, три из которых кодировали структурные и функциональные белки лентивируса (pLP1, pLP2, pVSVG). Четвертая плазмида кодировала изоформы HNF4α (вектора pLenti-HNF4α1-FLAG или pLenti-HNF4α7-FLAG), мшРНК HNF4α (вектора pLKO.1-shHNF4α-15) или использовалась для получения контрольных культур (вектора pLenti6/V5-D-TOPO, pLKO.1-Puro или pLKO.1-shGFP). Для контроля эффективности трансфекции клеток HEK293 и последующей инфекции клеток ПАКПЖ использовали лентивирусную плазмиду pLSL-GFP, кодирующую зеленый флюоресцентный белок. Трансфекцию осуществляли при помощи стандартного кальций-фосфатного метода [Chen and Okayama, 1988]. На второй день клеткам 58 HEK293T меняли среду инкубации и рассевали клетки ПАКПЖ, предназначенные для инфекции. На третий день собирали среду с чашек с клетками HEK293Т, содержащую лентивирусные частицы, фильтровали ее через фильтр с размером пор 0,45 мкм и вносили в чашки с клетками ПАКПЖ. Процедуру повторяли на четвертый день. Через 24 часа в культуральную среду добавляли антибиотик бластицидин (до концентрации 8 мкг/мл) или пуромицин (до концентрации 2 мкг/мл), в соответствии с геном устойчивости, кодируемым используемыми плазмидами, после чего проводили селекцию в течение 14 дней. В ходе селекции клетки линий ПАКПЖ, не подвергшиеся инфекции, погибали; после проведения селекции полученные клеточные культуры оценивали по уровню экспрессии HNF4α. Эффективность трансфекции клеток HEK293T и последующей инфекции культур ПАКПЖ оценивали по свечению зеленого флуоресцентного белка при длине волны 490 нм в инвертированном флюоресцентном микроскопе Axioplan 2 (Carl Zeiss, США). 3.9. ВЫДЕЛЕНИЕ СУММАРНОЙ КЛЕТОЧНОЙ РНК Для выделения РНК из культур клеток на чашках Петри удаляли ростовую среду, клетки переносили в пробирку и центрифугировали 5 минут при температуре 4°С и 4500 об/мин. Из полученного клеточного осадка получали образцы тотальной РНК при помощи набора для выделения РНК «RNeasy Plus Mini Kit» (QIAGEN, Германия). Далее РНК выделяли в соответствии с протоколом, предлагаемым производителем. РНК элюировали с колонки в 40 мкл воды, свободной от рибонуклеаз. Полученные препараты хранили при -70°С. Качество полученных препаратов РНК проверяли визуально при помощи электрофореза. Электрофорез РНК проводили на горизонтальных пластинах 1,0% агарозного геля, приготовленного на буфере TAE (10 мМ трис-HCl, pH 8,0, 1 мМ ЭДТА (Sigma-Aldrich, США)) с добавлением бромистого этидия. В электрофорез брали 1 мкл раствора РНК и 1 мкл краски (1 мМ ЭДТА, 0,25% бромфеноловый синий, 0,25% ксилен-цианол, 50% глицерин (Sigma-Aldrich, США) в H2O). Электрофорез РНК проводили в течение 3-5 минут в поле с напряженностью 2-5 В/см. Концентрацию РНК определяли по оптической плотности раствора, измеренной на спектрофотометре NanoDrop-1000 (Thermo Scientific, США) при длине волны 260 нм. Об отсутствии примесей в образце судили по соотношению значений оптической плотности раствора при длинах волн 230, 260 и 280 нм. 59 3.10. ОБРАТНАЯ ТРАНСКРИПЦИЯ Для проведения обратной транскрипции 12,25 мкл смеси, содержащей 2 мкг РНК и 0,1 мкг случайных гексамерных олигонуклеотидов, денатурировали при 72° С 10 мин и охлаждали на льду. Затем добавляли 7,75 мкл ОТ-смеси следующего состава: 4 мкл MMLV-буфера (Promega, США), 2 мкл смеси дезоксинуклеозид-трифосфатов (Силекс, Россия) по 2,5 мМ каждого, 1 мкл 2 мМ дитиотритола (Sigma, США), 50 ед. обратной транскриптазы MMLV (Promega, США) и 2,5 ед. ингибитора рибонуклеаз RNasin Ribonuclease Inhibitor (Promega, США). Реакцию проводили при 42° С в течение 60 мин, затем останавливали реакцию инактивацией обратной транскриптазы при 95°С в течение 10 минут, объем смеси доводили Н2О до 100 мкл и использовали аликвоты для проведения полимеразной цепной реакции со специфическими праймерами. 3.11. ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ Для проведения ПЦР использовали праймеры, последовательности которых и размеры получаемых продуктов приведены выше (Таблица 3, в направлении 5’-3’), и набор реактивов для проведения ПЦР (Силекс, Россия). Реакционная смесь объемом 25 мкл содержала: 5-10 мкл смеси после ОТ, 2,5 мкл 10х буфера для проведения ПЦР с Taq-полимеразой, 2 нг/мкл каждого праймера, 1,25 ед. Taqполимеразы, 0,05 мМ каждого дезоксинуклозид-трифосфата, деионизированную воду. Выравнивание количества взятой в ОТ-ПЦР РНК производили по реакции со специфическими праймерами к гену PPIA (пептидил-пролил-изомеразы А). ПЦР проводили в амплификаторе «Biometra T3 Thermocycler» (Biometra, Германия). Минерального масла не использовали, устанавливали температуру нагрева крышки пробирок с ПЦР-смесью равной 100°С. В работе были использованы следующие температурные параметры: 1) 95° С – 5 мин. – первичная полная денатурация. 2) N циклов: 95° С – 50 сек – денатурация; Т(отжиг) – 50 сек – отжиг праймеров (см. Таблицу 3); 72° С – 50 сек – элонгация; 3) 72° С – 10 мин – полное достраивание продукта; 4) 4° С – хранение. Температура отжига праймеров была подобрана для достижения наибольшей эффективности ПЦР (Таблица 3). Количество циклов реакции подбирали так, чтобы 60 зависимость количества ПЦР-продуктов от времени была логарифмической, поэтому ПЦРанализ можно считать полуколичественным. Продукты ПЦР анализировали с помощью электрофореза. Электрофорез ДНК проводили на горизонтальных пластинах 2,0% агарозного геля, приготовленного на буфере TAE (10 мМ трис-HCl, pH 8,0, 1 мМ ЭДТА (Sigma-Aldrich, США)) с добавлением бромистого этидия. В электрофорез брали 3 мкл раствора ДНК и 1 мкл красителя. Электрофорез ДНК проводили в течение 3-5 минут в поле с напряженностью 2-5 В/см. Для обработки результатов использовали систему для видеодокументации гелей «UVP Doc-It LS Image Analysis Software» (UVP, Германия). 3.12. КОЛИЧЕСТВЕННАЯ ПОЛИМЕРАЗНАЯ ЦЕПНАЯ РЕАКЦИЯ С ДЕТЕКЦИЕЙ В РЕАЛЬНОМ ВРЕМЕНИ Для проведения ПЦР использовали набор реактивов для проведения ПЦР-РВ в присутствии красителя SYBR Green I (Синтол, Россия). Использовали те же праймеры, что и для полуколичественного ПЦР, последовательности которых и размеры получаемых продуктов приведены выше (Таблица 3, в направлении 5’-3’). Реакционная смесь объемом 25 мкл содержала: смесь после ОТ из расчета 20 нг исходной РНК на одну пробу, 2,5 мкл 10х Taq-буфера с красителем SYBR Green I, 10 пкмоль каждого праймера, 1,5 ед. Taq-полимеразы, 0,25 мМ каждого дезоксинуклотид-трифосфата, 2,5 мМ MgCl2, деионизированную воду. ПЦР проводили в амплификаторе «Bio-Rad IQ5» (Bio-Rad Laboratories, США). Детекцию и обработку результатов производили с помощью программного пакета «Bio-Rad IQ5 Software» (Bio-Rad Laboratories, США). Минерального масла не использовали, устанавливали температуру нагрева крышки пробирок с ПЦР-смесью равной 100°С. В работе были использованы следующие температурные параметры: 1) 95° С – 5 мин. – первичная полная денатурация. 2) 45 циклов: 95° С – 50 сек – денатурация; Т(отжиг) – 50 сек – отжиг праймеров (см. Таблицу 3); 72° С – 50 сек – элонгация; 86° С – 20 сек – детекция сигнала SYBR Green I; 3) 72° С – 10 мин – полное достраивание продукта; 4) 60-95° С – повышение температцры на 1° С каждые 10 сек – построеине кривой плавления ДНК в ПЦР-смеси; 5) 4° С – хранение. 61 Температура отжига праймеров была подобрана для достижения наибольшей эффективности ПЦР (Таблица 3). Пороговые значения для количественного анализа подбирали так, чтобы реакция находилась в логарифмической фазе. Специфичность реакции проверяли, анализируя кривую плавления продуктов в ПЦР-смеси после реакции. 3.13. БЕЛКОВЫЙ ДСН-ЭЛЕКТРОФОРЕЗ В ПААГ Для проведения белкового электрофореза получали клеточные лизаты исследуемых культур. Для этого из чашек Петри с клетками удаляли ростовую среду, клетки переносили в пробирку и центрифугировали 5 минут при температуре 4°С и 4500 об/мин. Полученный осадок лизировали в 60 мкл лизис-буфера RIPA (Roche, Швейцария) 15 минут при комнатной температуре, лизат дважды центрифугировали при 13400 об/мин в течение 15 минут. Супернатант хранили при -20° С. Концентрацию белка в лизатах определяли по методу Брэдфорд. К 999 мкл реактива Брэдфорд добавляли 1 мкл лизата, тщательно перемешивали раствор и измеряли оптическую плотность на спектрофотометре «Beckman DU 530» при длине волны 595 нм. В качестве пробы, не содержащей белка, использовали пробу с добавлением 1 мкл лизис-буфера RIPA. Электрофорез белков в полиакриламидном геле проводили в приборе системы «BioRad’s Modular Mini Electrophoresis System» (Bio-Rad Laboratories, США). Приготовление геля для электрофореза осуществляли следующим образом: между закрепленными стеклами заливали разделяющий полиакриламидный гель (концентрация мономеров акриламида 10%). Сверху для выравнивания поверхности геля наслаивали этанол и оставляли на 10-20 мин до окончания полимеризации. После того как разделяющий гель заполимеризовался, промывали поверхность 0,5М трис-HCl (pH 6,8) и заливали сверху концентрирующий гель (концентрация мономеров АА 5%). Вставляли гребенку и оставляли гель до окончания полимеризации. В лунки заполимеризовавшегося геля наносили пробы белка. Каждая проба объемом 5 мкл содержала равные объемы красителя для белкового SDS-электрофореза (Bio-Rad Laboratories, США) и клеточного лизата (количество белка определяли по методу Брэдфорд и выравнивали добавлением к пробе соответствующего количества лизис-буфера RIPA). Электрофорез проводили в трис-глициновом буфере (25 мМ Трис-ацетат, 192 мМ глицин, 0,1% SDS, рН 8.3) в течение 50 мин в поле с напряженностью около 20 В/см. 62 3.14. ЭЛЕКТРОПЕРЕНОС БЕЛКОВ ИЗ ПААГ НА PVDF-МЕМБРАНУ Белки, разделенные в ПААГ после электрофореза, для последующего иммуноблоттинга переносили на PVDF-мембрану. Для этого мембрану Immobilon-P (Merck Millipore, США) активировали метанолом 10 сек, затем тщательно промывали в буфере для переноса (25 мМ трис-ацетат, 192 мМ глицин, рН 8,3). В кассету для переноса помещали мембрану и гель, зажатые между фильтровальной бумагой и губками. Перенос осуществляли в камере «Bio-Rad’s Modular Mini Electrophoresis System» (Bio-Rad Laboratories, США), заполненной буфером для переноса, в течение 1 часа в поле с напряженностью 25 В/см. После переноса мембрану высушивали. 3.15. ИММУНОБЛОТТИНГ Для проведения иммуноблоттинга с антителами, специфичными к какому-либо белку, мембрану активировали метанолом (10 сек), а затем промывали PBS с добавлением 0,1% Tween (PBST). Для блокирования неспецифических сайтов связывания активированную мембрану инкубировали в течение 1 часа на орбитальной качалке при комнатной температуре и 120 об/мин в 5% растворе обезжиренного сухого молока, разведенного на PBST. Затем промывали мембрану в PBST 3 раза по 5 мин. Далее мембрану инкубировали с антителами мыши к белку, на который велось окрашивание (разведение антител на 5% молоке 1:5000 для GAPDH, 1:4000 для HNF4αTOT, 1:2000 для HNF4αP1 и 1:700 для HNF4αP2) в течение 1,5 ч при комнатной температуре на орбитальной качалке при 120 об/мин. Объем раствора антител брали из расчета 4 мл на 1 см 2 мембраны. По окончании инкубации мембрану промывали в PBST 3 раза по 5 мин. Добавляли вторые антитела, специфичные к первым (моноклональные антитела козы к γ-глобулину мыши), коньюгированные с пероксидазой хрена. Разведение вторых антител в 5% молоке составляло 1:3000. Мембрану инкубировали со вторыми антителами 1 час при комнатной температуре на орбитальной качалке при 120 об/мин. По окончании инкубации промывали мембрану в PBST 3-4 раза по 5 мин. Для оценки связывания антител с белком использовали систему детекции «Immobilon Western Chemiluminescent HRP Substrate» (Merck Millipore, США). Согласно инструкции производителя смешивали детектирующие растворы А и В в соотношении 1:1 из расчета 400 мкл смеси на см2 мембраны (1 мл на мембрану). Смесь наносили на мембрану, с которой был удален избыток жидкости. Мембрану инкубировали 5 мин при комнатной температуре. Затем 63 удаляли избыток раствора с поверхности мембраны и детектировали интенсивность сигнала, полученного при расщеплении субстрата пероксидазы хрена, на приборе Chemycapt 3000 (Vilber-Lourmat, Германия) при помощи программы Chemycapt 3000. 3.16. ФИКСАЦИЯ КЛЕТОК Клетки фиксировали либо метанолом (для окраски на HNF4αTOT), либо смесью метанола и ацетона 1:1 (для окраски на E-кадгерин). Из чашек удаляли ростовую среду и промывали клетки теплым раствором PBS в течение 5 минут. Отбирали PBS, заливали чашки холодным (-20°С) метанолом или смесью метанола и ацетона и инкубировали их при -20°С в течение 20 минут. После этого промывали клетки теплым PBS 10 минут, после чего хранили клетки при +4ºС до 24 часов. 3.17. ИММУНОФЛЮОРЕСЦЕНТНАЯ ОКРАСКА КЛЕТОК НА HNF4αTOT И E-КАДХЕРИН Клетки, зафиксированные метанолом на чашке Петри, промывали теплым PBS в течение 10 минут. Под микроскопом маркировали на чашке область окраски с плотностью клеток 6070%. Отбирали из чашек PBS, при помощи фильтровальной бумаги удаляли клетки, находящиеся вне области окраски. Клетки в области окраски инкубировали в растворе антител к HNF4αTOT или E-кадхерину (разведение антител к HNF4αTOT 1:200, к E-кадхерину 1:50 на PBS) в течение 50 минут при комнатной температуре. Промывали клетки PBS в течение 10 минут, после чего инкубировали область окраски в растворе антител, специфичных к первичным антителам (антитела козы к γ-глобулинам мыши, разведение 1:200 на PBS с 3% BSA) и конъюгированных с флюоресцентной меткой (Alexa 488), в течение 40 минут в темноте. Промывали клетки PBS 10 минут, после чего инкубировали их в PBS, содержащем 3мкМ DAPI (Sigma, США) в течение 15 минут. Промывали клетки PBS 20 минут, после чего отбирали PBS фильтровальной бумагой. На область окраски наносили 15-20 мкл эльванола и накрывали сухим покровным стеклом, обезжиренным в спирте. Заключенные таким образом клетки инкубировали в темноте при комнатной температуре в течение ночи, после чего хранили при +4°С. Для детектирования окрашенных клеток использовали флуоресцентный микроскоп Axioplan 2 (Carl Zeiss, США). Рабочее увеличение объектива составляло 100х. Для документации результатов применялась система Axio Vision 4.0 (Carl Zeiss, США). 64 3.18. ОПРЕДЕЛЕНИЕ ИНТЕНСИВНОСТИ СИНТЕЗА ДНК Клетки, находящиеся в логарифмической фазе роста (1-2 дня после пересева), инкубировали при +37°С в атмосфере 5% СО2 2 часа в среде, содержащей 10 мМ 5бромдезоксиуридина (5-BrdU). Отбирали среду с 5-BrdU, промывали клетки теплым PBS в течение 5 минут, фиксировали метанолом. Инкубировали клетки в 1%-м растворе Triton X-100 на PBS 3 минуты при +20°С, промывали теплым PBS в течение 10 минут. После этого инкубировали клетки в 4 Н растворе HCl 10 минут, отмывали PBS 5 минут и выдерживали в течение ночи при +4°С После фиксации под микроскопом маркировали на чашке область окраски с плотностью клеток 60-70%. Отбирали из чашек PBS, при помощи фильтровальной бумаги удаляли клетки, находящиеся вне области окраски. Блокировали неспецифические места связывания антител 3%-м раствором BSA, покрывая им область окраски на 30 минут при комнатной температуре. Отбирали раствор BSA фильтровальной бумагой и инкубировали клетки в области окраски в растворе антител к 5-BrdU, на который производилось окрашивание (разведение антител к 5BrdU 1:100 на PBS с 3% BSA), в течение 30 минут при комнатной температуре. Промывали клетки PBS в течение 10 минут, после чего инкубировали область окраски в растворе антител, специфичных к первичным антителам (антитела козы к γ-глобулинам мыши, разведение 1:200 на PBS с 3% BSA) и конъюгированных с флюоресцентной меткой (Alexa 488), в течение 40 минут в темноте. Промывали клетки PBS 10 минут, после чего отбирали PBS фильтровальной бумагой. На область окраски наносили 15-20 мкл эльванола и накрывали сухим покровным стеклом, обезжиренным в спирте. Заключенные таким образом клетки инкубировали в темноте при комнатной температуре в течение ночи, после чего хранили при +4°С. Для детектирования окрашенных клеток использовали флуоресцентный микроскоп Axioplan 2 (Carl Zeiss, США). Рабочее увеличение объектива составляло 20х или 40х. Для документации результатов применялась система Axio Vision 4.0 (Carl Zeiss, США). 3.19. КЛОНОГЕННЫЙ ТЕСТ Клетки обрабатывали трипсином и суспендировали в среде инкубации, после чего подсчитывали количество клеток в 1 мл суспензии. В чашки со средой вносили по 1000 клеток (культуры Panc1, MiaPaCa2, AsPC1) или 2000 клеток (культуры CaPan2), после чего культивировали чашки 14 суток (культуры Panc1, MiaPaCa2, CaPan2) или 21 сутки (культуры AsPC1). Образовавшиеся колонии фиксировали метанолом и окрашивали кристаллическим 65 фиолетовым в течение 30-40 минут, после чего отмывали краситель дистиллированной H2O до исчезновения окраски фона. Для документации и анализа результатов использовали пакет программ «Total Lab 2.01» 3.20. ИЗМЕРЕНИЕ КИНЕТИКИ РОСТА КЛЕТОЧНЫХ КУЛЬТУР in vitro Клетки обрабатывали трипсином и суспендировали в среде инкубации, после чего подсчитывали количество клеток в 1 мл суспензии. В лунки 96-луночного планшета высевали по 1000 клеток (культуры Panc1, MiaPaCa2, AsPC1) или 2000 клеток (культуры CaPan2), инкубировали планшеты при +37°С в атмосфере 5% СО2 в течение 3 часов (период адгезии клеток на поверхности планшета), 24, 48, 72 и 96 часов. Количество клеток в лунках планшета оценивали с помощью набора для определения клеточной пролиферации «CyQUANT NF Cell Proliferation Assay Kit» (Invitrogen, США) согласно протоколу, предлагаемому изготовителем. Интенсивность флюоресценции определяли с помощью планшетного считывателя «SpectraMax M5e» (Molecular Devices, США). Для возбуждения флюоресценции использовали свет с длиной волны 495 нм, регистрировали излучение с длиной волны 535 нм. Для определения количества клеток использовали калибровочный график зависимости интенсивности флюоресценции от количества клеток в лунке, который является линейным на промежутке 100-20000 клеток в пробе. Результаты, полученные после 3 часов инкубации, принимали за исходное количество клеток в лунке и использовали для нормировки дальнейших результатов и подсчета относительного прироста клеток. 3.21. МИГРАЦИОННЫЙ ТЕСТ Клетки обрабатывали трипсином и суспендировали в среде, не содержащей сыворотку, после чего подсчитывали количество клеток в 1 мл суспензии. В верхнее отделение модифицированной камеры Бойдена для 24-луночных планшетов «BD Falcon Cell Culture Insert» (BD Biosciences, США) с размером пор 8,0 мкм вносили по 10000 клеток (культуры Panc1, MiaPaCa2, AsPC1) или 20000 клеток (культуры CaPan2) в 300 мкл среды, не содержащей сыворотку. В нижнее отделение камеры вносили 500 мкл среды с 5%-й сывороткой в качестве хемоаттрактанта. Инкубировали планшет с камерами при +37° С в атмосфере 5% СО2 16 часов. Для подсчета количества мигрировавших сквозь мембрану камеры клеток извлекали камеру из планшета и промывали PBS. Удаляли клетки из верхнего отделения камеры при помощи ватной палочки, смоченной в среде с сывороткой. После этого помещали нижнюю поверхность мембраны в 0,1%-й раствор кристаллического фиолетового на 10-15 минут, 66 отмывали краситель H2O до исчезновения окраски фона. При помощи микроскопа подсчитывали количество клеток на нижней поверхности мембраны. 3.22. СТАТИСТИЧЕСКАЯ ОБРАБОТКА ДАННЫХ При проведении всех экспериментов производили не менее трех независимых повторов. Данные, полученные в нескольких независимых экспериментах, обрабатывали в программном пакете «Microsoft Office Excel 2003» (Microsoft Corporation, США) и Origin Pro 9.0 (OriginLab Corporation, США). Для определения ошибки определения величин находили стандартное отклонение от среднего значения обрабатываемой величины. Достоверность отличий проверяли с помощью t-теста Стьюдента (скорость роста, клоногенный тест), U-теста Манна-Уитни (тест на синтез ДНК, миграционный тест) и парного t-теста Стьюдента для связанных выборок (ПЦРРВ). Достоверными считали изменения, для которых показатель p<0,05. 67 4. РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ На основании данных, изложенных в обзоре литературы, мы сделали предположение, что нарушения экспрессии транскрипционного фактора HNF4α могут быть важным механизмом прогрессии ПАКПЖ. Чтобы проверить эту гипотезу, мы использовали в качестве модельной системы клеточные культуры ПАКПЖ человека, в которых с помощью лентивирусной трансдукции искусственно изменяли уровни синтеза фактора HNF4α. Обнаруженные в экспериментах in vitro закономерности экспрессии тканеспецифических генов были проверены на панели клинических образцов ткани ПАКПЖ человека. 4.1. ВЫБОР МОДЕЛЬНОЙ СИСТЕМЫ ДЛЯ ИССЛЕДОВАНИЯ РОЛИ ИЗМЕНЕНИЯ ЭКСПРЕССИИ HNF4α В КЛЕТКАХ ПАКПЖ Фактор HNF4α является важным регулятором дифференцировочного статуса клеток печени и ряда других органов. Его различные изоформы обладают разными трансактивирующими свойствами; для каждой ткани в норме характерен определенный спектр экспрессии изоформ HNF4α (Раздел 5.5.3). Для того, чтобы наиболее полно исследовать роль изменений экспрессии HNF4α в клетках ПАКПЖ, мы выбрали модельную систему из 4 клеточных линий ПАКПЖ человека, отличающихся как уровнем дифференцировки, так и спектрами экспрессии изоформ HNF4α: CaPan2, AsPC1, Panc1 и MiaPaCa2. Внешний вид исследованных клеток и образуемых ими E-кадхериновых контактов приведен на Рисунке 11, а уровни экспрессии изоформ HNF4α и других тканеспецифических генов – на Рисунке 12. Клетки линии Capan2 получены из высокодифференцированной ПАКПЖ и обладают наибольшей степенью дифференцировки из выбранных культур; для них характерна эпителиальная морфология, формирование монослойных островков с ярко выраженными Eкадхериновыми контактами, наблюдается экспрессия цитокератинов-7, -8, -17 и -18 [Интернетбаза данных ATCC; Kyriazis et al., 1986]. Как и в нормальной ткани ПЖ, в клетках Capan2 экспрессируются изоформы группы HNF4αP2, при этом экспрессия HNF4αP1 не детектируется. Культура AsPC1 была получена из асцита больного раком ПЖ и характеризуется пониженной степенью дифференцировки по сравнению с Capan2. Клетки AsPC1 имеют фибробластоподобную форму и почти не образуют адгезионных контактов. По сравнению с нормальной панкреатической тканью, в них гиперэкспрессированы обе группы изоформ HNF4α: как характерная HNF4αP2, так и нехарактерная HNF4αP1. В кетках AsPC1 наблюдается гиперэкспрессия ряда панкреа-специфических генов, в частности – регуляторов 68 дифференцировки ПЖ, поэтому клеткам AsPC1 приписывают умеренный уровень дифференцировки [Интернет-база данных ATCC; Чесноков и соавт., 2012]. Клетки линии Panc1 обладают низким уровнем дифференцировки, для них характерна неправильная форма, пониженная экспрессия цитокератинов и повышенная – виментина [Neureiter et al., 2005]. Они образуют радиальные E-кадхериновые межклеточные контакты, нехарактерные для эпителиальных клеток, которые чаще наблюдаются в клетках на стадии ЭМП. По сравнению с нормальной тканью ПЖ в клетках Panc1 полностью подавлена экспрессия всех изоформ HNF4α. Линия MiaPaCa2 характеризуется крайне низкой степенью дифференцировки, склонностью к образованию многослойных агрегатов при росте in vitro, значительным снижением экспрессии тканеспецифических белков и резким повышением экспрессии виментина [Neureiter et al., 2005]. Эти клетки имеют фибробластоподобную форму и не образуют выраженных адгезионных контактов. Экспрессии HNF4α в них не детектируется. 69 A Б Рисунок 11. Клетки линий ПАКПЖ CaPan2, AsPC1, Panc1 и MiaPaCa2. Окраска гематоксилин-эозином (А) и антителами к E-кадхерину (Б). Закономерности экспрессии изоформ HNF4α в рассмотренных клеточных линиях аналогичны наблюдаемым в клетках высоко- и низкодифференцированных гепатокарцином: на ранних стадиях прогрессии наблюдается активация экспрессии нехарактерной для данной ткани группы изоформ HNF4α, на более поздних стадиях экспрессия HNF4α полностью подавлена. Таким образом, описанная панель из четырех клеточных линий ПАКПЖ человека с различной степенью дифференцировки представляет собой удобную и представительную экспериментальную систему для исследования роли изменений экспрессии HNF4α в прогрессии этого типа опухолей. 70 4.2. ВЫБОР ИССЛЕДУЕМЫХ ТКАНЕСПЕЦИФИЧЕСКИХ ГЕНОВ, СВЯЗАННЫХ С УРОВНЕМ ДИФФЕРЕНЦИРОВКИ И ФУНКЦИЯМИ ПОДЖЕЛУДОЧНОЙ ЖЕЛЕЗЫ Чтобы оценить, как уровни экспрессии изоформ HNF4α соотносятся с дифференцировочным статусом клеток ПАКПЖ, мы определили уровни экспрессии ряда панкреа-специфических генов в исследуемых клетках методом полуколичественного ОТ-ПЦР. Из клеток выбранных культур и образца условно нормальной ткани ПЖ выделяли образцы тотальной РНК, из которых с помощью обратной транскрипции получали образцы кДНК. Для проведения ПЦР использовали специфические праймеры к панкреатическим генам и различным участкам гена HNF4α. Детекцию полученных ПЦР-продуктов производили с помощью ДНК-электрофореза в агарозном геле. Чтобы дифференциально определить уровни экспрессии различных изоформ и групп изоформ HNF4α были использованы пары праймеров, фланкирующие вариабельные участки гена HNF4A (Рисунок 10). Характерные длины образующихся ПЦР-продуктов соответствуют различным изоформам HNF4α, которые содержатся в исследуемых образцах. Праймеры HNF4ATOT соответствуют консервативному участку гена и позволяют определить суммарный уровень экспрессии всех изоформ. Праймеры HNF4AP1 были использованы для определения суммарной экспрессии изоформ группы P1; они фланкируют участок экзона 1, содержащего вставку, характерную для изоформ HNF4α4-α6 (90 п. н.), поэтому уровни экспрессии этих изоформ можно определить отдельно от изоформ HNF4α1-α3 по содержанию в пробе ПЦРпродуктов большего размера. Аналогично, праймеры HNF4AP2 позволяют определить экспрессию как HNF4α7-α9, так и HNF4α10-α12 изоформ, содержащих вставку длиной 222 п. н. Праймеры HNF4A2 использовали для определения уровней экспрессии изоформ, содержащих вставку длиной 30 п. н. в 9 экзоне (HNF4α2, α5, α8 и α11) и не содержащих ее (HNF4α1, α4, α7 и α10). Праймеры HNF4A3 комплементарны альтернативной последовательности 8 экзона, содержащейся только в изоформах HNF4α3, α6, α9 и α12. Таким образом, используя комбинации рассмотренных праймеров, можно определить уровни экспрессии отдельных изоформ HNF4α; например, детекция ПЦР-продуктов HNF4A2 длиной только 163 п. н. в клетках, экспрессирующих только изоформы группы HNF4αP2, позволяет говорить об экспрессии изоформ HNF4α8 и α11, но не HNF4α7 и α10. Расположение праймеров на последовательности мРНК HNF4α и длины ПЦР-продуктов подробно описаны в Разделе 6.2. Общий дифференцировочный статус клеток определяется уровнями экспрессии целых блоков транскрипционных факторов. Для оценки уровня дифференцировки клеток ПАКПЖ мы выбрали гены, кодирующие важнейшие регуляторы дифференцировки ПЖ, подробно 71 описанные в Разделе 2.4. Параллельно мы исследовали уровни экспрессии генов, кодирующих основные секретируемые белки ПЖ - α-амилазу-2a и эластазу-2a, а также E-кадхерин (CDH1) и N-кадхерин (CDH2), экспрессия которых отражает выраженность эпителиальных свойств клеток. Помимо этого, нами была проанализирована экспрессия гена CDKN1A, так как регуляция его экспрессии считается наиболее вероятным механизмом антипролиферативного действия HNF4α. Таким образом, нами было выбрано три блока генов, уровни экспрессии которых были проанализированы в исследуемых образцах. Изоформы и группы изоформ HNF4α: HNF4ATOT, HNF4AP1, HNF4P2, HNF4A2, HNF4A3. Регуляторы дифференцировки клеток ПЖ: PDX1, PTF1A, HNF1A, HNF1B, FOXA1, FOXA2, HNF6, OC2. Функциональные панкреатические гены: AMY2A, ELA2A, CDH1, CDH2, CDKN1A. Для контроля количества кДНК, взятой в ПЦР, в исследуемых образцах дополнительно определяли уровень экспрессии гена циклофилина А (пептидил-пролил изомераза А, PPIA). 72 4.3. ХАРАКТЕРИСТИКА ЭКСПРЕССИИ ГЕНОВ В КУЛЬТУРАХ КЛЕТОК ПАКПЖ С РАЗЛИЧНЫМ УРОВНЕМ ДИФФЕРЕНЦИРОВКИ В качестве предварительного этапа исследований мы подробно охарактеризовали спектры экспрессии выбранных генов в образцах клеточных линий ПАКПЖ Panc1, MiaPaCa2, AsPC1 и CaPan2, а также в образце условно нормальной панкреатической ткани пациента без опухолей ПЖ. Это позволило уточнить дифференцировочный статус клеток и оценить исходный уровень экспрессии генов, относительно которого мы определяли изменения, вызванные гиперэкспрессией или подавлением HNF4α. Результаты ОТ-ПЦР анализа приведены на Рисунке 12. Рисунок 12. Уровни экспрессии групп изоформ HNF4α и панкреа-специфических генов в клетках культур Panc1, MiaPaCa2, CaPan2, AsPC1 и образце условно нормальной ткани ПЖ (УН ПЖ). Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия образцов, справа – длины ПЦР-продуктов в п. н. 73 В культуре CaPan2 экспрессируется большая часть генов, характерных для нормальной ткани ПЖ, что соответствует высокому уровню дифференцировки этих клеток. В то же время уровни экспрессии почти всех этих генов (за исключением HNF1B, FOXA2 и CDH1) значительно понижены по сравнению c образцом нормальной ткани, что свидетельствует о начальных этапах дедифференцировки клеток CaPan2 по сравнению с нормальной тканью. Особенно важно отсутствие экспрессии фактора HNF6, играющего критическую роль в развитии протоковых клеток. По всей видимости, подавление активности гена HNF6 является очень ранним событием в развитии ПАКПЖ и может наблюдаться даже в высокодифференцированных опухолях. Культура CaPan2 - единственная из исследованных культур ПАКПЖ, в которой сохраняется чрезвычайно слабая экспрессия α-амилазы-2a и эластазы-2a, что также говорит о более высоком уровне ее дифференцировки. Умереннодифференцированные клетки AsPC1 характеризуются еще более низкими уровнями экспрессии таких регуляторов развития ПЖ, как PDX1, PTF1α, HNF1β, FOXA2 и HNF6, а также значительным подавлением экспрессии E-кадхерина. Низкий уровень экспрессии E-кадхерина согласуется с отсутствием в культуре AsPC1 выраженных межклеточных контактов. Относительно высокая экспрессия гена HNF1A, по всей видимости, может объясняться гиперэкспрессией фактора HNF4α, особенно изоформ группы HNF4αP1, которые напрямую активируют ген HNF1A. В то же время высокие уровни экспрессии факторов FOXA1 и OC-2 сложно объяснить без дополнительных исследований. В культурах низкодифференцированных клеток Panc1 и MiaPaCa2 полностью подавлена экспрессия большей части панкреа-специфических ТФ (HNF4α, HNF1α, HNF1β, PDX1, PTF1α, HNF6) и значительно снижена экспрессия факторов семейства FOXA. Клетки Panc1 характеризуются повышением экспрессии N-кадхерина, что часто происходит при ЭМП; в то время как в клетках MiaPaCa2 экспрессия Е- и N-кадхеринов полностью подавлена. Кроме того, в клетках MiaPaCa2 подавлена экспрессия гена CDKN1A, кодирующего белок p21CIP1/WAF1. Таким образом, экспрессия панкреа-специфических ТФ и функциональных генов ПЖ коррелирует с уровнем дифференцировки клеток ПАКПЖ. При этом экспрессия HNF4α и основных регуляторов дифференцировки ПЖ (PDX1, PTF1α, HNF1α, FOXA2) имеют общие закономерности: их экспрессия сохраняется в высоко- и умереннодифференцированных клетках и значительно подавляется в низкодифференцированных. Следующие этапы исследования были направлены на исследование возможного влияния изменения экспрессии HNF4α на дифференцировочный статус и опухолевый фенотип клеток ПАКПЖ. 74 4.4. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ЭКЗОГЕННОЙ ЭКСПРЕССИИ HNF4α НА ЗЛОКАЧЕСТВЕННЫЙ ПОТЕНЦИАЛ КУЛЬТУР НИЗКОДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК ПАКПЖ PANC1 И MIAPACA2 В качестве первого этапа проверки гипотезы о противоопухолевой функции HNF4α в протоковых клетках ПЖ мы исследовали влияние экзогенной экспрессии различных изоформ HNF4α в дедифференцированных клетках ПАКПЖ человека линий Panc1 и MiaPaCa2, для которых характерно отсутствие экспрессии эндогенных изоформ HNF4α. 4.4.1. Получение клеточных культур Panc1 и MiaPaCa2, экзогенно экспрессирующих изоформы HNF4α1 и HNF4α7 Клетки линий Panc1 и MiaPaCa2 заражали лентивирусными частицами, несущими вектора pLenti-HNF4α1-FLAG или pLenti-HNF4α7-FLAG, кодирующие ген устойчивости к бластицидину и варианты нуклеотидных последовательностей изоформ HNF4α1 и HNF4α7, не содержащие интронов и не подверженные сплайсингу, или вектор pLenti-V5, несущий только ген устойчивости. После заражения вирусными частицами и последующей селекции в среде с бластицидином были получены культуры этих клеток, экзогенно экспрессирующие изоформы HNF4α1 и HNF4α7 (Panc1-HNF4α1, Panc1-HNF4α7, MiaPaCa2-HNF4α1 и MiaPaCa2-HNF4α7, соответственно). В качестве контрольных культур использовали клетки Panc1 и MiaPaCa2, не экспрессирующие изоформы HNF4α, далее они обозначены как Panc1-ref и MiaPaCa2-ref. В нормальных панкреатических клетках активно экспрессируются изоформы группы HNF4αP2, в то время как уровень экспрессии HNF4αP1 очень низок [Huang et al., 2008]. Однако изоформы группы HNF4αP1 экспрессируются в процессе эмбрионального развития ПЖ, а их активация в умереннодифференцированных клетках ПАКПЖ позволяет предположить, что индукция нехарактерных для ПЖ изоформ HNF4α является одним из этапов прогрессии ПАКПЖ. 4.4.2. Определение уровней экспрессии изоформ и групп изоформ HNF4α в клетках Panc1-HNF4α и MiaPaCa2-HNF4α Первым этапом исследования клеток культур Panc1-HNF4α и MiaPaCa2-HNF4a стало определение уровней экспрессии в них изоформ и групп изоформ HNF4α с помощью полуколичественного ОТ-ПЦР анализа. Полученные результаты приведены на Рисунке 13. 75 A Б Рисунок 13. ОТ-ПЦР анализ экспрессии изоформ HNF4α в клетках HNF4αэкспрессирующих и контрольных культур Panc1 (А) и MiaPaCa2 (Б). Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. Как видно из рисунка, в культурах Panc1-HNF4α1, Panc1-HNF4α7, MiaPaCa2-HNF4α1 и MiaPaCa2-HNF4α7 наблюдается значительно более высокий уровень экспрессии HNF4αTOT, чем в контрольных культурах Panc1-ref и MiaPaCa2-ref, что позволяет использовать полученные культуры для дальнейших исследований. Результаты исследования спектров экспрессии изоформ HNF4α в перечисленных клеточных культурах,описаны ниже сначала для клеток, экзогенно экспрессирующих HNF4α1, а потом – HNF4α7. HNF4α1. Ни в клетках Panc1, ни в клетках MiaPaCa2 экзогенная экспрессия изоформы HNF4α1 не вызывает индукцию экспрессии эндогенных изоформ HNF4αP2. Активация промотора P2 при экзогенной экспрессии HNF4α1 описана в клетках культуры гепатоцеллюлярной карциномы H33 [Lazarevich et al., 2004]. С другой стороны, описана возможность подавления экспрессии изоформ HNF4αP2 под действием факторов группы HNF4αP1, которое осуществляется посредством прямого связывания с регуляторным участком в промоторе P2 [Briancon et al., 2004]. При использовании праймеров HNF4A2 и HNF4A3 выявлена экспрессия изоформ HNF4α1 и α2 в клетках Panc1-HNF4α1 и изоформ HNF4α1, α2 и α3 в клетках MiaPaCa2-HNF4α. Поскольку в клетки был введен вектор, кодирующий изоформу HNF4α1, причиной появления изоформ HNF4α2 и HNF4α3 могла стать только активация экспрессии с промотора P1 эндогенной последовательности HNF4α. Эти данные свидетельствуют о том, что собственный 76 ген HNF4A и промотор P1 в геноме клеток Panc1 и MiaPaCa2 не повреждены и могут быть реактивированы. Экспрессии изоформ HNF4α4-α6 (ПЦР-продукт с праймером HNF4АP1 длиной 229 п. н.) выявлено не было. Кроме того, в клетках Panc1 не наблюдалось HNF4α1зависимой активации экспрессии изоформы HNF4α3. Возможно, это указывает на отличия механизмов сплайсинга мРНК HNF4α в клетках Panc1 и MiaPaCa2. Таким образом, изменения, наблюдаемые в клетках Panc1-HNF4α1 и MiaPaCa2-HNF4α1 по сравнению с контрольными культурами, вызваны только активацией факторов группы HNF4αP1. HNF4α7. Клетки линий Panc1 и MiaPaCa2, экзогенно экспрессирующие HNF4α7, не экспрессируют эндогенных изоформ группы HNF4αP1. Этот результат согласуется с литературными данными, указывающими на отсутствие сайтов связывания HNF4α в промоторе P1 [Hatzis and Talianidis, 2004]. Наблюдаемое соотношение уровней экспрессии групп изоформ HNF4α (высокая экспрессия HNF4αP2 и низкая или отсутствующая – HNF4αP1) характерно для нормальных клеток ПЖ [Tanaka et al., 2006]. При анализе результатов ПЦР с праймерами HNF4A2 и HNF4A3 была выявлена HNF4α7зависимая активация экспрессии изоформ HNF4α8 в клетках Panc1 и MiaPaCa2 и HNF4α9 в клетках MiaPaCa2. Как и в клетках Panc1-HNF4α1 и MiaPaCa2-HNF4α1, этот результат указывает на активацию эндогенного промотора P2 и свидетельствует об отсутствии нарушений структуры гена HNF4A. Аналогично культуре Panc1-HNF4α1, в клетках Panc1HNF4α7 не происходит активации экспрессии изоформы HNF4α9, наблюдающейся в нормальных β-клетках [Hansen et al., 2002] и культуре MiaPaCa2-HNF4α7. Экспрессии изоформ HNF4α10-α12 (продукт ПЦР с праймером HNF4АP2 длиной 387 п. н), описанных в клетках инсулиномы [Huang et al., 2009], ни в одной из культур выявлено не было. Таким образом, изменения, наблюдаемые в клетках Panc1-HNF4α7 и MiaPaCa2-HNF4α7 по сравнению с контрольными культурами, вызваны только активацией факторов группы HNF4αP2. Реактивация эндогенного гена HNF4A при экзогенной экспрессии HNF4α в клетках Panc1 и MiaPaCa2 указывает на то, что механизмы репрессии гена HNF4α в этих линиях, вероятно, похожи и могут оказаться универсальными для клеток ПАКПЖ. Подавление транскрипции изоформ группы HNF4αP2 в дедифференцированных опухолевых клетках ПЖ носит обратимый характер и вызвана, по всей видимости, не генетическими нарушениями, а эпигенетическими факторами (метилирование промоторов, нарушения функций других тканеспецифических ТФ). Активация экспрессии эндогенных изоформ HNF4α под действием экзогенного HNF4α указывает на существование ауторегуляторных путей, контролирующих экспрессию HNF4a в клетках ПЖ. Важно отметить, что экзогенные изоформы HNF4α1 и HNF4α7 активируют 77 экспрессию только со «своих» промоторов. В литературе описано связывание HNF4α1 в промоторе P1, которое приводит к негативной регуляции активности гена в гепатоцитах [Magenheim et al., 2005]. В промоторной области P2 описан сайт связывания HNF4α, по всей видимости, определяющий HNF4α1-зависимое подавление экспрессии HNF4αP2 [Briancon et al., 2004; Odom et al., 2004]. Наиболее вероятной представляется гипотеза о непрямой индукции транскрипции HNF4α посредством HNF4α-зависимой активации генов, кодирующих факторы HNF1α, HNF1β или HNF6, экспрессия которых характерна для клеток ПЖ, а сайты связывания находятся в промоторах P1, P2 и энхансере гена HNF4α [Bailly et al., 2001; Thomas et al., 2001; Kyrmizi et al., 2006]. Однако все эти факторы способны активировать экспрессию как HNF4αP1, так и HNF4αP2, поэтому изоформ-специфическая индукция экспрессии в исследованных культурах может быть связана с активностью дополнительных регуляторных путей. Например, изоформы HNF4αP1 обладают способностью подавлять экспрессию изоформ HNF4αP2, что может объяснять их отсутствие в клетках Panc1-HNF4α1 и MiaPaCa2-HNF4α1 [Briancon et al., 2004]. 4.4.3. Определение уровней синтеза белка HNF4α в клетках Panc1-HNF4α и MiaPaCa2-HNF4α Анализ уровней синтеза HNF4α в исследованных клеточных культурах проводили с помощью методов иммуноблоттинга и иммунофлюоресценции со специфическими антителами HNF4aTOT к общему для всех изоформ участку молекулы HNF4α. Уровни синтеза отдельных групп изоформ HNF4α на данном этапе не определяли, так как их экспрессия уже анализировалась методом ОТ-ПЦР. Результаты иммуноблоттинга представлены на Рисунке 14. Для контроля количества белка, внесенного в каждую пробу, мембраны окрашивали антителами к глицеральдегид-фосфат-дегидрогеназе (GAPDH). A Б Рисунок 14. Уровни синтеза белка HNF4α в клетках HNF4α-экспрессирующих и контрольных культур Panc1 (А) и MiaPaCa2 (Б). Уровни синтеза белка GAPDH использовали для контроля общего количества белка, нанесенного на дорожки. 78 Как видно из представленного рисунка, в образцах белка клеток Panc1-HNF4α и MiaPaCa2-HNF4α уровни HNF4α значительно повышены по сравнению с образцами контрольных культур. Представленное на Рисунке 15 иммунофлюоресцентное окрашивание клеток антителами HNF4αTOT демонстрирует гетерогенность клеток полученных культур по содержанию HNF4α в клеточных ядрах, однако доля HNF4α-меченых клеток в культурах Panc1HNF4α и MiaPaCa2-HNF4α значительно выше, чем в контрольных культурах. A Б Рисунок 15. Иммунофлюоресцентное окрашивание клеток HNF4α-экспрессирующих и контрольных культур Panc1 (А) и MiaPaCa2 (Б) моноклональными антителами HNF4αTOT к HNF4α. Ядра клеток окрашены DAPI. 4.4.4. Изменения экспрессии тканеспецифических транскрипционных факторов в клетках Panc1-HNF4α и MiaPaCa2-HNF4α Изменения активности ключевых регуляторов клеточной дифференцировки всегда сопровождаются значительными изменениями уровней экспрессии целых блоков генов, задействованных в регуляции многих клеточных систем. Чтобы выяснить, какие регуляторные системы могут быть связаны с влиянием HNF4α на дифференцировку клеток ПЖ, мы исследовали уровни экспрессии ряда наиболее важных панкреа-специфических ТФ методом полуколичественного ОТ-ПЦР. Результаты исследований приведены на Рисунке 16. 79 Б A Рисунок 16. ОТ-ПЦР анализ экспрессии тканеспецифических регуляторов дифференцировки в клетках HNF4α-экспрессирующих и контрольных культур Panc1 (А) и MiaPaCa2 (Б). Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. Экзогенная экспрессия как HNF4α1, так и HNF4α7 в клетках Panc1 и MiaPaCa2 сопровождается повышением уровней экспрессии генов PDX1 и PTF1A по сравнению с контрольными культурами. Степень активации транскрипции PDX1 не зависит от уровня синтеза HNF4α и от того, какая группа изоформ HNF4α экспрессируется в клетках. Ген PTF1A значительно сильнее активируется в клетках MiaPaCa2-HNF4α7, чем в MiaPaCa2-HNF4α1, хотя уровни синтеза суммарного HNF4α в них очень близки (Рисунок 14). Да не, навряд ли. В конце концов, α3 – активатор, а в MiaPaCa2-α1 его больше. А если дело в том, что остальных изоформ меньше – то Панкам это не мешало наблюдается. В клетках Panc1-HNF4α подобных различий не 80 Активация экспрессии факторов семейства HNF1 в клетках Panc1-HNF4α и MiaPaCa2HNF4α, напротив, носит изоформ-специфический характер. Так, ген HNF1A активируется только в HNF4αP2-экспрессирующих культурах Panc1 и MiaPaCa2. Экспрессия HNF1B выявляется только в клетках Panc1-HNF4α1; под действием HNF4αP2 активации этого гена в клетках Panc1 не происходит. В клетках MiaPaCa2 HNF4α-зависимой индукции экспрессии HNF1B также не происходит. Экспрессия генов семейства FOXA в клетках Panc1 и MiaPaCa2 под действием экзогенного HNF4α также усиливается. При этом активация гена FOXA1 происходит только в HNF4αP2-экспрессирующих клетках, в то время как экспрессия гена FOXA2 индуцируется в равной степени обеими группами изоформ HNF4α. Фактор HNF6, играющий критическую роль в дифференцировке протоковых клеток, не экспрессируется в дедифференцированных культурах клеток Panc1 и MiaPaCa2. Экзогенной экспрессии изоформ HNF4α1 и HNF4α7 недостаточно для восстановления активности гена HNF6. В то же время в клетках Panc1-HNF4α и MiaPaCa2-HNF4α наблюдается активация транскрипции его гена-паралога OC2, выполняющего в клетках ПЖ вспомогательную роль. Значимых HNF4α-зависимых изменений экспрессии фактора HNF4γ в исследуемых культурах выявлено не было: в клетках Panc1-HNF4α уровни экспрессии HNF4G слабо отличаются от наблюдаемого в контрольной культуре Panc1-ref, а в клетках MiaPaCa2, изначально не экспрессирующих HNF4γ, его HNF4α-зависимой индукции не происходит. Таким образом, в результате ОТ-ПЦР анализа выявлен целый блок тканеспецифических ТФ, транскрипция которых индуцируется в дедифференцированных культурах ПАКПЖ Panc1 и MiaPaCa2 при экзогенной экспрессии HNF4α. Все эти факторы являются регуляторами дифференцировки различных типов клеток ПЖ. Экспрессия PDX1, PTF1α, FOXA1 и FOXA2, HNF1α, OC-2 характерна для эндокринных и экзокринных дифференцированных панкреатических клеток, в то время как HNF1β наиболее активно экспрессируется в частично дифференцированных клетках-предшественниках ПЖ. Низкодифференцированные клетки Panc1 и MiaPaCa2 отличаются от нормальной ткани ПЖ значительно сниженным уровнем экспрессии всех вышеперечисленных генов (Рисунок 12). Таким образом, описанная HNF4αзависимая индукция экспрессии целого блока регуляторов развития ПЖ в клетках Panc1 и MiaPaCa2 указывает на их частичную редифференцировку. Этот результат является серьезным аргументом в пользу гипотезы об опухоле-супрессорной функции HNF4α в протоковых клетках ПЖ. Важно отметить, что в культурах Panc1-HNF4α и MiaPaCa2-HNF4α выявляется одновременная экспрессия факторов PDX1 и PTF1α. Коэкспрессия этих регуляторов 81 транскрипции характерна для эмбриональных панкреатических клеток на стадии частичной дифференцировки [Zhou et al., 2007]. Таким образом, клетки Panc1-HNF4α и MiaPaCa2-HNF4α по своим свойствам могут оказаться близки к панкреатическим клеткам-предшественникам. Это предположение подтверждается как минимум двумя наблюдениями: 1) Клетки Panc1 и MiaPaCa2, как и все клетки ПАКПЖ, происходят из протоковых клеток ПЖ; в ряде исследований показано, что клетки, выстилающие протоки ПЖ, способны к контролируемой частичной дедифференцировке и редифференцировке в другие типы клеток ПЖ, то есть являются своеобразным пулом мультипотентных панкреатических клеток [BonnerWeir and Sharma, 2002; Grapin-Botton, 2005]. При повреждениях ПЖ регенерация происходит за счет протоковых клеток (и в меньшей степени клеток островков), которые начинают активно делиться и мигрировать в место повреждения [Bonner-Weir et al., 1993; Kim and Hebrok, 2001]. В процессе регенерации эндокринной или экзокринной части ПЖ в протоковых клетках повышается экспрессия PDX1 и PTF1α, соответственно, и понижается экспрессия HNF6 – маркера протоковых клеток [Li et al., 2010; Criscimanna et al., 2011]. Описанный спектр экспрессии генов близок к наблюдаемому в культурах Panc1-HNF4α и MiaPaCa2-HNF4α. 2) Индукция экспрессии PDX1 и PTF1α вызывается экзогенной экспрессией обеих изоформ HNF4α. Однако выраженная экспрессия HNF4αP1 наблюдается в панкреатических клетках только во время их эмбрионального развития и снижается после окончательной дифференцировки [Tanaka et al., 2006; Harries et al., 2008; Huang et al., 2008]. Таким образом, в клетках Panc1-HNF4α1 и MiaPaCa2-HNF4α1 могут активироваться HNF4α-зависимые сигнальные пути, характерные именно для частично дифференцированных клеток ПЖ, которые и приводят к индукции PDX1 и PTF1α. Из всех исследованных тканеспецифических ТФ PDX1, PTF1α, FOXA2 и OC-2 проявляют общую тенденцию: их экспрессия в клетках Panc1 и MiaPaCa2 может с близкой эффективностью индуцироваться обеими группами изоформ HNF4αP1 и HNF4αP2. Только для PTF1α наблюдаются различия в HNF4α1- и HNF4α7-зависимой индукции его экспрессии в клетках MiaPaCa2-HNF4α; в то же время в клетках Panc1-HNF4α подобных различий не выявлено. Группы изоформ HNF4αP1 и HNF4αP2 обладают разными транс-активационными свойствами, поэтому логично было бы предположить, что они будут дифференциально активировать экспрессию различных блоков генов, характерных для эмбрионального (HNF4αP1) или взрослого (HNF4αP2) состояния ПЖ, как это показано для гепатоцитов [TorresPadilla et al., 2002]. Однако полученные результаты показывают, что важнейшие регуляторы дифференцировки панкреатических клеток (PDX1, PTF1α, FOXA2) могут быть индуцированы обеими группами изоформ HNF4α. Возможно, в клетках ПЖ множества генов-мишеней 82 HNF4αP1 и HNF4αP2 перекрываются значительно сильнее, чем в гепатоцитах, благодаря чему в эмбриональный период развития ПЖ изоформы групп P1 и P2 действуют скоординировано, а не взаимоисключающе. Эта гипотеза подтверждается исследованием эффектов экзогенной экспрессии изоформ HNF4α2 и HNF4α8 в клетках инсулиномы крысы INS-1, в котором показано, что изоформы группы HNF4αP1 регулируют уровни экспрессии приблизительно вдвое большего количества генов, чем HNF4αP2. При этом 70% HNF4αP2-индуцируемых генов также являются и HNF4αP1-индуцируемыми [Erdmann et al., 2007]. Другим возможным объяснением наблюдаемого отсутствия различий может быть то, что эти факторы способны регулировать уровни экспрессии друг друга: для PTF1α характерна ауторегуляция, ген PDX1 контролируется факторами FOXA2, PTF1α, HNF6 (возможно, что близкую роль играет его гомолог OC-2) и самим PDX1, в промоторе FOXA2 обнаружены сайты связывания факторов семейства ONECUT [Jacquemin et al., 1999; Gerrish et al., 2000; Jacquemin et al., 2003; Kyrmizi et al., 2006; Wiebe et al., 2007; Gao et al., 2008; Masui et al., 2008]. Возможно, экзогенная экспрессия HNF4α играет роль пускового стимула для включения комплексной системы панкреа-специфических ТФ, обеспечивающих поддержание частично дифференцированного статуса клеток. В отличие от описанного выше блока генов, индукция HNF1A, HNF1B и FOXA1 зависит от того, какие группы изоформ HNF4α экспрессировались в клетках Panc1 и MiaPaCa2. Так, активация генов HNF1A и FOXA1 индуцируетется только изоформами группы HNF4αP2. Это наблюдение хорошо соотносится с тем фактом, что экспрессия факторов HNF1α и FOXA1, как и HNF4αP2, характерна для клеток нормальной взрослой ПЖ [De Simone et al., 1991; Gao et al., 2008; Gao et al., 2010]. При этом ген HNF1A является прямой транскрипционной мишенью HNF4α [Tian and Schibler, 1991]. Как правило, экспрессия HNF1α активируется изоформами группы HNF4αP1 (например, в гепатоцитах), поэтому HNF4α7-зависимая активация этого гена в клетках ПАКПЖ может указывать на более сложную схему его регуляции в панкреатических клетках. Тот факт, что экспрессия FOXA1 индуцируется только в клетках Panc1-HNF4α7, говорит о том, что регуляция активности гена FOXA1 может осуществляться независимо от изменений экспрессии факторов PDX1, PTF1α, FOXA2 и OC-2 и, возможно, указывает на наличие прямой HNF4α-зависимой регуляции гена FOXA1 (аналогично гену HNF1A). В то же время экспрессия HNF1β, характерная для клеток ПЖ на ранних этапах дифференцировки, активируется в культуре Panc1-HNF4α1. HNF4α1 экспрессируется в эмбриональной ПЖ, однако его участие в дифференцировке клеток этого органа исследовано недостаточно [Harries et al., 2008]. Возможно, выявленная нами HNF4αP1-индуцированная активация гена HNF1B вносит вклад в регуляцию процессов раннего развития ПЖ. 83 HNF6 является одним из важнейших маркеров протоковых клеток ПЖ [Pierreux et al., 2006]. Его экспрессия подавлена в обеих исследованных низкодифференцированных линиях ПАКПЖ. Несмотря на то, что в промоторе гена HNF6 находится сайт связывания HNF4α [Kyrmizi et al., 2006], экзогенная экспрессия HNF4α в клетках Panc1 и MiaPaCa2 недостаточна для его активации, но вызывает индукцию транскрипции его паралога OC2. Важное значение HNF6 в дифференцировке именно протоковых клеток позволяет сделать предположение о важной роли его инактивации в развитии ПАКПЖ. Так как HNF6 не экспрессируется ни в одной из исследуемых линий (даже в высокодифференцированной CaPan2, Рисунок 12), с большой вероятностью его подавление является ранним событием в канцерогенезе протоковых клеток ПЖ. Таким образом, экзогенная экспрессия изоформ HNF4α в клетках Panc1 и MiaPaCa2 вызывает активацию экспрессии ряда важных панкреа-специфических регуляторов транскрипции. Этот эффект указывает на частичную редифференцировку этих клеток и свидетельствует о возможности частичной реверсии их злокачественного фенотипа при восстановлении функции HNF4α. 4.4.5. Изменения экспрессии функциональных панкреатических генов в клетках Panc1-HNF4α и MiaPaCa2-HNF4α Дифференцированные клетки любой ткани организма обладают характерным спектром экспрессии тканеспецифических генов, отвечающих за выполнение функций этой ткани и поддержание ее архитектуры. Для того, чтобы полнее исследовать влияние изменений экспрессии HNF4α на активность функциональных панкреатических генов, мы исследовали уровни экспрессии α-амилазы-2a и эластазы-2a, E- и N-кадхеринов и гена CDKN1A, кодирующего важный регулятор клеточной пролиферации p21. Результаты исследования представлены на Рисунке 17. 84 A Б Рисунок 17. ОТ-ПЦР анализ экспрессии функциональных генов в клетках HNF4αэкспрессирующих и контрольных культур Panc1 (А) и MiaPaCa2 (б). Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. В клетках Panc1-HNF4α7, MiaPaCa2-HNF4α1 и MiaPaca2-HNF4α7 наблюдается повышение экспрессии гена AMY2A по сравнению с контрольными культурами. В то же время в клетках Panc1-HNF4α1 активации этого гена не происходит. HNF4α-зависимой индукции экспрессии эластазы-2a в клетках Panc1 и MiaPaCa2 выявлено не было. Экзогенная экспрессия изоформ HNF4α в клетках Panc1 не вызывает существенных изменений уровней экспрессии E-кадхерина. В то же время уровень экспрессии N-кадхерина в клетках Panc1-HNF4α7 по сравнению с контрольной культурой повышается; в клетках Panc1HNF4α1 таких изменений не наблюдается. Экспрессия E- и N-кадхеринов в клетках MiaPaCa2 полностью подавлена; HNF4α-зависимой активации экспрессии генов CDH1 и CDH2 не происходит. Экспрессия гена CDKN1A в клетках Panc1 под действием экзогенного HNF4α снижается, однако выраженность этого снижения не очень высока. В отличие от клеток Panc1, в обеих HNF4α-экспрессирующих культурах MiaPaCa2 наблюдается значительная индукция экспрессии гена CDKN1A, которая не зависит от того, какая группа изоформ HNF4α экспрессируется в исследуемых клетках. 85 HNF4α-зависимая индукция экспрессии панкреатической α-амилазы-2a в клетках Panc1HNF4α7 и MiaPaCa2-HNF4α свидетельствует о том, что под действием экзогенного HNF4α дедифференцированные клетки ПАКПЖ могут редифференцироваться. Однако отсутствие экспрессии эластазы-2a во всех исследованных культурах указывает на их неполную редифференцировку. Активация гена AMY2A в клетках ПЖ может быть опосредована действием факторов FOXA2 и PTF1α, экспрессия которых наблюдается в клетках Panc1-HNF4α и MiaPaCa2-HNF4α и может стимулировать редифференцировку этих клеток по экзокринному пути [Cockell et al., 1995]. Однако одновременно с PTF1α в этих культурах экспрессируется фактор PDX1, что характерно для панкреатических клеток-предшественников. Возможно, что экспрессия эластазы-2a активируется на поздних стадиях дифференцировки ациноцитов и не характерна для частично дифференцированных клеток. В то же время предположение об активации гена AMY2A факторами FOXA2 и PTF1α не может объяснить отсутствие его экспрессии в культуре Panc1-HNF4α1. Следует заметить, что в клетках Panc1-HNF4α1 экспрессируется фактор HNF1β, свойственный эмбриональным панкреатическим клеткам, в то время как активная экспрессия α-амилазы-2a является признаком достаточно высокого уровня дифференцировки клеток ПЖ. По всей видимости, уровень дифференцировки клеток Panc1HNF4α1 ниже, чем Panc1-HNF4α7, что подтверждается отсутствием в них индукции экспрессии факторов FOXA1 и HNF1α. Следует, однако, отметить, что активная экспрессия HNF1β в высокодифференцированных клетках CaPan2 не препятствует экспрессии гена AMY2A (Рисунок 12). Таким образом, регуляция экспрессии α-амилазы-2a в протоковых клетках ПЖ требует дальнейших исследований. Уровни экспрессии E- и N-кадхеринов в клетках Panc1 близки к характерным для нормальной ткани ПЖ, несмотря на низкий уровень их дифференцировки (Рисунок 12). Однако E-кадхериновые контакты в клетках Panc1 имеют структуру, отличную от контактов нормальных эпителиальных клеток (Рисунок 11Б). Такие адгезионные контакты в большей степени характерны для подвижных клеток, находящихся на стадии ЭМП. В культуре Panc1HNF4α7 наблюдается повышение экспрессии N-кадхерина, которое в некоторых случаях может происходить при ЭМП [Maeda et al., 2005]. Однако изменения экспрессии E-кадхерина под действием экзогенной экспрессии HNF4α не происходит; мы также не наблюдали видимых изменений морфологии в HNF4α-экспрессирующих клетках Panc1. Отсутствие экспрессии кадхеринов в клетках MiaPaCa2 характерно для низкодифференцированных опухолевых клеток, фенотип которых близок к мезенхимальному. HNF4α-зависимой активации генов CDH1 и CDH2 в них не наблюдается. Таким образом, в исследованных линиях HNF4α оказывает незначительное влияние на экспрессию генов CDH1 и CDH2 в низкодифференцированных клетках ПАКПЖ и, по всей видимости, слабо влияет на их эпителиальные свойства. 86 Изменения экспрессии белка p21CIP1/WAF1 могут оказывать значительное влияние на скорость пролиферации, подвижность, апоптоз и ряд других клеточных характеристик [Besson et al., 2004; Romanov et al., 2011; Warfel and El-Deiry, 2013]. Индукция экспрессии p21CIP1/WAF1 в клетках MiaPaCa2-HNF4α позволяет ожидать изменения пролиферативной и миграционной активности этих клеток. В литературе описано повышение экспрессии p21 CIP1/WAF1 при гиперэкспрессии HNF4α1 или α2 в клетках почки HEK293 и эмбриональной мышиной карциномы F9, сопровождающееся замедлением их пролиферации; изоформа HNF4α1 способна напрямую активировать промотор гена CDKN1A [Chiba et al., 2005; Grigo et al., 2008; HwangVerslues and Sladek, 2008]. Влияние изоформ группы HNF4αP2 на экспрессию p21CIP1/WAF1 на сегодняшний день не исследовано, HNF4αP2-зависимая индукция активности этого гена описана нами впервые. С другой стороны, в клетках Panc1-HNF4α индукции экспрессии p21CIP1/WAF1 не происходит. Возможно, в клетках Panc1 нарушены регуляторные пути, определяющие HNF4α-зависимую активацию гена CDKN1A, а наблюдаемые изменения его экспрессии вызваны другими механизмами. Таким образом, экзогенная экспрессия изоформ HNF4α в дедифференцированных клетках ПАКПЖ приводит к их частичной редифференцировке и индукции экспрессии целого блока важных панкреа-специфических генов. Этот результат свидетельствует о том, что HNF4α занимает одно из важных мест в системе регуляции транскрипции генов, контролирующих развитие и функции панкреатических клеток. Такое положение HNF4α делает его многообещающим объектом исследований, направленных на установление механизмов развития опухолей ПЖ. Изменение активности ключевых факторов дифференцировки клеток затрагивает большое количество внутриклеточных регуляторных путей и оказывает значительное влияние на их биологические характеристики. Анализ изменений этих характеристик позволяет оценить опухолесупрессорное или пропухолевое действие исследуемых факторов. Следующая часть работы посвящена исследованию изменений биологических характеристик клеток Panc1 и MiaPaCa2 под действием экзогенных изоформ HNF4α. 4.4.6. Влияние экзогенной экспрессии HNF4α на биологические характеристики клеток Panc1 и MiaPaCa2 Опухолевая трансформация клеток сопряжена с характерными изменениями их биологических свойств. Прежде всего, это нарушение контроля клеточного цикла, которое выражается в усилении пролиферативной активности и скорости роста клеточных культур. Другим важным изменением, характерным для опухолевых клеток, является независимость от окружения, в частности, от контактов с другими клетками и матриксом. Благодаря этому у 87 опухолевых клеток значительно повышены способности к миграции и образованию очагов пролиферации из отдельных клеток (клонов). С помощью тестов, проводимых с клеточными культурами в условиях in vitro, можно оценить их пролиферативный, колониеобразующий и миграционный потенциал. Чтобы определить возможное влияние экзогенной экспрессии изоформ HNF4α на выраженность злокачественного фенотипа клеток Panc1 и MiaPaCa2, мы исследовали характеристики клеточных культур Panc1-HNF4α, MiaPaCa2-HNF4α и контрольных линий Panc1-ref и MiaPaCa2-ref. 4.4.6.1. Определение скорости роста клеточных культур Panc1-HNF4α и MiaPaCa2-HNF4α Неконтролируемое повышение пролиферативной активности является наиболее характерным признаком опухолевых клеток. Высокая частота делений опухолевых клеток сопряжена с нарушениями функций белков-регуляторов клеточного цикла (например, циклинзависимых киназ) или компонентов путей активации этих белков. Как правило, экзогенная экспрессия опухолевых супрессоров в неопластических клеточных культурах вызывает снижение скорости пролиферации этих клеток и увеличение доли клеток, подверженных апоптозу. Для того чтобы выявить возможное влияние экзогенной экспрессии HNF4α в клеточных культурах ПАКПЖ на скорость их роста, мы исследовали кинетику роста этих культур in vitro с помощью набора «CyQUANT NF Cell Proliferation Assay Kit» (Invitrogen, США). Флуоресцентный краситель CyQUANT связывается с высокополимерной ДНК в эквимолярном соотношении; по интенсивности флюоресценции можно определить количество геномной ДНК в пробе, которое пропорционально количеству клеток в лунке. Подробно методика проведения теста описана в Разделе 3.20. На Рисунке 18 приведены результаты определения относительного прироста клеток HNF4α-экспрессирующих и контрольных культур Panc1 и MiaPaCa2. A Относительное кол-во клеток 88 13 Panc1-ref Panc1-HNF4α1 Panc1-HNF4α7 11 9 7 5 3 1 0 1 2 3 4 5 Б Относительное кол-во клеток Время культивации, сут. 15 MiaPaCa2-ref MiaPaCa2-HNF4α1 MiaPaCa2-HNF4α7 13 11 *** *** 9 7 *** 5 *** 3 1 0 1 2 3 4 5 Время культивации, сут. Рисунок 18. Кинетика роста HNF4α-экспрессирующих культур Panc1 (А) и MiaPaCa2 (Б) и соответствующих контрольных культур. Данные нормированы относительно начального количества клеток. - p<0,001 (t-тест Стьюдента). Отличий кинетики пролиферации культур Panc1-HNF4α1 и Panc1-HNF4α7 от контрольной линии выявлено не было. В то же время экзогенная экспрессия обеих изоформ HNF4α в клетках MiaPaCa2 сопровождалась достоверным снижением скорости роста HNF4αэкспрессирующих культур по сравнению с контрольной линией. Значимых различий между влиянием, оказываемым на скорость роста клеток MiaPaCa2 изоформами HNF4α1 и HNF4α7, не наблюдалось. 89 Ранее антипролиферативное действие HNF4α было описано в клетках печени, почки, кишечника и эмбриональной карциномы [Cattin et al., 2003; Lazarevich et al., 2004; Chiba et al., 2005; Grigo et al., 2008; Hwang-Verslues and Sladek, 2008]. Опубликованы данные о снижении пролиферативной активности клеток инсулиномы крысы INS-1 при гиперэкспрессии в них изоформ HNF4α2 и HNF4α8 [Erdmann et al., 2007]. HNF4α-зависимое снижение скорости роста клеток ПАКПЖ описано нами впервые и свидетельствует об ослаблении злокачественного потенциала клеток MiaPaCa2-HNF4α. 4.4.6.2. Исследование интенсивности синтеза ДНК в клетках Panc1-HNF4α и MiaPaCa2HNF4α Кинетика роста клеточных культур определяется соотношением их пролиферативной активности и частоты их апоптотической гибели. Для оценки пролиферативного потенциала клеток Panc1 и MiaPaCa2 при экспрессии в них изоформ HNF4α мы исследовали интенсивность синтеза ДНК в клетках культур Panc1-HNF4α, MiaPaCa2-HNF4α и соответствующих контрольных культур. Для этого клетки инкубировали в среде, содержащей 5-BrdU, который способен включаться в синтезируемую ДНК вместо дезокситимидина в активно пролиферирующих клетках, находящихся в S-фазе клеточного цикла. Клетки фиксировали и окрашивали моноклональными антителами к 5-BrdU, несущими флюоресцентную метку, после чего подсчитывали долю окрашенных клеточных ядер. Активный синтез ДНК характерен для часто делящихся клеток, поэтому описанный подход позволяет оценить вклад пролиферативной активности в кинетику роста клеточных культур. На Рисунке 19 показана доля клеток исследуемых культур Panc1 и MiaPaCa2, ядра которых интенсивно синтезируют ДНК и активно включают в нее 5-BrdU. A Доля клеток, меченых 5-BrdU 90 0,60 0,50 0,42 * 0,46 0,44 0,40 0,30 0,20 0,10 0,00 Б Доля клеток, меченых 5-BrdU Panc1-ref 0,50 Panc1-HNF4α1 Panc1-HNF4α7 0,40 0,41 0,41 MiaPaCa2-ref MiaPaCa2HNF4α1 MiaPaCa2HNF4α7 0,40 0,30 0,20 0,10 0,00 Рисунок 19. Включение 5-BrdU в ДНК клеток HNF4α-синтезирующих и контрольных культур Panc1 (A) и MiaPaCa2 (Б). - p<0,05 (U-тест Манна-Уитни). Нами не было выявлено значительных изменений доли 5-BrdU-меченых клеток в клетках Panc1-HNF4α и MiaPaCa2-HNF4α по сравнению с контрольными культурами. Небольшое, статистически достоверное повышение доли активно пролиферирующих клеток наблюдается только в культуре Panc1-HNF4α1 по сравнению с линией Panc1-ref; тем не менее, наблюдаемое повышение пролиферативного потенциала недостаточно велико, чтобы оказывать значительный эффект на скорость роста этой культуры (Раздел 4.4.6.1.). Скорость роста клеточных культур регулируется несколькими клеточными сигнальными путями. Одним из наиболее важных регуляторов клеточного цикла и апоптоза является белок p21CIP1/WAF1, повышение экспрессии которого ассоциировано с остановкой клеточного цикла из- 91 за ингибирования циклин-зависимых киназ [Luo et al., 1995; Chen et al., 1996]. Как и в случае многих других опухолевых супрессоров, экспрессия p21CIP1/WAF1 часто подавляется в ходе прогрессии опухолевых клеток. Связь антипролиферативного действия HNF4α с активацией экспрессии гена CDKN1A уже описывалась в ряде работ [Cattin et al., 2009; Chiba et al., 2005; Hwang-Verslues and Sladek, 2008]. В клетках Panc1 мы не обнаружили HNF4α-зависимой индукции экспрессии p21CIP1/WAF1, что согласуется с отсутствием значительных изменений интенсивности синтеза ДНК и скорости роста этих культур. Скорость роста культур MiaPaCa2-HNF4α понижена по сравнению с культурой MiaPaCa2-ref, но при этом не происходит изменений доли клеток, активно синтезирующих ДНК. Следовательно, арест клеточного цикла в клетках MiaPaCa2-HNF4α должен наступать уже после прохождения S-фазы (в фазе G2 или во время митоза) и, таким образом, не затрагивать ДНК-синтетические процессы. Это предположение не согласуется с выявленной нами HNF4α-зависимой индукцией экспрессии p21CIP1/WAF1 в клетках MiaPaCa2. Канонический путь регуляции пролиферации клеток с помощью p21CIP1/WAF1 происходит через ингибирование циклин-зависимых киназ, что останавливает клеточный цикл на стадии G 1 и приводит к ослаблению синтеза ДНК. Возможно, в клетках MiaPaCa2 регуляция пролиферации определяется процессами, не зависящими от экспрессии p21CIP1/WAF1, либо действие этого белка осуществляется по другим, менее исследованным сигнальным путям. Второй возможный путь ослабления скорости роста исследуемых культур MiaPaCa2 – увеличение частоты апоптоза в клетках MiaPaCa2-HNF4α по сравнению с контрольной культурой, однако возможное влияние HNF4α на процессы клеточной смерти в данной работе не исследовалось. 4.4.6.3. Снижение колониеобразующей способности клеток Panc1 и MiaPaCa2 при экзогенной экспрессии HNF4α Наиболее опасным проявлением злокачественного фенотипа опухоли является приобретение способности к метастазированию, то есть образованию удаленных очагов опухолевого роста. Для метастазирования клетки должны обладать повышенной подвижностью, устойчивостью к аноикису (например, при перемещении в просвете кровеносных сосудов), способностью прикрепляться к субстрату и образовывать очаги пролиферации. Одним из тестов, используемых для определения перечисленных свойств клеток in vitro, является клоногенный тест. Определение колониеобразующей способности клеточных культур проводили, высевая исследуемые клетки на чашки Петри в условиях высокого разведения (1000 клеток на чашку диаметром 3 см для культур Panc1 и MiaPaCa2), после чего культивировали их в течение 14 суток и подсчитывали количество сформированных колоний. 92 Типичный вид чашек, полученных в результате колониеобразующего теста, приведен на Рисунке 20. Рисунок 20. Типичные результаты, полученные при проведении клоногенных тестов с HNF4α-экспрессирующими и контрольными культурами Panc1 (А) и MiaPaca2 (Б). Разведение – 1000 клеток/чашка. Сверху указаны клеточные культуры, снизу – количество колоний на представленной чашке. Результаты, полученные в трех независимо проведенных экспериментах с каждой клеточной потенциала линией, свидетельствуют HNF4α-экспрессирующих о достоверном клеток Panc1 соответствующими контрольными клетками (Рисунок 21). понижении и MiaPaCa2 колониеобразующего по сравнению с A Количество колоний на чашке 93 220 200 180 160 140 120 100 80 60 40 20 0 167,3 * 118,0 Количество колоний на чашке Panc1-ref Б * 112,7 Panc1-HNF4α1 Panc1-HNF4α7 *** *** 32,5 39,3 MiaPaCa2HNF4α1 MiaPaCa2HNF4α7 120 89,1 100 80 60 40 20 0 MiaPaCa2-ref Рисунок 21. Среднее количество колоний, формируемых клетками HNF4αсинтезирующих и контрольных культур Panc1 (А) и MiaPaCa2 (Б). - p<0,05, - p<0,001 (t-тест Стьюдента). Ослабление колониеобразующего потенциала клеток Panc1 и MiaPaCa2 при экзогенной экспрессии в них HNF4α не зависит от того, какая группа изоформ HNF4α экспрессируется в исследуемых культурах. Ранее (Раздел 4.4.4) мы уже показывали, что как изоформы HNF4αP1, так и HNF4αP2 могут с близкой эффективностью активировать экспрессию генов PDX1, PTF1A, FOXA2 и OC2. Возможно, HNF4α-зависимая регуляция колониеобразующей способности опосредуется этим блоком ТФ Влияние, оказываемое HNF4α на клоногенную способность клеток MiaPaCa2, выражено значительно сильнее, чем в случае клеток Panc1. Колониеобразующий потенциал опухолевых 94 клеток основывается на их способности к выживанию в неприкрепленном состоянии, эффективности прикрепления к субстрату и возможности образовывать очаг активной пролиферации. Поэтому наиболее вероятным объяснением наблюдаемых различий может служить HNF4α-зависимое снижение скорости роста культур MiaPaCa2, которого не наблюдается в клетках Panc1. 4.4.6.4. Усиление способности клеток Panc1-HNF4α и MiaPaCa2-HNF4α к направленной миграции Повышение способности к миграции является важным этапом развития злокачественного фенотипа опухолевых клеток. Высокий миграционный потенциал позволяет клеткам покидать пределы первичной опухоли и образовывать очаги удаленного опухолевого роста – метастазы. Искусственное ослабление способности опухолевых клеток к миграции снижает вероятность образования метастазов. В большинстве случаев усиление миграционной способности клеток сопряжено с дисфункцией опухолевых супрессоров, поэтому исследования механизмов его регуляции представляют высокий научно-практический интерес. Как правило, в организме миграция клеток происходит под действием градиентов ростовых факторов, питательных веществ и кислорода. Для исследования направленной миграции в условиях in vitro используют камеры Бойдена, представляющие собой емкость, разделенную на две камеры пористой мембраной. В верхнюю камеру помещают исследуемые клетки в среде инкубации, не содержащей аттрактанта, а в нижнюю камеру – среду инкубации с исследуемым аттрактантом. В большинстве случаев в качестве аттрактанта используют эмбриональную сыворотку крупного рогатого скота (FBS) или аналогичные сыворотки. Под действием образующегося градиента содержащихся в сыворотке ростовых факторов клетки мигрируют сквозь пористую мембрану на ее нижнюю сторону, где их окрашивают и подсчитывают. Количество клеток, мигрировавших сквозь мембрану, отражает способность исследуемой клеточной культуры к направленной миграции (Рисунок 22). Рисунок 22. Схема устройства камеры Бойдена. 95 Миграционный потенциал клеток Panc1-HNF4α и MiaPaCa2-HNF4α определяли согласно методике, описанной в Разделе 3.21. В трех независимых экспериментах нами было показано статистически достоверное повышение способности HNF4α-экспрессирующих клеток Panc1 и Б Количество клеток, мигрировавших сквозь мембрану A 900 800 700 600 500 400 300 200 100 0 Количество клеток, мигрировавших сквозь мембрану MiaPaCa2 к направленной миграции по сравнению с контрольными линиями (Рисунок 23). 600 * * 597,00 547,00 Panc1HNF4α1 Panc1HNF4α7 347,00 Panc1-ref ** 500 ** 366,86 357,06 MiaPaCa2HNF4α1 MiaPaCa2HNF4α7 400 300 200 102,52 100 0 MiaPaCa2-ref Рисунок 23. Среднее количество клеток HNF4α-экспрессирующих и контрольных культур Panc1 (А) и MiaPaCa2 (Б), мигрировавших сквозь мембрану камеры Бойдена. - p<0,05, - p<0,01(U-тест Манна-Уитни). Сведения о том, что экспрессия HNF4α необходима для правильного прохождения гаструляции, указывают на то, что HNF4α участвует в регуляции миграционной активности клеток бластоцисты [Chen et al., 1994; Duncan et al., 1997]. Однако внутриклеточные механизмы влияния HNF4α на миграционные свойства клеток на данный момент исследованы недостаточно. На сегодняшний день данных о прямой HNF4α-зависимой регуляции процессов клеточной миграции чрезвычайно мало, но в литературе было описано значительное усиление 96 способности клеток Panc1 и MiaPaCa2 к направленной миграции и инвазии при экзогенной экспрессии фактора PDX1 [Koizumi et al., 2003; Liu et al., 2011]. Возможно, повышение миграционного потенциала клеток Panc1 и MiaPaCa2 при экзогенной экспрессии в них HNF4α опосредуется фактором PDX1. Повышение экспрессии p21CIP1/WAF1 в клетках MiaPaCa2-HNF4α также может приводить к повышению миграционной активности клеток. Усиление синтеза p21CIP1/WAF1 может сопровождаться увеличением его концентрации в цитоплазме. Показано, что в цитоплазме p21CIP1/WAF1 и другие представители семейства Cip/Kip способны регулировать активность Rho-киназ и таким образом воздействовать на перестройку актинового цитоскелета, предотвращая образование стресс-фибрилл [Lee and Helfman, 2004; Besson et al., 2004]. Более того, нокаут p21CIP1/WAF1 в Ras-трансформированных эмбриональных фибробластах мыши приводит к значительному снижению их миграционной способности [Romanov et al., 2011]. С другой стороны, это предположение не объясняет повышения миграционного потенциала клеток Panc1-HNF4α, которое, по всей видимости, определяется другими HNF4α-зависимыми регуляторными сигналами. Для адекватного истолкования обнаруженных изменений следует снова обратиться к гипотезе о том, что протоковые клетки ПЖ могут играть роль мультипотентных клетокпредшественников. Как правило, повышение миграционного потенциала клеточной линии свидетельствует об усилении злокачественности клеток культуры. Однако это не всегда верно в отношении клеток-предшественников, способных дифференцироваться в несколько типов клеток, локализованных в разных частях органа. Показано, что для дифференцировки по типу эндокринных клеток островков Лангерганса панкреатические клетки-предшественники должны обладать повышенной способностью к активной направленной миграции [Kim and Hebrok, 2001]. Таким образом, повышение миграционного потенциала в случае клеточных линий, полученных из панкреатических протоковых клеток, может указывать на приобретение ими фенотипа, сходного с клетками-предшественниками, находящимися на стадии начальной дифференцировки. На это же указывает и одновременная экспрессия в этих клетках факторов PDX1 и PTF1α [Burlison et al., 2004; Zhou et al., 2007]. Усиление направленной миграции клеток может также указывать на повышение чувствительности к используемому хемоаттрактанту. В качестве аттрактанта мы использовали неинактивированную фетальную телячью сыворотку, содержащую большое количество ростовых факторов, необходимых для поддержания жизнедеятельности эукариотических клеток. Как уже указывалось ранее, изменение чувствительности к внешним ростовым факторам является одним из ключевых изменений, происходящих при опухолевой прогрессии. Возможно, экзогенная экспрессия HNF4α в клетках Panc1 и MiaPaCa2 может модифицировать эту чувствительность. Однако в рамках этой работы мы не проводили экспериментов, 97 направленных на определение чувствительности клеток исследуемых линий к различным ростовым факторам, поэтому данная гипотеза требует проведения серии дальнейших исследований. Итак, экзогенная экспрессия изоформ HNF4α в клетках ПАКПЖ человека Panc1 и MiaPaCa2 сопровождается ослаблением их колониеобразующей способности, а в клетках MiaPaCa2 приводит к замедлению роста по сравнению с контрольными клетками. Эти изменения свидетельствуют о частичной реверсии их злокачественного фенотипа под действием HNF4α. В то же время HNF4α-экспрессирующие клетки Panc1 и MiaPaCa2 обладают большей способностью к направленной миграции, что обычно является признаком более злокачественных опухолевых клеток. Однако в данном случае HNF4α-зависимое усиление миграционной активности исследованных культур сопряжено с повышением их уровня дифференцировки и активацией в них генов, характерных для частично дифференцированных клеток-предшественников ПЖ. Следует помнить, что протоковые клетки ПЖ мультипотентны и способны к дедифференцировке и последующей редифференцировке в другие типы панкреатических клеток. Активная миграция дифференцирующихся мультипотентных клеток необходима для естественных процессов регенерации ткани ПЖ и не сопровождается их малигнизацией, поэтому повышение миграционного потенциала клеток Panc1 и MiaPaCa2 не обязательно указывает на усиление их злокачественных свойств и способности к образованию метастазов (что подтверждается результатами теста на колониеобразование). Экзогенная экспрессия изоформ HNF4α1 и HNF4α7 в исследуемых клетках приводит к почти идентичным изменениям их биологических характеристик. Экспрессия HNF4αP1 нехарактерна для клеток нормальной взрослой ПЖ, низкий уровень его транскрипции наблюдается только в клетках панкреатических островков [Huang et al., 2008]. Высокая активность промотора P1 наблюдается в эмбриональной ПЖ, из чего следует логичное предположение, что изоформы группы HNF4αP1 должны активировать преимущественно эмбриональные панкреато-специфические гены. Это предположение частично подтверждается HNF4αP1-зависимой активацией гена HNF1β в клетках Panc1. Однако большая часть регуляторов дифференцировки панкреатических клеток (PDX1, PTF1α, FOXA2, OC-2) с приблизительно одинаковой эффективностью индуцируется обеими группами изоформ HNF4α. Следует помнить, что редифференцировка клеток ПАКПЖ под действием экзогенного HNF4α1 происходит не до конца, а до состояния панкреатических клеток-предшественников, в которых экспрессия HNF4αP1 является нормой во время эмбриогенеза. Поэтому данное наблюдение позволяет предположить, что изоформы группы HNF4αP1 наравне с изоформами группы HNF4αP2 могут играть важную роль в регуляции дифференцировки эмбриональных 98 панкреацитов; на сегодняшний день функции HNF4αP1 в развивающейся ПЖ практически не исследованы, поэтому данный вопрос представляет большой интерес и требует дальнейших экспериментов. Полученные в этой части работы результаты указывают на то, что экспрессия изоформ HNF4αP1 и HNF4αP2 в дедифференцированных клетках ПАКПЖ может приводить к частичной реверсии злокачественного фенотипа, а ядерный рецептор HNF4α - выполнять функции опухолевого супрессора в протоковых клетках ПЖ. Благодаря возможности экзогенной реактивации гена HNF4α в клетках ПАКПЖ, он может оказаться потенциальной мишенью для разработки таргетных препаратов. 99 4.5. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ПОДАВЛЕНИЯ ЭКСПРЕССИИ HNF4α НА ЗЛОКАЧЕСТВЕННЫЙ ПОТЕНЦИАЛ КУЛЬТУРЫ ВЫСОКОДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК ПАКПЖ CAPAN2 В первой части работы мы продемонстрировали, что экзогенная экспрессия изоформ ядерного рецептора HNF4α в низкодифференцированных клетках ПАКПЖ человека Panc1 и MiaPaCa2 сопровождается повышением уровня их дифференцировки и частичной реверсией злокачественного фенотипа. Если, согласно нашей гипотезе, HNF4α является важным опухолевым супрессором в протоковых клетках ПЖ, подавление его экспрессии в панкреатических протоковых клетках должно повышать вероятность их злокачественной трансформации или стимулировать прогрессию уже трансформированных клеток. Для проверки этого предположения была использована высокодифференцированная клеточная линия ПАКПЖ человека CaPan2, характеризующаяся невысокой пролиферативной активностью и близкая по спектру экспрессии тканеспецифических генов, в том числе изоформ HNF4α, к нормальной ткани ПЖ (Рисунок 12). 4.5.1. Получение клеточных культур CaPan2 с подавленной экспрессией HNF4α Для подавления экспрессии HNF4α в клетках CaPan2 были использованы лентивирусные вектора, экспрессирующие малые шпилечные РНК (мшРНК), комплементарные к участкам последовательности мРНК гена HNF4A. Связывание мшРНК с молекулой мРНК HNF4α приводит к образованию шпильки, которая предотвращает трансляцию мРНК рибосомами и увеличивает скорость разрушения мРНК. В работе было использовано 5 различных последовательностей мшРНК, отличающихся участками связывания с молекулой мРНК HNF4α. Клетки линии CaPan2 заражали лентивирусными частицами, содержащими генетические конструкции на основе вектора pLKO1, кодирующие 5 вариантов мшРНК, комплементарных последовательности HNF4α, и ген устойчивости лентивирусные к пуромицину. частицы с Для вектором получения pLKO-1, контрольной несущим культуры кроме гена использовали устойчивости последовательность мшРНК к мРНК зеленого флюоресцентного белка (GFP). После заражения проводили селекцию в среде, содержащей пуромицин. Было получено 5 культур CaPan2, в которых подавлена экспрессия HNF4α (далее в тексте обозначены как CaPan2-shHNF4α), и контрольная культура CaPan2-ref. 100 4.5.2. Определение уровней синтеза белка HNF4α в клетках CaPan2-shHNF4α Эффективность подавления экспрессии HNF4α в культурах CaPan2-shHNF4α, оценивали методом иммуноблоттинга со специфическими антителами HNF4αTOT к общему для всех изоформ участку молекулы HNF4α. Для контроля количества белка, внесенного в каждую пробу, дополнительно проводили окрашивание мембраны антителами к глицеральдегидфосфат-дегидрогеназе (GAPDH). Результаты определения уровней синтеза HNF4α представлены на Рисунке 24. Рисунок 24. Уровни синтеза белка HNF4α в клетках культур CaPan2-shHNF4α и контрольной культуры CaPan2-ref. Уровни синтеза белка GAPDH использовали для контроля общего количества белка, нанесенного на дорожки. В образцах белка всех полученных культур CaPan2-shHNF4α уровни экспрессии HNF4α, определенные с помощью иммуноблоттинга, были существенно ниже, чем в образце культуры CaPan2-ref. Наибольшей эффективностью подавления синтеза HNF4α по сравнению с контрольной культурой отличались культуры CaPan2-shHNF4α-1 и CaPan2-shHNF4α-3; уровень синтеза HNF4α в них составлял соответственно около 30% от уровня синтеза HNF4α в контрольной культуре. Эти культуры были использованы для дальнейших исследований. Уровень синтеза и локализация HNF4α в культурах CaPan2-ref, CaPan2-shHNF4α-1 и CaPan2-shHNF4α-3 были исследованы методом иммунофлюоресценции с антителами HNF4αTOT. В клетках CaPan2-ref HNF4α имеет преимущественно ядерную локализацию, в то время как в культурах CaPan2-shHNF4α его содержание в ядрах клеток значительно ниже (Рисунок 25). 101 Рисунок 25. Иммунофлюоресцентное окрашивание клеток CaPan2-ref и CaPan2-shHNF4α моноклональными антителами HNF4αTOT к HNF4α. Ядра клеток окрашены DAPI. 4.5.3. Определение уровней экспрессии изоформ и групп изоформ HNF4α в клетках CaPan2-shHNF4α Для детального исследовании экспрессии изоформ HNF4α в клетках CaPan2-shHNF4α был использован метод полуколичественного ОТ-ПЦР со специфическими праймерами, фланкирующими вариабельные участки последовательности мРНК HNF4α. Результаты ОТПЦР анализа уровней экспрессии изоформ HNF4α в клетках CaPan2-shHNF4α приведены на Рисунке 26. Рисунок 26. ОТ-ПЦР анализ экспрессии изоформ HNF4α в клетках CaPan2shHNF4α и контрольной культуры CaPan2-ref. Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. 102 Общий уровень экспрессии HNF4α и группы изоформ HNF4αP2 в клетках культур CaPan2-shHNF4α-1 и CaPan2-shHNF4α-3 понижен по сравнению с клетками контрольной культуры CaPan2-ref. Связывание мшРНК с молекулами мРНК изоформ HNF4α не только затрудняет трансляцию, но и способствует быстрому разрушению этих молекул. Таким образом, результаты ОТ-ПЦР еще раз подтверждают высокую эффективность подавления синтеза HNF4α в отобранных культурах CaPan2-shHNF4α. Подавление экспрессии HNF4αP2 не привело к индукции экспрессии изоформ группы HNF4αP1. Результаты ОТ-ПЦР с праймерами к вариабельным участкам 8-го (HNF4α3, α6, α9, α12) и 9-го (HNF4α2, α5, α8, α11) экзонов гена HNF4A, показали, что в клетках CaPan2-ref и CaPan2-shHNF4α экспрессируются изоформы HNF4α7, α8 и α9, характерные для ткани нормальной ПЖ; преобладающей является изоформа HNF4α8, что также совпадает с литературными данными [Hansen et al., 2002; Harries et al., 2008]. Подавление экспрессии HNF4α с помощью мшРНК с близкой эффективностью влияет на уровни экспрессии всех трех изоформ HNF4α7, α8 и α9. Ни в контрольных клетках CaPan2-ref, ни в клетках CaPan2-shHNF4α экспрессии изоформ HNF4α10-α12 выявлено не было. Таким образом, можно с уверенностью утверждать, что отличия клеток CaPan2-shHNF4α от клеток контрольной линии CaPan2-ref вызваны именно подавлением активности группы изоформ HNF4αP2. 4.5.4. Изменения экспрессии тканеспецифических транскрипционных факторов в клетках CaPan2-shHNF4α В первой части работы нами было выявлено влияние экзогенной экспрессии HNF4α в клетках Panc1 и MiaPaca2 на уровень дифференцировки клеток ПАКПЖ и важнейших регуляторов дифференцировки протокоых клеток (Раздел 4.4.4). Для проверки универсальности выявленных закономерностей мы исследовали изменения уровней экспрессии важнейших регуляторов дифференцировки панкреатических клеток при подавлении экспрессии HNF4α в клетках CaPan2. На Рисунке 27 приведены результаты ОТ-ПЦР анализа экспрессии тканеспецифических ТФ в клетках культур CaPan2-ref и CaPan2-shHNF4α. 103 Рисунок 27. ОТ-ПЦР анализ экспрессии тканеспецифических регуляторов дифференцировки в клетках культур CaPan2-shHNF4α и контрольной культуры CaPan2-ref. Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. Как уже упоминалось ранее (Раздел 4.3, Рисунок 12), в культуре CaPan2 сохраняются достаточно высокие уровни экспрессии многих ТФ, характерных для нормальной панкреатической ткани (кроме HNF1α и HNF6). При мшРНК-опосредованном подавлении активности HNF4α в клетках CaPan2-shHNF4α происходит значительное снижение уровней экспрессии генов PDX1, PTF1A и FOXA1 по сравнению с контрольной культурой. В то же время активность генов FOXA2 и HNF4G не изменяется; индукции экспрессии факторов HNF1α и HNF6 также не происходит. Уровень экспрессии HNF1B повышен по сравнению с контрольной культурой в клетках CaPan2-shHNF4α-3, но не изменяется в CaPan2-shHNF4α-1. Изменения активности гена OC2 также носят неоднозначный характер: в культуре CaPan2shHNF4α-1 наблюдается значительное понижение его экспрессии, в то время как в клетках CaPan2-shHNF4α-3 происходит его незначительная активация. 104 Для того чтобы правильно интерпретировать выявленные изменения экспрессии панкреа-специфических ТФ, необходимо оценить их влияние на дифференцировочный статус клеток CaPan2 и сравнить их с изменениями, описанными ранее в HNF4α-экспрессирующих клетках Panc1 и MiaPaCa2. В клетках CaPan2-ref и CaPan2-shHNF4α экспрессируются только изоформы группы HNF4αP2, поэтому мы будем сравнивать их только с культурами Panc1HNF4α7 и MiaPaCa2-HNF4α7. Экзогенная экспрессия изоформ группы HNF4αP2 в низкодифференцированных клетках Panc1 и MiaPaCa2 приводит к повышению экспрессии генов PDX1, PTF1A, HNF1A, FOXA1, FOXA2 и OC2 (см. Раздел 4.4.4). Согласно нашему предположению, подавление активности HNF4αP2 в клетках CaPan2 могло привести к противоположному эффекту - понижению активности этих генов; эта гипотеза подтвердилась при исследовании уровней экспрессии генов PDX1, PTF1A и FOXA1. Активная экспрессия этих факторов характерна для эмбриональных и взрослых клеток ПЖ [Monaghan et al., 1993; Afelik et al., 2006; Zhou et al., 2007], в то время как в низкодифференцированных опухолевых клетках (например, клеточных линиях Panc1 и MiaPaCa2, см. Рисунок 12) их транскрипция значительно снижена. Одновременное снижение экспрессии PDX1, PTF1α и FOXA1 свидетельствует о том, что подавление синтеза HNF4α в клетках CaPan2 приводит к их частичной дедифференцировке. Такое изменение является еще одним весомым доводом в пользу выдвинутой гипотезы об опухолесупрессорной роли фактора HNF4α в протоковых клетках ПЖ. С другой стороны, в клетках CaPan2-shHNF4α не наблюдается однозначных корреляций между снижением синтеза HNF4α и уровнями экспрессии генов HNF1B, FOXA2 и OC2. В клетках Panc1 и MiaPaCa2 экзогенная экспрессия HNF4α вызывала активацию экспрессии генов FOXA2 и OC-2; однако в культурах CaPan2-shHNF4α снижение уровней синтеза HNF4α не вызывает значимых изменений экспрессии FOXA2 по сравнению с контрольными клетками. Изменения уровня транскрипции OC-2 не коррелируют со степенью подавления HNF4α: культуры CaPan2-shHNF4α-1 и CaPan2-shHNF4α-3 характеризуются приблизительно одинаковой эффективностью подавления синтеза HNF4α, но в одной из них (CaPan2-shHNF4α-1) наблюдается значительное снижение, а в другой (CaPan2-shHNF4α-3) – повышение активности гена OC2. Такие изменения представляются значимым аргументом против гипотезы о прямой HNF4α-зависимой регуляции генов FOXA2 и OC2; по всей видимости, влияние HNF4α на эти гены опосредуется дополнительными механизмами. При исследовании клеток Panc1-HNF4α и MiaPaCa2-HNF4α нами было показано, что экспрессия факторов PDX1, PTF1α, FOXA2 и OC-2 под действием HNF4α изменяется согласованно. На основании этого мы предположили, что активность этих генов регулируется 105 общим HNF4α-зависимым сигнальным путем. Однако отсутствие подобных закономерностей в клетках CaPan2-shHNF4α подвергает это предположение сомнению. Индукция экспрессии фактора HNF1β в клетках Panc1-HNF4α наблюдалась только под действием изоформ группы HNF4αP1. Таким образом, HNF4αP2 либо не влияет на экспрессию HNF1β в панкреатических клетках, либо подавляет ее. Полученные результаты показывают, что более вероятным является независимость регуляции HNF1β от HNF4αP2: уровень экспрессии HNF1β не изменяется в клетках Capan2-shHNF4α-1 и незначительно повышается в CaPan2shHNF4α-3. Высоким уровнем экспрессии HNF1β клетки CaPan2 отличаются от нормальной ткани ПЖ, в которой активная экспрессия HNF1β наблюдается только во время эмбрионального развития [Ott et al., 1991; Maestro et al., 2003; Nammo et al., 2008]. Таким образом, наблюдаемое сохранение высокого уровня экспрессии HNF1β в клетках CaPan2shHNF4α свидетельствует о пониженном уровне дифференцировки по сранению с нормальными клетками ПЖ. В исследованных культурах CaPan2-shHNF4α экспрессии генов HNF1α и HNF6 не выявлено. Оба этих фактора регулируют заключительные стадии дифференцировки панкреатических клеток, причем HNF6 играет критическую роль в дифференцировке протоковых клеток. Поэтому отсутствие индукции их экспрессии при частичой дедифференцировке клеток CaPan2 является логичным и ожидаемым результатом. Итак, мшРНК-опосредованное подавление синтеза фактора HNF4α в высокодифференцированных клетках ПАКПЖ человека CaPan2 приводит к падению экспрессии панкреа-специфических факторов PDX1, PTF1α и FOXA1, что указывает на снижение уровня их дифференцировки. Это наблюдение согласуется с описанной нами ранее возможностью редифференцировки клеток Panc1 и MiaPaCa2 при экзогенной экспрессии HNF4α. и подтверждает опухолесупрессорное действие HNF4α в панкреатических клетках. С другой стороны, степень дедифференцировки клеток CaPan2-shHNF4α по сравнению с контрольной культурой не очень высока, так как экспрессия панкреатических дифференцировочных маркеров HNF1β и FOXA2 в них сохраняется на практически неизменном уровне, а понижение экспрессии PDX1 и PTF1α выражено не так сильно, как в случае дедифференцированных культур Panc1 и MiaPaCa2. Следует отметить, что в клетках CaPan2-ref и CaPan2-shHNF4α сохраняется одновременная экспрессия факторов PDX1 и PTF1α, свойственная панкреатическим клеткампредшественникам. Во время регенерации ПЖ протоковые клетки способны к частичной дедифференцировке с последующей усиленной пролиферацией и миграцией в область повреждения. Возможно, частичная дедифференцировка протоковых клеток ассоциирована с 106 временным подавлением в них экспрессии HNF4α, однако в данной работе проверка этого предположения не проводилась. Тем не менее, сходство спектров экспрессии генов в клетках CaPan2-shHNF4α и клетках-предшественниках позволяет предположить сходство некоторых их биологических свойств, в частности, повышенного миграционного и пролиферативного потенциалов. 4.5.5. Изменения экспрессии функциональных панкреатических генов в клетках CaPan2-shHNF4α Как установлено в первой части работы, изменение экспрессии HNF4α в клетках ПАКПЖ может влиять не только на уровень дифференцировки клеток, но и на их функции посредством регуляции уровней экспрессии тканеспецифических функциональных генов. В отличие от дедифференцированных клеток ПАКПЖ, клетки CaPan2 характеризуются сохранением экспрессии панкреатических маркеров α-амилазы-2a и эластазы-2a – секретируемых белков панкреатического сока, синтезирующихся в экзокринных клетках ПЖ. Клетки CaPan2 сохраняют эпителиальную морфологию, активно экспрессируют E-кадхерин и образуют выраженные межклеточные контакты (Рисунки 11 и 12). HNF4α-зависимые изменения уровней экспрессии генов AMY2A, ELA2A, CDH1, CDH2 и CDKN1A в клетках CaPan2 были исследованы методом ОТ-ПЦР (Рисунок 28). Рисунок 28. ОТ-ПЦР анализ экспрессии функциональных генов в клетках культур CaPan2-shHNF4α и контрольной культуры CaPan2-ref. Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. 107 Подавление экспрессии HNF4α в клетках CaPan2 вызывает значительное снижение уровней экспрессии генов AMY2A и ELA2A, Значимых изменений экспрессии E-кадхерина (CDH1) в клетках CaPan2-shHNF4α по сравнению с контрольной культурой обнаружено не было, в то время как экспрессия N-кадхерина (CDH2), изначально низкая в клетках CaPan2-ref, почти полностью подавлена в клетках CaPan2-shHNF4α. В культурах CaPan2 с подавленным синтезом HNF4α значительно снижается активность гена CDKN1A, который кодирует белок p21CIP1/WAF1. Экспрессия панкреатических α-амилазы-2a и эластазы-2a в клетках CaPan2 – еще один факт, подтверждающий их высокий дифференцировочный статус. CaPan2 - единственная из исследованных нами клеточных линий ПАКПЖ, в которой сохраняется экспрессия этих секреторных белков, характерных для нормальных ацинарных и протоковых клеток (Рисунок 12). Значительное снижение экспрессии этих белков в клетках CaPan2 с подавленной экспрессией HNF4α свидетельствует о потере одной из основных функций экзокринных клеток ПЖ – секреции пищеварительных ферментов. Этот факт подтверждает вывод о дедифференцировке клеток CaPan2-shHNF4α и хорошо согласуется с описанной нами ранее индукцией экспрессии AMY2A под действием HNF4αP2. Таким образом, экспрессия HNF4αP2 в панкреатических клетках может быть необходимым фактором для поддержания их экзокринной функции. На сегодняшний день не описано прямой регуляции генов AMY2A и ELA2A фактором HNF4α. По данным литературы, основными регуляторами экспрессии α-амилазы-2a в клетках ПЖ являются факторы семейства FOXA и фактор PTF1α. Вероятно, понижение экспрессии FOXA1 и PTF1A опосредует влияние подавления HNF4α на экспрессию амилазы в клетках CaPan2-shHNF4α. С другой стороны, активация гена α-амилазы-2a в клетках MiaPaca2-HNF4α1 ассоциирована с повышением экспрессии PTF1α, но не FOXA1; скорее всего, PTF1α является его основным регулятором. В клетках CaPan2-ref и CaPan2-shHNF4α наблюдается приблизительно одинаковый высокий уровень экспрессии E-кадхерина, что характерно для большинства дифференцированных эпителиальных клеток. В то же время экспрессия N-кадхерина, изначально низкая в клетках культуры CaPan2, подавляется еще больше в клетках CaPan2shHNF4α. Эти результаты соответствуют закономерностям, которые наблюдаются в клетках Panc1-HNF4α7: повышение экспрессии HNF4α стимулирует экспрессию N-кадхерина. Описанные изменения недостаточно сильно выражены для ЭМП, решающим фактором для 108 которого является отсутствие влияния HNF4α на активность гена CDH1, кодирующего Eкадхерин. Наиболее важным изменением, наблюдаемым в клетках CaPan2-shHNF4α, является значительное понижение уровня экспрессии гена CDKN1A, кодирующего один из важнейших регуляторов клеточной пролиферации и апоптоза – p21CIP1/WAF1. Ингибирование активности гена CDKN1A наблюдается во многих опухолях различного происхождения и представляет собой один из универсальных механизмов опухолевой прогрессии. Ряд работ описывает HNF4αP1-зависимую регуляцию экспрессии p21CIP1/WAF1 в клетках почки, кишечника и эмбриональной карциномы [Cattin et al., 2009; Chiba et al., 2005; Grigo et al., 2008; HwangVerslues and Sladek, 2008]; в первой части работы нами было показано, что экзогенная экспрессия изоформ как группы HNF4αP1, так и группы HNF4αP2 в клетках ПАКПЖ MiaPaCa2 индуцирует экспрессию этого белка. Снижение экспрессии p21CIP1/WAF1 в клетках CaPan2 при подавлении в них синтеза HNF4αP2 подтверждает наличие в панкреатических клетках HNF4αзависимых механизмов регуляции активности гена CDKN1A, описанных ранее в клетках других тканей. Таким образом, подавление синтеза HNF4α в высокодифференцированных клетках ПАКПЖ человека CaPan2 с помощью мшРНК приводит к их частичной дедифференцировке и ослаблению секреторной функции, характерной для экзокринных панкреатических клеток. Изменения экспрессии генов, наблюдаемые в клетках CaPan2-shHNF4α по сравнению с контрольной культурой, во многом соответствуют закономерностям, описанным нами при экзогенной экспрессии изоформы HNF4α7 в клетках Panc1 и MiaPaCa2. В частности, повышение уровня экспрессии HNF4αP2 активирует, а понижение – снижает экспрессию генов PDX1, PTF1A, FOXA1, AMY2A и CDKN1A. Вероятно, высокий уровень экспрессии HNF4αP2 в клетках ПЖ необходим для поддержания их дифференцированного состояния, а его понижение может быть одним из важных механизмов неопластической трансформации протоковых панкреатических клеток или прогрессии клеток ПАКПЖ. 4.5.6. Влияние подавления синтеза HNF4α на биологические характеристики клеток CaPan2-shHNF4α Частичная дедифференцировка клеток CaPan2, происходящая при подавлении в них экспрессии HNF4α, может приводить к изменениям их злокачественного потенциала. В первой части работы при исследовании клеток Panc1 и MiaPaСa2 нами были описаны HNF4αзависимые изменения биологических характеристик клеток ПАКПЖ. Восстановление экспрессии HNF4α в этих низкодифференцированных культурах вызывало замедление скорости 109 роста клеток, ослабление их колониеобразующей активности и повышение способности к направленной миграции. Поскольку подавление экспрессии HNF4α в клетках CaPan2 вызывает изменения экспрессии генов, противоположные наблюдаемым в культурах Panc1-HNF4α и MiaPaCa2-HNF4α, мы предположили, что и изменения клеточных свойств культур CaPan2shHNF4α могут быть направлены в противоположную сторону. Для проверки этого предположения мы сравнили скорость роста, интенсивность синтеза ДНК, колониеобразующую и миграционную способности клеток культур CaPan2-shHNF4α и контрольной культуры CaPan2-ref. 4.5.6.1. Повышение скорости роста клеточных культур CaPan2-shHNF4α Обнаруженное нами в клетках CaPan2-shHNF4α подавление экспрессии белка p21CIP1/WAF1 с высокой вероятностью ассоциировано с повышением пролиферативной активности клеток этих культур. Для исследования кинетики роста культур CaPan2-ref и CaPan2-shHNF4α использовали набор «CyOUANT NF Cell Proliferation Assay Kit» (см. Раздел 3.20), полученные кинетические кривые приведены на Рисунке 29. Относительное кол-во клеток 3,0 CaPan2-ref CaPan2-shHNF4α-1 2,5 *** *** CaPan2-shHNF4α-3 2,0 *** *** 1,5 1,0 0 1 2 3 Время культивации, сут. 4 5 Рисунок 29. Кинетика роста клеток CaPan2-ref и CaPan2-shHNF4α. Данные нормированы относительно начального количества клеток. - p<0,001 (t-тест Стьюдента). Подавление экспрессии HNF4α в клетках CaPan2 сопровождается значительным увеличением скорости роста культур CaPan2-shHNF4α по сравнению с контрольной культурой. Этот результат согласуется с описанным ранее замедлением роста клеток MiaPaCa2 при повышении в них экспрессии HNF4α. 110 4.5.6.2. Усиление интенсивности синтеза ДНК в клетках CaPan2-shHNF4α Для того чтобы определить вклад усиления пролиферативной активности клеток культур CaPan2-shHNF4α в ускорение их роста, мы проанализировали активность ДНК-синтетических процессов в этих клетках. Для этого был использован метод включения 5-BrdU в ДНК с последующим иммунофлюоресцентным окрашиванием клеток антителами к 5-BrdU. Чтобы оценить, насколько клетки исследованных культур склонны к выходу из фазы G1 и переходу к Доля клеток, меченых 5-BrdU активному делению, подсчитывали долю клеток, ядра которых включили 5-BrdU (Рисунок 30). 0,50 0,40 *** 0,40 *** 0,39 CaPan2shHNF4α-1 CaPan2shHNF4α-3 0,30 0,30 0,20 0,10 0,00 CaPan2-ref Рисунок 30. Включение 5-BrdU в ДНК клеток CaPan2-ref и CaPan2shHNF4α. - p<0,001 (U-тест Манна-Уитни). В культурах CaPan2 с подавленной экспрессией HNF4α происходит достоверное повышение доли клеток, активно синтезирующих ДНК. Этот результат свидетельствует о повышении их пролиферативной активности по сравнению с контрольной культурой и полностью согласуется с результатами определения кинетики пролиферации. Ослабление ДНКсинтетических процессов наблюдается, как правило, при остановке клеточного цикла в фазе G 1; соответственно, повышение доли активно пролиферирующих клеток ассоциировано со снятием блока фазы G1 и повышением частоты перехода в S-фазу. Как отмечено выше, подавление экспрессии HNF4α в клетках CaPan2 сопровождается снижением экспрессии p21CIP1/WAF1, ингибирующего клеточный цикл на стадии G1. По всей видимости, в клетках CaPan2 влияние p21CIP1/WAF1 на пролиферацию опосредуется каноническим путем, через ингибирование CDK1 и CDK2 (в отличие от клеток MiaPaCa2-HNF4α, Раздел 4.4.6.2). В соответствии с литературными данными, HNF4α-зависимая регуляция экспрессии гена CDKN1A представляется наиболее 111 вероятным механизмом, опосредующим влияние HNF4α на клеточную пролиферацию [Chiba et al., 2005; Grigo et al., 2008; Hwang-Verslues and Sladek, 2008]. Инактивация опухолевых супрессоров, таких как p21CIP1/WAF1, является важным механизмом, обеспечивающим прогрессию опухолевых клеток; наблюдаемое нами повышение скорости роста клеток CaPan2-shHNF4α, ассоциированное с подавлением в них экспрессии гена CDKN1A, свидетельствует о приобретении этими клетками более злокачественного фенотипа в результате подавления в них экспрессии HNF4α. 4.5.6.3. Увеличение колониеобразующего потенциала клеток CaPan2 при подавлении синтеза HNF4α Колониеобразующая способность клеток зависит от нескольких факторов, одним из которых является способность к активной пролиферации, не зависящей от контактов с матриксом и другими клетками. Усиление скорости роста и ДНК-синтетической активности клеток культур CaPan2-shHNF4α позволяет предположить, что их способность к формированию колоний из одиночных клеток также повышается по сравнению с контрольной культурой. Для проверки этого предположения мы провели клоногенный тест. Данные, полученные в результате трех независимых экспериментов (Рисунки 31 и 32), достоверно свидетельствуют о значительном увеличении колониеобразующего потенциала клеток CaPan2 при подавлении экспрессии HNF4α. Рисунок 31. Типичные результаты клоногенного теста с культурами CaPan2ref и CaPan2-shHNF4α. Разведение – 2000 клеток/чашку. Сверху указаны клеточные линии, снизу – количество колоний на чашке. Количество колоний на чашке 112 220 200 180 160 140 120 100 80 60 40 20 0 *** *** 138,6 128,7 CaPan2shHNF4α-1 CaPan2shHNF4α-3 39,2 CaPan2-ref Рисунок 32. Среднее количество колоний, формируемых клетками культур CaPan2-ref и CaPan2-shHNF4α. - p<0,001 (t-тест Стьюдента). Повышение колониеобразующей способности опухолевых клеток является прямым свидетельством усиления их злокачественного потенциала и может объясняться как стимуляцией их пролиферативной активности, так и увеличением эффективности их прикрепления к субстрату и устойчивости к аноикису. В первой части работы на примере клеток MiaPaCa2-HNF4α мы показали, что HNF4α-зависимые изменения скорости роста клеточных культур вносят значительный вклад в изменения их клоногенного потенциала (Раздел 4.4.6.3). По-видимому, в клетках CaPan2-shHNF4α наблюдается аналогичный эффект: усиление пролиферативной активности при подавлении HNF4α является основным фактором, приводящим к более эффективному колониеобразованию. Как показано в случае клеток Panc1HNF4α, вклад HNF4α-зависимых изменений, не связанных с пролиферативной активностью клеток, выражен значительно слабее. Так, изменение адгезионных способностей клеток, как правило, ассоциировано с характерными для ЭМП изменениями их морфологии, которых в клетках CaPan2-shHNF4α не наблюдалось; влияние подавления экспрессии HNF4α на частоту апоптоза и устойчивость к аноикису клеток CaPan2 в данной работе не исследовалось. 4.5.6.4. Повышение способности клеток CaPan2-shHNF4α к направленной миграции При исследовании влияния экзогенной экспрессии изоформ HNF4α на характеристики низкодифференцированных клеток Panc1 и MiaPaCa2 мы наблюдали достаточно неожиданный эффект. HNF4α-экспрессирующие клетки этих линий, отличающиеся от контрольных культур более высоким уровнем дифференцировки, сниженными скоростью роста и клоногенным потенциалом, обладали достоверно более высокой способностью к направленной миграции. Поэтому возможное влияние подавления экспрессии HNF4α на миграционный потенциал 113 клеток CaPan2 представляло для нас особенно большой интерес. Результаты нескольких независимых экспериментов по исследованию способности клеток Capan2-ref и CaPan2shHNF4α к направленной миграции в камерах Бойдена приведены на Рисунке 33. Согасно этим результатам, клетки обеих культур CaPan2-shHNF4α достоверно отличаются от контрольных Количество клеток, мигрировавшх сквозь мембрану клеток CaPan2-ref повышением способности к направленной миграции. 3000,00 ** 1664,9 2500,00 *** 1663,0 2000,00 1500,00 1032,7 1000,00 500,00 0,00 CaPan2-ref CaPan2shHNF4α-1 CaPan2shHNF4α-3 Рисунок 33. Среднее количество клеток культур CaPan2-ref и CaPan2shHNF4α, мигрировавших сквозь мембрану камеры Бойдена. - p<0,01, - p<0,001 (U-тест Манна-Уитни). Усиление миграционного потенциала в культурах CaPan2-shHNF4α согласуется с общей тенденцией к дедифференцировке и повышению злокачественного потенциала клеток CaPan2 при подавлении экспрессии HNF4α. Однако этот результат не согласуется с описанной в клетках Panc1 и MiaPaCa2 способностью HNF4α стимулировать направленную миграцию клеток. Как подавление, так и гиперэкспрессия фактора HNF4α в клетках ПАКПЖ вызвали однонаправленные изменения их миграционной способности. Это сильнейший аргумент в пользу того, что HNF4α-зависимая регуляция миграционных свойств клеток происходит не напрямую, а опосредуется различными клеточными механизмами и сигнальными путями. По всей видимости, направление влияния, оказываемого на миграционную способность клеток этими регуляторными механизмами, зависит от экспрессии генов, дифференцировочного статуса и других свойств конкретных клеток (так называемого «клеточного контекста»). Так, ранее мы уже выдвигали гипотезу о том, что усиление миграции клеток Panc1-HNF4α и MiaPaCa2-HNF4α связано с их частичной редифференцировкой и приобретением свойств, характерных для панкреатических клеток-предшественников. Ниже мы постараемся более детально проанализировать значение повышения миграционного потенциала клеток CaPan2shHNF4α. 114 Как правило, повышение миграционной способности эпителиальных клеток связано с ЭМП. Однако подавление экспрессии HNF4α в клетках CaPan2 не сопровождается снижением уровня экспрессии E-кадхерина, основного белка адгезионных контактов эпителиальных клеток. Более того, в них наблюдается подавление экспрессии N-кадхерина, активация экспрессии которого может наблюдаться при ЭМП. Неполная дедифференцировка клеток CaPan2-shHNF4α подтверждается и сохранением в них высокой экспрессии ряда тканеспецифических ТФ (HNF1β, FOXA2, OC-2). Протоковые клетки ПЖ в норме обладают ограниченной способностью к временной дедифференцировке; таким образом, для объяснения наблюдаемых изменений можно снова обратиться к обсуждавшейся выше теории о том, что протоковые клетки, из которых развивается ПАКПЖ, обладают свойствами панкреатических клеток-предшественников. В экспериментах по регенерации ПЖ показано, что после повреждения органа очаги усиленной пролиферации панкреатических клеток локализуются в протоках, совпадают с местами экспрессии фактора PDX1 и, по всей видимости, вызваны активным делением протоковых клеток [Bonner-Weir et al., 2008; Li et al., 2010]. В активно делящихся протоковых клетках также наблюдается подавление экспрессии фактора HNF6 и активация HNF1β, что указывает на их частичную дедифференцировку [Li et al., 2010]. Частично дифференцированные клетки ПЖ одновременно экспрессируют факторы PDX1 и PTF1α [Burlison et al., 2004; Zhou et al., 2007]. Для них характерно также повышение миграционного потенциала, необходимое для перемещения в места повреждения ПЖ и их репарации [Kim and Hebrok, 2001]. Все вышеперечисленные особенности наблюдаются и в клетках культур CaPAn2shHNF4α (хотя экспрессия генов PDX1 и PTF1A при подавлении HNF4α падает, но не исчезает совсем). Таким образом, механизмы, отвечающие за усиление миграционной активности клеток CaPan2-shHNF4α, могут быть очень близки к механизмам, регулирующим частичную дедифференцировку нормальных протоковых клеток ПЖ. К сожалению, на сегодняшний день детали этого процесса изучены недостаточно, поэтому для более точного выявления роли HNF4α в регуляции миграционной способности панкреатических клеток необходимы дополнительные исследования. Итак, в процессе регенерации ткани ПЖ протоковые клетки приобретают характеристики, близкие к описанным нами в клетках CaPan2-shHNF4α. По всей видимости, высокая вероятность возникновения опухолей из протоковых клеток ПЖ и высочайшая агрессивность этих опухолей вызваны именно этой особенностью протоковых клеток, в результате чего вероятность их неопластической трансформации резко повышается. Подавление экспрессии фактора HNF4α вызывает аналогичные изменения клеточных свойств и 115 экспрессии генов в высокодифференцированных клетках ПАКПЖ человека CaPan2, а именно: снижение уровней экспрессии ряда панкреа-специфических генов, повышение скорости роста, синтеза ДНК, колониеобразующей и миграционной способностей этих клеток. Другими словами, мшРНК-опосредованное подавление синтеза HNF4α в клетках CaPan2 сопровождается усилением их злокачественных характеристик, что указывает на его опухоле-супрессорную роль в этих клетках. 116 4.6. ИССЛЕДОВАНИЕ ВЛИЯНИЯ ПОДАВЛЕНИЯ ЭКСПРЕССИИ HNF4α НА БИОЛОГИЧЕСКИЕ ХАРАКТЕРИСТИКИ КУЛЬТУРЫ УМЕРЕННОДИФФЕРЕНЦИРОВАННЫХ КЛЕТОК ПАКПЖ ASPC1 В первой и второй частях данной работы нами была исследована возможная роль изменений экспрессии ядерного рецептора HNF4α в регуляции свойств клеток ПАКПЖ человека. Его экзогенная экспрессия в дедифференцированных клетках Panc1 и MiaPaCa2 вызывает их частичную редифференцировку и ослабление злокачественных свойств. Подавление синтеза HNF4α в высокодифференцированных клетках CaPan2 сопровождается противоположными эффектами – снижением уровней экспрессии дифференцировочных маркеров и усилением злокачественного потенциала этих клеток. Таким образом, транскрипционный фактор HNF4α в перечисленных клеточных линиях проявляет свойства, характерные для опухолевых супрессоров. В выбранную нами для исследований панель клеточных линий ПАКПЖ человека также входит линия AsPC1, которая характеризуется средним уровнем дифференцировки и повышенным по сравнению с нормальной тканью ПЖ уровнем экспрессии обеих групп изоформ HNF4α: как свойственной для панкреатических клеток группы HNF4αP2, так и нехарактерной для них группы HNF4αP1 (Рисунок 12). На сегодняшний день значение усиления экспрессии HNF4α в опухолевых клетках практически не изучено; мы предположили, что гиперэкспрессия HNF4α может оказывать влияние на прогрессию клеток ПАКПЖ. В данной части работы исследуется влияние мшРНКопосредованного подавления экспрессии HNF4α на свойства клеток AsPC1. 4.6.1. Получение клеточных культур AsPC1 с подавленной экспрессией HNF4α Культуры AsPC1 с подавленным синтезом HNF4α (AsPC1-shHNF4α) получали с помощью лентивирусной трансфекции теми же мшРНК, комплементарными последовательности HNF4α, которые ранее были использованы для получения клеток CaPan2shHNF4α (см. Раздел 3.8 и 4.5.1). В качестве контрольной культуры (далее AsPC1-ref) использовали клетки AsPC1, зараженные лентивирусом, содержащим исходный вектор pLKO1, несущий только ген устойчивости к пуромицину. После заражения клеток AsPC1 вирусными частицами проводили селекцию в среде, содержащей антибиотик пуромицин, в результате чего было получено 5 культур, экспрессирующих мшРНК к HNF4α, и контрольная культура AsPC1ref. 117 4.6.2. Анализ уровня синтеза белка HNF4α в клетках AsPC1-shHNF4α Для определения эффективности подавления синтеза HNF4α в клетках полученных культур AsPC1-shHNF4α были использованы методы иммуноблоттинга и иммунофлюоресценции. При оценке уровней синтеза HNF4α с помощью иммуноблоттинга мы использовали моноклональные антитела, специфичные как к общему для всех изоформ эпитопу (HNF4αTOT), так и избирательно связывающиеся с изоформами группы P1 (HNF4αP1) или группы P2 (HNF4αP2). Использование перечисленных антител позволило проанализировать не только общую эффективность подавления HNF4α в клетках AsPC1-shHNF4α, но и более точно установить соотношение уровней экспрессии групп изоформ HNF4α в этих клетках, чтобы учесть возможное влияние изоформенного состава HNF4α на свойства клеток AsPC1. Для контроля количества белка, внесенного в каждую пробу, дополнительно проводили окрашивание мембраны антителами к глицеральдегид-фосфат-дегидрогеназе (GAPDH). Результаты определения уровней синтеза HNF4α в исследуемых клетках представлены на Рисунке 34. Рисунок 34. Уровни синтеза белка HNF4α в клетках культур AsPC1-shHNF4α и контрольной культуры AsPC1-ref. Уровни синтеза белка GAPDH использовали для контроля общего количества белка, нанесенного на дорожки. Как видно из Рисунка 34, наибольшая эффективность подавления синтеза HNF4α по сравнению с контрольной линией AsPC1-ref наблюдается в клеточных культурах AsPC1shHNF4α-2 и AsPC1-shHNF4α-3. В культуре AsPC1-shHNF4α-2 снижение уровня синтеза HNF4α происходит в основном за счет подавления группы изоформ HNF4αP2, в то время как в клетках AsPC1-shHNF4α-3 снижается экспрессия обеих групп изоформ HNF4α. Аналогичные результаты были получены при исследовании синтеза и внутриклеточной локализации HNF4α в клетках AsPC1-shHNF4α методом иммунофлюоресценции с антителами 118 HNF4αTOT. Культуры AsPC1-shHNF4α-2 и AsPC1-shHNF4α-3 характеризуются пониженной интенсивностью окраски HNF4α по сравнению с клетками AsPC1-ref. Во всех исследованных культурах для HNF4α наблюдалась четкая ядерная локализация (Рисунок 35). Рисунок 35. Иммунофлюоресцентное окрашивание клеток AsPC1-ref и AsPC1-shHNF4α моноклональными антителами HNF4αTOT к HNF4α. Ядра клеток окрашены DAPI. Таким образом, для дальнейших исследований мы выбрали культуры клеток AsPC1shHNF4α-2 и AsPC1-shHNF4α-3, в которых эффективность подавления синтеза была наибольшей, а в качестве контрольной культуры использовали AsPC1-ref. По результатам денситометрической оценки интенсивности полос HNF4αTOT на Рисунке 34, эффективность подавления HNF4αTOT в клетках AsPC1-shHNF4α-2 составила приблизительно 50%, а в клетках AsPC1-shHNF4α-3 – около 80%. 4.6.3. Определение уровней экспрессии изоформ и групп изоформ HNF4α в клетках AsPC1-shHNF4α В клетках AsPC1, в отличие от нормальных панкреатических клеток, активно экспрессируются не только изоформы группы HNF4αP2, но и изоформы группы HNF4αP1 (Рисунок 12). Для определения спектра экспрессии отдельных изоформ HNF4α в клетках AsPC1-ref и AsPC1-shHNF4α, как и в предыдущих частях данной работы, был использован метод полуколичественного ОТ-ПЦР (Рисунок 36). 119 Рисунок 36. ОТ-ПЦР анализ экспрессии изоформ HNF4α в клетках AsPC1-shHNF4α и контрольной культуры AsPC1-ref. Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. Экзогенная экспрессия в клетках AsPC1 мшРНК, комплементарных к последовательности HNF4α, вызывает снижение экспрессии HNF4α не только на белковом уровне (Рисунок 34), но и на уровне мРНК (Рисунок 36). При этом в клетках AsPC1-shHNF4α снижение уровня экспрессии наблюдается только для изоформ группы HNF4αP2, в то время как экспрессия HNF4αP1 практически не меняется. Возможно, эффективность разрушения комплексов мРНК-мшРНК в случае изоформ группы HNF4αP2 выше, чем для HNF4αP1. Экспрессия изоформ HNF4α4-α6 (праймеры HNF4αP1, продукт длиной 229 п. н.) и HNF4α10α12 (праймеры HNF4αP2, продукт длиной 386 п. н,), изначально отсутствующая в клетках AsPC1, в клетках AsPC1-shHNF4α не обнаружена. ОТ-ПЦР с праймерами, фланкирующими вариабельные участки 8-го (HNF4α3, α6, α9, α12) и 9-го (HNF4α2, α5, α8, α11) экзонов гена HNF4A, показал, что во всех исследованных культурах экспрессируются как изоформы HNF4α, не содержащие вставок (α1, α7), так и изоформы, содержащие альтернативные последовательности 3'-конца молекулы мРНК – HNF4α2, α3, α8 и α9. Как и в нормальной панкреатической ткани, основными изоформами HNF4α в клетках AsPC1-ref и AsPC1-shHNF4α являются изоформы HNF4α2 и HNF4α8, содержащие 30-тинуклеотидную вставку в экзоне 9. Таким образом, подавление экспрессии HNF4α в клетках AsPC1 с помощью мшРНК не сопровождается избирательным изменением экспрессии отдельных изоформ внутри групп HNF4αP1 и HNF4αP2. 120 4.6.4. Изменения экспрессии тканеспецифических транскрипционных факторов в клетках AsPC1-shHNF4α Для клеток линии AsPC1 характерен достаточно необычный фенотип. С одной стороны, уровни экспрессии многих важных регуляторов развития ПЖ (PDX1, PTF1α, факторы семейств HNF1 и FOXA, HNF6) в клетках AsPC1 значительно снижены по сравнению с образцами нормальной ткани ПЖ, что свидетельствует о более низком уровне дифференцировки этой линии. С другой стороны, экспрессия FOXA1, OC-2 и HNF4αP2, наблюдаемая в клетках AsPC1, выше, чем в культуре CaPan2, отличающейся ярко выраженным эпителиальным фенотипом (Рисунок 12). При этом биологические свойства клеток AsPC1 характерны скорее для низкодифференцированных клеток: их скорость роста выше, чем у высокодифференцированных клеток CaPan2, морфология клеток значительно ближе к мезенхимальной, чем к эпителиальной, клетки AsPC1 не образуют выраженных межклеточных контактов (Рисунок 11). Ввиду этих причин клеткам AsPC1, как правило, приписывают умеренный уровень дифференцировки. Одним из характерных отличий клеток AsPC1 от нормальной панкреатической ткани является высокий уровень экспрессии в них изоформы HNF4αP1, которая в ПЖ активно экспрессируется только во время эмбрионального развития [Harries et al., 2008]. Активация экспрессии эмбриональных генов часто наблюдается в опухолях и, возможно, отвечает за сходство биологических характеристик опухолевых клеток и мультипотентных клетокпредшественников [Hanahan and Weinberg, 2011]. Мы предположили, что индукция экспрессии HNF4αP1 в клетках ПАКПЖ может быть одним из механизмов их прогрессии и дедифференцировки. Кроме того, в клетках AsPC1 гиперэкспрессированы изоформы группы HNF4αP2; повышение уровня синтеза HNF4α наблюдается в PanIN и высокодифференцированных клетках ПАКПЖ [Kim et al., 2013]. В клетках кишечного эпителия в некоторых случаях наблюдается корреляция между высоким уровнем экспрессии обеих изоформ HNF4α и повышенной частотой возникновения и скоростью роста опухолей [Schwartz et al., 2009; Darsigny et al., 2010]. Активация экспрессии группы изоформ HNF4αP1, не свойственных клеткам желудочного эпителия, наблюдается более чем в 50% случаев карцином желудка [Tanaka et al., 2006]. Ранее мы показали, что изменения экспрессии HNF4α в клеточных линиях ПАКПЖ человека оказывают выраженное влияние на их дифференцировочный статус. Экзогенная экспрессия изоформ групп HNF4αP1 и HNF4αP2 в дедифференцированных клетках Panc1 и MiaPaCa2 приводит к их частичной редифференцировке, в то время как подавление экспрессии HNF4αP2 в высокодифференцированных клетках CaPan2 вызывает снижение их уровня дифференцировки. В свете этих закономерностей свойства клеточной культуры AsPC1 121 выглядят необычно: гиперэкспрессия HNF4α сочетается в них со снижением уровня дифференцировки относительно нормальной панкреатической ткани. Этот факт плохо согласуется с гипотезой о том, что активность HNF4α стимулирует дифференцировку панкреатических клеток. Чтобы лучше понять взаимосвязь между уровнем экспрессии HNF4α и дифференцировочным статусом клеток, мы исследовали уровни экспрессии регуляторов дифференцировки ПЖ в культурах AsPC1-shHNF4α методом ОТ-ПЦР (Рисунок 37). Рисунок 37. ОТ-ПЦР анализ экспрессии тканеспецифических регуляторов дифференцировки в клетках культур AsPC1-shHNF4α и контрольной культуры AsPC1-ref. Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. На Рисунке 37 приведены результаты ОТ-ПЦР анализа экспрессии основных панкреатических ТФ, регулирующих дифференцировку ПЖ. В отличие от ранее исследованных клеточных культур, подавление HNF4α в клетках AsPC1 не приводит к изменениям экспрессии 122 факторов PDX1, PTF1α и FOXA1. В то же время активность генов HNF1A и HNF4G в клетках AsPC1-shHNF4α снижается, а гена OC2 - повышается по сравнению с контрольной культурой. Однозначного влияния подавления HNF4α на экспрессию фактора FOXA2 не наблюдается: в клетках AsPC1-shHNF4α-2 его экспрессия падает, а в клетках AsPC1-shHNF4α-3 - усиливается по сравнению с AsPC1-ref. Активации экспрессии генов HNF1B и HNF6 в исследованных культурах не выявлено. Таким образом, подавление синтеза HNF4α в клетках AsPC1 не сопровождается настолько значительными изменениями экспрессии регуляторов дифференцировки панкреатических клеток, как при изменениях экспрессии HNF4α в клетках Panc1, MiaPaCa2 и CaPan2. Отсутствие изменений экспрессии PDX1 и PTF1A при подавлении HNF4α – наиболее важное отличие клеток AsPC1 от иследованных ранее культур. В случае культуры AsPC1shHNF4α-2 отсутствие таких изменений можно было бы объяснить невысокой эффективностью подавления HNF4α, однако в клетках AsPC1-shHNF4α-3 их также не наблюдается. Это наблюдение подтверждает сделанное ранее предположение о том, что HNF4α-зависимая регуляция этих генов происходит не напрямую, а опосредуется через другие регуляторные пути. Аналогичный результат наблюдается для гена FOXA1. Ранее, при исследовании клеток Panc1-HNF4α и MiaPaCa2-HNF4α, нами было сделано предположение о прямой HNF4αP2зависимой регуляции этого гена; в клетках AsPC1-shHNF4α это предположение не подтверждается. Снижение уровней экспрессии HNF1α в клетках AsPC1-shHNF4α по сравнению с контрольной культурой AsPC1-ref является ожидаемым изменением, поскольку промотор гена HNF1A напрямую регулируется HNF4α [Tian and Schibler, 1991; Odom et al., 2004]. Степень подавления его транскрипции коррелирует с эффективностью репрессии изоформ группы HNF4αP2 (Рисунок 34), что согласуется с описанной в клетках Panc1-HNF4α и MiaPaCa2HNF4α индукцией HNF1α под действием HNF4αP2, но не HNF4αP1. Таким образом, HNF4αP2зависимая регуляция активности гена HNF1A наблюдается во всех исследованных клеточных линиях ПАКПЖ и с большой долей вероятности является важным механизмом регуляции экспрессии HNF1α в панкреатических клетках. AsPC1 – единственная из исследованных линий ПАКПЖ, в которой при репрессии HNF4α изменилась активность гена HNF4G. На сегодняшний день HNF4α-зависимые изменения экспрессии HNF4γ описаны только в эпителии кишечника: при нокауте HNF4α наблюдается компенсаторное усиление синтеза HNF4γ [Cattin et al., 2009]. Однако в исследованных культурах ПАКПЖ подавление HNF4α либо не сопровождается значимыми изменениями экспрессии HNF4γ (CaPan2-shHNF4α), либо приводит к понижению уровней 123 экспрессии этого фактора (AsPC1-shHNF4α). Вероятно, механизмы, регулирующие экспрессию HNF4γ в панкреатических клетках, отличаются от таковых в клетках эпителия кишечника. Итак, мшРНК-опосредованное подавление синтеза HNF4α в клетках AsPC1, в отличие от культуры CaPan2, не оказывает ярко выраженного влияния на дифференцировочный статус этих клеток. Для более точной оценки влияния снижения экспрессии HNF4α на уровень дифференцировки клеток AsPC1 необходимо проанализировать возможные изменения активности функциональных генов в клетках AsPC1-shHNF4α. 4.6.5. Исследование изменений экспрессии функциональных панкреатических генов в клетках AsPC1-shHNF4α. Ввиду того, что подавление синтеза HNF4α неоднозначно влияет на экспрессию регуляторов дифференцировки ПЖ в клетках AsPC1, мы провели ОТ-ПЦР анализ уровней экспрессии функциональных генов в клетках AsPC1-ref и AsPC1-shHNF4α (Рисунок 38). Рисунок 38. ОТ-ПЦР анализ экспрессии функциональных генов в клетках культур AsPC1-shHNF4α и контрольной культуры AsPC1-ref. Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – названия исследованных культур, справа – длины ПЦР-продуктов в п. н. Подавление синтеза HNF4α в клетках AsPC1 вызывает активацию гена панкреатической α-амилазы-2a, обратно пропорциональную степени репрессии HNF4α. Экспрессия эластазы-2a не детектируется ни в AsPC1-shHNF4α, ни в контрольных клетках. Клетки AsPC1-shHNF4α 124 характеризуются сниженным по сравнению с контрольной культурой уровнем транскрипции Eкадхерина и значительным повышением экспрессии N-кадхерина. Помимо этого, снижение уровня синтеза HNF4α в клетках AsPC1 приводит к усилению экспрессии гена CDKN1A. Выявленные HNF4α-зависимые изменения экспрессии функциональных генов в клетках AsPC1-shHNF4α значительно отличаются от закономерностей, описанных при исследовании культур Panc1-HNF4α, MiaPaCa2-HNF4α и CaPan2-shHNF4α. Так, активность гена AMY2A в клетках AsPC1-shHNF4α существенно повышена по сравнению с контрольными клетками. Уровень активации гена AMY2A коррелирует со степенью подавления HNF4α, что может свидетельствовать о существовании непрямого регуляторного механизма (сайта связывания HNF4α в регуляторном районе гена AMY2A не выявлено). Кроме того, не наблюдается корреляций между уровнем экспрессии α-амилазы-2a и уровнями экспрессии двух важных регуляторов гена AMY2A – FOXA2 и PTF1α, которые могли бы опосредовать HNF4α-зависимую регуляцию этого гена [Cockell et al., 1995]. Как было показано выше, в клетках MiaPaCa2 обе группы изоформ HNF4α способны индуцировать экспрессию α-амилазы-2a, поэтому наблюдаемый эффект невозможно объяснить понижением синтеза изоформ HNF4αP1, нехарактерных для нормальных панкреатических клеток. Несоответствие изменений экспрессии генов, наблюдаемых в клетках AsPC1-shHNF4α, закономерностям, описанным на других системах, наблюдаются и в случае генов CDH1 и CDH2, кодирующих белки межклеточных адгезионных контактов E-и N-кадхерин, соответственно. Подавление экспрессии HNF4α в клетках AsPC1 приводит к ослаблению экспрессии E-кадхерина и усилению – N-кадхерина. В клетках Panc1 и CaPan2 экзогенная экспрессия HNF4αP2 приводила к активации гена CDH2, а его подавление – к ослаблению экспрессии N-кадхерина, в то время как значительных изменений экспрессии E-кадхерина не происходило. Следует, однако, отметить, что клетки AsPC1 изначально обладают фибробластоподобной морфологией и не образуют выраженных межклеточных контактов, поэтому снижение экспрессии CDH1 нельзя однозначно трактовать как ослабление эпителиальных свойств. HNF4α-зависимые изменения экспрессии p21CIP1/WAF1 в клетках AsPC1-shHNF4α также противоположны наблюдаемым в культурах MiaPaCa2-HNF4α и CaPan2-shHNF4α: подавление синтеза HNF4α сопровождается не снижением, а усилением активности гена CDKN1A. Это наблюдение тем более неожиданно, что в отличие от большинства исследуемых генов, ген CDKN1A может напрямую активироваться фактором HNF4α в клетках карциномы кишечника HCT116 и эмбриональной карциномы F9 [Chiba et al., 2005; Grigo et al., 2008; Hwang-Verslues and Sladek, 2008]. HNF4α-зависимая активация экспрессии p21CIP1/WAF1 наблюдается в клетках 125 MiaPaCa2. Однако результаты, полученные при исследовании клеток AsPC1-shHNF4α, свидетельствуют о том, что снижение изначально высокого уровня синтеза HNF4α в клетках ПАКПЖ также может сопровождаться усилением активности гена CDKN1A. Повышение экспрессии p21CIP1/WAF1 при подавлении HNF4α описано нами впервые и может указывать на то, что гиперэкспрессия HNF4α в клетках ПАКПЖ связана с усилением их злокачественных характеристик. Описанные изменения активности функциональных генов, наблюдающиеся в клетках AsPC1-shHNF4α, характеризуют функции HNF4α в клетках ПАКПЖ с новой стороны. Снижение экспрессии E-кадхерина и активация N-кадхерина при подавлении синтеза HNF4α согласуются с выдвинутой ранее гипотезой об опухоле-супрессорной роли HNF4α в протоковых панкреатических клетках. Однако значительное повышение уровней экспрессии αамилазы-2a и p21CIP1/WAF1, наоборот, могут свидетельствовать о повышении уровня дифференцировки клеток AsPC1-shHNF4α и возможной реверсии таких злокачественных изменений, как усиленная пролиферация и подавление апоптоза. В свете этих фактов возникает новое предположение о том, что повышенный по сравнению с нормальной панкреатической тканью уровень экспрессии HNF4α в опухолевых клетках ПЖ способен стимулировать их прогрессию. Подобные закономерности наблюдаются в некоторых случаях опухолей кишечника и желудка: гиперэкспрессия группы HNF4αP1 или обеих групп изоформ HNF4α может являться неблагоприятным прогностическим фактором, в то время как подавление экспрессии HNF4α приводит к ослаблению злокачественности опухолевых клеток кишечного эпителия [Schwartz et al., 2009; Darsigny et al., 2010]. Усиление синтеза HNF4α описано в клетках PanIN [Kim et al., 2013]. Вероятно, наибольшее влияние на свойства клеток AsPC1 оказывает экспрессия изоформ группы HNF4αP1, нехарактерная для нормальных клеток ПЖ. Таким образом, подавление синтеза фактора HNF4α в клетках AsPC1 приводит к неоднозначным изменениям дифференцировочного статуса этих клеток и свидетельствует о том, что роль HNF4α в клетках ПАКПЖ может не ограничиваться функциями опухолевого супрессора. Для более детального исследования роли HNF4α в регуляции клеточных свойств культур AsPC1-ref и AsPC1-shHNF4α с этими клетками были проведены функциональные тесты, направленные на анализ их способностей к пролиферации, колониеобразованию и направленной миграции. 126 4.6.6. Влияние подавления синтеза HNF4α на биологические характеристики клеток AsPC1 Для исследования того, как подавление синтеза HNF4α влияет на злокачественный потенциал клеток AsPC1, были проанализированы скорость роста, ДНК-синтетическая активность, колониеобразующая и миграционная способности этих клеток. 4.6.6.1. Замедление роста культур AsPC1-shHNF4α in vitro В проведенных ранее экспериментах (Разделы 4.4.6.1 и 4.5.6.1) было показано, что экспрессия HNF4α подавляет скорость роста клеточных культур ПАКПЖ. Логично предположить, что подавление экспрессии HNF4α в клетках AsPC1 могло бы привести к повышению скорости их роста. Однако исследование кинетики роста культур с помощью набора «CyQUANT NF Cell Proliferation Assay Kit» (Invitrogen, США) выявило значительное замедление роста клеток AsPC1-shHNF4α по сравнению с контрольной линией (Рисунок 39). Относительное кол-во клеток 25 AsPС1-ref AsPC1-shHNF4α-2 20 AsPC1-shHNF4α-3 15 10 *** 5 *** 0 0 1 2 3 Время культивации, сут. *** *** 4 5 Рисунок 39. Кинетика роста клеток AsPC1-ref и AsPC1-shHNF4α. Данные нормированы относительно начального количества клеток. - p<0,001 (t-тест Стьюдента). Описанный результат не согласуется ни с выдвинутым предположением об усилении пролиферативной активности клеток ПАКПЖ при подавлении HNF4α, ни с литературными данными, указывающими на антипролиферативную функцию HNF4α в клетках печени, почки, кишечника и β-клетках ПЖ [Lazarevich et al., 2004; Erdmann et al., 2007; Grigo et al., 2008; Cattin et al., 2009; Bonzo et al., 2012]. С другой стороны, в некоторых случаях подавление экспрессии HNF4α может приводить к ослаблению пролиферативной активности клеток. Например, такой эффект наблюдается в клетках колоректальной карциномы HT29 [Schwartz et al., 2009]. Следует отметить, что для клеток кишечного эпителия, как и для культуры AsPC1, характерна 127 экспрессия обеих групп изоформ HNF4α [Tanaka et al., 2006]. Возможно, замедление роста при подавлении HNF4α в клетках AsPC1 и эпителиальных клетках кишечника определяется сходными механизмами, однако эта гипотеза требует детальной проверки. 4.6.6.2. Ослабление ДНК-синтетической активности клеток AsPC1 при подавлении синтеза HNF4α Наблюдаемое замедление роста клеток AsPC1-shHNF4α может быть вызвано как снижением их пролиферативной активности, так и увеличением частоты апоптоза. Влияние подавления HNF4α на пролиферацию клеток AsPC1 было исследовано по активности синтеза ДНК с использованием метода включении в нее 5-BrdU. Полученные результаты приведены на Доля клеток, меченых 5-BrdU Рисунке 40. 0,70 0,60 0,50 * 0,50 0,29 0,40 * 0,30 0,24 0,20 0,10 0,00 AsPC1-ref AsPC1shHNF4α-2 AsPC1shHNF4α-3 Рисунок 40. Включение 5-BrdU в ДНК клеток AsPC1-ref и AsPC1shHNF4α. - p<0,05 (U-тест Манна-Уитни). Доля клеток, находящихся в S-фазе и активно синтезирующих ДНК, в культурах AsPC1shHNF4α значительно снижена. Это указывает на повышение частоты ареста клеточного цикла в фазе G1. Вероятно, снижение пролиферативной активности клеток этих культур является основной причиной замедления их роста in vitro. Снижение доли клеток, переходящих из фазы G1 в фазу S в клетках AsPC1-shHNF4α коррелирует с повышением экспрессии негативного регулятора клеточной пролиферации p21CIP1/WAF1 [Luo et al., 1995; Chen et al., 1996]. Замедление роста клеток MiaPaCa2-HNF4α, описанное выше (Раздел 4.4.5, 4.4.6.1), также коррелировало с повышением активности гена CDKN1A, однако в этом случае индукция его экспрессии вызывалась усилением, а не подавлением активности HNF4α. Подавление HNF4α в клетках CaPan2, наоборот, приводило к снижению экспрессии p21CIP1/WAF1 и усилению их пролиферативного потенциала (Раздел 4.5.5 и 4.5.6.1). 128 Таким образом, подавление синтеза HNF4α в умеренно-дифференцированных клетках AsPC1 приводит к значительному снижению их пролиферативной активности – одного из важнейших параметров, определяющих злокачественность опухолевых клеток. 4.6.6.3. Снижение колониеобразующего потенциала клеток AsPC1-shHNF4α Снижение скорости роста культур опухолевых клеток, как правило, сопровождается ослаблением способности этих клеток к колониеобразованию, то есть формированию очага пролиферации из одиночных клеток. Снижение пролиферативной активности клеток AsPC1shHNF4α позволило нам предположить, что их клоногенный потенциал также будет понижен. Клоногенный тест, проведенный в соответствии с описанной в Разделе 6.19 методикой, показал, что подавление синтеза HNF4α в клетках AsPC1 сопровождается достоверным уменьшением количества колоний, образуемых ими в условиях высокого разведения (Рисунки 41 и 42). Количество колоний на чашке Рисунок 41. Типичные результаты клоногенного теста с культурами AsPC1-ref и AsPC1-shHNF4α. Разведение – 1000 клеток/чашку. Сверху указаны клеточные линии, снизу – количество колоний на чашке. 60 38,4 50 40 *** 30 13,9 20 *** 6,1 10 0 AsPC1-ref AsPC1shHNF4α-2 AsPC1shHNF4α-3 Рисунок 42. Среднее количество колоний, формируемых клетками культур AsPC1-ref и AsPC1-shHNF4α. - p<0,001 (t-тест Стьюдента). 129 Среднее количество колоний, образуемых клетками AsPC1, существенно понижается при подавлении в них синтеза HNF4α. Уменьшение колониеобразующей способности клеток AsPC1-shHNF4α, как и снижение их пролиферативной активности свидетельствует об ослаблении злокачественного потенциала. Результаты, полученные на этой модельной системе, указывают на то, что высокие уровни экспрессии HNF4α в клетках ПАКПЖ не всегда выполняют противоопухолевую функцию, а могут, наоборот, сочетаться с повышенной злокачественностью опухолевых клеток. 4.6.6.4. Усиление способности клеток AsPC1 к направленной миграции при подавлении синтеза HNF4α Ранее было показано, что изменения уровней экспрессии HNF4α в клетках ПАКПЖ могут оказывать влияние на их способность к направленной миграции. Исходя из гипотезы об опухоле-супрессорном действии HNF4α, мы предполагали, что этот фактор окажется негативным регулятором клеточной миграции. Однако проведенные тесты показали, что как повышение, так и понижение уровней синтеза HNF4α может приводить к усилению Количество клеток, мигрировавшх сквозь мембрану способности клеток ПАКПЖ к направленной миграции (Разделы 4.4.6.4 и 4.5.6.4). 500 * 370,02 400 * 300 154,87 200 100 15,87 0 AsPC1-ref AsPC1shHNF4α-2 AsPC1shHNF4α-3 Рисунок 43. Среднее количество клеток культур AsPC1-ref и AsPC1shHNF4α, мигрировавших сквозь мембрану камеры Бойдена. - p<0,05 (Uтест Манна-Уитни). Согласно результатам миграционного теста (Рисунок 43), подавление синтеза HNF4α в клетках AsPC1 приводело к значительному усилению их способности к направленной миграции. Наблюдаемые изменения плохо согласуются с описанным для клеток AsPC1shHNF4α ослаблением пролиферативного и клоногенного потенциала; повышение миграционной способности, как правило, означает усиление злокачественности опухолевых 130 клеток. Таким образом, в данном случае HNF4α проявляет свойства, характерные для опухолевого супрессора. Наблюдаемый в клетках AsPC1-shHNF4α комплекс изменений биологических свойств (замедление роста, ослабление колониеобразования, усиление миграции) аналогичен изменениям, вызываемым экзогенной экспрессией HNF4α в клетках MiaPaCa2. Анализируя изменения, вызванные экзогенной экспрессией HNF4α в клетках MiaPaCa2 и Panc1, мы предположили, что HNF4α-зависимое повышение их миграционного потенциала может осуществляться за счет индукции экспрессии PDX1; по литературным данным, гиперэкспрессия PDX1 в клетках ПАКПЖ приводит к усилению их способности к миграции и инвазии [Koizumi et al., 2003; Liu et al., 2011]. Однако это предположение не объясняет изменения, наблюдающиеся в клетках AsPC1-shHNF4α: изменения экспрессии PDX1 в них не наблюдается. Единственный из исследованных регуляторов дифференцировки панкреатических клеток, для которого наблюдаются однонаправленные изменения в клетках Panc1-HNF4α, MiaPaCa2HNF4α и AsPC1-shHNF4α – фактор OC-2. Стоит отметить, что в клетках CaPan2-shHNF4α-3, в которых повышение миграционной способности по сравнению с CaPan2-ref наиболее выражено, также наблюдается повышение экспрессии гена OC2. Возможно, фактор OC-2 является значимым элементом системы регуляции миграционных свойств клеток ПАКПЖ. Другим важным регуляторным фактором, изменения которого сходны в AsPC1-shHNF4α и MiaPaCa2-HNF4α, является p21CIP1/WAF1 – один из ключевых регуляторов клеточного цикла и апоптоза. Ранее уже отмечалась корреляция экспрессии p21CIP1/WAF1 с изменениями пролиферативной активности и скорости роста исследованных культур. На сегодняшний день регуляция экспрессии гена CDKN1A представляется наиболее вероятным механизмом влияния HNF4α на клеточную пролиферацию [Chiba et al., 2005; Grigo et al., 2008; Hwang-Verslues and Sladek, 2008]. Однако в последнее время появляется все больше свидетельств того, что p21CIP1/WAF1 способен влиять не только на пролиферацию и апоптоз, но и на многие другие клеточные процессы: перестройку цитоскелета, экспрессию генов, дифференцировку, аутофагию. При этом он может проявлять свойства как опухолевого супрессора, так и онкогена [Warfel and El-Deiry, 2013]. Предполагается, что функция p21CIP1/WAF1 зависит от его внутриклеточной локализации: в то время как внутри клеточного ядра он действует как ингибитор циклин-зависимых киназ CDK1 и CDK2, в цитоплазме этот фактор способен подавлять апоптоз и вызывать перестройки актинового цитоскелета [Luo et al., 1995; Asada, 1999; Besson, 2004; Lee, 2004; Romanov, 2011]. Кроме того, повышение экспрессии p21CIP1/WAF1 наблюдается во многих образцах PanIN, причем является одним из самых ранних событий в развитии ПАКПЖ [Biankin et al., 2001]. Возможно, повышение экспрессии p21CIP1/WAF1 является важным механизмом, опосредующим наблюдаемые в клетках MiaPaCa2-HNF4α и AsPC1- 131 shHNF4α изменения их пролиферативного, клоногенного и миграционного потенциала. Индукция транскрипции гена CDKN1A, вероятно, приводит к увеличению количества белка p21CIP1/WAF1 как в ядре, где он подавляет пролиферацию, так и в цитоплазме, где он влияет на цитоскелет и усиливает миграционную способность клеток. Итак, изменения уровней экспрессии генов и биологических свойств, наблюдаемые в умереннодифференцированных клетках AsPC1 при подавлении в них экспрессии HNF4α, не позволяют сделать однозначных выводов о роли HNF4α в этой модельной системе. С одной стороны, клетки AsPC1 с подавленным синтезом HNF4α проявляют большую миграционную активность, в них понижаются уровни экспрессии HNF1α и E-кадхерина – эти изменения согласуются с гипотезой о противоопухолевой функции HNF4α. С другой стороны, подавление HNF4α в клетках AsPC1-shHNF4α ослабляет их пролиферативную активность и колониеобразующую способность, стимулирует экспрессию фактора OC-2 и панкреатической α-амилазы-2a, что указывает на его онкогенные свойства. По всей видимости, гиперэкспрессия изоформ HNF4α в клетках ПАКПЖ способна усиливать их злокачественность. Таким образом, в умереннодифференцированных клетках ПАКПЖ HNF4α может проявлять как функцию опухолевого супрессора, так и онкогена. 132 4.7. ИССЛЕДОВАНИЕ УРОВНЕЙ ЭКСПРЕССИИ HNF4α И ДРУГИХ ТКАНЕСПЕЦИФИЧЕСКИХ ГЕНОВ В КЛИНИЧЕСКИХ ОБРАЗЦАХ ПАКПЖ ЧЕЛОВЕКА Итак, изменения уровней синтеза изоформ HNF4α в клеточных культурах ПАКПЖ могут влиять на уровни экспрессии многих панкреа-специфических генов, кодирующих важные регуляторы дифференцировки клеток ПЖ, в частности, PDX1, PTF1α, факторы семейств HNF1, FOXA2 и ONECUT. Экзогенная экспрессия HNF4α в дедифференцированных клетках Panc1 и MiaPaCa2 приводит к их частичной редифференцировке, а подавление синтеза HNF4α в высокодифференцированных клетках CaPan2 ассоциировано с понижением уровней экспрессии тканеспецифических генов. Эти и другие HNF4α-зависимые изменения свойств клеток ПАКПЖ были описаны in vitro. Для того чтобы проверить, соответствуют ли обнаруженные закономерности процессам, происходящим в ткани ПАКПЖ in vivo, мы исследовали ряд образцов ткани ПАКПЖ, полученных при проведении гастропанкреатодуоденальных резекций (ГПДР) в отделении опухолей печени и поджелудочной железы НИИ клинической онкологии ФГБУ «РОНЦ им. Н. Н. Блохина» РАМН. Для исследования нами была выбрана панель из 21 образца опухолевой ткани ПАКПЖ (далее обозначены ОП). Параллельно с образцами опухолей были проанализированы образцы прилежащей неопухолевой ткани ПЖ, взятые у тех же пациентов (далее обозначены ПТ). В роли дополнительного контроля был использован образец условно нормальной ткани ПЖ, взятый у пациента без опухолей ПЖ (далее обозначен УН). В этих образцах были исследованы уровни экспрессии групп изоформ HNF4α и ряда тканеспецифических генов, для которых наблюдались HNF4α-зависимые изменения в исследованных клеточных культурах. 4.7.1. Анализ уровней экспрессии HNF4α и групп его изоформ в панели клинических образцов ПАКПЖ На первом этапе анализа в описанной панели образцов с помощью количественного ОТПЦР в реальном времени были исследованы общий уровень экспрессии HNF4α и уровни экспрессии групп изоформ HNF4αP1 и HNF4αP2. В качестве внутреннего контроля количества кДНК в реакционной смеси был использован ген PPIA. Определенные в ходе ПЦР-РВ уровни экспрессии HNF4ATOT, HNF4AP1 и HNF4AP2 пересчитывали относительно уровня экспрессии PPIA в соответствующих образцах. Результаты проведенного анализа обощены на Рисунке 44. 133 Рисунок 44. Уровни экспрессии HNF4ATOT, HNF4AP1 и HNF4AP2 в образцах ткани ПАКПЖ и неопухолевой ткани тех же пациентов. Указаны медианы, нижние и верхние квартили, минимальные и максимальные значения. ПТ – прилежащая неопухолевая ткань, ОП – опухолевая ткань. - p<0,01, - p<0,001 (парный t-тест для связанных выборок). 134 Как видно из приведенных на Рисунке 44 диаграмм, для ткани ПАКПЖ характерно значительное снижение уровней экспрессии HNF4ATOT и HNF4AP2 по сравнению с прилежащей неопухолевой тканью ПЖ тех же пациентов. В то же время в образцах ОП происходит достоверное усиление экспрессии изоформ группы HNF4αP1. Таким образом, изменения экспрессии изоформ HNF4α часто наблюдаются в клинических образцах ПАКПЖ человека. Более детально изменения экспрессии изоформ HNF4α в образцах опухолей по сравнению с прилежащей тканью приведены на Рисунке 45 и рассмотрены ниже. Рисунок 45. Изменения экспрессии HNF4AP1, HNF4AP2 и HNF4ATOT в образцах ткани ПАКПЖ по сравнению с соответствующей неопухолевой тканью. ОП – опухолевая ткань, ПТ – прилежащая неопухолевая ткань. - p<0,05 (U-тест МаннаУитни). Экспрессия изоформ группы HNF4αP1 в исследованных образцах неопухолевой ткани ПЖ, как и в нормальной панкреатической ткани, чрезвычайно низка. В 13 из рассмотренных случаев (62%) происходит достоверное усиление экспрессии HNF4αP1 в опухолевой ткани. Снижение экспрессии изоформ группы Р1 в опухолевой ткани наблюдается крайне редко (2 случая (10%)), в 6 случаях (28%) значимых изменений экспрессии HNF4αP1 не выявлено. 135 Закономерности экспрессии HNF4αTOT и группы изоформ HNF4αP2, характерной для клеток ПЖ, в исследованных образцах очень близки. Экспрессия HNF4αP2 значительно снижается в 15 образцах (71%) опухолевой ткани, в 14 из них (67%) это снижение совпадает со снижением общего количества HNF4α. В 4 случаях (19%) достоверных изменений экспрессии HNF4αP2 и HNF4αTOT в опухоли по сравнению с прилежащей тканью не выявлено. В образце ОП 15 небольшое достоверное подавление HNF4αP2 не приводит к статистически значимому снижению экспрессии HNF4αTOT, возможно, из-за значительного повышения экспрессии HNF4αP1. Гиперэкспрессия HNF4αTOT и HNF4αP2 наблюдается в 2 опухолевых образцах (10%). Полученные результаты указывают на то, что наиболее распространенным типом нарушения функции HNF4α в ткани ПАКПЖ является снижение экспрессии HNF4αP2 по сравнению с прилежащей неопухолевой тканью. Высокая корреляция между уровнями экспрессии HNF4αP2 и HNF4αTOT согласуется с тем, что изоформы HNF4αP2 являются доминирующей группой изоформ в клетках ПЖ. В недавно опубликованной работе повышение синтеза HNF4α описано в PanIN и высокодифференцированных участках ткани ПАКПЖ, в то время как в областях опухолей с низкой дифференцировкой синтез HNF4α подавлен [Kim et al., 2013]. Возможно, в исследованной нами выборке высокая частота снижения экспрессии HNF4α в опухолевой ткани объясняется тем, что из-за трудности ранней диагностики ПАКПЖ большая часть обнаруженных опухолей характеризуется низким уровнем дифференцировки. Усиление экспрессии HNF4α в образцах ОП наблюдается только в 2 случаях из 21. Другим типом изменения экспрессии HNF4α в клетках ПАКПЖ является активация экспрессии изоформ группы HNF4αP1, несвойственных для нормальных клеток ПЖ. Такая активация наблюдается более чем в 60% исследованных случаев ПАКПЖ. Повышение уровня экспрессии HNF4αP1 может происходить одновременно с ослаблением экспрессии изоформ HNF4αP2 (9 случаев, с 7 по 15). Однако даже в случае значительного повышения уровня экспрессии HNF4αP1 в образцах опухолевой ткани по сравнению с прилежащей (например, образцы ОП 11 и 21), вклад этой группы изоформ в общий уровень экспрессии HNF4α остается незначительным по сравнению с HNF4αP2. Ранее при исследовании роли HNF4α в развитии и прогрессии ГК в нашей лаборатории была сформулирована гипотеза о том, что ранние стадии прогрессии этого типа опухолей характеризуются активацией экспрессии изоформ группы HNF4αP2, нехарактерных для нормальных гепатоцитов. Дальнейшая прогрессия и дедифференцировка ГК сопровождается подвалением экспрессии обеих групп изоформ HNF4α [Lazarevich et al., 2004; Lazarevich et al., 2010]. По всей видимости, сходные закономерности могут наблюдаться при развитии ПАКПЖ. 136 Так, для умеренно-дифференцированных клеток AsPC1 характерна активация экспрессии изоформ HNF4αP1, а для низкодифференцированных Panc1 и MiaPaCa2 – полное подавление HNF4α (см. Разделы 4.1, 4.3). Высокая частота повышения экспрессии HNF4αP1 в клинических образцах ПАКПЖ указывает на то, что активация транскрипции нехарактерных изоформ может сопровождать прогрессию этого типа опухолей. Высокая частота подавления экспрессии HNF4αP2 в опухолевой ткани говорит о его возможной связи с процессом дедифференцировки ПАКПЖ. Далее мы проверили возможную связь изменений экспрессии изоформ HNF4α с дифференцировочным статусом образцов ткани ПАКПЖ. 4.7.2. Исследование корреляции между экспрессией изоформ HNF4α и панкреа-специфических генов в клинических образцах ПАКПЖ В предыдущих разделах работы было показано, что изменение уровня экспрессии HNF4α в клетках ПАКПЖ может приводить к значительным изменениям уровня их дифференцировки и экспрессии тканеспецифических генов. Зависимость уровня транскрипции от экспрессии HNF4α была описана для генов PDX1, PTF1A, HNF1A, FOXA1, FOXA2, OC2, AMY2A, ELA2A и CDKN1A. Чтобы проверить, насколько выявленные in vitro закономерности справедливы для клинических образцов ПАКПЖ человека, мы провели полуколичественный ОТ-ПЦР анализ экспрессии регуляторов дифференцировки и функциональных генов ПЖ в панели, включающей 21 пару образцов ткани ПАКПЖ и неопухолевой ткани, а также образец условно нормальной панкреатической ткани. На Рисунке 46 представлена репрезентативная панель из 9 пар проанализированных образцов и образца УН. Образцы выбраны таким образом, чтобы для каждого гена процентное соотношение вариантов изменения экспрессии было таким же, как и в полной панели из 21 пары образцов. Поэтому Рисунок 46 четко отражает тенденции, обнаруженные нами при исследовании полной панели. 137 Рисунок 46. ОТ-ПЦР анализ экспрессии панкреа-специфических регуляторов дифференцировки и функциональных генов в клинических образцах ПАКПЖ человека. Данные по экспрессии PPIA приведены для контроля количества кДНК, взятой в реакцию. Слева указаны названия генов, сверху – номера пар образцов, справа – длины ПЦР-продуктов в п. н. УН – условно нормальная ткань ПЖ, ОП – опухолевая ткань, ПТ – прилежащая неопухолевая ткань. Спектры экспрессии изоформ HNF4α, полученные с помощью полуколичественного ОТПЦР анализа, совпали с данными, полученными при количественном ОТ-ПЦР анализе в реальном времени. Следует отметить, что в большей части образцов экспрессию изоформ HNF4αP1 из-за недостаточной чувствительности метода детектировать не удалось. Это подтверждает сделанное ранее утверждение о чрезвычайно низком уровне экспрессии этих изоформ в панкреатических клетках и их малом вкладе в общий уровень экспрессии HNF4α. Как и в случае количественного анализа, общий уровень экспрессии HNF4α коррелирует с экспрессией HNF4αP2. В результате проведенного анализа был выявлен блок генов, уровни экспрессии которых значительно коррелируют с уровнями экспрессии изоформ HNF4α: HNF1A, HNF1B, FOXA2, PDX1, HNF6, AMY2A и ELA2A. Активность всех этих генов, за исключением HNF1A, прямо коррелирует с экспрессией изоформ HNF4αP2, но не HNF4αP1. Так, изменения экспрессии фактора HNF1β совпадают с изменениями HNF4αP2 в 100% случаев (21 из 21); FOXA2 – в 90% случаев (19 из 21); PDX1 – в 85% (18 из 21); HNF6 – в 95% (20 из 21); α-амилазы-2a и эластазы- 138 2a – в 76% (16 из 21). В случае HNF1α зависимость подчиняются более сложной схеме. В 8 образцах, в которых не наблюдается повышения экспрессии HNF4αP1, изменения HNF1α совпадают с изменениями HNF4αP2; в 9 из 13 опухолевых образцов с повышенным уровнем экспрессии изоформ HNF4αP1 экспрессия HNF1α не изменилась или повысилась по сравнению с прилежащей тканью. Уровни экспрессии OC-2 и p21 коррелируют с HNF4α в 43% (9 из 21) и 38% (8 из 21) случаев, соответственно, при этом четких зависимостей от уровней экспрессии отдельных групп изоформ HNF4α не прослеживается. Для гена FOXA1 корреляция с экспрессией HNF4α наблюдается только в 24% (5 из 21) случаев. Итак, анализ клинических образцов показал, что в них наблюдается значительное сходство паттернов экспрессии изоформ HNF4α и генов PDX1, HNF1A, HNF1B, FOXA2, HNF6, AMY2A и ELA2A. При этом для генов, кодирующих PDX1, HNF1α, FOXA2, α-амилазу-2a и эластазу-2a нами ранее была показана возможность HNF4α-зависимых изменений экспрессии в клеточных культурах ПАКПЖ (см. Разделы 4.4.4, 4.4.5, 4.5.4, 4.5.5, 4.6.4 и 4.6.5). Таким образом, полученные результаты подтверждают закономерности, наблюдающиеся для этих генов в экспериментах in vitro. Экспрессия HNF1α существенно зависит от того, какая группа изоформ HNF4α экспрессируется в ткани ПАКПЖ. Так, активация синтеза изоформ группы HNF4αP1 ассоциирована с сохранением или повышением активности гена HNF1A, несмотря на значительное снижение экспрессии HNF4αP2 (образцы 8, 12 и 14). Очевидно, изоформы группы HNF4αP1 являются более сильными активаторами экспрессии этого гена, чем HNF4αP2, как это описано в гепатоцитах [Tian and Schibler, 1991]. Это, однако, не объясняет, почему в клетках Panc1 и MiaPaCa2 экспрессия HNF1α индуцируется изоформами группы P2, но не P1. Возможно, HNF4αP1 в клетках ПЖ только усиливает экспрессию HNF1α, уже активированную изоформами группы HNF4αP2, но не может самостоятельно активировать ген HNF1A. Неожиданным результатом является очень высокая корреляция между HNF4αP2 и факторами HNF1β и HNF6. В проведенных ранее экспериментах нами не было обнаружено четкого влияния HNF4α на экспрессию этих ТФ. Более того, активность гена HNF6, необходимого для дифференцировки протоковых клеток, подавлена во всех исследованных клеточных культурах ПАКПЖ (включая высокодифференцированные клетки CaPan2) и не может быть индуцирована экзогенным HNF4α (см. Раздел 4.3 и 4.4.4). Вероятнее всего, в исследованных образцах изменения активности генов HNF4A, HNF1B и HNF6 вызываются действием общего вышестоящего регуляторного механизма, однако в данной работе этот аспект не исследовался. Частота инактивации HNF6 в исследованных нами образцах опухолей 139 составляет 81% (17 из 21), что согласуется с литературными данными и подтверждает значимость подавления HNF6 в развитии ПАКПЖ [Jiang et al., 2008]. Экспрессия α-амилазы-2a и эластазы-2a существенно понижается в 95% (20 из 21) всех исследованных опухолей, даже в тех случаях, когда уровень экспрессии HNF4α не изменяется или повышается (образцы 18 и 20). Этому может быть два объяснения. Первое – начавшийся процесс дедифференцировки ткани, в ходе которого первыми инактивируются гены, отвечающие за основные функции клеток, в данном случае – секрецию пищеварительных ферментов. Вторым объяснением может быть то, что в образцах прилежащей ткани содержится достаточно высокая доля ацинарных клеток, активно синтезирующих эти ферменты, в то время как опухолевая ткань образована трансформированными протоковыми клетками, в которых активность генов AMY2A и ELA2A изначально ниже, чем в ацинарных. Несмотря на то, что ранее нами были описаны HNF4α-зависимые изменения экспрессии генов FOXA1, OC2 и CDKN1A, анализ клинических образцов не выявил серьезных корреляций между уровнями экспрессии этих генов и HNF4α. По всей видимости, HNF4α может быть лишь одним из многих элементов регуляции экспрессии этих генов и не играет решающей роли в их активации. В особенности это касается гена CDKN1A, кодирующего p21CIP1/WAF1 – один из важнейших регуляторных белков клетки, экспрессия которого контролируется множеством сигнальных путей [Warfel and El-Deiry, 2013]. Итак, в исследованных образцах ПАКПЖ человека уровни экспрессии HNF4α находятся в прямой корреляции со многими регуляторами панкреатической дифференцировки. Подавление HNF4α по сравнению с условно нормальной тканью или образцами неопухолевой ткани ПЖ является частым событием в ПАКПЖ и сопровождается подавлением экспрессии генов PDX1, HNF1A, HNF1B, FOXA2, HNF6, AMY2A и ELA2A, в то время как гиперэкспрессия HNF4α может быть ассоциирована с повышенной экспрессией части панкреа-специфических генов (образец 20). Таким образом, изменения экспрессии изоформ HNF4α в ткани ПАКПЖ и прилежащей неопухолевой ткани связаны с изменениями уровня дифференцировки этой ткани. Высокие уровни экспрессии HNF4α наблюдаются в образцах с высоким или средним уровнем дифференцировки, в то время как подавление HNF4α ассоциировано со значительной дедифференцировкой ткани ПЖ. Описанные закономерности соответствуют изменениям, наблюдавшимся при изменении уровней экспрессии HNF4α в исследованных клеточных культурах ПАКПЖ, и, по всей видимости, достоверно отражают процессы, происходящие при прогрессии данного вида опухолей. 140 5. ЗАКЛЮЧЕНИЕ. Представленная работа посвящена исследованию возможной роли ядерного рецептора HNF4α в прогрессии ПАКПЖ человека и регуляции клеточных свойств, определяющих выраженность злокачественного фенотипа этого типа опухолей. В качестве модельной системы были использованы 4 клеточные линии ПАКПЖ человека, различающиеся уровнем дифференцировки и спектрами экспрессии изоформ HNF4α. В дедифференцированных линиях Panc1 и MiaPaCa2 были экзогенно экспрессированы изоформы HNF4α1 или HNF4α7; в высокодифференцированной линии CaPan2 и умереннодифференцированной линии AsPC1 экспрессия HNF4α была подавлена с помощью мшРНК, комплементарных к последовательности мРНК этого фактора. Для определения влияния изменения уровня HNF4α на свойства клеток ПАКПЖ в полученных культурах были проанализированы спектры экспрессии регуляторов дифференцировки и функциональных генов, а также исследованы пролиферативные, колониеобразующие и миграционные свойства этих клеток. Обнаруженные закономерности были верифицированы на панели клинических образцов ткани ПАКПЖ и прилежащей неопухолевой ткани тех же пациентов. Экзогенная экспрессия групп изоформ HNF4αP1 и HNF4αP2 в низкодифференцированных клеточных культурах Panc1 и MiaPaCa2 вызывает их частичную редифференцировку, выражающуюся в активации экспрессии генов, кодирующих важные регуляторы дифференцировки панкреатических клеток (HNF4α, PDX1, PTF1α, HNF1α, HNF1β, FOXA1, FOXA2, OC-2) и белок α-амилазу-2a, секретируемую экзокринными клеткам ПЖ. Помимо этого, в клетках MiaPaCa2-HNF4α наблюдается индукция экспрессии гена CDKN1A, кодирующего белок p21CIP1/WAF1, ингибирующий клеточную пролиферацию. HNF4α-зависимая активация генов PDX1, PTF1A, OC2 и AMY2A описана нами впервые и свидетельствует о HNF4α-зависимой регуляции процессов дифференцировки панкреатических клеток. Наблюдающаяся при этом реэкспрессия эндогенного HNF4α указывает на обратимость репрессии этого гена в дедифференцированных клетках ПАКПЖ и свидетельствует о том, что такая репрессия вызвана изменением активности сигнальных каскадов, лежащих выше HNF4α в цепи передачи внутриклеточных сигналов. Экспрессия HNF4α в клетках культур Panc1 и MiaPaCa2 вызывает снижение колониеобразующей способности, а в клетках культуры MiaPaCa2 также снижение скорости роста. В то же время экспрессия HNF4α в таких клетках сопровождается значительным усилением их способности к направленной миграции. Аналогичное изменение биологических свойств клеток в сочетании с одновременной экспрессией факторов PDX1 и PTF1α характерно для панкреатических клеток-предшественников, находящихся на стадии частичной 141 дифференцировки. По одной из современных теорий, протоковые клетки ПЖ являются мультипотентными, участвуют в регенерации ПЖ и обладают свойствами клеток- предшественников. Поэтому изменения, наблюдаемые в культурах Panc1-HNF4α и MiaPaCa2HNF4α, можно рассматривать как ослабление злокачественных свойств и частичную редифференцировку. Во второй части работы было исследовано влияние мшРНК-опосредованого подавления HNF4α на свойства высокодифференцированной культуры CaPan2. Подавление синтеза HNF4α в этих клетках приводит к снижению уровней транскрипции факторов PDX1, PTF1α, FOXA1, панкреатических белков α-амилазы-2a и эластазы-2a, что указывает на снижение уровня дифференцировки. Репрессия HNF4α в клетках CaPan2 вызывает также значительное подавление экспрессии онкосупрессорного белка p21CIP1/WAF1. Эти изменения согласуются с HNF4α-зависимыми изменениями экспрессии генов, описанными в первой части работы. Подавление экспрессии HNF4α в культуре CaPan2 вызывает увеличение скорости роста и усиление ДНК-синтетической активности, а также повышение колониеобразующего потенциала клеток, и повышение их способности к направленной миграции. Такие изменения клеточных свойств характерны для опухолевой прогрессии и свидетельствуют о том, что нарушение функции HNF4α в клетках CaPan2 приводит к усилению их злокачественности. Таким образом, инактивация HNF4α в клетках ПАКПЖ может рассматриваться как возможный механизм прогрессии этого вида опухолей, что подтверждает гипотезу об опухолесупрессорной роли фактора HNF4α в панкреатических клетках. Умереннодифференцированная линия AsPC1 характеризуетсяся повышенными уровнями экспрессии обеих групп изоформ HNF4αP1 и HNF4αP2 и ряда других регуляторов развития ПЖ по сравнению с нормальными тканями ПЖ. Подавление синтеза HNF4α в клетках AsPC1 не оказало однозначного влияния на их дифференцировочный статус: экспрессия генов PDX1, PTF1A, FOXA1 не изменилась, генов OC2 и AMY2A повысилась, а HNF1A и HNF4G – понизилась. Параллельно с этими изменениями произошло HNF4α-зависимое подавление экспрессии Е-кадхерина и активация гена CDH2, кодирующего N-кадхерин, значительно усилилась экспрессия p21CIP1/WAF1. Таким образом, четкого соответствия изменений, выявленных на этой модельной системе с закономерностями, описанными ранее в клетках Panc1, MiaPaCa2 и CaPan2, не наблюдается. Часть HNF4α-зависимых изменений экспрессии генов в клетках AsPC1 можно рассматривать как свидетельство повышения уровня дифференцировки, в то время как другие изменения указывают на ослабление эпителиального фенотипа клеток. Мы рассматриваем эти данные как указание на то, что повышенная экспрессия HNF4α в клетках ПАКПЖ может оказывать не только противо-, но и проопухолевые эффекты. 142 Клеточные культуры AsPC1 с подавленной экспрессией HNF4α отличаются от контрольных значительно сниженной скоростью роста, активностью синтеза ДНК и колониеобразующей способностью. В то же время миграционный потенциал клеток AsPC1 при подавлении в них синтеза HNF4α резко повышается. Наблюдаемые изменения биологических свойств клеток AsPC1-shHNF4α свидетельствуют о том, что подавление HNF4α приводит к усилению одних (миграция) и ослаблению других (пролиферация, клоногенность) злокачественных характеристик. Возможно, в зависимости от уровня экспрессии в клетках ПАКПЖ HNF4α может выполнять двоякую функцию – как опухолевого супрессора, так и фактора, гиперэкспрессия которого может стимулировать опухолевую прогрессию. По данным мировой литературы, представленная работа является первым указанием на возможность проопухолевого действия фактора HNF4α в панкреатических клетках: на данный момент всего три работы приводят данные об опухоле-стимулирующей роли HNF4α в клетках кишечного и желудочного эпителия. Выявленная в ходе исследования клеточных культур зависимость экспрессии ряда панкреатических генов (PDX1, HNF1A, HNF1B, FOXA2, AMY2A, ELA2A) от экспрессии HNF4α была подтверждена на панели клинических образцов ПАКПЖ и прилежащей неопухолевой ткани. В большинстве исследованных образцов наблюдаются нарушения нормальной экспрессии HNF4α: активация нехарактерной для нормальной панкреатической ткани группы изоформ HNF4αР1, гиперэкспрессия подавление обеих групп экспрессии изоформ изоформ HNF4α. группы Уровни HNF4αP2, экспрессии изредка других – генов, перечисленных выше, коррелируют с уровнями экспрессии HNF4α, причем характер корреляции согласуется с закономерностями, описанными в клеточных культурах ПАКПЖ. Итак, нарушение экспрессии изоформ HNF4α является частым событием в развитии ПАКПЖ. Для умереннодифференцированных клеток ПАКПЖ характерна гиперэкспрессия обеих групп изоформ HNF4α, в то время как значительная дедифференцировка клеток ассоциирована с подавлением экспрессии HNF4α. Фактор HNF4α является важным регулятором экспрессии генов, дифференцировки и биологических характеристик клеток ПАКПЖ и может обладать как онкосупрессорными, так и про-онкогенными функциями. По всей видимости, гиперэкспрессия изоформ HNF4α в опухолевых клетках может стимулировать прогрессию ПАКПЖ, в то время при «нормальном» уровне экспрессии этот белок обладает противоопухолевым действием. Дальнейшие исследования будут направлены на идентификацию HNF4α-респонсивных генов-мишеней и регуляторных механизмов, определяющих его влияние на формирование злокачественного потенциала протоковых клеток ПЖ. 143 6. ВЫВОДЫ 1. Нарушение экспрессии ядерного рецептора HNF4α является частым событием при протоковой аденокарциноме поджелудочной железы человека. Впервые описана его опухоле-супрессорная функция в клетках ПАКПЖ. 2. Экзогенная экспрессия двух групп изоформ HNF4αP1 и HNF4αP2 в культурах низкодифференцированных клеток ПАКПЖ человека Panc1 и MiaPaCa2 приводит к их частичной редифференцировке, выражающейся в активации экспрессии ключевых регуляторов дифференцировки панкреатических клеток PDX1, PTF1α, FOXA1, FOXA2 и OC-2, а также индукции синтеза панкреатической α-амилазы-2a. 3. Восстановление функции HNF4α в дедифференцированных культурах клеток ПАКПЖ человека Panc1 и MiaPaCa2 замедляет скорость роста этих культур и ослабляет их колониеобразующую активность, одновременно повышая способность к направленной миграции. 4. Подавление экспрессии HNF4α в высокодифференцированной культуре ПАКПЖ человека CaPan2 приводит к частичной дедифференцировке клеток и повышению их злокачественного потенциала, выражающемуся в ускорении роста клеток, усилении их колониеобразующей и миграционной активности. 5. При подавлении экспрессии HNF4α в умеренно-дифференцированных клетках ПАКПЖ человека AsPC1 значительно снижаются скорость роста и колониеобразующий потенциал клеток, в то время как миграционная способность резко возрастает. 6. Нарушение экспрессии HNF4α и связанного с ним блока панкреа-специфических генов являются частым событием в клинических образцах ПАКПЖ человека. Дерегуляция HNF4α может выражаться как в активации экспрессии нехарактерных для ПЖ изоформ группы HNF4αP1, так и в подавлении экспрессии изоформ группы HNF4αP2. 144 7. СПИСОК СОКРАЩЕНИЙ АА акриламид а. о. аминокислотный остаток бГК быстрорастущая гепатоцеллюлярная карцинома ВКМ внеклеточный матрикс ГК гепатоцеллюлярная карцинома ГПДР гастропанкреатодуоденальная резекция ГЯФ гепатоцитарный ядерный фактор ДНК дезоксирибонуклеиновая кислота ДСН додецилсульфат натрия мГК медленнорастущая гепатоцеллюлярная карцинома мшРНК малая шпилечная рибонуклеиновая кислота МЭП мезенхимально-эпителиальный переход ОТ обратная транскрипция ПААГ полиакриламидный гель ПАКПЖ протоковая аденокарцинома поджелудочной железы ПЖ поджелудочная железа ПСА персульфат аммония ПЦР полимеразная цепная реакция ПЦР-РВ полимеразная цепная реакция с детекцией в реальном времени РНК рибонуклеиновая кислота ТЕМЕД тетраметилэтилендиамин ТФ транскрипционный фактор ЭМП эпителиально-мезенхимальный переход ЭДТА этилендиаминтетраацетат натрия 5-BrdU 5-бромдезоксиуридин bHLH основной белок типа «спираль-петля-спираль» (basic «Helix-Loop-Helix») BRCA антиген опухолей молочной железы (Breast Cancer Antigen) BSA бычий сывороточный альбумин (Bovine Serum Albumin) CDH кадхерин (Cadherin) CDK циклин-зависимая киназа (Cyclin-Dependent Kinase) CDKN ингибитор циклин-зависимых киназ (Cyclin-Dependent Kinase Inhibitor) 145 COUP-TF транскрипционный фактор промотора альбумина цыпленка (Chicken Ovalbumin Upstream Promoter-Transcription Factor) С/EBP СААТ/энхансер-связывающий белок (CAAT/Enhancer Binding Protein) ERK киназа, регулируемая внеклеточными сигналами (Extracellular-Regulated Kinase) FGF фактор роста фибробластов (Fibroblast Growth Factor) FOX транскрипционный фактор типа «forkhead» («Forkhead» Box Protein) FSP белок, специфичный для фибробластов (Fibroblast-Specific Protein) GATA GATA-связывающий белок (GATA-Binding Protein) GLUT-2 переносчик глюкозы типа 2 (Glucose Transporter-2) HEX гомеобоксный белок, экспрессирующийся в кроветворных клетках (Hematopoietically Expressed Homeobox) HLX H2.0-подобный белок с гомеобоксом (H2.0-Like Homeobox Protein) HNF гепатоцитарный ядерный фактор (Hepatocyte Nuclear Factor) IPMN внутрипротоковая панкреатическая муцинозная неоплазия (Intraductal Pancreatic Mucinous Neoplasia) ISL белок, связывающийся с энхансером гена инсулина (Insulin Gene Enhancer Protein) KRAS онкоген крысиной саркомы Кирстена (Kirsten Rat Sarcoma Oncogene) MAF гомолог онкогена мускульно-апоневротической фибробластомы (MuscleAponeurotic Fibroblastoma Oncogene Homolog) MAPK митоген-активируемая протеинкиназа (Mitogen-Activated Protein Kinase) miR микро-рибонуклеиновая кислота (Micro-Ribonucleic Acid) MMP матриксная металлопептидаза (Matrix Metallopeptidase) MODY сахарный диабет взрослого типа у молодых (Maturity-Onset Diabetes of the Young) MUC Муцин (Mucin) MMLV мышиный вирус лейкемии Молони (Moloney Murine Leukemia Virus) NEUROD фактор нейрогенной дифференцировки (Neuronal Differentiation Factor) NF-κB ядерный фактор-энхансер κ-легких цепей активированных В-клеток (Nuclear Factor Kappa-Light-Chain-Enhancer of Activated B Cells) NKX гомеобоксный белок 2 типа NK2 (NK2 Homeobox Protein 2) NRG Нейрегулин (Neuregulin) OC транскрипционный фактор типа «ONECUT» («ONECUT» Trancription Factor) 146 PanIN панкреатическая внутрипротоковая неоплазия (Pancreatic Intraductal Neoplasia) PARP поли-(АДФ-рибоза)-полимераза (Poly-(ADP-Ribose)-Polymerase PAX белок со спаренными доменами (Paired Box Protein) PDX гомеобокс-белок поджелудочной железы и двенадцатиперстной кишки (Pancreas and Duodenum Homeobox Protein) PMSF Фенилметансульфонилфторид (phenylmethanesulfonylfluoride) PPIA пептидил-пролил-изомераза А, циклофилин A (Peptidyl-Prolyl Isomerase A) PTF панкреатический транскрипционный фактор (Pancreatic Transcription Factor) PVDF фторид поливинилидена (Polyvinylidenefluoride) SMAD SMA/MAD-родственный белок (SMA/MAD-related Protein) SNAI Белок с доменом «цинковые пальцы» семейства SNAIL (SNAIL Family Zinc Finger Protein) TCF транскрипционный фактор (TransCription Factor) TGFβ трансформирующий фактор роста β (Transforming Growth Factor β) TWIST Twist-подобный траснкрипционный фактор типа «спираль-петляспираль» (Twist-like «Helix-Loop-Helix» Transcription Factor) ZEB гомеобоксный белок с доменом «цинковые пальцы», связывающийся с Eбоксом (Zinc Finger E-box Binding Homeobox Protein) 147 8. СПИСОК ЛИТЕРАТУРЫ 1. Быков, В. Л. Частная гистология человека / Владимир Лазаревич Быков. – СПб. : СОТИС, 1999. — 301 с. : ил. 2. Заридзе, Д. Г. Канцерогенез / под ред. Г. Д. Заридзе. — М. : Медицина, 2004. – 576 с. : ил. 3. Интернет-база данных ATCC [электронный http://www.lgcstandards-atcc.org/?geo_country=ru. 4. Интернет-сервис NCBI BLAST http://blast.ncbi.nlm.nih.gov/Blast.cgi. 5. Интернет-сервис NCBI GenBank https://www.ncbi.nlm.nih.gov/genbank. 6. Интернет-сервис Primer3 http://bioinfo.ut.ee/primer3. 7. Лазаревич, Н. Л. Тканеспецифические транскрипционные факторы в прогрессии эпителиальных опухолей / Н. Л. Лазаревич, Д. И. Флейшман // Биохимия. — 2008. — Т. 73. — № 5. — С. 713-734. 8. Маев, И. В. Болезни поджелудочной железы. Практическое руководство / И. В. Маев, Ю. А. Кучерявый — М. : ГЭОТАР-Медиа, 2009. — 736 с. : ил. 9. Патютко, Ю. И. Хирургия рака органов билиопанкреатодуоденальной зоны / Ю. И. Патютко, А. Г. Котельников. — М. : Медицина, 2007. — 448 с. 10. Сапин, М. Р. Анатомия человека: В двух томах / Э. И. Борзяк, Л. И. Волкова, Е. А. Добровольская, В. С. Ревазов, М. Р. Сапин; под ред. М. Р. Сапина. — М. : Медицина, 1993. — 2 т. 11. Уоткинс, П. Дж. Сахарный диабет / Питер Дж. Уоткинс; под ред. М. И. Балаболкина. — Пер. с англ. М. : Бином, 2006. — 134 с. : ил. 12. Хендерсон, Дж. М. Патофизиология органов пищеварения / Джозеф М. Хендерсон; под ред. Ю. В. Наточина. — Пер. с англ. М. : Бином, 1997. — 272 с. : ил. 13. Чесноков, М. С. Влияние экзогенной экспрессии ядерного рецептора HNF4α на свойства клеток протоковой аденокарциномы поджелудочной железы человека / М. С. Чесноков, Д. А. Шавочкина, И. Ф. Кустова с соавт. // Цитология. — 2012. — Т. 54. — № 1. — С. 99-100. 14. Чесноков, М.С. Молекулярные биомаркеры протоковой аденокарциномы поджелудочной железы и возможности их использования в клинической практике / М. С. Чесноков, Д. А. Шавочкина, А. Д. Горев, Н.Л. Лазаревич // Молекулярная Медицина. — 2013. — № 6. — С. 21-26. 15. Afelik, S. Combined ectopic expression of Pdx1 and Ptf1a/p48 results in the stable conversion of posterior endoderm into endocrine and exocrine pancreatic tissue / S. Afelik, Y. Chen, T. Pieler // Genes Dev. — 2006. — Т. 20 — № 11. — С. 1441-1446. 16. Almoguera, C. Most human carcinomas of the exocrine pancreas contain mutant c-K-ras genes. / C. Almoguera, D. Shibata, K. Forrester et al. // Cell. — 1988. — Т. 53. — № 4. — С. 549-554. 17. Asada, M. Apoptosis inhibitory activity of cytoplasmic p21(Cip1/WAF1) in monocytic differentiation / M. Asada, T. Yamada, H. Ichijo et al. // EMBO J. — 1999. — Т. 18. — № 5. — С. 1223-1234. 18. Babeu, J. P. Hepatocyte nuclear factor 4alpha contributes to an intestinal epithelial phenotype in vitro and plays a partial role in mouse intestinal epithelium differentiation / J. P. Babeu, M. [электронный [электронный [электронный ресурс] // режим доступа: ресурс] // режим доступа: ресурс] // режим доступа: ресурс] // режим доступа: 148 Darsigny, C. R. Lussier, F. Boudreau // — Am. J. Physiol. Gastrointest. Liver. Physiol. — 2009. — Т. 297. — № 1. — С. G124-G134. 19. Bachet, J. B. Contribution of CXCR4 and SMAD4 in predicting disease progression pattern and benefit from adjuvant chemotherapy in resected pancreatic adenocarcinoma / J. B. Bachet, R. Maréchal, P. Demetter et al. // Ann. Oncol. — 2012. — Т. 23. — № 9. — С. 2327-2335. 20. Bailly, A. An enhancer element 6 kb upstream of the mouse HNF4alpha1 promoter is activated by glucocorticoids and liver-enriched transcription factors / A.Bailly, M. E. Torres-Padilla, A. P. Tinel, M. C, Weiss // Nucleic Acids Res. — 2001. — Т. 29. — № 17. — С. 3495-3505. 21. Ballehaninna, U. K. The clinical utility of serum CA 19-9 in the diagnosis, prognosis and management of pancreatic adenocarcinoma: An evidence based appraisal / U. K. Ballehaninna, R. S. Chamberlain // J. Gastrointest. Oncol. — 2012. — Т. 3. — № 2. — С. 105-119. 22. Ban, N. Hepatocyte nuclear factor-1alpha recruits the transcriptional co-activator p300 on the GLUT2 gene promoter / N. Ban, Y. Yamada, Y. Someya et al. // Diabetes. — 2002. — Т. 51. — № 5. — С. 1409-1418. 23. Barbacci, E. Variant hepatocyte nuclear factor 1 is required for visceral endoderm specification / E. Barbacci, M. Reber, M. O. Ott et al. // Development. — 1999. — Т. 126. — № 21. — С. 4795-4805. 24. Bartoov-Shifman, R. Activation of the insulin gene promoter through a direct effect of hepatocyte nuclear factor 4 alpha / R. Bartoov-Shifman, R. Hertz, H. Wang et al. // J. Biol. Chem. — 2002/ — Т. 277. — № 29. — С. 25914-25919. 25. Battle, M. A. Hepatocyte nuclear factor 4alpha orchestrates expression of cell adhesion proteins during the epithelial transformation of the developing liver / M. A. Battle, G. Konopka, F. Parviz et al. // Proc. Natl. Acad. Sci. USA. — 2006. — Т. 103. — № 22. — С. 8419-8424. 26. Beckers, D. Neonatal cholestatic jaundice as the first symptom of a mutation in the hepatocyte nuclear factor-1beta gene (HNF-1beta) / D. Beckers, C. Bellanné-Chantelot, M. Maes // J. Pediatr. — 2007. — Т. 150. — № 3. — С. 313-314. 27. Bellanné-Chantelot, C. Clinical spectrum associated with hepatocyte nuclear factor-1beta mutations / C. Bellanné-Chantelot, D. Chauveau, J. F. Gautier et al. // Ann. Intern. Med. — 2004. — Т. 140. — № 7. — С. 510-517. 28. Besson, A. Regulation of the cytoskeleton: an oncogenic function for CDK inhibitors? / A. Besson, R. K. Assoian, J. M. Roberts // Nat. Rev. Cancer. — 2004. — Т. 4. — № 12. — С. 948955. 29. Biankin, A. V. Overexpression of p21(WAF1/CIP1) is an early event in the development of pancreatic intraepithelial neoplasia / A. V. Biankin, J. G. Kench, A. L. Morey et al. // Cancer Res. — 2001. — Т. 61. — № 24. — С. 8830-8837. 30. Biankin, A. V. DPC4/Smad4 expression and outcome in pancreatic ductal adenocarcinoma / A. V. Biankin, A. L. Morey, C. S. Lee et al. // J. Clin. Oncol. — 2002. — Т. 20. — № 23. — С. 4531-4542. 31. Boj, S. F. A transcription factor regulatory circuit in differentiated pancreatic cells / S. F. Boj, M. Parrizas, M. A. Maestro, J. Ferrer // Prot. Natl. Acad. Sci. USA. — 2001. — Т. 98. — № 25. — С. 14481-14486. 32. Bolotin, E. Integrated Approach for the Identification of Human Hepatocyte Nuclear Factor 4 Target Genes Using Protein Binding Microarrays / E. Bolotin, H. Liao, T. C. Ta et al. // Hepatology. — 2010. — Т. 51. — № 2. — С. 642-653. 33. Bonner-Weir, S. Pancreatic stem cells / S. Bonner-Weir, A. Sharma. J. Pathol. — 2002. — Т. 197. — № 4. — С. 519-526. 149 34. Bonner-Weir, S. A second pathway for regeneration of adult exocrine and endocrine pancreas. A possible recapitulation of embryonic development / S.Bonner-Weir, L. A. Baxter, G. T. Schuppin, F. E. Smith // Diabetes. — 1993. — Т. 42. — № 12. — С. 1715-1720. 35. Bonner-Weir, S. Transdifferentiation of pancreatic ductal cells to endocrine beta-cells / S. Bonner-Weir, A. Inada, S. Yatoh et al. // Biochem. Soc. Trans. — 2008. — Т. 36. — № 3. — С. 353-356. 36. Bonzo, J. A. Suppression of hepatocyte proliferation by hepatocyte nuclear factor 4α in adult mice / J. A. Bonzo, C. H. Ferry, T. Matsubara et al. // J. Biol. Chem. — 2012. — Т. 287. — № 10. — С. 7345-7356. 37. Bort, R. Paths to the pancreas / R. Bort, K. Zaret // Nat. Genet. — 2002. — Т. 32. — № 1. — С. 85-86. 38. Boucher, M. J. The homeodomain-interacting protein kinase 2 regulates insulin promoter factor1/pancreatic duodenal homeobox-1 transcriptional activity / M. J. Boucher, M. Simoneau, H. Edlund // Endocrinology. — 2009. — Т. 150. — № 1. — С. 87-97. 39. Briancon, N. Expression of the α7 Isoform of Hepatocyte Nuclear Factor (HNF) 4 Is Activated by HNF6/OC-2 and HNF1 and Repressed by HNF4α 1 in the Liver / N. Briancon, A. Bailly, F. Clotman et al. // J. Biol. Chem. — 2004. — Т. 279. — № 32. — С. 33398–33408. 40. Brooke, N. M. The parahox gene cluster is an evolutionary sister of the hox gene cluster / N. M. Brooke, J. Garcia-Fernandez, P. W. Holland // Nature. — 1998. — Т. 392. — № 6679. — С. 920–922. 41. Burlison, J. S. (2008) Pdx-1 and Ptf1a concurrently determine fate specification of pancreatic multipotent progenitor cells / J. S. Burlison, Q. Long, Y. Fujitani et al. // Dev. Biol. — 2008. — Т. 316. — № 1. — С. 74-86. 42. Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye / A. Caicedo // Semin. Cell Dev. Biol. — 2013. — Т. 24. — № 1. — С. 11-21. 43. Cano, A. The transcription factor snail controls epithelial-mesenchymal transitions by repressing E-cadherin expression / A. Cano, M. A. Pérez-Moreno, I. Rodrigo et al. // Nat. Cell. Biol. — 2000. — Т. 2. — № 2. — 76-83. 44. Carew, J. A. A new mutation in the HNF4 binding region of the factor VII promoter in a patient with severe factor VII deficiency / J. A. Carew, E. S. Pollak, S. Lopaiciuk, K. A. Bauer // Blood. — Т. 96. — № 13. — С. 4370-4372. 45. Casas, E. Snail2 is an essential mediator of Twist1-induced epithelial mesenchymal transition and metastasis / E. Casas, J. Kim, A. Bendesky et al. // Cancer Res. — 2011. — Т. 71.— № 1. — С. 245-254. 46. Cattin, A. L. Hepatocyte nuclear factor 4alpha, a key factor for homeostasis, cell architecture, and barrier function of the adult intestinal epithelium / A. L. Cattin, J. Le Beyec, F. Barreau et al. // Mol. Cell. Biol. — Т. 29. — № 23. — С. 6294-6308. 47. Chalasani P. Response to a third-line mitomycin C (MMC)-based chemotherapy in a patient with metastatic pancreatic adenocarcinoma carrying germline BRCA2 mutation / P. Chalasani, S. Kurtin, T. Dragovich // JOP. — 2008. — Т. 9. — № 3. — С. 305-308. 48. Chang, D. T. Expression of p16(INK4A) but not hypoxia markers or poly adenosine diphosphate-ribose polymerase is associated with improved survival in patients with pancreatic adenocarcinoma / D. T. Chang, C. H. Chapman, J. A. Norton et al. // Cancer. — 2010. — Т. 116. — № 22. — С. 5179-5187. 49. Chellappa, K. Src tyrosine kinase phosphorylation of nuclear receptor HNF4α correlates with isoform-specific loss of HNF4α in human colon cancer / K. Chellappa, Jankova L., J. M. Schnabl et al. // Proc. Natl. Acad. Sci. USA. — 2012. — Т. 109. — № 7. — С. 2302-2307. 150 50. Chen, C. A. Calcium phosphate-mediated gene transfer: a highly efficient transfection system for stably transforming cells with plasmid DNA / C. A. Chen, H. Okayama // Biotechniques. — 1988. — Т. 6. — № 7. — С. 632-638. 51. Chen, J. Cyclin-binding motifs are essential for the function of p21CIP1 / J. Chen, P. Saha, S. Kornbluth et al. // Mol. Cell. Biol. — 1996. — Т. 16. — № 9. — С. 4673-4682. 52. Chen, W. S. Disruption of the HNF4 gene, expressed in visceral endoderm, leads to cell death in embryonic ectoderm and impaired gastrulation of mouse embryos / W. S. Chen, K. Manova, D. C. Weinstein et al. // Genes Dev. — 1994. — Т. 8. — № 20. — С. 2466-2477. 53. Chiba, H. Activation of p21CIP1/WAF1 gene expression and inhibition of cell proliferation by overexpression of hepatocyte nuclear factor-4alpha / H. Chiba, T. Itoh, S. Satohisa et al. // Exp. Cell. Res. — 2005. — Т. 302. — № 1. — С. 11-21. 54. Chou, W.-C. Mechanism of a Transcriptional Cross Talk between Transforming Growth Factorβ–regulated Smad3 and Smad4 Proteins and Orphan Nuclear Receptor Hepatocyte Nuclear Factor-4 / W.-C. Chou, V. Prokova, K. Shiraishi et al. // Mol. Biol. Cell. — 2003. — Т. 14. — № 3. — С. 1279-1294. 55. Christofori, G. The role of the cell-adhesion molecule E-cadherin as a tumour-suppressor gene / G. Christofori, H. Semb // Trends Biochem. Sci. — 1999. — Т. 24. — № 2. — С. 73-76. 56. Cicchini, C. Snail Controls Differentiation of Hepatocytes by Repressing HNF4a Expression / C. Cicchini, D. Filippini, S. Coen et al. // J. Cell. Physiol. — 2006. — Т. 209. — № 1. — С. 230238. 57. Cirillo, L. A. Opening of compacted chromatin by early developmental transcription factors HNF3 (FoxA) and GATA-4 / L. A. Cirillo, F. R. Lin, I. Cuestaet al. // Mol. Cell. — 2002. — Т. 9. — № 2. — С. 279-289. 58. Cirillo, L. A. Specific interactions of the wing domains of FOXA1 transcription factor with DNA / L. A. Cirillo, K. S. Zaret // J. Mol. Biol. — 2007. — Т. 366. — № 3. — С. 720-724. 59. Clark, K. L. Co-crystal structure of the HNF-3/fork head DNA-recognition motif resembles histone H5 / K. L. Clark, E. D. Halay, E. Lai, S. K. Burley // Nature. — 1993. — Т. 364. — № 6436. — С. 412-420. 60. Clotman, F. Control of liver cell fate decision by a gradient of TGF beta signaling modulated by Onecut transcription factors / F. Clotman, P. Jacquemin, N. Plumb-Rudewiez et al. // Genes Dev. — 2005. — Т. 19. — № 16. — С. 1849-1854. 61. Clotman F. The onecut transcription factor HNF6 is required for normal development of the biliary tract / F. Clotman, V. J. Lannoy, M. Reber et al. // Development. — 2002. — Т. 129. — № 8. — С. 1819-1828. 62. Cockell, M. Identification of a cell-specific DNA-binding activity that interacts with a transcriptional activator of genes expressed in the acinar pancreas / M. Cockell, B. J. Stevenson, M. Strubin et al. // Mol. Cell. Biol. — 1989. — Т. 9. — № 6. — С. 2464-2476. 63. Cockell, M. Binding sites for hepatocyte nuclear factor 3 beta or 3 gamma and pancreas transcription factor 1 are required for efficient expression of the gene encoding pancreatic alphaamylase / M. Cockell, D. Stolarczyk, S. Frutiger et al. // Mol. Cell. Biol. — 1995. — Т. 15. — № 4. — С. 1933-1941. 64. Coffinier, C. Bile system morphogenesis defects and liver dysfunction upon targeted deletion of HNF1beta / C. Coffinier, L. Gresh, L. Fiette et al. // Development. — 2002. — Т. 129. — № 8. — С. 1829-1838. 65. Cozzolino, A. M. TGFβ overrides HNF4α tumor suppressing activity through GSK3β inactivation: implication for hepatocellular carcinoma gene therapy / A. M. Cozzolino, T. Alonzi, L. Santangelo et al. // J. Hepatol. — 2013. — Т. 58. — № 1. — С. 65-72. 151 66. Criscimanna, A. Duct cells contribute to regeneration of endocrine and acinar cells following pancreatic damage in adult mice / A. Criscimanna, J. A. Speicher, G. Houshmand et al. // Gastroenterology. — 2011. — Т. 141. — № 4. — С. 1451-1462. 67. Darsigny, M. Loss of hepatocyte-nuclear-factor-4alpha affects colonic ion transport and causes chronic inflammation resembling inflammatory bowel disease in mice / M. Darsigny, J. P. Babeu, A. A. Dupuis et al. // PLoS One. — 2009. — Т. 4. — № 10. — С. e7609. 68. Darsigny, M. Hepatocyte nuclear factor-4alpha promotes gut neoplasia in mice and protects against the production of reactive oxygen species / M. Darsigny, J. P. Babeu, E. G. Seidman et al. // Cancer Res. — 2010. — Т. 70. — № 22. — С. 9423-9433. 69. De Craene, B. The transcription factor snail induces tumor cell invasion through modulation of the epithelial cell differentiation program / B. De Craene, B. Gilbert, C. Stove et al. // Cancer Res. — 2005. — Т. 65. — № 14. — С. 6237-6244. 70. De Simone, V. LFB3, a heterodimer-forming homeoprotein of the LFB1 family, is expressed in specialized epithelia / V. De Simone, L. De Magistris, D. Lazzaro et al. // EMBO J. — 1993. — Т. 10. — № 6. — С. 1435-1443. 71. Dell, H. CREB-binding protein is a transcriptional coactivator for hepatocyte nuclear factor-4 and enhances apolipoprotein gene expression / H. Dell, M. Hadzopoulou-Cladaras // J. Biol. Chem. — 1999. — Т. 274. — № 13. — С. 9013-9021. 72. Deutsch, G. A bipotential precursor population for pancreas and liver within the embryonic endoderm / G. Deutsch, J. Jung, M. Zheng et al. // Development. — 2001. — Т. 128. — № 6. — С. 871-881. 73. Dong, P. D. Graded levels of Ptf1a differentially regulate endocrine and exocrine fates in the developing pancreas / P. D. Dong, E. Provost, S. D. Leach, D. Y. Stainier // Genes Dev. — 2008. — Т. 22. — № 11. — С. 1445-1450. 74. Drewes, T. Human Hepatocyte Nuclear Factor 4 Isoforms Are Encoded by Distinct and Differentially Expressed Genes / T. Drewes, S. Senkel, B. Holewa, G. U. Ryffel // Mol. Cell. Biol. — 1996. — Т. 16. — № 3. — С. 925-931. 75. Dukes, I. D. Defective pancreatic beta-cell glycolytic signaling in hepatocyte nuclear factor1alpha-deficient mice / I. D. Dukes, S. Sreenan, M. W. Roe et al. // J. Biol. Chem. — 1998. — Т. 273. — № 38. — С. 24457-24464. 76. Duncan, S. A. Murine gastrulation requires HNF-4 regulated gene expression in the visceral endoderm: tetraploid rescue of Hnf-4(-/-) embryos / S. A. Duncan, A. Nagy, W. Chan // Development. — 1997. — Т. 124. — № 2. — С. 279-287. 77. Duncan, S. A. Regulation of a transcription factor network required for differentiation and metabolism / S. A. Duncan, M. A. Navas, D. Dufort et al. // Science. — 1998. — Т. 281. — № 5377. — С. 692-695. 78. Eguchi, G. Transdifferentiation / G. Eguchi, R. Kodama // Curr. Opin. Cell. Biol. — 1993. — Т. 5. — № 6. — С. 1023-1028. 79. Erdmann, S. Tissue-specific transcription factor HNF4alpha inhibits cell proliferation and induces apoptosis in the pancreatic INS-1 beta-cell line / S. Erdmann, S. Senkel, T. Arndt et al. // Biol. Chem. — 2007. — Т. 388. — № 1. — С. 91-106. 80. Erickson, R. L. p300 coactivates the adipogenic transcription factor CCAAT/enhancer-binding protein alpha / R. L. Erickson, N. Hemati, S. E. Ross, O. A. MacDougald // J. Biol. Chem. —2001. — Т. 276. — № 19. — С. 16348-16355. 81. Fajans, S. S. Macrosomia and neonatal hypoglycaemia in RW pedigree subjects with a mutation (Q268X) in the gene encoding hepatocyte nuclear factor 4alpha (HNF4A) / S. S. Fajans, G. I. Bell // Diabetologia. — 2007. — Т. 50. — № 12. — С. 2600-2601. 152 82. Faust, D. M. Constancy of expression of the protein kinase A regulatory subunit R1 α in hepatoma cell lines of different phenotypes / D. M. Faust, M. Boshart, T. Imaizumi-Scherrer et al. // Cell Growth Differ. — 1994. — Т. 5. — № 1. — С. 47-53. 83. Feng, X.-H. Specificity and versatility in TGF-β signaling through Smads / X.-H. Feng, R. Derynck // Annu. Rev. Cell Dev. Biol. — 2005. — Т. 21. — № 1. — № — С. 659–693. 84. Fernandez-Zapico, M. E. MODY7 gene, KLF11, is a novel p300-dependent regulator of Pdx-1 (MODY4) transcription in pancreatic islet beta cells / M. E. Fernandez-Zapico, J. C. van Velkinburgh, R. Gutiérrez-Aguilar et al. // J. Biol. Chem. — 2009. — Т. 284. — № 52. — С. 36482-36490. 85. Flodby, P. Increased hepatic cell proliferation and lung abnormalities in mice deficient in CCAAT/enhancer binding protein alpha / P. Flodby, C. Barlow, H. Kylefjord et al. // J. Biol. Chem. — 1996. — Т. 271. — № 40. — С. 24753-24760. 86. Flodby, P. Expression of the liver-enriched transcription factors C/EBP alpha, C/EBP beta, HNF1, and HNF-4 in preneoplastic nodules and hepatocellular carcinoma in rat liver / P. Flodby, D. Z . Liao, A. Blanck et al. // Mol. Carcinog. — 1995. — Т. 12. — № 2. — С. 103-109. 87. Francis, J. Pdx-1 links histone H3-Lys-4 methylation to RNA polymerase II elongation during activation of insulin transcription / J. Francis, S. K. Chakrabarti, J. C. Garmey // J. Biol. Chem. — 2005. — Т. 280. — № 43. — С. 36244-36253. 88. Friedman, J. R. The Foxa family of transcription factors in development and metabolism / J. R. Friedman, K. H. Kaestner // Cell. Mol. Life Sci. — 2006. — Т. 63. — № 19-20. — С. 23172328. 89. Gao, N. Foxa1 and Foxa2 maintain the metabolic and secretory features of the mature beta-cell / N. Gao, J. Le Lay, W. Qin et al. // Mol Endocrinol. — 2010. — Т. 24. — № 8. — С. 1594-1604. 90. Gao, N. Dynamic regulation of Pdx1 enhancers by Foxa1 and Foxa2 is essential for pancreas development / N. Gao, J. Le Lay, M. Z. Vatamaniuk et al. // Genes Dev. — 2008. — Т. 22. — № 24. — С. 3435-3448. 91. Garrison, W. D. Hepatocyte nuclear factor 4alpha is essential for embryonic development of the mouse colon / W. D. Garrison, M. A. Battle, C. Yang et al. // Gastroenterology. — 2006. — Т. 130. — № 4. — С. 1207-1220. 92. Gerrish, K. The role of hepatic nuclear factor 1 alpha and PDX-1 in transcriptional regulation of the pdx-1 gene / K. Gerrish, M. A. Cissell, R. Stein // J. Biol. Chem. — 2001. — Т. 276. — № 51. — С. 47775-47784. 93. Gerrish, K. Pancreatic beta cell-specific transcription of the pdx-1 gene. The role of conserved upstream control regions and their hepatic nuclear factor 3beta sites / K. Gerrish, M. Gannon, D. Shih et al. // J. Biol. Chem. — 2000. — Т. 275. — № 5. — С. 3485-3492. 94. Giovannetti, E. MicroRNA-21 in pancreatic cancer: correlation with clinical outcome and pharmacologic aspects underlying its role in the modulation of gemcitabine activity / E. Giovannetti, N. Funel, G. J. Peters et al. // Cancer Res. — 2010. — Т. 70. — № 11. — С. 45284538. 95. Gold, D. V. PAM4 enzyme immunoassay alone and in combination with CA 19-9 for the detection of pancreatic adenocarcinoma / D. V. Gold, J. Gaedcke, B. M. Ghadimi et al. // Cancer. — 2013. — Т. 119. — № 3. — С. 522-528. 96. Gold, D. V. PAM4-reactive MUC1 is a biomarker for early pancreatic adenocarcinoma / D. V. Gold, Z. Karanjawala, D. E. Modrak et al. // Clin. Cancer Res. — 2007. — Т. 13. — № 24. — С. 7380-7387. 153 97. Gold, D. V. New MUC1 serum immunoassay differentiates pancreatic cancer from pancreatitis / D. V. Gold, D. E. Modrak, Z. Ying et al. // J. Clin. Oncol. — 2006. — Т. 24. — № 2. — С. 252258. 98. Goudet, G. Functional and cooperative interactions between the homeodomain PDX1, Pbx, and Prep1 factors on the somatostatin promoter / G. Goudet, S. Delhalle, F. Biemar et al. // J. Biol. Chem. — 1999. — Т. 274. — № 7. — С. 4067-4073. 99. Grapin-Botton, A. Ductal cells of the pancreas / A. Grapin-Botton // Int. J. Biochem. Cell. Biol. — 2005. — Т. 37. — № 3. — С. 504-510. 100. Greenbaum, L. E. Coexistence of C/EBP alpha, beta, growth-induced proteins and DNA synthesis in hepatocytes during liver regeneration. Implications for maintenance of the differentiated state during liver growth / L. E. Greenbaum, D. E. Cressman, B. A. Haber, R. Taub // J. Clin. Invest. — 1995. — Т. 96. — № 3. — С. 1351-1365. 101. Greenbaum, L. E. CCAAT enhancer- binding protein beta is required for normal hepatocyte proliferation in mice after partial hepatectomy / L. E. Greenbaum, W. Li, D. E. Cressman et al. // J. Clin. Invest. — 1998. — Т. 102. — № 5. — С. 996-1007. 102. Grigo, K. HNF4 alpha orchestrates a set of 14 genes to down-regulate cell proliferation in kidney cells / K. Grigo, A. Wirsing, B. Lucas et al. // Biol. Chem. — 2008. — Т. 389. — № 2. — С. 179-187. 103. Guz, Y. Expression of murine STF-1, a putative insulin gene transcription factor, in β cells of pancreas, duodenal epithelium and pancreatic exocrine and endocrine progenitors during ontogeny / Y. Guz, M. R. Montminy, R. Stein et al. // Development. — 1995. — Т. 121. — № 1. — С. 11–18. 104. Habbe, N. MicroRNA miR-155 is a biomarker of early pancreatic neoplasia / N. Habbe, J. B. Koorstra, J. T. Mendell et al. // Cancer Biol. Ther. — 2009. — Т. 8. — № 4. — С. 340-346. 105. Habener, J. F. Minireview: transcriptional regulation in pancreatic development / J. F. Habener, D. M. Kemp, M. K. Thomas // Endocrinology. — 2005. — Т. 146. — № 3. — С. 1025-1034. 106. Habener, J. F. A newly discovered role of transcription factors involved in pancreas development and the pathogenesis of diabetes mellitus / J. F. Habener, D. A. Stoffers // Proc. Assoc. Am. Physicians. — 1998. — Т. 110. — № 1. — С. 12-21. 107. Hadzopoulou-Cladaras, M. Functional domains of the nuclear receptor hepatocyte nuclear factor 4 / M. Hadzopoulou-Cladaras, E. Kistanova, C. Evagelopoulou et al. // J. Biol. Chem. — 1997. — Т. 272. — № 1. — С. 539-550. 108. Haglund, C. CA 242, a new tumour marker for pancreatic cancer: a comparison with CA 19-9, CA 50 and CEA / C. Haglund, J. Lundin, P. Kuusela, P. J. Roberts // Br. J. Cancer. — 1994. — Т. 70. — № 3. — С. 487-492. 109. Halloran, C. M. 5-Fluorouracil or gemcitabine combined with adenoviral-mediated reintroduction of p16INK4A greatly enhanced cytotoxicity in Panc-1 pancreatic adenocarcinoma cells / C. M. Halloran, P. Ghaneh, S. Shore et al. // J. Gene Med. — 2004. — Т. 6. — № 5. — С. 514-525. 110. Han, Z. Role of p21 in apoptosis and senescence of human colon cancer cells treated with camptothecin / Z. Han, W. Wei, S. Dunaway et al. // J. Biol. Chem. — 2002. — Т. 277. — № 19. — С. 17154-17160. 111. Hanahan, D. The hallmarks of cancer / D. Hanahan, R. A. Weinberg // Cell. — 2000. — Т. 100. — № 1. — С. 57-70. 112. Hanahan, D. Hallmarks of cancer: the next generation / D. Hanahan, R. A. Weinberg // Cell. — 2011. — Т. 144. — № 5. — С. 646-674. 154 113. Hansen, S. K. Genetic evidence that HNF-1alpha-dependent transcriptional control of HNF4alpha is essential for human pancreatic beta cell function / S. K. Hansen, M. Párrizas, M. L. Jensen et al. // J. Clin. Invest. — 2002. — Т. 110. — № 6. — С. 827-833. 114. Hara, M. No diabetes-associated mutations in the coding region of the hepatocyte nuclear factor4gamma gene (HNF4G) in Japanese patients with MODY / M. Hara, X. Wang, V. P. Paz et al. // Diabetologia. — 2000. — Т. 43. — № 8. — С. 1064-1069. 115. Harries, L. W. The diabetic phenotype in HNF4A mutation carriers is moderated by the expression of HNF4A isoforms from the P1 promoter during fetal development / L. W. Harries, J. M. Locke, B. Shields et al. // Diabetes. — 2008. — Т. 57. — № 6. — С. 1745-1752. 116. Hatziapostolou, M. An HNF4α-miRNA inflammatory feedback circuit regulates hepatocellular oncogenesis / M. Hatziapostolou, C. Polytarchou, E. Aggelidou et al. // Cell. — 2011. — Т. 147. — № 6. — С. 1233-1247. 117. Hatzis, P. Regulatory mechanisms controlling human hepatocyte nuclear factor 4 alpha gene expression / P. Hatzis, I. Talianidis // Mol. Cell. Biol. — 2001. — Т. 21. — № 21. — С. 73207330. 118. Haumaitre, C. Lack of TCF2/vHNF1 in mice leads to pancreas agenesis / C. Haumaitre, E. Barbacci, M. Jenny et al. // Proc. Natl. Acad. Sci. USA. — 2005. — Т. 102. — № 5. — С. 14901495. 119. Hayhurst, G. P. Hepatocyte nuclear factor 4alpha (nuclear receptor 2A1) is essential for maintenance of hepatic gene expression and lipid homeostasis / G. P. Hayhurst, Y. H. Lee, G. Lambert et al. // Mol. Cell Biol. — 2001. — Т. 21. — № 4. — С. 1393-1403. 120. Hayhurst, G. P. Morphogenetic competence of HNF4α-deficient mouse hepatic cells / G. P. Hayhurst, H. Strick-Marchand, C. Mulet et al. // J. Hepatol. — 2008. — Т. 49. — № 3. — С. 384–395. 121. Hesselson, D. Suppression of Ptf1a activity induces acinar-to-endocrine conversion / D. Hesselson, R. M. Anderson, D. Y. Stainier // Curr. Biol. — 2011. — Т. 21. — № 8. — С. 712717. 122. Holewa, B. HNF4beta, a new gene of the HNF4 family with distinct activation and expression profiles in oogenesis and embryogenesis of Xenopus laevis / B. Holewa, D. Zapp, T. Drewes et al. // Mol. Cell. Biol. — 1997. — Т. 17. — № 2. — С. 687-694. 123. Hood, J. D. Role of integrins in cell invasion and migration / J. D. Hood, D. A. Cheresh // Nat. Rev. Cancer. — 2002. — Т. 2. — № 2. — С. 91-100. 124. Horikawa, Y. Mutation in hepatocyte nuclear factor-1 beta gene (TCF2) associated with MODY / Y. Horikawa, N. Iwasaki, M. Hara et al. // Nat. Genet. — 1997. — Т. 17. — № 4. — С. 384-385. 125. Hruban, R. H. Molecular genetics and related developments in pancreatic cancer / R. H. Hruban, M. Goggins, S. E. Kern // Curr. Opin. Gastroenterol. — 1999. — Т. 15. — № 5. — С. 404-409. 126. Huang, J. Expression of HNF4alpha variants in pancreatic islets and Ins-1 beta cells / J. Huang, V. Karakucuk, L. L. Levitsky, D. B. Rhoads // Diabetes Metab. Res. Rev. — 2008. — Т. 24. — № 7. — С. 533-543. 127. Huang, J. Novel P2 promoter-derived HNF4alpha isoforms with different N-terminus generated by alternate exon insertion / J. Huang, L. L. Levitsky, D. B. Rhoads // Exp. Cell. Res. — 2009. — Т. 315. — № 7. — С. 1200-1211. 128. Humphrey, R. K. Glucose regulates steady-state levels of PDX1 via the reciprocal actions of GSK3 and AKT kinases / R. K. Humphrey, S. M. Yu, L. E. Flores, U. S. Jhala // J. Biol. Chem. — 2010. — Т. 285. — № 5. — С. 3406-3416. 155 129. Hwang-Verslues, W. W. (2008) Nuclear receptor hepatocyte nuclear factor 4alpha1 competes with oncoprotein c-Myc for control of the p21/WAF1 promoter / W. W. Hwang-Verslues, F. M. Sladek // Mol. Endocrinol. — 2008. — Т. 22. — № 1. — С. 78-90. 130. Jacquemin, P. Transcription factor hepatocyte nuclear factor 6 regulates pancreatic endocrine cell differentiation and controls expression of the proendocrine gene ngn3 / P. Jacquemin, S. M. Durviaux, J. Jensen et al. // Mol. Cell Biol. — 2000. — Т. 20. — № 12. — С. 4445-4454. 131. Jacquemin, P. OC-2, a novel mammalian member of the ONECUT class of homeodomain transcription factors whose function in liver partially overlaps with that of hepatocyte nuclear factor-6 / P. Jacquemin, V. J. Lannoy, G. G. Rousseau, F. P. Lemaigre // J. Biol. Chem. — 1999. — Т. 274. — № 5. — С. 2665-2671. 132. Jacquemin, P. The Onecut transcription factor HNF-6 (OC-1) is required for timely specification of the pancreas and acts upstream of Pdx-1 in the specification cascade / P. Jacquemin, F. P. Lemaigre, G. G. Rousseau // Dev. Biol. — 2003. — Т. 258. — № 1. — С. 105-116. 133. Jamieson, N. B. MicroRNA molecular profiles associated with diagnosis, clinicopathologic criteria, and overall survival in patients with resectable pancreatic ductal adenocarcinoma / N. B. Jamieson, D. C. Morran, J. P. Morton et al. // Clin. Cancer Res. — 2012. — Т. 18. — № 2. — С. 534-545. 134. Jiang, G. The DNA binding domain of hepatocyte nuclear factor 4 mediates cooperative, specific binding to DNA and heterodimerization with the retinoid X receptor alpha / G. Jiang, F. M. Sladek // J. Biol. Chem. — 1997. — Т. 272. — № 2. — С. 1218-1225. 135. Jiang, X. Loss of ONECUT1 expression in human pancreatic cancer cells / X. Jiang, W. Zhang, H. Kayed et al. // Oncol. Rep. — 2008. — Т. 19. — № 1. — С. 157-163. 136. Jonsson, J. Insulin-promoter-factor 1 is required for pancreas development in mice / J. Jonsson, L. Carlsson, T. Edlund, H. Edlund // Nature. — 1994. — Т. 371. — № 6498. — С. 606–609. 137. Kaestner, K. H. Inactivation of the winged helix transcription factor HNF3alpha affects glucose homeostasis and islet glucagon gene expression in vivo / K. H. Kaestner, J. Katz, Y. Liu et al. // Genes Dev. — 1999. — Т. 13. — № 4. — С. 495-504. 138. Kanazawa, T. Hepatocyte nuclear factor 4 alpha is associated with mesenchymal-epithelial transition in developing kidneys of C57BL/6 mice / T. Kanazawa, O. Ichii, S. Otsuka et al. // J. Vet. Med. Sci. — 2011. — Т. 73. — № 5. — С. 601-607. 139. Kanazawa, T. Expression of hepatocyte nuclear factor 4alpha in developing mice / T. Kanazawa, A. Konno, Y. Hashimoto, Y. Kon // Anat. Histol. Embryol. — 2009. — Т. 38. — № 1. — С. 3441. 140. Kanazawa, T. Hepatocyte nuclear factor 4 alpha is related to survival of the condensed mesenchyme in the developing mouse kidney / T. Kanazawa, A. Konno, Y. Hashimoto, Y. Kon // Dev. Dyn. — 2010. — Т. 239. — № 4. — С. 1145-1154. 141. Kapoor, R. R. Persistent hyperinsulinemic hypoglycemia and maturity-onset diabetes of the young due to heterozygous HNF4A mutations / R. R. Kapoor, J. Locke, K. Colclough et al. // Diabetes. — 2008. — Т. 57. — № 6. — С. 1659-1663. 142. Kardassis, D. SMAD Proteins Transactivate the Human ApoCIII Promoter by Interacting Physically and Functionally with Hepatocyte Nuclear Factor 4 / D. Kardassis, K. Pardali, V.I. Zannis // J. Biol. Chem. — 2000. — Т. 275. — № 52. — С. 41405-41414. 143. Kawaguchi, Y. The role of the transcriptional regulator Ptf1a in converting intestinal to pancreatic progenitors / Y. Kawaguchi, B. Cooper, M. Gannon et al. // Nat. Genet. — 2002. — Т. 32. — № 1. — С. 128-134. 144. Khoo, C. Research resource: the pdx1 cistrome of pancreatic islets / C. Khoo, J. Yang, S. A. Weinrott et al. // Mol. Endocrinol. — 2012. — Т. 26. — № 3. — С. 521-533. 156 145. Kim, S. K. Intercellular signals regulating pancreas development and function / S. K. Kim, M. Hebrok // Genes Dev. — 2001. — Т. 15. — № 2. — С. 111-127. 146. Kim, J. An iPSC line from human pancreatic ductal adenocarcinoma undergoes early to invasive stages of pancreatic cancer progression / J. Kim, J. P. Hoffman, R. K. Alpaugh et al. // Cell Rep. — 2013. — Т. 3. — № 6. — С. 2088-2099. 147. Koizumi, M. Increased PDX-1 expression is associated with outcome in patients with pancreatic cancer / M. Koizumi, R. Doi, E. Toyoda et al. // Surgery. — 2003. — Т. 134. — № 2. — С. 260266. 148. Kong, X. Detection of differentially expressed microRNAs in serum of pancreatic ductal adenocarcinoma patients: miR-196a could be a potential marker for poor prognosis / X. Kong, Y. Du, G. Wang et al. // Dig. Dis. Sci. — 2011. — Т. 56. — № 2. — С. 602-609. 149. Korinek V. Two members of the Tcf family implicated in Wnt/beta-catenin signaling during embryogenesis in the mouse / V. Korinek, N. Barker, K. Willert et al. // Mol. Cell Biol. — 1998. — Т. 18. — № 3. — С. 1248-1256. 150. Krapp, A. The p48 DNA-binding subunit of transcription factor PTF1 is a new exocrine pancreas-specific basic helix-loop-helix protein / A. Krapp, M. Knöfler, S. Frutiger et al. // EMBO J. — 1996. — Т. 15. — № 16. — С. 4317-4329. 151. Krapp, A. The bHLH protein PTF1-p48 is essential for the formation of the exocrine and the correct spatial organization of the endocrine pancreas / A. Krapp, M. Knöfler, B. Ledermann et al. // Genes. Dev. — 1998. — Т. 12. — № 23. — С. 3752-3763. 152. Kritis, A. A. Isolation and characterization of a third isoform of human hepatocyte nuclear factor 4 / A. A. Kritis, A. Argyrokastritis, N. K. Moschonas et al. // Gene. — 1996. — Т. 173 — № 2. — С. 275-280. 153. Kyriazis, A. A. Morphological, biological, biochemical, and karyotypic characteristics of human pancreatic ductal adenocarcinoma Capan-2 in tissue culture and the nude mouse / A. A. Kyriazis, A. P. Kyriazis, C. N. Sternberg et al. // Cancer Res. — 1986. — Т. 46. — № 11. — С. 58105815. 154. Kyrmizi, I. Plasticity and expanding complexity of the hepatic transcription factor network during liver development / I. Kyrmizi, P. Hatzis, N. Katrakili et al. // Genes Dev. — 2006. — Т. 20. — № 16. — С. 2293-2305. 155. Landry, C. HNF-6 is expressed in endoderm derivatives and nervous system of the mouse embryo and participates to the cross-regulatory network of liver-enriched transcription factors / C. Landry, F. Clotman, T. Hioki et al. // Dev. Biol. — 1997. — Т. 192. — № 2. — С. 247-257. 156. Lazarevich, N. L. Progression of HCC in mice is associated with a downregulation in the expression of hepatocyte nuclear factors / N. L. Lazarevich, O. A. Cheremnova, E. V Varga et al. // Hepatology. — 2004. — Т. 39. — № 4. — С. 1038-1047. 157. Lazarevich N. L. Deregulation of hepatocyte nuclear factor 4 (HNF4) as a marker of epithelial tumors progression / N.L. Lazarevich, D.A. Shavochkina, D.I. Fleishman et al. // Exp. Oncol. — 2010. — Т. 32. — № 3. — С. 167-171. 158. Lee, S. Cytoplasmic p21Cip1 is involved in Ras-induced inhibition of the ROCK/LIMK/cofilin pathway / S. Lee, D. M. Helfman // J. Biol. Chem. — 2004. — Т. 279. — № 3. — С. 1885-1891. 159. Lee, C. S. Foxa2 is required for the differentiation of pancreatic alpha-cells / C. S. Lee, N. J. Sund, R. Behr et al. // Dev. Biol. — 2005. — Т. 278. — № 2. — С. 484-495. 160. Lehner, F. The hepatocyte nuclear factor 6 (HNF6) and FOXA2 are key regulators in colorectal liver metastases / F. Lehner, U. Kulik, J. Klempnauer, J. Borlak // FASEB. J. — 2007. — Т. 21. — № 7. — С. 1445-1462. 157 161. Lemaigre, F. P. Hepatocyte nuclear factor 6, a transcription factor that contains a novel type of homeodomain and a single cut domain / F. P. Lemaigre, S. M. Durviaux, O. Truong et al. // Proc. Natl. Acad. Sci. USA. — 1996. — Т. 93. — № 18. — С. 9460-9464. 162. Li, W.-C. Activation of pancreatic-duct-derived progenitor cells during pancreas regeneration in adult rats / W.-C. Li, M. E. Horb, D. Tosh, J. M. W. Slack // J. Cell Sci. — 2010. — Т. 123. — № 16. — С. 2792-2802. 163. Li, J. Mammalian hepatocyte differentiation requires the transcription factor HNF-4alpha / J. Li, G. Ning, S. A. Duncan // Genes Dev. — 2000. — Т. 14. — № 4. — С. 464-474. 164. Liu, S. H. PDX-1: demonstration of oncogenic properties in pancreatic cancer / S. H. Liu, S. Patel, M. C. Gingras et al. // Cancer. — 2011. — Т. 117. — № 4. — С. 723-733. 165. Liu, Y. Foxa3 (HNF-3gamma) binds to and activates the rat proglucagon gene promoter but is not essential for proglucagon gene expression / Y. Liu, W. Shen, P. L. Brubaker et al. // Biochem. J. — 2002. — Т. 366. — № 2. — С. 633-641. 166. Liu, T. PDX-1 expression and proliferation of duct epithelial cells after partial pancreatectomy in rats / T. Liu, C. Wang, S. Gou et al. // Hepatobiliary Pancreat. Dis. Int. — 2007. — Т. 6. — № 4. — С. 424-429. 167. Liu, T. In vitro pancreas duodenal homeobox-1 enhances the differentiation of pancreatic ductal epithelial cells into insulin-producing cells / T. Liu, C. Wang, F. Yu et al. // World. J. Gastroenterol. — 2007. — Т. 13. — № 39. — С. 5232-5237. 168. Locascio, A. Cell movements during vertebrate development: integrated tissue behaviour versus individual cell migration / A. Locascio, M. A. Nieto // Curr. Opin. Genet. Dev. — Т. 11. — № 4. — С. 464–469. 169. Lowery, M. A. An emerging entity: pancreatic adenocarcinoma associated with a known BRCA mutation: clinical descriptors, treatment implications, and future directions / M. A. Lowery, D. P. Kelsen, Z. K. Stadler et al. // Oncologist. — 2011. — Т. 16. — № 10. — С. 1397-1402. 170. Lu, C. Rbms3, an RNA-binding protein, mediates the expression of Ptf1a by binding to its 3’UTR during mouse pancreas development / C. Lu, Y. Lai, H. Chen, M. Chiang // DNA Cell Biol. — 2012. — Т. 31. — № 7. — С. 1245-1251. 171. Lu, P. Structural basis of natural promoter recognition by a unique nuclear receptor, HNF4alpha. Diabetes gene product / P. Lu, G. B. Rha, M. Melikishvili et al. // J. Biol. Chem. — 2008. — Т. 283. — № 48. — С. 33685-33697. 172. Lucas, B. HNF4alpha reduces proliferation of kidney cells and affects genes deregulated in renal cell carcinoma / B. Lucas, K. Grigo, S. Erdmann et al. // Oncogene. — 2005. — Т. 24. — № 42. — С. 6418-6431. 173. Luka, J. Development of a serum biomarker assay that differentiates tumor-associated MUC5AC (NPC-1C ANTIGEN) from normal MUC5AC / J. Luka, P. M. Arlen, A. Bristol // J. Biomed. Biotechnol. — 2011. — 934757. — режим доступа: http://downloads.hindawi.com/journals/bmri/2011/934757.pdf. 174. Lundin, J. Prognostic significance of serum CA 242 in pancreatic cancer. A comparison with CA 19-9 / J. Lundin, P. J. Roberts, P. Kuusela, C. Haglund // Anticancer Res. — 1995. — Т. 15. — № 5B. — С. 2181-2186. 175. Luo, Y. Cell-cycle inhibition by independent CDK and PCNA binding domains in p21Cip1 / Y. Luo, J. Hurwitz, J. Massagué // Nature. — 1995. — Т. 375. — № 6527. — С. 159-161. 176. MacFarlane, W. M. (1997) The p38/reactivating kinase mitogen-activated protein kinase cascade mediates the activation of the transcription factor insulin upstream factor 1 and insulin gene transcription by high glucose in pancreatic β-cells / W. M. MacFarlane, S. B. Smith, R. F. James et al. // J. Biol. Chem. — Т. 272. — № 33. — С. 20936–20944. 158 177. Maeda, M. Cadherin switching: essential for behavioral but not morphological changes during an epithelium-to-mesenchyme transition / M. Maeda, K. R. Johnson, M. J. Wheelock // J. Cell. Sci. — 2005. — Т. 118. — № 5. — С. 873-887. 178. Maestro, M. A. Hnf6 and Tcf2 (MODY5) are linked in a gene network operating in a precursor cell domain of the embryonic pancreas / M. A. Maestro, S. F. Boj, R. F. Luco et al. // Hum. Mol. Genet. — 2003. — Т. 12. — № 24. — С. 3307-3314. 179. Magenheim, J. Negative autoregulation of HNF-4alpha gene expression by HNF-4alpha1 / J. Magenheim, R. Hertz, I. Berman et al. // Biochem J. — 2005. — Т. 388. — № 1. — С. 325-332. 180. Makarova, A. S. HNF4α (Hepatocyte nuclear factor 4 alpha) review / A. S. Makarova, M. S. Chesnokov, N. L. Lazarevich // Atlas Genet. Cytogenet. Oncol. Haematol. — 2014. (принято в печать). 181. Malik, S. TRAP/SMCC/mediator-dependent transcriptional activation from DNA and chromatin templates by orphan nuclear receptor hepatocyte nuclear factor 4 / S. Malik, A. E. Wallberg, Y. K. Kang, R. G. Roeder // Mol. Cell Biol. — 2002. — Т. 22. — № 15. — С. 5626-37. 182. Mani, S. A. Mesenchyme Forkhead 1 (FOXC2) plays a key role in metastasis and is associated with aggressive basal-like breast cancers / S. A. Mani, J. Yang, M. Brooks et al. // Proc. Natl. Acad. Sci. USA. — 2007. — Т. 104. — № 24. — С. 10069-10074. 183. Marcil, V. Modification in oxidative stress, inflammation, and lipoprotein assembly in response to hepatocyte nuclear factor 4alpha knockdown in intestinal epithelial cells / V. Marcil, E. Seidman, D. Sinnett et al. // J. Biol. Chem. — 2010. — Т. 285. — № 52. — С. 40448-40460. 184. Margagliotti, S. The Onecut transcription factors HNF-6/OC-1 and OC-2 regulate early liver expansion by controlling hepatoblast migration / S. Margagliotti, F. Clotman, C. E. Pierreux et al. // Dev. Biol. — 2007. — Т. 311. — № 2. — С. 579-589. 185. Massagué, J. (2005) Smad transcription factors / J. Massagué, J. Seoane, D. Wotton // Genes Dev. — Т 19. — № 23. — С. 2783–2810. 186. Masui, T. Transcriptional autoregulation controls pancreatic Ptf1a expression during development and adulthood / T. Masui, G. H. Swift, M. A. Hale et al. // Mol. Cell. Biol. — 2008. — Т. 28. — № 17. — С. 5458-5468. 187. Matsuda, T. Ablation of C/EBPbeta alleviates ER stress and pancreatic beta cell failure through the GRP78 chaperone in mice / T. Matsuda, Y. Kido, S. Asahara et al. // J. Clin. Invest. — 2010. — Т. 120. — № 1. — С. 115-126. 188. Meivar-Levy, I. Pancreatic and duodenal homeobox gene 1 induces hepatic dedifferentiation by suppressing the expression of CCAAT/enhancer-binding protein beta / I. Meivar-Levy, T. Sapir, S. Gefen-Halevi et al. // Hepatology. — 2007. — Т. 46. — № 3. — С. 898-905. 189. Mink, S. Interaction and functional collaboration of p300 and C/EBPbeta / S. Mink, B. Haenig, K. H. Klempnauer // Mol. Cell. Biol. — 1997. — Т. 17. — № 11. — С. 6609-6617. 190. Miura, A. Hepatocyte nuclear factor-4alpha is essential for glucose-stimulated insulin secretion by pancreatic beta-cells / A. Miura, K. Yamagata, M. Kakei et al. // J. Biol. Chem. — 2006. — Т. 281. — № 8. — С. 5246-5257. 191. Miyatsuka, T. Ptf1a and RBP-J cooperate in activating Pdx1 gene expression through binding to Area III / T. Miyatsuka, T. Matsuoka, T. Shiraiwa et al. // Biochem. Biophys. Res. Commun. — 2007. — Т. 362. — № 4. — С. 905-909. 192. Monaghan, A. P. Postimplantation expression patterns indicate a role for the mouse forkhead/HNF-3 alpha, beta and gamma genes in determination of the definitive endoderm, chordamesoderm and neuroectoderm / A. P. Monaghan, K. H. Kaestner, E. Grau, G. Schütz // Development. — 1993. — Т. 119. — № 3. — С. 567-578. 159 193. Montgomery, R. C. Prediction of recurrence and survival by post-resection CA 19-9 values in patients with adenocarcinoma of the pancreas / R. C. Montgomery, J. P. Hoffman, L. B. Riley et al. // Ann. Surg. Oncol. — 1997. — Т. 4. — № 7. — С. 551-556. 194. Morali, O. G. IGF-II induces rapid beta-catenin relocation to the nucleus during epithelium to mesenchyme transition / O. G. Morali, V. Delmas, R. Moore et al. // Oncogene. — 2001. — Т. 20. — № 36. — С. 4942-4950. 195. Moreno-Bueno, G. Genetic profiling of epithelial cells expressing E-cadherin repressors reveals a distinct role for Snail, Slug, and E47 factors in epithelial-mesenchymal transition / G. MorenoBueno, E. Cubillo, D. Sarrió et al. // Cancer Res. — 2006. — Т. 66. — № 19. — С. 9543-9556. 196. Mosley, A. L. Glucose regulation of insulin gene expression requires the recruitment of p300 by the beta-cell-specific transcription factor Pdx-1 / A. L. Mosley, J. A. Corbett, S. Ozcan // Mol. Endocrinol. — 2004. — Т. 18. — № 9. — С. 2279-2290. 197. Nakhei, H. An alternative splice variant of the tissue specific transcription factor HNF4alpha predominates in undifferentiated murine cell types / H. Nakhei, A. Lingott, I. Lemm, G. U. Ryffel // Nucleic. Acids. Res. — 1998. — Т. 26. — № 2. — С. 497-504. 198. Nammo, T. Expression of HNF-4alpha (MODY1), HNF-1beta (MODY5), and HNF-1alpha (MODY3) proteins in the developing mouse pancreas / T. Nammo, K. Yamagata, T. Tanaka et al. // Gene. Expr. Patterns. — 2008. — Т. 8. — № 2. — С. 96-106. 199. Neureiter, D. Different capabilities of morphological pattern formation and its association with the expression of differentiation markers in a xenograft model of human pancreatic cancer cell lines / D. Neureiter, S. Zopf, A. Dimmler et al. // Pancreatology. — 2005. — Т. 5. — № 4-5. — С. 387-397. 200. Nikolaidou-Neokosmidou, V. Inhibition of hepatocyte nuclear factor 4 transcriptional activity by the nuclear factor kappaB pathway / V. Nikolaidou-Neokosmidou, V. I. Zannis, D. Kardassis // Biochem. J. — 2006. — Т. 398. — № 3. — С. 439-450. 201. Ning, B. Hepatocyte nuclear factor 4 alpha suppresses the development of hepatocellular carcinoma / B. Ning, J. Ding, C. Yin, W. et al. // Cancer Res. — 2010. — Т. 70. — № 19. — С. 7640-7651. 202. Odom, D. T. Control of pancreas and liver gene expression by HNF transcription factors / D. T. Odom, N. Zizlsperger, D. B. Gordon et al. // Science. — 2004. — Т. 303. — № 5662. — С. 1378-1381. 203. Offield, M. F. PDX-1 is required for pancreatic outgrowth and differentiation of the rostral duodenum / M. F. Offield, T. L. Jetton, P. A. Labosky et al. // Development. — 1996. — Т. 122. — № 3. — С. 983-995. 204. Ohlsson, H. IPF1, a homeodomain-containing transactivator of the insulin gene / H. Ohlsson, K. Karlsson, T. Edlund // EMBO J. — 1993. — Т. 12. — № 11. — С. 4251-4259. 205. Ohuchida K. MicroRNA expression as a predictive marker for gemcitabine response after surgical resection of pancreatic cancer / K. Ohuchida, K. Mizumoto, T. Kayashima et al. // Ann. Surg. Oncol. — 2011. — Т. 18. — № 8. — С. 2381-2387. 206. Oliver-Krasinski, J. M. The diabetes gene Pdx1 regulates the transcriptional network of pancreatic endocrine progenitor cells in mice / J. M. Oliver-Krasinski, M. T. Kasner, J. Yang et al. // J. Clin. Invest. — 2009. — Т. 119. — № 7. — С. 1888-1898. 207. Olmeda, D. Snai1 and Snai2 collaborate on tumor growth and metastasis properties of mouse skin carcinoma cell lines / D. Olmeda, A. Montes, G. Moreno-Bueno et al. // Oncogene. — 2008. — Т. 27. — № 34. — С. 4690-4701. 160 208. Oshima, T. Downregulated P1 promoter-driven hepatocyte nuclear factor-4alpha expression in human colorectal carcinoma is a new prognostic factor against liver metastasis / T. Oshima, T. Kawasaki, R. Ohashi et al. // Pathol. Int. — 2007. — Т. 57. — № 2. — С. 82-90. 209. Ott, M. O. vHNF1 is expressed in epithelial cells of distinct embryonic origin during development and precedes HNF1 expression / M. O. Ott, J. Rey-Campos, S. Cereghini, M. Yaniv // Mech. Dev. — 1991. — Т. 36. — № 1-2. — С. 47-58. 210. Pantalone D. p53 and DPC4 alterations in the bile of patients with pancreatic carcinoma / D. Pantalone, E. Pelo, B. Minuti et al. // J. Surg. Oncol. — 2004. — Т. 88. — № 4. — С. 210-216. 211. Pardali, K. Actions of TGF-beta as tumor suppressor and pro-metastatic factor in human cancer / K. Pardali, A. Moustakas // Biochim. Biophys. Acta. — 2007. — Т. 1775. — № 1. — С. 21-62. 212. Park, S.-M. The miR-200 family determines the epithelial phenotype of cancer cells by targeting the E-cadherin repressors ZEB1 and ZEB2 / S.-M. Park, A. B. Gaur, E. Lengyel, M. E. Peter // Genes. Dev. — 2008. — Т. 22. — № 7. — С. 894-907. 213. Parviz, F. Hepatocyte nuclear factor 4alpha controls the development of a hepatic epithelium and liver morphogenesis / F. Parviz, C. Matullo, W. D. Garrison et al. // Nat. Genet. — 2003. — Т. 34. — № 3. — С. 292-296. 214. Pearson, E. R. Macrosomia and hyperinsulinaemic hypoglycaemia in patients with heterozygous mutations in the HNF4A gene / E. R. Pearson, S. F. Boj, A. M. Steele et al. // PLoS Med. — 2007. — Т. 4. — № 4. — С. e118. 215. Pearson, E. R. Molecular genetics and phenotypic characteristics of MODY caused by hepatocyte nuclear factor 4alpha mutations in a large European collection / E. R. Pearson, S. Pruhova, C. J. Tack et al. // Diabetologia. — 2005. — Т. 48. — № 5. — С. 878-85. 216. Peinado, H. Transcriptional regulation of cadherins during development and carcinogenesis / H. Peinado, F. Portillo, A. Cano // Int. J. Dev. Biol. — 2004. — Т. 48. — № 5-6. — С. 365-375. 217. Petrescu, A. D. Ligand specificity and conformational dependence of the hepatic nuclear factor4alpha (HNF-4alpha ) / A. D. Petrescu, R. Hertz, J. Bar-Tana et al. // J. Biol. Chem. — 2002. — Т. 277. — № 27. — С. 23988-23999. 218. Pierreux, C. E. The transcription factor hepatocyte nuclear factor-6 controls the development of pancreatic ducts in the mouse / C. E. Pierreux, A. V Poll, C. R. Kemp et al. // Gastroenterology. — 2006. — Т. 130. — № 2. — С. 532-541. 219. Plaisance, V. Role of the transcriptional factor C/EBPbeta in free fatty acid-elicited beta-cell failure / V. Plaisance, V. Perret, D. Favre et al. // Mol. Cell. Endocrinol. — 2009. — Т. 305. — № 1-2. — С. 47-55. 220. Plengvidhya, N. Hepatocyte nuclear factor-4gamma: cDNA sequence, gene organization, and mutation screening in early-onset autosomal-dominant type 2 diabetes / N. Plengvidhya, A. Antonellis, L. T. Wogan et al. // Diabetes. — 1999. — Т. 48. — № 10. — С. 2099-2102. 221. Poll, A. V, Pierreux, C. E. A vHNF1/TCF2-HNF6 cascade regulates the transcription factor network that controls generation of pancreatic precursor cells / A. V Poll, C. E. Pierreux, L. Lokmane et al. // Diabetes. — 2006. — Т. 55. — № 1. — С. 61-69. 222. Pontoglio, M. Hepatocyte nuclear factor 1 inactivation results in hepatic dysfunction, phenylketonuria, and renal Fanconi syndrome / M. Pontoglio, J. Barra, M. Hadchouel et al. // Cell. — 1996. — Т. 84. — № 4. — С. 575-585. 223. Pontoglio, M. HNF1alpha controls renal glucose reabsorption in mouse and man / M. Pontoglio, D. Prié, C. Cheret et al. // EMBO. Rep. — 2000. — Т. 1. — № 4. — С. 359-365. 161 224. Pontoglio, M. Defective insulin secretion in hepatocyte nuclear factor 1alpha-deficient mice / M. Pontoglio, S. Sreenan, M. Roe et al. // J. Clin. Invest. — 1998. — Т. 101. — № 10. — С. 22152222. 225. Prévot, P. P. Role of the ductal transcription factors HNF6 and Sox9 in pancreatic acinar-toductal metaplasia / P. P. Prévot, A. Simion, A. Grimont et al. // Gut. — 2012. — Т. 61. — № 12. — С. 1723-1732. 226. Rafiq, I. Glucose-dependent translocation of insulin promoter factor-1 (IPF-1) between the nuclear periphery and the nucleoplasm of single MIN6 β-cells / I. Rafiq, H. J. Kennedy, G. A. Rutter // J. Biol. Chem. — 1998. — Т. 273. — № 36. — С. 23241–23247. 227. Ramji, D. P. CCAAT/enhancer-binding proteins: structure, function and regulation / D. P. Ramji, P. Foka // Biochem. J. — 2002. — Т. 365. — № Pt3. — С. 561-575. 228. Rastegar, M. Hepatocyte nuclear factor 6: organization and chromosomal assignment of the rat gene and characterization of its promoter / M. Rastegar, C. Szpirer, G. G. Rousseau, F. P. Lemaigre // Biochem. J. — 1998. — Т. 334. — № 3. — С. 565-569. 229. Robinson-Rechavi, M. The nuclear receptor superfamily / M. Robinson-Rechavi, H. Escriva Garcia, V. Laudet // J. Cell Sci. — 2003. — Т. 116. — № Pt 4. — С. 585-586. 230. Romanov, V. S. p21Waf1 is required for complete oncogenic transformation of mouse embryo fibroblasts by E1Aad5 and c-Ha-ras oncogenes / V. S. Romanov, A. A. Bardin, S. G. Zubova et al. // Biochimie. — 2011. — Т. 93. — № 9. — С. 1408-1414. 231. Rosanas-Urgell, A. Pdx1-related homeodomain transcription factors are distinctly expressed in mouse adult pancreatic islets / A. Rosanas-Urgell, G. Marfany, J. Garcia-Fernandez // Mol. Cell Endocrinol. — 2005. — Т. 237. — № 1-2. — С. 59–66. 232. Ruse, M. D. Competitive cofactor recruitment by orphan receptor hepatocyte nuclear factor 4alpha1: modulation by the F domain / M. D. Ruse, M. L. Privalsky, F. M. Sladek // Mol. Cell. Biol. — 2002. — Т. 22. — № 6. — С. 1626-1638. 233. Saitou, M. MUC4 expression is a novel prognostic factor in patients with invasive ductal carcinoma of the pancreas / M. Saitou, M. Goto, M. Horinouchi et al. // J. Clin. Pathol. — 2005. — Т. 58. — № 8. — С. 845-852. 234. Salek, C. Evaluation of clinical relevance of examining K-ras, p16 and p53 mutations along with allelic losses at 9p and 18q in EUS-guided fine needle aspiration samples of patients with chronic pancreatitis and pancreatic cancer / C. Salek, L. Benesova, M. Zavoral et al. // World J. Gastroenterol. — 2007. — Т. 13. — № 27. — С. 3714-3720. 235. Salek, C. Mutation status of K-ras, p53 and allelic losses at 9p and 18q are not prognostic markers in patients with pancreatic cancer / C. Salek, P. Minarikova, L. Benesova et al. // Anticancer Res. — 2009. — Т. 29. — № 5. — С. 1803-1810. 236. Santangelo, L. The stable repression of mesenchymal program is required for hepatocyte identity: a novel role for hepatocyte nuclear factor 4α / L. Santangelo, A. Marchetti, C. Cicchini et al. // Hepatology. — 2011. — Т. 53. — № 6. — С. 2063-2074. 237. Sapir, T. Cell-replacement therapy for diabetes: Generating functional insulin-producing tissue from adult human liver cells / T. Sapir, K. Shternhall, I. Meivar-Levy et al. // Proc. Natl. Acad. Sci. USA. — 2005. — Т. 102. — № 22. — С. 7964-7969. 238. Sato, Y. Anks4b, a novel target of HNF4α protein, interacts with GRP78 protein and regulates endoplasmic reticulum stress-induced apoptosis in pancreatic β-cells / Y. Sato, M. Hatta, M. F. Karim et al. // J. Biol. Chem. — 2012. — Т. 287. — № 27. — С. 23236-23245. 239. Scarpa, A. Pancreatic adenocarcinomas frequently show p53 gene mutations / A. Scarpa, P. Capelli, K. Mukai et al. // Am. J. Pathol. — 1993. — Т. 142. — № 5. — С. 1534-1543. 162 240. Schrem, H. Liver-enriched transcription factors in liver function and development. Part II: the C/EBPs and D site-binding protein in cell cycle control, carcinogenesis, circadian gene regulation, liver regeneration, apoptosis, and liver-specific gene regulation / H. Schrem, J. Klempnauer, J. Borlak // Pharmacol. Rev. — 2004. — Т. 56. — № 2. — С. 291-330. 241. Schutte, M. Abrogation of the Rb/p16 tumor-suppressive pathway in virtually all pancreatic carcinomas / M. Schutte, R. H. Hruban, J. Geradts et al. // Cancer Res. — 1997. — Т. 57. — № 15. — С. 3126-3130. 242. Schwartz, B. Inhibition of colorectal cancer by targeting hepatocyte nuclear factor-4alpha / B. Schwartz, A. Algamas-Dimantov, R. Hertz et al. // Int. J. Cancer. — 2009. — Т. 124. — № 5. — С. 1081-1089. 243. Sel, S. Human renal cell carcinogenesis is accompanied by a coordinate loss of the tissue specific transcription factors HNF4 alpha and HNF1 alpha / S. Sel, T. Ebert, G. U. Ryffel, T. Drewes // Cancer. Lett. — 1996. — Т. 101. — № 2. — С. 205-210. 244. Sellick, G. S. Mutations in PTF1A cause pancreatic and cerebellar agenesis / G. S. Sellick, K. T. Barker, I. Stolte-Dijkstra et al. // Nat. Genet. — 2004. — Т. 36. — № 12. — С. 1301-1305. 245. Siegel, R. Cancer statistics, 2013 / R. Siegel, D. Naishadham, A. Jemal // CA. Cancer. J. Clin. — 2013. — Т. 63. — № 1. — С. 11-30. 246. Siemens, H. miR-34 and SNAIL form a double-negative feedback loop to regulate epithelialmesenchymal transitions / H. Siemens, R. Jackstadt, S. Hünten et al. // Cell. Cycle. — 2011. — Т. 10. — № 24. — С. 4256-4271. 247. Silander, K. Genetic variation near the hepatocyte nuclear factor-4 alpha gene predicts susceptibility to type 2 diabetes / K. Silander, K. L. Mohlke, L. J. Scott et al. // Diabetes. — 2004. — Т. 53. — № 4. — С. 1141-1149. 248. Singh M. Precursor lesions of pancreatic cancer: molecular pathology and clinical implications / M. Singh, A. Maitra // Pancreatology. — 2007. — Т. 7. — № 1. — С. 9-19. 249. Slack, J. M. Developmental biology of the pancreas / J. M. Slack // Development. — 1995. — Т. 121. — № 6. — С. 1569-1580. 250. Sladek, F. M. Liver-enriched transcription factor HNF-4 is a novel member of the steroid hormone receptor superfamily / F. M. Sladek, W. M. Zhong, E. Lai, J. E. Darnell // Genes Dev. — 1990. — Т. 4. — № 12B. — С. 2353-2365. 251. Song, Y. Loss of FOXA1/2 is essential for the epithelial-to-mesenchymal transition in pancreatic cancer / Y. Song, M. K. Washington, H. C. Crawford // Cancer Res. — 2010. — Т. 70. — № 5. — С. 2115-2125. 252. Spaderna, S. The transcriptional repressor ZEB1 promotes metastasis and loss of cell polarity in cancer / S. Spaderna, O. Schmalhofer, M. Wahlbuhl et al. // Cancer Res. — 2008. — Т. 68. — № 2. — С. 537-544. 253. Spagnoli, F. M. From endoderm to pancreas: a multistep journey / F. M. Spagnoli // Cell Mol. Life Sci. — 2007. — Т. 64. — № 18. — С. 2378-2390. 254. Späth, G. F. Hepatocyte nuclear factor 4 expression overcomes repression of the hepatic phenotype in dedifferentiated hepatoma cells / G. F. Späth, M. C. Weiss // Mol. Cell Biol. — 1997. — Т. 17. — № 4. — С. 1913-1922. 255. Späth, G. F. Hepatocyte nuclear factor 4 provokes expression of epithelial marker genes, acting as a morphogen in dedifferentiated hepatoma cells / G. F. Späth, M. C. Weiss // J. Cell Biol. — 1998. — Т. 140. — № 4. — С. 935-946. 256. Standring, S. Gray’s Anatomy: The Anatomical Basis of Clinical Practice / ed. Susan Standring. – Spain, 2008. – 1551 p. 163 257. Stoffers, D. A. Homeodomain protein IDX-1: a master regulator of pancreas development and insulin gene expression / D. A. Stoffers, M. K. Thomas, J. F. Habener // Trends Endocrinol. Metab. — 1997. — Т. 8. — № 4. — С. 145-151. 258. Strippoli, R. Epithelial-to-mesenchymal transition of peritoneal mesothelial cells is regulated by an ERK/NF-kappaB/Snail1 pathway / R. Strippoli, I. Benedicto, M. L. Pérez Lozano et al. // Dis. Model. Mech. — 2008. — Т. 1. — № 4-5. — С. 264-274. 259. Suckale, J. Pancreas islets in metabolic signaling--focus on the beta-cell / J. Suckale, M. Solimena // Front. Biosci. — 2008. — Т. 13. — № . — С. 7156-7171. 260. Sund, N. J. Tissue-specific deletion of Foxa2 in pancreatic beta cells results in hyperinsulinemic hypoglycemia / N. J. Sund, M. Z. Vatamaniuk, M. Casey et al. // Genes Dev. — 2001. — Т. 15. — № 13. — С. 1706-1715. 261. Swartz, M. J. MUC4 expression increases progressively in pancreatic intraepithelial neoplasia / M. J. Swartz, S. K. Batra, G. C. Varshney et al. // Am. J. Clin. Pathol. — 2002. — Т. 117. — № 5. — С. 791-796. 262. Swift, G. H. An endocrine-exocrine switch in the activity of the pancreatic homeodomain protein PDX1 through formation of a trimeric complex with PBX1b and MRG1 (MEIS2) / G. H. Swift, Y. Liu, S. D. Rose et al. // Mol. Cell Biol. — 1998. — Т. 18. — № 9. — С. 5109-5120. 263. Talar-Wojnarowska, R. Usefulness of p16 and K-ras mutation in pancreatic adenocarcinoma and chronic pancreatitis differential diagnosis / R. Talar-Wojnarowska, A. Gasiorowska, B. Smolarz et al. // J. Physiol. Pharmacol. — 2004. — Т. 55. — Suppl 2. — С. 129-138. 264. Tan, Y. Increased expression of hepatocyte nuclear factor 6 stimulates hepatocyte proliferation during mouse liver regeneration / Y. Tan, Y. Yoshida, D. E. Hughes, R. H. Costa // Gastroenterology. — 2006. — Т. 130. — № 4. — С. 1283-1300. 265. Tanaka, T. Dysregulated expression of P1 and P2 promoter-driven hepatocyte nuclear factor4alpha in the pathogenesis of human cancer / T. Tanaka, S. Jiang, H. Hotta, et al. // J. Pathol. — 2006. — Т. 208. — № 5. — С. 662-672. 266. Tang, Y. FOXA2 functions as a suppressor of tumor metastasis by inhibition of epithelial-tomesenchymal transition in human lung cancers / Y. Tang, G. Shu, X. Yuan et al. // Cell Res. — 2011. — Т. 21. — № 2. — С. 316-326. 267. Taraviras, S. Primary structure, chromosomal mapping, expression and transcriptional activity of murine hepatocyte nuclear factor 4gamma / S. Taraviras, T. Mantamadiotis, T. Dong-Si et al. // Biochim. Biophys. Acta. — 2000. — Т. 1490. — № 1-2. — С. 21-32. 268. Thiery, J. P. Epithelial-mesenchymal transitions in tumour progression / J. P. Thiery // Nat. Rev. Cancer. — 2002. — Т. 2. — № 6. — С. 442-454. 269. Thiery, J. P. Complex networks orchestrate epithelial-mesenchymal transitions / J. P. Thiery, J. P. Sleeman // Nat. Rev. Mol. Cell. Biol. — 2006. — Т. 7. — № 2. — С. 131-142. 270. Thomas, H. A distant upstream promoter of the HNF-4alpha gene connects the transcription factors involved in maturity-onset diabetes of the young / H. Thomas, K. Jaschkowitz, M. Bulman et al. // Hum. Mol. Genet. — 2001. — Т. 10. — № 19. — С. 2089-2097. 271. Thompson, N. RNA profiling and chromatin immunoprecipitation-sequencing reveal that PTF1a stabilizes pancreas progenitor identity via the control of MNX1/HLXB9 and a network of other transcription factors / N. Thompson, E. Gésina, P. Scheinert et al. // Mol. Cell Biol. — 2012. — Т. 32. — № 6. — С. 1189-1199. 272. Tian, J. M. Tissue-specific expression of the gene encoding hepatocyte nuclear factor 1 may involve hepatocyte nuclear factor 4 / J. M. Tian, U. Schibler // Genes. Dev. — 1991. — Т. 5. — № 12A. — С. 2225-2234. 164 273. Tjora, E. Exocrine pancreatic function in hepatocyte nuclear factor 1β-maturity-onset diabetes of the young (HNF1B-MODY) is only moderately reduced: compensatory hypersecretion from a hypoplastic pancreas / E. Tjora, G. Wathle, F. Erchinger et al. // Diabet. Med. — 2013. — Т. 30. — № 8. — С. 946-955. 274. Torres-Padilla, M. E. Expression of HNF4alpha isoforms in mouse liver development is regulated by sequential promoter usage and constitutive 3’ end splicing / M. E. Torres-Padilla, C. Fougère-Deschatrette, M. C. Weiss // Mech. Dev. — 2001. — Т. 109. — № 2. — С. 183-193. 275. Torres-Padilla, M. E. Developmentally regulated N-terminal variants of the nuclear receptor hepatocyte nuclear factor 4alpha mediate multiple interactions through coactivator and corepressor-histone deacetylase complexes / M. E. Torres-Padilla, F. M. Sladek, M. C. Weiss // J. Biol. Chem. — 2002. — Т. 277. — № 47. — С. 44677-44687. 276. Tronche, F. Analysis of the distribution of binding sites for a tissue-specific transcription factor in the vertebrate genome / F. Tronche, F. Ringeisen, M. Blumenfeld et al. // J. Mol. Biol. — 1997. — Т. 266. — № 2. — С. 231-245. 277. Tronche, F. HNF1, a homeoprotein member of the hepatic transcription regulatory network / F. Tronche, M. Yaniv // Bioessays. — 1992. — Т. 14. — № 9. — С. 579-587. 278. Tweedie, E. Maintenance of hepatic nuclear factor 6 in postnatal islets impairs terminal differentiation and function of beta-cells / E. Tweedie, I. Artner, L. Crawford et al. // Diabetes. — 2006. — Т. 55. — № 12. — С. 3264-3270. 279. Uozaki, H. Transcriptional factor typing with SOX2, HNF4aP1, and CDX2 closely relates to tumor invasion and Epstein-Barr virus status in gastric cancer / H. Uozaki, R. R. Barua, S. Minhua et al. // Int. J. Clin. Exp. Pathol. — 2011. — Т. 4. — № 3. — С. 230-240. 280. Vaisse, C. Pancreatic islet expression studies and polymorphic DNA markers in the genes encoding hepatocyte nuclear factor-3alpha, -3beta, -3gamma, -4gamma, and -6 / C. Vaisse, J. Kim, R. Espinosa 3rd et al. // Diabetes. — 1997. — Т. 46. — № 8. — С. 1364-1367. 281. Vandewalle, C. SIP1/ZEB2 induces EMT by repressing genes of different epithelial cell-cell junctions / C. Vandewalle, J. Comijn, B. De Craene et al. // Nucleic Acids Res. — 2005. — Т. 33. — № 20. — С. 6566-6578. 282. Vanhorenbeeck, V. OC-3, a novel mammalian member of the ONECUT class of transcription factors / V. Vanhorenbeeck, P. Jacquemin, F. P. Lemaigre, G. G. Rousseau // Biochem. Biophys. Res. Commun. — 2002. — Т. 292. — № 4. — С. 848-854. 283. Vanhorenbeeck, V. Role of the Onecut transcription factors in pancreas morphogenesis and in pancreatic and enteric endocrine differentiation / V. Vanhorenbeeck, M. Jenny, J.-F. Cornut et al. // Dev. Biol. — 2007. — Т. 305. — № 2. — С. 685-694. 284. Vatamaniuk, M. Z. Foxa1-deficient mice exhibit impaired insulin secretion due to uncoupled oxidative phosphorylation / M. Z. Vatamaniuk, R. K. Gupta, K. A. Lantz et al. // Diabetes. — 2006. — Т. 55. — № 10. — С. 2730-2736. 285. Waeber, G. Transcriptional activation of the GLUT2 gene by the IPF-1/STF-1/IDX-1 homeobox factor / G. Waeber, N. Thompson, P. Nicod, C. Bonny // Mol. Endocrinol. — 1996. — Т. 10. — № 11. — С. 1327–1334. 286. Walesky, C. Hepatocyte-specific deletion of hepatocyte nuclear factor-4α in adult mice results in increased hepatocyte proliferation / C. Walesky, S. Gunewardena, E. F. Terwilliger et al. // Am. J. Physiol. Gastrointest. Liver Physiol. — 2013. — Т. 304. — № 1. — С. G26-G37. 287. Wang, M. Transcriptional activation by growth hormone of HNF-6-regulated hepatic genes, a potential mechanism for improved liver repair during biliary injury in mice / M. Wang, M. Chen, G. Zheng et al. // Am. J. Physiol. Gastrointest. Liver Physiol. — 2008. — Т. 295. — № 2. — С. G357-G366. 165 288. Wang, N. D. Impaired energy homeostasis in C/EBP alpha knockout mice / N. D. Wang, M. J. Finegold, A. Bradley et al. // Science. — 1995. — Т. 269. — № 5227. — С. 1108-1112. 289. Wang, H. Hepatocyte nuclear factor 4alpha regulates the expression of pancreatic beta -cell genes implicated in glucose metabolism and nutrient-induced insulin secretion / H. Wang, P. Maechler, P. A. Antinozzi, et al. // J. Biol. Chem. — 2000. — Т. 275. — № 46. — С. 3595335959. 290. Warfel, N. A. p21WAF1 and tumourigenesis: 20 years after / N. A. Warfel, W. S. El-Deiry // Curr. Opin. Oncol. — 2013. — Т. 25. — № 1. — С. 52-58. 291. Warshaw, A. L. Pancreatic carcinoma / A. L. Warshaw, C. Fernández-del Castillo // N. Engl. J. Med. — 1992. — Т. 326. — № 7. — С. 455-465. 292. Watada, H. Involvement of the homeodomain-containing transcription factor PDX-1 in islet amyloid polypeptide gene transcription / H. Watada, Y. Kajimoto, H. Kaneto et al. // Biochem. Biophys. Res. Commun. — 1996. — Т. 229. — № 3. — С. 746–751. 293. Watada, H. PDX-1 induces insulin and glucokinase gene expressions in αTC1 clone 6 cells in the presence of betacellulin / H. Watada, Y. Kajimoto, J. Miyagawa et al. // Diabetes. — 1996. — Т. 45. — № 12. — С. 1826–1831. 294. Welters, H. J. Conditional expression of hepatocyte nuclear factor-1beta, the maturity-onset diabetes of the young-5 gene product, influences the viability and functional competence of pancreatic beta-cells / H. J. Welters, S. Senkel, L. Klein-Hitpass et al. // J. Endocrinol. — 2006. — Т. 190. — № 1. — С. 171-181. 295. Weltmeier, F. A high resolution genome-wide scan of HNF4α recognition sites infers a regulatory gene network in colon cancer / F. Weltmeier, J. Borlak // PLoS. One. — 2011. — Т. 6. — № 7. — С. e21667. 296. Westmacott, A. C/EBPalpha and C/EBPbeta are markers of early liver development / A. Westmacott, Z. D. Burke, G. Oliver et al. // Int. J. Dev. Biol. — 2006. — Т. 50. — № 7. — С. 653-657. 297. Wiebe, P. O. Ptf1a binds to and activates area III, a highly conserved region of the Pdx1 promoter that mediates early pancreas-wide Pdx1 expression / P. O. Wiebe, J. D. Kormish, V. T. Roper et al. // Mol. Cell Biol. — 2007. — Т. 27. — № 11. — С. 4093-4104. 298. Wilentz R.E. Loss of expression of DPC4 in pancreatic intraepithelial neoplasia: evidence that DPC4 inactivation occurs late in neoplastic progression / R. E. Wilentz, C. A. IacobuzioDonahue, P. Argani et al. // Cancer Res. — 2000. — Т. 60. — № 7. — С. 2002–2006. 299. Wissniowski, T. T. Mucin production determines sensitivity to bortezomib and gemcitabine in pancreatic cancer cells / T. T. Wissniowski, S. Meister, E. G. Hahn et al. // Int. J. Oncol. — 2012. — Т. 40. — № 5. — С. 1581-1589. 300. Wu, X. Evaluation of the diagnostic value of serum tumor markers, and fecal k-ras and p53 gene mutations for pancreatic cancer / X. Wu, X. H. Lu, T. Xu et al. // Chin. J. Dig. Dis. — 2006. — Т. 7. — № 3. — С. 170-174. 301. Yamagata, K.. Regulation of pancreatic beta-cell function by the HNF transcription network: lessons from maturity-onset diabetes of the young (MODY) / K. Yamagata // Endocr. J. — 2003. — Т. 50. — № 5. — С. 491-499. 302. Yamagata, K. Mutations in the hepatocyte nuclear factor-4alpha gene in maturity-onset diabetes of the young (MODY1) / K. Yamagata, H. Furuta, N. Oda et al. // Nature. — 1996. — Т. 384. — № 6608. — С. 458-460. 303. Yang, J. Twist, a master regulator of morphogenesis, plays an essential role in tumor metastasis / J. Yang, S. A. Mani, J. L. Donaher et al. // Cell. — 2004. — Т. 117. — № 7. — С. 927-939. 166 304. Yang, Y. MiR-18a regulates expression of the pancreatic transcription factor Ptf1a in pancreatic progenitor and acinar cells / Y. Yang, L. Ding, Y. An et al. // FEBS. Lett. — 2012. — Т. 586. — № 4. — С. 422-427. 305. Yang, Y. P. Context-specific α- to-β-cell reprogramming by forced Pdx1 expression / Y. P. Yang, F. Thorel, D. F. Boyer et al. // Genes Dev. — 2011. — Т. 25. — № 16. — С. 1680-1685. 306. Yin, C. Differentiation therapy of hepatocellular carcinoma in mice with recombinant adenovirus carrying hepatocyte nuclear factor-4alpha gene / C. Yin, Y. Lin, X. Zhang et al. // Hepatology. — 2008. — Т. 48. — № 5. — С. 1528-1539. 307. Yoshida, Y. C/EBPalpha and HNF6 protein complex formation stimulates HNF6-dependent transcription by CBP coactivator recruitment in HepG2 cells / Y. Yoshida, D. E. Hughes, F. M. Rausa et al. // Hepatology. — 2006. — Т. 43. — № 2. — С. 276-286. 308. Yuan, X. Identification of an endogenous ligand bound to a native orphan nuclear receptor / X. Yuan, T. C. Ta, M. Lin et al. // PLoS. One. — 2009. — Т. 4. — № 5. — С. e5609. 309. Zecchin, E. Evolutionary conserved role of ptf1a in the specification of exocrine pancreatic fates / E. Zecchin, A. Mavropoulos, N. Devos et al. // Dev. Biol. — 2004. — Т. 268. — № 1. — С. 174-184. 310. Zhang, H. Multiple, temporal-specific roles for HNF6 in pancreatic endocrine and ductal differentiation / H. Zhang, E. T. Ables, C. F. Pope et al. // Mech. Dev. — 2009. — Т. 126. — № 11-12. — С. 958-973. 311. Zhang, T. Insulinoma-associated antigen-1 zinc-finger transcription factor promotes pancreatic duct cell trans-differentiation / T. Zhang, H. Wang, N. A. Saunee et al. // Endocrinology. — 2010. — Т. 151. — № 5. — С. 2030-2039. 312. Zhou, Q. A multipotent progenitor domain guides pancreatic organogenesis / Q. Zhou, A. C. Law, J. Rajagopal et al. // Dev. Cell. — 2007. — Т. 13. — № 1. — С. 103-114.