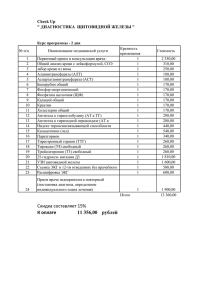
Морфофункциональные изменения щитовидной железы и
реклама

ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ИЖЕВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ» МИНИСТЕРСТВА ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ На правах рукописи Сметанина Марина Викторовна Морфофункциональные изменения щитовидной железы и регионарных лимфатических узлов при различных моделях атерогенеза 03.03.04 – клеточная биология, цитология, гистология Диссертация на соискание ученой степени кандидата медицинских наук Научный руководительдоктор биологических наук, профессор В.А. Глумова Тюмень - 2014 Оглавление ВВЕДЕНИЕ ...................................................................................................................... 5 Глава 1. Обзор литературы ........................................................................................... 13 1.1.Уровни организации биологических систем и методы их анализа на примере щитовидной железы (ЩЖ) и паратрахеальных лимфоузлов (ПТЛУ) в норме и эксперименте ....................................................................... 13 1.2. Морфофункциональная лабильность щитовидной железы и лимфоузлов при различных патологических процессах ............................. 30 1.3. Методы экспериментального воспроизведения гипергомоцистеинемии ...................................................................................... 34 Глава 2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ .......................................................... 43 2.1 Материал и методики исследований........................................................... 43 2.2 Морфофункциональные изменения в щитовидной железе при гиперхолестериновой модели атерогенеза................................................ 48 2.3 Морфофункциональные изменения в щитовидной железе при гипергомоцистеиновой модели атерогенеза ............................................. 65 2.4 Сравнительная характеристика морфофункциональных изменений в щитовидной железе при гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза ........................................................................................... 79 2.5 Морфофункциональные изменения в паратрахеальных лимфоузлах при гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза . 86 ЗАКЛЮЧЕНИЕ ........................................................................................................... 113 ВЫВОДЫ ..................................................................................................................... 126 ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ ..................................................................... 126 СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ИССЛЕДОВАНИЯ .................................... 127 СПИСОК ЛИТЕРАТУРЫ........................................................................................... 131 2 СПИСОК СОКРАЩЕНИЙ АГ – артериальная гипертония АДЛЕ – атерогенная дислипидемия АИ – атерогенный индекс ВЭВ – высокоэндотелиальные венулы ГГЦ – гипергомоцистеинемия ГХ – гиперхолестеринемия ГЦ – герминативный центр ДК – десквамированные клетки ДЛП – дислипопротеинемия ИБС – ишемическая болезнь сердца ИГ – индекс гранулолизиса ИД – индекс дегрануляции ИДКР – интердигитирующие клетки ретикулума ИНГ – индекс насыщения гепарином ИП – индекс пролиферации ИСГ – индекс суммарного гранулолизиса ЛПВП – липопротеины высокой плотности ЛПНП – липопротеины низкой плотности ЛПОНП – липопротеины очень низкой плотности ЛУ – лимфоузлы ЛФ – лимфоцит МВ – мозговое вещество МФ – макрофаг оГЦ – общий гомоцистеин ОХ – общий холестерин ПКЗ – паракортикальная зона ПТЛУ – паратрахеальные лимфоузлы СД – сахарный диабет СИР – стереологический индекс резорбции 3 ТБ – тканевые базофилы ТГ – триглицериды ТК – тучные клетки ТТГ – тиреотропный гормон УЗИ – ультразвуковое исследование ФДК – фолликулярные дендритные клетки ФКИ – фолликулярно-коллоидный индекс ЩЖ – щитовидная железа ADMA – ассимметричный диметиларгинин CBS – цистатионин β-синтетаза MS - метионин синтетаза MTHFR – метилентетрагидрофолатсинтетаза NMDA - N-метил-D-аспартат NO – оксид азота SAM – S-аденозилметионин 4 ВВЕДЕНИЕ Актуальность темы Атеросклероз и его осложнения были и остаются актуальной проблемой современной биологии и медицины. Смертность от сердечно-сосудистой патологии, обусловленной атеросклеротическим процессом, по данным ВОЗ является лидирующей в мире (World Health Organization. Cardiovascular diseases (CVDs), 2013). При обширном поражении сосудов и длительном существовании бляшек атеросклероз может привести к развитию ИБС, стенокардии, и, как следствие, к инфаркту миокарда; ишемическое поражение сосудов головного мозга, главным образом артерий основания мозга и средних мозговых артерий, вызывает такие нейродегенеративные расстройства, как ишемический инсульт, кровоизлияния в мозг, сосудистый паркинсонизм. Длительная ишемия головного мозга на фоне стенозирующего атеросклероза мозговых артерий приводит к развитию атеросклеротической деменции (Song J. et al., 2014; Sudduth T.L. et al.,2014). Со стороны опорно-двигательного аппарата наблюдаются такие осложнения, как перемежающаяся хромота, гангрена верхних и нижних конечностей. При атеросклерозе почечных артерий сужение просвета бляшкой приводит к развитию атеросклеротического нефроцирроза (т.н. крупнобугристая атеросклеротическая сморщенная почка). Прогрессирующий атеросклероз также может способствовать недостаточности. Не развитию может или остаться усугублять без внимания течение тот почечной факт, что атеросклеротическое поражение сосудов стало чаще встречаться не только среди людей групп риска, но и у лиц молодого возраста, женщин и представителей активных профессий (Gokay S. et al., 2013; Ranthe M.F. et al., 2013; Caviezel S. et al., 2014; Vlachopoulos C. et al., 2014). Атерогенез представляет собой длительный, многоэтапный процесс, долгое время протекающий бессимптомно, часто выявляющийся на клинической стадии уже в виде серьезных осложнений. Задействованность многих систем в атерогенезе, в том числе эндокринной, позволяет отнести атеросклероз к 5 системной патологии, что подтверждает целостность организма. В ряде работ указывается на взаимосвязь гипофункционального состояния щитовидной железы и атеросклероза в пожилом возрасте (Mitu F. et al., 2012; Tseng F.Y. et al., 2012; Pasqualetti G. et al., 2013), однако имеются данные, показывающие, что возраст, изменение ТТГ, общего холестерина, триглицеридов являются независимыми предикторами наличия каротидных бляшек (Valentina V.N. et al., 2011). При этом остается неясным – что является первичным изменением (Wang P. et al., 2014). Проблеме морфофункционального состояния щитовидной железы при различных патологических процессах уделяется внимание многими авторами (Федченко Н.П., 1988; Хмельницкий О.К., Котович В.М., 1997; Дедов И.И. с соавт., 2001; Васильева Е.В., 2009; Яглова Н.В., 2011; Bamashmoos S.A. et al., 2013; Geng H. et al., 2014). Это связано с высокой значимостью тиреоидных гормонов в поддержании гомеостаза организма, лабильностью щитовидной железы при воздействии эндо- и экзогенных факторов. В настоящее время считается приоритетным одновременное изучение нескольких функциональных систем (нервная, гуморальная, иммунная), осуществляющих регуляторную функцию в тесной взаимосвязи друг с другом. По современным представлениям наименее изученным остается взаимодействие щитовидной железы с ее лимфатической системой при различных патологических состояниях, в том числе, при атеросклерозе (Горчакова О.В., 2010; Valentina V.N., 2011; Backteman K. et al., 2012; Tseng F.Y. et al., 2012; Hamze M. et al., 2013). До последнего времени главенствующее значение в механизмах возникновения и развития атеросклероза отводилось липидам и липопротеинам, главным образом, благодаря фундаментальной работе Аничкова Н.Н., который экспериментально доказал развитие атеросклероза у кроликов, находящихся на холестериновой диете (инфильтрационная теория, 1912-1915г.). В ходе дальнейшего изучения атерогенеза были предложены иные теории развития данного процесса. Среди них: нейрогенная Мясникова А.Л. (1965), мутагенная (моноклональная) Benditt E., Benditt J. (1973), мембранная Jackson R., Gutto A. (1976), аутоиммунная Климова А.Н. (1980-1995) 6 и др. Современный синтетический вариант – инфекционно-аутоиммунно-воспалительная теория, объединяющая мультифакторность причин возникновения, но с обязательным первичным повреждением сосудистой стенки. Одна из последних – гомоцистеиновая модель атерогенеза McCully K.S., Wilson R.B. (1975), – является наименее разработанной. Проблема гипергомоцистеинемии как предиктора атеросклероза остается малоизученным вопросом и не всегда учитывается в диагностике и лечении современными врачами. Взаимосвязь между уровнями гомоцистеина, холестерина, тиреоидными гормонами прослеживается в единичных работах последних лет (Bamashmoos S.A. et al., 2013). Степень разработанности проблемы Гипергомоцистеинемия является относительно молодой и малоизученной проблемой современной медицины (Guo H.Y. et al., 2014; Wang S. et al., 2014). В настоящее время нет описания структурно-функциональных преобразований во многих органах при данном патологическом процессе. Щитовидная железа, являясь лабильной структурой, чутко реагирующей на большинство экзо- и эндогенных воздействий, обладая широким спектром регуляторных влияний, представляет собой важный объект для исследования, ввиду возможности выявления морфологических преобразований на ранних стадиях атерогенеза. Помимо этого, интерес к ЩЖ обусловлен патогенетической взаимосвязью между атеросклерозом и гипотиреозом. Участие локального и системного воспаления в инициации и прогрессировании атеросклероза (Нагорнев В.А., Мальцева С.В., 2005; Libby P., 2013) делает целесообразным изучение регионарных лимфоузлов, изменения в которых позволяют судить как о состоянии ЩЖ, так и сделать выводы об иммунологической напряженности организма в целом (Backteman K. et al., 2012; Uchiyama R. et al., 2012; Hamze M. et al., 2013). В литературе отсутствуют сравнительные морфологические исследования щитовидной железы и лимфоузлов при атерогенезе, хотя эта зависимость обнаружена в ряде работ (Горчакова О.В., 2010). В работе Hamze M. et al. (2013) сформулированы общие принципы формирования разнообразных компенсаторно-приспособительных реакций, в 7 частности принцип структурного обеспечения гомеостаза, действующий на всех уровнях организма (от молекулярного до органного): варьирует число активно функционирующих структур, изменяется скорость их обновления и т.д. Поэтому, на наш взгляд, важно проследить характер изменений в изучаемых органах с учетом разных методических подходов к их анализу. Цели и задачи Целью настоящего исследования явилось выяснение специфичности реакций отдельных клеточных популяций в щитовидной железе и регионарных (паратрахеальных) лимфатических узлах при различных моделях атерогенеза (гиперхолестеринемия и гипергомоцистинемия). Для достижения данной цели мы поставили перед собой следующие задачи: 1. Отработать гиперхолестериновую и гипергомоцистеиновую модели атерогенеза у крыс. 2. Определить особенности морфофункциональных изменений щитовидной железы и регионарных лимфоузлов на различных уровнях организации (органный, тканевой, клеточный, субклеточный) при гиперхолестериновой диете. 3. Дать морфофункциональную оценку указанных органов (щитовидная железа и паратрахеальные лимфатические узлы) при гипергомоцистеиновой модели атерогенеза. 4. Провести сравнительный анализ специфичности реакций отдельных клеточных популяций в щитовидной железе и паратрахеальных лимфоузлах при гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза. Научная новизна Впервые показано, что гипергомоцистеинемия является важнейшим триггерным фактором атерогенеза, и патогенетические эффекты гомоцистеина приводят к более грубым морфофункциональным изменениям биологических систем на клеточном и тканевом уровнях, в отличие от структурных изменений, вызванных нарушением липидного обмена при гиперхолестеринемии. Впервые изучен морфофункциональный статус щитовидной железы при гипергомоцистеиновой модели атерогенеза, выявлены дис- и атрофические 8 преобразования, сопровождающиеся гипофункциональным состоянием органа, дан детальный анализ тучноклеточной популяции щитовидной железы и регионарных лимфатических узлов. Впервые показана асинхронность структурных преобразований и различная степень выраженности компенсаторных изменений в органах при разных моделях атерогенеза. Наиболее существенны изменения на субклеточном и клеточном уровнях как в щитовидной железе, так и в лимфатических узлах, проявляющиеся в изменении структуры и количества ядер, числа ядрышек, активно функционирующих тироцитов и органелл, обеспечивающих продукцию специфических белков. Продемонстрирована разная по интенсивности и направленности изменений реакция лимфатических узлов при атерогенезе, индуцированном различными факторами (гиперхолестеринемия и гипергомоцистеинемия). Впервые показано, что более мощным и быстрым атерогенным потенциалом обладает гомоцистеин, в избыточном количестве присутствующий в крови. Впервые выявлено, что в ответ на гипергомоцистеинемию регионарные паратрахеальные лимфоузлы обнаруживают разную реакцию. Структурные изменения самого крупного лимфатического узла (фолликулярная гиперплазия) обеспечивают выполнение лимфоидной функции, другие – лимфодренажной. Теоретическая и практическая значимость Наше исследование демонстрирует однонаправленность гистологических изменений в щитовидной железе и регионарных лимфоузлах на доклинических этапах развития заболевания, что доказывает не только их топографическое единство, но и функциональную взаимосвязь. Наши данные расширяют существующие представления о воздействии гипергомоцистеинемии на щитовидную железу и регионарные лимфоузлы, тем самым позволяя более полно охарактеризовать влияние гомоцистеина на организм в целом. Выявленные морфофункциональные изменения изучаемых органов помогают объяснить отдельные механизмы поддержания внутриорганного гомеостаза и подчеркивают важность изучения тиреоидных гормонов при атеросклерозе. Полученные факты 9 могут быть использованы в последующих научных работах по изучению системного влияния гомоцистеина. Кроме того, результаты данной работы позволяют рекомендовать для апробации в клинической практике определение уровня гомоцистеина, что позволит выявить и в последующем скорректировать атерогенез на доклинических этапах развития патологического процесса, что может обеспечить раннее выявление атеросклероза и предотвращение осложнений. Углубленные представления о внутриорганных структурных перестройках щитовидной железы могут способствовать нахождению новых точек приложения патогенетического лечения и разработке наиболее оптимальной схемы терапии данного состояния. Методология и методы исследования Для выполнения поставленных задач по исследованию структурных и функциональных особенностей реакции органов системы ЩЖ-ЛУ в условиях атеросклеротического процесса различного генеза были воспроизведены экспериментальные модели атерогенеза и использованы общегистологические (окраска гематоксилин-эозином для изучения общей морфологии клеток), гистохимические (реакция по Браше, ШИК-реакция, окраска азотнокислым серебром (AgNOR’s), реакция по Гомори, окраска по Вейгерту, азур-II-эозином, суданом черным), биохимические (липидный спектр – ОХ, ТГ, ЛПНП, ЛПОНП, иммуноферментные (гормоны щитовидной железы Т3 и Т4, уровень гомоцистеина в плазме крови) методы, проведена оценка цитологических показателей крови, для выявления соотношения процессов апоптоза и пролиферации – метод моноклональных антител. Для оценки ультраструктуры клеток была использована электронная микроскопия в вариантах просвечивающей (для щитовидной железы) и сканирующей (для лимфоузлов) методик исследования. Для обобщения цифрового материала была применена статистическая обработка материала с использованием стандартного пакета программ Statistica 6. Положения, выносимые на защиту 10 1) Глубина и выраженность морфофункциональных преобразований в щитовидной железе и окружающих ее лимфоузлах зависит от вида атерогенного индуцирующего фактора (гиперхолестеринемия и гипергомоцистеинемия). 2) При гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза в щитовидной железе свидетельствующие о происходят дис- гипофункциональном и атрофические состоянии изменения, органа. Наиболее чувствительными структурами при атерогенезепри различных моделях его воспроизведения являются фолликулярный эпителий, коллоид и соединительнотканная строма органа. 3) Степень морфофункциональных изменений в щитовидной железе при гипергомоцистеинемии выше, чем при атерогенной дислипидемии, что проявляется в более выраженном изменении процентного соотношения тканевых компонентов органа (эпителий – коллоид – строма), а также в значительном увеличении секреторной активности тучных клеток. 4) В паратрахеальных лимфоузлах при холестериновой нагрузке наблюдается паракортикальная гиперплазия, характеризующая активность Тклеточного звена иммунитета, при гипергомоцистеинемии – фолликулярная гиперплазия, отражающая усиление В-клеточного иммунитета; регионарные лимфоузлы при гипергомоцистеинемии испытывают неодинаковую нагрузку. Апробация работы Материалы Объединенном настоящего исследования Иммунологическом форуме доложены и обсуждены (Санкт-Петербург, 2008), на VI Всероссийском съезде анатомов, гистологов и эмбриологов (Саратов, 2009), III эмбриологическом симпозиуме Всероссийского Научного Общества анатомов, гистологов, эмбриологов «Закономерности эмбриофетальных морфогенезов человека и позвоночных» (Ханты-Мансийск, 2011), Объединенном Иммунологическом форуме (Нижний Новгород, 2013), Всероссийской научной конференции «Актуальные проблемы адаптогенеза и репаративных гистогенезов (Оренбург, 2013), межвузовских научных конференциях молодых ученых и студентов (Ижевск, 2010, 2012, 2013, 2014), совместных межкафедральных 11 конференциях Ижевской государственной медицинской академии в 2008-2014 г.г. Апробация работы проведена на совместном заседании кафедр биологии с экологией; цитологии, гистологии и эмбриологии; анатомии человека; патологической анатомии; патофизиологии; микробиологии, вирусологии и иммунологии; нормальной здравоохранения; физиологии; поликлинической общественного терапии с курсом здоровья и клинической фармакологии ФПК и ПП ГБОУ ВПО «Ижевская государственная медицинская академия» Министерства здравоохранения и социального развития Российской Федерации 25.06.2014 года. Публикации По теме диссертации опубликована 21 научная работа, в том числе 7 статей и 4 тезисных сообщения в рецензируемых журналах, рекомендованных ВАК Министерства образования и науки РФ, оформлено одно рационализаторское предложение. Объем и структура диссертации Диссертация изложена на 167 страницах машинописного текста и состоит из введения, обзора литературы, результатов собственных исследований, заключения, выводов, практических рекомендаций и указателя литературы. Работа иллюстрирована 14 таблицами и 76 рисунками. Библиография включает 337 источников, в том числе 181 – на иностранном языке, занимает 36 страниц. 12 ГЛАВА 1. ОБЗОР ЛИТЕРАТУРЫ 1.1.Уровни организации биологических систем и методы их анализа на примере щитовидной железы (ЩЖ) и паратрахеальных лимфоузлов (ПТЛУ) в норме и эксперименте Уровни организации живого характеризуются специфическими взаимодействиями компонентов и отчетливыми особенностями взаимоотношений с ниже- и вышележащими системами. Понятие об уровнях имеет широкое значение и относится к системам, которые существуют благодаря связям, объединяющим составляющие их компоненты в целое, что подтверждает свойство иерархичности. Выделяют следующие уровни организации живой материи: биосферный, биогеоценетический, популяционно-видовой, организменный, системный, органный, тканевой, клеточный, субклеточный. Для современного представления о гистофизиологии щитовидной железы наиболее рационально рассмотреть следующие уровни ее организации: Органный уровень организации. В функциональном статусе эндокринной системы и поддержании гомеостаза организма важную роль играет щитовидная железа, отличающаяся выраженной морфофизиологической органо- специфичностью (Гербильский Л.В., 1985; Глумова В.А., 1987; Федченко Н.П., 1987; Балаболкин М.И., 1989; Виноградов С.Ю., 1989; Семенов В.В., 1996; Юминова Н.А., 1996; Andersson H.C. et al., 1990; Clark O.H., 1990; Johnson K.E., 1991; Ginsberg J., 1992; Hall R., 1992). Щитовидная железа, располагающаяся на передней поверхности трахеи, между щитовидным хрящом и 5-6 трахейными кольцами, является единственным органом, синтезирующим органические вещества, содержащие йод. Масса ЩЖ у взрослого человека составляет 12-25 г, причем у женщин она несколько выше по сравнению с мужчинами того же возраста. В период менструации и беременности масса ЩЖ увеличивается (Дедов И.И. с соавт., 2001; Кокорев А.В., 2003; Асфандияров Р.И. с соавт., 2004; Забродин В.А. с соавт., 2005; Каган И.И., Фатеев И.Н., 2007; Гайворонский И.В., Ничипорук Г.И., 2009). 13 Щитовидная железа имеет вид бабочки, крылья которой представлены левой и правой долями, соединенными между собой перешейком. Размеры каждой доли составляют 2,5-4 см в длину, 1,5-2 см в ширину и 1-1,5 см – толщины. Перешеек может отсутствовать, иногда представлен широкой полосой, доли железы могут располагаться ассиметрично. В 20-25% выявляется пирамидальная доля, располагающаяся над перешейком и представляющая собой небольшое количество тироидной ткани. Реже выявляются добавочные доли ЩЖ, располагающиеся в треугольнике, основанием которого является подъязычная кость, а вершиной – щитовидный хрящ (Глумова В.А., Черенков И.А., 2003; Калмин О.В., Никишин Д.В., 2007). ЩЖ заключена в соединительнотканную оболочку, состоящую из наружной и внутренней капсулы, между которыми находятся сосуды, возвратный нерв и околощитовидные железы. ЩЖ очень интенсивно кровоснабжается. Кровь поступает в орган по верхним (ВЩА) и нижним (НЩА) щитовидным артериям (Yamasaki M., 1995), а также по непостоянной дополнительной срединной артерии. ВЩА человека (диаметр 2,4-2,9 мм) являются основным источником кровоснабжения передних отделов органа, а НЩА распространяется по задней его части (Ермолович Н.А., 1998; Фатеев И.Н., 1999; Zhao S.Z. et al., 1999). Работами румынских исследователей выявлена более высокая васкуляризация центральных отделов долей ЩЖ по сравнению с их периферией (Rottenberg N. et al., 1990). Отток крови от ЩЖ осуществляется по верхним и нижним щитовидным венам, а также через боковую вену Кохера (Фатеев И.Н., 1999). Венозная кровь собирается в широкое венозное сплетение, наиболее развитое в области перешейка и передней поверхности трахеи, так называемое непарное венозное щитовидное сплетение. Регионарными лимфатическими узлами (ЛУ) ЩЖ являются пред- и паратрахеальные лимфатические узлы, которые затем анастомозируют с глубокими лимфатическими узлами шеи (Фатеев И.Н., 2006; Черных А.В. с соавт., 2006). Лимфатические узлы являются органами периферического иммуногенеза. Согласно концепции Ю.И. Бородина о лимфатичеком регионе, объединение органа и окружающих его лимфатических узлов – это единая 14 функциональная гомеостатическая система. Морфофункциональное состояние ЛУ отражает как деятельность всего организма в целом, так и состояние его определенной области. Началом внутрижелезистой лимфатической системы ЩЖ являются межфолликулярные лимфатические капилляры, окружающие фолликулы. На периферии дольки они образуют сеть коллекторных капилляров, служащих началом междольковых лимфатических сосудов первого порядка, которые, сливаясь из разных долек, образуют более крупные коллекторы второго порядка. Подходя к поверхности железы, они формируют паренхиматозное сплетение и поверхностную капсульную сеть, которая имеет небольшие лимфатические узлы, расположенные под капсулой органа. Щитовидная железа характеризуется высокой структурной и функциональной лабильностью в ответ на различного рода воздействия. В ходе индивидуального развития потребности в тиреоидных гормонах значительно меняются, что обеспечивается сложными перестройками структурных компонентов ЩЖ. Щитовидная железа млекопитающих к моменту рождения представляет собой сформированный орган. Темпы роста ЩЖ у человека неравномерны. Так, со 2-го месяца внутриутробного развития и до рождения масса органа увеличивается в 103,5 раза, в последующем нарастание массы железы замедляется – с момента рождения и до 20-50 лет она увеличивается в 10,4 раза (Калмина О.А., Никишин Д.В., 2009). Переход к внеутробному образу жизни сопровождается функциональным напряжением ЩЖ, в которой обнаруживают участки дискомплексации с резорбцией коллоида, десквамацией и деструкцией фолликулов. Рост ЩЖ у молодых животных обеспечивается увеличением размеров предшествующих и образованием новых фолликулов, пролиферацией и гипертрофией клеток и их ультраструктур. При этом повышается функциональная активность органа, достигая максимального уровня к моменту полового созревания. С возрастом укрупнение фолликулов и уплощение фолликулярных клеток закономерно сопровождается угнетением 15 йодаккумулирующей и гормонопоэтической способности ЩЖ (Глумова В.А., 1987; Удочкина Л.А., Санджиев Э.А., 2007). Развитие восстановительных процессов в органе зависит от уровня тиреоидных гормонов, скорости метаболических процессов, состояния сосудистой системы органа и его соединительнотканного компонента, а также целого ряда других факторов эндо- и экзогенной природы. При нарушении функции ЩЖ у человека, ее физиологической, компенсаторной и патологической гиперплазии наблюдаются выраженные колебания в количестве и структуре органелл клеток всех типов (Глумова В.А.,1987; Марков О.Е., Должиков А.А., 2002; Шлыков И.П., 2004; Васильева Е.В., 2009). Таким образом, восстановительные процессы в органе, направленные на компенсацию нарушенных функций, осуществляются вследствие фолликулообразования, пролиферации железистых клеток и их гипертрофии, связанной с регенерацией ультрастуктур. Прижизненное изучение и определение анатомических показателей ЩЖ и лимфоузлов производится с использованием ряда методов: сканирование; ультразвуковое исследование (УЗИ); рентгено-, ангио- и лимфография; компьютерная и ядерно-магнитная томография; биопсия. Тканевой уровень организации. Щитовидная железа представляет собой сложную гетерогенную тканевую систему. Если рассматривать с позиций гистогенеза, в ЩЖ можно выделить три взаимосвязанные тканевые системы: собственно-тиреоидная паренхима, ультимобранхиальные фолликулы и С-клетки (Быков В.Л., 1979; Андроник В.И., Мельник Б.Е., 1986; Петрова Н.И., Бирюкова О.В., 2002; Быков В.Л., 2004; Забродин О.А. с соавт., 2005). Основная масса ЩЖ состоит из собственно тиреоидной паренхимы, образованной типичными тироцитами, в основном интерфолликулярные клетки. двух разновидностей: Фолликулярные клетки фолликулярные образуют и стенку фолликулов. Интерфолликулярные клетки расположены между фолликулами – это так называемые интерфолликулярные островки (Глумова В.А. с соавт., 2005; Калмина О.А., Никишин Д.В., 2009). Ультимобранхиальная ткань в ЩЖ, среди 16 клеточных элементов которой встречаются С-клетки и типичные тироциты, формирует систему фолликулов. Под системой ультимобранхиальных фолликулов понимается только ткань, имеющая четкие морфологические признаки ультимобранхиального генеза (Быков В.Л., 1979; Андроник В.И., Мельник Б.Е., 1986; Калмина О.А., Никишин Д.В., 2009). Однако до сих пор нет единого взгляда на гистогенез элементов паренхимы ЩЖ. Остается неясной и функция ультимобранхиальных фолликулов. С позиций системного подхода современной морфологии, структурнофункциональной единицей щитовидной железы является тироидон (тиреон, тиреоидный микрорайон) – комплекс фолликулов, объединенных морфологически (Федченко Н.П., 1988; Усенко В.С., 1989; Черенков И.А., 2001; Maile S., Merkel H.J., 1995), имеющих общие трофические (Качалка О.В., 1986; Хмельницкий О.К., Котович В.М., 1997) и регуляторные связи (Гербильский Л.В., 1987; Погорелов Ю.В. с соавт., 1988; Усенко В.С., 1989), окруженные клеточными элементами, преимущественно мезенхимального происхождения – мастоцитами, гистиоцитами, фибробластами (Гербильский Л.В., 1984, 1985; Виноградов С.Ю. с соавт., 1987; Рящиков С.Н., 1989; Павлов А.В., 1994; Bechther G. et al., 1987; Rottenberg N. et al. 1990), а также лимфатические сосуды (Бородин Ю.И, 2009; Горчакова О.В., 2010). Полости фолликулов заполнены коллоидом, основную часть которого составляет гликопротеид тиреоглобулин (Березин В.А. с соавт., 1993; Васильева Е.В., 2009; Kameda Y., 1995). В полости фолликулов тиреоглобулин находится в компактизированной форме, его концентрация достигает 100-400 мг/мл. Молекула тиреоглобулина включает 5496 аминокислотных остатков и содержит 140 тирозиновых остатков и около 10% углеводов (галактоза, манноза, фукоза, сиаловые кислоты, N-ацетилглюкозамин, хондроитинсульфат). Тканевой уровень лимфатического узла представляет собой изменчивую область в связи с постоянным действием антигенов на лимфоидную ткань. Первым пограничным соединительнотканная структурным капсула, компонентом представленная 17 сетью ЛУ является коллагеновых, эластических и ретикулярных волокон. Внутри ЛУ, между трабекулами, располагается лимфоидная паренхима, образованная ретикулярной стромой и клетками лимфоидного ряда. Ретикулярная строма представлена трехмерной сетью, петли которой формируются ретикулярными волокнами и ретикулярными клетками. Паренхиму ЛУ разделяют на корковое и мозговое вещество. Корковое вещество занимает периферические отделы ЛУ. В нем имеется диффузная лимфоидная ткань, а также лимфоидные узелки с центрами размножения и без них. Количество и размеры лимфоидных узелков могут варьировать в зависимости от влияния различных эндо- и экзогенных факторов (Бородин Ю.И, 2009). Многие авторы обращают внимание на наличие корреляционных взаимосвязей между патологическими изменениями в органах и регионарных лимфоузлах (Горчакова О.В., 2010; Горчакова О.В., Горчаков В.Н., 2013; Гусейнов Т.С., Гусейнова С.Т., 2012). В зоне диффузной лимфоидной ткани выделяют корковое плато, в котором различают расположенную между узелками межузелковую зону, а также лимфоидную ткань кнаружи от узелков, между ними и капсулой узла. Светлые центры являются местом размножения клонов клеток, реагирующих на антиген, зоной, где идет образование предшественников плазмоцитов и лимфоцитов памяти, а также регионом, в котором может происходить увеличение числа лимфоцитов, не зависящее от действия чужеродных агентов. Лимфоидные узелки считают зоной первого контакта антигена с иммунокомпетентными клетками (Белянин В.Л., Цыплаков Д.Э., 1999; Кормилина Н.В., 2004; Muretto P., 1994). Кнутри от лимфоидных узелков имеется полоска лимфоидной ткани, граничащая с мозговым веществом – паракортикальная зона. Изменения в этой зоне происходят при действии антигенов, активирующих как клеточное, так и гуморальное звено иммунитета (Ковалевский Г.В., 1992; Кормилина Н.В., 2004). Значимой структурной особенностью данной области является наличие посткапиллярных венул с высоким эндотелием (Girard J.P. et al., 2012; Bai Z. et al., 2013). Мозговое вещество находится в центральной части узла, вблизи его ворот. Паренхима мозгового вещества представлена мякотными тяжами, направленными к воротам 18 ЛУ. Синусы ЛУ, расположенные в строме органа, представляют собой пути оттока лимфы через узел. Афферентные лимфатические сосуды входят в ЛУ на его выпуклой стороне, а эфферентные – выходят с противоположной (вогнутой), называемой воротами. Лимфа поступает в субкапсулярный синус и затем фильтруется через сеть мозговых синусов. Каркас этих синусов образован коллагеном IV типа, к которому прилежат выстилающие синус клетки. Одним из основных методов количественного изучения органов на светооптическом уровне является метод точечного счета (Хмельницкий О.К., Третьякова М.С., 1997). Если на плоскость наблюдения, содержащую несколько объектов, наложить систему точек, то отношение количества точек, попавших на объекты, к общему числу точек равно удельной площади объектов. Например, при увеличении ×420 с помощью окулярной морфометрической сетки учитывается не менее 1000 точек; по Автандилову Г.Г. используют тест сетку с 25 точками, 289 точками, наблюдение проводят в 1-15 полях зрения, с 69 точками (Автандилов Г.Г., 1990). Объемы исследуемых тканевых компонентов выражают в процентах соответственно числу точек измерительной сетки. При количественном исследовании эпителиального компонента ЩЖ, в том числе фолликулообразования (степени фолликулярной организации), измеряются следующие показатели: внутренний и внешний диаметр, форма и объем фолликулов; мозаичность строения ЩЖ (процентная доля фолликулов разной величины, диаметра или формы); суммарный и относительный объем эпителия в целом, фолликулярного и интерфолликулярного эпителия, очагов гиперплазии фолликулярного эпителия; показатель гетероморфности (морфологической энтропии тироцитов – количественная оценка степени разнообразия железистых клеток). Для количественной характеристика коллоида рассчитывают: суммарный и относительный стереологический объем коллоида индекс резорбции (в том (СИР), числе, резорбированного) характеризующий и динамику накопления и выведения интрафолликулярного коллоида; индекс накопления коллоида, фолликулярно-коллоидный индекс (ФКИ, индекс активности ЩЖ). Для анализа стромы ЩЖ пользуются следующими показателями: суммарный и 19 относительный объем стромы и лимфо-плазмоцитарной инфильтрации (Т- и Влимфоцитами), индекс «склерозирования», количество фибробластов на единицу площади в стандартном поле зрения. С целью оценки сосудистого русла ЩЖ применяют показатели: суммарный и относительный объем сосудистого русла; индекс кровоснабжения ЩЖ; относительный объем капилляров к объему органа; коэффициент кровоснабжения ЩЖ; относительный объем (площадь) активных по определенному ферменту парафолликулярных микрососудов к суммарному объему сосудистого русла. Для оценки состояния лимфатических узлов используют стереометрический метод и метод наложения точечных морфометрических сеток (Стефанов С.Б, 1985) с определением объемной плотности структурных лимфоидных узелков, зон (площади лимфоидных мантии узелков и без центров центров размножения размножении, паракортикальной зоны, мякотных тяжей, мозговых синусов, краевого синуса, толщину капсулы). Расчет корково-мозгового индекса позволяет определить структурно-функциональный тип лимфатического узла (Бородин Ю.И., 1969). Выбор метода изучения ЩЖ и ЛУ на тканевом уровне (из данного перечня) зависит от задач исследования. Клеточный уровень организации. В паренхиме железы выделяют несколько типов клеток: фолликулярные клетки (А-клетки), парафолликулярные (С-клетки) и клетки Ашкенази-Гюртля (В-клетки). Данная классификация клеточных элементов была предложена в 1975 году Краевским Н.А. с соавт. и признается большинством исследователей (Андроник В.И., Мельник Б.Е., 1986; Черенков И.А., 2001; Быков В.Л., 2004; Redmond O., Tuffery A.R., 1981). Клетки щитовидной железы представлены в основном тироцитами (А-клетки) (MartinLavace I. et al., 1993). Клетки располагаются в один ряд, ограничивая фолликул. Как правило, форма тироцита – кубическая, однако, при гипо- или гиперфункции высота клетки может меняться (Автандилов Г.Г., 1984; Хмельницкий О.К., Третьякова М.С., 1997; Черенков И.А., 2001). В-клетки характеризуются высокой активностью метаболических процессов, способностью поглощать и накапливать биогенные амины, в частности, 20 серотонин, что позволяет отнести их к APUD-системе (amino precursor uptake and decarboxylation - диффузная эндокринная система) (Кветной И.М., 1987). В- клетки обнаруживаются в щитовидной железе в период полового созревания, содержание их возрастает к старости. При злокачественном перерождении, аденоме ЩЖ количество В-клеток значительно выше, в связи с чем их называют онкоцитами щитовидной железы, трансформировавшимися из типичных тироцитов (Андроник В.И., Мельник Б.Е., 1986; Аксенова Н.П. 1994;). Другие авторы считают, что клетки Ашкенази-Гюртля не возникают непосредственно из тироцитов, но развиваются из общего с ними источника (Краевский Н.А. с соавт, 1971; Смирнова Е.А., 1974). Некоторые исследователи (Виноградов С.Ю., Погорелов Ю.В., 1984; Gershon M.D. et al., 1976) рассматривают В-клетки как особую форму функционального состояния тироцитов. Есть мнение, что В-клетки должны быть отнесены к популяции нейроэндокринных, поскольку наряду с серотонином они содержат соматостатин (Алешин Б.В., 1988). Таким образом, вопрос о роли, происхождении и выделении В-клеток в самостоятельную группу в настоящее время остается спорным. Отдельной категорией клеток можно считать С-клетки (называемые также парафолликулярными клетками), необходимые для поддержания системы гомеостатического регулирования (Горбунова М.П., 1981; Алешин Б.В., Губский В.И., 1983; Аксенова Н.П., 1993; Kameda Y., 1995; Thomas G.A. et al., 1992). Распределение С-клеток неодинаково по объему органа. Большая их часть обнаруживается в центральной части, в отличие от периферийных областей и перешейка (в последнем случае они не выявляются) (Аксенова Н.П., 1993; Шадлинский В.Б., Рустамова С.М., 2000; Marti-Lavace I. et al., 1993; Kameda Y., 1995). С-клетки интегрированы в выстилку фолликулов, сообщаясь с его просветом, или, не контактируя с ним, находятся в соединительной строме, образуя небольшие скопления (Алешин Б.В., Губский В.И., 1983; Рящиков С.Н., 1989; Глумова В.А. с соавт., 1991; Марков В.Н., 1998; Kameda Y., 1995). Кальцитониноциты отличаются от тироцитов разнообразной формой. Они могут 21 быть округлыми, полигональными и даже иметь выросты (Хмельницкий О.К., Ступина А.С., 1989; Аксенова Н.П., 1993). По данным авторов, применявших непрямой иммунопероксидазный метод с антисывороткой к кальцитонину человека, общее количество и концентрация Склеток у людей с возрастом увеличиваются (Gibson W.G. et al., 1982). Это подтверждается и морфометрическими исследованиями на лабораторных животных (Рящиков С.Н., 1989; Марков В.Н., 1998). У крыс возрастная гиперплазия С-клеток носит системно-популяционный характер – количество клеток в поле зрения практически постоянно (с учетом увеличения размеров ЩЖ это означает увеличение абсолютного числа С-клеток), а объем их цитоплазмы достоверно нарастает (Рящиков С.Н., 1989; Хмельницкий О.К., Ступина А.С., 1989; Марков В.Н., 1998). Такая возрастная динамика основана на митотической репродукции С-клеток и их гипертрофии за счет внутриклеточной регенерации (Красноперов Р.А. с соавт., 2000). Кальцитониноциты вырабатывают по меньшей мере три полипептидных гормона семейства кальцитонина – кальцитонин, катакальцин, пептид гена кальцитонина, а также соматостатин, нейротензин, бомбезин и целый ряд других биологически активных веществ (Држевецкая И.А., 1994; Чернышева М.П., 1995; Новицкий В.В. с соавт., 1997; Arias J. et al., 1989). Функциональное значение кальцитониноцитов во многом определяется их принадлежностью к APUD-системе (Алешин Б.В., 1984; Яглов В.В., 1989; Pearse A.G., 1992; Clark M.S. et al., 1995; Johnston D. et al., 1998). Они накапливают, метаболизируют и выделяют моноамины (Чернышева М.П., 1995; Марков В.Н., 1998). С-клеткам принадлежит важная роль в фолликулогенезе и регуляции морфогенетической активности кровеносных капилляров (Федченко Н.П., 1986; Krasnoperov R.A. et al., 2009). В отдельный клеточный клон ЩЖ можно выделить тучные клетки (ТК), которые являются активными участниками многих физиологических и патологических реакций и широко представлены практически во всех органах и тканях (Зуга М.В., Невзорова В.А., 1999; Ильин Д.А., 2011). ТК являясь 22 структурным элементом соединительной ткани органов и сосудистой стенки, оказывают влияние на метаболические процессы, пролиферацию клеток, проницаемость сосудистой стенки, развитие иммунных и воспалительных реакций (Ильин Д.А., 2011; Galli J. et al., 2005; Kovanen P.T., 2009; Smith D.D. et al., 2012; Shi G.P., Lindhol J.S., 2013). В ответ на воздействие антигенов, ТК выделяют разнообразные биологически активные вещества (гистамин, нейтральные протеазы – химаза и триптаза, кислые гидролазы, серотонин, катепсин G, карбоксипептидаза, гепарин- и хондроитин-сульфат, протеогликаны), а также медиаторы воспаления, которые синтезируются при активации клетки (PAR, простагландин D2, лейкотриен С4, IL-4, IL-5, IL-6, IL-8, IL-13, TNF-α, MIP-α (воспалительный белок макрофагов α) (Galli J. et al., 2005). ТК также высвобождают такие регуляторы, как NO, TGF-β1 (трансформирующий фактор роста-β1) , активатор фибринолиза и др. (Wedemeyer J., Galli S.J., 2000; Chen K., Popel A.S., 2007). NO регулирует активность ТК, повышая уровень цГМФ, секрецию медиаторов и ингибируя агрегацию тромбоцитов (Galkina E., Ley K., 2009). Медиаторы вызывают миграцию и хемотаксис других клеток-участников воспалительной реакции: эозинофилов, Т-клеток (Th2-клеток), базофилов, моноцитов, нейтрофилов (Зуга М.В., Невзорова В.А., 1999; Ильин Д.А., 2011). Биологически активные вещества гранул ТК, такие как гистамин и серотонин, оказывают влияние на клетки иммунной системы (Ставинская О.А., 2008). Выявлено, что повышенные концентрации гистамина и серотонина ассоциируются с увеличением содержания реагинового компонента и значительным дефицитом лимфоцитов CD4+ (Ставинская О.А., 2008; Akdis C.A., Blaser K., 2003). Единичные публикации касаются изменения фенотипа лимфоцита под влиянием гистамина (CD4+ на CD8+) (Jutel M. et al., 2001). Гистамин и серотонин снижают содержание в крови провоспалительных цитокинов IL-6 и TNF-α и повышают уровень противовоспалительного цитокина IL-10 (Ставинская О.А., 2008). ТК оказывают влияние на регенерацию поврежденных тканей. Реакция системы ТК носит системный характер, проявляется в перераспределении ТК 23 между тканями, за счет их миграции, и в тотальной дегрануляции, с секрецией биологически активных веществ (Зуга М.В., Невзорова В.А., 1999; Ильин Д.А., 2011). Считается, что ТК являются гетерогенной популяцией, отличающейся по морфологическим и функциональным свойствам, при попадании предшественников ТК в ту или иную ткань они дифференцируются и микроокружение определяет их окончательный фенотип. Разные типы ТК образуют единую систему регуляции различных физиологических функций организма, играющую важную роль в патогенезе многих заболеваний (Гусельникова В.В. с соавт., 2010; Galli S.J. et al., 2009; Aguirre A. et al., 2013; Alevizos M. et al., 2014). В исследованиях на животных и человеке показано, что на многие воздействия ТК отвечают стереотипной реакцией – изменением количества клеток, выбросом медиаторов из гранул, снижением содержания в них гепарина. Определяющими факторами в механизме секреции являются сила, характер, длительность стрессорного воздействия, индивидуальные, видовые и возрастные особенности организма. Секрецию мастоцитов можно определить по индексам: коэффициент дегрануляции является показателем апокриновой секреции, а гранулолизиса – мерокриновой. Мерокриновый тип секреции, в отличие от дегрануляции, является более щадящим способом, не влекущим значительного разрушения клеточных мембран, а значит, более предпочтительна в условиях срочной адаптации и может рассматриваться как один из ее механизмов. При этом важно учитывать, что ответ соединительной ткани на экстремальное воздействие проявляется со стороны клеточной реакции быстрее, чем волокнистого компонента. Ответ тучных клеток и макрофагов выражен более значительно и проявляется раньше, чем реакция фибробластов. Таким образом, оценка состояния популяции тучных клеток может быть использована как ранний маркер воспалительных изменений в соединительнотканной строме. В норме полностью дегранулированные тучные клетки остаются жизнеспособными и через некоторое время восстанавливают пул медиаторов, тогда как при патологии наблюдается снижение числа ТК, их дегрануляция, а в 24 трудных случаях – замещение нормальной популяции ТК незрелыми мастоцитами с иными цитофизиологическими свойствами. Клеточный состав капсульно-трабекулярной основы ЛУ представлен фиброцитами, фибробластами и единичными гладкомышечными клетками. Макрофаги, мастоциты и клетки лимфо-плазмоцитарного ряда встречаются редко. Клетки лимфоцитопоэтической системы пополняются в ткани ЛУ как за счет местной пролиферации, так и вследствие поступления их из посткапиллярных венул, а также кровеносных капилляров. Клеточный состав коркового плато представлен ретикулярными клетками, лимфоцитами (бластные, средние, малые), плазматическими клетками и макрофагами. Первичные фолликулы построены из малых В-лимфоцитов и фолликулярных дендритных клеток (Белянин В.Л., Цыплаков Д.Э., 1999). Вторичные фолликулы имеют центр размножения, состоящий из бластных клеток (центробласты) и их потомства (центроциты). Эти клетки проявляют полярность в связи с формированием темной зоны из бластных клеток и светлой зоны из центроцитов. Центр размножения окружен мантийной зоной, состоящей из малых В-клеток с фенотипом, похожим на таковой клеток, обнаруживаемых в первичных лимфоидных узелках. В-клетки краевой зоны со светлой цитоплазмой могут обнаруживаться кнаружи от мантийной зоны. Лимфоидные фолликулы содержат сеть фолликулярных дендритных клеток (ФДК). Они захватывают и удерживают иммунные комплексы на своей поверхности для презентации Т- и В-клеткам. Паракортикальная зона представлена в основном Т-лимфоцитами, преимущественно Т-киллерами. Также здесь расположены нефагоцитирующие антиген-перерабатывающие В-клетки, известные как интердигитирующие клетки ретикулума (ИДКР). Они имеют сходство с клетками Лангерганса, но не содержат гранул Бирбека. Кроме того, в паракортикальной зоне определяются рассеянные фагоцитирующие гистиоциты. Клеточный состав ЛУ также включает в себя так называемые плазмоцитоидные моноциты. Они могут располагаться поодиночке, в виде маленьких групп или небольших скоплений, тем самым имитируя фолликулярные центры. Мозговые тяжи ЛУ состоят из клеток лимфоидного ряда, макрофагов, расположенных в 25 петлях сети, образованной ретикулярными клетками. Характерные для лимфоидных узелков дендритные ретикулярные клетки в мякотных тяжах отсутствуют. Стенки синусов ЛУ со стороны их просвета выстланы эндотелиальными (береговыми) клетками. Сквозь эти стенки могут проникать лимфоциты, макрофаги и другие мобильные клетки (Бирюкова О.В., Савельев В.Е., 2000; Бородин Ю.И., 2009; Backteman K. et al., 2012; Bai Z. et al., 2013; Girard J.P. et al., 2014). Для морфометрической оценки клеточного состава ЩЖ используют следующие показатели: средняя высота клеток (тироцитов, клеток Ашкенази, Склеток); количество клеток (на стандартной площади среза, в стандартном поле зрения, на один фолликул). Пролиферативная активность А-, В- и С-клеток определяется на основе следующих показателей: средние измерения диаметра и объема ядра, площади клетки; ядерно-цитоплазматический индекс; митотическая активность; интенсивность реакции Фельгена; оценка ядрышковых организаторов; суммарный объем ядер тироцитов. С целью изучения десквамации используют два показателя: среднее количество десквамированных клеток на 1 фолликул, относительный объем десквамированного эпителия. Для анализа клеточного состава лимфатических узлов применяют стандартный метод подсчета клеточных элементов с использованием специализированной морфометрической сетки (Автандилов Г.Г., 1990). Субклеточный уровень организации. На субмикроскопическом уровне в тироцитах наблюдается распределение органелл по объему цитоплазмы (Ericson L.E., Nilsson M., 1992; Kuliawat R. et al., 1995). Тироциты взимосвязаны между собой различными вариантами межклеточных соединений (замыкательные пластинки, плотные зоны слияния, десмосомы, интердигитации). На поверхности, обращенной к полости фолликула, формируется до 10-12 микроворсинок (в количестве от 7-8 до 10-12) на продольном срезе. Изнутри к апикальному полюсу примыкают актиновые филаменты (Ohno S., Takasu N., 1989), к базальному множество промежуточных филаментов (Ohno S., Takasu N., 1989). В этой области сосредоточены более 80% рецепторов к фактору роста эпидермиса, 26 коллаген VI, что также является проявлением полярности тироцитов (Ohno S., Takasu N., 1989; Westermark K., 1989; Nilsson M. et al., 1995). Процесс поляризации (дифференцировки) тироцитов контролируется ТТГ гипофиза (Brown R.S. et al., 2000). В цитоплазматическом матриксе можно обнаружить капли коллоида, отграниченные от него мембраной. Тироциты расположены на базальной мембране, которая контактирует с базальной мембраной капилляра, могут сливаться друг с другом. Фибриллярный компонент базальной мембраны не выражен (Андроник В.И., Мельник Б.Е., 1986; Хмельницкий О.К., Ступина А.С., 1989; Nakano T. et al., 1995). Ядра тироцитов состоят в основном из эухроматинизированных участков, гетерохроматин расположен вдоль кариолеммы. Объем ядра может меняться в зависимости от функциональной активности и некоторых патологических процессов (Хмельницкий О.К., Третьякова М.С., 1997; Черенков И.А., 2001). Ядрышки крупные, занимают различное положение, их число варьирует при изменении функционального состояния ЩЖ (Боташева В.С., 2000; Черенков И.А., 2001). По поверхности внешнего листка кариолеммы располагаются в значительном количестве рибосомы, шероховатая ЭПС занимает пространство в апикальной части клетки, имеет широкие цистерны, заполненные электроннопрозрачным содержимым; мембраны густо усеяны рибосомами. Состояние эндоплазматического ретикулума изменяется при различных патологических процессах и экспериментальных воздействиях (Хмельницкий О.К., Ступина А.С., 1989; Юминова Н.А., 1996; Kim P.S. et al., 1999). Физиологически изменение объема цистерн ЭПС тироцитов происходит в ответ на стимуляцию ТТГ (Hoang V.C. et al., 1995). Митохондрий много, они электронноплотные, с хорошо выраженными кристами, расположенными поперечно. Эти органеллы структурно взаимодействуют как с ЦПС, так и с ядерным аппаратом клетки. Комплекс Гольджи хорошо развит. В цитоплазматическом матриксе множество как одиночных рибосом, так и собранных в группы (полисомы). Развит вакуолярный аппарат (микро- и мультивезикулярные тельца, первичные и вторичные лизосомы). Их число 27 возрастает в ответ на стимуляцию ТТГ (Хмельницкий О.К., Ступина А.С., 1989; Hoang V.C. et al., 1995). Число, размер, длина микровыростов на апикальной части тироцитов, выраженность складок базальной мембраны влияют на высоту тироцитов – морфологический эквивалент функционального состояния клетки (Андроник В.И., Мельник Б.Е., 1986; Kameda Y., 1995). В-клетки щитовидной железы (клетки Ашкенази-Гюртля) отличаются от фолликулярных А-клеток рядом морфологических (более крупные размеры, гиперхромные ядра), ультраструктурных (большое количество митохондрий, между которыми (высокая располагаются активность секреторные сукцинатдегидрогиназы) гранулы), признаков, гистохимических эозинофильной цитоплазмой (Загуровский В.М., 1986; Юминова Н.А., 1996). Плазмалемма С-клеток плотно прилежит к базальной мембране тироцита, а с другой стороны к базальной мембране капилляра, а также соседствует с телами и отростками аналогичных клеток (Хмельницкий О.К., Ступина А.С., 1989; Красноперов Р.А., 1995; Марков В.Н., 1998; Шадлинский В.Б., Рустамова С.М., 2000; Thomas G.A. et al., 1992; Kameda Y., 1995). Показан факт содержания в тироцитах кальцитонина при отсутствии соответствующей и-РНК. По мнению авторов, это свидетельство межклеточного переноса гормонов (Thomas G.A. et al., 1992). Данный факт на молекулярном уровне доказывает сложившееся представление о С-клетках, как о регуляторах тканевого гомеостаза в ЩЖ (Федченко Н.П., 1982; Виноградов С.Ю., Погорелов Ю.В., 1987; Рящиков С.Н., 1989; Krasnoperov R.A. et al., 2009). Ядра С-клеток на срезе имеют округлую форму, у внутренней ядерной мембраны узкой каймой располагается не очень плотный гетерохроматин; остальная часть ядра электроннопрозрачна. Кариолемма С-клеток отличается ровными очертаниями (Рящиков С.Н., 1989; Gatti R. et al., 1988). Ядрышки, как правило, крупные, расположены эксцентрично. На внешней оболочке ядра располагаются многочисленные рибосомы. Гиалоплазма таких клеток характеризуется умеренной степенью гиперхромии, митохондрий мало, они незначительны по величине, вытянутые, с невыраженными кристами. Цитоплазма содержит секреторные пузырьки, малое 28 количество лизосом, жировых включений (Краснаперов Р.А., 1995; Шадлинский В.Б., Рустамова С.М., 2000). Эндоплазматический ретикулум образован небольшими каналами, на внешней стороне которых много рибосом, комплекс Гольджи хорошо развит, диктиосомы которого имеют гранулы различного размера и степени зрелости. При групповом расположении С-клеток между ними формируются многочисленные контакты, плотные соединения, нексусы, зоны облитерации (Хмельницкий О.К., Ступина А.С., 1989; Черенков И.А., 2001; Thomas G.A. et al., 1992). Нередко в области групп С-клеток определяются терминали нервных волокон, при этом формируется контакт нервных терминалей с С-клетками, эндотелиоцитами и перицитами (Хмельницкий О.К., Ступина А.С., 1989; Красноперов Р.А, 1995; Марков В.Н., 1998). В отростках С-клетки у мембраны, обращенной к базальной мембране капилляра, определяется обилие микропиноцитозных пузырьков. Эндотелиоциты капилляров в этой области истончены (Красноперов Р.А. с соавт., 2000). ИДКР паракортикальной зоны ЛУ отличаются множественными филаментными цитоплазматическими отростками. ИДКР содержат сложные глубоко расщепленные ядра с мелкими ядрышками. Плазмоцитоидные моноциты представляют собой клетки с округлыми, как правило, эксцентричными ядрами, в которых отсутствует характерный для плазмоцитов конденсированный хроматин. При окрашивании препаратов по Гимза цитоплазма базофильная; при электронной микроскопии в ней определяется большое количество гранулярного эндоплазматического ретикулума. Несмотря на то, что пролиферативная активность этих клеток низкая, характерным является обнаружение апоптотических клеток в группах плазмоцитоидных моноцитов. Их скопление и выживаемость определяется цитокинами и, как полагают, предшественниками антиген-представляющих дендритных клеток. 29 1.2. Морфофункциональная лабильность щитовидной железы и лимфатических узлов при различных патологических процессах Структурно-функциональная перестройка клеток щитовидной железы при различных патологических состояниях является актуальной проблемой биологии и медицины, так как тиреоидные гормоны оказывают влияние на многие процессы жизнедеятельности организма. Многие авторы отмечают лабильность в морфологии и функциональной активности щитовидной железы в ответ на действие разнообразных агрессивных факторов как экзо-, так и эндогенной природы. Так, методами световой и электронной микроскопии установлено, что в период внутриутробного развития ЩЖ претерпевает структурную перестройку и способна изменять функциональную активность в зависимости от условий существования организма, что сопровождается изменениями со стороны сосудистого русла, паренхиматозных элементов и межклеточного вещества (Гайдук В.С. с соавт., 2011). Ягловой Н.В. (2011) была выявлена неоднородность реакции центральных и периферических зон долей ЩЖ при создании модели нетиреоидных заболеваний у крыс. Причем, морфофункциональные изменения возникли уже через сутки после введения липополисахарида (снижение концентрации Т4 и ТТГ в сыворотке крови). При изучении мутагенной активности акриламида в клетках ЩЖ у крыс Алтаевой А.А. с соавт. (2011) было отмечено максимальное повышение частоты клеток ЩЖ с цитогенетическими нарушениями в 8 раз. При хронической эндогенной интоксикации в ЩЖ выявляется мозаичное нарушение гистоархетиктоники органа (Калашникова С.А. с соавт., 2011). По мере увеличения длительности эндотоксикоза структурные преобразования в ЩЖ характеризуются фазовыми изменениями и не имеют принципиальных особенностей в различных моделях. Реакция тканей ЩЖ на экспериментальную макроглоссию была выявлена через 2 месяца от начала исследования и проявлялась в виде достоверного увеличения высоты эпителия и диаметра коллоида с одновременным увеличением диаметра фолликулов. 30 Полученные результаты могут свидетельствовать о тенденции к повышению функциональной активности ЩЖ, которая на данный срок определялась сбалансированностью накопительного и инкретного процессов. Через 4 месяца у опытных животных наблюдалось достоверное увеличение высоты эпителия железы, которое привело к значительному уменьшению значений фолликулоэпителиального индекса, что может свидетельствовать о функциональном напряжении ЩЖ (Матвеев Р.С. с соавт., 2012). Щитовидная железа реагирует на экзо- и эндогенные воздействия, что выражается в изменении ее функциональной активности (определяемой по содержанию в плазме крови тироксина и трийодтиронина) и морфологических показателей, основными из которых являются высота тироцитов, диаметр фолликулов и соотношение тканевых компонентов. Большинством исследователей (Глумова В.А., 1987; Хмельницкий О.К., Котович В.М., 1997; Хмельницкий О.К., Третьякова М.С., 1997; Martin-Lavace I. et al., 1993) признаны следующие морфологические критерии повышенной гормоногенетической активности тироцитов: увеличение высоты тироцитов; крупные округлые ядра тироцитов с расположением большой оси перпендикулярно базальной мембране; высокой активностью ДНК в ядрах тироцитов; наличие пролиферирующих тироцитов; повышенное содержание РНК в цитоплазме клеток; накопление в апикальных частях тироцитов ШИК-позитивных капель. Вызывает интерес состояние ядрышкового аппарата тироцитов, что в настоящее время остается малоизученным. Гипофункция железы проявляется противоположными изменениями (Марков В.Н. с соавт., 1991; Глумова В.А. с соавт., 1993; Муравьев О.Б., 1994; Вылегжанина Т.А. с соавт., 1996; Юминова Н.А., 1996; Clark O.H., 1990; Hall R., 1992; Cabanillas A.M. et al., 1994). Лимфатический узел – динамичная структура, подверженная различным морфологическим преобразованиям при воздействии различных факторов (Сапин М.Р. с соавт., 2001; Кормилина Н.В., 2004; Нурмухамбетова Б.Н., Дюсембаева А.Т., 2005). При старении наблюдается как уменьшение количества лимфоузлов, 31 так и признаки их морфологической дегенерации (Ahmadi O. et al., 2013). Значительные преобразования происходят в морфологическом статусе лимфатических узлов при беременности. Так в ряде работ (Thuere C. et al., 2007; Leber A. et al., 2010; Schumacher A. et al., 2012; Teles A. et al., 2013) указывается на наличие регуляторных Т-лимфоцитов (Tregs), которые накапливаются в лимфатических узлах тимуса и матки на ранних сроках беременности. На более поздних сроках гестации Tregs определяются также и в периферических лимфоузлах. В экспериментальных исследованиях на собаках показано, что воздействие физической нагрузки на неподготовленный организм вызывает существенные изменения клеточного состава лимфатических узлов. Возрастает количество клеток в воротном синусе, что говорит о миграции клеток из ЛУ. Было выявлено, что во всех зонах ЛУ увеличивается количество дегенеративно измененных клеток. В краевой зоне и мозговых тяжах снижается доля средних лимфоцитов. При электронно-микроскопическом исследовании выявлено множество вакуолей в цитоплазме клеток, расширение перинуклеарного пространства, набухание митохондрий, разрушение их крист, разрыв оболочки ядра (Бирюкова О.В., Савельев В.Е., 2000). В работе Coursey T.G. et al. (2013) и Chen Y. et al. (2013) показано участие шейных лимфатических узлов в патогенезе синдрома сухого глаза в виде активации рецепторов хемокинов CCR6 and CXCR3, экспрессируемых на поверхности клеток Th-17 и Th-1 соответственно. Немало научных сообщений посвящено изменениям в лимфоузлах при хроническом психологическом стрессе (Wang H.Y. et al., 2012; Kain M.J., Owens B.M., 2013; Stefanski V. et al., 2013; Füchsl A.M. et al., 2014; Hall J.M. et al., 2014). Показана способность лимфоцитов оказывать нейропротективное действие за счет выделения медиаторов при моделировании нейродегенеративных заболеваний (Shrestha R. et al., 2013). Parker V.J. et al. (2014) при создании модели алиментарного ожирения на ранних сроках беременности отмечали снижение активности Т-клеточного звена иммунитета, что проявлялось уменьшением количества NK-лимфоцитов и секреции интерферона-γ. При хронической интоксикации хромом и бензолом в Т-зависимых зонах лимфатических узлов и 32 селезенки выявляются апоптотические тимоциты и лимфоциты (Ermolina E.V. et al., 2012). В настоящее время имеется много сведений о взаимосвязи между гипотиреозом и атеросклерозом (Valentina V.N. et al., 2011; Mitu F. et al., 2012; Tseng F.Y. et al., 2012; Kilic I.D. et al., 2013; Pasqualetti G. et al., 2013; Billon C. et al., 2014; Posadas-Romero C. et al., 2014; Wang P. et al., 2014). Эти два процесса, как правило, сопровождают и усугубляют течение друг друга. Так, установлено, что высокий уровень свободного тироксина в сывортке крови способствует кальцификации аорты, повышению жесткости ее стенки и как следствие – преждевременному появлению возрастных изменений в сосудистой системе (Kim E.S. et al., 2012; Caviezel S., 2014; Delitala A.P. et al., 2014; Zhang Y. et al., 2014). Некоторыми учеными выдвигается версия о том, что гормоны щитовидной железы обладают холестерин-снижающим действием и с этим связано появление гипотиреоза, как протективного мехнизма (Billon C. et al., 2014). В тоже время группой ученых было установлено, что при коррекции тиреоидного статуса у больных с субклиническим гипотиреозом, показатели липидного профиля не нормализуются (Anagnostis P. et al., 2014). Таким образом, данные по течению атеросклероза и гипотиреоза в настоящий момент противоречивы и остается открытым вопрос о том, какой из этих патологических процессов первичен. Лимфатические узлы как лабильная система также претерпевают морфофункциональные изменения при атеросклерозе. Так, по сообщению Hamze M. et al. (2013), В-клетки обладают протективными и проатерогенетическими эффектами. Атеропротективные свойства Т-клеток проявляются в увеличении субпопуляций СD4(+) и CD25(+) в лимфатических узлах и селезенке, а также в повышении супрессивной функции регуляторных Т-клеток in vitro (Uchiyama R. et al., 2012). По данным других авторов увеличение количества Т-лимфоцитов свидетельствует о нестабильности атеросклеротических бляшек и риске развития острых сердечно-сосудистых осложнений (Backteman K. et al., 2012), причем изменения в субпопуляции лимфоидных клеток происходят быстрее и более выражены в лимфоузлах, чем в плазме крови. В работе Scherer E.B. et al. показано, 33 что атерогенетические гипергомоцистеинемией, изменения, вызванные сопровождаются хронической изменением умеренной активности эктонуклеотидаз, которые играют роль в развитии провоспалительного статуса. Одним из компенсаторных механизмов для задержки развития или даже регрессии атерогенеза является выведение холестерина из атеросклеротической бляшки при помощи макрофагов через стенку лимфатических сосудов (Martel C., Randolph G.J., 2013). Имеется небольшое количество современных сообщений зарубежных авторов (Stranford S., Ruddle N.H., 2012; Kawahara I. et al., 2013; Mohanta S. et al., 2014) о роли сосуд-ассоциированной лимфоидной ткани (VALT) в развитии атеросклеротической бляшки. Согласно этим данным система VALT обеспечивает динамическое равновесие между синтезом и деградацией коллагена, однако, до конца ее роль еще не ясна. . 1.3. Методы экспериментального воспроизведения гипергомоцистеинемии Сравнительно недавно к известным факторам риска развития атеросклероза стали относить гипергомоцистеинемию. Гипергогомоцистеинемия – это повышение уровня гомоцистеина в плазме крови выше 5-16 мкмоль/л. Гомоцистеин – это серосодержащая аминокислота, гомолог аминокислоты цистеина, отличающаяся от него на одну метильную группу (-СН2-). Схема биохимических превращений гомоцистеина представлена рисунке 1.3.1. 34 на Рисунок 1.3.1 - Схема биохимических превращений гомоцистеина в организме человека. Достоверность взаимосвязи между повышением уровня гомоцистеина и развитием сердечно-сосудистых заболеваний была подтверждена рядом исследований (Верещагин Н.В., 2003; Коломиец Н.М., Бакшеев В.И., 2003; Макацария А.Д., Бицадзе В.О., 2003; Скворцова В.И., Евзельман М.А., 2006). В результате при последующем изучении была выделена самостоятельная гомоцистеиновая теория атерогенеза. В 1969 году впервые McCully K.S сообщил о наличии выраженных атеросклеротических повреждений у больных с гомоцистинурией и предположил существование патогенетической атерогенезом. Последние спровоцированных достоверными моделей между результаты гипергомоцистинемией генетически гипергомоцистеинемии доказательствами атеросклеротического связи процесса. роли и Эти методы диетически являются гомоцистеина в и в наиболее патогенезе настоящее время совершенствуются, и, помимо этого, предложены новые способы создания экспериментальной гипергомоцистеинемии in vitrо, которые позволяют воспроизвести наиболее физиологичные условия для постановки исследования. Аутоиммунная теория патогенеза атеросклеротического процесса была впервые предложена Климовым А.Н. в 1980 году. В последующем многочисленные исследования подтвердили участие локального и системного воспаления в инициации и прогрессировании атеросклероза и его осложнений вне зависимости от наличия атерогенной ДЛП (Нагорнев В.А. с соавт., 2000; Алекперов Э.З., Наджафов Р.Н., 2010; Willerson J.T., Ridker R.M., 2004; Ridker P.M., 2007).Установлено, что ИБС, как правило, сопровождается признаками хронической воспалительной реакции (повышение в сыворотке крови больных уровня С-реактивного белка, сиаловых кислот, фибриногена, плазминогена, общего количества лейкоцитов) (Ridker P.M., 2001). Результаты проведенных в этом направлении исследований, свидетельствуют 35 о вероятной провоспалительной роли накапливающихся в интиме модифицированных ЛПНП (мЛПНП) и нативных ЛПНП (Санникова А.А. с соавт., 2010), выступающих в роли аутоантигенов, белки теплового шока (hsp), эндотоксины, микроорганизмы и их антигенные детерминанты (Mandal K. et al., 2005). В последующем эта теория была дополнена новыми сведениями. Установлено, что в качестве аутоантигенов могут выступать конъюгаты гомоцистеин-альбумин, и потенцировать образование аутоантител (Изместьев С.В. с соавт., 2012; Undas A. et al., 2006). Сформированные иммунные комплексы могут явиться дополнительным фактором альтерации эндотелия и бляшкообразования. Интересные данные получены Изместьевым С.В. (2013), который указывает на присутствие аутоантител к комплексу сывороточного альбумина с гомоцистеином в сыворотке крови интактных крыс, что указывает на сенсибилизацию организма к данному антигену в физиологических условиях. При этом было установлено, что у животных при введении в организм экзогенного гомоцистеина и гомоцистеинтиолактона в течение 9 дней уровень общего гомоцистеина плазмы крови остается на исходном уровне на фоне резкого повышения титра аутоантител к модифицированному альбумину. Таким образом, при непродолжительной внешней нагрузке гомоцистеином иммунная система способна регулировать уровень общего гомоцистеина (оГЦ) в плазме крови в пределах физиологических значений путем образования аутоантител против комплекса гомоцистеина с сывороточным альбумином. При этом на клеточном и тканевом уровнях происходят глубокие атрофические преобразования органов-мишеней. Исходя из этого, можно предположить, что высокие показатели гипергомоцистенемии свидетельствуют о длительно протекающем хроническом процессе или иммунодефицитном состоянии. Различные модели атеросклеротических изменений применяются к разным животным (Karourchali F.R. et al., 2014). Чтобы достичь повышения уровня концентрации оГЦ в плазме крови используют генетические методы и специальные диеты. Для создания экспериментальной модели используют пероральный или парентеральный пути введения метионина или гомоцистеина, 36 диету с ограничением фолиевой кислоты, холина, витаминов группы В, а также генетически детерминированные повреждения ферментов, участвующих в метаболизме гомоцистеина, таких как цистатионин β-синтетаза (CBS), метионин синтетаза (MS) или метилентетрагидрофолатсинтетаза (MTHFR). CBS – это пиридоксин-зависимый фермент, который катализирует превращение гомоцистеина в цистатионин. MS представляет собой кобаламин-зависимый фермент, который участвует в реметилировании гомоцистеина в метионин. МТHFR является донором метильных групп, 5-метилтетрагидрофолата, который используется MS в реакциях реметилирования. Холин – это предшественник бетаина, является субстратом для альтернативного пути реметилирования гомоцистеина, в котором в качестве катализатора выступает бетаин- гомоцистеинметилтрансфераза (BHMT). Впервые гипотеза о роли гомоцистеина как причинного фактора в развитии сердечно-сосудистых заболеваний была подтверждена в экспериментальных моделях Harker L.A. et al. (1974, 1976, 1983). В этих исследованиях инфузия гомоцистеина и тиолактона гомоцистеина привела к эндотелиальной денудации и увеличению количества циркулирующих эндотелиальных клеток. Несколько лет спустя, в 1995 году, Rolland Р.Н. et al. наблюдали структурные изменения брюшной части аорты и коронарных артерий у карликовых свиней, находившихся на обогащенной метионином диете. Гистологическое исследование этих сосудов выявило фрагментацию внутренней эластической пластинки, разрывы эластических волокон и очаги гиперплазии гладкомышечных клеток. Подобные нарушения, такие как эрозия внутренней эластической пластинки и дегенерация мышечных клеток аорты, были обнаружены Matthias D. et al. в 1996 году после перорального введения гомоцистеина крысам. В настоящее время имеются данные о корреляции уровня сывороточного гомоцистеина с тяжестью ИБС (Shenoy V. et al., 2014). В середине 90-х гг. XX века была создана первая генетическая модель гипергомоцистеинемии у мышей путем нарушения целостности гена CBS, который кодирует фермент CBS (Watanabe M. et al., 1995). CBS-дефицитные 37 мыши предрасположены к гипергомоцистеинемии, поскольку у них нарушена способность превращать гомоцистеин в цистатионин. В последние годы были разработаны дополнительные линии мышей с повреждением целевых генов. Среди них наиболее интересными представляются генетические модели с прицельным повреждением MTHFR (Chen Z. et al., 2001) и MS (Swanson D.A. et al., 2001) генов, которые кодируют синтез MTHFR и MS, соответственно. Эти мыши предрасположены к гипергомоцистеинемии, потому что у них нарушена способность реметилировать гомоцистеин в метионин. Было доказано, что гипергомоцистеинемия способствует прогрессивному развитию атеросклероза у восприимчивых животных моделей, таких как аполипопротеин-Е-дефицитных мышей. Hoffman M.A. et al. в 2001 году сравнили сосудистые изменения аполипопротеин-Е-дефицитных мышей, которые содержались на гипергомоцистеиновой диете в течение 8 недель и апоЕдефицитных мышей, получавших стандартное питание. Животные, получавшие диету с высоким содержанием метионина и ограничением фолиевой кислоты и витаминов группы В, имели большие размеры атеросклеротических поражений в синусе аорты, чем мыши со стандартным рационом питания. Впоследствии результаты Hoffman M.A. et al. были подтверждены исследованиями Zhou J. et al. (2001), которые использовали диету с высоким содержанием жиров, метионина или гомоцистеина в течение 3 месяцев для создания гипергомоцистеиновой модели у апоЕ-дефицитных мышей. Несколько последующих исследований (Troen M.A. et al., 2003; Zhou J. et al., 2003; Zhou J. et al.,2004) c различными вариациями рациона питания крыс подтвердили результаты наблюдений Hoffman M.A. et al. и Zhou J. et al. (2001). В большинстве этих исследований проатерогенетические эффекты гипергомоцистеинемии наблюдались у молодых животных (2-3 месяца) и лишь незначительные изменения у взрослых крыс. Это позволило предположить, что влияние гипергомоцистеинемии на атеросклероз временное явление, или что с течением времени к гипергомоцистеинемии может произойти адаптация. 38 В 2003 году исследование, проведенное Troen A.M. et al., показало, что гипергомоцистеинемия у апоЕ-дефицитных мышей, спровоцированная диетой с высоким содержанием метионина более атерогенная, чем рацион с дефицитом витаминов группы В, а также что степень тяжести атеросклероза не зависит от уровня оГЦ в плазме крови. В последующем эти данные были подтверждены исследованиями с экспериментальной гипергомоцистеинемией на кроликах (Zulli A. et al., 2004) и крысах (Zhang R. et al., 2004). Нарушение эндотелиальной вазомоторной функции наблюдалось в экспериментальных моделях на обезьянах (Lentz S.R. et al., 1996), карликовых свиньях (Rolland P.H. et al., 1995), крысах (Ungvari Z. et al., 1999) и мышах (Eberhardt R.T. et al., 2000; Lentz S.R. et al., 2000; Dayal S. et al., 2001). Патологическое сосудистую расширение стенку, также сосудов, было опосредованное действием выявлено людей у с NO на острой гипергомоцистеинемией, спровоцированной пероральным приемом высоких доз метионина (Bellamy M.F. et al., 1998; Chambers J.C. et al., 1998; Kanani P.M. et al., 1999). Следует отметить, что степень нарушения функции эндотелия при гомоцистеинемии аналогична другим факторам риска, таким как гипертония и гиперхолестеринемия. По данным этих исследований, развитие эндотелиальной дисфункции у гипергомоцистеиновых мышей напрямую связано со степенью повышения уровня гомоцистеина в плазме крови, независимо от конкретного сочетания генетических и диетических факторов, используемых для создания экспериментальной модели. Эти наблюдения позволяют предположить, что оГЦ крови или прямой его метаболит, оказывает непосредственное влияние на развитие эндотелиальной дисфункции. По мнению Faraci F.M. (2003) главным пусковым моментом развития гомоцистеин-опосредованной эндотелиальной дисфункции является снижение биодоступности оксида азота (NO). NO является мощным вазодилататором, который активирует гуанилилциклазу в мышечной стенке сосуда, что приводит к его расширению, путем аккумуляции цГМФ. Оксид азота продуцируется с 39 участием эндотелиальной NO-синтетазы (eNOS), в ответ на такие физиологические стимулы, как ацетилхолин, тромбин, брадикинин (Cai H. et al., 2000). Нарушение NO-опосредованной вазодилатации у гомоцистеиновых животных было выявлено в работах Stamler J.S. et al. (1993), Upchurch G.R. et al. (1997), которые пришли к выводу, что гомоцистеин снижает биодоступность NO для эндотелиальных клеток. Снижение биодоступности NO может также способствовать развитию тромбоза и атеросклероза, так как эндотелий-зависимый NO ингибирует агрегацию тромбоцитов и адгезию лейкоцитов (Welch G.N., Loscalzo J., 1998). Причины снижения биодоступности при гипергомоцистеинемии, по-видимому, мультифакториальны (Faraci F.M., 2003), однако большая часть экспериментов на животных доказывает, что приоритетное значение принадлежит гомоцистеин-индуцированному окислительному стрессу, который приводит к ускоренной окислительной инактивации NO. Подтверждение о развитии оксидантного стресса при гипергомоцистеинемии было получено как на фармакологических (Eberhardt R.T. et al., 2000; Weiss N. et al., 2002; Ungvari Z. et al., 2003; Guo T. et al., 2009; Wang S. et al., 2014), так и на генетических (Weiss N. et al., 2001; Dayal S. et al., 2002; Guo H.Y. et al., 2014) животных моделях. По данным Eberhardt R.T. et al. (2000) и Faraci F.M. (2003) несколько типов активной формы кислорода, такие как супероксид, пероксид водорода и гидроксильные радикалы, могут способствовать окислительной инактивации NO при гипергомоцистеинемии. Диметиларгинин (ADMA) – это эндогенный ингибитор NO-синтетазы, который образуется путем протеолиза белков, содержащих метилированные остатки аргинина (Böger R.H., 2003). Повышение уровня ADMA в плазме крови является новым фактором риска, который гиперхолестеринемией, встречается гипергомоцистинемией, сахарным у пациентов диабетом с и артериальной гипертонией. Помимо того, что ADMA ингибирует продукцию NO, он также может способствовать распаду eNOS, что напрямую влияет на усугубление оксидантного стресса (Vallance P., 2001; Böger R.H., 2003). 40 Повышение уровня ADMA в плазме крови непосредственно коррелирует с нарушением эндотелий-зависимой дилатацией сонной артерии у обезьян (Böger R.H. et al., 2000). Подобные изменения были выявлены у крыс (Fu Y-F. et al., 2005) и людей с острой гипергомоцистеинемией, индуцированной пероральной нагрузкой метионином (Böger R.H. et al., 2001; Stuhlinger M.C. et al., 2003). Эти наблюдения показывают, что повышение ADMA может способствовать нарушению биодоступности NO при гомоцистеинемии. Повышение ADMA при гипергомоцистеинемии может аденозилметионин(SAM)-зависимым быть вызвано метилированием увеличением белковых S- остатков аргинина, снижением почечной экскреции ADMA или понижением активности фермента диметиларгинина диметиламиногидролазы (DDAH), который участвует в метаболизме ADMA (Vallance P., 2001). Учеными Stuhlinger M.C. et al. в 2001 году удалось представить гомоцистеин как ингибитор DDAH in vitro. Впоследствии, на мышах была разработана генетическая модель с подавлением экспрессии гена DDAH (Dayoub H. et al., 2003), что может в дальнейшем послужить для изучения роли ADMA в развитии эндотелиальной дисфункции и окислительного стресса при гипергомоцистеинемии. В последнее время появились сведения о том, что действие гомоцистеина не ограничивается повреждением эндотелия с запуском атеротромбоза. Описана способность этого аминотиола связываться с особой группой глутаматных рецепторов (NMDA-рецепторов), имеющихся на мембранах нейронов, кардиомиоцитов, лейкоцитов, эритроцитов, мегакариоцитов и других клеток (Арзуманян Е.С. с соавт., 2008; Машкина А.П., 2010; Болдырев А.А. с соавт., 2012; Изместьев С.В., 2013; Gill S.S. et al., 2007). Данный механизм объясняется сходством строения молекулы гомоцистеина и продукта его аутоокисления – гомоцистеиновой кислоты с N-метил-D-аспартатом (NMDA). Исходя из этого, в основе токсического эффекта гомоцистеина на клетки-мишени лежит способность самого гомоцистеина и гомоцистеиновой кислоты активировать NMDA- рецепторы, создавая в клетках повышенный уровень ионов кальция и активных форм кислорода, что приводит к повреждению и гибели клеток. 41 Этот, далеко неполный перечень источников литературы свидетельствует о многообразии методов, используемых учеными для создания экспериментальной гипергомоцистеинемии. Однако до сих пор неясно, является ли гипергомоцистеинемия причинным фактором или маркером сердечно-сосудистых заболеваний. Главным доказательством того, что повышенный уровень гомоцистеина играет причинную роль в формировании атеросклеротических изменений, является возможность создания экспериментальных моделей на животных. В тоже время некоторыми учеными выдвинута иная точка зрения. Schiffrin E.L. et al. (2007), Friedman A.N. et al. (2001) считают, что гипергомоцистеинемия связана с повышением сосудистого риска опосредованно, то есть прямое патологическое воздействие гомоцистеина направлено на почки, а ренальная дисфункция, в свою очередь, повышает уровень сердечно-сосудистой заболеваемости и смертности. По мнению этой группы исследователей, результаты экспериментов на животных предполагают, но не доказывают, что повышенный уровень гомоцистеина является причинным фактором сосудистой дисфункции. Нельзя исключить и роль тиреоидных гормонов (повышение или снижение их уровня) в развитии атеросклероза и гиперхолестеринемии (Хмельницкий О.К., Ступина А.С., 1989; Глумова В.А. с соавт., 2011; Чучкова Н.Н. с соавт., 2011). 42 Глава 2. СОБСТВЕННЫЕ ИССЛЕДОВАНИЯ 2.1. Материал и методики исследований Из информации, приведенной в обзоре литературы, становится понятно, что морфофункциональные атеросклеротическом особенности процессе щитовидной различного генеза железы остаются при недостаточно изученными и вызывают ряд спорных положений. Малоизвестна взаимосвязь изменений тиреоидных структур и лимфатических узлов. Учитывая эти обстоятельства, мы признаем необходимость использования ряда тестов, привлекаемых для решения вопросов о структурных перестройках щитовидной железы и регионарных лимфоузлов при различных моделях атерогенеза. Работа выполнена на 200 беспородных белых крысах-самцах Rattus norvegicus Berk в возрасте 2-3 месяца, массой тела 180-200 граммов. Исследование одобрено комитетом по биомедицинской этике ГБОУ ВПО (аппликационный № 290 от 28.02.2012). ИГМА МЗ РФ Использование в качестве экспериментального материала только самцов крыс обусловлено половым диморфизмом физиологической активности эндокринных органов, в частности, щитовидной железы (Юминова Н.А., 1996; Кириллов О.И., 1998; Ишунина Т.А., 2003; Мялин А.Н. с соавт., 2007; Cardy R.H., 1991). С целью выявления особенностей изменения морфологии и функции органов в зависимости от причинного фактора атерогенеза для сравнения между собой нами были созданы две модели – гиперхолестериновая и гипергомоцистеиновая. Чтобы создать экспериментальную модель атерогенеза у крыс в нашем исследовании была использована синтетическая гиперхолестериновая диета по Мещерской К.А. (1964) (Николова Н.П., 1965) в нашей модификации (с ограничением двигательного режима, в условиях зоосоциального и полового стресса). Животные получали атерогенный рацион в течение 2,5 месяцев, который включал в себя: 30% свиного жира в кукурузной муке грубого помола, 0,5% холестерина и 1% минеральных солей (карбонат кальция – 45%, хлорид натрия – 43 45%, цитрат железа – 9,75%, йодид калия – 0,25%) – по 4 г ежедневно одной крысе; ежедневно – молоко по 80-100 мл, 1 раз в неделю – хлеб и 2 раза в месяц – мясо (50-70 г). Животные содержались в условиях ограниченного жизненного пространства, в условиях скученности, борьбы за источники питания, а также разделенные по разным клеткам по половому признаку, но в пределах зрительного и обонятельного контакта между самцами и самками. Контрольные животные содержались в стандартных условиях вивария – стандартный режим питания и двигательная активность. Для создания гипергомоцистеиновой модели атерогенеза опытным животным ежедневно внутрибрюшинно вводился раствор гомоцистеина в дозе 13,4 мг/кг (Смирнов А.В. с соавт., 2005). Забой животных производился непосредственно после окончания курса инъекций через 1 месяц. Животные контрольных групп получали ежедневно внутрибрюшинные инъекции изотонического раствора хлорида натрия. Забой животных производился путем эфирного наркоза в летальной дозе в соответствии с правилами проведения работ с использованием экспериментальных животных (приказ Минздрава СССР от 12.08.1977 №755; приказ Минздравсоцразвития РФ от 23.08.2010 №708н). Все процедуры проводились в строго контролируемых условиях, материал от опытных и контрольных животных каждой серии обрабатывался одновременно. У животных проводили общий анализ крови с определением лейкоцитарной формулы, а также выявляли липидный спектр плазмы крови: общий холестерин (ОХ), липопротеиды высокой (ЛПВП), низкой (ЛПНП) и очень низкой плотности (ЛПОНП), триглицериды (ТГ), атерогенный индекс (АИ). Для диагностики функционального состояния щитовидной железы определяли уровни Т3 и Т4 с использованием наборов реагентов для твердофазного иммуноферментного анализа (Алкор Био, Санкт-Петербург). Для выявления атеросклеротических изменений грудную часть аорты и ее дугу фиксировали в формальдегиде («Реахим»), обезвоживали и заливали в парафиновую среду для заливки (HISTOMIX). Готовили поперечные и 44 продольные срезы, подвергали стандартной гистологической обработке и окраске гематоксилин-эозином и суданом черным. Изучаемые органы (ЩЖ и паратрахеальные ЛУ) также заливали в парафин и подвергали стандартной гистологической обработке. Срезы ткани щитовидной железы и регионарных лимфоузлов подвергались окраске гематоксилин-эозином для анализа общей структуры органа. В ЩЖ определяли объемную плотность тканевых компонентов, размерные показатели фолликулов, митотическую активность тироцитов и показатели кариоцитометрии. Для удобства работы фолликулы щитовидной железы были нами условно подразделены на 3 группы в зависимости от среднего диаметра: крупные (13 мкм и более), средние (5-12 мкм) и малые (до 5 мкм). В срезах паратрахеальных лимфоузлов, окрашенных гематоксилин-эозином, определялось процентное соотношение коркового и мозгового вещества, основные типы клеточных популяций, состояние лимфатических фолликулов, межфолликулярной лимфоидной ткани, кровеносных сосудов. Количество клеток рассчитывалось в 10 полях зрения коркового вещества, паракортикальной зоны, мозгового вещества (не менее 100 клеток). Подсчитывались популяции лимфоцитов, центроцитов, центробластов, иммунобластов, плазмоцитов, макрофагов, а также митотических и апоптотических элементов. А также оценивалось состояние ткани, окружающей лимфоузлы и сосудов ЛУ. Для детального изучения структурной организации ядер и ядрышек тироцитов использовалась окраска AgNOR’s (Челидзе П.В., Зацепина О.В., 1988). ШИК-реакция по Мак-Манусу позволила оценить содержание нейтральных и кислых мукополисахаридов в тироцитах, коллоиде и базальных мембранах. ШИК-реакция в лимфатических узлах дает представление о состоянии венул с высоким эндотелием. Для выявления РНК в ядре и цитоплазме клеток был использован метод окраски метиловым зеленымпиронином (по Браше). Для качественной оценки состояния соединительной ткани был использован метод Вейгерта для окраски эластических волокон. Активность кислой и щелочной фосфатазы определялась реакцией по Гомори. 45 Объемную плотность тканевых компонентов ЩЖ (эпителий фолликулов, интерфолликулярный эпителий, коллоид, соединительная ткань стромы, сосуды) определяли, используя окулярную сетку с 64 равноудаленными точками. Количественно определяли процентное соотношение малых, средних и крупных фолликулов (Хмельницкий О.К., Быков В.Л., 1980; Крейчман Г.С., 1985). Содержание тканевых базофилов в изучаемых органах определяли в срезах, окрашенных азур-II-эозином. Подсчитывали количество ТБ в поле зрения при увеличении 400. Характеристику отдельных популяций ТК осуществляли при х1500. Представление о функциональном состоянии ТК дает подразделение их по степени дегрануляции на 4 типа (по Д.П. Линднеру, 1980): «А» - ТК с плотно заполнеными неразличимыми гранулами и ядром; «В» - ТК с различимыми отдельными гранулами и непольностью замаскированным ядром; «С» - клетки с хорошо различимыми гранулами как внутри, так и вокруг клетки и отчетливым ядром; «D» - опустошенные ТК с единичными гранулами внутри и рассеянными гранулами вокруг клетки. Рассчитывали индексы активности ТК по следующим формулам: - индекс дегрануляции-1 (ИД-1) – без учета активности секреции: ИД-1=С/(А+В+С+D) - индекс дегрануляции-2 (ИД-2) (с учетом вклада отдельных клеток в общую секрецию): ИД-2=0×А+1×В+2×С+3×D - индекс гранулолизиса (ИГ): ИГ= D/(А+В+С+D) - индекс суммарного гранулолизиса (ИСГ): ИСГ=(С+D)/(А+В+С+D) индекс насыщения гепарином (ИНГ): ИНГ=(А+В)/(С+D). Белок Ki-67 – клеточный маркер пролиферации, который идентифицирует ядерный антиген, присутствующий на всех стадиях митотического цикла (M, S, G1), кроме G0. Для верификации экспрессии в тканях белка Ki-67 был использован иммуногистохимический метод. Срезы ткани ЩЖ и паратрахеальных лимфоузлов помещали на предметные стекла, покрытые пленкой из полилизина. Использовали первичные моноклональные антитела к Ki-67 (1:500, Dako). В качестве вторых антител использовали биотинилированные антитела (Dako). 46 Визуализацию окрасок проводили с применением комплекса авидина с биотинилированной пероксидазой (ABCkit) с последующим проявлением пероксидазы хрена диаминобензидином (все реагенты от Dako). Оценка активности апоптоза проводилась с использованием метода определения одного из ключевых ферментов апоптоза – каспазы-3. Для этого срезы обрабатывались моноклональными антителами с Caspase-3. Чтобы определить места связывания использовались вторичные антитела, меченые пероксидазой хрена; визуализация осуществлялась диаминобензидином, который с ПХ дает нерастворимые продукты коричневого цвета. На отдельных срезах осуществлялась подкраска метиленовым синим для визуализации структуры органа. Для изучения состояния щитовидной железы и регионарных лимфоузлов на субклеточном уровне проведены электронно-микроскопические исследования, включающие фиксацию в глютаровом альдегиде с постфиксацией OsO4, дегидратацию, заливку в смесь смол эпон-аралдит. Ультратонкие срезы контрастировали уранилацетатом. Были использованы просвечивающий (для ЩЖ) и сканирующий (для паратрахеальных лимфозлов) варианты электронной микроскопии. Формирование сводных таблиц и статистическая обработка материала велись в разработанной базе данных в программе Microsoft Office Excel, Statistica 6. Для обобщения числовых характеристик изучаемых признаков при нормальном распределении данных (оценка нормальности распределения проводилась с использованием критерия Колмогорова-Смирнова) использовали среднюю арифметическую величину признака (М), стандартную ошибку средней (m) (Гланц, С., 1999). На основании этих показателей из числа наблюдений в группе (n) высчитывали t – коэффициент Стъюдента, а затем определяли p – достоверность различий между средними показателями сравниваемых вариационных рядов. Различия считали достоверными при уровне значимости p≤0,05, тенденцию к изменению показателей определяли при р≤0,1 (Гланц, С., 1999). Статистический анализ выполнялся согласно методикам, применяемым в медико-биологической статистике (Гланц С., 1999; Новиков Д.А., Новочадов В.В., 2005). 47 2.2. Морфофункциональные изменения в щитовидной железе при гиперхолестериновой модели атерогенеза Гиперхолестериновая модель атерогенеза сопровождается изменениями в грудной аорте (рисунок 2.2.1). Рисунок 2.2.1 - Грудная аорта контрольных (А, Б) крыс и животных с гиперхолестеринемией (В, Г). Инфильтрация липидными включениями, адгезия жировых капель к поверхности сосуда, изменение архитектоники эластических волокон. Окраска: судан-черный. Об.100, ок. 15. При изучении гистологических срезов щитовидной железы интактных животных фолликулы среднего и малого диаметров расположены в центральной зоне органа, крупные же аденомеры занимают периферическую часть железы. Встречаются фолликулы разной формы: округлые, вытянутые, полигональные. Стенка фолликулов образована призматическими и кубическими тироцитами, расположенными на базальной мембране. Ядра тироцитов округлые, крупные, содержат хорошо визуализируемые ядрышки. Коллоид, секретируемый тироцитами и заполняющий полость фолликула гомогенный, с краевой вакуолизацией (рисунок 2.2.2). Соединительнотканная строма органа представлена сетью коллагеновых и эластических волокон. В межклеточном веществе щитовидной железы определяются артерии, вены, лимфатические 48 сосуды. Застойных явлений в просвете сосудов (гемостаза, лимфоколлоидостаза) не определяется. Рисунок 2.2.2 - Щитовидная железа интактных животных. Фолликулы округлой и овальной форм. Кубические и цилиндрические тироциты с крупными ядрами. Окраска: гематоксилин-эозин. Об.40, Ок.10. На субклеточном уровне обнаруживаются хорошо выраженные микроворсинки на апикальной части тироцитов, крупные палочковидные митохондрии, хорошо развитый пластинчатый комплекс (рисунок 2.2.3). Рисунок 2.2.3 - Апикальный полюс тироцита интактных животных. Микроворсинки (1), митохондрии (2), комплекс Гольджи (3), ядро (4). Ув. ×13000. 49 Изучение срезов щитовидной железы, окрашенных метиловым зеленымпиронином, показало, что наиболее активную реакцию на РНК дает коллоид малых фолликулов. Интенсивность реакции коллоида на РНК в зависимости от размера фолликулов можно условно отобразить следующим образом: Малые +++, средние ++, крупные +. При этом имеются участки ЩЖ, где локально расположены сгруппированные фолликулы малого и среднего диаметра с пиронин-негативной реакцией коллоида (рисунок 2.2.4). В группе интактных животных ШИК-позитивная реакция коллоида отмечалась во всех фолликулах (рисунок 2.2.5). Не выявлена зависимость интенсивности окраски реактивом Шиффа от размеров фолликулов. Цитоплазма тироцитов фолликулов разного диаметра ярко окрашена по всей площади органа. Рисунок 2.2.4 - Щитовидная железа интактных животных. Фолликулы с разной степенью пиронинофилии коллоида. Единично расположенные (1) и сгруппированные (2) фолликулы, коллоид которых не проявляет реакцию на РНК. Окраска: метиловый зеленый-пиронин. Об.10, Ок.10. 50 Рисунок 2.2.5 - Щитовидная железа интактных животных. Фолликулы разного диаметра с равномерной плотностью коллоида. ШИК-реакция. Об.40, Ок.10. При анализе популяции ТК выявлена их выраженная полиморфность. Тучные клетки ЩЖ интактных животных располагаются вдоль сосудов, по соединительнотканным прослойкам, между фолликулами. Форма и размеры клеток варьируют. Основная часть клеточного пула представлена ТК овальной формы, крупных размеров, с хорошо выраженными гранулами (рисунок 2.2.6). Они соответствуют субпопуляции «А» и «В» (по классификации Линднера Д.П., 1980) (рисунок 2.2.7). Обычно вблизи подобных клеток, экстрацеллюлярно гранул не отмечается. Ряд ТК имеют малые размеры, их форма приближается к треугольной или веретеновидной. Гранулы в них мельче, плотность расположения гранул не столь высока, но за пределами клетки гранул нет, либо они единичны. Светлые клетки («С» и «D») всегда меньших размеров, с неровным контуром, вблизи них отмечается большее или меньшее количество гранулярного материала. Количество мастоцитов, приходящихся на одно поле зрения (Об.40, Ок.10) не превышает 10 (в среднем 4,48±2,38). 51 10,1 34,5 13,9 ТК типа "А" ТК типа "В" ТК типа "С" ТК типа "D" 41,5 Рисунок 2.2.6 - Соотношение субпопуляций тучных клеток щитовидной железы интактных животных. Рисунок 2.2.7 - Щитовидная железа интактных животных. Тучные клетки типа «А» в соединительнотканной строме органа (указаны стрелками). Окраска: азур-II-эозин. Об.40, Ок. 10. Атерогенный рацион и дополнительные стрессорные факторы приводят к нарушению соотношения основных фракций липопротеидов крови, соотношение 52 которых характерно для развивающегося атерогенного процесса. Ранее проведенные на нашей кафедре совместные эксперименты с Гайсиной Э.Ш. (2011) свидетельствуют о статистически достоверных изменениях в уровне ЛПВП и повышении коэффициента атерогенности крови уже через 1 месяц содержания животных на гиперхолестериновой диете. На 58 день опыта, произошел значительный рост уровня ЛПНП (более чем в 3 раза) (р≤0,05), появилась тенденция к увеличению ОХ, ЛПОНП, ТГ. Полученные авторами данные убедительно доказывают развивающуюся картину ДЛП на фоне введения экзогенного холестерина подопытным животным, причем интенсивность ДЛП зависит от длительности получения крысами атерогенного рациона. Липидный спектр к окончанию эксперимента (2,5 месяца) представлен в таблице 2.2.1. Таблица 2.2.1. Показатели липидного обмена у крыс при гиперхолестериновой модели атерогенеза (M±m) Показатель Интактные животные 2,5 месяца эксперимента ЛИПИДНЫЕ ФРАКЦИИ ОХ, ммоль/л 2,20±0,27 2,51±0,10# ЛПВП, ммоль/л 1,08±0,09 1,06±0,17* ЛПНП, ммоль/л 0,55±0,12 0,46±0,03 ЛПОНП, ммоль/л 0,50±0,05 0,8±0,12* ТГ, ммоль/л 1,07±0,11 1,75±0,26* АИ 1,02±0,13 1,29±0,17# ЦИТОЛОГИЧЕСКИЕ ПОКАЗАТЕЛИ КРОВИ Палочкоядерные лейкоциты 0 0,33±0,12 Сегментоядерные лейкоциты 24,67±1,20 13,29±1,44* Лимфоциты 57,33±3,76 68,81±1,50* Моноциты 11,67±2,03 15,86±0,86# 3,66±1,20 1,76±0,33 Эозинофилы Примечание - * - р≤0,05 достоверность между показателями у интактных животных и при гиперхолестеринемии; # - р≤0,1 достоверность между показателями у здоровых животных и в процессе создания модели. 53 Гиперхолестериновая диета вызывала увеличение относительного количества лимфоцитов (р≤0,01), снижение сегментоядерных нейтрофилов (р≤0,05); наблюдалась тенденция к изменению моноцитов и эозинофилов (р≤0,1) в сравнении с данными показателями у интактных животных. Изменения в лейкоцитарной формуле косвенно свидетельствуют об активации клеточного иммунитета. Таким образом, повышение количества экзогенно введенного холестерина, социальный и половой стресс, гиподинамия приводят к формированию гиперхолестеринемии, триглицеридемии, сопровождается увеличением наиболее атерогенных фракций крови (ЛПОНП), повышением коэффициента атерогенности. Изменения в лейкоцитарной формуле свидетельствуют об активации клеточного иммунитета и неспецифической резистентности организма: рост относительного содержания лимфоцитов и моноцитов в крови животных. При микроскопическом исследовании срезов щитовидной железы экспериментальных животных (гиперхолестеринемия), окрашенных по методу Вейгерта, обращает на себя внимание перекалибровка артерий, расширение капилляров, гемостаз, разрастание и склероз стромы (рисунок 2.2.8а). Отмечается превалирование фолликулов крупного диаметра по всему объему органа. Встречаются единично расположенные и сгруппированные кистозно- расширенные фолликулы. При этом количество фолликулов малого диаметра достоверно уменьшается по сравнению с контрольной группой (таблица 2.2.2). Соотношение фолликулов разных размеров (малые:средние:крупные) у интактных животных составляет 3:2:1, при гиперхолестеринемии их соотношение выравнивается (1:1:1). Таблица 2.2.2. Соотношение фолликулов разных диаметров в щитовидной железе в норме и эксперименте (M±m) Показатель Интактные животные ГХ Малые фолликулы 48,2±1,55 34,3±1,41* Средние фолликулы 34,5±2,08 31,9±1,33# Крупные фолликулы 17,3±0,70 33,8±1,59* Примечание - * - р≤0,05 в сравнении с контрольными показателями, # - р≤0,1. 54 В соотношении тканевых компонентов выявлено снижение удельной площади тиреоидного эпителия (таблица 2.2.3). Это объясняется тем, что высота клеток фолликулярного эпителия становится меньше, превалирует кубическая и плоская форма преимущественно тироцитов, в цилиндрические аденомерах малого клетки размера. встречаются Выявлено редко, нарастание относительного процента площади коллоида за счет большего количества крупных фолликулов, увеличение среднего диаметра аденомеров (таблица 2.2.3), содержащих плотный, густой коллоид. В полости фолликулов обнаруживаются десквамированные клетки. Краевая вакуолизация коллоида не выявляется. Таблица 2.2.3. Соотношение тканевых компонентов щитовидной железы в норме и эксперименте (M±m) Объемная плотность % Группа Фолликулярный эпителий Коллоид Соединительная ткань, сосуды Контрольная группа 50,9±0,85 26,8±0,81 22,3±0,77 Гиперхолестеринемия 40,6±0,90* 32,3±1,10* 27,1±0,83* Примечание - * - р˂0,05 в сравнении с контрольными показателями. При экспериментальной гиперхолестеринемии увеличение объема соединительнотканной в железе наблюдается стромы, за счет набухания коллагеновых и эластических волокон, отека стромы, расширения просвета сосудов. В стенке сосудов отмечены гиперплазия мышечного слоя, при этом базальная мембрана истончена, в эндотелии обнаруживаются фенестры (рисунок 2.2.8б). Форменные элементы крови имеют тенденцию к агрегации на внутренней стенке артерий, склеиванию между собой. В то же время, в отдельных участках органа отмечается склерозирование компонентов стромы. Увеличение объемной плотности внутри- и междольковой соединительной ткани, гиперплазия стенок средних артерий и артериол, запустевание капилляров и венул свидетельствует о развитии атрофических процессов и может быть причиной анемизации органа. 55 Рисунок 2.2.8а Щитовидная - железа животных с экспериментальной гиперхолестеринемией. Фолликулы крупного и среднего диаметра выстланы низким призматическим и плоским эпителием. Коллоид ретенционный, без признаков краевой вакуолизации(1). Разрастание и выраженный отек соединительнотканной стромы, набухание коллагеновых и эластических волокон. Интенсивная эозинофильная инфильтрация межклеточного вещества (2). Окраска по Вейгерту. Об.10, Ок.10. Рисунок 2.2.8б - Щитовидная железа экспериментальных животных (гиперхолестеринемия). Расширенный сосуд с эритроцитами (1), базальная мембрана слабо выражена (2), фенестрация эндотелия (3), пиноцитоз (4). Ув. ×10000. 56 Из клеточных популяций наиболее выражены изменения тироцитов. Использование метода электронной микроскопии на срезах щитовидной железы экспериментальной группы позволило выявить следующие изменения на субклеточном уровне: редукция микроворсинок, появление первичных и вторичных лизосом, изменение плотности цитоплазматического матрикса, набухание митохондрий, инвагинация кариолеммы (рисунок 2.2.9). Рисунок 2.2.9 - Щитовидная железа экспериментальных животных (гиперхолестеринемия). Тироциты кубической формы. Микроворсинки слаборазвиты (1), митохондрии (2), ЦПС (3). Ув.×3000. Значительные изменения отмечены в состоянии ядрышек тироцитов. Так, у интактных животных в эндокриноцитах ядрышки располагаются вблизи кариолеммы, в количестве 3-х и более с преобладанием кольцевидных и компактных форм (рисунок 2.2.10). Изменения ядерного аппарата тироцитов при гиперхолестеринемии выражены неярко. Средний диаметр ядер статистически достоверно уменьшается по сравнению с контрольной группой и составляет 0,25±0,01 мкм. Отмечается тенденция к уменьшению количества ядрышек в тироцитах крупных фолликулов и к увеличению в аденомерах среднего и крупного диаметров (таблица 2.2.4). 57 Рисунок 2.2.10 - Щитовидная железа интактных животных. Фолликулы среднего диаметра. Стенка фолликула образована тироцитами низкой призматической формы с округлыми и овальными ядрами. Ядра преимущественно содержат 3 и более ядрышек. Окраска: азотнокислое серебро. Об. 100, Ок.10. Таблица 2.2.4. Процентное соотношение тироцитов с разным числом ядрышек в фолликулах интактных и экспериментальных групп (M±m) Интактные Гиперхолестеринемия Количество ядрышек в клетке Количество ядрышек в клетке Группа Фолликулы 1 2 3 и более 1 Крупные 22±2,08 30,7±1,45 49±1,53 19,7±0,88# 32,7±3,28 47,7±3,84 Средние 22,7±4,26 33,7±3,71 44,3±2,60 29,7±2,40# 23,7±3,48* 46,7±2,19 25±3,61 31,3±3,53 43,7±6,84 25,3±1,86 26,7±2,91* 48±4,60 Малые и микроФолликулы 2 Примечание - * - р˂0,05 в сравнении с контрольными показателями; # - p≤0,1. 58 3 и более Уменьшение количества ядрышек в фолликулярных эндокриноцитах свидетельствует о снижении процессов синтеза субъединиц рибосом, следовательно, и валового синтеза белковых продуктов, что сопровождается замедлением выведения гормонов в кровоток (отсутствие резорбционных вакуолей в коллоиде) (рисунок 2.2.11). Застой секрета в полости фолликулов может приводить к растяжению его стенок, вызывая признаки гипертрофии. Рисунок 2.2.11 - Щитовидная железа экспериментальных животных (гиперхолестеринемия). Сглаженость микроворсинок (1), секреторные включения (2), стрелкой указано направление выведения гормонов в просвет фолликулов. Ув. ×6000. Выявленные морфометрические перестройки (увеличение количества крупных аденомеров по всему объему органа, нарастание относительного объема коллоида и стромального компонента, снижение высоты тироцитов и уменьшение диаметра ядер) свидетельствуют о развитии атрофических процессов в тканях щитовидной железы и гипофункциональном состоянии органа. Эти данные подтверждаются показателями биохимического анализа крови на содержание гормонов щитовидной железы. Так, уровень Т3 равен 2,8±0,02 нмоль/л, что составляет 90% от контрольных значений (3,1±0,2 нмоль/л), а Т4 – 43,5±0,03 нмоль/л, т.е. 86,3% от значений группы интактных животных (50,4±1,8нмоль/л). 59 Изменения ядрышкового организатора со стороны тироцитов крупных фолликулов подтверждают вышеуказанные морфологические перестройки и свидетельствуют об угнетении синтеза и двустороннего выведения активных продуктов структурами щитовидной железы. В основе данных преобразований может быть двоякий механизм: во-первых, изменение проницаемости сосудистой стенки (Хмельницкий О.К., Ступина А.С., 1989) на фоне длительной дислипидемии, во-вторых, нарушение экспрессии генов и этапа трансляции на рибосомах тироцитов. При атерогенной гиперхолестериновой диете отмечено уменьшение числа ТК на одно поле зрения: с 4,48±2,38 (в контроле) до 3,63±1,71 (в опытной группе). Изменение количества тканевых базофилов в одном поле зрения может быть связано, во-первых, с перекалибровкой (укрупнением) фолликулов по всему срезу. Во-вторых, это может быть результатом тотальной дегрануляции ТК, вследствие чего при подсчете не все они учитываются в силу резкого снижения тинкториальных свойств цитоплазмы, подобная ситуация возможна при наличии высокой плотности распределения внеклеточных гранул. Можно полагать, что активация ТК, влияя на сосудистую проницаемость, способствует развитию отеков. Размер тучных клеток уменьшается, соотношение субпопуляций при АДЛЕ представлено на рисунке 2.2.12. 12,7 ТК типа "А" 12,6 43,6 ТК типа "В" ТК типа "С" ТК типа "D" 31,1 Рисунок 2.2.12 - Соотношение субпопуляций тучных клеток щитовидной железы при эксперментальной гиперхолестеринемии. 60 Несколько выше (в 1,26 раза) количество тучных клеток группы «А», что свидетельствует о процессах активного синтеза и накопления БАВ. Индексы, рассчитываемые на основе клеточных типов, представлены в таблице 2.2.5. Общий индекс дегрануляции сопоставим с контрольными цифрами, соотношение процессов мерокриновой и апокриновой секреции сохраняются на уровне показателей интактных животных. Можно предположить, что гиперхолестериновая диета сопровождается адаптационными процессами, направленными на восстановление и поддержание выраженных изменений состава ТК. Однако уровень синтетических процессов и накопления метахроматических гранул в ТК (субпопуляция «А») повышен, без признаков активной дегрануляции и гранулолизиса. Таблица 2.2.5. Индексы секреторной активности ТК в щитовидной железе (M±m) Индекс Интактные животные Гиперхолестеринемия Общий индекс дегрануляции 0,141±0,03 0,130±0,03 Индекс дегрануляции 0,999±0,060 0,939±0,111 Индекс гранулолизиса 0,101±0,020 0,131±0,050 Индекс суммарного гранулолизиса 0,239±0,04 0,251±0,040 Индекс насыщения 3,692±0,731 3,302±0,810 При проведении ШИК-реакции наиболее интенсивное окрашивание имеет коллоид в фолликулах крупного диаметра (++). В средних и малых аденомерах реакция на гликопротеид менее интенсивна (+). Коллоид единичных фолликулов не проявляет ШИК-позитивных свойств (рисунок 2.2.13). Цитоплазма тироцитов фолликулов разного диаметра ярко окрашена по всей площади органа, однако интенсивность ШИК-реакции более выражена в призматических и кубических тироцитах, то есть коррелирует с функциональной выраженностью в синтезе и секреции тиреоидных гормонов. 61 напряженностью и Рисунок 2.2.13 - (гиперхолестеринемия). фолликулов (1), Щитовидная Наиболее единичные железа выражена фолликулы экспериментальных ШИК(+)-реакция с животных коллоида ШИК(-)-реакцией крупных коллоида (2), десквамированные клетки (указаны стрелками). ШИК-реакция. Об. 10, Ок.10. Известно, что ШИК-позитивная реакция цитоплазмы тироцитов свидетельствует о синтезе и накоплении тиреоидных гормонов. В апикальной части клеток кроме микроворсинок локализуются пластинчатый комплекс, лизои фаголизосомы. Вследствие чего именно в этой зоне – интенсивная реакция на кислую фосфатазу. Учитывая, что концентрация тиреоидных гормонов при ГХ в крови снижена, можно полагать о задержке вывода их из тироцита. Наиболее активные свойства накопления РНК (при окраске метиловым зеленым-пиронином) проявляет коллоид фолликулов среднего диаметра. Имеются небольшие участки сгруппированных малых фолликулов, коллоид которых не окрашивается пиронином (рисунок 2.2.14). В цитоплазме тироцитов реакция на РНК проявляется слабее, чем в органах контрольной группы, что оценивается как показатель менее активного гормоногенеза. 62 Рисунок 2.2.14 - (гиперхолестеринемия). Щитовидная Фолликулы железа с разной экспериментальных интенсивностью животных пиронинофилии. Десквамированные клетки в просвете фолликулов (указаны стрелками). Окраска: метиловый зеленый-пиронин. Об.20, Ок.10. Исследование активности пролиферации (Ki-67) и апоптотических процессов (Caspase-3) не выявило значимых преобразований при холестериновом атерогенезе, что согласуется с данными, полученными другими методами. Таким образом, при экспериментальной гиперхолестеринемии на тканевом уровне нами выявлены дистрофические изменения, свидетельствующие о снижении функциональной активности органа. Среди них: увеличение количества крупных фолликулов, уплощение фолликулярного эпителия, отсутствие краевой вакуолизации коллоида. Эти данные коррелируют с преобразованиями на клеточном уровне, а именно, – уменьшение среднего диаметра ядер и снижение концентрации РНК в цитоплазме тироцитов, что свидетельствует об угнетении синтетических процессов, белокпродуцирующей происходящих способности клеток в влечет клетке. за собой Ослабление снижение концентрации тиреоглобулина (слабоположительная ШИК-реакция коллоида) в просвете фолликулов и цитоплазме тироцитов. 63 Анализ результатов по морфологической и функциональной реорганизации позволяет заключить, что развитие адаптационно-компенсаторных процессов в щитовидной железе при длительной алиментарной дислипидемии затрагивает все структурные комплексы органа, проявляется мозаично, что обусловлено принципом временной перемежающейся активности функционирующих структур. Все вышеизложенное позволяет полагать, что избыточное поступление холестерина в организм сопровождается повышением его содержания в крови, а затем и в поверхностном аппарате клеток. По данным Доценко Э.А. и соавт. (2001) при этом меняются жидкостные свойства, проницаемость и метаболическая активность клеточных мембран, а их патология является одним из механизмов нарушения функциональных систем. 64 2.3. Морфофункциональные изменения в щитовидной железе при гипергомоцистеиновой модели атерогенеза Гипергомоцистеиновая модель атерогенеза сопровождается увеличением гомоцистеина в крови до умеренных значений: 27±0,3 мкмоль/л. Повышенному уровню гомоцистеина плазмы крови сопутствуют изменения в грудном отделе аорты (рисунок 2.3.1), которые можно охарактеризовать как начальная стадия развития атеросклеротического процесса. Рисунок 2.3.1 - Аорта экспериментальных животных при гипергомоцистеинемии. А – формирование лимфоидных узелков вблизи сосуда (стрелка). Об. 10, ок. 7. Б – лимфоидный узелок – фрагмент предыдущего снимка. Стрелками показаны тучные клетки. Об. 100, ок. 10. В, Г – адгезия клеток к эндотелию (стрелка – В), изменение архитектоники эластических волокон, гиперхромия ядер мышечных клеток, фрагментация ядер миоцитов (стрелка – Г). Изменения в лейкоцитарной формуле, происходящие экспериментальной группе, представлены в таблице 2.3.1. 65 в данной Таблица 2.3.1. Показатели лейкоцитарной формулы у крыс при экспериментальной гипергомоцистеинемии с/я лейкоциты Эозинофилы КОНТРОЛЬ Моноциты Лимфоциты 23,17 3,67 6,83 63,0 6,14 2,25 4,17 4 2,51 0,92 1,7 1,63 Среднее значение (M) δ Ошибка среднего (m) ГГЦ Среднее значение (M) δ Ошибка среднего (m) 24,33 2,6* 3,13* 69,67# 11,22 2,5 2,23 13,52 2,89 0,64 0,57 3,49 Примечание - * - р≤0,05 достоверность между показателями у интактных животных и при моделировании дислипидемии; # - р≤0,1 достоверность между показателями у здоровых животных и в процессе создания модели. Обращает на себя внимание снижение количества моноцитов крови (в 2,2 раза) и эозинофилов (в 1,4 раза) в сравнении с контролем. Отмечается тенденция к увеличению количества лимфоцитов (на 9,5%). В срезах щитовидной железы экспериментальных животных (гипергомоцистеинемия), окрашенных гематоксилин-эозином, обращает на себя внимание увеличение количества крупных фолликулов (в 1,28 раза, табл.2.3.2). Стенка крупных фолликулов образована уплощенными клетками; цилиндрическая форма тироцитов сохраняется только в фолликулах малых размеров (рисунок 2.3.2а, 2.3.2б). Эти данные подтверждаются морфометрическими показателями, которые свидетельствуют об уменьшении высоты эпителия в 1,7 раза. 66 Рисунок 2.3.2а Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Фолликулы средних размеров выстланы плоским эпителием (1), малых – кубическим (2). Экстрацеллюлярное расположение гепариновых гранул тучных клеток типа «С» (указано стрелкой). Окраска: по Браше. Об.40, Ок.10. Рисунок 2.3.2б - Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Тироциты кубической формы (1) с гладким апикальным полюсом (2), базальная мембрана истончена. Ув.×3000. 67 Помимо этого, при изучении тканевого состава щитовидной железы, выявлено достоверное уменьшение процентной доли эпителия (таблица 2.3.3). При этом диаметр ядер также становится меньше. Коллоид плотный, густой, без признаков краевой вакуолизации, содержит десквамированные клетки. Локально определяются фолликулы с ретенцией коллоида (рисунок 2.3.3). Рисунок 2.3.3 - Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Преимущественно крупные и средние фолликулы в поле зрения. Единичные фолликулы свободны от коллоида (1), рядом - ретенция коллоида (2). Окраска: по Вейгерту. Об. 10, Ок. 10. Таблица 2.3.2. Процентное соотношение фолликулов разных диаметров в щитовидной железе в норме и эксперименте (M±m) Показатель Интактные животные ГГЦ Малые фолликулы 48,2±1,55 45,3±1,89# Средние фолликулы 34,5±2,08 32,6±2,99 Крупные фолликулы 17,3±0,70 22,1±1,61* Примечание - * – р≤0,05 в сравнении с контрольными показателями; # – p≤0,1. 68 Атрофические процессы в виде десквамации фолликулярного эпителия приводят к нарушению контакта между фолликулами. Локально это привело к обнаружению мастоцита в просвете фолликула (рисунок 2.3.4). Рисунок 2.3.4 - Щитовидная железа. Экспериментальная гипергомоцистеинемия. Тучная клетка типа «В» (указана стрелкой) в просвете фолликула. Окраска: азур-II-эозин. Об. 40, Ок. 10. Имеет место увеличение площади стромы за счет разрастания соединительной ткани, локально имеются участки склерозирования. Количество клеток в состоянии апоптоза нарастает преимущественно в соединительной ткани, вблизи сосудов (рисунок 2.3.5а, 2.3.5б). Нарастание относительной доли межклеточного вещества (таблица 2.3.3) может быть обусловлено отеком, набуханием коллагеновых и эластических волокон. При морфометрическом исследовании сосудистого компонента стромы выявлено значительное расширение артерий. Стенка их утолщена за счет гиперплазии мышечного и эндотелиального слоев (рисунок 2.3.6а, 2.3.6б). 69 А Б Рисунок 2.3.5 – Щитовидная железа контрольных (А) и экспериментальных (гипергомоцистеинемия) (Б) животных. Стрелками показаны апоптозные клетки. Иммунопероксидазный метод. Об. 20, Ок. 10. 70 Рисунок 2.3.6а - Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Строма отечна, разволокнена (1). Сосуды расширены, стенка артерий утолщена, в просвете сосудов – явления стаза (2). Много тучных клеток в поле зрения (указаны стрелками). Окраска: по Вейгерту. Об.40, Ок. 10. Рисунок 2.3.6б - Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Разветвление капилляра, в просвете которого определяются эритроциты (1), лимфоциты (2); клетка гистиогенного ряда (3), эндотелиоцит (4), тироцит (5). Ув.× 3000. Таблица 2.3.3. Процентное соотношение тканевых компонентов щитовидной железы в норме и эксперименте (M±m) 71 Объемная плотность % Группа Фолликулярный эпителий Коллоид Соединительная ткань, сосуды Контрольная группа 50,9±0,85 26,8±0,81 22,3±0,77 ГГЦ 24,8±2,17* 30±3,55* 45,2±4,67* Примечание - * - р˂0,05 в сравнении с контрольными показателями. В состоянии ядрышкового аппарата тироцитов обращает на себя внимание значительное преобладание одно- и двуядрышковых форм (рисунок 2.3.7), при этом количество многоядрышковых клеток значительно снижено (таблица 2.3.4), что указывает на угнетение синтетической функции клеток в фолликулах всех размеров. При этом относительная плотность коллоида возрастает, что может свидетельствовать о затруднении выхода гормонов в кровоток. В норме зрелый тироглобулин по мере необходимости фагоцитируется тироцитами, поступая в лизосомы и расщепляясь в фаголизосомах. Аминокислоты используются для новых синтезов, а Т3 и Т4 из базальной части клеток поступают в кровь. Таблица 2.3.4. Процентное соотношение тироцитов с разным числом ядрышек в фолликулах интактной и экспериментальной групп (M±m) Группа Фолликулы Крупные Средние Малые Интактные Количество ядрышек 1 2 3 и более 22,0±2,08 30,7±1,45 49,0±1,53 22,7±4,26 33,7±3,71 44,3±2,60 25,0±3,61 31,3±3,53 43,7±6,84 ГГЦ Количество ядрышек 1 2 3 и более 26,9±0,91* 41,4±1,01* 31,7±1,16* 26,7±0,87# 43,9±1,76* 29,4±1,98* 33,9±1,10* 39,2±1,30* 26,9±0,75* Примечание - * - р≤0,05 в сравнении с контрольными показателями; # - p≤0,1. Значительные изменения претерпевает популяция тучных клеток при экспериментальной гипергомоцистеинемии. Среднее количество мастоцитов, приходящихся на одно поле зрения, возрастает практически в 2 раза (рисунок 2.3.8). Максимальное число ТК в группе контроля составляет 10 на одно поле зрения, а в группе с гипергомоцистеинемией – 30. 72 Рисунок 2.3.7 - Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Фолликулы среднего и крупного диаметров. В ядрах тироцитов определяется преимущественно 1 или 2 ядрышка. В просвете фолликулов – десквамированные клетки (ДК). Окраска: азотнокислое серебро. Об.100, Ок.10. Рисунок 2.3.8 – Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Скопление тучных клеток в строме органа, вблизи сосудов (1). Окраска: азур-II-эозин. Об. 40, Ок.10. 73 Соотношение ТК различных форм представлено на рисунке 2.3.9. 16,2 28,2 ТК типа "А" ТК типа "В" 20,3 ТК типа "С" ТК типа "D" 35,4 Рисунок 2.3.9 – Соотношение субпопуляции тучных клеток щитовидной железы при экспериментальной гипергомоцистеинемии. Таким образом, количество тучных клеток типа «А» и «В» значительно снижено по сравнению с контролем, в то время как количество светлых и очень светлых клеток увеличено в 1,46 и 1,6 раза соответственно (рисунок 2.3.10). Если общий индекс дегрануляции в контрольной и экспериментальной группах находится на одинаковом уровне, то ИД, рассчитываемый с учетом вклада отдельных типов клеток достоверно выше (в 1,3 раза) при гипергомоцистеиновой модели атерогенеза (таблица 2.3.5). ИГ мастоцитов экспериментальных животных увеличивается, что свидетельствует о выходе содержимого гранул и преобладании мерокринового типа секреции. Процессы дегрануляции, выхода биологически активных веществ идут активно, но при этом насыщение клеток гепарином снижается. Показатель, отражающий тип мерокриновой секреции растет (ИГ) – увеличивается за счет повышения числа «С» и «D» форм (светлых и очень светлых), тогда как ИНГ уменьшается в 2 раза (таблица 2.3.5). 74 Рисунок 2.3.10 - Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Диаметр фолликулов увеличен, тиреоидный эпителий уплощен. В поле зрения тучные клетки преимущественно типа «С» (указаны стрелками). Окраска: азур-II-эозин. Об.40, Ок.10. Таблица 2.3.5. Индексы секреторной активности ТК в щитовидной железе (M±m) Индекс Интактные животные ГГЦ Общий индекс дегрануляции 0,141±0,03 0,201±0,021# Индекс дегрануляции 0,999±0,060 1,240±0,091* Индекс гранулолизиса 0,101±0,020 0,160±0,020* Индекс суммарного гранулолизиса 0,239±0,04 0,361±0,040* Индекс насыщения гепарином 3,692±0,731 1,872±0,301* Примечание - * - р≤0,05 в сравнении с контрольными показателями; # - p≤0,1. Таким образом, в железах контрольной и экспериментальной групп наблюдения процессы насыщения и секреции ТК различны. На субклеточном уровне организации щитовидной железы выявлены следующие изменения. Микроворсинки тироцитов практически не выражены, особенно в двуядерных клетках. В цитоплазме определяется значительное количество митохондрий, элементов ЦПС, секреторных вакуолей, первичных и вторичных лизосом (рисунок 2.3.11). 75 Рисунок 2.3.11 - (гипергомоцистеинемия). Щитовидная железа экспериментальных Фолликулы выстланы низким кубическим животных эпителием. Сглаженность микроворсинок (1), митохондрии (2), ЦПС (3). Ув. ×3000. ШИК-положительная реакция коллоида отмечается сплошь в фолликулах разного диаметра (рисунок 2.3.12). В целом, интенсивность реакции коллоида несколько ниже, чем при ГХ. При этом степень окрашивания тироцитов выше, чем в группе с гиперхолестеринемией. Интенсивность ШИК-реакции коллоида не приурочена к фолликулам определенного размера. Встречается интенсивно окрашенный коллоид фолликулов, как большого, так и малого диаметров, и наоборот, сниженная реакция проявляется в фолликулах разных размеров. Такие изменения в тинкториальных свойствах являются показателем реакции функционального напряжения и носят мозаичный характер. При окраске метиловым зеленым пиронином коллоид фолликулов разных диаметров проявляют реакцию на РНК умеренно (+) (по сравнению с контрольной группой ++). Окрашивание коллоида фолликулов по всей площади органа примерно одинаково (рисунок 2.3.13а.). Фолликулов с повышенной пиронинофилией не наблюдается. Не проявляют пиронинофильной реакции единично расположенные и сгруппированные крупные фолликулы (рисунок 2.3.14). Интенсивность окраски цитоплазмы тироцитов снижена по сравнению с контролем, но повышена относительно первой экспериментальной группы, что можно выразить как соотношение: контроль (++):ГХ(+–): ГГЦ (+). 76 Рисунок 2.3.12 Щитовидная железа экспериментальных животных (гипергомоцистеинемия). Фолликулы с разными тинкториальными свойствами. Расширенный сосуд с форменными элементами крови (1), десквамированные клетки (2). ШИК-реакция. Об. 10, Ок.10. Рисунок 2.3.13 - Щитовидная железа экспериментальных животных (гипергомоцистеинемия): А) Фолликулы разного диаметра. Крупные аденомеры преобладают по периферии органа (1). Аморфная субстанция стромы прозрачная, нежная фибриллярная сеть (2). Большое количество тучных клеток по всему срезу (указаны стрелками); Б) Фолликулы среднего (3) и крупного (4) размеров. Эпителий уплощен. 77 Цитоплазма тироцитов с умеренной пиронинофилией. Окраска: по Браше. Об. А) 10 Б) 40, Ок. 10. Рисунок 2.3.14 - (гипергомоцистеинемия). Щитовидная железа Фолликулы среднего экспериментальных диаметра с разной животных степенью пиронинофилии. Окраска: по Браше. Об. 40, Ок. 10. Данные изменения свидетельствуют о разной интенсивности накопления РНК-протеида, и, следовательно, об изменении функциональных свойств фолликулов разных диаметров. Таким образом, суммируя полученные данные по морфофункциональным изменениям щитовидной железы при экспериментальной гипергомоцистеинемии, можно сказать, что преобразования на тканевом, клеточном и субклеточном уровнях носят однонаправленный характер и отражают дис- и атрофические перестройки, происходящие в органе. Уплощение тироцитов, уменьшение диаметра ядер, снижение интенсивности пиронинофилии цитоплазмы клеток щитовидной железы свидетельствует о недостаточной активности синтетических процессов. В то же время, увеличение количества крупных фолликулов, процентной доли коллоида, отсутствие резорбционных вакуолей в нем, говорит о накоплении тиреоглобулина в просвете фолликулов. Соответственно, происходит задержка секрета и гормоны не поступают в кровяное русло, что характерно для гипофункционального состояния щитовидной 78 железы. Снижение функциональной активности щитовидной железы подтверждается биохимическим анализом крови. Так, уровень Т3 составляет 77% от контрольных значений и равен 2,4±0,01 нмоль/л, а Т4 – 82,3% (41,5±0,3 нмоль/л). 2.4. Сравнительная характеристика морфофункциональных изменений в щитовидной железе при гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза Изменения, происходящие в щитовидной железе при гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза, носят однонаправленный характер. При морфометрии фолликулов было выявлено, что в группе экспериментальной гиперхолестеринемии достоверно уменьшается процент малых фолликулов. При этом содержание крупных аденомеров возрастает почти в 2 раза. Полученные данные свидетельствуют о подавлении фолликулогенеза. Во второй экспериментальной группе количество малых и средних фолликулов остается на уровне нормальных значений. Увеличение процента крупных аденомеров по сравнению с группой ДЛП выражено меньше (рисунок 2.4.1). В обеих экспериментальных группах увеличивается количество крупных фолликулов (рисунок 2.4.1), что является признаком накопления тироглобулина в просвете фолликулов и свидетельствует о затруднении выхода гормонов в кровоток, т.е. о гипофункциональном состоянии органа. Из рисунка 2.4.1 становится видно, что в экспериментальных группах отмечается тенденция к увеличению числа крупных фолликулов и уменьшению количества малых и средних аденомеров. При этом средний диаметр фолликулов в целом уменьшается по сравнению с интактными животными (рисунок 2.4.2). Данное явление может быть обусловлено динамичной сменой фаз секреции, т.е. принципом временной перемежающейся структур. 79 активности функционирующих Крупные Средние 34,3* 48,2 Малые 45,3# 31,9# 32,6 34,5 33,8* 17,3 Контроль ГХ 22,1* ГГЦ Рисунок 2.4.1 - Процентное соотношение фолликулов разных диаметров в норме и группах эксперимента: * - р≤0,05 по сравнению с контрольными показателями; # - p≤0,1. 18 мкм 16 * 14 12 10 Контроль # 8 ГГЦ 6 4 2 ГХ # * 0 Диаметр малых фолликулов Диаметр средних Диаметр крупных фолликулов фолликулов Рисунок 2.4.2 - Средний диаметр фолликулов ЩЖ в норме и группах эксперимента: * р≤0,05 по сравнению с контрольными показателями; # - p≤0,1. Таким образом, в обеих экспериментальных группах меняется процентное соотношение, приходящееся на малые, средние и крупные фолликулы. Так, у 80 интактных животных данное гипергомоцистеинемии 2:1,5:1, соотношение а в составляет группе 3:2:1, при экспериментальной гиперхолестеринемии соотношение выравнивается - 1:1:1. Задержка тиреоглобулина в просвете фолликулов, нарушение его экскреции в кровоток подтверждаются данными, полученными при изучении процентного соотношения тканевых структур в щитовидной железе. Как при холестеринемии, так и при гипергомоцистеинемии процентная доля, приходящаяся на коллоид, повышена (рисунок 2.4.3). Также в обеих экспериментальных группах отмечается снижение удельной площади фолликулярного эпителия и увеличение доли стромального компонента (рисунок 2.4.3). Снижение процентного соотношения эпителия обусловлено уменьшением высоты тироцитов (до 0,31±0,01 мкм при ГХ и 0,28±0,01 при ГГЦ) (таблица 2.4.1). Увеличение доли, приходящейся на стромальный компонент, объясняется разрастанием и отеком соединительной ткани, которые были выявлены в обеих группах эксперимента. 60 % 50 * 40 * Контроль * 30 * * ГХ ГГЦ 20 10 0 Эпителий Коллоид Строма Рисунок 2.4.3 – Процентное соотношение тканевых компонентов щитовидной железы в норме и эксперименте: * - р≤0,05 по сравнению с контрольными значениями; # - p≤0,1. 81 Таблица 2.4.1. Морфометрическая характеристика тироцитов в норме и группах эксперимента (M±m) Интактные животные ГХ ГГЦ Высота (мкм) 0,48±0,010 0,31±0,01* 0,28±0,010* Диаметр ядер (мкм) 0,34±0,009 0,25±0,01* 0,22±0,008* Характеристика тироцитов Примечание - * - р≤0,05 по сравнению с контрольными показателями. Данные изменения свидетельствуют о развитии атрофических процессов в органе, снижении его функциональной активности и накоплении гликопротеидов в просвете фолликулов. При этом обращает на себя внимание, что изменения в морфологии тироцитов и соединительной ткани при экспериментальной гипергомоцистеинемии оказываются более выраженными (рисунок 2.4.3) и развиваются с большей скоростью. Значительные изменения в популяции мастоцитов свидетельствут об активации иммунной системы при изучаемых патологических процессах. Гипергомоцистеинемия, как стрессорный агент, активирует пул тучных клеток интенсивнее, чем гиперхолестериновая модель. Количество мастоцитов при ГГЦ, приходящихся на одно поле зрения, увеличивается более, чем в 2 раза (р≤0,05). Это клетки преимущественно групп «С» и, главным образом, «D», т.е. опустошенные, светлые, часть из которых представляет собой клетки-тени, от которых остается только мембрана с россыпью гранул вокруг. Индекс дегрануляции статистически достоверно увеличивается в 1,25 раза, индекс гранулолизиса – в 1,6 раза (рисунок 2.4.4). Индекс насыщения гепарином уменьшается практически в 2 раза, что свидетельствует о длительном тяжелом воспалительном процессе, при котором мастоциты не успевают восстановить уровень медиаторов. Гомоцистеин, накапливающийся в крови, повреждающе действует на эндотелий сосудов, способствует его слущиванию (Скворцов Ю.И., Королькова А.С., 2011). Избыток его подвергается аутоокислению, что вызывает развитие оксидативного стресса и активизацию кальциевых каналов в ТК, являясь стимулом к их дегрануляции и выбросу содержимого в окружающую среду 82 (Болдырев А.А. с соавт., 2006). Можно предположить, что накопление биологически активных веществ во внеклеточном пространстве усиливает цитотоксическое действие самого гомоцистеина. При формировании модели гиперхолестеринемии мы получили другие закономерности изменения активности тучных клеток согласно рассчитываемым индексам. В этой группе экспериментальных животных индексы секреторной активности тучных клеток остаются на уровне с контрольными значениями (рисунок 2.4.4). При этом количество мастоцитов, приходящихся на одно поле зрения, уменьшается по сравнению с интактными животными в 1,23 раза. Можно предположить, что разнонаправленность изменений в популяции мастоцитов при экспериментальных моделях объясняется разными стимулами, приводящими к дегрануляции ТК. Так, при гиперхолестеринемии пусковым сигналом может служить иммунный дисбаланс и формирование иммунных комплексов, которые взаимодействут с мембраной ТК. Можно полагать, что ТК, являясь исключительно лабильным элементом, служат своего рода функциональным «перекрестом» гормональной и иммунной регуляции в организме. 4 3,5 3 2,5 Контроль * 2 ГХ ГГЦ 1,5 1 0,5 * * 0 ИД ИГ ИСГ ИНГ Рисунок 2.4.4 - Индексы секреторной активности тучных клеток в норме и эксперименте: * - р≤0,05 при сравнении с контрольными показателями. 83 В состоянии ядрышкового аппарата экспериментальных животных (гиперхолестеринемия) не отмечается активных изменений по сравнению с контролем. При гипергомоцистеинемии преобладают клетки, ядра которых содержат одно либо два ядрышка. При этом количество многоядрышковых клеток значительно снижено по сравнению с контролем. Подобные изменения наблюдаются в фолликулах разного диаметра. Средний диаметр ядер в обеих экспериментальных группах также уменьшается (таблица 2.4.1). Подобные изменения свидетельствуют об угнетении синтетической функции тироцитов.Для подтверждения снижения белокпродуцирующей функции эпителиальных клеток ЩЖ нами была использована качественная оценка срезов ЩЖ, окрашенных метиловым зеленым-пиронином. В обеих экспериментальных группах была выявлена сниженная (по сравнению с контролем) реакция цитоплазмы тироцитов на РНК (таблица 2.4.2). Таблица 2.4.2. Оценка синтетической функции тироцитов в норме и группах эксперимента Показатель Интактные животные ГХ ГГЦ Количество ядрышек Преимущественно многоядрышковые Преимущественно 1и 2-ядрышковые Преимущественно 1и 2-ядрышковые Реакция цитоплазмы тироцитов на РНК +++ + ++ ШИК-реакция цитоплазмы тироцитов +++ ++ + ШИК-реакция коллоида +++ ++ + Сопоставляя полученные данные, можно предположить, что при экспериментальной гиперхолестеринемии количество ядерышек больше, но они менее функционально активны, в то время как количество ядрышек при ГГЦ меньше, но синтетические процессы в них выше. Интересным является тот факт, 84 что несмотря на то, что при ГГЦ реакция цитоплазмы на РНК выше, чем во второй экспериментальной группе, концентрация тиреоглобулина при этом ниже, как в цитоплазме фолликулярных клеток, так и в коллоиде (таблица 2.4.2).Таким образом, можно сделать вывод, что ядерный этап биосинтеза белка при ГГЦ активирован, но за счет способности гомоцистеина вызывать стресс ЭПР, нарушается цитоплазматический этап, что приводит к снижению концентрации тиреоглобулина. Данный вывод подтверждается реакцией клеток по Гомори. Так при экспериментальной дислипидемии реакция на кислую фосфатазу наблюдатся преимущественно в апикальной, а при гипергомоцистеинемии – в базальной части тироцитов. 85 2.5. Морфофункциональные изменения в паратрахеальных лимфоузлах при гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза Паратрахеальные лимфоузлы интактных животных находятся по обе стороны от трахеи, располагаясь цепочкой в кранио-каудальном направлении. Обычно это группа ЛУ, в которых один узел крупного размера, бобовидной формы узлы, остальные – мелкие. Гистологическое В целом исследование их количество ПТЛУ интактных может достигать животных 3-5. показало преобладание в них корковой зоны, она занимает большую площадь среза (~7075%). Согласно классификации Бородина Ю.И. (Бородин Ю.И. с соавт., 1992), такой тип относится к компактным ЛУ. Здесь отчетливо просматриваются относительно немногочисленные, расположенные в один ряд округлой формы лимфатические узелки, часть из которых имеет развитый герминативный центр (ГЦ), выраженную корону узелка. Соотношение первичных и вторичных (с развитым ГЦ) лимфатических узелков в паратрахеальных лимфатических узлах контрольных крыс составляет ~ 2:1. В ГЦ располагаются делящиеся и молодые клетки лимфоидного ряда, в основном предшественники антителообразующих клеток – плазмоцитов, типичные макрофаги (их немного), дендритные ретикулярные клетки. Периферическая часть лимфоидных узелков (корона) содержит большое количество малых и средних В-лимфоцитов. Соотношение в зрелом вторичном фолликуле площади светлого центра и окружающего мантийного слоя составляет примерно 3:1. Клеточный состав неактивных (первичных) узелков представлен преобладающими в числе малыми и средними лимфоцитами; макрофаги единичны, мантийный слой не определяется. Паракортикальная часть ПТЛУ (Т-зависимая зона) незначительна по объёму. Она располагается между корковым и мозговым веществом и состоит из диффузно расположенных малых лимфоцитов. От внутреннего коркового вещества внутрь отходят сильно разветвленные мозговые тяжи, образованные преимущественно лимфоцитами, плазмоцитами и макрофагами. Мозговое вещество лимфатических узлов в целом является В-зависимой структурнофункциональной зоной. Между мякотными тяжами расположены мозговые 86 синусы, в которых находятся лимфоциты, макрофаги, плазматические клетки (рисунок 2.5.1). На рисунке 2.5.2 представлен также субкапсулярный синус лимфоузла контрольных животных, содержащий лимфоциты различных посткапиллярными венулами, морфотипов. Сосудистый компонент представлен артериями, капиллярами. Соотношение тучных клеток различных форм уравновешено (рисунок 2.5.3). Клетки 1-го и 2-го типа встречаются в основном в соединительнотканной строме капсулы, располагаясь вдоль направления волокон. Клетки 3-го и 4-го типов чаще представлены в мозговом веществе, концентрируясь группами в мозговых тяжах и синусах. Часть клеток – это одиночно лежащие, разбросанные по площади узла ТК без определенной топологической привязанности к определенных зонам ЛУ. Также изредка можно встретить отдельно расположенные гранулы, локализующиеся преимущественно в ткани капсулы. Плотность расположения тучных клеток на единицу поля зрения составляет 3,54±1,09 (σ=7,78). Индексы активности мастоцитов представлены в таблице 2.5.1. Рисунок 2.5.1 - Мозговое вещество паратрахеального лимфоузла контрольных животных. 1 – синус, 2 – отростки дентритных клеток, выстилающих синус, 3 - рыхло расположенные лимфоциты. Ув. 2500. 87 Рисунок 2.5.2 - Субкапсулярный синус паратрахеального лимфоузла контрольных животных. Стромальные элементы капсулы лимфоузла (1), пространство синуса (2), гладкий лимфоцит (Т-лимфоцит, согласно классификации морфотипов) (3), лимфоциты, имеющие выросты на своей поверхности (В-лимфоцит, согласно классификации морфотипов) (4), отростки дендритных клеток синуса (5). Ув. 2000. 20,3 26,7 ТК типа "А" ТК типа "В" ТК типа "С" ТК типа "D" 26,5 25,5 Рисунок 2.5.3 – Соотношение субпопуляций тучных клеток паратрахеальных лимфатических узлов у интактных животных. 88 Таблица 2.5.1. Индексы активности тучных клеток паратрахеальных лимфатических узлов в норме и эксперименте (M±m) Показатель Индекс дегрануляции Индекс гранулолизиса Индекс суммарного гранулолизиса Индекс насыщения гепарином Интактные животные Экспериментальная группа с ГХ Экспериментальная группа с ГГЦ 0,26±0,02 0,33±0,05# 0,46±0,02* 0,20±0,01 0,35±0,03* 0,28±0,04# 0,47±0,01 0,67±0,03* 0,74±0,03* 1,14±0,04 0,48±0,01* 0,26±0,01* Примечание - * - р<0,05 в сравнении с контрольными показателями, # - р<0,1 При изменений формировании микротопография холестериновой гистологических модели зон атеросклеротических лимфатических узлов экспериментальных животных в целом соответствует таковой у животных группы сравнения. Сохраняются все структурные элементы органа с присущими им в норме клеточными элементами. Однако изменяется архитектоника ткани ЛУ и структурно-функциональные характеристики. Соотношение зон сдвигается в сторону преобладания коркового вещества, оно занимает 80-85% среза, увеличен объем паракортикальной зоны (рисунок 2.5.4). Капсула лимфоузла отечна, резко расширен субкапсулярный синус, он плотно заполнен лимфоцитами, встречаются тучные клетки, эозинофилы, макрофаги и т.д. (рисунок 2.5.5). Количество лимфатических узелков в корковой зоне выше, чем в норме, они могут располагаться в 2-3 ряда, могут встречаться участки, в которых на поле зрения (7х10) их число достигает 15-18. Но в основном это фолликулы, не имеющие светлого центра, без выраженной короны, окружающей узелок (рис. (рисунок 2.5.6). В целом подобная ситуация может трактоваться и как новообразующийся, начинающий свою активность герминативный центр, а с другой стороны – как затухающий, заканчивающий свое развитие. 89 Рисунок 2.5.4 – Паратрахеальный (гиперхолестеринемия). Корковое лимфоузел вещество эксперментальных (стрелки), мозговое животных вещество (МВ), лимфатические узелки (1). Окраска: гематоксилин-эозин. Об.10, Ок. 5. Рисунок 2.5.5 – Паратрахеальный лимфоузел экспериментальных животных (гиперхолестеринемия). Расширен субкапсулярный синус, капсула отечна. Окраска: азурII-эозин. Об. 40, Ок. 5. 90 Рисунок 2.5.6 – Паратрахеальный лимфоузел экспериментальных животных (гиперхолестеринемя). Увеличение количества лимфатических узелков со слаборазвитым герминативным центром (стрелки). Окраска: азур-II-эозин. Об.10, Ок. 10. Большей частью это центры, в которых преобладают малые лимфоциты, митозов мало (количество митотических элементов в коре и паракортикальной зоне имеет тенденцию к снижению – таблица 2.5.2). В таких герминативных центрах преобладают центроциты, располагающиеся по краям фолликула. В целом в коре эти клетки увеличиваются в 1,4 раза и в ПКЗ – в 1,2 раза. Сканирующая электронная микроскопия показывает увеличение разнообразия форм лимфоцитов. Так, в корковой области повышается количество В-клеток с интенсивно выраженной ворсинчатым микрорельефом, неправильной формы, с большим количеством отростков различной длины, складками (рисунок 2.5.7), в паракортикальной зоне расположены относительно гладкие лимфоциты, иногда с микроворсинками на поверхности (рисунок 2.5.8). Аналогичный морфотип лимфоцитов в мозговой зоне (рисунок 2.5.9). 91 Рисунок 2.5.7 - Корковое вещество паратрахеального лимфоузла экспериментальных животных (гиперхолестеринемия). Клетки с большим количеством различных по длине выростов (морфотип В-лимфоцитов). Ув. 3000. Рисунок 2.5.8 - Паракортикальная зона паратрахеального лимфоузла экспериментальных животных (гиперхолестеринемия). Диффузное расположение клеток. Лимфоциты с относительно гладкой поверхностью – Т-лимфоциты (ЛФ). Ув. 1500. 92 Рисунок 2.5.9 - Мозговое вещество паратрахеального лимфоузла экспериментальных животных (гиперхолестеринемия). Лимфоциты (1) в просвете синуса (3) и в мозговом тяже (2). Ув.2500. Нарастает число плазмоцитов по сравнению с контролем, особенно в корковой области их число повышается в 5,64 раза (р≤0,05) (таблица 2.5.2). Таблица 2.5.2. Клеточный состав различных зон ПТЛУ в норме и эксперименте (М±m) Кора 58,22±2,51 Гиперхолес теринемия 55,42±4,61 ПКЗ 55,12±9,53 54,96±3,31 57,78±6,22 МВ 17,61±1,88 18,26±2,12 17,87±2,23 Кора 18,44±2,37 25,18±1,26* 18,04±2,91 ПКЗ 16,24±1,15 20,45±2,12# 17,84±1,36 МВ 6,78±1,55 7,13±1,18 6,04±1,23 Кора 2,42±0,31 1,98±0,12* 4,25±0,44* ПКЗ 3,89±0,63 3,67±0,41 3,03±0,26 МВ 2,11±0,15 2,24±0,25 5,56±0,41* Кора 0,52±0,01 ПКЗ 3,23±0,63 4,44±0,90# 3,84±0,92 МВ 5,82±1,01 7,11±1,23# 6,84±1,12 Клеточные элементы Зоны ЛУ Лимфоциты Центроциты Центробласты Иммунобласты Контроль 93 0,81±0,1* Гипергомо цистеинемия 58,63±3,82 0,74±0,08* Продолжение таблицы 2.5.2. Плазмоциты Макрофаги Митотические элементы Апоптотические элементы Кора 0,22±0,01 ПКЗ 8,45±1,30 10,33±2,14 7,0±1,56 МВ 21,88±2,57 24,66±1,89 15,90±2,44* Кора 2,88±0,84 4,64±0,91# 7,12±1,11* ПКЗ 1,62±0,06 1,59±0,32 2,80±0,81# МВ 5,36±0,91 6,54±1,53 10,21±2,87* Кора 0,20±0,02 0,25±0,02 0,83±0,03* ПКЗ 0,82±0,10 0,71±0,22 1,24±0,20# МВ 0,77±0,21 0,83±0,32 1,56±0,30* Кора 0,33±0,01 0,82±0,09# 1,51±0,25* ПКЗ 0,23±0,01 0,34±0,01 0,2±0,02 МВ 0 Примечание - в сравнении с контролем: * – р≤0,05; # – р≤0,1 1,24±0,03* 0 0,53±0,01* 0,58±0,12* Это наблюдение соотносится с данными окраски Ki-67, при которой количество клеток, находящихся в состоянии митотического деления ниже, чем в контроле, что также предполагает второй вариант развития ГЦ (рисунок 2.5.10). Рисунок 2.5.10 - Герминативные центры фолликулов при реакции Ki-67. а – паратрахеальный лимфоузел котрольных животных, б – паратрахеальный лимфоузел при гиперхолестеринемии (выявляются единичные ГЦ, снижена плотность элементов). Реакция с моноклональными антителами Ki-67 (иммуно-пероксидазный метод). Об.10, Ок. 5. 94 Исследование апоптотических элементов иммуногистохимическим методом (на выявление каспазы-3) показало незначительное увеличение числа апоптотических элементов в корковом веществе паратрахеальных лимфоузлов, что согласуется с данными морфометрического анализа (таблица 2.5.2). Соотношение первичных и вторичных ГЦ при гиперхолестеринемии составляет ~ 1:6. Подобный вариант гистологической картины может трактоваться как доброкачественная реактивная гиперплазия. В ряде случаев отмечено появление фолликулов с макрофагальным преобладанием. Объем мозгового вещества ЛУ снижен (рисунок 2.5.5; 2.5.10), в отдельных случаях мозговое вещество раздвигает корковое и узкими участками проникает в периферические отделы узла, вплоть до капсулы (вариант нормы более характерный для брыжеечных узлов, чем для глубоких шейных). Рисунок 2.5.11 - Уменьшение площади мозгового вещества паратрахеального лимфоузла экспериментальных животных (гиперхолестеринемия), лимфатические узелки (стрелки), участок мозгового вещества достигает капсулы (двойная стрелка). Окраска: азур-II-эозин. Об.10, Ок. 5. Морфология синусов и мозговых тяжей существенно не меняется, плотность клеток невысока, но соизмерима с контролем. Синусы расширены, 95 заполнены клетками. Представительство основных клеток (лимфоцитов, плазмоцитов, макрофагов) в них соответствует норме (таблица 2.5.2), однако в синусах отмечается обилие эозинофилов (рисунок 2.5.11), могут встречаться скопления макрофагов. В мозговом веществе отмечаются отдельные пролиферирующие клеточные элементы. Таким образом, хотя плотность клеток в различных структурно- функциональных отделах мозгового вещества в целом соответствует контролю, но изменяется его клеточный состав. Преобладание тимус-независимой В-зоны с одновременным увеличением паракортикальной зоны, увеличенное число первичных лимфатических фолликулов, фолликулов с центрами размножения, количества макрофагов свидетельствует об имеющейся антигенной стимуляции. Рисунок 2.5.12 Паратрахеальный - лимфоузел экспериментальных животных (гиперхолестеринемия). Мозговой синус (1), мозговые тяжи (2), тучные клетки (3), эозинофилы (4). Окраска: азур-II-эозин. Об.40, Ок. 5. Известно, гемопоэтическая что и важнейшими функциями иммунопоэтическая, но ЛУ и являются функция не только обеспечения рециркулирующего пула лимфоцитов, которая обеспечивается прохождением их через высокоэндотелиальные венулы (ВЭВ). 96 В паракортикальной зоне лимфоузлов при окраске по методу ШИК выявляется ШИК-позитивное окрашивание, которое контурирует венулы с высоким эндотелием, содержащим в просвете много малых лимфоцитов (рисунок 2.5.13а – контроль и 2.5.13б – гиперхолестеринемия). Сосуды ЛУ расширены, отмечается стаз форменных элементов, как эритроцитов, так и лимфоцитов (рисунок 2.5.14.) Застойные явления отмечаются также и в капиллярах. Обращает на себя внимание эозинофильная инфильтрация соединительной ткани, окружающей лимфатические узлы (рисунок 2.5.15). Рисунок 2.5.13 - Венулы с высоким эндотелием в паракортикальной зоне паратрахеального лимфоузла контрольных животных (А) и крыс с гиперхолестеринемией (Б). Просвет ВЭВ при ГХ заполнен лимфоцитами и клетками моноцитоидного ряда. ШИК-позитивное окрашивание. Об.100, Ок. 10. 97 Рисунок 2.5.14 – Паратрахеальный лимфоузел экспериментальных животных (гиперхолестеринемия). Расширенные сосуды мозгового вещества ЛУ, пристеночный стаз. Окраска: азур-II-эозин. Об.40, Ок. 10. Рисунок 2.5.15. Паратрахеальный лимфоузел экспериментальных животных (гиперхолестеринемия). Многочисленные эозинофилы в соединительнотканной строме. Окраска: азур-II-эозин. Об.40, Ок. 10. Количество тучных клеток падает в сравнении с контролем, на поле зрения оно составляет 1,63±0,87(σ=4,24). Однако в отличие от контроля снижено 98 количество мастоцитов главным образом в капсуле, тогда как в синусах они могут формировать скопления, в которых их количество может достигать 15-20, а в тяжах 5-6 на поле зрения (рисунок 2.5.16, 2.5.17). Тучноклеточная популяция на одном и том же участке органа представлена мастоцитами, находящимися на разных стадиях секреторного цикла (таблица 2.5.1, рисунок 2.5.17). Таким образом, резко выражена зональность распределения мастоцитов: больше всего их в синусах>мякотные тяжи>соединительнотканная строма капсулы. Соотношение клеток разного фенотипа представлено на рисунке 2.5.18. В связи с этим меняются коэффициенты, рассчитываемые на их основе (таблица 2.5.1). Повышаются индексы дегрануляции и гранулолизиса, причем более активно (в 1,75 раз) повышается индекс, отражающий вариант мерокриновой секреции. Индекс насыщения гепарином снижен в 2,38 раз. Рисунок 2.5.16 – Паратрахеальный лимфоузел экспериментальных животных (гиперхолестеринемия). Тучные клетки в мозговом синусе (стрелки). Уменьшение площади мозгового вещества. Окраска: азур-II-эозин. Об. 5, Ок. 10. 99 Рисунок 2.5.17 – Паратрахеальный лимфоузел экспериментальных животных (гиперхолестеринемия). Скопление тучных клеток разной степени зрелости в мозговом синусе (фрагмент предыдущего снимка). Окраска: азур-II-эозин. Об.40, Ок. 10. 4,3 34,6 28,2 ТК типа "А" ТК типа "В" ТК типа "С" ТК типа "D" 32,9 Рисунок 2.5.18 – Соотношение субпопуляций тучных клеток паратрахеальных лимфоузлов при экспериментальной гиперхолестеринемии. Повышение уровня гомоцистеина в крови в ПТЛУ также приводит к выраженным сравнении с морфологическим перестройкам, предыдущей экспериментальной 100 интенсивность группой которых выше. в Они характеризуются своеобразием, отличаются как от контроля, так и от изменений, вызванных введением холестерина. Так, в этой группе экспериментальных животных в ПТЛУ отмечается незначительное расширение субкапсулярного синуса, в котором располагаются редкие лимфоциты, макрофаги, единичные плазматические клетки, отмечается присутствие мастоцитов. Капсула лимфоузла утолщена (рисунок 2.5.19), инфильтрирована тучными клетками и их гранулами (рисунок 2.5.20). Незначительно меняется соотношение коркового и мозгового вещества с общей тенденцией к увеличению объема, занимаемого мозговым веществом. Ситуация в узлах различна, иногда прямо противоположна, чаще связана с величиной узла. Так, в ЛУ малого размера объем коркового вещества незначителен, часто большую часть среза занимает мозговая зона (рисунок 2.5.21). Подобный тип ЛУ относится к фрагментированным (Бородин Ю.И. с соавт., 1992), выполняющим преимущественно лимфодренажную (в отличие от компактного) функцию. Можно предположить, что это узлы второго порядка, получающие лимфу от первичных крупных реактивных ЛУ, обеспечивающих, главным образом, усиленный лимфооток. Рисунок 2.5.19 – Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемиия). Утолщение капсулы узла, в синусе практически отсутствуют клеточные элементы. Окраска: гематоксилин-эозин. Об. 100, Ок. 10. 101 Рисунок 2.5.20 – Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемиия). Инфильтрация капсулы тучными клетками и гранулами. Окраска: азур-II-эозин. Об. 40, Ок. 10. Рисунок 2.5.21 – Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемиия). Мозговое вещество занимает большую часть ЛУ. Окраска: азур-II-эозин. Об. 10, Ок.10. 102 В лимфатических узелках ЛУ с сохраненной корковой зоной большая часть представлена вторичными, с хорошо развитым герминативным центром (соотношение первичных и вторичных узелков может достигать 1:8) и выраженной короной узелка (рисунок 2.5.22). Размеры узелков варьируют, также как и степень их зрелости. Плотность элементов в ГЦ снижена по сравнению с контролем, однако отличается большим разнообразием клеточных элементов, входящих в их состав (лимфоциты, плазмоциты, макрофаги) в отличие от контроля. Увеличивается число центробластов в коре (в 1,76 раз, р≤0,05) и мозговом веществе (в 2,6 раза, р≤0,05), иммунобластов, количество плазмоцитов в корковом веществе имеет тенденцию к повышению, тогда как в мозговом – к снижению (таблица 2.5.2). Размеры узелков варьируют, также как и степень их зрелости. Плотность элементов в ГЦ снижена по сравнению с контролем, однако отличается большим разнообразием клеточных элементов, входящих в их состав (лимфоциты, плазмоциты, макрофаги) в отличие от контроля. Увеличивается число центробластов в коре (в 1,76 раз, р≤0,05) и мозговом веществе (в 2,6 раза, р≤0,05), иммунобластов, количество плазмоцитов в корковом веществе имеет тенденцию к повышению, тогда как в мозговом – к снижению (таблица 2.5.2). Рисунок 2.5.22 – Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемиия). Корковое (1) и мозговое (2) вещество лимфоузла с развитыми лимфатическими узелками (3). Окраска: гематоксилин-эозин. Об. 10, Ок.10. 103 Сканирующая электронная микроскопия выявляет изменение формы лимфоцитов – это ламеллярные лимфоциты с пластинчатыми выростами в виде оборок, комбинированные формы (рисунок 2.5.23). Заметно возрастает число макрофагов по всей площади лимфоузла (в корковом веществе, например, увеличение составляет 2,47 раз, р≤0,05) (рисунок 2.5.24). Рисунок 2.5.23 – Паратрахеальный лимфоузел (корковое вещество) экспериментальных животных (гипергомоцистеинемиия). Скопление лимфоцитов разных морфотипов (описание в тексте). Ув. 1000. 104 Рисунок 2.5.24 – Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемиия). Граница мозгового тяжа (1) и синуса (2). Макрофаг в синусе (3) с адгезированным на поверхности материалом; отростки дендритных клеток (4). Ув. 2000. В отдельных ГЦ резко увеличено количество апоптозных телец (рисунок 2.5.25). Увеличенное количество делящихся элементов при окраске Ki-67 в ГЦ, появление их в короне узелка представлено на рисунке 2.5.26. Рисунок 2.5.25 – Паратрахеальный лимфоузел (герминативный центр) экспериментальных животных (гипергомоцистеинемиия). Апоптозные тельца (стрелки), макрофаги (МФ). Окраска: гематоксилин-эозин. Об.100, Ок. 10. 105 Рисунок 2.5.26 – Паратрахеальный лимфоузел (герминативный центр) экспериментальных животных (гипергомоцистеинемиия). Пустоты соответствуют местам апоптотического разрушения. Реакция с моноклональными антителами Ki-67 (иммунопероксидазный метод). Об.100, Ок. 10. Количество апоптотических элементов (иммуногистохимический метод) увеличено в корковом веществе и мозговых тяжах лимфоузлов (рисунок 2.5.27а, 2.5.27б). Паракортикальная зона не выражена. Количество центроцитов и центробластов, иммунобластов здесь соответствует контрольным значениям, отмечена тенденция к снижению плазмоцитов (в 1,2 раза, р≤0,1) и повышению макрофагов (в 1,73 раза, р≤0,1), количество митотических элементов в 1,5 раза выше контрольных значений (таблица 2.5.2). 106 А Б Рисунок 2.5.27 – Паратрахеальный лимфоузел контрольных (А) и экспериментальных (гипергомоцистеинемия) (Б) животных. Единичные апоптотические элементы указаны стрелками (А). Контур (Б) окружает скопление апоптотических клеток. Реакция с моноклональными антителами (иммуно-пероксидазный метод). Об. 10, Ок. 10. Венулы с высоким эндотелием не обладают четким контуром, что характерно для контроля, эндотелий производит впечатление набухшего, характерна размытость границ, увеличение размера самих венул (рисунок 2.5.28а, 2.5.28б). В них отмечается изобилие клеточных элементов, адгезированных к стенке ВЭВ как изнутри, так и снаружи, находящихся в процессе миграции. Синусы мозгового вещества небольших размеров, площадь, занимаемая мякотными тяжами, повышена. Характерным является сниженное количество плазмоцитов в мозговом веществе (в 1,38 раза, р≤ 0,05) (таблица 2.5.2). Плотность клеток в мозговых тяжах выше, чем в контроле. Интересен факт появления в мозговом веществе сформированных, с герминативным центром и короной 107 лимфоидных фолликулов (рисунок 2.5.29, 2.5.30). Часть узелков может располагаться на границе корковой и мозговой зоны. Рисунок 2.5.28 – Паратрахеальный (гипергомоцистеинемия). Венулы с лимфоузел высоким экспериментальных эндотелием в разных животных участках паракортикальной зоны. Расширение венулы, обилие клеточных элементов, размытость границ, мигрирующие лимфоциты (стрелки). ШИК-реакция. Об.100, Ок. 10. Рисунок 2.5.29 - Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемия). Фолликулы (стрелки) на границе мозгового вещества и в мозговом веществе. Окраска: гематоксилин-эозин. Об.5, Ок.10. 108 Рисунок 2.5.30 - Паратрахеальный лимфоузел (лимфатический фолликул, фрагмент предыдущего снимка) экспериментальных животных (гипергомоцистеинемия). Митозы (1), макрофаги (2), бластные элементы (3). Окраска: гематоксилин-эозин. Об.100, Ок. 10. В мозговой части лимфоузла обращает на себя внимание обилие макрофагов, формирующих группы (рисунок 2.5.31). Рисунок 2.5.31 – Паратрахеальный (гипергомоцистеинемия). лимфоузел экспериментальных Скопление макрофагов в мозговом синусе. гематоксилин-эозин. Об.100, Ок.10. 109 животных Окраска: Сосуды ЛУ расширены, эндотелий набухший, неровный, в большинстве отмечаются застойные явления, отмечаются признаки сладж-феномена. Застойные явления характерны и для капилляров. Клетки представлены в основном эритроцитами, единичными лимфоцитами (рисунок 2.5.32). Число ТК в целом снижается 1,46±0,34 (σ=1,67), они располагаются главным образом в соединительнотканной строме капсулы. Отдельные участки капсулы сплошь инфильтрированы ТК с разной степенью дегрануляции и отдельными гранулами, окружают сосуды (рисунок 2.5.20, 2.5.33). Рисунок 2.5.32 – Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемия). Набухший, отекший эндотелий (1), в сосуде располагаются сладжированные эритроциты (2), лимфоциты, гомогенизированные детритные массы (3). Окраска: гематоксилин-эозин. Об.40, Ок. 10. 110 Рисунок 2.5.33 – Паратрахеальный лимфоузел экспериментальных животных (гипергомоцистеинемия). Тучные клетки в капсуле лимфоузла. Активная дегрануляция, клетки и гранулы располагаются вокруг сосудов. Окраска: азур-II-эозин. Об. 100, Ок.10. В мозговом веществе и в синусах они встречаются редко, это фенотипы «С» и «D» форм. Процентный состав субпопуляций ТК представлен на рисунке 2.5.34. 16,3 27,9 9,9 ТК типа "А" ТК типа "В" ТК типа "С" ТК типа "D" 45,9 Рисунок 2.5.34 – Соотношение субпопуляций тучных лимфоузлов при экспериментальной гипергомоцистеинемии. 111 клеток паратрахеальных Снижается количество мастоцитов, заполненных гранулами биологически активных веществ (группы «А» в 2,1 раза и «В» в 2,4 раза). Одновременно повышается процентное содержание дегранулировавших клеток (группы «С» и «D») на 21,1 и 10,8% соответственно. В связи с этим и повышаются индексы дегрануляции при снижении индексов насыщения гепарином (табл. 2.4.1). Однако учитывая возросший на 77% индекс дегрануляции при модели ГГЦ, а также индекс гранулолизиса на 28,6%, возможна смена секреторной активности на преимущественно апокриновый ее вариант. В итоге обобщенный индекс (без учета типа секреции, отражается в параметре «ИСГ») увеличивается на 57,4%. При гиперхолестеринемии, несмотря на изменение индексов дегрануляции и гранулолизиса, типы секреции были уравновешены. Таким образом, формирование модели атерогенеза, обусловленное введением гомоцистеина в целом сопровождается более выраженными изменениями в ПТЛУ. Подобная гистологическая картина может трактоваться как фолликулярная гиперплазия, при которой обычно происходит увеличение размеров и числа вторичных фолликулов (фолликулов со светлыми центрами) в коре лимфоузла (В-зависимая зона). В светлом центре вторичных фолликулов происходит физиологическая бласттрансформация малых лимфоцитов (повышается количество иимунобластов, центробластов), с последующей клональной пролиферацией и селекцией, необходимая для осуществления эффективного гуморального иммунного ответа. Изменение морфотипов лимфоцитов свидетельствует об активности идущих процессов. Активный гуморальный ответ подтверждают также скопления макрофагов, обеспечивающих презентацию антигена, в цитоплазме которых определяется множество апоптозных телец. На антигенную стимуляцию указывают также факты обнаружения лимфоидных фолликулов на границе коркового и мозгового вещества, а также в самом мозговом веществе. Активная дегрануляция тучных клеток, преобладание апокринового типа секреции свидетельствуют о напряженности иммунного ответа организма при ГГЦ. 112 ЗАКЛЮЧЕНИЕ Несмотря на успехи современной медицины, атеросклероз остается важной медико-социальной проблемой в России и зарубежных странах в связи с широкой распространенностью, непрерывно прогрессирующим течением, поздней диагностикой и наличием тяжелых, затрагивающих многие системы органов, осложнений. Подтверждением атеросклеротических изменений у экспериментальных крыс являются показатели биохимического анализа крови и гистологический анализ триггерного органа для атеросклероза – грудной аорты, в которой наблюдаются характерные для атерогенеза изменения: липидные капли и адгезия клеток на поверхности эндотелия, дезорганизация мышечных клеток и эластических волокон, появление тучных клеток, как в аорте, так и в лимфоидных фолликулах, расположенных по ходу аорты. Последнее интересно в связи с появлением публикаций о роли сосуд-ассоциированной лимфоидной ткани (VALT) и необходимости ее морфологических исследований, что упоминается в работе Kawahara I. et al. (2013). На активную реакцию VALT, определяемую как третичные лимфоидные органы, при атеросклерозе стали обращать внимание совсем недавно (Stranford S., Ruddle N.H., 2012; Kawahara I. et al., 2013; Mohanta S. et al., 2014). По данным Hamze M. et al. формирующаяся атерома содержит резидентные В-клетки, которые могут способтвовать развитию воспаления и прогрессированию атеросклероза. Липидный спектр к окончанию эксперимента изменен, атерогенный индекс повышен. Необходимо отметить, что в нашей модели воспроизведения атерогенеза (с введением стрессовых факторов в дополнение к холестериновому рациону) данные липидного спектра у разных животных могли достаточно выражено отличаться, тогда как исходные (контрольные) значения имеют малый разброс показателей. Такие результаты можно трактовать в пользу генетической предрасположенности к развитию заболевания. Возможно, что наследственно обусловленные стресс-неустойчивые особи наиболее склонны к формированию заболевания. В пользу генетической обусловленности атеросклеротических изменений свидетельствуют и данные 113 литературы (the Framingham study, 1987). Цитологический анализ мазка крови позволяет предположить наличие воспалительного процесса, что характерно для атерогенеза (Нагорнев В.А. с соавт., 2000; Алекперов Э.З., Наджафов Р.Н., 2010; Willerson J.T., Ridker R.M., 2004; Ridker P.M., 2007) и косвенно свидетельствуют об активации клеточного иммунитета. Дефицит эозинофилов у этой группы животных может быть обусловлен усиленной миграцией клеток в ткани, что приводит к недостатку антимедиаторов воспаления в крови и влечет за собой дефицит дезинтоксикационного компонента в спектре медиаторов. Умеренная степень гипергомоцистеинемии, воспроизведенная в нашем втором эксперименте, также сопровождается изменениями в лейкоцитарной формуле. Обращает на себя внимание снижение количества моноцитов крови (в 2,2 раза) и эозинофилов (в 1,4 раза) в сравнении с контролем. Незначительная эозинопения может быть обусловлена, в частности, стрессорной реакцией; моноцитопения - усиленной миграцией клеток из кровяного русла в ткани, а также, что более важно, расстройством регуляции лейкопоэза, который, в нашем случае, может быть обусловлен, например, дефицитом тиреоидных гормонов. Scherer E.B. et al. (2012), исследуя влияние умеренной гипергомоцистеинемии на эктонуклеотидазы в лимфоцитах, установили, что ГГЦ уменьшает активность исследуемых ферментов в лимфоузлах, что может привести к развитию провоспалительного статуса. Известно, что основной мишенью гомоцистеина является эндотелий сосудов (Eberhardt R.T. et al., 2000; Lentz S.R. et al., 2000; Dayal S.et al., 2001; Weiss N. et al., 2001; Dayal S. et al., 2002; Faraci F.M., 2003;). С этих позиций данные, имеющиеся в литературе о гемопоэзрегулирующем влиянии эндотелиоцитов (Юшков Б.Г. с соавт., 2004.) могут объяснить изменения клеточного состава крови при гипергомоцистеинемии. Так, показано, что эндотелиоциты выполняют опорную, трофическую функции и участвуют в образовании гемопоэтических островков (Гольдберг Е.Д. с соавт., 1999). Таким образом, прямое цитотоксическое действие гомоцистеина на эндотелиальную выстилку сосудов, опосредованно оказывает влияние на кроветворение. 114 Данные морфометрии органных структур показали, что изменения в щитовидной железе носят мозаичный характер, наибольшую функциональную активность проявляют фолликулы малых размеров центральных участков органа. На фоне атеросклеротического процесса в щитовидной железе происходят изменения на клеточном и тканевом уровнях, а именно, увеличение процентной доли крупных фолликулов практически в 2 раза по сравнению с контрольной группой. При этом количество малых фолликулов уменьшается в 1,4 раза. Крупные и средние аденомеры выстланы преимущественно кубическим и плоским эпителием, только в малых фолликулах встречаются призматические тироциты. За счет уменьшения высоты тиреоидного эпителия (в 1,5 раза по сравнению с контрольной группой) уменьшается и его процентная доля в соотношении тканевых компонентов щитовидной железы. В то же время нарастает площадь стромального компонента, так как в ЩЖ наблюдается отек соединительно-тканной стромы органа, набухание коллагеновых и эластических волокон. За счет того, что крупных фолликулов в ЩЖ становится больше, средний диаметр их возрастает, увеличивается и процентная доля, приходящаяся на коллоид. Таким образом, за счет перекалибровки фолликулов в экспериментальной группе отмечается изменение соотношения фолликулов разного диаметра по всей площади органа. Так, в контрольной группе соотношение малые:средние:крупные фолликулы составляет 3:2:1, а при гиперхолестеринемии – 1:1:1. По данным литературы (Глумова В.А. с соавт., 1993; Муравьев О.Б., 1994; Вылегжанина Т.А. с соавт., 1996; Юминова Н.А., 1996; Clark O.H., 1990; Hall R., 1992; Cabanillas A.M. et al., 1994) подобные тканевые преобразования в ЩЖ свидетельствуют о гипофункциональном состоянии органа. В срезах органа сосуды расширены, за счет гиперплазии мышечного и адвентициального слоев, однако при этом интима истончена. В просвете артерий определяются форменные элементы крови, которые имеют тенденцию к агрегации на внутренней стенке сосудов. Местами выявлен выход клеток крови в межклеточное дополняются вещество щитовидной морфологическим железы. исследованием 115 Вышеуказанные срезов ЩЖ, изменения окрашенных гематоксилин-эозином, где в просвете фолликулов выявляются десквамированные клетки. Только в малых аденомерах обнаруживаются отдельные пролиферирующие тироциты. Именно в таких фолликулах отмечена краевая вакуолизация коллоида, что свидетельствует о проявлении эндоцитоза, расщеплении тироглобулина и секреции Т3 и Т4. Снижение функциональной активности ЩЖ подтверждается изменениями на клеточном уровне. Так, по мнению ряда авторов (Хмельницкий О.К., Третьякова М.С., 1997; Боташева В.С., 2000; Черенков И.А., 2001) при гипотиреозе наблюдается уменьшение диаметра ядер тироцитов, концентрация РНК в цитоплазме клеток снижается, микроворсинки апикальной части клеток сглажены, что выявлено и при нашей модели исследования. Помимо этого, в подтверждение вышеуказанных гипофункционального преимущественно в изменений, наблюдаются состояния, как: реакция апикальной части клеток, на такие кислую снижение признаки фосфатазу концентрации тиреоглобулина в просвете фолликулов (слабоположительная ШИК-реакция), ядрышковый аппарат представлен преимущественно кольцевидными и микроядрышками (т.е. с пониженной функциональной активностью). При гипергомоцистеиновой модели атерогенеза нами были выявлены изменения, сходные с преобразованиями при экспериментальной дислипидемии. В щитовидной железе происходят изменения, характерные для гипотиреоза. Так, увеличивается процентная доля крупных фолликулов, несмотря на то, что в целом средний диаметр фолликулов уменьшается. В связи с этим при оценке соотношения тканевых компонентов нарастает процентная доля, приходящаяся на коллоид. Коллоид гомогенный компактный, без признаков краевой вакуолизации. Также о напряжении вывода гормонов в кровоток свидетельствуют десквамированные клетки, обнаруживаемые в просвете фолликулов. За счет отека межклеточного вещества органа, разволокнения и набухания коллагеновых и эластических волокон, нарастает процентная доля стромального компонента. Уменьшается процент фолликулярного эпителия, за счет того что высота тироцитов уменьшается и клетки приобретают кубическую и плоскую формы. В 116 пользу снижения синтетических процессов, происходящих в клетке, говорит уменьшение размеров ядер, представительство ядрышкового аппарата преимущественно ядрышками кольцевидного типа и микроядрышками. При проведении реакции по Браше установлена сниженная, по сравнению с контролем, концентрация РНК в цитоплазме тироцитов. Сравнение данного показателя в двух экспериментальных группах показало, что количество РНК ниже в цитоплазме тироцитов группы с гиперхолестеринемией. Следовательно, ядерный этап биосинтеза белка идет активнее при гипергомоцистеиновой модели атерогенеза. Однако, благодаря ШИК-реакции, установлено, что концентрация гликопротеида в просвете фолликула при гипергомоцистеиновой модели ниже, чем при гиперхолестериновой. Данное противоречие может быть обусловлено тем, что при ГГЦ нарушается цитоплазматический этап биосинтеза белка, а именно конформационные преобразования в эндоплазматическом ретикулуме. В работе Меситова М.В. (2012) показана способность гомоцистеина вызывать стресс ЭПР в клетках различного тканевого происхождения, что подтверждается результатами нашей работы. Длительный стресс ЭПР при воспалении приводит к дисфункции клеток и апоптозу, что способствует прогрессированию атеросклеротических изменений (Zhang S.Y. et al., 2013). Популяция мастоцитов при экспериментальной гипергомоцистеинемии реагирует более активно, чем в первой экспериментальной группе. Так, количество мастоцитов, приходящихся на одно поле зрения, увеличивается более чем в 2 раза. Повышаются индексы секреторной активности тучных клеток, отражающие как апокриновый, так и мерокриновый типы секреции. При этом, индекс насыщения гепарином значительно снижается. Известно, что гомоцистеин, накапливающийся в крови, повреждающее действует на эндотелий сосудов, способствует его слущиванию (Скворцов Ю.И., Королькова А.С., 2011). Избыток его подвергается аутоокислению, что вызывает развитие оксидативного стресса и активизацию кальциевых каналов в ТК, являясь стимулом к их дегрануляции и выбросу содержимого во внешнюю среду (Болдырев А.А. с соавт., 2006). Можно предположить, что накопление биологически активных 117 веществ во внеклеточном пространстве усиливает цитотоксическое действие самого гомоцистеина. Таким образом, из полученных данных можно сделать вывод, что морфофункциональные изменения в щитовидной железе при разных моделях атерогенеза носят однонаправленный характер. Однако, гипо- и атрофические изменения при гипергомоцистеиновой модели атерогенеза выражены в большей степени. Это может быть связано с разнонаправленным и множественным токсическим действием гомоцистеина на клеточные популяции различного генеза (эпителиоциты, эндотелиоциты, тучные клетки). Основные патогенетические звенья двух моделей атерогенеза представлены на рисунке «Возможные пути реализации атерогенеза при гиперхолестеринемии и гипергомоцистеинемии». Гипергомоцистеине мия Гиперхолестеринемия Дислипопротеинемия Окислительный стресс Клетки иммунной системы: ТК, Лф Стресс ЭПР Тироциты Прямое цитотоксическое действие Эндотелиоциты Атерогенез Гипофункция ЩЖ Рисунок. Возможные пути реализации атерогенеза гипергомоцистеинемии. 118 при гиперхолестеринемии и Как видно из схемы, при гипергомоцистеиновой модели атерогенеза больше триггерных факторов, которые вызывают как непосредственно гипофункцию ЩЖ (через цитотоксическое действие гомоцистеина на тироциты и эндотелиоциты, окислительный стресс), так и опосредованно (через атеросклеротические изменения сосудов). Имеет место взаимное усугубляющее действие патологических процессов. Так, с одной стороны, гипофункция ЩЖ способствует развитию атеросклероза, а с другой – атеросклеротические преобразования приводят к развитию гипотиреоза, о чем свидетельствуют характерные структурные и функциональные изменения. Щитовидная железа имеет богато развернутую лимфатическую систему. Внутриорганная часть лимфатической системы представлена объемным сплетением лимфатических капилляров, внутриорганных лимфатических сосудов и небольших лакунообразных полостей. Лимфатические капилляры пронизывают все соединительнотканные прослойки органа. По состоянию регионарных (в данном случае - паратрахеальных) лимфоузлов, архитектонике гистологических зон, их клеточному составу, а также по характеристике тучноклеточной популяции в ЛУ можно оценить напряженность иммунных процессов (Черешнев В.А., Шмагель К.В., 2013; Suzuki A. et al., 2005; Kovanen P.T., 2009; Smith D.D. et al., 2012). Увеличение в ПТЛУ (при избыточном введении холестерина) объема, занимаемого корковым веществом и паракортикальной зоной, свидетельствует о напряженности как В-, так и Т-клеточного иммунитета. Объем мозгового вещества в ПТЛУ при ГХ заметно снижается, хотя в отдельных случаях мозговое вещество раздвигает корковое и узкими участками проникает в периферические отделы узла, вплоть до капсулы (вариант нормы более характерный для активных брыжеечных ЛУ, чем для глубоких шейных (Бородин Ю.И. с соавт., 1968). Гистологическая картина лимфатического узла при холестеринозе соответствует картине реактивного ЛУ. В пользу этого говорит отечность капсулы ЛУ, расширенный субкапсулярный синус, обильная его клеточная инфильтрация, увеличенное число иммунобластов, плазмоцитов и макрофагов в коре, повышенное количество митотических элементов. Однако, одновременно 119 возрастает и число апоптотических телец, что вызвано активизацией процессов гибели клеток. Наличие в лимфоузлах фолликулов без центра размножения (аттенуированные фолликулы), часто встречающихся в ослабленном организме, считается морфологическим проявлением сниженной иммунной защиты (Белянин В.Л. с соавт., 1999). Кровоснабжение лимфатического узла затруднено за счет стаза в просвете крупных и мелких сосудов. Расширение сосудов и явления гемостаза могут быть как следствием воспалительной реакции, так и атеросклеротического процесса; возможно, эти процессы сопутствуют и взаимно усугубляют друг друга, тем более что основной теорией атерогенеза на сегодняшний момент является иммуновоспалительная (Нагорнев, В.А. с соавт., 2000; Алекперов Э.З., Наджафов Р.Н., 2010; Neurauter G. et al., 2003; Boyle J.J., 2005; Cullen P. et al., 2005; Galkina E., Ley K., 2009). Известно, гемопоэтическая что и важнейшими функциями иммуннопоэтическая, но ЛУ и являются функция не только обеспечения рециркулирующего пула лимфоцитов, которая обеспечивается прохождением их через высокоэндотелиальные венулы (ВЭВ). Высокий эндотелий посткапиллярных венул является особым типом специализированного эндотелия, обеспечивающего проникновение в лимфоидные органы рециркулирующих и мигрирующих Т- и В-лимфоцитов (Сапин М.Р., Буланова Г.В., 1981; Бобрик И.И., 1988; Березовская С.Э., 1990; Марченко Я.В., 2009). Гистохимически высокие эндотелиоциты отличаются от других эндотелиоцитов высоким содержанием неспецифических эстераз и РНК (Anderson N. et al., 1976), наличием гепарансульфата, облегчающего хоминг лимфоцитов (Tsuboi K. et al., 2013), что позволяет дифференцировано их окрашивать. В ПТЛУ животных, находящихся на атерогенной диете, активно представлено ШИК-позитивное окрашивание венул с высоким эндотелием, в просвете которых содержится много малых лимфоцитов, что свидетельствует об активности их рециркуляции. Последнее способствует установлению межклеточных взаимодействий, необходимых для развития и регуляции иммунного ответа (Girard J.P. et al., 2012). Расширенные 120 венулы с высоким эндотелием отмечены в лимфоузлах при неонкологической патологии ЩЖ (Estevez S., Bosisio F.M., 2013). Данные сканирующей электронной микроскопии лимфоузлов животных, находящихся на атерогенном рационе, показали увеличение лимфоцитов с относительно гладкой поверхностью, округлой формы, ламеллярных лимфоцитов с пластинчатыми формами. Такой формы лимфоциты, согласно классификации (Козинец Г.И., 2004) относят к категории Т-лифоцитов, следовательно, стимулируется звено клеточного иммунитета. Особенности состава популяций лимфоцитов в крови и лимфоузлах сообщаются в исследованиях Uchiyama R. et al. (2012) и Backteman K. et al. (2012). Особую роль в процессе атерогенеза играют тучные клетки. Гранулы ТК могут переносить ЛПНП в макрофаги и гладкомышечные клетки синтетического типа, вызывая их трансформацию в пенистые клетки (Кондашевская М.В., 2010; Sun J. et al., 2007). В экспериментах показана зависимость между количеством ТК в стенке аорты и степенью выраженности атеросклероза (Жданов В.С. с соавт., 2002, Кондашевская М.В., 2010; Shi G.P., Lindholt J.S., 2013). В наших экспериментах у животных, находящихся на атерогенной диете, количество ТК, приходящихся на одно поле зрения, снижается по сравнению с интактными животными, как в ЩЖ, так и в паратрахеальных ЛУ. Однако при этом выявляются очаговые скопления мастоцитов в синусах ПТЛУ. Увеличение объема коркового вещества и паракортикальной зоны может быть признаком активации гуморального и клеточного иммунитета, в то же время, количество активно пролиферирующих герминативных центров (при реакции Ki-67) даже несколько ниже контрольных значений, большее количество герминативных центров – это затухающие, вторичные узелки. В целом это свидетельствует о сниженной пролиферативной активности, но при этом усиливается процесс рециркуляции стимулированных лейкоцитов через ВЭВ. Возможно, сочетание атерогенного рациона, социального и полового стрессов, ограниченного двигательного режима, приводит к изменениям ЩЖ, перестройке гормонального статуса, активации иммунных процессов, что 121 отражается на дренирующих этот орган паратрахеальных лимфоузлах и впоследствии влечет за собой резкое их истощение. Скопление мастоцитов исключительно в синусах ЛУ может свидетельствовать об активации ТК на содержащийся в лимфе антиген. На АГ-зависимый процесс также указывает выявленная при холестериновой нагрузке эозинофильная инфильтрация синусов. Эти данные свидетельствуют в пользу теории аутоиммунного воспаления, участие которого в патогенезе атеросклероза отмечалось многими авторами (Нагорнев В.А. с соавт.,2000; Нагорнев В. А. с соавт., 2003; Hansson G. K., 2001). Подобную морфологическую картину лимфоузлов можно объяснить несколькими механизмами: нарастающая деструкция клеток, миграции лимфоцитов из органов иммуногенеза, уменьшение пролиферативной активности лимфоцитов, угнетение лимфоцитарного ростка в костном мозге. Гомоцистеин, являясь независимым фактором развития атеросклероза, вызывает в организме ряд биохимических и цитологических изменений, приводящих к нарушению системы иммунно-эндокринного гомеостаза. На морфологическом уровне эти изменения проявляются как в ЩЖ, так и в окружающих ее регионарных лимфоузлах. Они характеризуются своеобразием, отличаются как от контроля, так и от изменений, вызванных введением холестерина. Обращают на себя внимание выраженные различия в реакции лимфоузлов у одного и того же животного (при формировании гипрехолестеринемиии во всех группах ЛУ, как в более крупном, так и в ПТЛУ меньшего размера, изменения носят однонаправленный характер). Так, чаще всего в крупном лимфоузле (в отличие от небольших ЛУ) архитектоника зон (преобладание коркового вещества), клеточная характеристика свидетельствуют в пользу более выраженной стимуляции В-клеточного, гуморального звена иммунитета: развитие фолликулов, имеющих светлый центр (увеличено количество центробластов, иммунобластов), активная реакция мозгового вещества (высокая плотность клеток в мозговых тяжах, увеличение числа макрофагов, митотических элементов, как мозговых тяжах, так и в синусах). Роль макрофагов различного типа в модуляции эффектов атеросклероза и его 122 осложнений считается доказанной (De Paoli F. et al., 2014) и, как показано в последнее время, это может быть связано с недостаточно активным выведением холестерина из бляшек через лимфатческую сеть (Martel C., Randolf G.J., 2013). На факт активной стимуляции гуморального звена иммунной системы указывает также развитие фолликулов на границе паракортикальной и мозговой зоны, а также в самом мозговом веществе. На развитие лимфоидных фолликулов в мозговом веществе (а также за его пределами) при фитостимуляции указывают Горчакова О.В. и Горчаков Н.В. (2013), рассматривая этот процесс как компенсаторную реакцию на изменившиеся условия в результате фитотерапии. Часть лимфоузлов (обычно меньшего размера) при гипергомоцистеинемии меняют морфотип с компактного характерного для контрольных животных на фрагментированный, в котором преобладающей является мозговая зона с расширенными мозговыми синусами. Согласно функциональной классификации лимфоузлов (Бородин Ю.И. с соавт., 1992) подобная реакция вызывается условиями, способствующими активной дренажной функции. Смена морфологического типа лимфоузла была отмечена в ряде работ, в т.ч. в регионарных узлах ЩЖ при фитореабилитации (Горчакова О.В., 2010). Можно предположить, что ряд лимфоузлов берет на себя преимущественно лимфоидную функцию и отвечает реактивной перестройкой в ответ на активную антигенную стимуляцию организма, тогда как другие лимфоузлы выполняют преимущественно лимфодренажную функцию. Несмотря на то, что последний морфологический вариант лимфоузлов – это ЛУ меньшего размера, однако они обычно располагаются вблизи ЩЖ в большом количестве. Martel C. et al. (2013), исследуя обратный транспорт холестерина у мышей, показывают, что именно поддержка транспортной функции может обеспечить предотвращение атеросклероза. Необходимо отметить, что сканирующая электронная микроскопия выявляет в синусах мозгового вещества лимфоузла лимфоциты с большим количеством различных по длине нитевидных отростков, с пузырями, имеющими на своей поверхности сферической формы выпячивания и т.п. Подобные формы клеток 123 относят к В-лимфоцитам (Козинец Г.И., 2004), они также встречаются при первой модели атерогенеза, но микрорельеф поверхности характеризуется своеобразием и отличается от того, что наблюдался при гиперхолестеринемии. Гомоцистеин, обладая эндотелий-повреждающим действием, приводит к изменениям сосудистого компонента лимфоузлов, свидетельствующих об активной реакции микрососудистого русла (набухание эндотелия, адгезия клеточных элементов к сосудистой стенке, сладжирование эритроцитов, в ряде случаев – накопление распадающихся детритных масс, краевой вакуолихзации). Изменяется и стенка венул с высоким эндотелием, нарушение межклеточных соединений (действие гомоцистеина) в стенке которых приводит, по всей видимости, к изменению процессов транспорта и рециркуляции лимфоцитов (обильное представительство клеток как внутри венул, так и непосредственно осуществляющих прохождение через стенку, адгезия с внутренней и наружной стороны ВЭВ). С современных позиций совокупность тучных клеток в тканях – это целостная система, чутко реагирующая на различные экстремальные воздействия (Арташян О.С., 2006), перераспределение которых является тканеспецифическим и рассматривается как проявление адаптационного синдрома. Тучноклеточная популяция в ПТЛУ при гомоцистеиновом воздействии представлена в основном клетками, располагающимися в капсуле, с меньшим представительством в других отделах лимфатического узла. Реакция мастоцитов проявляется в виде дегрануляции в различных вариантах, снижении количества клеток, заполненных гранулами биологически активных веществ. В ряде случаев капсула ЛУ бывает настолько заполнена гранулами, что выглядит инфильтрированной. Усиленная дегрануляция является показателем повышенной функциональной активности тучных клеток и наблюдается при действии многих факторов физической, химической, биологической природы, при антигенных воздействиях (Арташян О.С., 2006; Кондашевская М.В., 2010). Кроме того, биологически активные вещества, выделяемые из гранул ТК, принимают участие в регуляции гидрофильности тканей, синтезе и 124 секреции гликозаминогликанов, непосредственно предназначенных для построения внеклеточных структур соединительной ткани и т.п. Таким образом, формирование модели атерогенеза, обусловленное введением гомоцистеина в целом сопровождается угнетением функциональной активности щитовидной разнонаправленными железы, изменениями более в выраженными ПТЛУ, и ранними свидетельствующими и об активизации иммунного ответа и усилении лимфодренажной функции в регионарных ЛУ. 125 ВЫВОДЫ 1. Морфофункциональные изменения щитовидной железы при гиперхолестериновой и гипергомоцистеиновой моделях атерогенеза носят однонаправленный характер. В ЩЖ происходят гипо- и атрофические изменения, свидетельствующие о гипофункциональном состоянии органа. Данные изменения происходят на всех уровнях организации: органном, тканевом, клеточном и субклеточном. 2. Структурно-функциональные перестройки, характерные для гипотиреоза, значительно более выражены при гипергомоцистеиновой экспериментальной модели атерогенеза. Данное явление обусловлено большим количеством триггерных факторов, действующих при гипеогомоцистеинемии. А именно, – непосредственное цитотоксическое действие на тироциты, тучные клетки и эндотелиоциты; способность гомоцистеина провоцировать стресс ЭПР; гомоцистеин-индуцированный окислительный стресс. 3. Морфофункциональные изменения в регионарных лимфоузлах при гиперхолестеринемии свидетельствует о более выраженной локальной активации клеточного звена иммунитета, при гипергомоцистеинемии – гуморального. Степень и разнообразие структурных и цитологических преобразований в лимфоузлах, характеризующих напряженность иммунных процессов, выше при гипергомоцистеинемии. 4. Структурно-функциональные зоны и при регионарных лимфатических узлов (реактивный лимфоузел), тогда разнонаправлена: один из узлов как цитологическая характеристика гиперхолестеринемии при испытывает однотипна гипергомоцистеинемиии реактивные перестройки, характеризующиеся как фолликулярная гиперплазия, другие характеризуются преобладанием мозгового вещества и сменой морфотипа лимфатического узла с компактного на фрагментированный. 5. Атерогенез, независимо от типа инициирующего фактора (гиперхолестеринемия, гипергомоцистеинемия), сопровождается снижением функциональной активности щитовидной железы и одновременной 126 гиперфункцией окружающих лимфатических узлов, что может быть обусловлено развитием адаптационнокомпенсаторных процессов, направленных на сохранение местного гомеостаза и стабилизацию функционального состояния щитовидной железы. ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ Результаты данной работы позволяют рекомендовать определение уровня гомоцистеина для широкого применения в клинической практике, что позволит выявить и в последующем скорректировать атерогенез на доклинических этапах развития патологического процесса, что может обеспечить раннее выявление атеросклероза и предотвращение осложнений. СПИСОК ПУБЛИКАЦИЙ ПО ТЕМЕ ИССЛЕДОВАНИЯ 1. Глумова, В.А. Морфофункциональная характеристика надпочечников крыс при экспериментальном атеросклерозе / В.А. Глумова, М.В. Чучкова // Морфология, 2008. - Т. 133, № 2. - С. 33. 2. Чучкова, Н.Н. Соотношение эндокринных и иммунных тканевых компонентов щитовидной железы при экспериментальном атеросклерозе / Н.Н. Чучкова, В.А. Глумова, М.В. Чучкова // Объединенный иммунологический форум Санкт-Петербург, 30 июня-5 июля 2008. - Российский иммунологический журнал, 2008. - Т. 2(11), №2-3. - С. 325. 3. Чучкова, М.В. Постнатальный гистогенез некоторых органов эндокринной системы в норме и эксперименте / М.В. Чучкова, В.А. Глумова // Вестник Уральской медицинской академической науки, 2008. - №1(19). - С. 73-74. 4. Глумова, В.А. Онтогенетическая динамика популяции тучных клеток щитовидной железы у человека в условиях экологического напряжения / В.А. Глумова, И.А.Черенков, Н.А. Юминова, М.В.Чучкова // Материалы докладов VI всероссийского съезда анатомов, гистологов и эмбриологов. Саратов, 29 сентября 2009 г. - Морфология, 2009. – Т. 136, №4. - С.152. 5. Глумова, В.А. Морфофункциональные изменения щитовидной железы крыс при экспериментальном атеросклерозе / В.А. Глумова, М.В. Чучкова, Н.В. 127 Кормилина // Актуальные проблемы эндокринологии. - Ижевск, 2009. - С. 117118. 6. Чучкова, М.В. Особенности возрастных морфофункциональных изменений щитовидной железы в норме и эксперименте // Современные аспекты медицины и биологии. Материалы X межвузовской научной конференции молодых ученых и студентов 26-29 апреля 2010 года. – Ижевск, 2010. – С. 5-6. 7. Чучкова, Н.Н. Морфологические критерии активности иммуномодуляторов с различным механизмом действия (экспериментальное исследование) / Н.Н. Чучкова, Н.В. Кормилина, В.А. Глумова, М.В. Чучкова // Материалы докладов III эмбриологического симпозиума всероссийского научного общества анатомов, гистологов, эмбриологов «Югра-эмбрио-2011». «Закономерности эмбриофетальных морфогенезов у человека и позвоночных», г. Ханты-Мансийск, 5-6 октября 2011. - Морфология, 2011. - №5. - C. 126-127. 8. Чучкова, Н.Н. Морфологическая характеристика функциональной реорганизации тиреоидных комплексов при экспериментальной дислипидемии / Н.Н. Чучкова, В.А. Глумова, Н.В. Кормилина, М.В. Чучкова // Вестник Удмуртского университета, 2011. - №3. – C. 151-153. 9. Чучкова, Н.Н. Морфофункциональный статус тучноклеточных популяций периферических органов иммунной системы крыс / Н.Н. Чучкова, Н.В. Кормилина, В.А. Глумова, М.В. Чучкова // Труды Ижевской государственной медицинской академии. Сборник научных статей. - Ижевск, 2011. - Т.49. - C. 3334. 10. Чучкова, Н.Н. Особенности реактивных изменений лимфоузлов различной локализации под влиянием иммуномодуляторов направленного действия / Н.Н. Чучкова, Н.В. Кормилина, Э.Ш. Гайсина, М.А. Овчинников, М.В. Чучкова // Вестник уральской медицинской академической науки. Тематический выпуск по аллергологии и иммунологии, 2011. - №2/2 (35). - C.75-76. 11. Сметанина, М.В. Морфометрическая характеристика ядер тироцитов при экспериментальной гипергомоцистеинемии 128 // Современные аспекты медицины и биологии. Материалы XII межвузовской научной конференции молодых ученых и студентов 23-26 апреля 2012 года. – Ижевск, 2012. – С. 7-8. 12. Сметанина, М.В. Структурные особенности внутриорганной сосудистой системы щитовидной железы крыс в норме и эксперименте // 4-я всероссийская научная конференция с международным участием «Микроциркуляция в клинической практике», 19-20 апреля 2012. Москва. - Ангиология и сосудистая хирургия, 2012. - т.18. - C. 28. 13. Чучкова, Н.Н. Дислипопротеинемия приводит к снижению функциональной активности AgNOR’s лимфоцитов крови / Н.Н. Чучкова, Н.В. Кормилина, М.В. Сметанина, П.В. Смирнов // X конференция иммунологов Урала. Вестник Уральской академической науки. Тюмень, 2012. - №4 (41). - C. 248-249. 14. Чучкова, Н.Н. Клеточный гомеостаз и процессы дегрануляции тучных клеток в условиях атерогенной дислипидемии и иммуномодуляции / Н.Н. Чучкова, Н.В. конференция Кормилина, «Актуальные М.В. Сметанина проблемы // Всероссийская адаптогенеза и научная репаративных гистогенезов», посвященная памяти Ф.М. Лазаренко 19-20 ноября 2013. Оренбург. - «Морфология», 2013. - Т. 144, №5. - С. 131. 15. Сметанина, М.В. Транскрипционная активность рибосомальных генов фолликулярных клеток щитовидной железы в норме и при иммуномодуляции // Российская академия медицинских наук. Международная ассоциация морфологов. Архив анатомии, гистологии и эмбриологии. – Морфология, 2013. Т. 144, 5. - С.114. 16. Чучкова, Н.Н. Влияние длительности введения иммуномодуляторов на интегральные индексы лейкограммы (экспериментальные аспекты) / Н.Н. Чучкова, Н.В. Кормилина., М.В. Сметанина, М.А. Овчинников // Наука, образование, общество: проблемы и перспективы развития. Сборник научных трудов по материалам Международной конференции 29 марта 2013. - Тамбов, 2013. - № 6. - С. 140-141. 129 17. Чучкова, Н.Н. Иммунноэндокринные взаимодействия в условиях формирования гомоцистеиновой модели атеросклероза / Н.Н. Чучкова, В.А. Глумова, М.В. Сметанина, Н.В. Кормилина // Объединенный иммунологический форум. Нижний Новгород 30 июня- 5 июля 2013. - Российский иммунологический журнал, 2013. - Т.7 (16), №2-3. - С. 301. 18. Чучкова, Н.Н. Нуклеологенез моноцитов крови при моделировании долипидной стадии атеросклероза / Н.Н. Чучкова, Н.В. Кормилина, М.В. Сметанина, М.А. Овчинников // Сборник материалов «Проблемы современной морфологии человека». Материалы международной научно-практической конференции, посвященной 80-летию профессора Б.А. Никитюка, 25-27 сентября 2013. - Москва, 2013. - С. 67-69. 19. Сметанина, М.В. Морфофункциональная характеристика щитовидной железы при экспериментальной гипергомоцистеинемии // Современные аспекты медицины и биологии. Материалы XIII научно-практической конференции молодых ученых и студентов с международным участием 22-25апреля 2013 года. Ижевск, 2013 - С. 15-16. 20. Сметанина, М.В. Характеристика лаброцитов щитовидной железы при различных моделях атергенеза // Современные аспекты медицины и биологии Материалы XIV межвузовской научно-практической конференции молодых ученых и студентов 21-24 апреля 2014. – Ижевск, 2014. – С. 20-21. 21. Сметанина, железы при М.В. различных Морфометрическая моделях характеристика атеросклероза/М.В. Морфологические ведомости, 2014. - №1. – С. 106-111. 130 щитовидной Сметанина// СПИСОК ЛИТЕРАТУРЫ 1. Автандилов, Г.Г. Проблемы патогенеза и патологоанатомической диагностики болезней в аспектах морфометрии. – М.: Медицина, 1984. – 288 с. 2. Автандилов, Г.Г. Медицинская морфометрия: Руководство. – М.: Медицина, 1990. – 384 с. 3. Аксенова, Н.П. К характеристике В-клеток щитовидной железы человека в постнатальном онтогенезе. // Морф. сб. ст. мед. ВУЗов России «Актуальные вопросы медицинской морфологии». – Ижевск, 1993. – Вып.2, часть 1. – С. 25-29. 4. Аксенова, Н.П. К характеристике В-клеток щитовидной железы. // Сб. ст. мед. ВУЗов «Актуальные вопросы фундаментальной и прикладной медицинской морфологии». – Смоленск, 1994. – С. 8. 5. Алекперов, Э.З. Современные концепции о роли воспаления при атеросклерозе / Э.З. Алекперов, Р.Н. Наджафов // Кардиология. – 2010 - №6. – С. 88-91. 6. Алешин Б.В., Губский В.И. Гипоталамус и щитовидная железа. – М.: Медицина, 1983. – 184 с. 7. Алешин, Б.В. О некоторых противоречиях в современных теориях эндокринологии. //Пробл. эндокринол. – 1988. – т.34, №3. – С. 14-23. 8. Алешин, Б.В. Проблемы нейроэндокринных клеток и гипотезы диффузной нейроэндокринной системы // Усп. совр. биол. 1984. – т.98, №1 (4). – С. 116-133. 9. Алтаева, А.А. Мутагенная активность акриламида в клетках ЩЖ крыс в условиях подострого эксперимента / А.А. Алтаева, Л.П.Сычева, Н.Н. Беляева // Бюлл. эксп. биол. и мед. – 2011. – С. 238-239. 10. Анашкина, Е.Н. Гистофизиология популяций тканевых базофилов щитовидной и околощитовидных желез крыс: Автореф. дисс. канд. мед. наук: (03.00.13): Ярославль, 2001.- 21 с. 131 11. Андроник, В.И. Качественно-количественная характеристика структуры тиреоцитов (при экспериментальной гипер- и гипофункции) / В.И. Андроник, Б.Е. Мельник // Кишинев: Штиинца, 1986, 113 с. 12. Арзуманян, Е.С. Карнозин защищает эитроциты от окислительного стресса, вызываемого гомоцистеиновой кислотой / Е.С. Арзуманян, А.А. Болдырев, А.В. Махро, О.В. Тюлина // Бюлл. экспер. биол. и мед. 2008 – Т.418, №6. С. 1-3. 13. Аронов, Д.М. Атеросклероз и коронарная болезнь сердца / Д.М. Аронов, В.П. Лупанов. – М.: «Триада-Х», 2009. – 248 с. 14. Арташян, О.С. Система тучных клеток при действии на организм экстремальных факторов: Дисс. канд. биол. наук (03.00.13) – Екатеринбург, 2006 – 190 с. 15. Асфандияров, Р.И. Варианты формы щитовидной железы по данным регрессионного анализа / Р. И. Асфандияров, Л. А. Удочкина, И. Ю. Квитковская // Морфология. 2004. - Т. 126, № 4. С. 11-12. 16. Аутоиммунные реакции в патогенезе атеросклероза / А.А. Санникова, И.В. Меньшиков, Л.В. Бедулева и др. // Иммунология. – 2010. - №5. – С.242-246. 17. Балаболкин, М.И. Эндокринология: Учебное пособие. – М.: Медицина, 1989. – 416 с. 18. Белянин, В.Л. Диагностика реактивных гиперплазий лимфатических узлов / В.Л. Белянин, Д.Э. Цыплаков // СПб; Казань. – 1999. – 289 с. 19. Березин, В.А. Тиреоглобулин / В.А.Березин, Л.В. Гербильский, И.Н. Корниловская //Пробл. эндокр., 1993, №4, C. 89-95. 20. Березовская, С.Э. Структурная организация большого сальника как иммунокомпетентного органа: Дисс. канд. мед. наук (14.00.02). – Ярославль, 1990. – 153 с. 21. Бирюкова, О.В. Индивидуально-типологические особенности строения лимфатического узла в зависимости от работоспособности и функционального резерва / О.В. Бирюкова, В.Е. Савельев // Морфология. – 2000. - №5. – С. 40-42. 132 22. Бобрик, И.И. Развитие посткапиллярных венул с высоким эндотелием в органах иммунной системы плодов человека // Морфология и развитие органов иммунной системы. – Москва-Пермь, 1988. – С.9. 23. Болдырев, А.А. Влияние гомоцстеина и гомоцистеиновой кислоты на гранулярные клетки мозжечка/А.А. Болдырев, Е.Р. Булыгина, Махро А.В. // Нейрохимия. – 2006. - №3. – С. 179-184. 24. Болдырев, А.А. NMDA-рецепторы в клетках иммунной системы / А.А. Болдырев, Е.А. Брюшкова, Е.А. Владыченская // Биохимия. – 2012. - №77. – С. 128-134. 25. Боровиков, В.П. Искусство STATISTICA. анализа данных на компьютере: для профессионалов. 2-е изд. / В.П. Боровиков – СПб.: Питер, 2003. – 688 с. 26. Бородин, Ю.И. Анатомо-экспериментальное исследование лимфатических путей и вен в нормальных условиях гемодинамики и при венозном застое: Автореф. дисс. докт. мед. наук. Новосибирск, 1969. – 40 с. 27. Бородин, Ю.И. Вопросы экспериментальной морфологии лимфатической системы и соединительнотканного каркаса/ Ю.И. Бородин, Г.П. Кузина, П.М. Трясучев // Новосибирск: Наука. Сиб. отд-ние, 1968. С. 79-84. 28. Бородин, Ю.И. Лимфология в междисциплинарном аспекте // Лимфология. Журнал имени С.У. Джумабаева. Узбекистан, 2009. №1-2. – С. 219220. 29. Бородин Ю.И., Сапин М.Р., Этинген Л.Е. Функциональная анатомия лимфатического узла. – Новосибирск, 1992. – 150 с. 30. Боташева, В.С. Показатели активности ядрышкового организатора при патологии щитовидной железы. // Арх. патол., 2000, №1, т.62, С. 21-24. 31. Быков, В. Л. Гетерогенность и гетероморфия щитовидной железы / В.Л. Быков // Материалы VIII конгресса международной ассоциации; морфологов. Морфология.- 2004.-Т. 129.- № 4. -C. 27. 32. Быков, В.Л. Развитие и гетерогенность тучных клеток // Морфология. 2000; 117(2): С. 86-92. 133 33. Быков, В.Л. Секреторные механизмы и секреторные продукты тучных клеток / Морфология. 1999; 115(2): С. 64-72. 34. Быков, В.Л. Стереологический анализ щитовидной железы (обзор методов).// Арх. анат., гистол., эмбриол. – 1979. – т.77, вып.7. – C. 98-106. 35. Васильева, Е.В. Влияние прерывистой гипербарической гипоксии на морфофункциональные изменения щитовидной железы у крыс в норме и при экспериментальной дисфункции: автореф. дис … канд. биол. наук / Е.В. Васильева. – Ульяновск, 2009. – 19 с. 36. Верещагин, Н.В. Гетерогенность инсульта: взгляд с позиции клинициста. // Журн. неврологии и психиатрии им. С.С. Корсакова. – 2003. - №9. С. 8-9. 37. Виноградов, С.Ю. Нейромедиаторные биоамины щитовидной железы и структурно-функциональные аспекты ее гомеостаза / С.Ю. Виноградов, Ю.В. Погорелов // Арх. анат., гистол., эмбриол. – 1987. – т.92, №1. – C. 12-22. 38. Виноградов, С.Ю. Серотонин и его участие в регуляции функций щитовидной железы / С.Ю. Виноградов, Ю.В. Погорелов // Усп. совр. биол. – 1984. – т.98, вып.2(5) – C. 206-218. 39. Виноградов, С.Ю. Функциональная морфология внутриорганного нейромедиаторного биоаминового обеспечения адаптационно-компенсаторных реакций щитовидной железы: Автореф. дис. … докт. мед. наук. – Иваново, 1989. – 41 с. 40. Виноградов, С.Ю. Функциональная морфология нейромедиаторного биоаминового обеспечения щитовидной железы в условиях адаптации / С.Ю. Виноградов, Ю.В. Погорелов // Вестник Ивановской мед. академии. – 1997. – Т.2, №3. – С. 6-14. 41. Вылегжанина, Т.А. Реакция нервных структур щитовидной железы морских свинок на воздействие ионизирующей радиации / Т.А. Вылегжанина, О.А. Манеева, Е.Л. Рыжковская // Морфология. – 1996. – т.109, №1. – С. 18-20. 42. Гайворонский И.В., Ничипорук Г.И. «Функциональная анатомия эндокринной системы», ЭЛБИ-СПб, 2009, 56 с. 134 43. Гайдук, В.С. Становление сосудистого русла эндокринных желез в эмбриогенезе / В.С. Гайдук, А.А. Артишевский, И.А. Мельников, А.В. Елак, Т.М. Студеникина // Морфология– 2011. - С. 36. 44. Гайсина, аспекты Э.Ш. Клинико-иммунологические атеросклероза и и морфологические возможность включения глюкозаминилмурамилдипептида в комплексное лечение стабильной стенокардии у лиц пожилого возраста: Дисс. канд. мед. наук (14.01.05; 03.03.04) – Ижевск, 2011. – 208 с. 45. Гайсина, Э.Ш. Клинико-экспериментальная оценка влияния иммуномодулятора Ликопида на клетки иммунной системы и липидный обмен при атеросклерозе / Э.Ш. Гайсина, А.А. Санникова, Н.Н. Чучкова и др. // Актуальные вопросы фундаментальной и клинической иммунологии и аллергологии: материалы VI конференции иммунологов Урала. Ижевск, 28-31 октября 2007 г. – Ижевск, 2007. – С. 118-119. 46. Гербильский, Л.В. Внутриорганная интеграция щитовидной железы: Автореф. д-ра мед. наук. – Днепропетровск, 1987. – 42 с. 47. Гербильский, Л.В. Роль тканевых базофилов в регуляции функций щитовидной железы // Центральная регуляция вегетативных функций: Материалы 6 науч. конф. ЦНИЛ Тбилисского ГИУВ (1-4 июля 1984 г.). – Тбилисси: Изд. ГИУВ, 1984. – С. 113. 48. Гербильский, Л.В. Системообразующие элементы щитовидной железы // Морфология и магнитобиология: Межвуз. сб. – Чебоксары: Изд. чувашского унта, 1985. – С. 42-44. 49. Гланц, С. Медико-биологическая статистика / С. Гланц / Пер. с англ. – М. – Практика. – 1999. – 459 с. 50. Глумова, В. А. Морфогенетические процессы в постнатальном развитии щитовидной железы человека / В.А. Глумова, И.А. Черенков // Актуальные проблемы морфологии: сборник научных трудов. Красноярск, 2003. — С. 44-45. 135 51. Глумова, В.А. Возрастная характеристика компенсаторно- восстановительных процессов в некоторых органах при воздействии на регуляторные звенья / В.А. Глумова, С.Н. Рящиков, В.Н. Марков // Тез. докл. Всеросс. конф. «Влияние антропогенных факторов на морфогенез и структурные преобразования органов». – Астрахань, 1991. – C. 38-39. 52. Глумова, В.А. Щитовидная железа и механизмы ее регуляции / В.А. Глумова, С.Н. Рящиков, В.Н. Марков // Морф. сб. ст. мед. ВУЗов России « Актуальные вопросы медицинской морфологии». – Ижевск, 1993. – Вып. 2, часть 1. – C. 156-160. 53. Глумова, В.А. Структурные основы адаптации и компенсации нарушенных функций: Руководство/АМН СССР; Л.И. Аруин, А.Г. Бабаева, В.Б. Гельфанд и др.; Под ред. Д.С. Саркисова. – М.: Медицина, 1987. – 448 с. 54. Глумова, В.А. Щитовидная железа.// Структурные основы адаптации и компенсации нарушенных функций: Руководство./ Под ред. Д.С. Саркисова. – М.: Медицина, 1987. – C. 320-328. 55. Глумова, В. А. Эволюционные и онтогенетические особенности щитовидной железы позвоночных / В.А. Глумова, Н. Н. Чучкова, И. А. Черенков // Морфологические ведомости. 2005. - № 1-2. - С. 11-12. 56. Глумова, В.А., Чучкова Н.Н., Кормилина Н.В., Чучкова М.В. Морфологическая характеристика функциональной реорганизации тиреоидных комплексов при экспериментальной дислипидемии / В.А. Глумова, Н.Н. Чучкова, Н.В. Кормилина, М.В. Чучкова // Вестник Удмуртского университета, 2011. Вып. 3. C. 151-153. 57. Гольдберг Е.Д., Дыгай А.М., гемопоэзредуцирующегомикроокружения в Жданов регуляции В.В. кроветворения Роль при цитотоксических миелосупрессиях. Томск, 1999. 128 с. 58. Горбунова, М.П. Кальцитониноциты (С-клетки) щитовидной железы при старении. // Журн. общ. биол. – 1981. – т.42, №4. – C. 610-621. 136 59. Горчакова, О.В. Структурно-жидкостная характеристика лимфоузла в ранние возрастные периоды и в условиях озоно- и фитотерапии /О.В. Горчакова, Н.В. Горчаков // Фундаментальные исследования, 2013. - №6(3). – С. 591-595. 60. Горчакова, О.В. Функциональная морфология щитовидной железы и регионарного лимфатического узла при гипотиреозе в период восстановления и фитореабилитации (экспериментально-морфологическое исследование): Дисс. канд. мед. наук (03.03.04; 14.03.01) – Новосибирск, 2010. – 152 с. 61. Гусейнов Т.С. Анатомия лимфатического русла тонкой кишки при дегидротации и коррекции перфтораном / Т.С. Гусейнов, С.Т. Гусейнова // Медицинский вестник Северного Кавказа. – 2012. - №2. – С. 15-18. 62. Диагностика заболеваний щитовидной железы: атлас / И. И. Дедов и др. - М., 2001(6). 130 с. 63. Доценко, Э.А. Холестерин и липопротеины низкой плотности как эндогенные иммуномодуляторы / Э.А. Доценко, Г.И. Юпатов, А.А. Чиркин // Иммунопатология, аллергология, инфектология, 2001. - №3. – С. 6-15. 64. Држевецкая, И.А. Основы физиологии обмена веществ и эндокринной системы. – М.: Высш. школа ,1994, 256 с. 65. Ермолович, Н.А. Закономерности распределения артерий в щитовидной железе у человека// Тез. докладов 4 конгресса международной ассоциации морфологов, Морфология, 1998. - №3. - C. 46. 66. Забродин, В.А. Морфология щитовидной железы и методы ее изучения: Методические рекомендации: / Н. Ермакова; О.А. Васильева // Смоленск: изд-во; СЕМА, 2005: — 37 с. 67. Зуга, М.В. Тучные клетки и их значение в физиологии и патологии легких / М.В. Зуга, В.А. Невзорова // Тер. архив. – 1999. – №3. – С. 76-80. 68. Загуровский, В.М. К вопросам о клетках Ашкенази: Тез. докл. 10-го Всесоюз. съезда анат., гистол., эмбриол. – Винница: Полтава, 1986. – С. 128. 69. Изместьев, С.В. Иммунные механизмы компенсации гипегомоцистеинемии (клинико-экспеиментальное исследование): Автореф. дис. … канд. мед. наук (14.03.03). – Чита, 2013. – 13 с. 137 70. Изместьев, С.В. Исследование уровня аутоантител к модифицированному сывороточному альбумину и тромбину / С.В. Изместьев, Е.В. Фефелова, П.П. Терешков, А.А. Дутов, С.И. Михайличенко, Н.Н. Цыбиков // Забайкальский медицинский вестник, 2012. - №4. - С. 112-115. 71. Изучение роли популяции тучных клеток интимы аорты в развитии атеросклероза у человека / В.С. Жданов, И.П. Дропкова, Н.М. Черпаченко и др. // Кардиология. – 2002. – № 11. – С. 4-8. 72. Ильин, Д.А. Актуальные аспекты изучения тучных клеток in vitro / Д.А. Ильин // Сборник научных трудов «Современный мир, природа и человек» – Т.2 – №1. – Томск, 2011 – С. 74-77. 73. Ишунина, Т.А. Морфологические основы полового диморфизма ядер гипоталамуса человека (морфометрическое и иммуногистохимическое исследование): Дисс. канд. мед. наук (03.00.25). – Волгоград, 2003. – 102 с. 74. Каган, И. И. Топографоанатомические особенности щитовидной железы по данным компьютерной томографии / И.И. Каган, И. Н. Фатеев // Морфология.- 2007.- Т. 132.- № 4. С. 56-60. 75. Калашникова С.А. Морфологическая характеристика эндокринных органов при хронической эндогенной интоксикации / С.А. Калашникова, Л.В. Полякова, А.И. Щёголев // Бюлл. эксп. биол. и мед. – 2011 (2) – с. 211-214. 76. Калмин, О.В. Изменчивость добавочных долей щитовидной железы / О.В. Калмин; Д.В. Никишин // Астраханский, медицинский журнал. 2007. - №4. С. 86-87. 77. Калмина, О. А. Возрастная динамика компонентного состава щитовидной железы / О. А. Калмина, Д. В. Никишин // Морфология. — 2009. -Т. 136. -№4.- С. 70-71. 78. Качалка, О.В. Пространственная организация фолликулов щитовидной железы у новорожденных детей // Арх. анат., гистол., эмбриол., 1986. - №5. - C. 63-68. 138 79. Кветной, И.М. АПУД-СИСТЕМА (структурно-функциональная организация, биологическое значение в норме и патологии) // Арх. патол. – 1987. – т.18. - №1. – C. 84-102. 80. Кириллов, О.И. Половой диморфизм постнатального роста надпочечников крыс // Проблемы эндокринологии, 1998. - Т.44. - №5. - С. 45-46. 81. Климов, А.Н. Обмен липидов и липопротеидов и его нарушения (Руководство для врачей) / А.Н. Климов, Н.Г. Никульчева – СПб: Питер Ком, 1999. – 512 с. 82. Козинец, Г.И. Клетки крови икостного мозга. М. Изд. «МИА». – 2004. - 203 с. 83. Ковалевский, Г.В. Морфофункционалные стадии иммуногенеза лимфатического узелка на тимус-зависимый антиген / Г.В. Ковалевский // Труды СПб об-ва пат. анатомов. – СПб: Сотис ,1992. – Вып. 33. – С. 127-131. 84. Кокорев, А. В. Критические периоды развития щитовидной железы человека / А. В. Кокорев // Актуальные проблемы морфологии: сборник научных трудов. Красноярск, 2003. — С. 98-99. 85. Коломиец Н.М., Бакшеев В.И. Гипертоническая болезнь и ишемическая болезнь сердца. М.: Медицина, 2003 – 334 c. 86. Кондашевская, М.В. Тучные клетки и гепарин – ключевые звенья в адаптивных и патологических процессах / М.В. Кондашевская // Вестник РАМН. – 2010. – №6. – С. 49-54. 87. Кормилина, Н.В. Морфофункциональная характеристика органов иммуногенеза при действии ксеноспленоперфузата: морфо-экспериментальное исследование: Дисс. канд. мед. наук (03.00.25) – Ижевск, 2004. – 150 с. 88. Краевский, Н.А. Гистогенетические основы классификации опухолей щитовидной железы в свете современных представлений о строении и функции этого органа / Н.А. Краевский, Н.Т. Райхлин // Арх. патол., 1975. – т.37. - №1. – C. 22-30. 139 89. Краевский, Н.А. Биогенные моноамины в клетках Ашкенази (Гюртля) щитовидной железы / Н.А. Краевский, Н.Т. Райхлин, И.Г. Михайлов // ДАН СССР, 1971. – т.199, №2. – С. 501-502. 90. Красноперов, Р.А. Эндокринная регуляция уровня кальциемии у крыс при неонатальной химической десимпатизации / Р.А. Красноперов, В.А. Глумова, С.В. Грачев, С.Н. Рящиков // Российские морфологические ведомости, 2000. №1-2. – C.43-47. 91. Красноперов, Р.А. Структурно-функциональная характеристика гемато-С-целлюлярных взаимоотношений в щитовидной железе нормальных и частично десимпатизированных крыс разного возраста: Дис. … канд. мед. наук (14.00.16.; 14.00.23.) – М., 1995. – 128 c. 92. Крейчман, Г.С. Полуколичественный метод исследования фолликулов щитовидной железы / Г.С. Крейчман // Арх. пат. 1985. - Т. XLVII, № 2. - С. 83-84. 93. Линднер, Д.П. Морфометрический анализ популяции тучных клеток / Д.П. Линднер, И.А. Поберий, М.Я. Розкин, В.С. Ефимов // Арх. патол. ,1980. -№6. - С. 60-64. 94. Макарова, М.И. Особенности микробиоциноза кишечника у больных ИБС пожилого возраста / М.И. Макарова, Е.В. Обухова, Э.Ш. Гайсина // Вестник Уральской медицинской академической науки. – 2009. – №2/1. – С.269-271. 95. Макацария А.Д., Бицадзе В.О. Тромбофилии и противотромботическая терапия акушерской практике. М: Триада-Х 2003; 904 с. 96. Марков, В.Н. Динамика моноаминергических популяций в постнатальном онтогенезе: Дисс. докт. биол. наук. - М., 1998. - 208 с. 97. Марков, В.Н. Возрастная динамика клеток симпатического ганглия, надпочечников и щитовидной железы десимпатизированных крыс / В.Н. Марков, А.С. Елкин, Ю.В. Погорелов // Сб. науч. тр. «Реактивность и пластичность органов и тканей в патологии и эксперименте». / Под ред. В.Я. Глумова. – Н. Новгород, 1991. – С. 61-65. 140 98. Марков, О. Е. К морфологическим особенностям щитовидной железы / О. Е. Марков, А. А. Должиков // Морфогенез и регенерация. — Курск: Изд-во КГМУ, 2002.- С. 71-72. 99. Марченко, Я.В. Структурная организация микрососудистого русла лицевой области: Дисс. канд. мед. наук (14.00.02) – Саранск, 2009. – 107 с. 100. Матвеев, Р.С. Реакция железистых органов на экспериментальную макроглоссию / Р.С. Матвеев, И.Г. Ямашев, С.П. Сапожников, П.Б. Карышев // Бюлл. эксп. биол. и мед., 2012. - №2. – С. 244-248. 101. Машкина, А.П. Обнаружение NMDA-рецепторов в лимфоцитах и их характеристика: Дисс. канд. биол. наук (03.01.04). - Москва, 2010 – 114 с. 102. Меситов, М.В. Тканеспецифичные особенности экспрессии генов, ассоциированных со стрессом эндоплазматического ретикулума под действием гомоцистеина: Дисс. канд. биол. наук (14.03.03) – Москва, 2012. – 147 с. 103. Морфометрический анализ популяции тучных клеток /Д.П. Линднер, И.А. Поберий, М.Я. Розкин и др. // Арх. пат. – 1980. - №62(6). – С. 60-64. 104. Муравьев, О.Б. К вопросу об изменениях тиреоидного статуса в критических состояниях: Тез. докл. науч. конф. мол. уч. России, посв. 50-летию АМН. РАМН. – М., 1994. – С. 107-108. 105. Мялин, А.Н. Влияние ожогового шока на морфофункциональное состояние щитовидной железы / А.Н. Мялин, С.А. Мозеров, А.А. Чекушкин, И.А. Соколов // Медицинские науки. Теоритическая и экспериментальная медицина. – 2007. - №4. – С. 22-29. 106. Нагорнев, В.А. Атерогенез как отражение развития иммунного воспаления в сосудистой стенке / В.А. Нагорнев, О.А. Яковлева, С.В. Мальцева // Вестник РАМН. – 2000. – № 10. – С. 45-50. 107. Нагорнев В.А. Аутоиммунные и воспалительные механизмы развития атеросклероза / В.А. Нагорнев, С.В. Мальцева // Архив патологии, 2005 - №5. – С. 6-15. 141 108. Нагорнев, В.А. Цитотоксический эффект липопротеидовнизкой плотности / В.А. Нагорнев, А.Н. Восканьянц, А.Г. Виноградов и др. // Бюлл. эксп. биол. и мед. – 2003. - №1. – С.107-110. 109. Николова, Н.П. Сравнительное изучение методов экспериментального атеросклероза у белых крыс / Н.П. Николова, И.Ю. Михайлова, Д.П. Стоянов // Фармакология и токсикология. – 1965. – Т.28. – №3. – С.324-329. 110. Новиков, Д.А. Статистические методы в медико-биологическом эксперименте (типовые случаи) / Д.А. Новиков, В.В. Новочадов. – Волгоград: ВолГМУ, 2005. – 84 с. 111. Новицкий В.В., Козлов Ю.А., Лаврова В.С., Шевцова Н.М. Гемопоэз, гормоны, эволюция. – Новосибирск, - 1997. – 432 с. 112. Нурмухамбетова, Б.Н. Структурные изменения в эндотелиоцитах кровеносных капилляров регионарных лимфатических узлов тимуса при экзотоксикозе и в условиях его коррекции / Б.Н. Нурмухамбетова, Дюсембаева А.Т. // Бюллетень СО РАМН – 2005. - №1(115). – С.50-52. 113. Павлов, А.В. Роль тканевых базофилов в регуляции постнатального и адаптивного роста эндокринных желез // Матер. 3-го съезда анат., гистол., эмбриол. Тюмень, 1994. – C. 142. 114. Петрова, Н. И. Эпителиально-стромальные отношения в щитовидной железе у собак в норме и при различных режимах двигательной активности / Н. И. Петрова, О. В. Бирюкова // Морфология, 2002. - №2-3. - С.123. 115. Погорелов Ю.В., Виноградов С.Ю., Миронов В.А., Шишло В.К., Тиреоидный микрорайон в обеспечении структурно-функционального гомеостаза щитовидной железы. // в кн. «Экспериментальная и прикладная морфология»: Межвуз. сб. Чебоксары, 1988. – с.93-96. 116. Преображенский, Д.В. Клиническое значение гипер- и гипохолестеринемии у пожилых и безопасность статинов / Д.В. Преображенский, С.А. Патарая, Т.А. Батыралиев // Проблемы стандартизации в здравоохранении. – 2007. – №2. – С. 13-21. 142 117. Происхождение тучных клеток: современное состояние проблемы / В.В. Гусельникова, А.П. Пронина, П.Г. Назаров и др. // Вопросы морфологии XXI века. Сборник научных трудов. – ДЕАН. – 2010. – Вып. 2.– С. 108-115. 118. Рящиков, С.Н. Морфофункциональная характеристика компенсаторновосстановительных процессов щитовидной железы крыс в норме и при частичной десимпатизации: Автореф. дис. … канд.мед.наук. – Ижевск, 1989. – 24 с. 119. Санникова, А.А. Влияние иммуномодулятора глюкозаминилмурамилдипептида на липидный обмен и клетки иммунной системы при стабильном течении атеросклероза / А.А. Санникова, Н.Н. Чучкова, Э.Ш. Гайсина и др. // Российский иммунологический журнал. – 2008. – Т.2 (11). – № 2-3. – С. 324. 120. Санникова, А.А. глюкозаминилмурамилдипептида Иммуномодулирующее при изменном липидном действие обмене и атеросклерозе / А.А. Санникова, Н.Н. Чучкова, Э.Ш. Гайсина // Вестник Уральской медицинской академической науки. – 2008. – №1.– С.64-66. 121. Сапин, М.Р. Брыжееные лимфатические узлы крыс при действии эмоционального стресса / М.Р. Сапин, Е.В. Коплик, Д.Б. Никитюк // Морфология, 2001. - №1. – С. 48-51. 122. Сапин, М.Р. Ультраструктурные особенности организации ПКВ лимфатического русла / М.Р. Сапин, Г.В. Буланова // Архив анатомии, гистологии и эмбриологии.- 1981.- Т. 81.- № 12.- с. 24-33. 123. Семенов, В.В. Морфофункциональные механизмы межорганного гомеостаза эндокринной системы в эксперименте.// Росс. морф. ведомости. – 1996. - №1(4). – C. 87-89. 124. Скворцова В.И., Евзельман М.А. Ишемический инсульт. – Орел, 2006. – 404 с. 125. Скворцов Ю.И. Гомоцистеин как фактор риска развития ИБС (обзор)/ Ю.И. Скворцов, А.С. Королькова // Саратовский научно-медицинский журнал. – 2011. – Т.7, №3. – С. 619-624. 143 126. Смирнов, клубочкового, но А.В. и Гомоцистеин канальцевого вызывает отдела поврждения нефрона не только (экспериментальное исследование) / А.В. Смирнов, В.А. Добронравов, А.И. Невротин // Нефрология, 2005. – Т. 9, №3. – С.81-87. 127. Смирнова, Е.А. Гистогенез В-клеток (клеток Ашкенази) щитовидной железы человека. // Арх. патологии, 1974. – Т. 36, №9. – С. 76-80. 128. Ставинская, О.А. Влияние гистамина и серотонина на регуляцию иммунологической реактивности: автореф. дис … канд. биол. наук / О.А. Ставинская. – Архангельск, 2008. – 17 с. 129. Стефанов, С.Б. Визуальная классификация при количественном сравнении изображений / С.Б. Стефанов // Архив АГЭ. 1985. – Т.88, №2. – С. 7883. 130. Творогова, М.Г. Липиды и липопротеиды (общие представления, анализ, клиническая значимость) / М.Г. Творогова. – М.: РАМЛД, 2010. – 188с. 131. Удочкина, Л. А. Структурные преобразования щитовидной железы человека на этапах инволюции / Л. А. Удочкина, Э. А. Санджиев // Астраханский медицинский журнал. 2007.- № 1. - С. 189-190. 132. Усенко, В.С. Структурная организация щитовидной железы в норме, при действии ретинола и мерказолила. // Автореф. дисс. канд. мед. наук, Симферополь, 1989. - 16 с. 133. Фатеев, И. Н. Различия и особенности прижизненной топографии щитовидной железы по данным компьютерной томографии / И.Н. Фатеев // Анатомо-физиологические аспекты современных хирургических технологий. СПб. : Изд-во Воен.-мед. акад, 2006. - С. 172-173. 134. Фатеев, И.Н. Современные вопросы хирургической анатомии щитовидной и паращитовидной желез // Морфология, 1999. - Т. 116, №5. - С. 7881. 135. Федченко, Н.П. Механизм фолликулогенеза в щитовидной железе крыс при длительной гиперкальциемии // Арх. анат., гистол., эмбриол., 1982. – Т. 82, №3. – С. 60-66. 144 136. Федченко, Н.П. Морфологические аспекты внутриорганной регуляции структурного гомеостаза паренхимы щитовидной железы. // Автореф.дис. … докт.мед.наук – М., 1988. – 32 с. 137. Федченко, Н.П. Некоторые проблемы структурной организации щитовидной железы. // Арх. анат., гистол., эмбриол., 1986. -№6. - С.82-89. 138. Федченко, Н.П. Проблема внутриорганной регуляции структурного гомеостаза паренхимы щитовидной железы / /Днепропетровск: Днепропетр. мед. ин-т, 1987. – ДЕП. в Укр. НИИНТИ 25.05.87. – 41 с. 139. Хмельницкий, O.K. Полуколичественные методы анализа изменений щитовидной железы / O.K. Хмельницкий, В.Л. Быков //Арх. патологии, 1980. Т.60, №4. - С. 47-50. 140. Хмельницкий О.К., Котович В.М. Дифференциальная диагностика заболеваний щитовидной железы при морфологическом исследовании – Спб, 1997, 63 c. 141. Хмельницкий О.К., Ступина А.С. Функциональная морфология эндокринной системы при атеросклерозе и старении. Л., 1989. - 248 с. 142. Хмельницкий О.К., Третьякова М.С. Морфометрическое исследование щитовидной железы. – СПб, 1997. - 16 с. 143. Челидзе П.В., Зацепина О.В. Морфофункциональная классификация ядрышек // Успехи современной биологии, 1988. – Т. 105. – С. 252-258. 144. Черенков, И.А. Постнатальный морфогенез щитовидной железы человека в различных районах Удмуртии: дисс. канд. биол. наук. - Ижевск, 2001. – 151 с. 145. Черешнев, В.А. Иммунология / В.А. Черешнев, К.В. Шмагель. – М.: Издательский дом «МАГИСТР-ПРЕСС», 2013. – 448 с. 146. Черных, А. В. Вариантная анатомия щитовидной железы / А. В. Черных, Ю. В. Малеев, Н. М. Шмакова // Морфология, 2006. - Т. 129, № 4. - С. 135-136. 147. Чернышева, М.П. Гормоны животных. Введение в физиологическую эндокринологию: Учебное пособие – СПб. – 1995. – 296 с. 145 148. Чучкова, Н.Н. Состояние липидного обмена и клеток иммунной системы при экспериментальном атеросклерозе у крыс и возможность иммунокоррекции Ликопидом / Н.Н. Чучкова, А.А. Санникова, Э.Ш. Гайсина // Актуальные вопросы фундаментальной и клинической иммунологии и аллергологии: материалы V конференции иммунологов Урала. Оренбург, 30 октября-1 ноября 2006 г. – Оренбург, 2006. – С. 33-34. 149. Чучкова, Н.Н. Морфофункциональный статус тучноклеточных популяций периферических органов иммунной системы крыс / Н.Н. Чучкова, Н.В. Кормилина, В.А. Глумова, М.В. Чучкова //Труды ИГМА, 2011. - Т.49. - С. 32-34. 150. Шадлинский, В.Б. Морфологическое исследование системы С-клеток щитовидной железы животных / В.Б. Шадлинский, С.М. Рустамова // Тез. докл. V Конгресса Международной Ассоциации Морфологов, Морфология, 2000. - С. 133134. 151. Шевченко, О.П. Ишемическая болезнь сердца / О.П. Шевченко, О.Д. Мишнев. – М.: Реофарм. – 2005. – 416 с. 152. Шлыков, И. П. Факторы, регулирующие восстановительные процессы в регенерирующей щитовидной железе / И. П. Шлыков // Морфологические ведомости, 2004. - №1-2. — С. 125. 153. Юминова, Н.А. Влияние морфина гидрохлорида на морфо- функциональное состояние щитовидной железы и некоторые звенья ее регуляции у крыс: Дисс. канд. мед. наук. - Саранск, 1996. – 156 с. 154. Юшков Б.Г., Климин В.Г., Кузьмин А.И. Сосуды костного мозга и регуляция кроветворения. Екатеринбург: УрО РАН, 2004, 149 с. 155. Яглов, В.В. Актуальные проблемы биологии диффузной эндокринной системы. // Арх. анат., гистол., эмбриол., 1989. - Т.96, №1. - С. 14-29. 156. Яглова, Н.В. Нарушения секреторного цикла фолликулярных тироцитов и их коррекция тиреотропным гормоном при экспериментальном синдроме нетиреоидных заболеваний // Бюлл. эксп. биол. и мед., 2011. - №8. - С. 215-219. 146 157. Aguirre, A. Possible involvement of TLRs and hemichannels in stressinduced CNS dysfunction via mastocytes, and glia activation / A. Aguirre, C.J. Maturana, P.A. Harcha, J.C. Sáez // Mediators Inflamm. – 2013; 2013:893521. doi: 10.1155/2013/893521. 158. Ahmadi, O. Does senescence affect lymph node number and morphology? A systematic review / O. Ahmadi, J.L. McCall, M.D. Stringer // Nat. Rev. Immunol. – 2012. – Vol. 12(11). – P. 762-773. 159. Akdis, C.A. Histamine in the immune regulation of allergic inflammation / C.A. Akdis, K. Blaser // J. Allergy. Clin. Immunol. – 2003. – Vol. 112. – P. 15-22. 160. Alevizos, M. Stress triggers coronary mast cells leading to cardiac events / M. Alevizos, A. Karagkouni, S. Panagiotidou, M. Vasiadi, T.C. Theoharides // Curr. Vasc. Pharmacol. – 2013. – Vol. 11(3). – P. 314-326. 161. Anagnostis P, Efstathiadou ZA, Slavakis A, Selalmatzidou D, Poulasouchidou M, Katergari S, Karathanasi E, Dogramatzi F, Kita M. The effect of Lthyroxine substitution on lipid profile, glucose homeostasis, inflammation and coagulation in patients with subclinical hypothyroidism. Int J Clin Pract. 2014 Jul;68(7):857-63. doi: 10.1111/ijcp.12394. Epub 2014 Feb 18. 162. Andersson, H.C. Characterization of lysosomal monoidotyrozine transport in rat thyroid cells. Evidence for transport by system / H.C. Andersson, L.D. Kohn, I. Bernardini, H.I. Blom, F. Tietze, W.A. Gahl // J. Biol. Chem. – 1990. – Vol. 265, №19. – P. 10950-10954. 163. Arias, J. Light and electronmicroscopical localization of calcitonin gene related peptide somatostatine C-terminal gastrin/cholecystocinin immunoreactives in rat thyroid / J. Arias, L. Scopsi, J.A. Fisher, L. Larsson // Histochemistry. – 1989. – vol. 91, №4. – p. 265-272. 164. Atherosclerosis, inflammation and Chlamydia pneumoniae / G. Fazio, M. Giovino, A. Gullotti et al. // World J. Cardiol. – 2009. – Vol. 1. – Р. 31-40. 165. Atorvastatin suppresses interferon-gamma-induced neopterin formation and tryptophan degradation in human peripheral blood mononuclear cells and in monocytic 147 cell lines / G. Neurauter, B. Wirleitner, A. Laich et al. // Clin Exp Immunol. – 2003. – Vol. 131. – P. 264-267. 166. Autoimmunity, infectious immunity and atherosclerosis / E. Matsuura, K. Kobayashi, Y. Matsunami et al. // J. Clin. Immunol. – 2009. – Vol. 29. – P. 714-721. 167. Backteman, K. Lymphocyte subpopulations in lymph nodes and peripheral blood: a comparison between patients with stable angina and acute coronary syndrome / K. Backteman, C. Andersson, L.G. Dahlin, J. Ernerudh, L. Jonasson // PLoS One. 2012. – Vol. 7(3):e32691. doi: 10.1371/journal.pone.0032691. 168. Bai, Z. Constitutive lymphocyte transmigration across the basal lamina of high endothelial venules is regulated by the autotaxin/lysophosphatidic acid axis / Z. Bai, L. Cai, E. Umemoto, A. Takeda, K. Tohya, Y. Komai, P.T. Veeraveedu, E. Hata, Y. Sugiura, A. Kubo, M. Suematsu, H. Hayasaka, S. Okudaira, J. Aoki, T. Tanaka, H.M. Albers , H. Ovaa, M. Miyasaka // Int J Surg Pathol. - 2013. – Vol. 21. – P. 142143. 169. Bamashmoos, S.A. Relationship between total homocysteine, total cholesterol and creatinine levels in overt hypothyroid patients / S.A. Bamashmoos, M.A. Al-Nuzaily, A.M. Al-Meeri, F.H. Ali // Springerplus. - 2013. – Vol. 2. – P. 423. 170. Benditt, E.P. Evidence for a monoclonal origin of human atherosclerosis plaques / E.P. Benditt, J.M. Benditt // Proc. Natl. Acad. Sci. USA. – 1977. – Vol. 706. – P. 1753-1756. 171. Bendtzen, K. A matrix of cholesterol crystals, but not cholesterol alone, primes human monocytes/macrophages for excessive endotoxin-induced production of tumor necrosis factor-alpha. Role in atherosclerotic inflammation? / K. Bendtzen, O. Christensen, C.H. Nielsen, P. Holmstrup // Discov. Med. – 2014. – Vol. 17(96). – P.309-312. 172. Bechther, G. Paracrine interaction between thyrocytes and fibroblasts / G. Bechther, W. Greil, D. Stubner, R. Gartner // Acta endocrinol. Suppl. – 1987. - №283. – P. 28. 173. Bellamy, M.F. Hyperhomocysteinemia after an oral methionine load acutely impairs endothelial function in healthy adults / M.F. Bellamy, I.F.W. Mcdowell, M.W. 148 Ramsey, M. Brownlee, C. Bones, R.G. Newcombe, M.J. Lewis // Circulation. – 1998. – Vol. 98. – P. 1848–1852. 174. Billon C, Canaple L, Fleury S, Deloire A, Beylot M, Dombrowicz D, Del Carmine P, Samarut J, Gauthier K. TRα protects against atherosclerosis in male mice: identification of a novel anti-inflammatory property for TRα in mice. Endocrinology. 2014 Jul;155(7):2735-45. doi: 10.1210/en.2014-1098. Epub 2014 May 5. 175. Böger, R.H. Plasma concentration of asymmetric dimethylarginine, an endogenous inhibitor of nitric oxide synthase, is elevated in monkeys with hyperhomocyst(e)inemia or hypercholesterolemia / R.H. Böger, S.M. Bode-Böger, K. Sydow, D.D. Heistad, S.R. Lentz //Arterioscl. Thromb. Vasc. Biol. – 2000 – Vol. 20. – P. 1557–1564. 176. Böger, R.H. Elevation of asymmetric dimethylarginine may mediate endothelial dysfunction during experimental hyperhomocyst(e)inemia in humans/ R.H. Böger, S.R. Lentz, S.M. Bode-Böger, H.R. Knapp, W.G. Haynes // Clin. Sci. – 2001. – Vol. 100. - P.161–167. 177. Böger, R.H. The emerging role of asymmetric dimethylarginine as a novel cardiovascular risk factor // Cardiovasc. Res. – 2003 – Vol.59. – P. 824–833. 178. Boyle, J.J. Macrophage activation in atherosclerosis: pathogenesis and pharmacology of plaque rupture / J.J. Boyle // Curr. Vasc. Pharmacol. – 2005. – Vol. 3. – P. 63-68. 179. Brown, R.S. Developmental regulation of thyrotropin receptor gene expression in the fetal and neonatal rat thyroid: relation to thyroid morphology and to thyroid-specific gene expression / R.S. Brown, V. Shalohoub, S. Coulter, S. Alex, I. Joris, W. De Vito, J. Lian, G.S. Stein // Endocrinol. – 2000. - Vol. 141. – P. 340-345. 180. Cabanillas, A.M. Thyroid iodine transport is reduced by administration of monoamine oxidase A inhibitors to rats/ A.M. Cabanillas, A.M. Masini-Repiso, M.E. Costamagna, C. Pellizas, A.H. Coleoni // Endocrinol. – 1994. – Vol. 143, №2. – P. 235240. 181. Cardy, R.H. Sexual dimorphism of the normal rat mammary gland // Vet. Pathol. – 1991. - Vol 28. - P. 139-145. 149 182. Cai, H. Endothelial dysfunction in cardiovascular diseases: the role of oxidant stress/ H. Cai, D.G. Harrison // Circ. Res. – 2000. – Vol. 87. – P. 840–844. 183. Caviezel, S. Sex-specific associations of cardiovascular risk factors with carotid stiffness - Results from the SAPALDIA Cohort Study / S. Caviezel, J. Dratva, E. Schaffner, C. Schindler, E. Zemp Stutz, E. de Groot, L. Burdet, T. Rothe, M. Pons, J.M. Gaspoz, T. Rochat, N. Künzli, N. Probst-Hensch, A. Schmidt-Trucksäss // Atherosclerosis. – 2014. – Vol. 235(2). – P. 576-584. 184. Chambers, J.C. Acute hyperhomocysteinemia and endothelial dysfunction/ J.C. Chambers, A. McGregor, J. Jean-Marie, J.S. Kooner // Lancet. – 1998. –Vol. 351. – P. 36–37. 185. Chen, K. Vascular and perivascular nitric oxide release and transport: biochemical pathways of neuronal nitric oxide synthase (NOS1) and endothelial nitric oxide synthase (NOS3) / K. Chen, A.S. Popel // Free Radic. Biol. Med. – 2007. – Vol. 42. – P. 811-822. 186. Chen Y, Chauhan SK, Lee HS, Stevenson W, Schaumburg CS, Sadrai Z, Saban DR, Kodati S, Stern ME, Dana R. Effect of desiccating environmental stress versus systemic muscarinic AChR blockade on dry eye immunopathogenesis // Invest Ophthalmol Vis Sci. 2013 Apr 3;54(4):2457-64. doi: 10.1167/iovs.12-11121. 187. Chen, Z. Mice deficient in methylene tetrahydrofolate reductase exhibit hyperhomocysteinemia and decreased methylation capacity, with neuropathology and aortic lipid deposition/ Z. Chen, A.C. Karaplis, S.L. Ackerman, I.P. Pogribny, S. Melnyk, S. Lussier-Cacan, M.F. Chen, A. Pai, S.W.M. John, R.S. Smith, T. Bottiglieri, P. Bagley, J. Selhub, M.A. Rudnicki, S.J. James, R. Rozen // Hum. Mol. Genet. – 2001. – Vol. 10. – P. 433–443. 188. Clark, O.H. Excess iodine intake and thyroid function // Thyroid. – 1990. – Vol.1, №1. – P. 69-72. 189. Clark, M.S. Induction of a serotogenic and neuronal phenotype in thyroid Ccell / M.S. Clark, T.M. Lanigan, N.M. Page, A.F. Ruso // Neurosci. – 1995. – Vol.15 (9). - P. 6167-6178. 150 190. Coursey, T.G. Chemokine receptors CCR6 and CXCR3 are necessary for CD4(+) T cell mediated ocular surface disease in experimental dry eye disease / T.G. Coursey, N.B. Gandhi, E.A. Volpe, S.C. Pflugfelder, C.S. de Paiva // PLoS One. 2013 Nov 4;8(11):e78508. doi: 10.1371/journal.pone.0078508. 191. C-Reactive protein, a sensitive marker of inflammation, predicts future risk of coronary heart disease in initially healthy middle-aged men: results from the MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 to 1992. / W. Koenig, M. Sund, M. Fröhlich et al. // Circulation. – 1999. – Vol. 99. – P. 237-242. 192. Cullen, P. The pathogenesis of atherosclerosis / P. Cullen, J. Rauterberg, S.Lorkowski // Handb. Exp. Pharmacol. – 2005. – Vol. 170. – P. 3-70. 193. Dayal, S. Endothelial dysfunction and elevation of S-adenosylhomocysteine in cystathionine β-synthase-deficient mice / S. Dayal, T. Bottiglieri, E. Arning, N. Maeda, M.R. Malinow, C.D. Sigmund, D.D. Heistad, F.M. Faraci, S.R. Lentz // Circ. Res. – 2001. – Vol. 88. – P. 1203–1209. 194. Dayal, S. Deficiency of glutathione peroxidase-1 sensitizes hyperhomocysteinemic mice to endothelial dysfunction / S. Dayal, K.L. Brown, C.J. Weydert, L.W. Oberley, E. Arning, T. Bottiglieri, F.M. Faraci, S.R. Lentz //Arterioscl. Thromb. Vasc. Biol. – 2002. – Vol. 22. – P. 1996–2002. 195. Dayoub, H. Dimethylarginine dimethylaminohydrolase regulates nitric oxide synthesis: genetic and physiological evidence / H. Dayoub, V. Achan, S. Adimoolam, J. Jacobi, M.C. Stuehlinger, B.Y. Wang, P.S. Tsao, M. Kimoto, P. Vallance, A.J. Patterson, J.P. Cooke // Circulation. – 2003. – Vol. 108. – P. 3042–3047. 196. Delitala AP, Orrù M, Filigheddu F, Pilia MG, Delitala G, Ganau A, Saba PS, Decandia F, Scuteri A, Marongiu M, Lakatta EG, Strait J, Cucca F. Serum free thyroxine levels are positively associated with arterial stiffness in the SardiNIA study. Clin Endocrinol (Oxf). 2014 Jun 23. doi: 10.1111/cen.12532. 197. De Paoli, F. Macrophage Phenotypes and Their Modulation in Atherosclerosis / F. De Paoli, B. Staels, G. Chinetti-Gbaguidi // Arterioscler. Thromb. Vasc. Biol. - 2012. – Vol. 32(9). – P. 2045-2051. 151 198. Eberhardt, R.T. Endothelial dysfunction in a murine model of mild hyperhomocyst(e)inemia / R.T. Eberhardt, M.A. Forgione, A. Cap, J.A. Leopold, M.A. Rudd, M. Tolliet, S. Heyrick, R. Stark, E.S. Klings, N.I. Moldovan, M. Yaghoubi, P.J. Goldschmidt-Clermont, H.W. Farber, R. Cohen, J. Loscalzo // Clin. Invest. – 2000. – Vol. 106. – P. 483–491. 199. Ericson, L.E. Structural and functional aspects of the thyroid follicular epithelium/ L.E. Ericson, M. Nilsson // Toxicol. Lett. – 1992. - № 64-65. - P. 365-373. 200. Ermolina E.V., Stadnikov A.A., Smoliagin A.I. Morphological features of the organs of the immune system in conditions of exposure to chromium and benzene // Gig Sanit. 2012 May-Jun;(3):69-71. 201. Faraci, F.M. Hyperhomocysteinemia: a million ways to lose control // Arterioscl. Thromb. Vasc. Biol. – 2003. – Vol. 23. – P. 371–373. 202. Friedewald, W. T. Estimation of the concentration of low-density lipoprotein cholesterol in plasma, without use of preparative ultracentrifuge / W.T. Friedewald, R.I. Levy, D.S. Fredrickson // Clin. Chem. – 1972. – Vol.18. – P. 499-502. 203. Estevez, S. Dilated high endothelial venules in lymph nodes simulating metastatic thyroid carcinoma / S. Estevez, F.M. Bosisio // ANZ J Surg. – 2013. – Vol. 83(9). – P. 612-618. 204. Fairweather D. Mast cells and inflammatory heart disease: potential drug targets / D. Fairweather, S. Frisancho-Kiss // Mediators Inflamm. 2013; 2013:893521. doi: 10.1155/2013/893521. 205. Feig, J.E. Laser capture microdissection for analysis of macrophage gene expression from atherosclerotic lesions / J.E. Feig , E.A. Fisher // Methods Mol Biol. 2013. – Vol. 1027. – P. 123-135. 206. Friedman, A.N. The kidney and homocysteine metabolism / A.N. Friedman, A.G. Bostom, J. Selhub, A.S. Levey, I.H. Rosenberg // Am. Soc. Nephrol. – 2001. –Vol. 12(10). - P. 2181-2189. 207. Fu, Y.-F. A reduction of endogenous asymmetric dimethylarginine contributes to the effect of captopril on endothelial dysfunction induced by 152 homocysteine in rats / Y.-F. Fu, Y. Xiong, Z. Guo // Eur. J. Pharmacol. – 2005. –Vol. 508. – P. 175. 208. Füchsl AM, Neumann ID, Reber SO. Stress resilience: a low-anxiety genotype protects male mice from the consequences of chronic psychosocial stress // Endocrinology. 2014 Jan;155(1):117-26. doi: 10.1210/en.2013-1742. 209. Galkina, E. Immune and inflammatory mechanisms of atherosclerosis / E. Galkina, K. Ley // Annu. Rev. Immunol. – 2009. – Vol. 27. – P. 165-197. 210. Gatti, R. The ultrastructure of the thyroid parafollicular cell of the marmot (Marmota marmota). Immunocytochemical localization of calcitonin and somatostatin / R. Gatti, G. Bucci, G. Orlandini // Acta Bio-med/Ateneo Parm. – 1988. – Vol. 59, №56. – P. 205-222. 211. Gautier, E.L. Local apoptosis mediates clearance of macrophages from resolving inflammation in mice / E.L. Gautier, S. Ivanov, P. Lesnik, G.J. Randolph // Blood. – 2013. – Vol. 122 (15). – P. 2714-2722. 212. Geng, H. Even mildly elevated TSH is associated with an atherogenic lipid profile in postmenopausal women with subclinical hypothyroidism / H. Geng, X. Zhang, C. Wang, M. Zhao, C. Yu, B. Zhang, Y. Wang, B. Ban, J. Zhao // Endocr Res. 2014 Mar 28. 213. Gershon, M.D. Uptake of biogenic amines by thyroid gland/ M.D. Gershon, E.S. Nunez // Mol. and Cell. Endocrinol. – 1976. – Vol.5, №3. – P. 169-180. 214. Gibson, W.G. Age-associated C-cell hyperplasia in the human thyroid / W.G. Gibson, T.C. Peng, B.P. Croker // Am. J. Pathol. – 1982. – Vol. 106(3). - P.388393. 215. Gill, S.S. Antipsychotic drug use and mortality in older adults with dementia / S.S.Gill, S.E.Bronskill, S.L.Normand, G.M.Anderson, K.Sykora, K.Lam, C.M.Bell, P.E. Lee, H.D. Fischer, N. Herrmann, J.H. Gurwitz, P.A.Rochon // Ann. Intern. Med. – 2007. - Vol. 146. – P. 775–786. 216. Ginsberg, J. Protein kinase C as a mediator of THS and thyroid autoimmunity action // Autoimmunity. – 1992. – Vol.13, №1. – P.51-59. 153 217. Girard, J.P. HEVs, lymphatics and homeostatic immune cell trafficking in lymph nodes / J.P. Girard, C. Moussion, R. Förster // Ann Allergy Asthma Immunol. – 2014. – Vol. 112(4). – P.309-316. 218. Gokay, S. Hyperhomocysteinemia in a young woman presenting with acute myocardial infarction: Case report. / S. Gokay, D. Ciçek, H. Müderrisoğlu // Intery Med Appl Sci, 2013. – Vol. 5(1). – P. 39-42. 219. Guo, H.Y. Hyperhomocysteinemia independently causes and promotes atherosclerosis in LDL receptor-deficient mice / H.Y. Guo , F.K. Xu , H.T. Lv , L.B. Liu , Z. Ji , X.Y. Zhai , W.L. Tang , J.F. Chi // J Geriatr Cardiol. – 2014. – Vol. 11(1). – P. 74-78. 220. Guo, T. Chymase activity is closely related with plaque vulnerability in a hamster model of atherosclerosis / T. Guo, W.Q. Chen, C. Zhang, Y.X. Zhao, Y. Zhang // Curr Atheroscler Rep. – 2009. – Vol. 11(3). – P. 214-219. 221. Hall JM, Witter AR, Racine RR, Berg RE, Podawiltz A, Jones H, Mummert ME. Chronic psychological stress suppresses contact hypersensitivity: potential roles of dysregulated cell trafficking and decreased IFN-γ production // Brain Behav Immun. 2014 Feb;36:156-64. doi: 10.1016/j.bbi.2013.10.027. Epub 2013 Oct 31. 222. Hall, R. Fluctuating thyroid functions // Clin. Endocrinol. – 1992. – Vol. 36., №2. – P.214-216. 223. Hamze, M. Characterization of resident B cells of vascular walls in human atherosclerotic patients / M. Hamze, C. Desmetz, M.L. Berthe, P. Roger, N. Boulle, P. Brancherau, E. Picard, C. Guzman, C. Tolza, P. Guglielmi // J Immunol. – 2013. – Vol. 191 (6). – P. 3006-3016. 224. Hansson, G. К. Immune mechanisms in atherosclerosis // Arterioscler. Thromb. Vas. Biol. - 2001. - Vol.21, №12. - P. 1876-1890. 225. Harker, L.A. Effect of sulfinpyrazone on homocysteine-induced endothelial injury and arteriosclerosis in baboons/ L.A. Harker, J.M. Harlan, R. Ross // Circ. Res. 1983. – Vol.53. – P. 731–739. 154 226. Harker, L.A. Homocysteine-induced arteriosclerosis: the role of endothelial cell injury and platelet response in its genesis/ L.A. Harker, R. Ross, S.J. Slichter, C.R. Scott // Clin. Invest. – 1976. – Vol.58. – P. 731–741. 227. Harker, L.A.Homocysteinemia. Vascular injury and arterial thrombosis/ L.A. Harker, S.J. Slichter, C.R. Scott, R. Ross // N. Eng. J. Med. – 1974. – Vol.291. – P. 537–543. 228. Heart rate cardiovascular mortality: the Framingham study / W.B. Kannel, C. Kannel, R.S. Paffenbarger Jr. et al. // Am. Heart J. – 1987. – Vol. 113. – P. 14891494. 229. Histamine regulates T-cell and antibody responses by differential expression of H1 and H2 receptors / M. Jutel, T. Watanabe, S. Klunker et al. – Nature. – 2001. – Vol. 413. – P. 420-425. 230. Hoang, V.C. Functional and morphological changes of the thyroid gland following 5 days of pulsatile TRH stimulation in male rats/ V.C. Hoang, G. Brabant, H. Leitolf, A. Von zur Muhlen, H. Dralle, S. Schroder, W.D. Sierralta // J. Endocrinol. – 1995. – Vol.146 (2). - P. 339-348. 231. Hoffman, M.A. Hyperhomocysteinemia enhances vascular inflammation and accelerates atherosclerosis in a murine model / M.A. Hofmann, E. Lalla, Y. Lu, M.R. Gleason, B.M. Wolf, N. Tanji, L.J. Ferran Jr., B. Kohl, V. Rao, W. Kisiel, D.M. Stern, A.M. Schmidt // Clin. Invest. – 2001. – Vol.107. – P. 675–683. 232. Johnson, K.E. Histology and cell biology // A. Williams & Wilkins Medical Publ.: Baltimore, Maryland. - 1991. – P. 409. 233. Johnston, D. Expression of v-Ha-ras driven by the calcitonin/calcitonin gene-related peptide promoter: a novel transgenic murine model for medullary thyroid carcinoma / D. Johnston, D. Hatzis, M.E. Sunday // Oncogene. – 1998. – Vol.16 (2). – P. 167-177. 234. Kain MJ, Owens BM. Stromal cell regulation of homeostatic and inflammatory lymphoid organogenesis // Immunology. 2013 Sep;140(1):12-21. doi: 10.1111/imm.12119. 155 235. Kameda, Y. Co-expression of vimentin and 19S-thyroglobulin in follicular cells located in the C-cell complex of dog thyroid gland // Histochem. Cytochem. – 1995. - Vol. 43, №11. - P. 1097-1106. 236. Kanani, P.M. Role of oxidant stress in endothelial dysfunction produced by experimental hyperhomocyst(e)inemia in humans / P.M. Kanani, C.A. Sinkey, R.L. Browning, M. Allaman, H.R. Knapp, W.G. Haynes // Circulation. – 1999. – Vol. 100. – P. 1161–1168. 237. Kapourchali, F.R. Animal models of atherosclerosis / F.R. Kapourchali, G. Surendiran, L. Chen, E. Uitz, B. Bahadori, M.H. Moghadasian // World J Clin Cases. – 2014. – Vol. 2(5). – P. 126-132. 238. Kawahara, I. The role of the vascular-associated lymphoid tissue (VALT) network and neovascularization in atherosclerotic carotid plaque / I. Kawahara, K. Tsutsumi, I. Nagata // Circ. Res. – 2014. – 114(11). – P. 1772-1787. 239. Kilic, I.D. Noninvasive indicators of atherosclerosis in subclinical hypothyroidism / I.D. Kilic, H. Tanriverdi, S. Fenkci, F. Akin, S. Uslu, A. Kaftan // Indian J Endocrinol Metab. - 2013. – Vol. 17(2). – P. 271-275. 240. Kim, E.J. Cholesterol-induced non-alcoholic Fatty liver disease and atherosclerosis aggravated by systemic inflammation / E.J. Kim, B.H. Kim, H.S. Seo, Y. J. Lee, H.H. Kim, H.H. Son, M.H. Choi // PLoS One. – 2014. – Vol. 9(6): e97841. doi: 10.1371/journal.pone.0097841. 241. Kim, E.S. Association between low serum free thyroxine concentrations and coronary artery calcification in healthy euthyroid subjects / E.S. Kim, J.A. Shin, J.Y. Shin, D.J. Lim, S.D. Moon, H.Y. Son, J.H. Han // Thyroid. – 2012. – Vol. 22(9). – P. 870-876. 242. Kim, P.S. An endoplasmic reticulum storage disease causing congenital goiter with hypothyroidism / P.S. Kim, O.Y. Kwon, P. Arvan // Cell. Biol. – 1999. Vol. 133. - P. 517-527. 243. Kovanen, P.T. Mast cells in atherogenesis: actions and reactions // Cardiovasc Hematol Disord Drug Targets. – 2009. – Vol. 8(1). – P.80-90. 156 244. Krasnoperov, R.A. C-cell-blood barrier in the normal and guanethidinesympathectomized rat thyroid: relationships between ultrastructure and efficiency of endogenous calcitonin transport / R.A. Krasnoperov, V.A. Glumova, A.N. Gerasimov, S.N. Ryashikov // Microcirculation: Function, Malfunction and Measurement/ Ed. by R. Tompson. New York, Nova Science Publ. - 2009. - P.113-130. 245. Kuliawat, R. Polarized distribution and delivery of plasma membrane proteins in thyroid follicular epithelial cells / R. Kuliawat, M.P. Lisanti, P. Arvan // Biol. Chem. – 1995. - № 270. - P. 2478-2482. 246. Leber A, Teles A, Zenclussen AC. Regulatory T cells and their role in pregnancy // Am J Reprod Immunol. 2010 Jun;63(6):445-59. doi: 10.1111/j.16000897.2010.00821.x. Epub 2010 Mar 11. 247. Lentz, S.R. Folate dependence of hyperhomocysteinemia and endothelial dysfunction in cystathionine β-synthase-deficient mice / S.R. Lentz, R.A. Erger, S. Dayal, N. Maeda, M.R. Malinow, D.D. Heistad, F.M. Faraci // Am. J. Physiol. – 2000. – Vol. 278. - H970–H975. 248. Lentz, S.R. Vascular dysfunction in monkeys with diet-induced hyperhomocyst(e)inemia / S.R. Lentz, C.G. Sobey, D.J. Piegors, M.Y. Bhopatkar, F.M. Faraci, M.R. Malinow, D.D. Heistad // Clin. Invest. – 1996. – Vol. 98. – P. 24–29. 249. Libby P. Inflammation in atherosclerosis. J Clin Invest. - 2013. – Vol. 123(4). – P. 1571-1579. 250. Maile, S. The interstitial space of the thyroid gland of marmosets (Callithrix jacchus) / S. Maile, H.J. Merker // Anat. Anz. – 1995. - Vol. 177 (4). - P. 347-359. 251. Mandal, K. Autoimmune mechanisms of atherosclerosis / K. Mandal, M. Jahangiri, Q. Xu // Handb. Exp. Pharmacol. – 2005. – Vol. 170. – P. 723-743. 252. Mangat, G.S. Ameliorative Effect of a Selective Endothelin ETA Receptor Antagonist in Rat Model of L-Methionine-induced Vascular Dementia / G.S. Mangat, A.S. Jaggi, N. Singh // Korean J Physiol Pharmacol. – 2014. – Vol. 18 (3). – P. 201-209. 253. Martel, C. Atherosclerosis and transit of HDL through the lymphatic vasculature / C. Martel, G.J. Randolph // Curr Atheroscler Rep. – 2013. – Vol. 15 (9). – P. 354. 157 254. Martel, C. Lymphatic vasculature mediates macrophage reverse cholesterol transport in mice / C. Martel, W. Li, B. Fulp, A.M. Platt, E.L. Gautier, M. Westerterp, R. Bittman, A.R. Tall, S.H. Chen, M.J. Thomas, D. Kreisel, M.A. Swartz, M.G. SorciThomas, G.J. Randolph // No Shinkei Geka. – 2013. – Vol. 41(1). – P. 5-13. 255. Martin-Lavace, I. Quantitative changes in the frequency and distribution of the C-cell population in the rat thyroid gland with age / I. Martin-Lavace, E. Conde, C. Montero, H. Galera-Davidson // Cell and tissue Res. – 1993. - Vol. 1. - P. 73-77. 256. Mast cells as «tunable» effector and immunoregulatory cells: recent advances / S.J. Galli, J. Kalesnikoff, M.A. Grimbaldeston et al. // Annu. Rey. Immunol. – 2005. – Vol. 23. – P. 749-786. 257. Mast cells promote atherosclerosis by releasing proinflammatory cytokines / J. Sun, G.K. Sukhova, P.J. Wolters et al. // Nat. Med. – 2007. – Vol. 13. – P. 719-724. 258. Matthias, D. Homocysteine induced arteriosclerosis-like alterations of the aorta in normotensive and hypertensive rats following application of high doses of methionine / D. Matthias, C.H. Becker, R. Riezler, P.H. Kindling // Atherosclerosis/ 1996. – Vol. 122. – P. 201–216. 259. McCully, K.S. Vascular pathology of homocysteinemia: implications for the pathogenesis of arteriosclerosis // Am. J. Pathol. – 1969. – Vol. 56. – P.111–128. 260. McCully, K.S. Homocysteine theory of arteriosclerosis / K.S. McCully, R.B. Wilson // Atheroscerosis, 1975. – Vol. 2. – P. 215-227. 261. Mishra, P. Oxidative stress and heart failure in altered thyroid States / P. Mishra, L. Samanta // ScientificWorldJournal. 2012; 2012:741861. doi: 10.1100/2012/741861. 262. Mitu, F. Prevalence of cardiovascular diseases in patients with hypothyroidism / F. Mitu, E. Cojocaru, B. Tamba, M.M. Leon // Rev Med Chir Soc Med Nat Iasi. - 2012. – Vol. 116(2). – P. 413-418. 263. Mohanta, S.K. Artery tertiary lymphoid organs contribute to innate and adaptive immune responses in advanced mouse atherosclerosis / S.K. Mohanta, C. Yin, L. Peng, P. Srikakulapu, V. Bontha, D. Hu, F. Weih, C. Weber, N. Gerdes, A.J. Habenicht // Microcirculation. – 2004. – Vol. 11(7). – P. 597-603. 158 264. Muretto, P. Lymphoid follicles in extranodal sites: an immunohistochemical study / P. Muretto // Eur. J. Histochem. – 1994. – V. 38. – P. 219-228. 265. Nakano, T. Study of type I and IV collagenase activity in human thyroid diseases / T. Nakano, T. Kusunoki, K. Funasaka, K. Murata, S. Nishida, T. Tomura // Nippon-Jibiinkoka-Gakkai-Kaiho. – 1995. - Vol.98(6). - P. 937-941. 266. Nilsson, M. Transforming growth factor-beta promotes epidermal growth factor-induced thyroid cell migration and follicle neoformation in collagen gel separable from cell proliferation / M. Nilsson, T. Dahlman, B. Westermark, K. Westermark // Exp. Cell. Res. – 1995. - Vol. 220 (2). - P. 257-265. 267. Ohno, S.Three-stages studies of cytosceletal organizations in cultured thyroid cells by quick-frosting and deep-pickling methods / S. Ohno, N. Takasu // Electron. Microsc. – 1989. - Vol. 38 (5). - P. 352-362. 268. Owecki, M. Serum homocysteine levels are decreased in levothyroxinetreated women with autoimmune thyroiditis / M. Owecki, J. Dorszewska, N. SawickaGutaj, A. Oczkowska, M.K. Owecki, M. Michalak, J. Fischbach, W. Kozubski, M. Ruchała // BMC Endocr Disord. - 2014. – Vol. 14(1). – P. 18. 269. Parker VJ, Solano ME, Arck PC, Douglas AJ. Diet-induced obesity may affect the uterine immune environment in early-mid pregnancy, reducing NK-cell activity and potentially compromising uterine vascularization // Int J Obes (Lond). 2014 Jun;38(6):766-74. doi: 10.1038/ijo.2013.164. Epub 2013 Sep 4. 270. Pasqualetti, G. Is subclinical hypothyroidism a cardiovascular risk factor in the elderly? / G. Pasqualetti, S. Tognini, A. Polini, N. Caraccio, F. Monzani // J Clin Endocrinol Metab. – 2013. – Vol. 98(6). – P. 2256-2266. 271. Pearse, A.G. Calcitonin and the C cells: role model for neuroendocrine system // Bone Miner. – 1992. - Vol. 16 (3). - P. 166-168. 272. Posadas-Romero C, Jorge-Galarza E, Posadas-Sánchez R, Acuña-Valerio J, Juárez-Rojas JG, Kimura-Hayama E, Medina-Urrutia A, Cardoso-Saldaña GC. Fatty liver largely explains associations of subclinical hypothyroidism with insulin resistance, metabolic syndrome, and subclinical coronary atherosclerosis. Eur J Endocrinol. 2014 Sep;171(3):319-25. doi: 10.1530/EJE-14-0150. 159 273. Pursnani, S.The effect of aging on the association between coronary heart disease risk factors and carotid intima media thickness: an analysis of the Atherosclerosis Risk in Communities (ARIC) cohort / S. Pursnani, M. Diener-West, A.R. Sharrett // Atherosclerosis. – 2014. – Vol. 233(2). – P. 441-446. 274. Ranthe, M.F. Pregnancy loss and later risk of atherosclerotic disease / M.F. Ranthe, E.A. Andersen, J. Wohlfahrt, H. Bundgaard, M. Melbye, H.A. Boyd // Circulation. – 2013. – Vol. 127(17). – P. 1775-1782. 275. Redmond, O.Mitotic rate of rat thyroid follicular cells in vivo in response to a signal injection of Thyrotropin (TSH) / O. Redmond, A.R. Tuffery // Cell and Tissue Kinet. – 1981. – Vol. 14, №6. – P. 625-631. 276. Ridker, P.M. C-reactive protein and the prediction of cardiovascular events among those at intermediate risk: moving an inflammatory hypothesis toward consensus / P.M. Ridker // Am. Coll. Cardiol. – 2007. – Vol.49. – P. 2129-2138. 277. Ridker, P.M. Novel risk factors for systemic atherosclerosis: a comparison of C-reactive protein, fibrinogen, homocysteine, lipoprotein(a), and standard cholesterol screening as predictors of peripheral arterial diseases / P.M. Ridker, M.J. Stampfer, N. Rifai // JAMA. – 2001. – Vol. 285. – P. 2481-2485. 278. Ritchie, J. High-risk clinical presentations in atherosclerotic renovascular disease: prognosis and response to renal artery revascularization / J. Ritchie, D. Green, C. Chrysochou, N. Chalmers, R.N. Foley, P.A. Kalra // Am J Kidney Dis. – 2014. – Vol. 63(2). – P. 186-197. 279. Rolland, P.H. Hyperhomocysteinemia-induced vascular damage in the minipig: captopril-hydrochlorothiazide combination prevents elastic alterations / P.H. Rolland, A. Friggi, A. Barlatier, P. Piquet, V. Latrille, M.M. Faye, J. Guillou, P. Charpiot, H. Bodard, O. Ghiringhelli, R. Calaf, R. Luccioni, D. Garçon // Circulation. 1995. –Vol. 91. – P. 1161–1174. 280. Ross, R. Hyperlipidemia and atherosclerosis. / R. Ross, L. Harker // Science. – 1976. – Vol. 193. – P. 1094-1100. 281. Ross, R. The pathogenesis of atherosclerosis – an update. / R. Ross // N. Engl. J. Med. – 1986. – Vol. 314. – P. 489-500 160 282. Rottenberg, N. Aspects of the thyroid gland vascularization in young organisms (a morphological and radioisotope-based study) / N. Rottenberg, F. Rottenberg, P. Matusz // Rev. Roum. morphol., embryol. et physiol. – 1990 - Vol. 36(1). - P. 3-8. 283. Russolino, F. Actions of molecules wich regulate hemopoesis on endothelial cells: memoirs of common ancestor / F. Russolino, E. Bocchietto, F. Silvagno // Pathol. Res. Pract. - 1994. - Vol. 190/ - №9-10. - P. 834-839. 284. Scherer, E.B. Chronic mild hyperhomocysteinemia alters ectonucleotidase activities and gene expression of ecto-5'-nucleotidase/CD73 in rat lymphocytes / E.B. Scherer, L.E. Savio, F.C. Vuaden, A.G. Ferreira, M.R. Bogo, C.D. Bonan, A.T. Wyse // Mol Cell Biochem. – 2012. – Vol. 362 (1-2). – P. 187-194. 285. Schiffrin, E.L. Chronic kidney disease: effects on the cardiovascular system / E.L. Schiffrin, M.L. Lipman, J.F. Mann // Circulation, 2007 Jul 3; 116(1): P. 85-97. 286. Schumacher A, Wafula PO, Teles A, El-Mousleh T, Linzke N, Zenclussen ML, Langwisch S, Heinze K, Wollenberg I, Casalis PA, Volk HD, Fest S, Zenclussen AC. Blockage of heme oxygenase-1 abrogates the protective effect of regulatory T cells on murine pregnancy and promotes the maturation of dendritic cells // PLoS One. 2012;7(8):e42301. doi: 10.1371/journal.pone.0042301. Epub 2012 Aug 10. 287. Shenoy, V. Correlation of serum homocysteine levels with the severity of coronary artery disease / V. Shenoy, V. Mehendale, K. Prabhu, R. Shetty, P. Rao // Indian J Clin Biochem. – 2014. – Vol. 29(3). – P. 339-344. 288. Shi, G.P. Mast cells in abdominal aortic aneurysms / G.P. Shi, J.S. Lindholt // Am J Physiol Heart Circ Physiol. – 2012. – Vol. 302(12). – P. 2612-2621. 289. Shrestha R, Millington O, Brewer J, Bushell T. Lymphocytes protect cortical neurons against excitotoxicity mediated by kainic acid, an in vitro model for neurodegeneration // Kathmandu Univ Med J (KUMJ). 2013 Apr-Jun;11(42):132-8. 290. Smith, D.D. Mast cell deficiency attenuates progression of atherosclerosis and hepatic steatosis in apolipoprotein E-null mice / D.D. Smith, X. Tan, V.V. Raveendran, O. Tawfik, D.J. Stechschulte, K.N. Dileepan // Atherosclerosis. – 2009. – Vol. 207(1). – P.59-67. 161 291. Song, J. Association between risk factors for vascular dementia and adiponectin / J. Song, W.T. Lee, K.A. Park, J.E. Lee // Biomed Res Int. 2014; 2014: 261672. doi: 10.1155/2014/261672. 292. Stamler, J.S. Adverse vascular effects of homocysteine are modulated by endothelium-derived relaxing factor and related oxides of nitrogen / J.S. Stamler, J.A. Osborne, O. Jaraki, L.E. Rabbani, M. Mullins, D. Singel, J. Loscalzo // Clin. Invest. – 1993. – Vol. 91. – P. 308–318. 293. Stefanski V, Hemschemeier SK, Schunke K, Hahnel A, Wolff C, Straub RH. Differential effect of severe and moderate social stress on blood immune and endocrine measures and susceptibility to collagen type II arthritis in male rats // Brain Behav Immun. 2013 Mar;29:156-65. doi: 10.1016/j.bbi.2012.12.019. Epub 2013 Jan 4. 294. Stranford, S. Follicular dendritic cells, conduits, lymphatic vessels, and high endothelial venules in tertiary lymphoid organs: Parallels with lymph node stroma / S. Stranford, N.H. Ruddle // Front Immunol. - 2012. – Vol. 3. – P. 350. 295. Stuhlinger, M.C. Endothelial dysfunction induced by hyperhomocyst(e)inemia: role of asymmetric dimethylarginine / M.C. Stuhlinger, R.K. Oka, E.E. Graf, I. Schmolzer, B.M. Upson, O. Kapoor, A. Szuba, M.R. Malinow, T.C. Wascher, O. Pachinger, J.P. Cooke // Circulation. – 2003. – Vol. 108. – P. 933–8. 296. Stuhlinger, M.C.Homocysteine impairs the nitric oxide synthase pathway: role of asymmetric dimethylarginine / M.C. Stuhlinger, P.S. Tsao, J.H. Her, M. Kimoto, R.F. Balint, J.P. Cooke // Circulation. – 2001. –Vol. 104. – P. 2569–2575. 297. Sudduth, T.L. β-amyloid deposition is shifted to the vasculature and memory impairment is exacerbated when hyperhomocysteinemia is induced in APP/PS1 transgenic mice / T.L. Sudduth, E.M. Weekman, H.M. Brothers, K. Braun, D.M. Wilcock // Alzheimers Res Ther. – 2014. – Vol. 6(3). – P. 32. 298. Suzuki, A. Calcium response and F cepsilon RI expression in bone marrowderived mast cells co-cultured with SCG neuritis / A. Suzuki, R. Suzuki, T. Furuno, R. Teshima, M. Nakanishi // Biol. Pharm. Bull. – 2005. – V. 28, №10. – P. 1963-1965. 162 299. Swanson, D.A.Targeted disruption of the methionine synthase gene in mice / D.A. Swanson, M.L. Liu, P.J. Baker, L. Garrett, M. Stitzel, J. Wu, M. Harris, R. Banerjee, B. Shane, L.C. Brody // Mol. Cell. Biol. – 2001. – Vol. 21 – P. 1058–1065. 300. Tailor, A. Hypercholesterolemia promotes leukocyte-dependent platelet adhesion in murine postcapillary venules / A. Tailor, D.N. Granger // J Immunol. – 2013. – Vol. 191(1). – P. 448-455. 301. Teles A, Thuere C, Wafula PO, El-Mousleh T, Zenclussen ML, Zenclussen AC. Origin of Foxp3(+) cells during pregnancy // Am J Clin Exp Immunol. 2013 Oct 16;2(3):222-33. eCollection 2013. 302. The association of mast cells and atherosclerosis: a morphologic study of early atherosclerotic lesions in young people / J.B. Atkinson, C.W. Harlan, G.C. Harlan et al. // Hum. Pathol. – 1994. – Vol. 25. – P. 154-159. 303. Thomas, G.A. Calcitonin transfer from C to follicular cell in the thyroid: Abstr. 165th Meet. Pathol. Soc. Great Britain and Ireland, Manchester6 9-11 July, 1992 / G.A. Thomas, H.G. Davies, N. Thomas // Pathol. – 1992. – Vol.168. – P.131. 304. Thuere C, Zenclussen ML, Schumacher A, Langwisch S, Schulte-Wrede U, Teles A, Paeschke S, Volk HD, Zenclussen AC. Kinetics of regulatory T cells during murine pregnancy // Am J Reprod Immunol. 2007 Dec;58(6):514-23. 305. Troen, A.M. The atherogenic effect of excess methionine intake/ A.M. Troen, E. Lutgens, D.E. Smith, I.H. Rosenberg, J. Selhub // Proc. Natl. Acad. Sci. USA. – 2003. – Vol. 100. – P. 15089–15094. 306. Tsaousi, A. 171 Deleting TH1-lymphocytes Influences Macrophage Activation and Metalloproteinase Expression in apoe Null Mice / A. Tsaousi, E. Hayes, A. Thomas, L. Bevan, A. Newby // Heart (British Cardiac Society). - 2014. – Vol. 100. – P. A97. 307. Tseng, F.Y. Subclinical hypothyroidism is associated with increased risk for all-cause and cardiovascular mortality in adults / F.Y. Tseng, W.Y. Lin, C.C. Lin, L.T. Lee, T.C. Li, P.K. Sung, K.C. Huang // J Am Coll Cardiol. – 2012. – Vol.60(8). – P. 730-737. 163 308. Tsuboi, K. Role of high endothelial venule-expressed heparan sulfate in chemokine presentation and lymphocyte homing / K. Tsuboi, J. Hirakawa, E. Seki, Y. Imai, Y. Yamaguchi, M. Fukuda, H. Kawashima // J Immunol. – 2013. – Vol. 190(5). – P. 2036-2048. 309. Uchiyama, R. Role of regulatory T cells in atheroprotective effects of granulocyte colony-stimulating factor / R. Uchiyama, H. Hasegawa, Y. Kameda, K. Ueda, Y. Kobayashi, I. Komuro, H. Takano // J Mol Cell Cardiol. – 2012. – Vol. 52(5). – P. 1038-1047. 310. Undas, A. Folic acid administration and antibodies against homocysteinylated proteins in subjects with hyperhomocysteinemia / A. Undas, E. Stepien, R. Glowacki et al. // Thromb. Haemost. – 2006. – Vol. 96. – P. 342-347. 311. Ungvari, Z. Increased superoxide production in coronary arteries in hyperhomocysteinemia: role of tumor necrosis factor-alpha, NAD(P)H oxidase, and inducible nitric oxide synthase / Z. Ungvari, A. Csiszar, J.G. Edwards, P.M. Kaminski, M.S. Wolin, G. Kaley, A. Koller //Arterioscl. Thromb. Vasc. Biol. – 2003. – Vol. 23. P. 418–24. 312. Ungvari, Z. Dysfunction of nitric oxide mediation in isolated rat arterioles with methionine diet-induced hyperhomocysteinemia / Z. Ungvari, P. Pacher, K. Rischak, L. Szollar, A. Koller // Arterioscl. Thromb. Vasc. Biol. – 1999. – Vol. 19. – P. 1899–904. 313. Upchurch, G.R. Homocyst(e)ine decreases bioavailable nitric oxide by a mechanism involving glutathione peroxidase / G.R. Upchurch, G.N. Welch, A.J. Fabian, J.E. Freedman, J.L. Johnson, J.F.Keaney, J. Loscalzo // Biol. Chem. – 1997. – Vol. 272. – P. 17012–17017. 314. Urruticoechea, A. Proliferation marker Ki-67 in early breast cancer / A. Urruticoechea, I.E. Smith, M. Dowsett // Clin. Oncol. – 2005. – Vol. 23(28). – P. 72127220. 315. Valentina, V.N. Subclinical hypothyroidism and risk to carotid atherosclerosis / V.N. Valentina, B. Marijan, D. Chedo, K. Branka // Arq Bras Endocrinol Metabol. – 2011. – Vol. 55(7). – P. 475-480. 164 316. Vallance, P. The asymmetrical dimethylarginine/dimethylarginine dimethylaminohydrolase pathway in the regulation of nitric oxide production // Clin. Sci. – 2001. – Vol. 100. – P. 159–60. 317. Vlachopoulos, C.Testosterone deficiency: a determinant of aortic stiffness in men / C. Vlachopoulos, N. Ioakeimidis, M. Miner, A. Aggelis, P. Pietri, D. TerentesPrintzios, D. Tsekoura, C. Stefanadis // Atherosclerosis. – 2014. – Vol. 233(1). – P. 278283. 318. Wang HY, Gao WT, He QH, Yang C, Gu W, Yan J, Jiang JX. Endogenous glucocorticoid increases the basal level of Treg-Th17 balance under early phase of stress // Chin J Traumatol. 2012;15(6):323-8. 319. Wang, P. Vascular smooth muscle cell apoptosis is an early trigger for hypothyroid atherosclerosis / P. Wang, T.Y. Xu, Y.F. Guan, Y. Zhao, Z.Y. Li, X.H. Lan, X. Wang, P.Y. Yang, Z.M. Kang, P.M. Vanhoutte, C.Y. Miao // Cardiovasc Res. 2014. – Vol. 102(3). – P. 448-459. 320. Wang, S. Oxidative stress in rats with hyperhomo-cysteinemia and intervention effect of lutein / S. Wang, M. Wang, S. Zhang, L. Zhao // Eur Rev Med Pharmacol Sci. – 2014. – Vol. 18(3). – P. 359-364. 321. Watanabe, M. Mice deficient in cystathionine β-synthase: animal models for mild and severe homocyst(e)inemia / M. Watanabe, J. Osada, Y. Aratani, K. Kluckman, R. Reddick, M.R. Malinow, N. Maeda // Proc. Natl. Acad. Sci. USA. - 1995. – Vol. 92. – P. 1585– 1589. 322. Weiss, N. Cellular redox state and endothelial dysfunction in mildly hyperhomocysteinemic cystathionine beta-synthase-deficient mice / N. Weiss, S. Heydrick, Y.Y. Zhang, C. Bierl, A. Cap, J. Loscalzo // Arterioscl. Thromb. Vasc. Biol. – 2002. – Vol.22 – P. 34–41. 323. Weiss, N. Overexpression of cellular glutathione peroxidase rescues homocyst(e)ine-induced endothelial dysfunction / N. Weiss, Y.Y. Zhang, S. Heydrick, C. Bierl, J. Loscalzo // Proc. Natl. Acad. Sci. USA. – 2001. – Vol. 98. – P. 12503– 12508. 165 324. Welch, G.N. Homocysteine and atherothrombosis / G.N. Welch, J. Loscalzo // N. Eng. J. Med. – 1998. – Vol. 338 – P. 1042–1050. 325. Willerson, J.T. Inflammation as a Cardiovascular Risk Factor. / J.T. Willerson, R.M. Ridker // Circulation. – 2004. – Vol. 21. – Suppl. 1. – P. 2-10. 326. Wedemeyer, J. Mast cells and basophiles in acquired immunity / J. Wedemeyer, S.J. Galli // Br. Med. Bull. – 2000. – Vol. 56(4). – P. 936-955. 327. Westermark, K. Epidermal growth factor receptors and receptor localization in thyroid follicule cells // Growth Regul. Thyroid Gland and Thyroid Tumors Workshop, Dusseldorf . -1988-1989. - P. 28-34. 328. World Health Organization. Cardiovascular diseases (CVDs), 2013. http://www.who.int/mediacentre/factsheets/fs317/en/. 329. Xiang, G.D. Postprandial lipaemia suppresses endothelium-dependent arterial dilation in patients with hypothyroidism / G.D. Xiang, L.W. Xiang, H.L. He, L.S. Zhao // Endocrine. – 2012. – Vol. 42(2). – P. 391-398. 330. Yamasaki, M. Comparative anatomical studies on the thyroid and thymic arteries. III. Guinea pig (Cavia cobaya) // Anat. – 1995 - Vol., 186 (pt 2). - P. 383-393. 331. Zhang, R. Mild hyperhomocysteinemia induced by feeding rats diets rich in methionine or deficient in folate promotes early atherosclerotic inflammatory processes / R. Zhang, J. Ma, M. Xia, H. Zhu, W. Ling // Nutr. - 2004. – Vol. 134. – P. 825–830. 332. Zhang Y, Kim BK, Chang Y, Ryu S, Cho J, Lee WY, Rhee EJ, Kwon MJ, Rampal S, Zhao D, Pastor-Barriuso R, Lima JA, Shin H, Guallar E. Thyroid Hormones and Coronary Artery Calcification in Euthyroid Men and Women. Arterioscler Thromb Vasc Biol. 2014 Jul 24. pii: ATVBAHA.114.303889. 333. Zhao, S.Z. Flow in carotid bifurcations: effect of the superior thyroid artery / S.Z. Zhao, X.Y. Xu, M.W. Collins, A.V. Stanton, A.D. Hughes, S.A. Thom // Med. Eng. Phys. – 1999. - Vol. 21. - P. 207-214. 334. Zhou, J. Dietary supplementation with methionine and homocysteine promotes early therosclerosis but not plaque rupture in apoE-deficient mice / J. Zhou, J. Moller, C.C. Danielson, J. Bentzon, H.B. Ravn, R.C. Austin, E. Falk // Arterioscl. Thromb. Vasc. Biol. – 2001. – Vol. 21. – P. 1470–1476. 166 335. Zhou, J. Effects of vitamin supplementation and hyperhomocysteinemia on atherosclerosis in apoE-deficient mice / J. Zhou, J. Moller, M. Ritskes-Hoitinga, M.L. Larsen, R.C. Austin, E. Falk //Atheroscl. – 2003. – Vol. 168. – P. 255–262. 336. Zhou, J. Association of multiple cellular stress pathways with accelerated atherosclerosis in hyperhomocysteinemic apolipoprotein E-deficient mice / J. Zhou, G.H. Werstuck, S. Lhotak, A.B.L. de Koning, S.K. Sood, G.S. Houssain, J. Moller, M. Ritskes-Hoitinga, E. Falk, S. Dayal, S.R. Lentz, R.C. Austin // Circulation. – 2004. – Vol. 110. – P. 207–213. 337. Zulli, A. High dietary methionine plus cholesterol exacerbates atherosclerosis formation in the left main coronary artery of rabbits / A. Zulli, D.L. Hare, B.F. Buxton, M.J. Black // Atheroscl. – 2004. – Vol. 176. – P. 83–89. 167