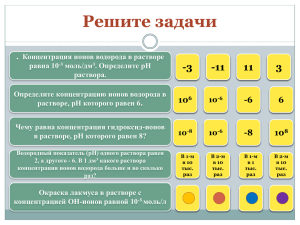
Домашнее задание №2 1. Используя величину свободной
реклама

Домашнее задание №2 1. Используя величину свободной энергии гидратации (-157 кДж/моль), определите радиус гидратированного электрона по Борну. Сравните эту величину с радиусом, определенным из диффузионной кинетики (0.25 нм). Каковы возможные причины различия? Сравните радиус e-(aq) с радиусами галогенид-анионов. 2. Найдите значение рН, при котором в насыщенном водородом растворе с содержанием ионов соответствующего металла 10-6 М будут самопроизвольно растворяться Fe, Сu, Pb, Al, Ag, Cr, Co. Предполагайте при этом, что оксидные пленки на поверх-ности металлов не образуются. 3. Найдите эквивалентные электропроводности раствора 0,01 M LiCl в воде и метаноле при температуре 298 К. Диэлектрические постоянные этих растворителей составляют 78,3 и 32,6, вязкости – 0,89 и 0,55 мПа⋅с соответственно. Предельное значение эквивалентной электропроводности в воде – 1,15⋅10-2, в метаноле – 9,1⋅10-3 См⋅м2/г-экв. 4. Рассчитайте ионный состав 0.01 М раствора L-лизина в воде, если его ступенчатые pKa при 25 оС равны 2.16, 9.08, 10.54. 5. Cтандартные потенциалы редокс-систем Cu+/Cu и Cu2+/Cu составляют при температуре 298 К 0,520 и 0,337 В (с.в.э.) соответственно. Определите стандартный потенциал редокс-системы Cu2+/Cu+. Чему он равен в шкале RHE (обратимый водородный электрод в том же растворе) при pH=1.5? 6. При какой скорости вращения дискового электрода с видимой поверхностью 1 см2 предельный диффузионный ток восстановления вещества Ox (при его постоянной концентрации) окажется равным полярографическому предельному диффузионному току, измеренному в таком же растворе на капилляре с периодом капания 10 с и скоростью вытекания ртути 1 мг/с? Температура 25 оС, коэффициент диффузии Ox в водном растворе 10-5 см2/с. 7. Как изменится скорость восстановления аниона с зарядом -3 при увеличении концентрации 1,1-электролита фона от 1 до 100 мМ и заряде поверхности -10 мкКл/см2? Примите коэффициент переноса α = 0,5. 8. Зная величину стандартного потенциала гидратированного электрона относительно НВЭ (E0 = -2.87 В) составьте термодинамический цикл, который позволил бы оценить величину стандартной свободной энергии гидратации атома водорода (Н). Используйте следующие дополнительные данные: 1) Для процесса H(aq) + OH-(aq) ↔ e-(aq) + H2O константы скорости прямой и обратной реакции составляют 1.8x107 и 16 М-1 с-1, соответственно. 2) Для реакции ½ H2(gas) Æ H(gas) величина ∆G0 = +203.5 кДж/ моль. 9. Рассчитайте изменение рН раствора 0.005 М НCOOH + 0.01 М НCOONa + 0.03 M NaCl при пропускании через него газообразного НCl до достижения концентрации HCl, равной 9⋅10-3 М. На сколько мВ в результате добавления HCl изменится потенциал водородного электрода в исследуемом растворе? Принять при 25°C pK(НCOOH) равным 3.75, диэлектрическую постоянную равной 78.4.