Лутошкинx - Сибирский федеральный университет
реклама
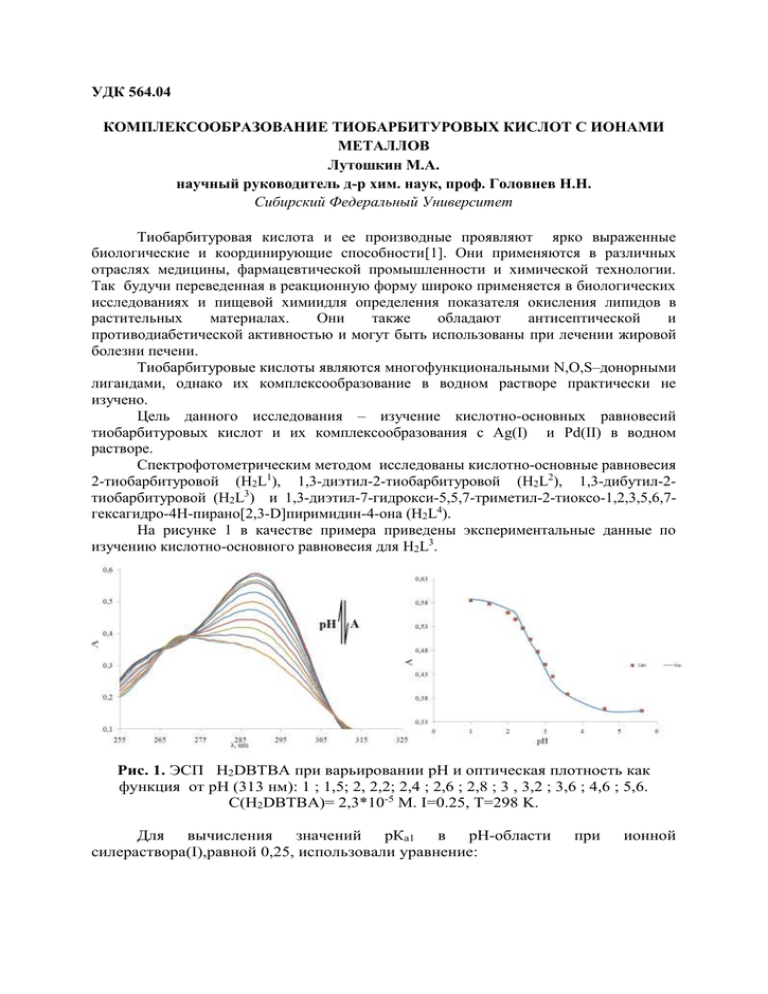
УДК 564.04 КОМПЛЕКСООБРАЗОВАНИЕ ТИОБАРБИТУРОВЫХ КИСЛОТ С ИОНАМИ МЕТАЛЛОВ Лутошкин М.А. научный руководитель д-р хим. наук, проф. Головнев Н.Н. Сибирский Федеральный Университет Тиобарбитуровая кислота и ее производные проявляют ярко выраженные биологические и координирующие способности[1]. Они применяются в различных отраслях медицины, фармацевтической промышленности и химической технологии. Так будучи переведенная в реакционную форму широко применяется в биологических исследованиях и пищевой химиидля определения показателя окисления липидов в растительных материалах. Они также обладают антисептической и противодиабетической активностью и могут быть использованы при лечении жировой болезни печени. Тиобарбитуровые кислоты являются многофункциональными N,O,S–донорными лигандами, однако их комплексообразование в водном растворе практически не изучено. Цель данного исследования – изучение кислотно-основных равновесий тиобарбитуровых кислот и их комплексообразования с Ag(I) и Pd(II) в водном растворе. Спектрофотометрическим методом исследованы кислотно-основные равновесия 2-тиобарбитуровой (H2L1), 1,3-диэтил-2-тиобарбитуровой (H2L2), 1,3-дибутил-2тиобарбитуровой (H2L3) и 1,3-диэтил-7-гидрокси-5,5,7-триметил-2-тиоксо-1,2,3,5,6,7гексагидро-4Н-пирано[2,3-D]пиримидин-4-она (H2L4). На рисунке 1 в качестве примера приведены экспериментальные данные по изучению кислотно-основного равновесия для H2L3. Рис. 1. ЭСП H2DBTBA при варьировании pH и оптическая плотность как функция от pH (313 нм): 1 ; 1,5; 2, 2,2; 2,4 ; 2,6 ; 2,8 ; 3 , 3,2 ; 3,6 ; 4,6 ; 5,6. C(H2DBTBA)= 2,3*10-5 M. I=0.25, T=298 K. Для вычисления значений рКа1 в рН-области силераствора(I),равной 0,25, использовали уравнение: при ионной Ai C HL ( L K a HL [ H ]) K a [H ] . Для нахождения констант протонирования в сильно кислых средах использовали нелинейное уравнение Кокса-Эйтса, основанного на использовании остаточной функции кислотности: AHL AH L 2 Ai AH L , 2 CH ( m* ) 1 ( )10 KH гдеAi, AHL(εHL),AH2L+(εH2L+) и AL-(εL-) оптическая плотность и молярный коэффициент экстинкции раствора, лиганда, сопряженной кислоты или основания, соответственно. Для исследуемых лигандов (H2L) кислотно-основные равновесия можно представить обобщенной схемой: Установлено что значение pKa1и pKa2изменяется в ряду лигандовH2L1<H2L2H2L3<H2L4. Для 1,3-замещенных 2-тиобарбитуровой кислоты порядок изменения Ka1 иKa2соответствует электронным эффектам заместителей. Однако на практике часто сольватационные эффекты оказываются более важными. Квантовохимическими расчетами (DFT/CC-PVDZ/PBE0/SMD) показано, что самыми устойчивыми нейтральными формами H2L1, H2L2и H2L3являются кето-формы и енольные формы протонированные через атом кислорода. В водном растворе существует равновесие: Спектрофотометрическим методом изучено комплексообразование 1,3замещенных 2-тиобарбиутровой кислоты с Ag(I) и Pd(II) при различных кислотностях и ионных силах водного раствора. Рис.2. Электронные спектры поглощения при разных кислотностях раствора: дляH2L1 (A1–CPdCl4=5.5*10-5, 𝐶𝐻2 𝐿1 =(1.1–15) * 10-4M) , для H2L2 (А2–СAg= (0,02–2,1)*10-3M, 𝐶𝐻2 𝐿2 =2.05*10-4) Для серебра с H2L2 в водном растворе установлено присутствие моно- и биядерного комплекса. При повышении кислотности условные константы устойчивости уменьшаются, что можно объяснить конкурирующими кислотноосновными реакциями. В зависимости от кислотности водного раствора логарифмы условных констант устойчивости для монокомплекса Ag(I) сH2L2 варьируются в пределах от 2,2 до 3,8, в случае биядерного комплекса от 5,2 до 6,5. ПредложенаS,O-координация лиганда H2L3, которая подтвержденаквантово-химическими расчетами и, косвенно, аналогичной координацией в синтезированном твердом комплексеAgHL2[1], установленной методом РСА. Логарифмы констант устойчивости монокомплексовPd(II) практически не зависят от типа лигандов(H2L1, H2L2и H2L3)и в зависимости от CCl- лежат в пределах от 3,5до 4,1. Значения констант не зависят от кислотности раствора и уменьшаются с ростом концентрациихлорид-ионов. Отсутствие влияние кислотности свидетельствует о S-координации лигандов. Основные выводы: - В рН- и сильнокислых областях водного раствора определены константы кислотно-основных равновесий четырех тиобарбитуровых кислот. Величины -pKa1 изменяются в пределах от 1,5– 3,2, а pKa2–от 2,2 до 5,8. - квантовохимическими расчетами (DFT/CC-PVDZ/PBE0/SMD) показано, что в водных растворах H2L1, H2L2и H2L3 кето-енольное равновесие смещено в сторону кетоформы, а протонированные формы имеют структуру енольного таутомера, с координацией зарядообразующего протона через атом кислорода. -определены константы устойчивости моно- и биядерных комплексов 2 + серебра(I) с H2L при I и CH =1;0.5;0.1; 0,04, а также моно- и билигандного комплексовH2L1, H2L2и H2L3 с Pd(II) при CHCl = 1 или 2M и такой же ионной силе. Список литературa: 1 - Synthesis and structure–activity relationship of thiobarbituric acid derivatives as potent inhibitors of urease - Khalid Mohammed Khan et al. - Bioorganic & Medicinal Chemistry Volume 22, Issue 15, 1 August 2014, Pages 4119–4123 2 - Crystal Structure of catena-(µ4-1,3-Diethyl-2-thiobarbiturato-O,O’,S,S’)silver(I)Coordintaion compound –N.N.Golovnev et al.