Некоторые качественные реакции неорганических соединений и изменения, сопровождающие химические превращения
реклама
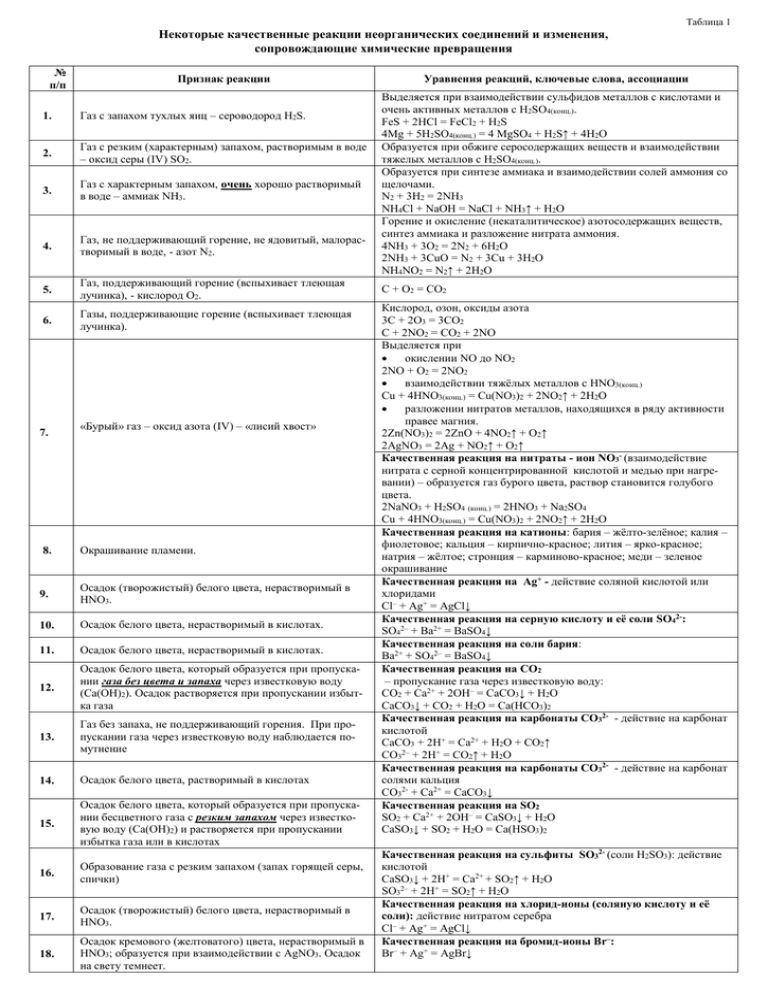
Таблица 1 Некоторые качественные реакции неорганических соединений и изменения, сопровождающие химические превращения № п/п Признак реакции 1. Газ с запахом тухлых яиц – сероводород H2S. 2. Газ с резким (характерным) запахом, растворимым в воде – оксид серы (IV) SO2. 3. Газ с характерным запахом, очень хорошо растворимый в воде – аммиак NH3. 4. Газ, не поддерживающий горение, не ядовитый, малорастворимый в воде, - азот N2. 5. Газ, поддерживающий горение (вспыхивает тлеющая лучинка), - кислород O2. 6. Газы, поддерживающие горение (вспыхивает тлеющая лучинка). 7. «Бурый» газ – оксид азота (IV) – «лисий хвост» 8. Окрашивание пламени. 9. Осадок (творожистый) белого цвета, нерастворимый в HNO3. 10. Осадок белого цвета, нерастворимый в кислотах. 11. Осадок белого цвета, нерастворимый в кислотах. 12. Осадок белого цвета, который образуется при пропускании газа без цвета и запаха через известковую воду (Ca(OH)2). Осадок растворяется при пропускании избытка газа 13. Газ без запаха, не поддерживающий горения. При пропускании газа через известковую воду наблюдается помутнение 14. Осадок белого цвета, растворимый в кислотах 15. Осадок белого цвета, который образуется при пропускании бесцветного газа с резким запахом через известковую воду (Ca(OH)2) и растворяется при пропускании избытка газа или в кислотах 16. Образование газа с резким запахом (запах горящей серы, спички) 17. Осадок (творожистый) белого цвета, нерастворимый в HNO3. 18. Осадок кремового (желтоватого) цвета, нерастворимый в HNO3; образуется при взаимодействии с AgNO3. Осадок на свету темнеет. Уравнения реакций, ключевые слова, ассоциации Выделяется при взаимодействии сульфидов металлов с кислотами и очень активных металлов с H2SO4(конц.). FeS + 2HCl = FeCl2 + H2S 4Mg + 5H2SO4(конц.) = 4 MgSO4 + H2S↑ + 4H2O Образуется при обжиге серосодержащих веществ и взаимодействии тяжелых металлов с H2SO4(конц.). Образуется при синтезе аммиака и взаимодействии солей аммония со щелочами. N2 + 3H2 = 2NH3 NH4Cl + NaOH = NaCl + NH3↑ + H2O Горение и окисление (некаталитическое) азотосодержащих веществ, синтез аммиака и разложение нитрата аммония. 4NH3 + 3O2 = 2N2 + 6H2O 2NH3 + 3CuO = N2 + 3Cu + 3H2O NH4NO2 = N2↑ + 2H2O C + O2 = CO2 Кислород, озон, оксиды азота 3C + 2O3 = 3CO2 C + 2NO2 = CO2 + 2NO Выделяется при окислении NO до NO2 2NO + O2 = 2NO2 взаимодействии тяжёлых металлов с HNO3(конц.) Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O разложении нитратов металлов, находящихся в ряду активности правее магния. 2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑ 2AgNO3 = 2Ag + NO2↑ + O2↑ Качественная реакция на нитраты - ион NO3- (взаимодействие нитрата с серной концентрированной кислотой и медью при нагревании) – образуется газ бурого цвета, раствор становится голубого цвета. 2NaNO3 + H2SO4 (конц.) = 2HNO3 + Na2SO4 Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2↑ + 2H2O Качественная реакция на катионы: бария – жёлто-зелёное; калия – фиолетовое; кальция – кирпично-красное; лития – ярко-красное; натрия – жёлтое; стронция – карминово-красное; меди – зеленое окрашивание Качественная реакция на Ag+ - действие соляной кислотой или хлоридами Cl– + Ag+ = AgCl↓ Качественная реакция на серную кислоту и её соли SO42-: SO42– + Ba2+ = BaSO4↓ Качественная реакция на соли бария: Ba2+ + SO42– = BaSO4↓ Качественная реакция на CO2 – пропускание газа через известковую воду: CO2 + Ca2+ + 2OH– = CaCO3↓ + H2O CaCO3↓ + CO2 + H2O = Ca(HCO3)2 Качественная реакция на карбонаты CO32- - действие на карбонат кислотой CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ CO32– + 2H+ = CO2↑ + H2O Качественная реакция на карбонаты CO32- - действие на карбонат солями кальция CO32- + Ca2+ = CaCO3↓ Качественная реакция на SO2 SO2 + Ca2+ + 2OH– = CaSO3↓ + H2O CaSO3↓ + SO2 + H2O = Ca(HSO3)2 Качественная реакция на сульфиты SO32- (соли H2SO3): действие кислотой CaSO3↓ + 2H+ = Ca2+ + SO2↑ + H2O SO32– + 2H+ = SO2↑ + H2O Качественная реакция на хлорид-ионы (соляную кислоту и её соли): действие нитратом серебра Cl– + Ag+ = AgCl↓ Качественная реакция на бромид-ионы Br–: Br– + Ag+ = AgBr↓ 19. 20. 21. 22. 23. 24. 25. Осадок жёлтого цвета, нерастворимый в HNO3; образуется при взаимодействии с AgNO3. Осадок ярко - жёлтого цвета, растворимый в кислотах; образуется при взаимодействии с AgNO3. Осадок ярко – желтого цвета Осадок синего цвета, образуется при взаимодействии с раствором красной кровяной соли К3[Fe(CN)6] Осадок белого (светло-зеленого) цвета; образуется при взаимодействии с растворами щелочей. Осадок синего цвета, образуется при взаимодействии с раствором жёлтой кровяной соли К4[Fe(CN)6] Осадок бурого цвета, образуется при взаимодействии с растворами щелочей. 26. Раствор кроваво-красного цвета. 27. Осадок голубого (синего) цвета, образуется при взаимодействии с растворами щелочей. 28. Осадок черного цвета, образуется при взаимодействии с растворимыми сульфидами (или сероводородом). 29. Появление запаха аммиака или изменение цвета влажной индикаторной бумаги (посинение влажной лакмусовой бумажки) при взаимодействии вещества с щелочами. 30. Осадок желтого цвета, не растворимый в уксусной кислоте, но растворимый в соляной кислоте. 31. Осадок белого цвета, растворимый в кислотах 32. Осадок белого цвета 33. Осадок студенистый кремниевой кислоты 34. Раствор жёлтого цвета. 35. 36. 37. Раствор жёлтого цвета. Раствор жёлтого цвета. Раствор оранжевого цвета 38. Раствор красного цвета. 39. Раствор малинового цвета. 40. 41. Раствор синего цвета. Раствор синего цвета. 42. Осадок белого цвета, желеобразный, который образуется при добавлении щёлочи в раствор и растворяется в избытке щёлочи. Качественная реакция на йодид-ионы I–: I– + Ag+ = AgI↓ Качественная реакция на ортофосфат-ионы PO43–: PO43– + 3Ag+ = Ag3PO4 ↓ Качественная реакция на ионы Pb2+ - ионы IPb2+ + 2I- = PbI2 Качественная реакция на соли Fe2+: 3Fe2+ + 2[Fe(CN)6]3– = Fe3[Fe(CN6)]2↓ (турнбулева синь) Качественная реакция на соли Fe2+: Fe2+ + 2OH– = Fe(OH)2↓ Качественная реакция на соли Fe3+: 4Fe3+ + 3[Fe(CN)6]4– = Fe4[Fe(CN6)]3↓ (берлинская лазурь) Качественная реакция на соли Fe3+: Fe3+ + 3OH– = Fe(OH)3 ↓ Качественная реакция на соли Fe3+ с раствором роданида калия KCNS (или роданида аммония NH4CNS – соли HCNS – тиоциановой кислоты): Fe3+ + 3CNS– = Fe(CNS)3 Качественная реакция на соли Cu2+: Cu2+ + 2OH– = Cu(OH)2 ↓ Качественная реакция на Fe2+, Ni2+, Cu2+, Pb2+, Ag+, Hg2+ и некоторые другие: Cu2+ + S2– = CuS↓ (PbS, FeS, Ag2S, HgS) Качественная реакция на соли аммония NH4+: (нагревание соли аммония со щелочью) NH4Cl + NaOH = NaCl + NH3↑ + H2O Качественная реакция на CrO42- (хромат ион) – действие растворимыми солями бария Ba2+ + CrO42- = BaCrO4 Качественная реакция на ионы кальция Ca2+ - действие растворами карбонатов CO32- + Ca2+ = CaCO3↓ Качественная реакция на F- - действие растворимыми солями кальция Са2+ + 2FCaF2 Качественная реакция на SiO32- - действие кислотой 2H+ + SiO32 = H2SiO3 Раствор индикатора метилоранжа окрашивается в жёлтый цвет в нейтральных и щелочных средах. Соли железа (III) Соли хромовой кислоты – Na2CrO4 Соли дихромовой кислоты – Na2Cr2O7 Растворы индикаторов лакмуса или метилового оранжевого в кислых средах (pH < 7). Раствор фенолфталеина в щелочных средах (pH > 7). Раствор фиолетового лакмуса в щелочных средах. Соли меди (II) Качественная реакция на соли Al3+ и Zn2+ (амфотерных гидроксидов): а) Al3– + 3OH– = Al(OH)3↓ Al(OH)3↓ + 2OH– = [Al(OH)4]– б) Zn2+ + 2OH– = Zn(OH)2↓ Zn(OH)2↓ + 2OH– = [Zn(OH)4]2– Таблица 2 Условия и признаки осуществления некоторых неорганических процессов № п/п Катализатор. Признак реакции 1. Железо 2. Оксид ванадия (V), V2O5 3. Оксид марганца (IV), MnO2 4. Платина 5. Ядовитый газ жёлто-зелёного цвета – хлор Cl2 Уравнения реакций, ключевые слова, ассоциации Катализатор синтеза аммиака из азота и водорода: N2 + 3H2 2NH3 Катализатор окисления SO2 в SO3 при получении серной кислоты: 2SO2 + О2 2SO3 Получение хлора из хлороводорода (соляной кислоты): 4HCl + MnO2 = Cl2↑ + MnCl2 + 2H2O Катализатор разложения H2O2 и KClO3 с выделением кислорода: 2 H2O2 = 2H2O + O2↑ 2KClO3 = 2KCl + 3O2 ↑ Катализатор окисления NH3 до NO при получении азотной кислоты: 4NH3 + 5O2 = 4NO + 6H2O Взаимодействие хлороводорода с окислителями (MnO2, KMnO4 и другие) и электролиз растворов и расплавов хлоридов: 4HCl + MnO2 = Cl2↑ + MnCl2 + 2H2O 2NaCl + 2H2O = 2NaOH + H2↑ + Cl2 (электролиз)