Задание на осенние каникулы по химии 7й класс
реклама

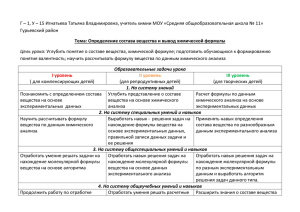
Задание на осенние каникулы по химии 7й класс 1. Запишите химические формулы веществ, в которых а) на один атом Магния приходится два атома Хлора; б) на два атома Феррума приходится три атома Оксигена. 2. Назовите химический элемент, ядро атома которого имеет заряд +16. Сколько электронов находится в атоме этого элемента? Какой заряд получит ион этого элемента, если притянет 2 электрона? Запишите формулу этого иона. 3. Из приведенного списка выпишите названия простых веществ, которые являются неметаллами: серебро, сера, вода, железо, феррум сульфид, фосфор, медь, кислород, магний оксид. По каким физическим свойствам неметаллы можно отличить от металлов? 4. Как разделить на чистые вещества смесь мела и сахара? 8й класс 1. Дайте определение оксидов. Из приведенных формул выпишите формулы оксидов: CaO, H2SO4, SiO2, NaCl, Cl2O7, Ba(OH)2, P2O5. Назовите оксиды. 2. Распределите вещества по классам, согласно схеме: Оксиды Кислоты Соли Основания SО2, HCl, Na2O, NaOH, AgNO3, P2O5, H3PO4, CaO, KOH, CaO, K3PO4, N2O5, HNO3, Cu(OH)2 FeCl3,BaO, Na3PO4, CO2 H2SO4, Al(OH)3 3.Смесь массой 5г состаоит из кислорода и хлора и занимает объем 22,4 л (н.у). Вычислите массовые доли газов в смеси. 4. Какой объем кислорода потребуется для реакции с 25 г железа. В результате химической реакции образовался окисид железа (ІІІ). 9й класс 1. Смешали 2 г соли и 140 мл воды. Какова массовая доля соли в полученном растворе? 2. Какую массу соли и объем воды необходимо взять для приготовления: 50 г 0,5 %-ного раствора (ответ: 0,25 г, H2O - 49,75 мл); 60 г 1 %-ного раствора (ответ: 0,6 г, H2O - 59,4 мл); 3. Определите количество ионов, образующихся при электролитической диссоциации 1 моль хлорида цинка. 4. Составте молекулярное и ионно-молекулярные уравнения реакции между растворами хлорида железа(III) и гидроксида натрия. 10й класс 1. Определите число атомов в 96г молекулы озона 2. Выведете формулу газообразного оксида, если его плотность по воздуху равна 1,586, а массовая доля кислорода 69,5% 3. Водородное соединение элемента содержит 3,85% водовода. Высший оксид элемента имеет формулу Е2О5. Назовите элемент 11й класс 1. Какой объём воздуха потребуется для полного сгорания 448 литров пропана? 2. Какой объём оксида углерода (IV) выделится при горении 10 литров бутана? 3. Найдите молекулярную формулу углеводорода, имеющего плотность 1,97 г/л, если при сгорании 4,4 г его в кислороде образуется 6,72 л СО2 и 7,2 г Н2О. 4. При сгорании 1,12 л органического вещества образовалось 3,36 л углекислого газа (н.у.) и 2,7 г воды. Относительная плотность паров этого вещества по гелию 14,5. Определите молекулярную формулу вещества и вычислите объем кислорода, необходимого для сгорания 0,5 моль этого вещества