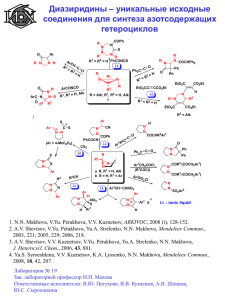
Аннотации - Институт органической химии им. Н.Д. Зелинского
реклама

Аннотации научных работ, представленных на конкурс 2014 года, посвященный 80-летию образования ИОХ РАН Лаборатория азотсодержащих соединений № 19 ИОННЫЕ ЖИДКОСТИ — РЕАКЦИОННЫЕ СРЕДЫ, ПРОМОТОРЫ И КАТАЛИЗАТОРЫ В ХИМИИ АРОМАТИЧЕСКИХ И АЗОТСОДЕРЖАЩИХ ГЕТЕРОЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ Н.Н. Махова, М.А. Епишина, А.С. Куликов, М.И. Плещев, Л.Л. Ферштат АННОТАЦИЯ Одной из важнейших задач современной стадии развития органической химии является разработка научных основ создания новых, малостадийных, экологически привлекательных методов построения основных классов органических соединений. Решение этой задачи взяло на себя интенсивно развивающееся с конца прошлого века новое научное направление в химии – «зеленая химия». Одними из ключевых направлений «зеленой химии» является проведение реакций в one-pot варианте без выделения промежуточных продуктов и применение альтернативных растворителей, в частности, ионных жидкостей (ИЖ). Целью настоящей работы является исследование возможности проведение ряда классических органических реакций в присутствии ионных жидкостей (ИЖ) как основы для разработки эффективных и экологически привлекательных методов синтеза и трансформация практически важных классов ароматических, гетероциклических и высокоэнергетических соединений. В докладе на конкурсе будут представлены результаты следующих направлений исследований: 1. [3+2]-Циклоприсоединение и метатезис азометиниминов в реакциях с терминальными этиленам, гетарилнитроэтиленам, карбонильными соединениями и арил(гетарил)метилиденмалононитрилами в ИЖ. 2. Реакции расширения цикла в 1,2-ди- и 1,2,3-тризамещенных диазиридинах при взаимодействии с активированными ацетиленами в ИЖ. 3. Синтез тетразолов, аминотиадиазолов и тетрагидроизохинолинов в ИЖ 4. Перегруппировки Шмидта и Чепмена и диазотирование аминофуроксанов в ИЖ. 5. Промотируемое ионными жидкостями нуклеофильное ароматическое cineзамещения водорода на примере реакции фон-Рихтера. 6. Реакции Анри и Манниха полинитроалканов в ИЖ 7. Циклореверсия динитрофуроксана в присутствии диполярофилов при катализе ИЖ. Основные результаты 1. [3+2]-Циклоприсоединение и метатезис азометиниминов в среде ИЖ. В результате исследования реакций [3+2]-циклоприсоединения азометиниминов к различным диполярофилам (терминальные этилены – акрилонитрил, арилвинилсульфоны, карбонильные соединения – изатины, 4-нитробензальдегид, и арил(гетарил)метилиденмалононитрилы) выявлены новые реакции метатезиса азометиниминов, что привело к разработке новых, простых, двухстадийных методов получения монозамещенных пиразолинов и пиразолов, а также новых конденсированных гетероциклических структур, в которых пиразолидиновый цикл аннелирован с различными пятичленными гетероциклами, содержащим функциональные (CN, SO2Ar, NO2) и фармакофорные гетероциклические заместители (фурил, тиенил, индолил) в аннелированном гетероцикле. При проведении как этих, так последующих реакций, ИЖ регенерировались и многократно повторно использовались без существенного снижения выходов конечных продуктов. 2. Реакции расширения цикла в 1,2-ди- и 1,2,3-тризамещенных диазиридинах при взаимодействии с активированными ацетиленами в ИЖ. Открыта новая реакция расширения диазиридинового цикла в 1,2-дизамещенных диазиридинах – при их взаимодействии с активированными ацетиленами (диэтилацетилендикарбоксилат, метилпропиолат) в ИЖ образуются производные тетрагидропиримидина (аддукт 1:2), а в MeCN в реакции с метилпропиолатом получена нециклическая структура, содержащая три молекулы метилпропиолата на одну молекулу диазиридина (аддукт 1:3). В трех случаях наряду с циклической структурой эти соединения образуются и в ИЖ с небольшими выходами. 3. Синтез тетразолов, аминотиадиазолов и тетрагидроизохинолинов в ИЖ В среде ИЖ эффективно протекают реакции с участием и других типов 1,3-диполей, в частности очень эффективным оказалось применение ИЖ в реакциях [3+2]циклоприсоединения азид-аниона или алкилазидов к нитрилам, приводящих к образованию 5-моно- или 1,5-дизамещенных тетразолов с различными заместителями в гетероцикле. В этих реакциях наилучшие результаты получены в ИЖ с гидросульфатным анионом [emim]HSO4, которая катализирует процесс. Использование ИЖ в качестве реакционной среды заметно ускоряет различные реакции конденсации, приводящие к гетероциклам. Так, в среде ИЖ был разработан простой метод синтеза аминотиадиазолов, содержащих один или два гетероциклических фрагмента, – важных составляющих целой серии биологически активных соединений. Метод основан на взаимодействии тиосемикарбазида с моно- или дикарбоновыми кислотами, включая N-защищенные аминокислоты, в растворах ИЖ, содержащих эквимолярное количество H2SO4. В органических растворителях бициклические соединения получают более сложным многостадийным путем. Еще одним примером усовершенствования метода синтеза гетероциклов в среде ИЖ является синтез 3,4-дигидроизохинолинов (антагонисты D1-допаминовых рецепторов) на основе циклизации N-ацил-2-арилэтиламинов в присутствии POCl3 (реакция БишлераНапиральского), которая существенно облегчается в среде ИЖ, содержащих анионы сильных кислот, что позволило успешно ввести в реакцию арилэтиламины с электроноакцепторными заместителями в ароматическом цикле. Перегруппировки Шмидта и Чепмена и диазотирование аминофуроксанов в ИЖ 4. В среде ИЖ впервые осуществлены некоторые практически важные реакции в ароматическомм ряду, в частности перегруппировки Шмидта и Чепмена. Амидирование кетонов при действии азида натрия (прегруппировка Шмидта) обычно проводят в органических растворителях в присутствии сильных неорганических кислот, которые нейтрализуют перед выделением продуктов. Применение ИЖ с трифлатным анионом [emim]CF3SO3 позволило минимизировать количество кислоты СF3SO3H до 1 моля и существенно повысить выходы амидов. Проведение перегруппировки Чепмена – трансформация О-арилиминоэфиров в N-ароилдиариламины в ИЖ привело к разработке безметального метода синтеза этих практически важных соединений. NАроилдиариламины обычно получают в условиях металл-катализируемого кросссочетания галогенбензолов и диариламидов. Снятие ацильной защиты с этих соединений является одним из общих методов синтеза диариламинов – важных добавок в процессах вулканизации резины в качестве антиоксидантов и предотвращающих ее старение. Использование перегруппировки Чепмена тормозилось необходимостью использования очень высокой температуры (250-350 оС). Было найдено, что в ИЖ перегруппировка Чепмена протекает при температуре на 80-100 оС ниже, чем в органических растворителях что позволяет ввести в реакцию те О-арилиминоэфиры, которые в органических растворителях разлагаются раньше, чем вступают в перегруппировку. Диазотирование таких слабоосновных аминов как аминофуроксаны ранее удавалось осуществить только в смеси концентрированных серной и фосфорной кислот. ИЖ, содержащие анионы сильных кислот, оказались очень эффективной реакционной средой для проведения этой реакции. Она проходит при действии нитрозилсерной кислоты в мягких условиях, а образовавшийся диазониевый ион был зафиксирован в виде продукта азосочетания с анизолом. 5. Первый пример промотируемого ИЖ нуклеофильного ароматического cineзамещение водорода на примере реакции фон-Рихтера. Нуклеофильное ароматическое замещение водорода в электроно-дефицитных аренах (SNH-процессы) приобрело в последние годы важное практическое и теоретическое значение. Было установлено, что присоединение нуклеофильного реагента к электроно-дефицитным аренам протекает быстрее к атому углерода, не связанного с уходящей группой, но обладающего электрофильным характером, с образованием ϭHаддукта, а поскольку спонтанный уход гидрид-иона невозможен, то равновесие смещается в сторону ϭХ-аддукта. В настоящее время разработан ряд вариантов проведения процесса, когда удается помочь уйти гидрид-иону, например – окислительное или викариозное нуклеофильное замещение водорода. Cine-замещение - это процесс, когда входящая нуклеофильная группа занимает место, соседнее с уходящей группой. К таким процессам относится реакция фон-Рихтера – трансформация нитробензолов в бензойные кислоты при действии избытка КСN в водном спирте, причем карбоксильная группа занимает о-положение по отношении к уходящей нитрогруппе. Эта реакция была открыта еще в 19 веке, но не получила широкого распространения, поскольку протекает либо при многодневном кипячении, либо в запаянной ампуле с низкими выходами, а во многих случаях реакционная масса просто осмоляется. В качестве исходных соединений мы взяли нитробензол, четыре 4-галогеннитробензола и 4-метоксинитробензол, провели скрининг условий и показали, что при добавлении в реакционную массу 175 мольных % ИЖ реакция протекает эффективно и соответствующие бензойные кислоты образуются с удовлетворительными выходами. Проведенное исследование является первым примером ароматического нуклеофильного cine-замещения водорода в нитробензолах, промотируемое ИЖ. 6. Реакции Анри и Манниха полинитроалканов в ИЖ Одним из приоритетных направлений наших исследований был синтез высокоэнергетических соединений в ИЖ. Так, мы впервые вовлекли полинитроалканы в реакции Анри и Манниха в среде ИЖ и разработали на этой основе экологически чистые способы синтеза полинитроспиртов [тринитроэтанола (TNE), 2,2-динитропропан-1,3диола (DNPD)] и 2,2,2-тринитроэтильных производных слабоосновных аминов (мочевины, 4-амино-3-R-фуроксанов)]. Конденсация тринитрометана (TNM) с параформом при 20 оС в ИЖ [emim][HSO4] приводит к TNE с выходом 89-94% сразу в кристаллическом виде с нужной т.пл. в отличие от стандартных условий, когда реакцию проводят при 65 оС с последующей кристаллизацией из CCl4. DNPD был синтезирован аналогично из натриевой соли динитрометана и параформа в ИЖ [bmim][BF4] при 0 оС в присутсвии АсОН. В близких условиях, включающих применение ИЖ ([emim][HSO4], 20оС, 24 ч), TNE был введен в реакцию Манниха с мочевиной с образованием бис(тринитроэтил)мочевины (BTNM) с выходом 90%. Реакция успешно протекала как с заведомым TNE, так и с полученным in situ в том же реакторе из тринитрометана (TNM) и параформа. Из других слабоосновных аминов в реакцию Манниха в среде ИЖ были введены аминофуроксаны. Полученные продукты конденсации были превращены в энергоемкие нитраминопроизводные при действии нитрующей смеси HNO3 – (CF3CO)2O. 7. Циклореверсия динитрофуроксана в присутствии диполярофилов при катализе ИЖ. Ранее в нашей лаборатории было показано, что динитрофуроксан (DNFO) в растворе CCl4 при 20 °С существует в равновесии со своей мономерной формой – нитроформнитрилоксидом (NFNO), который удалось уловить [3+2]-циклоприсоединением к нитрильной группе трихлорацетонитрила и метилцианоформиата с образованием двух представителей 3-нитро-1,2.4-оксадиазолов с небольшими выходами. Однако попытки проведения аналогичной реакции с другими диполярофилами (фенилацетилен, трансстильбен и циклогексен) приводили к сложной смеси продуктов, которую не удалось разделить. Оказалось, что добавление в реакционную массу каталитического количества ИЖ (40 мол. %) позволяет провести эту реакцию с широким кругом диполярофилов (олефины, ацетилены, карбонильные соединения, нитрилы), а разработанный тандемный процесс - циклореверсия DNFO с последующим [3+2]-циклоприсоединением образовавшегося NFNO, представляет собой новый общий, подход к получению трудно доступных 3-нитронитроазолов различного типа. Выводы 1. ИЖ являются перспективными, субстрат-специфичными, регенерируемыми растворителями, промоторами и катализаторами для проведения большого круга классических органических реакций, в частности 1,3-диполярного циклоприсоединения, Шмидта, Чепмена, Бишлера-Напиральского, Анри, Манниха, нуклеофильного ароматического cine-замещения, циклореверсии и др. Показано, что реакции в ИЖ протекают с высокой регио- и стереоселективностью, а в некоторых случаях приводят к получению непредсказуемых результатов. Кроме того, реакции в ИЖ идут при более низких температурах или вообще без нагревания, что существенно повышает их безопасность. 2. На основе проведенных исследований разработаны новые, эффективные, малостадийные (интермедиаты генерируются in situ), экологически привлекательные методы получения как известных, так и новых азотсодержащих гетероциклических структур и высокоэнергетических соединений, причем некоторые из обнаруженных реакций вообще не удается осуществить в органических растворителях, а разработанные методы могут лечь в основу новых высокоэффективных методов синтеза аналогичных гетероциклических систем. Список опубликованных статей по реакциям в ИЖ 2009-2014 г 1. 2. 3. 4. 5. 6. 7. Yu.S. Syroeshkinа, V.V. Kuznetsov, V.V. Kachala and N.N. Мakhova, “A New Reaction of 1,2-Di- and 1,2,3-Trialkyldiaziridines: Ring Expansion under the Action of Diethyl Acetylenedicarboxylate in Ionic Liquids” J. Heterocycl. Chem., 2009, 46, 1195-1202, С.Г. Злотин, Н. Н. Махова, «Реакции CН-кислот и 1,3-диполей в присутствии ионных жидкостей», Успехи химии, 2010, 79, 603-644 (обзор). S.G. Zlotin, N. N. Makhova, “Ionic liquids as substrat-specific recoverable solvents and catalysts of regio-, stereo- and enantioselective organic reactions,” Mendeleev Commun., 2010, 20, 63-71 (review) Ю.С. Сыроешкина, Л.Л. Ферштат, В. В. Качала, В.В. Кузнецов, и Н.Н. Махова, «Расширение диазиридинового цикла в 6-арил-1,5-диазабицикло[3.1.0]гексанах в реакции с активированными олефинами», Изв. Ан. Сер. хим., 2010, 1579-1588. M. A. Epishina, A.S. Kulikov, N. V. Ignat’ev, M. Schulte, N.N. Makhova,, “The First Example of the Schmidt Reaction in Ionic Liquids”, Mendeleev Commun., 2010, 20, 335-336 Н.Н. Махова, А.В. Шевцов, В.Ю. Петухова, «Превращения диазиридинов и их конденсированных аналогов под действием электрофильных реагентов», Успехи химии, 2011, 80, 1087-1118 (обзор). N.V. Ignat’ev, M. Schulte, K. Koppe, P. Barthen, S.G. Zlotin, N.N. Makhova, A.B. Sheremetev, A.A. Valente, “Ionic Liquids – Advanced reaction media for organic synthesis”, Phosphorus, Sulfur, and Silicon, 2011, 186, 1205–1216. 8. 9. 10. 11. 12. 13. 14. 15. 16. 17. 18. 19. 20. 21. M.A. Epishina, I.V. Ovchinnikov, A.S. Kulikov, N.N. Makhova, V.A. Tartakovsky, “The first examples of Henry and Mannich reactions of polynitroalkanes in ionic liquids”, Mendeleev Commun., 2011, 21, 21-23 M.A. Epishina, A.S. Kulikov, N.V. Ignat’ev, M. Schulte, N.N. Makhova, “Synthesis of 5-alkyl-2-amino-1,3,4-thiadiazoles and a,ω-bis(2-amino-1,3,4-thiadiazol-5-yl)alkanes in ionic liquids", Mendeleev Commun., 2011, 21, 331-333. M.A. Epishina, A.S. Kulikov, N.V. Ignat’ev, M. Schulte, N.N. Makhova, “Ionic liquidassisted synthesis of 5-mono- and 1,5-disubstituted tetrazoles”, Mendeleev Commun., 2011, 21, 334-336. M.A. Epishina, A.S. Kulikov, M.I. Struchkova, N.V. Ignat’ev, M. Schulte, N.N. Makhova, “Ionic liquids-assisted synthesis of 3,4-dihydroisoquinolines by a BishlerNapieralski reaction”, Mendeleev Commun., 2012, 22, 267-269. V.Yu. Petukhova, M.I. Pleshchev, L.L. Fershtat, V.V. Kuznetsov, V.V. Kachala, N.N. Makhova, “Metathesis of Azomethine Imines”, Mendeleev Commun., 2012, 22, 32–34. М.А. Епишина, А.О. Финогенов, А.С. Куликов, Н.Н. Махова, И.В. Ананьев, В.А. Тартаковский, «Синтез и нитрование 3-R-4-(2,2,2-тринитроэтил)аминофуроксанов», Изв. АН. Сер. хим., 2012, 1559-1565. N.M. Ignatyev, N.N. Makhova, A.S. Kulikov, M.A. Epishina, “Synthesis of Tetrazole Derivatives”, DE Pat. 102011014082 (A1), Priority Data 2010-01-16, Publication Data 2011-10-27. M.I. Pleshchev, V. Yu. Petukhova, V. V. Kuznetsov, D. V. Khakimov, T. S. Pivina, M. I. Struchkova, Yu. V. Nelyubina, and N. N. Makhova, «Metathesis of azometine imines in reaction of 6-aryl-1,5-diazabicyclo[3.1.0]hexanes with arylidene(hetarylidene) malononitriles», Mendeleev Commun., 2013, 23, 34–36. М.И. Плещев, В.Ю. Петухова, В.В. Кузнецов, Д.В. Хакимов, Т.С. Пивина, Ю. В. Нелюбина, Н.Н. Махова, “Генерация и метатезис азометиниминов в реакции 6арил-1,5-диазабицикло[3.1.0]гексанов с арил(гетарил)метилиденмалононитрилами”, Изв. АН, Сер .хим., 2013, №3, 10651074. V. Yu. Petukhova, L. L. Fershtat, V. V. Kachala, V. V. Kuznetsov, D. V. Khakimov, T. S Pivina, and N. N. Makhova, «Reaction of 1,2-Di- and 1,2,3-Trialkyldiaziridines with Methyl Propiolate in Ionic Liquids and in Organic Solvents», J. Heterocycl. Chem., 2013, 50, 326-336. M.I. Pleschev, V.V. Kachala, A.S. Goloveshkin, I.S. Bushmarinov, V.V. Kuznetsov, D.V. Khakimov and N.N. Makhova. “Unexpected regioselectivities of [3+2]cycloaddition of azomethine imines to acrylonitrile and 4-nitrophenyl vinyl sulfone”. Mendeleev Commun., 2013, 23, 271-273. M.I. Pleschev, M.A. Epishina, V.V. Kachala, V.V. Kuznetsov, A.S. Goloveshkin, I.S. Bushmarinov, and N.N. Makhova, “Ionic liquids promoted stereoselective [3+2]cycloaddition of hetaryl nitroethylenes to azomethine imines generated in situ”, Mendeleev Commun., 2013, 23, 206-208. Н. Н. Махова, М. И. Плещев, М. А. Епишина, А. С. Куликов, «Синтез и трансформация азотсодержащих гетероциклов в ионных жидкостях», ХГС, 2014, 690-703 (обзор). L. L. Fershtat, I. V. Ovchinnikov, N. N. Makhova, “Ionic liquid-promoted [3+2]cycloaddition reactions of nitroformonitrile oxide generated by the cycloreversion of dinitrofuroxan”, Tetrahedron Lett., 2014, 55, 2398-2400. Список публикаций по реакциям в ИЖ, направленных в печать. 1. M. A. Epishina, A. S. Kulikov, N. V. Ignat’ev, M. Schulte, and N. N. Makhova, “Efficient metal-free synthesis of tertiary acyclic amides by Chapmen rearrangement 2. 1. 2. 3. 4. 5. 6. 7. 8. 9. 10. O-aryliminoethers in ionic liquids”, Mendeleev Commun., 2015, 25, accepted for publication. M. A. Epishina, A. S. Kulikov, N. V. Ignat’ev, M. Schulte, and N. N. Makhova, “Nucleophilic aromatic cine-substitution of hydrogen: the ionic liquid-promoted von Richter reaction”, Mendeleev Commun., 2015, 25, accepted for publication. Тезисы устных докладов на конференциях 2009-2014 г Н.Н. Махова, Ю.С. Сыроешкина, В.В. Кузнецов, В.Ю. Петухова, ““Синтез и трансформация азотсодержащих гетероциклов в ионных жидкостях”, Тезисы докладов Международной конференции “Новые направления в химии гетероциклических соединений”, г. Кисловодск, 3-8 мая 2009, 78 (устный доклад). Н.Н. Махова, «Азометинимины и родственные структуры – генерация и реакционная способность в ионных жидкостях», Сборник тезисов докладов Всероссийской конференции по органической химии, посвященной 75-летию со дня основания ИОХ им. Н.Д. Зелинского, Москва, 25-30 октября 2009 г, 58 (устный доклад). Н.Н. Махова, Ю.С. Сыроешкина, Л.Л. Ферштат, В.Ю. Петухова, В.В. Кузнецов, «Синтез азотсодержащих гетероциклов на основе реакций расширения диазиридинового цикла», Сборник тезисов III Международной конференции «Химия гетероциклических соединений», посвященная 95-летию со дня рождения А.Н. Коста», Москва, МГУ, 18-21.10. 2010., П30 (пленарный доклад). Ферштат Л.Л., Качала В.В., Петухова В.Ю. Трансформация диазиридинового цикла в 1,2-ди- и 1,2,3-триалкилдиазиридинах под действием метилпропиолата в ионных жидкостях // IV Молодежная конференция ИОХ РАН: Тез. докл. – Москва, 2010. – С. 47. (устный доклад) Н.Н. Махова, В. Ю. Петухова, В.В. Кузнецов, «Генерация и реакционная способность азометиниминов и родственных структур в ионных жидкостях», Тезисы докладов XIX Менделеевского съезда по общей и прикладной химии», 2630 сентября, 2011, т.1, 64 (устный доклад). Петухова В.Ю., Ферштат Л.Л., Качала В.В., Кузнецов В.В., Махова Н.Н. Реакция 1,2-ди- и 1,2,3-триалкилдиазиридинов с метилпропиолатом в ионных жидкостях и органических растворителях // I Всероссийская научная конференция с международным участием «Успехи синтеза и комплексообразования»: Тез. докл. – Москва, 2011. – С. 41. (устный доклад) Ферштат Л.Л., Петухова В.Ю., Махова Н.Н. Расширение цикла в 1,2диалкилдиазиридинах и 6-арил-1,5-диазабицикло[3.1.0]гексанах при взаимодействии с активированными непредельными соединениями в ионных жидкостях // Межвузовская научно-практическая конференция молодых ученых и студентов «Образование и наука для устойчивого развития» – Москва, 2011. – У2. (устный доклад) Н.Н. Махова, М.А. Епишина, А.С. Куликов, М.И. Плещев, «Синтез азотсодержащих гетероциклов в ионных жидкостях», Сборник статей III Международной конференции «ТЕХНИЧЕСКАЯ ХИМИЯ. ОТ ТЕОРИИ К ПРАКТИКЕ», г. Пермь, 15-19 октября, 2012, т.1, 26-30 (устный доклад). Н.Н. Махова, М.И. Плещев, В.В. Кузнецов, «Генерация и метатезис азометиниминов в реакциях бициклических диазиридинов с диполярофилами», Тезисы докладов кластера конференций по органической химии «ОргХим-2013», С-Петербург, 17-21.06.2013, 187-188 (устный доклад). Н.Н. Махова, М.И. Плещев, М.А. Епишина, А.С. Куликов, В.В. Кузнецов. “Синтез и трансформация азотсодержащих гетероциклов в ионных жидкостях”. “Новые направления в химии гетероциклических соединений”. Тезисы III международной научной конференции. Пятигорск, 17–21 сентября 2013 г., с. 54 (устный доклад). 11. М.И. Плещев. “Неожиданная региоселективность [3+2]-циклоприсоединения азометиниминов к акрилонитрилу и арилвинилсульфонам”. Материалы Международного молодежного научного форума «ЛОМОНОСОВ-2013» [Электронный ресурс] — М.: МАКС Пресс, 2013. 12. Fershtat L.L., Ovchinnikov I.V., Makhova N.N. Synthesis of nitroheterocycles by ionic liquids promoted [3+2]-cycloaddition reactions to nitroformonitrile oxide generated by cycloreversion of dinitrofuroxan // Book of abstracts of 17th International Seminar “New Trends in Research of Energetic Materials” – Pardubice, Czech Republic, April 9-11, 2014. – P. 647 (стендовый доклад) 13. Ферштат Л.Л., Епишина М.А., Махова Н.Н. Региоселективный синтез и реакционная способность 4-нитрофуроксанов // Тез. докл. XVII Молодежной школы-конференции по органической химии Уральского научного форума «Современные проблемы органической химии» – Екатеринбург, 8-12 июня 2014. – С. 95 (устный доклад). Лаборатория полинепредельных соединений № 7 ПОЛНЫЙ СТЕРЕОКОНТРОЛИРУЕМЫЙ СИНТЕЗ СТРОБИЛУРИНА В Н.Я. Григорьева, В.А. Поповский, А.В. Степанов АННОТАЦИЯ Стробилуриновые антибиотики (стробилурины) – группа открытых в последней четверти XX века природных соединений с уникальной биологической активностью. Они способны разобщать дыхательную цепь в митохондриях и, благодаря этому, проявляют высокую фунгицидную и антимикробную активность. По той же причине стробилурины являются ценным инструментом для изучения биохимии процесса клеточного дыхания. К настоящему времени известны 15 представителей этой группы соединений. Все они являются производными метил-(2E, 3Z, 5E)-6-арил-3-метил-2-метоксиметиленгекса2,3,5-триеноата общей формулы 1 и различаются заместителями в бензольном кольце. R1 R2 MeOOC OMe 1a: R1= R2= H; 1b: R1= OMe, R2= Cl; 1c: R1=H, R2=OMe. Выполненные до 2006 г. синтезы стробилуринов не были стереоселективными. Первый стереоселективный синтез этих веществ был опубликован 2006г. Колеманом и Лу на примере стробилурина B. Он базируется на реакциях сочетания по Сузуки – Мияура и по Стиллу с использованием нестабильных и дорогостоящих реагентов. В то же время в активе нашей группы был высоко стереоселективный метод построения интернальной (Z)-тризамещенной связи С=С, хорошо зарекомендовавший себя в синтезе природных соединений (полипренолы, феромоны насекомых). Он основан на термодинамической предпочтительности (E)- изомеров 2,3- дизамещенных акролеинов (2), гладко получающихся конденсацией депротонированных альдиминов 3 с альдегидами 4 и стереоспецифически трансформируемых далее в 2,3- дизамещенные (Z)метилолефины 5: 1 t R CH2CH=NBu 1. LDA 2. R2 CHO(4) 3. H3O+ O R1 3 2 R2 R1 5 R2 Хотя α,β-ненасыщенные альдегиды в этих превращениях не изучались, ретросинтетический анализ молекул стробилуринов с учетом возможностей этого метода (схема 1) показывает, что (3Z, 5E)-6-арил-3-метилгекса-3,5- диеновый углеводородный скелет стробилуринов может быть построен вовлечением (E)-коричного альдегида и / или его замещенных в бензольном ядре аналогов 6 в конденсации с иминами O-защищенного 4-гидроксибутаналя (7) с последующей трансформацией CHO- группы образующихся (2E, 4E)-диеналей 8 до метила и выходом к (2Z, 5E)-эфирам 9. Для получения целевых стробилуринов далее необходимо выполнить депротекцию эфиров 9, окисление получающихся при этом диенолов 10 до арилдиеновых кислот 11 и введение метоксиметиленовой группы в положение C(2) эфиров 12, получаемых из кислот 11. Эффективность такого подхода была продемонстрирована нами в недавно выполненных формальных синтезах простейших стробилуринов A (1a) и X (1c). Схема 1 R1 R1 R2 R2 OMe MeOOC R1 COOMe R1 11 R1 R1 R2 R2 10 R2 9 OH OR O O 8 OR NBut — + R2 COOH 12 1 R1 R2 6 7 OR Целью представляемой работы является изучение возможности стереоконтролируемого построения по схеме 1 стробилурина B (1b), содержащего в ароматическом кольце два элетроноакцепторных заместителя, и изучение влияния последних на стереохимию сопряженного арилдиенового фрагмента обсуждаемых веществ в ходе превращений, рассмотренных в схеме 1. Схема 2 MeO NBut MeO O O + Cl Cl OBn 7a 14 13 OBn i- iii Et3Si NBut OBn MeO i, iv, v 14 + Cl OBn 7b vi vii MeO MeO Cl Cl OBn OBn MeO OH viii 16 O 15 + 17 Cl 18 OBn òî çèëèðî âàí èå ï ðè 0 °Ñ: 17 : 18 = 2 : 1 òî çèëèðî âàí èå ï ðè –80 °Ñ: 17 : 18 = 96 : 4 Реагенты и условия: i: LDA/ C6H14-THF, 0 °C, 30 мин.; ii: Et3SiCl/THF/ –80 °C, 1ч., нагрев до 0 °C, 4 ч.; iii: H2O; iv: 13 / THF, – 80 °C, 1ч., нагрев до 0 °C, 4 ч.; v: H3O+; vi: CHCl3, 100 °C, 1ч.(запаянная ампула); vii: NaBH4/EtOH, rt; 3ч.; viii: a: BuLi/C6H14-THF, 0 °C, затем TsCl/ HMPA, 0 °C, 2.5 ч.; viii: b:: BuLi/C6H14-THF, – 80 °C, затем TsCl/ HMPA, – 80 °C, выдержка при –20 °C, 2.5 ч., затем: LiAlH4, rt, 3.5ч. Ключевым интермедиатом синтеза стробилурина B по предложенной схеме является (2E,4E)- диеналь 14, образующийся с высокой (> 98 % ) стереоселективностью, но с выходом только 40% при конденсации депротонированного имина 7a (R=Bn) с ранее неизвестным 3-метокси-4-хлоркоричным альдегидом (13) (схема 2). Показано, что низкая эффективность конденсации в этом случае связана с параллельно протекающей реакцией Канниццаро. Выход целевого диеналя 14 удалось повысить до 60 % при замене имина 7a (R=Bn) на его 2-SiEt3- производное 7b. Полученный в этом случае в смеси с диеналем 14 его (2Z, 4E)-изомер (15) количественно изомеризуется в диеналь 14 (схема 2) при нагревании раствора диеналя 15 в хлороформе в запаянной ампуле при 100° С в течении 1 часа. Это превращение свидетельствует о термодинамической предпочтительности диеналя 14. Диенали 14 и 15 выделены хроматографически. Их строение, как и строение всех других, полученных в работе веществ, однозначно доказано с помощью совокупности физико-химических методов исследования, прежде всего HRMS и ЯМР 1H с привлечением NOE-эксперимента. Диеналь 14 количественно и стереоспецифично восстанавливается NaBH4 в этаноле до (2E,4E)- диенола 16 . Попытка трансформации гидроксиметильной группы последнего в метильную через стадию отвечающего ему C(1)- тозилата, полученного, как это было выполнено в синтезах стробилуринов A и X, при 0°С, привела после восстановления продуктов тозилирования с помощью LiAlH4 (схема 2), к смеси целевого (1E,3Z)арилдиенового эфира 17 с его (1E,3E)- изомером (18) в соотношении (2:1)). Осуществить дегидроксилирование диенола 16 с высокой степенью сохранения конфигурации системы сопряженных связей С=C удалось при значительном снижении температуры тозилирования. Целевой эфир 17 был получен при этом с выходом 60% и стерохимической чистотой 96%. Схема 3 MeO i Cl 17 MeO ii Cl 20 CHO OH O MeO v, vi Cl COOR 21: R=H iv iii Cl 19 OBn MeO MeO Cl OH I MeOOC 1b O OMe IBX O 22: R=Me Реагенты и условия: i: AlCl3–PhNMe2 (3:4) / CH2Cl2, –5 °C, 3.5 ч.; ii: IBX/DMF, rt, 2ч.; iii: NaClO2/DMSO – H2O, pH 9, 0 °C, 3ч.; iv: CH2N2/Et2O, 0 °C; v: HCOOMe, NaH, rt, 4ч.; vi: (MeO)2SO2/ DMF, 14ч. Дебензилирование эфира 17, как и изученное ранее дебензилирование эфиров 9 (R1=R2=H и R1=H, R2=OMe), участвующих в синтезах стробилуринов A и X, гладко протекает под действием безводного AlCl3 в присутствии избытка PhNMe2. и дает с выходом 85% кристаллический диенол 19 (схема 3), содержание примесей стерео - и регио-изомеров в котором не превышает 1%. Превращене диенола 19 в арилдиеновую кислоту 21 выполнено через стадию диеналя 20, полученного окислением диенола 19 с помощью IBX и превращенного без дополнительной очистки в кислоту 20 действием NaClO2 в водном ДМСО при pH 9. Кислота 21 количественно превращается в метиловый эфир 22 при обработке эфирным раствором CH2N2. Стерео- и регио-химическая чистота соединений 8b — 10b превышает 98%. Полный синтез стробилурина B (1b) завершает двухстадийное превращение эфира 22 в целевой 1b (схема 3). Оно выполнено в работе с помощью шприцевой техники “in one pot”(схема 3). Полученный стробилурин B выделен хроматографически с выходом 61%. Его общий выход в рассмотренном девятистадийном синтезе составляет 5.5%. Сохранение конфигурации сопряженной системы связей C=C на каждой стадии превышает 95 %. ВЫВОДЫ: 1. По оригинальной схеме выполнен девятистадийный стереоконтролируемый полный синтез антибиотика стробилурина B с общим выходом 5.5%. 2. Показано, что термодинамическая предпочтительность (2E, 4E)-изомеров 6-арил-3метилгекса-2,4-диеналей сохраняется при наличии в этих веществах элекроноакцепторных заместителей в положениях 3- и 4- бензольного кольца. 3. Найдены условия высоко стереоселективного тозилированного (2E, 4E)-6-арил-3метилгекса-2,4-диенолов, содержащих элекроноакцепторные заместители в положениях 3- и 4- бензольного кольца, что позволило построить арилдиеновый каркас стробилурина B со стереоселективностью 96%. 4. Подтвержден общий характер найденных авторами ранее стерео- и региоизбирательных способов депротекции бензиловых эфиров арилдиенолов, а также способов трансформации полученных арилдиенолов в метиловые эфиры отвечающих им арилдиеновых кислот. 5. Разработанная методология высоко стереоселективного построения (3Z,5E)-6-арил3-метилгекса-3,5-диеновой системы связей C=С и способы трансформации функциональных групп, связанных с этой системой, минимально (5%) затрагивающие ее конфигурацию, могут быть использованы в синтезах других арилдиеновых соединений. Список статей, опубликованных по теме представляемой работы: 1. В.А. Поповский, А.В. Степанов, Н.Я. Григорьева, Получение (2E, 4E)-2-(2бензилоксиэтил)-5-(3-метокси-4-хлорфенил)пента-2,4-диеналя –— ключевого интермедиата в синтезе стробилурина B // Изв. АН. Сер. хим., 2012, № 8, 1599. 2. Viktor A. Popovsky, Andrei V. Stepanov, Natalia Ya. Grigorieva, Total synthesis of strobilurin B // Mend. Comm., 2013, 23, 190. 3. В.А. Поповский, А.В. Степанов, Н. Я. Григорьева, Полный синтез стробилурина B // Изв. АН. Сер. хим., 2014, № 2, 491. Лаборатория полисераазотистых гетероциклических соединений № 31 КОНДЕНСИРОВАННЫЕ ПЯТИЧЛЕННЫЕ ХАЛЬКОГЕНАЗОЛЫ И РАДИКАЛЫ НА ИХ ОСНОВЕ — МОЛЕКУЛЯРНЫЕ МАГНЕТИКИ И ПРОВОДНИКИ ЭЛЕКТРИЧЕСТВА О.А. Ракитин, Л.С. Константинова, Е.А. Князева АННОТАЦИЯ В последние годы в области химии материалов происходят революционные изменения. Лавинообразно растет количество публикаций, посвященных созданию концептуально новых материалов, основанных на индивидуальных органических молекулах или их комплексах. Среди огромного числа используемых для этого гетероциклов, значительное место занимают 1,3,2-дитиазолы, 1,2,5-тиадиазолы и 1,2,5селенадиазолы. Нейтральные 1,3,2-дитиазолильные радикалы представляют интерес в качестве соединений, проявляющих магнитные свойства и способность проводить электрический ток. Важнейшим направлением практического применения 1,2,5тиадиазолов и 1,2,5-селенадиазолов является создание на их основе новых молекулярных электропроводящих материалов и магнетиков и использование их в качестве строительных блоков π-типа для низко- и высокомолекулярных органических светодиодов, а также как синтонов для синтеза комплексов с переносом зарядов, которые проявляют свойства полупроводников и фотопроводников. Поэтому разработка эффективных способов получения производных 1,3,2-дитиазолов, 1,2,5-тиаи 1,2,5-селенадиазолов, конденсированных с электроноакцепторными полиазотистыми гетероциклами, открывает широкие возможности для изучения свойств этих соединений и является актуальной задачей. Целью настоящей работы является разработка новых удобных, эффективных методов синтеза труднодоступных и неизвестных ранее производных 1,3,2-дитиазолов, 1,2,5-тиадиазолов и 1,2,5-селенадиазолов, как предшественников соответствующих стабильных радикальных частиц и ионных комплексов, обладающих свойствами молекулярных электропроводящих материалов и магнетиков. В результате проделанной работы впервые: Синтезированы радикалы [1,3]дитиоло[4,5-d][1,3,2]дитиазолия и тиено[1,3,2]дитиазолия, процесс образования и свойства которых изучены методами циклической вольтамперометрии и ЭПР-спектроскопии. Системно исследовано взаимодействие легкодоступных дизамещенных и циклических вицинальных диоксимов с монохлоридом серы. На основе полученных результатов разработан общий одностадийный селективный метод синтеза моноциклических и конденсированных 1,2,5-тиадиазолов и их N-оксидов. Открыта новая реакция о-аминонитропроизводных ароматического ряда с монохлоридом серы, в результате которой происходит образование соответствующих бензоконденсированных 1,2,5-тиадиазолов. Обнаружено неизвестное ранее превращение 1,2,5-тиадиазолов под действием диоксида селена в соответствующие 1,2,5-селенадиазолы путем прямой замены атома серы в цикле на атом селена. Найдена уникальная способность монохлорида серы замещать атомы кислорода и селена в 1,2,5-оксадиазолах и 1,2,5-селенадиазолах на серу с образованием соответствующих 1,2,5-тиадиазолов. Найдено, что взаимодействие [1,2,5]тиадиазоло[3,4-c][1,2,5]тиадиазола с тетратиафульваленом приводит к комплексу 1:1 с переносом заряда. Измерения на поликристаллических образцах показали существенное увеличение электропроводности комплекса при облучении светом со спектром, имитирующим солнечный спектр. Установлено, что взаимодействие [1,2,5]тиадиазоло[3,4-c][1,2,5]тиадиазола и [1,2,5]тиадиазоло[3,4-b]пиразина с бис(толуил)хромом приводит к гетероспиновым радикал-анионным солям и получены их первые представители. Изучение магнитных свойств радикал-ионных солей показало преобладание антиферромагнитных обменных взаимодействий в спиновой системе, что может быть использовано в создании наноразмерных ячеек памяти. Основное содержание работы изложено в следующих публикациях: 1. S. A. Amelichev, V. V. Popov, L. S. Konstantinova, S. P. Golova, V. V. Novikov, E. D. Lubuzh, L. V. Mikhalchenko, V. P. Gultyai, O. A. Rakitin “Identification of the [1,3]dithiolo[4,5-d]dithiazolyl radical” Mendeleev Commun., 2010, 20, No. 2, 80-82. 2. В. В. Попов, Л. С. Константинова, О. А. Ракитин «Синтез и реакционная способность 1,3,2-дитиазолов (обзор)» Химия гетероцикл. соедин., 2011, № 7, 963986. 3. О. А. Ракитин “Стабильные гетероциклические радикалы” Успехи химии, 2011, 80, № 7, 679-692. 4. L. S. Konstantinova, V. V. Popov, A. V. Lalov, L. V. Mikhalchenko, V. P. Gultyai, O. A. Rakitin «A short and efficient route from tetrahydrothiophene to thieno[2,3d][1,3,2]dithiazolium salts» Tetrahedron Lett., 2012, 53, No. 29, 3767-3770. 5. N. A. Pushkarevsky, A. V. Lonchakov, N. A. Semenov, E. Lork, L. I. Buravov, L. S. Konstantinova, G. T. Silber, N. Robertson, N. P. Gritsan, O. A. Rakitin, J. D. Woollins, E. B. Yagubskii, J. Beckmann, A. V. Zibarev “First Charge-Transfer Complexes between Tetrathiafulvalene and 1,2,5-Chalcogenadiazole Derivatives: Design, Synthesis, Crystal Structures, Electronic and Electrical Properties” Synth. Met., 2012, 162, № 24, 2267-2276. 6. L. S. Konstantinova, E. A. Knyazeva, N. V. Obruchnikova, Yu. V. Gatilov, A. V. Zibarev, O. A. Rakitin “Reaction of vicinal nitroamines with sulfur monochloride – a short and convenient route to fused 1,2,5-thiadiazoles and their N-oxides” Tetrahedron Lett., 2013, 54, No. 24, 3075-3078. 7. N. A. Semenov, N. A. Pushkarevsky, E. A. Suturina, E. A. Chulanova, N. V. Kuratieva, A. S. Bogomyakov, I. G. Irtegova, N. V. Vasilieva, L. S. Konstantinova, N. P. Gritsan, O. A. Rakitin, V. I. Ovcharenko, S. N. Konchenko, A. V. Zibarev “Bis(toluene)chromonium [1,2,5]Thiadiazolo[3,4-c][1,2,5]thiadiazolidyl and [1,2,5]Thiadiazolo[3,4-b]pyrazinidyl: New Heterospin (S1 = S2 = 1/2) Radical-Ion Salts” Inorg. Chem., 2013, 52, No. 11, 66546663. 8. A. V. Lonchakov, O. A. Rakitin, N. P. Gritsan, A. V. Zibarev “Breathing Some New Life into an Old Topic: Chalcogen-Nitrogen π-Heterocycles as Electron Acceptors”, Molecules, 2013, 18, No. 8, 9850-9900. 9. V. V. Popov, S. A. Amelichev, I. S. Bushmarinov, L. S. Konstantinova, K. A. Lyssenko, L. V. Mikhalchenko, V. V. Novikov, V. P. Gultyai, O. A. Rakitin, “Identification of [1,3]dithiolo[4,5-d]dithiazolyl radicals by in situ EPR spectroscopy and cyclic voltammetry” Tetrahedron, 2013, 69, 8790-8797. 10. L. S. Konstantinova, E. A. Knyazeva, N. V. Obruchnikova, N. V. Vasilieva, I. G. Irtegova, Y. V. Nelyubina, I. Yu. Bagryanskaya, L. A. Shundrin, Z. Yu. Sosnovskaya, A. V. Zibarev, O. A. Rakitin “1,2,5-Thiadiazole 2-oxides: selective synthesis, structural characterization and electrochemical properties” Tetrahedron, 2014, 70, 5558-5568. 11. В. В. Попов, С. А. Амеличев, Л. С. Константинова, О. А. Ракитин, В. В. Новиков “ Первый синтез радикала [1,3]дитиоло[4,5-d][1,3,2]дитиазолия ” Тезисы III Молодежной конференции ИОХ РАН, 23 – 24 апреля 2009 г., Москва, стр. 66-67. 12. В. В. Попов, Л. С. Константинова, О. А. Ракитин «Синтез 1,2,3-дитиазолильных катион-радикалов» Тезисы 1-ой Международной конференции "Новые направления в химии гетероциклических соединений" 3-8 мая 2009 г., г. Кисловодск, стр. 410. 13. В. В. Попов, С. А. Амеличев, Л. С. Константинова, О. А. Ракитин, В. В. Новиков “Синтез и идентификация 5-дицианометилен[1,3]дитиоло-[4,5d][1,3,2]дитиазолильного радикала ” Тезисы IV Молодежной конференции ИОХ РАН, 11 – 12 ноября 2010 г., Москва, стр. 150-151. 14. Л. С. Константинова, Е. А. Князева, О. А. Ракитин «Необычное превращение 1,2,5оксадиазольного цикла в 1,2,5-тиадиазольный. Новый метод синтеза [1,2,5]тиадиазоло[3,4-с][1,2,5]тиадиазола» Тезисы XV Молодежной школыконференции по органической химии, 31 мая – 2 июня 2012 г., Уфа, стр. 146. 15. V. V. Popov, L. S. Konstantinova, S. A. Amelichev, I. S. Bushmarinov, K. A. Lyssenko, L. V. Mikhalchenko, V. V. Novikov, V. P. Gultyai, O. A. Rakitin “Identification of [1,3]dithiolo[4,5-d]dithiazolyl radicals by in situ EPR spectrometry and cyclic voltammetry” Abstracts of the FLOHET-2013 Annual Florida Heterocyclic and Synthetic IUPAC-Sponsored Conference, Florida, USA, 2013, March 3 – 6, P127. 16. L. S. Konstantinova, E. A. Knyazeva, V. V. Popov, A. V. Zibarev, O. A. Rakitin, “Selective synthesis of benzofused 1,2,5-thiadiazoles and their 1-oxides from vicinal nitroamines and sulfur monochloride” Abstracts of the FLOHET-2013 Annual Florida Heterocyclic and Synthetic IUPAC-Sponsored Conference, Florida, USA, 2013, March 3 – 6, P128. 17. L. S. Konstantinova, E. A. Knyazeva, O. A. Rakitin, “Selective synthesis of [1,2,5]selenadiazolo[3,4-c][1,2,5]selenadiazole” Abstracts of the ICCST-12 12th International Conference on the chemistry of selenium and tellurium, Cardiff, Wales, UK, 2013, July 22 – 26, P. 67. 18. Е. А. Князева, Л. С. Константинова, О. А. Ракитин “Селективный синтез 1,2,5тиадиазолов и их 1-оксидов из вицинальных диоксимов и монохлорида серы” Тезисы Третьей Международной научной конференции «Новые направления в химии гетероциклических соединений», 17-21 сентября 2013 г., Пятигорск, стр. 200, 86-с. 19. L. S. Konstantinova, E. A. Knyazeva, O. A. Rakitin “Selective synthesis of [1,2,5]selenadiazolo[3,4-c][1,2,5]selenadiazole” Abstracts of the ICOS-20 20th International Conference on Organic Synthesis, Budapest, Hungary, 29 June– 4 July 2014, P-91. 20. L. S. Konstantinova, E. A. Knyazeva, O. A. Rakitin “Unexpected direct conversion of fused 1,2,5-selenadiazoles into 1,2,5-thiadiazoles” Abstracts of the International Conference "Molecular Complexity in Modern Chemistry" (MCMC-2014), Moscow, Russia, September 13 – 19 2014, P131. Лаборатория исследования гомолитических реакций № 13 НОВЫЕ РЕАКЦИИ ОКИСЛИТЕЛЬНОГО С-О СОЧЕТАНИЯ А.О. Терентьев, И.Б. Крылов, И.А.Яременко, В.А. Виль, Г.И. Никишин АННОТАЦИЯ Разработка методов окислительного кросс-сочетания (cross-dehydrogenative coupling, CDC, oxidative cross-coupling) является одним из главных направлений в современной органической химии. Как правило, эти термины обозначают реакции, в которых две разные молекулы соединяются новой связью с отщеплением по атому водорода от каждой из них, однако реакциями окислительного кросс-сочетания также называют большое число разнообразных процессов с участием окислителей, включающих межмолекулярное формирование новых связей. Такие реакции, например, включают окисление нескольких CH связей, отщепление от исходных молекул не только атомов водорода, но и других фрагментов, присоединение по кратным С-С связям и т.п. Окислительное кросс-сочетание позволяет осуществить образование новой связи с высокой атомной эффективностью и не требует дополнительных синтетических стадий введения в молекулы функциональных групп, необходимых в других вариантах кросссочетания, например, таких как: -Hal, -OTf, -BR2, -SnR3, -SiR3, -ZnHal, -MgHal. Таким образом, окислительное сочетание является перспективным подходом к снижению отходности и количества стадий органического синтеза. Проблема реализации окислительного сочетания заключается в обеспечении селективности процесса и минимизации побочных процессов окисления. Изучение процессов окислительного сочетания представляет не только практический, но и фундаментальный интерес, так как их реализация требует открытия новых аспектов реакционной способности органических соединений. Прогнозирование условий, необходимых для успешного осуществления окислительного кросс-сочетания, представляет актуальную задачу, требующую изучения механизмов этих процессов. Среди реакций окислительного кросс-сочетания наиболее развиты реакции С-С сочетания, в меньшей степени исследовано C-O сочетание. Исходное соединение, предоставляющее атом углерода для новой связи C-O, называется CH-реагентом или Cреагентом, а соединение, предоставляющее атом кислорода — OH-реагентом или Oреагентом. В настоящей работе обнаружено окислительное С-О кросс-сочетание фундаментальных для органической химии соединений: оксимов, N-гидроксиимидов, N-гидроксиамидов, гидропероксидов (О-H реагенты) с алкиларенами, β-дикарбонильными соединениями и их аналогами (С-Н реагенты). Впервые осуществлено окислительное С–O кросс–сочетание β-дикетонов и β-кетоэфиров с оксимами. Наилучшие результаты получены с использованием доступных окислителей на основе марганца: KMnO4, Mn(OAc)2/KMnO4 и Mn(OAc)3•2H2O; метод применим для сочетания широкого круга оксимов и β-дикарбонильных соединений, выходы составляют 27–92%. Результат необычен тем, что ранее Mn-содержащие окислители, в том числе Mn(OAc)3 и перманганаты, применялись для более глубокого окисления оксимов с селективным образованием карбонильных соединений. O O O O O Окислитель H H O N N Генерирование иминоксильных радикалов из оксимов в реакционных условиях доказано методом спектроскопии ЭПР. Обнаруженный процесс показал возможность использования генерируемых из оксимов неустойчивых иминоксильных радикалов в селективной межмолекулярной реакции. Впервые осуществлено окислительное С-O кросс-сочетание β-дикарбонильных соединений и их гетероаналогов, 2-замещенных малононитрилов и циануксусных эфиров, с N-гидроксиамидами и N-гидроксиимидами. Лучшие результаты получены с использованием в качестве окислителя Mn(OAc)3 или системы Co(OAc)2cat/KMnO4, выходы 30–94%. EWG1 O N EWG2 H H O EWG1 EWG2 O Окислитель N O EWG1, EWG2 = COOEt, COMe, CN Вероятно, реакции протекают по радикальному механизму через стадию образования из N-гидроксиамидов и N-гидроксимидов нитроксильных радикалов, что подтверждено непосредственным наблюдением этих радикалов методом спектроскопии ЭПР. Предложен метод окислительного C-O сочетания алкиларенов и родственных соединений с N-гидроксифталимидом (NHPI) под действием церий (IV) аммоний нитрата (CAN) с получением O-замещенных NHPI. Особенностью реакции является двойная роль NHPI: из него под действием CAN образуется фталимид-N-оксильный радикал (PINO), который затем отрывает атом водорода из бензильного положения с образованием Cцентрированного радикала. Целевой продукт окислительного сочетания образуется преимущественно путем рекомбинации PINO с C-центрированным радикалом. Таким образом, NHPI служит медиатором радикального процесса и реагентом для радикального сочетания. O O Окислитель Ar H + HO N O Ar O N O Предложен метод селективного пероксидирования α-замещеных β-дикетонов, кетоэфиров, диэфиров, динитрилов и цианэфиров в α-положение с использованием системы соль переходного металла (Cu, Fe, Mn, Co) / трет-бутилгидропероксид. Обнаружено, что эффективным катализатором данного процесса является Cu(ClO4)2, аналогичную активность проявляет Cu(BF4)2. Метод позволяет осуществлять пероксидирование различных по структуре α-замещенных β-дикарбонильных соединений и их гетероаналогов, продуктами реакции являются пероксиды ранее недоступных структурных типов. ButOO-H O O H R''' R' R'' O ButOOH, Mn+ R' CH3CN R'' O R''' OOBut R', R''' = CH3, OEt, OMe R'' = ArCH2, alkyl Синтезы легко масштабируются без снижения выхода целевых пероксидов, которые могут быть получены в граммовых количествах. Нестандартность разработанного подхода к синтезу пероксидов заключается в использовании солей переходных металлов, которые, в особенности соли железа и меди, как правило, применяют для разложения пероксидов. Публикации 1. Terent’ev A.O., Krylov I.B., Sharipov M.Y., Kazanskaya Z.M., Nikishin G.I. Tetrahedron. 2012, 68, 10263-10271. 2. Terent’ev A.O., Krylov I.B., Timofeev V.P., Starikova Z.A., Merkulova V.M., Ilovaisky A.I., Nikishin G.I., Adv. Synth. Catal. 2013, 355, 2375-2390. 3. Krylov I.B., Terent’ev A.O., Timofeev V.P., Shelimov B.N., Novikov R.A., Merkulova V.M., Nikishin G.I., Adv. Synth. Catal. 2014, 356, 2266-2280 4. Terent'ev Alexander; Borisov Dmitry; Yaremenko Ivan; Chernyshev Vladimir; Nikishin Gennady. J.Org.Chem. 2010, 75, 5065-5071. 5. Alexander O. Terent’ev, Dmitry A. Borisov, Vsevolod V. Semenov, Vladimir V. Chernyshev, Valery M. Dembitsky, Gennady I. Nikishin. Synthesis 2011, №13, 2091-2100. Лаборатория тонкого органического синтеза им. И.Н. Назарова №11 НОВЫЕ УСТОЙЧИВЫЕ ИММОБИЛИЗОВАННЫЕ ОРГАНОКАТАЛИЗАТОРЫ ДЛЯ СИНТЕЗА ХИРАЛЬНЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ А.С. Кучеренко, С.В. Кочетков, В.Г. Лисняк, С.Г. Злотин АННОТАЦИЯ Асимметрический органокатализ является бурно развивающимся направлением современной органической химии. В присутствии хиральных, не содержащих атомов металлов органических молекул (производных -аминокислот, аминов и др.) простые ахиральные соединения могут превращаться в полифункциональные продукты, имеющие высокую энантиомерную чистоту. При этом исключается свойственный металлокомплексному катализу риск попадания тяжелых металлов в продукты реакций, что особенно важно для получения лекарственных препаратов, присутствие в которых даже следов металлов часто недопустимо. Однако наиболее эффективные органокатализаторы довольно дороги, что делает актуальной разработку способов их регенерации. Ранее нами были разработаны общие методы синтеза иммобилизованных органокатализаторов асимметрических альдольных реакций на основе природных аминокислот и их производных, содержащих фрагменты ионных жидкостей (ИЖ). Однако такие катализаторы зачастую удавалось регенерировать лишь в 3-4 реакционных циклах. После чего происходило заметное снижение их активности и селективности, вследствие вымывания катализатора в органическую фазу или отравления. В настоящей работе мы предлагаем новые подходы к созданию более устойчивых форм иммобилизованных органокатализаторов асимметрических реакций карбонильных соединений, направленных на получение биологически активных веществ, путем введения в их состав специфических ионных фрагментов. Для решения проблемы повышения устойчивости катализаторов мы использовали два основных метода: 1) введение в молекулу дополнительных фрагментов ионных жидкостей, что позволило уменьшить вымывание катализатора в органическую фазу, 2) модификация ионного фрагмента функциональными группами, принимающими участие в каталитическом цикле реакции. Таким образом, были получены эффективные катализаторы асимметрических альдольных реакций Ia-c (схема 1). Среди веществ образующихся под действием полученных катализаторов особую ценность имеют природные вещества гингерол и его аналоги, различные полиолы и другие. Схема 1. O O O N H COOH O HN Ph O O Ph Ia N H HO O R HN R HN O O N H Ib O HN = IL Ph Ic Ph HN HO O Впервые синтезированы регенерируемые органокатализаторы на основе хирального 1(S),2(S)-дифенилдиаминоэтана, содержащие в своем составе катионы 1-метилимидазолия и 1-карбоксибутилимидазолия (схема 2). Полученные катализаторы IIa,b способны осуществлять взаимодействие между 4-гидроксикумарином а также его аналогами и различными -непредельными кетонами. Все изученные реакции протекают с высокими выходами (до 97%) и значениями ее (до 91%). Иммобилизованные органокатализаторы можно использовать многократно (3-7 реакционных циклов). Методом ESI-MS(+) был детально изучен возможный механизм дезактивации катализатора. В качестве особо ценного продукта можно отметить лекарственный препарат «варфарин». Предложен метод восстановления активности и селективности отработанных катализаторов Схема 2. R R R R O H 2N HN O H 2N IIa HN IIb CO2H = IL Таким образом, полученные результаты носят фундаментальный характер и позволяют расширить область применения хиральных иммобилизованных органокатализаторов для синтеза биологически активных соединений. СПИСОК ПУБЛИКАЦИЙ 1. Alexander S. Kucherenko, Dmitry E. Siyutkin, Albert G. Nigmatov, Alexander O. Chizhov, Sergei G. Zlotin. Chiral Primary Amine Tagged to Ionic Group as Reusable Organocatalyst for Asymmetric Michael Reactions of C-Nucleophiles with a,bUnsaturated Ketones. Adv. Synth. Catal. 2012, 354, 3078 – 3086. 2. Sergei V. Kochetkov, Alexandr S. Kucherenko, Galina V. Kryshtal, Galina M. Zhdankina, Sergei G. Zlotin. Simple Ionic Liquid Supported C2-Symmetric Bisprolinamides as Recoverable Organocatalysts for the Asymmetric Aldol Reaction in the Presence of Water. Eur. J. Org. Chem. 2012, 7129–7134. 3. Sergei V. Kochetkov, Alexandr S. Kucherenko, Sergei G. Zlotin. (1R,2R)-Bis[(S)prolinamido]cyclohexane Modified with Ionic Groups: The First C2-Symmetric Immobilized Organocatalyst for Asymmetric Aldol Reactions in Aqueous Media. Eur. J. Org. Chem. 2011, 6128–6133. 4. Alexandr S. Kucherenko, Vladislav G. Lisnyak, Alexandr O. Chizhov, Sergei G. Zlotin. Primary Amine Attached to an N-(Carboxyalkyl)imidazolium Cation: A Recyclable Organocatalyst for the Asymmetric Michael Reaction. Eur. J. Org. Chem. 2014, 3808– 3813. Лаборатория функциональных органических соединений № 8 НОВАЯ МЕТОДОЛОГИЯ СИНТЕЗА СОЕДИНЕНИЙ С CF2-ФРАГМЕНТОМ А.Д. Дильман, В.В. Левин, А.А. Земцов, М.Д. Кособоков, А.В. Цымбал АННОТАЦИЯ Предложен новый подход к синетзу соединений с CF2-фрагментом, основанный на сочетании трех компонентов— нуклеофила, дифторкарбена и электрофила. В качестве нуклеофилов могут использоваться цинкорганические реганеты, взаимодействие которых с источником дифторкарбена приводит к гем-дифторзамещенным цинкорганическим производным 1, которые обладают умеренной стабильностью. В качестве источника дифторкарбена использовались Me3SiCF2Br или бромдифторацетат калия. Реагенты 1 могут вовлекаться в реакции кросс-сочетания (реакция с аллилгалогенидами при катализе солями меди), а также протонироваться или взаимодействовать с галогенами с образованием продуктов, которые сложно получить другими способами. Реакция триметилсилцианида с дифторкарбеном дает (триметилсилил)дифторацетонитрил (2), который был выделен в индивидуальном состоянии. Этот кремниевый реагент реагирует с альдегидами и иминами с образованием фторсодержащих спиртов 3 (при содействии ацетатом лития) и аминов 4 (при использовании in situ генерируемой фтористоводородной кислоты). Амины 4 могут использоваться в синтезе фторсодержащих шестичленных гетероциклических соединений при взаимодействии с электрофильной двойной связью. Например, реакция аминов 4 с изоциантами может приводить к мочевинам 5, из которых могут быть получены 5-фторурацилы 6. Также предложен метод для осуществления реакций нуклеофильного бром- и иоддифторметилирования. Метод основывается на использовании комбинации галогениданиона с дифторкарбенов в качестве эквивалента нестабильного галодифторметильного карбаниона 7. Реакция альдегидов с галодифторметилсиланом проводится в присутствии галогенид аниона при нагревании в пропионитриле, давая соответствиующие фторзамещенные спирты. Более активные иминиевые катионы реагируют при комнатной температуре с образованием фторзамещенных третичных аминов. Публикации 1. Kosobokov, M. D.; Dilman, A. D.; Levin, V. V.; Struchkova, M. I. J. Org. Chem. 2012, 77, 5850. 2. Levin, V. V.; Zemtsov, A. A.; Struchkova, M. I.; Dilman, A. D. Org. Lett. 2013, 15, 917. 3. Kosobokov, M. D.; Struchkova, M. I.; Arkhipov, D. E.; Korlyukov, A. A.; Dilman, A. D. J. Fluorine Chem. 2013, 154, 73. 4. Kosobokov, M.D.; Levin, V.V.; Zemtsov, A.A.; Struchkova, M.I.; Korlyukov A.A.; Arkhipov, D.E.; Dilman, A.D. Org. Lett. 2014, 16, 1438. 5. Kosobokov, M. D.; Levin, V. V.; Struchkova, M. I.; Dilman, A. D. Org. Lett. 2014, 16, 3784. 6. Кособоков, М. Д.; Стручкова, М. И.; Дильман, А. Д. Изв. Акад. Наук., Сер. хим., 2014, 549. 7. Zemtsov, A. A.; Kondratyev, N. S.; Levin, V. V.; Struchkova, M. I.; Dilman, A. D. J. Org. Chem. 2014, 79, 818. 8. Tsymbal, A. V.; Kosobokov, M. D.; Levin, V. V.; Struchkova, M. I.; Dilman, A. D. J. Org. Chem. 2014, 79, 7831. 9. Levin, V. V.; Zemtsov, A. A.; Struchkova, M. I.; Dilman, A. D. J. Fluorine Chem. in press, DOI: 10.1016/j.jfluchem.2014.08.021 10. Смирнов, В.О.; Маслов, А.С.; Левин, В.В.; Стручкова, М.И.; Дильман, А.Д. Изв. Акад. Наук., Сер. хим., в печати. Лаборатория химии гликоконъюгатов № 52 ИЗОМЕРИЗАЦИЯ ПИРАНОЗИДОВ В ФУРАНОЗИДЫ — НОВАЯ РЕАКЦИЯ В ХИМИИ УГЛЕВОДОВ И ЕЕ ПРИМЕНЕНИЕ В ОЛИГОСАХАРИДНОМ СИНТЕЗЕ В.Б. Крылов, А.Г. Гербст, Д.А. Аргунов, Д.З. Винницкий, Н.Э.Нифантьев АННОТАЦИЯ Открыта новая реакция, не имеющая аналогии в органической химии – перегруппировка пиранозидов в фуранозиды. Данное превращение позволяет с хорошими выходами проводить трансформацию пиранозидных производных в фуранозидные с сохранением заместителей и конфигураций асимметрических центров в углеводном цикле. Превращение протекает при кислотно катализируемом исчерпывающем сульфатировании под действием PySO3 (Рис. 1). На первой стадии процесса происходит быстрое Oсульфатирование пиранозида I с количественным образованием продукта II. При выдерживании реакционной смеси пиранозид II количественно изомеризуется (с раскрытием пиранозного цикла) в фуранозид III, который десульфатируют с образованием IV. Исследование механизма и кинетики перегруппировки проведено с помощью спектроскопии ЯМР и расчетов ab initio. Рисунок 1. Общая схема изучаемой перегруппировки пиранозидов в фуранозиды. Рассмотренный процесс применим для превращения различных избирательно защищенных моносахаридных (галактоза, арабиноза, фукоза, глюкоза) олигосахаридных субстратов, позволяет существенно упростить сложные схемы синтезов как избирательно замещенных фуранозидов, так и соответствующих олигосахаридов. Это продемонстрировано впервые проведенными синтезами сложных гетеросахаридов, структурно родственных фрагментам галактоманнана плесневого гриба Aspergillus fumigatus («черная гниль»), полисахаридов патогенных бактерий Klebsiella pneumonia и Enterococcus faecalis, а также фукоидана из бурой водоросли Chordaria flagelliformis (рис.2). Синтезированные антигенные олигосахариды получены для разработки диагностикумов для обнаружения соответствующих патогенов, изучения биологического узнавания белками иммунной системы полисахарида K. pneumonia и использования при установлении строения дигетерогликана E. faecalis, которое было нами проведено впервые также в рамках данного исследования. Рисунок 2. Применение открытой перегруппировки в олигосахаридном синтезе. Список публикаций: 1. V.B. Krylov, N.E. Ustyuzhanina, A.A. Grachev, N.E. Nifantiev,“Efficient acid-promoted per-O-sulfation of organic polyols” Tetrahedron Lett., 2008, 49, 5877-5879. 2. V.B. Krylov, Z.M. Kaskova, D.Z. Vinnitskiy, N.E. Ustyuzhanina, A.A. Grachev, A.O. Chizhov, N.E. Nifantiev “Acid-promoted synthesis of per-O-sulfated fucooligosaccharides related to fucoidan fragments” Carbohydr. Res. 2011, 346, 540-550 3. V.B. Krylov, D.A. Argunov, D.Z. Vinnitskiy, S.A. Verkhnyatskaya, A.G. Gerbst, N.E. Ustyuzhanina, A.S. Dmitrenok, J. Huebner, O. Holst, H.-C. Siebert, N.E. Nifantiev, “Pyranoside-into-Furanoside Rearrangement: New Reaction in Carbohydrate Chemistry and Its Application in Oligosaccharide Synthesis”, Chem. Eur. J., 2014. doi: 10.1002/chem.201405083. 4. V.B. Krylov, D.A. Argunov, N.E. Nifantiev “Preparative synthesis of selectively substituted 1,6-anhydro-α-D-galactofuranose derivatives”, Mendeleev Commun. 2014, 24, 336-337. 5. V.B. Krylov, A.G. Gerbst, D.A. Argunov, A.S. Dmitrenok, A.S. Shashkov, Z. Kaczynski, J. Huebner, O. Holst, N.E. Nifantiev “Definitive Structural Assessment of Enterococcal Diheteroglycan” , Chem. Eur. J., (2015) doi: 10.1002/chem.201405857 . 6. А.Г. Гербст, В.Б. Крылов, Н.Э. Нифантьев Сравнительный анализ методов расчета ab initio ключевых стадий механизма перегруппировки сульфатированных пиранозидов в фуранозиды, (2014) направлено в редакцию. 7. D.A. Argunov, V.B. Krylov, N.E. Nifantiev “Convergent synthesis of isomeric heterosaccharides related to the fragments of galactomannan from Aspergillus fumigatus”, (2014) направлено в редакцию. Лаборатория химии углеводов № 21 Лаборатория металлокомплексных и наноразмерных катализаторов № 30 БИОХИМИЧЕСКИЕ ОСНОВЫ ФАГОТЕРАПИИ ВНУТРИБОЛЬНИЧНЫХ ИНФЕКЦИЙ. РАСЩЕПЛЕНИЕ БАКТЕРИАЛЬНЫХ ПОЛИСАХАРИДОВ СПЕЦИФИЧЕСКИМИ ХВОСТОВЫМИ ДЕПОЛИМЕРАЗАМИ БАКТЕРИОФАГОВ Ю.А. Книрель, С.Н. Сенченкова, А.О. Чижов АННОТАЦИЯ В группу наиболее распространенных возбудителей внутрибольничных инфекций входят виды Acinetobacter baumannii и Pseudomonas aeruginosa (синегнойная палочка), при этом роль первого постоянно возрастает во всем мире. Для этих бактерий характерна антибиотикоустойчивость, спектр которой постоянно расширяется, и у отдельных клинических изолятов чувствительность может снижаться до одного-двух антибиотиков и даже может возникать панрезистентность. В связи с этим перспективной является фаготерапия, основанная на лизисе бактериальных клеток бактериофагами. Одним из факторов вирулентности бактерий являются специфические полисахариды, расположенные на клеточной поверхности: у Acinetobacter baumannii это капсульный полисахарид (КПС, K-антиген), а у Pseudomonas aeruginosa – липополисахарид (ЛПС) с длинной Оспецифической полисахаридной цепью (ОПС, О-антиген). Бактериофаги узнают защитные поверхностные полисахариды бактерий (на этом основано фаготипирование) и расщепляют их специфическими хвостовыми деполимеразами, что необходимо для последующего успешного инфицирования бактерий. Бактериофаги имеют целый рzд преимуществ перед антибиотиками, важнейшие из которых – высокая специфичность и, как следствие, отсутствие подавления нормальной микрофлоры, а также минимальное число противопоказаний к применению. С целью разработки биохимических основ фаготерапии мы определили строение КПС Acinetobacter baumannii (строение ОПС Pseudomonas aeruginosa установлено нами ранее) и изучили механизмы расщепления полисахаридов этих бактерий хвостовыми деполимеразами специфических бактериофагов. Строение КПС и продуктов расщепления КПС и ОПС устанавливали с помощью двумерной спектроскопии 1H и 13C ЯМР, масс-спектрометрии высокого разрешения и химических методов, включая избирательный кислотный гидролиз. В результате были установлены структуры шести КПС Acinetobacter baumannii, построенных из линейных или разветвленных повторяющихся олигосахаридных звеньев (от трисахаридных до пентасахаридных). В их составе обнаружены как общие моносахариды (Glc, Gal, GlcNAc, GalNAc), так и специфические моносахаридные компоненты, такие как гексуроновые кислоты, N-ацильные производные 2-амино2,6-дезоксигексоз (D- и L-FucNAc), 2,4-диамино-2,4,6-тридезоксигексозы (бациллозамина) и 5,7-диамино-3,5,7.9-тетрадезоксинонулозоновых (легионаминовой и псевдаминовой) кислот. Для дальнейшего исследования были выбраны бактериофаги, строго специфичные к штаммам исследуемых бактерий, и были получены их рекомбинатные хвостовые деполимеразы. Основным продуктом расщепления КПС Acinetobacter baumannii 1053 деполимеразой бактериофага AP22 оказался трисахарид с 4,5-ненасыщенным моносахаридным остатком на невосстанавливающем конце, образовавшийся в результате -элиминирования от остатка 2-амино-2-деоксиманнуроной кислоты присоединенного к нему остатка FucNAc. Наряду с ним был получен гексасахарид, включающий одно модифицированное и одно интактное повторяющееся звено КПС. Аналогичный трисахарид с 4,5-ненасыщенным моносахаридом образовался в результате -элиминирования остатка FucNAc от остатка 2,3-диамино-2,3-дидезоксиманнуроной кислоты в ОПС Pseudomonas aeruginosa PAO1 под действием деполимеразы бактериофага 297. Таким образом, по механизму своего действия эти деполимеразы является лиазами, специфически расщепляющими полисахариды по механизму -элиминирования. Рекомбинантная деполимераза бактериофага FriI обладала гидролитической активностью и избирательно расщепляла КПС Acinetobacter baumannii 28 по гликозидной связи остатка бациллозамина. Гидролиз привел в основном к нонасахариду, являющемуся тримером повторяющегося звена КПС, наряду с гексасхаридом (димером) и додекасахаридом (тетрамером). Таким образом, деполимераза фага Fri1 является специфической гликозидазой. Изученные деполимеразы были получены в кристаллической форме и их пространственные структуры были установлены с помощью рентгеноструктурного анализа высокого разрешения. В результате было найдено, что все деполимеразы являются крупными тримерными белками сходного строения, и была выявлена локализация активных центров ферментов, находящихся в середине -спиральной части белков. Кристаллографическая визуализация трисахаридного продукта расщепления КПС Acinetobacter baumannii 1053 в составе его комплекса с лиазой фага AP22 позволила независимо подтвердить строение этого продукта и определить аминокислоты, участвующие в его связывании (пролин, тирозин, глютамин, изолейцин и другие). Таким образом, в результате проведенного исследования определены структуры шести ранее неисследованных КПС, представляющих восемь молекулярных групп Acinetobacter baumannii; установлены механизмы расщепления хвостовыми деполимеразами специфических бактериофагов полисахаридов трех штаммов Acinetobacter baumannii и Pseudomonas aeruginosa, циркулирующих в российских клиниках; определены пространственные структуры рекомбинантных фаговых деполимераз и комплекса лиазы фага AP22 с трисахаридным продуктом расщепления КПС Acinetobacter baumannii 1053; полученные данные являются химической основой для классификации штаммов Acinetobacter baumannii и биохимической основой для фаготерапии инфекций, вызываемых бактериями Acinetobacter baumannii и Pseudomonas aeruginosa. СПИСОК СТАТЕЙ И ТЕЗИСОВ КОНФЕРЕНЦИЙ S.N. Senchenkova, A.S. Shashkov, M.M. Shneider, N.P. Arbatsky, A.V. Popova, K.A. Miroshnikov, N.V. Volozhantsev, Y.A. Knirel. Structure of the capsular polysaccharide of Acinetobacter baumannii ACICU containing di-N-acetylpseudaminic acid. Carbohydr. Res. 2014, 391, 89-92. S.N. Senchenkova, A.S. Shashkov, A.V. Popova, M.M. Shneider, A.S. Nikitina, V.V. Babenko, E.S. Kostryukova, K.A. Miroshnikov, N.V. Volozhantsev, Y.A. Knirel. Structure of the capsular polysaccharide of Acinetobacter baumannii 1053 having the KL40 capsule biosynthesis locus. Carbohydr. Res. in press. А.С. Шашков, С.Н. Сенченкова, Ю.А. Книрель, М.М. Шнейдер, К.А. Мирошников, А.В. Попова, Н.В. Воложанцев. Строение капсульных полисахаридов Acinetobacter baumannii – возбудителя внутрибольничных инфекций. II Всероссийская конференция “Фундаментальная гликобиология”, 7-11 июля 2014 г., г. Саратов. Ю.А. Книрель, С.Н. Сенченкова, А.С. Шашков, А.О. Чижов, М.М. Шнейдер, К.А. Мирошников, А.В. Попова, Н.В. Воложанцев, S. Buth, P. Leiman. Расщепление капсульных полисахаридов Acinetobacter baumannii специфическими хвостовыми деполимеразами литических бактериофагов. II Всероссийская конференция “Фундаментальная гликобиология”, 7-11 июля 2014 г., г. Саратов. Y. Knirel, M. Shneider, A. Popova, S. Senchenkova, A. Shashkov, A. Chizhov, N. Volozhantsev, K. Miroshnikov, S. Buth, P. Leiman. Degradation of capsular polysaccharides of Acinetobacter baumannii by specific phage tail-spike depolymerases. 27th International Carbohydrate Symposium, 12–17 January 2014, Bangalore, India. K.A. Miroshnikov, M.M. Shneider, S.A. Buth, A.S. Shashkov, A.V. Popova, Yu.A. Knirel, P.G. Leiman. Acinetobacter polysaccharide degradation by the tailspike protein of bacteriophage AP22. EMBO Conference “Viruses of microbes: Structure and function, from molecules to communities”, 14–18 July 2014, Zurich, Switzerland Лаборатория растительных полисахаридов № 41 Лаборатория металлокомплексных и наноразмерных катализаторов № 30 ПОЛИСАХАРИДЫ БУРОЙ ВОДОРОСЛИ PUNCTARIA PLANTAGINEA А.И. Усов, М.И. Билан, Г.П. Смирнова, А.С. Шашков АННОТАЦИЯ Бурые водоросли представляют собой хорошо обособленный класс крупных морских фотосинтезирующих организмов (Phaeophyceae), которые находят разнообразное практическое применение главным образом благодаря присутствующим в них уникальным полисахаридам. Согласно имеющимся общепринятым представлениям, все бурые водоросли содержат резервные (1→3,1→6)-β-D-глюканы (ламинараны) и два типа структурных полисахаридов, альгиновые кислоты и фукоиданы. Альгиновые кислоты и их соли (альгинаты) являются объектом многотоннажного промышленного производства и используются как структурирующие агенты в пищевой промышленности, биотехнологии и медицине. Фукоиданы представляют собой, как правило, достаточно сложные сульфатированные гетерополисахариды. Постоянно растущий интерес к этим биополимерам объясняется их высокой и разнообразной биологической активностью. Данные о химическом строении альгиновых кислот и фукоиданов и современном состоянии структурного анализа этих полисахаридов можно найти в обзорах [1,2]. Для предварительной характеристики полисахаридного состава бурых водорослей в лаборатории № 41 была разработана спектрофотометрическая методика определения содержания альгинатов и фукоиданов в биомассе [3], которая оказалась весьма удобной для выявления различий между видами [4] и между отдельными частями таллома [5]. Применение этой методики к нескольким видам бурых водорослей Японского моря позволило установить, что наиболее богатой фукоиданом является Punctaria plantaginea. Эта водоросль содержала резервный глюкан (6.0%), фукоидан (19.2%) и альгинат (12.7%). Перечисленные полисахариды были выделены с помощью фракционной экстракции с последующей дополнительной очисткой, и их строение было изучено с применением химических методов структурного анализа в сочетании со спектроскопией ЯМР. Показано, что, в отличие от хорошо известных ламинаранов, резервный полисахарид P. plantaginea является новым для бурых водорослей линейным (1→6)-β-Dглюкопирананом [6]. В молекулах альгиновой кислоты содержание остатков гулуроновой кислоты (G) превышает содержание остатков маннуроновой кислоты (М), M/G = 0.5. Из продуктов частичного гидролиза альгиновой кислоты выделены блоки поли-G и поли-MG, но вместо ожидаемой фракции поли-М была получена смесь разнородных фрагментов полисахарида [6]. Содержащийся в водоросли фукоидан, как и глюкан, оказался новым для бурых водорослей типом сульфатированного полисахарида. (сульфатированным ксилофуканом), в составе которого были найдены α-L-фукоза, β-D-ксилоза и сульфат в соотношении 5:2:3. Его молекулы имеют главную цепь из остатков 3-связанной α-Lфукопиранозы, приблизительно две трети которых сульфатированы по О-2 с образованием трисахаридных повторяющихся звеньев →3)-α-L-Fucp-2-SO3Na-(1→3)-α-L-Fucp-2-SO3Na(1→3)-α-L-Fucp-(1→. Эта структурная регулярность замаскирована случайным распределением вдоль цепи единичных несульфатированных остатков β-D-ксилопиранозы, присоединенных к остаткам фукозы главной цепи в положения 4 [7]. H3C HO O HO O O HO H3C O OSO3Na O OSO3Na O HO H3C HO O HO O O O OH HO H3C O O OSO3Na HO Таким образом, оказалось, что по своему полисахаридному составу бурая водоросль Punctaria plantaginea существенно отличается от других видов этого класса. Резервные (1→6)-β-D-глюканы ранее в бурых водорослях не находили, они были известны только как компоненты некоторых грибов и лишайников (пустуланы). Частичный гидролиз альгиновой кислоты позволил получить индивидуальный полигулуронан. Такие полисахариды в природе не встречаются, но могут представить интерес для физикохимических и биологических исследований. Но наибольший интерес представляет найденный в водоросли сульфатированный ксилофукан. Его структура служит новым подтверждением того факта, что разнообразие фукоиданов, содержащихся в разных видах бурых водорослей, существенно выше, чем считалось ранее. В новом фукоидане имеются две структурных особенности, которые отличают его от других представителей этой группы полисахаридов, а именно, регулярное распределение сульфатных групп вдоль полимерной цепи и обильное замещение этой цепи единичными несульфатированными остатками β-D-ксилопиранозы. Значение этих структурных параметров для проявления биологической активности будет проанализировано в дальнейшем при сравнительном исследовании биологических свойств фукоиданов разного происхождения. ЛИТЕРАТУРА 1. А.И.Усов. Альгиновые кислоты и альгинаты: метода анализа, определения состава и установления строения. // Успехи химии, 68(11), 1051-1061 (1999). 2. А.И.Усов, М.И.Билан. Фукоиданы – сульфатированные полисахариды бурых водорослей. // Успехи химии, 78(8), 846-862 (2009). 3. A.I.Usov, G.P.Smirnova (2003), A new procedure for determination of alginate and fucoidan in brown seaweeds. // Proceedings of the XVIIth International Seaweed Symposium. / A.R.O.Chapman, R.J.Anderson, V.J.Vreeland and I.R.Davison, eds., Oxford, UK, Oxford University Press, 2003, pp. 209−212. 4. А.И.Усов, Г.П.Смирнова, Н.Г.Клочкова. Полисахариды водорослей. 55. Полисахаридный состав некоторых бурых водорослей Камчатки. // Биоорганическая химия, 27(6), 444-448 (2001). 5. А.И.Усов, Г.П.Смирнова, Н.Г.Клочкова. Полисахариды водорослей. Сообщение 58. Полисахаридный состав тихоокеанской бурой водоросли Alaria fistulosa P. et R. (Alariaceae, Laminariales). // Известия Академии наук. Серия химическая. № 5, 12451549 (2005). 6. М.И.Билан, Г.П.Смирнова, А.С.Шашков, А.И.Усов. Полисахариды водорослей. Сообщение 65. Необычный полисахаридный состав тихоокеанской бурой водоросли Punctaria plantaginea. // Известия Академии наук. Серия химическая. № 2, 522-528 (2014). 7. M.I.Bilan, A.S.Shashkov, A.I.Usov. Structure of a sulfated xylofucan from the brown alga Punctaria plantaginea. // Carbohydrate Research, 393, 1-8 (2014). Лаборатория химии стероидных соединений № 22 Лаборатория гетероциклических соединений № 3 МОЛЕКУЛЯРНЫЙ ДИЗАЙН, РАЗРАБОТКА МЕТОДОВ СИНТЕЗА И ОЦЕНКА ВОЗМОЖНЫХ БИОЛОГИЧЕСКИХ ФУНКЦИЙ НОВЫХ D1 ПЕНТАЦИКЛИЧЕСКИХ СТЕРОИДОВ И.В. Заварзин, И.С. Левина, И.В. Федюшкина, В.З. Ширинян, М.М Краюшкин АННОТАЦИЯ Прогестины (аналоги прогестерона) – гормональные препараты, получаемые химическими модификациями природного стероидного скелета широко используются в контрацепции, гормональной заместительной и противоопухолевой терапии и лечении различных гинекологических заболеваний. Очень важный аспект применения прогестагенных лекарств - предотвращение выкидышей и лечение бесплодия. Общеизвестно, что прогестерон связывается со своим ядерным рецептором (РП), индуцируя конформационные изменения, ведущие к взаимодействию прогестерон-РПкомплекса с прогестерон-чувствительными элементами в промоторах таргетных генов и, как следствие, к биологическому ответу в организме. Ранее нами создан новый перспективный класс аналогов природного гормона прогестерона, содержащего дополнительное шестичленное кольцо D', конденсированное с кольцом D стероидного скелета природного стероида, названный нами пентаранами. (Рис.1) O C A D B O прогестерон 19 11 1 21 O 21 18 19 13 D 9 2 10 6 13 10 15 7 5 4 20 D 9 2 3 3 AcO 11 1 14 8 O 18 12 20 12 O 5 D' 14 8 6 17 16 15 H 7 4 Как показал проведенный нами докинг (компьютерное моделирование) этих стероидов в лиганд-связывающий домен рецептора прогестерона, наличие дополнительного кольца умножает гидрофобные контакты с аминокислотными остатками при полной аналогии конформации молекулы данного стероида с конформацией природного гормона прогестерона. Одним из наиболее перспективных пентаранов оказался 6α-метил-16α,17α-циклогексанопрогестерон (мецигестон), использование которого не сопровождается вредными побочными эффектами, характерными для известных прогестинов: Он не имеет ни андрогенной, ни анаболической, ни эстрогенной активностей. Препарат не токсичен даже в дозах в 50 раз превышающей эффективную терапевтическую, не обладает эмбриотоксическим, мутагенным и тератогенным действием, не влияет на морфологическую картину и биохимические показатели крови. Мецигестон прошел доклинические и клинические исследования, рекомендован для использования в качестве лекарственного средства. В настоящее время разрабатываются современные нано-формы этого препарата, использование которых позволяет увеличить биодоступность (а следовательно и уменьшить терапевтическую дозу) в 8-10 раз. Имея в своем распоряжении серии 16α,17α-циклоалканопрогестеронов, мы провели анализ связи структура-активность применительно к набору пентаранов методом молекулярного моделирования. Всего в качестве обучающей выборки мы использовали данные о структуре 42 различных 16α,17α-циклоалканопрогестеронов и их величинах аффинности к рецептору прогестерона. Синтез и биологическое тестирование этих пентаранов были выполнены нами ранее [9-12]. Поскольку кристаллическая структура комплекса лиганд-связывающего домена (LBD) РП была известна, мы использовали метод молекулярного докинга для исследования конформаций пентаранов. В докинге решается двойная задача: размещение лиганда в активном центре белка-мишени и оценка энергии взаимодействия комплекса белок-лиганд. В итоге формируется большое число промежуточных структур комплексов с различными конформациями лиганда, затем с помощью оценочных функций энергий взаимодействия отбираются конформации с наименьшими значениями энергий связывания. По этим данным был построен набор моделей, предсказывающих аффинность лигандов к рецептору прогестерона. Наилучший результат (Q2=0,91) был получен при использовании комбинации методов молекулярного докинга, симуляции молекулярной динамики и искусственных нейронных сетей. Хорошая предсказательная сила этой модели была подтверждена на группе из 8 синтезированных отдельно и проверенных in vitro пентаранов (R2 тестирования равно 0,77). Эту предсказательную модель можно в дальнейшим использовать для определения степени сродства лиганда к рецептору и точного ранжирования соединений по связыванию. На основании полученных результатов мы разработали и осуществили направленный синтез новых стероидных структур с увеличенной (по сравнению с природным гормоном) гидрофобной поверхностью стероидного скелета за счет введения неполярных заместителей при сохранении основной геометрии молекулы стероида. Базовые структуры новых стероидных соединений представлены на рисунке O OH O C A O C D B A O C D A B D B O Далее мы предположили, что пентациклические стероиды с ароматическим кольцом A и дополнительным шестичленным кольцом, благодаря увеличенной гидрофобной поверхности стероидного остова и наличия фенольного гидроксила в 3-м положении, могут служить лигандами рецептора эстрогенов (РЭ) и, что самое главное, проявить эстрогенную и антиэстрогенную активность. Последняя особенно интересна в свете лечения подобными соединениями метастазирующих опухолей. Исходным соединением для получения таких структур служит стероидный диенофил, реакция Дильса-Альдера которого с бутадиеном дает пентациклическую структуру. O O CH3 O HO CH3 O CH3 O R O HO R' R'' R, R' = H, Me, Et, OMe R'' = H2, O, CH2/CH3 Используемый нами выше традиционный путь синтеза пентациклических стероидов, основанный на реакции Дильса-Альдера позволяет синтезировать лишь один тип пентаранов. Мы предприняли попытку расширить круг этих соединений используя реакцию Назарова. Для этого был получен ряд исходных соединений (халконов) по схеме: Далее мы исследовали поведение этих веществ в условиях реакции Назарова с использованием различных катализаторов: кислот Льюиса и кислот Бренстеда. Оказалось, что используемые катализаторы могут координально менять направление реакции и в результате был получен широкий ряд ранее неизвестных структур: O Brensted' acid Lewis' acid O Ar O O S Ar O HO O Ar O CF3CO2H O CF3 CH3SO3H CHCl3 BF3*Et2O HO O CH2Cl2 O Cl O Ar H2SO4 TiCl4 or SnCl4 HO Ar C6H6 Ar HO CH2Cl2 HO Далее эти структуры были модифицированы для получения целевых пентациклических стероидов, которые были направлены на исследования их биологических свойств. Нами был разработан также альтернативный способ получения пентаранов по EWG схеме: COOEt Br O O O CuBr2 i-AmOH HO O NaH THF HO EWG HO O COOH HO HO Таким образом, нами разработаны эффективные методы получения неизвестных ранее пентациклических стероидов, что позволило расширить круг пентаранов и исследовать их биологические свойства. Литература: 1. А.В. Камерницкий, И.С. Левина. Прегна-D′-пентараны – прогестины и антипрогестины. 1. Разделение биологических функций стероидных гормонов. Биоорган.химия, 2005, 31, № 2, 115-129. 2. А.В. Камерницкий, И.С. Левина. Прегна-D′-пентараны – прогестины и антипрогестины. 2. Пути и механизмы осуществления стероидными гормонами отдельных биологических функций. Биоорган.химия, 2005, 31, № 3, 227-238. 3. И.В. Федюшкина, В.С. Скворцов, И.В. Ромеро-Рейес, Молекулярный докинг и 3DQSAR производных 16α,17α-циклогексанопрогестерона как лигандов рецептора прогестерона. Биомедицинская химия, 2014, 8,168-176. 4. О.В. Лисанова, Т.А. Щелкунова, И.А. Морозов, П.М. Рубцов, И.С. Левина, Л.Е. Куликова, А.Н. Смирнов. Подходы к конструированию избирательных лигандов мембранного рецептора прогестерона альфа. Биохимия, 2013, 78(3), 320-328. 5. В.А. Золотцев, И.В. Заварзин, В.З. Ширинян, И.С.Левина. Синтез E- и Zизомерных 3-O-метилоксимов прогестерона. Изв. АН. Сер. хим., 2013, № 9, 2086-7. 6. А.В. Поликарпова, И.С. Левина, А.Н. Смирнов. 3-O-Метоксииминогруппа подавляет взаимодействие прогестинов с транскортином крови. Биохимия, 2013, 78(10), 1448-51. 7. I.S. Levina, T.A. Shchelkunova, P.M. Rubtsov, A.V. Kamernitsky, A.N. Smirnov Pregna-D′-pentarane strucnure influences progesterone receptor affinity for DNA. Steroids, 2002, 67,323-332. 8. E.V. Pokrovskaya, V.P. Shevchenko, A.V. Kamernitsky, I.S. Levina, A.N. Smirnov. DNA slows dissociation of progesterone receptor ligand complexes. Steroids, 2003, 68, 351-359. 9. I.S. Levina, E.V. Pokrovskaya, L.E. Kulikova, A.V. Kamernitsky, V.V. Kachala, A.N. Smirnov 3- and 19-Oximes of 16α,17α-cyclohexanoprogesterone derivatives and interactions with progesterone receptor and other proteins. Steroids, 2008, 73, 815-27. 10. А.В. Семейкин, И.С. Левина, Л.Е. Куликова, В.Б. Ветчинкина, К.А. Атрошкин, В.В. Банин, Н.Л. Шимановский Изучение влияния новых прогестинов ряда пентаранов на жизнеспособность, экспрессию рецептора эпидермального фактора роста и апоптоз клеточных структур HeLa и MCF-7. Хим.-фарм.ж. 2008, 42, №5, 27-9. 11. И.С. Левина, Л.Е. Куликова, Е.В. Шулишов, Ю.В. Томилов, А.Н. Смирнов Синтез, структура и биологические свойства замещенных [16α,17α]-цикло-пропапрегн-4-ен-3,20дионов. Изв. АН. Сер.хим., 2013, № 6, 1449-53. 12. В.П. Шевченко, И.Ю. Нагаев, И.С. Левина, Л.Е. Куликова, А.В. Камерницкий, Н.Ф. Мясоедов Синтез O-замещенных 3-оксимов 6α-метил-16α,17α-циклогексанопрегн-4ен-3,,20-диона, содержащих тритиевую метку в положении 1,2. Биоорган.химия, 2010, 36, № 2, 283-88. 13. Е.В. Покровская, И.С. Левина, Л.Е. Куликова, А.В. Камерницкий, А.Н. Смирнов Структурные детерминанты стероидов ряда 16α,17α-циклогексанопрегнанов и изучение их взаимодействия с белками цитозоля матки и сыворотки крови крысы. Биоорган.химия, 2004, 30, № 3, 301-307. 14. А.Н. Смирнов, Е.В. Покровская, И.С. Левина, Л.Е. Куликова, А.В. Камерницкий, В.П. Шевченко Видовые и тканевые особенности распределения белков, связывающих 16α,17α-циклоалкановые производные прогестерона. Биоорган.химия, 2002, 28, № 3, 251257. Лаборатория органического электросинтеза № 37 НОВАЯ КОНЦЕПЦИЯ НУКЛЕОФИЛЬНОГО АРОМАТИЧЕСКОГО ЗАМЕЩЕНИЯ — SNH (An) РЕАКЦИИ В.А. Петросян, В.А. Кокорекин, Б.В. Лялин Аннотация Реакции электрофильного и нуклеофильного замещения обладают важнейшим фундаментальным и прикладным значением в химии ароматических систем. Особый интерес, в том числе с позиций зеленой химии, вызывают реакции электрофильного и нуклеофильного замещения водорода (SNH реакции). Однако реализация последних путем удаления водорода в виде гидрид иона от промежуточного Н аддукта маловероятна. Основные же методы решения этой проблемы (окислительные SNH реакции, викариозное замещение) имеют ряд ограничений, поэтому в литературе специально отмечено, что «эффективное решение данной проблемы открыло бы новые горизонты в химии ароматических соединений». В связи с этим в настоящей работе изложена и экспериментально обоснована (Схема 1) новая концепция нуклеофильного ароматического замещения, впервые предложеннная в 2011г. Ï î ñòðî åí èå Ñ-Ñ, Ñ-Î , Ñ-N è äð. ñâÿçåé H H Nu Ñõåì à 1 SN ðåàêöèè [O] [ H ] R H Nu + SN (An) ðåàêöèè [e] H+ + Nu R O. Í . × ÓÏ ÀÕÈÍ , È. ß . Ï Î ÑÒÎ ÂÑÊÈÉ, Nu (àí î äí î å çàì åù åí èå) R Â.À. Ï ÅÒÐÎ Ñß Í Mendeleev Commun, 2011, 21, 115. Óñï . Õèì èè, 1976, 45, 908. Это плод многолетних усилий коллектива лаборатории по разработке методов анодной функционализации аренов. В основе концепции лежит электроиндуцированная инверсия полярности «umpolung» исходного арена (нуклеофила) с генерацией катион-радикальных (радикальных) частиц. Процесс (схема 2) протекает через образование Н+ (а не Н аддуктов) и замещаемый водород легко удаляется в виде протона. Эти реакции, обозначенные символом SNH (An), где An анод, представляют универсальный тип SNH реакций. Проведенный нами анализ закономерностей SNH (An) реакций позволил выделить два основных маршрута реализации таких процессов: с участием Nu, окисляющихся труднее аренов путь А и легче аренов путь В. ÝËÅÊÒÐÎ ËÈÇ H -e Ï ÓÒÜ A EDG Ñõåì à 2 Ï ÓÒÜ B Nu ArH+ B1 -e Nu B2 ( 2e) + Nu, -e + ÀrH, -e + EDG 2 Nu2 ÀrH Nu H Nu H+ EDG +àääóêò Согласно классификации Ингольда, процессы А и В (схема 2), независимо от механизма реализации, следует рассматривать как нуклеофильное замещение, поскольку при образовании новой связи замещающий реагент, отдавая свои электроны, ведет себя как нуклеофил. Последние годы наши усилия были связаны с развитием SNH (An) методологии на примере реализации соответствующих реакций гомо- и кросс-сочетания в ряду 5-членных азотсодержащих гетероциклов, а также азолирования, роданирования и галогенирования аренов (производные бензола, пиразола, индола, пиррола и др.) с целью создания новых подходов к синтезу веществ, представляющих практический интерес, в том числе к синтезу ранее не описанных структур. В ходе реализации этой задачи были впервые осуществлены SNH (An) процессы: - электросинтеза ранее не описанных пирролилазолов и индолилазолов, путем региоселективного кросс-сочетания соответствующих гетероциклов (выход 40-60%) ; - азолирования N,N-диметиланилина, протекающие региоселективно по метильной группе с образованием ранее не известных структур (выход до 80%). - связанные с разработкой новых подходов к электросинтезу азопиразолов, азофуразанов. - роданирования широкого ряда ароматических систем различного строения (производные бензола пиразола, индола, пиррола и др.) протекающие в мягких условиях (Т = 20 – 25 оС) региоселективно с выходом целевых продуктов 60-85%. - эффективного галогенирования, не требующего использования токсичных галогенов, неводных растворителей, удовлетворяющие требованиям «зеленой» химии и приводящие к практически ценным 4-галогенпиразолам с выходом 60-80%. На основании данных циклической вольтамперометрии получены важные результаты по закономерностям SNH (An) процессов роданирования аренов а также галогенирования пиразолов и выявлены факторы определяющие эффективность реализации этих процессов. Проведенные испытания серии синтезированных соединений выявили их высокую антибактериальную (в отношении S. aureus, E. coli) и антигрибковую активность (в отношении Candida albicans, C. tropicalis, C. kruzei, Aspergillus niger), что делает привлекательным развитие методов синтеза подобных структур. В заключении отметим, что уникальность рассмотренной концепции SNH(An)-реакций состоит в том, что, являясь реакциями нуклеофильного замещения они протекают через ключевой интермедиат электрофильного замещения аренов. Это позволяет легко удалить замещаемый водород в виде протона, существенно расширить базу исходных аренов в нуклеофильном замещении, наконец, по сравнению с SNH-реакциями SNH(An)-реакции в большей мере отвечают принципам «зеленой» химии. Они не связаны с удалением нуклеофугных групп (викариозное замещение), а перенос электрона с успехом заменяет добавку однократно используемого окислителя (окислительные SNH реакции). В целом SNH (An) методология открывает путь прямого замещения водорода на нуклеофил и является не только наиболее привлекательной версией SNH процессов, но в ряде случаев может служить практически полезной альтернативой известной методологии функционализации аренов на основе металлокомплексного катализа. И хотя SNH (An) процессы протекают обычно с меньшими выходами (40-70%) они не требуют использования подчас дорогостоящих катализаторов и галогенорганических веществ как сореагентов, а целевые продукты SNH реакций не содержат трудноудаляемых микропримесей переходных металлов. Список публикаций Статьи: 1. Б.В. Лялин, В.А. Петросян. Окисление органических соединений на NiOOHэлектроде. Электрохимия, 2010, 46, 1283. 2. V.A. Petrosyan. Reactions of anodic and chemical aromatic substitution. Mendeleev Commun., 2011, 21, 115. 3. Б.В. Лялин, В.А. Петросян. Эффект аномального протекания электрохимического галогенирования пиразолов и его причины». Изв. АН, Сер. хим., 2012, 61, 206. 4. V.L. Sigacheva, V.A. Kokorekin, Y.A. Strelenko, S.V. Neverov, V.A. Petrosyan Electrochemical Azolation of N-substituted Pyrroles: A New Case in SNH(An) Reactions Mendeleev Commun., 2012, 22, 270. 5. Б.В. Лялин, В.А. Петросян. Электрохимическое галогенирование органических соединений. Электрохимия, 2013, 49, 563. 6. А.В. Щепочкин, О.Н. Чупахин, В.Н. Чарушин, В.А. Петросян. Прямая нуклеофильная функционализация C(sp2)-H связей в аренах и гетероаренах электрохимическими методами. Усп. хим., 2013, 82, 747. 7. Б.В. Лялин, В.А. Петросян. Закономерности электрохимического хлорирования и бромирования N-замещённых и N-незамещённых пиразолов. ХГС, 2013, 49, 1726. 8. В.А. Петросян, В.А. Кокорекин. Глава 3 в книге «Высокореакционные интермедиаты». Под ред. М. П. Егорова, М. Я. Мельникова, Москва: МГУ, 2014. 9. V.A. Kokorekin, V.L. Sigacheva, V.A. Petrosyan. New data on heteroarene thiocyanation by anodic oxidation of NH4SCN. The processes of electroinduced nucleophilic aromatic substitution of hydrogen. // Tetrahedron Lett., 2014, 55, 4306 10. Патент РФ №2523012. Способ получения N-замещенных 2,5-дитиоцианато-1Нпирролов / Терентьев А.О., Кокорекин В.А., Петросян В.А., Грамматикова Н.Э.; Патентообладатель: ИОХ РАН. Заявка №2013107735; дата подачи заявки 22.02.2013; опубликовано 20.07.2014, Бюл. №20. Тезисы докладов: 1. V.A. Petrosyan. Anodic and chemical aromatic substitution. International Congress on Organic Chemistry (Butlerov Congress). Book of abstracts. Kazan, 2011, p. 447. 2. В.А. Петросян. Анодное замещение аренов – особый вид SNH реакций. XIX Менделеевский съезд по общей и прикладной химии. Тезисы докладов. Волгоград, 2011, т. 1, с. 74. 3. В.А. Кокорекин, В.А. Петросян. Электроиндуцированное гомолитическое роданирование аренов. VI Всероссийская конференция-школа «Высокореакционные интермедиаты химических и биохимических реакций». Тезисы докладов. Московская область, 2011, с. 23. 4. В.А. Петросян. Электроиндуцированные реакции замещения водорода в органическом синтезе. VII Всероссийская с международным участием школа по электрохимии органических соединений (ЭХОС – 2012). Тезисы докладов. Тамбов, 2012, с. 20. 5. В.А. Кокорекин. Прямое электрохимическое азолирование и тиоцианирование аренов. VII Всероссийская с международным участием школа по электрохимии органических соединений (ЭХОС – 2012). Тезисы докладов. Тамбов, 2012, с. 94. 6. В.А. Кокорекин, Г.В. Раменская, Г.М. Родионова, В.А. Петросян. Электросинтез биологически активных веществ на основе роданирования и азолирования гетероаренов. IV международная научно-практическая конференция "Высокие технологии, фундаментальные и прикладные исследования в физиологии, медицине, фармакологии". Тезисы докладов. Санкт-Петербург, 2012, т. 1, с. 40. 7. В.А. Петросян, О.Н. Чупахин. Электроокислительное прямое замещение водорода в аренах и гетероаренах на нуклеофил - особый вид SNH реакций. III международная научная конференция «Новые направления в химии гетероциклических соединений». Тезисы докладов. Пятигорск, 2013, с. 56. 8. В.А. Кокорекин, С.В. Коркач, И.В. Стаценко, В.А. Петросян. Развитие новых SNH(Аn) процессов азолирования и роданирования гетероаренов. III международная научная конференция «Новые направления в химии гетероциклических соединений». Тезисы докладов. Пятигорск, 2013, с. 202. 9. Б.В.Лялин, В.А. Петросян. Новые примеры электроиндуцированных процессов замещения водорода в аренах (SNH An реакции). III всероссийская (с международным участием) научная конференция «Успехи синтеза и комплексообразования». Тезисы докладов. Москва, 2014, ч. 1, с. 28. 10. В.А. Кокорекин, В.Л. Сигачева, Р.Р. Яубасарова, В.А. Петросян. Развитие методологии SNH(Аn)-процессов. Новые примеры азолирования и роданирования аренов и гетероаренов. VIII Всероссийское совещание с международным участием «Новости электрохимии органических соединений» (ЭХОС – 2014). Тезисы докладов. Тамбов, 2014, с. 17. Дополнительные материалы H 1. Концепция SN (An) реакций, положенная в основу настоящей конкурсной работы, явилась составной частью цикла работ Г.И. Никишина, В.А. Петросяна, М.Н. Элинсона «Новые методы органического электросинтеза», получивших премию им. Н.Д. Зелинского Российской Академии наук за 2011 г. 2. Концепция SNH (An) реакций включена в список важнейших результатов фундаментальных исследований ИОХ РАН за 2011г. Лаборатория катализа переходными металлами и их соединениями № 38 КАТАЛИТИЧЕСКИЕ РЕАКЦИИ КОНВЕРСИИ S-СОДЕРЖАЩИХ СОЕДИНЕНИЙ НЕФТИ, СИНТЕЗ-ГАЗА И ПРОДУКТОВ ЕГО ПРЕВРАЩЕНИЙ НА СУЛЬФИДАХ ПЕРЕХОДНЫХ МЕТАЛЛОВ В.М. Коган, В.С. Дорохов, Е.А. Пермяков АННОТАЦИЯ Катализаторы на основе дисульфида молибдена промотированного переходными и щелочными металлами проявляют активность в реакциях гидрообессеривания, конверсии синтез-газа в спирты и их дальнейшее превращение в другие оксигенаты. На основании исследований структуры и каталитической активности сульфидных катализаторов нами была разработана концепция динамической природы активных центров (АЦ) сульфидных катализаторов (концепция межслойной динамики). Данная концепция легла в основу «динамической» модели, согласно которой АЦ, образующиеся и функционирующие в условиях реакции, способны осциллировать между слоями промотированного сульфида молибдена. Настоящая модель предполагает существование «быстрых» и «медленных» АЦ и их взаимное превращение вследствие обратимой миграции атомов серы и промотора между слоями кристаллита дисульфида молибдена в атмосфере водорода. Частота таких миграций (осцилляций) определяет активность катализатора. Предложенная модель позволяет выработать критерии оценки эффективности работы катализаторов гидрообессеривания различного вида углеводородного сырья и синтеза спиртов из синтезгаза. На основании концепции межслойной динамики нами предложены механизмы реакции гидрогенолиза сероорганики, конверсии синтез-газа в оксигенаты и дальнейших их превращений. Результаты работы изложены в следующих публикациях: 1. P.A. Nikulshin, V.A. Salnikov, A.V. Mozhaev, P.P. Minaev, V.M. Kogan, A.A. Pimerzin, Relationship between active phase morphology and catalytic properties of the carbon–aluminasupported Co(Ni)Mo catalysts in HDS and HYD reactions, Journal of Catalysis 309 (2014) 386– 396. http://linkinghub.elsevier.com/retrieve/pii/S0021951713003710, DOI: 10.1016/j.jcat.2013.10.020. IF : 5.787. 2. В. М. Коган, П. А. Никульшин, В. С. Дорохов, Е. А. Пермяков, А. В. Можаев, Д. И. Ишутенко, О. Л. Елисеев, Н. Н. Рождественская, А.Л. Лапидус. Современные представления о катализе сульфидами переходных металлов реакций гидроочистки и синтеза спиртов из синтез газа, Известия Академии Наук. Серия Химическая, 63 (2) (2014) 332–345. [V.M. Kogan, P.A. Nikul´shin, V.S. Dorokhov, E.A. Permyakov, A.V. Mozhaev, D.I. Ishutenko, O.L. Eliseev, N.N. Rozhdestvenskaya, A.L. Lapidus. Modern concepts on catalysis of hydroprocessing and synthesis of alcohols from syngas by transition metal sulfides, Russian Chemical Bulletin, International Edition, 63 No. 2 (2014) 332—345. DOI: 1066.5285.14.6302.0332] 3. В.С. Дорохов, Д.И. Ишутенко, П.А. Никульшин, К.В. Коцарева, Е.А. Трусова, Т.Н. Бондаренко, О.Л. Елисеев, А.Л. Лапидус, Н.Н. Рождественская, В.М. Коган, Изучение превращения синтез-газа в спирты на нанесенных CoMo-сульфидных катализаторах, промотированных калием, Кинетика и катализ 54 (2) (2013) 253–262. http://elibrary.ru/item.asp?id=18850644, DOI: 10.7868/S0453881113020044. IF: 0.638. 4. В.С. Дорохов, Д.И. Ишутенко, П.А. Никульшин, О.Л. Елисеев, Н. Н. Рождественская, В.М. Коган, А.Л. Лапидус, Механизм превращения синтез-газа в спирты на сульфидах переходных металлов Доклады Академии наук Сер. хим. 451 (3) (2013) 291– 295. http://www.maik.ru/cgiperl/search.pl?type=abstract&name=danchem&number=7&year=13&page=191. DOI: 10.7868/S0869565213210123. IF: 0.513. 5. V.M. Kogan, P.A. Nikulshin, N.N. Rozhdestvenskaya, Evolution and interlayer dynamics of the active sites of the promoted TMS catalysts under HDS conditions, Fuel 100 (2012) 2-16. http://linkinghub.elsevier.com/retrieve/pii/S0016236111007101, DOI: 10.1016/j.fuel.2011.11.016. IF : 3.357. 6. П.А. Никульшин, А.В. Можаев, А.А. Пимерзин, Н.Н. Томина, В.В. Коновалов, В.М. Коган, Кобальтовые соли декамолибдодикобальтовой гетерополикислоты Н6[Co2Mo10O38H4] как предшественники высокоактивной CoMoS фазы II типа катализаторов гидроочистки, Кинетика и катализ 52 (6) (2011) 884 – 898. http://elibrary.ru/item.asp?id=17238606, DOI: 10.1134/S0023158411060152. IF: 0.638. 7. P.A. Nikulshin, N.N. Tomina, A.A. Pimerzin, A.Yu. Stakheev, I.S. Mashkovsky, V.M. Kogan, Effect of the second metal of Anderson type heteropolycompounds on hydrogenation and hydrodesulphurization properties of XMo6(S)/Al2O3 and Ni3-XMo6(S)/Al2O3 catalysts. Applied Catalysis A: General 393 (2011) 146–152. http://www.sciencedirect.com/science/article/pii/S0926860X10008008, http://linkinghub.elsevier.com/retrieve/pii/S0926860X10008008, DOI: 10.1016/j.apcata.2010.11.033 IF: 3.410 8. V.M. Kogan, P.A. Nikulshin, On the Dynamic Model of Promoted Molybdenum Sulfide Catalysts. Catalysis Today 149 (2010) 224–231. http://www.sciencedirect.com/science/article/pii/S0920586109001746, http://linkinghub.elsevier.com/retrieve/pii/S0920586109001746, DOI: 10.1016/j.cattod.2009.03.023, IF: 2.980 9. P.A. Nikulshin, N.N. Tomina, A.A. Pimerzin, A.V. Kucherov, V.M. Kogan, Investigation into the effect of the intermediate carbon carrier on the catalytic activity of the HDS catalysts prepared using heteropolycompounds, Catalysis Today 149 (2010) –82–90. http://www.sciencedirect.com/science/article/pii/S0920586109006695, http://linkinghub.elsevier.com/retrieve/pii/S0920586109006695, DOI: 10.1016/j.cattod.2009.11.016, IF: 2.980 10. P.A. Nikulshin, A.V. Mozhaev, K.I. Maslakov, A.A. Pimerzin, V.M. Kogan, Genesis of HDT catalysts prepared with the use of Co2Mo10HPA and cobalt citrate: Study of their gas and liquid phase sulfidation, Appl. Catal. B Environ. 158-159 (2014) 161–174. http://linkinghub.elsevier.com/retrieve/pii/S0926337314002306 DOI: 10.1016/j.apcatb.2014.04.013. 11. Е. А. Пермяков, В. Н. Солкан, В. М. Коган, Роль SH-групп и хемосорбированного водорода в образовании вакансий серы на ребре кристаллита дисульфида молибдена, Кинетика и катализ 56 № 2 (2015) В ПЕЧАТИ. Лаборатория каталитических реакций окислов углерода № 40 ГИДРОКСИКАРБОНИЛИРОВАНИЕ БЕНЗИЛХЛОРИДОВ НА ПАЛЛАДИЕВЫХ КАТАЛИЗАТОРАХ В СРЕДЕ ИОННЫХ ЖИДКОСТЕЙ Т.А.Бондаренко, О.Л. Елисеев, Р.В. Казанцев, А.Л. Лапидус АННОТАЦИЯ Изучено карбонилирование первичных и вторичных бензилгалидов в ионных жидкостях в присутствии безлигандного палладия. Стабилизация металла в отсутствие лиганда достигается благодаря образованию суспензии наночатиц в реакционной среде (ионной жидкости). Безлигандный палладий более активен, чем традиционные каталитические предшественники — комплексы Pd(II) и Pd(0) с трифенилфосфином. Для проведения реакции не требуется стехиометрического количества основания, в отличие от традиционных методик карбонилирования галогенидов в стандартных растворителях. Осуществлен препаративный каталитический синтез ряда арилуксусных кислот с высокими выходами. Список публикаций 1. A.L. Lapidus, O.L. Eliseev, T.N. Bondarenko, N.H. Chau, R.V. Kazantsev, Exceptionally simple catalytic system for the carbonylation of benzyl halides. Mendeleev Comm., 2009, 19, 256. 2. A.L. Lapidus, O.L. Eliseev, T.N. Bondarenko, N.H. Chau, Hydroxycarbonylation of benzylic derivatives in ionic liquid media. DGMK/SCI-Conference “Future Feedstocks for Fuels and Chemicals”. September 29 – October 1, 2008, Berlin, Germany. Proceedings, p. 249. Лаборатория математической химии и компьютерного синтеза № 44 НЕДОСТАТОЧНАЯ АДЕКВАТНОСТЬ ПРИБЛИЖЕНИЯ ХАРТРИ-ФОКА ПРИ АПРИОРНОМ ОПРЕДЕЛЕНИИ УЗЛОВЫХ ПОВЕРХНОСТЕЙ МНОГОЭЛЕКТРОННЫХ ВОЛНОВЫХ ФУНКЦИЙ Н.Д Чувылкин., В.А. Морозов, И.Д. Нестеров АННОТАЦИЯ Построение пробных волновых функций t – одна из первостепенных проблем при проведении квантово-химических расчетов не только сложных многоэлектронных систем, но даже, казалось бы, достаточно простых объектов, к числу которых относятся атомы He и Li и молекулы Н2 и LiH. При этом особая роль отводится выбору таких граничных условий, которые были бы наиболее близки к «шредингеровским» (т.е. истинным, присущим точным решениям уравнения Шредингера). Указанная проблема остается исключительно важной и до сих пор интригующей при обращении к квантовым методам Монте-Карло (QMC). В этих методах данная проблема обходится посредством допущения о наличии фиксированных непреодолимых границ для вымышленных положительных и отрицательных «блуждателей» (walkers), заключенных в раздельных областях пространства, причем нередко используются фиксированные узловые поверхности, полученные в приближении Хартри–Фока. Однако важно иметь в виду, что такие поверхности могут сильно отличаться от шредингеровских. Об этом, в частности, свидетельствует медленная сходимость процедуры конфигурационного взаимодействия (CI), ибо нужно взять очень много слэтеровских детерминантов (узловые поверхности которых почти никогда не совпадают), чтобы приблизиться к шредингеровской узловой поверхности. На основе гипотезы запрета эквипотенциальных поверхностей (ГЗЭП), проясняющей физический смысл принципа Паули, показана недостаточная адекватность хартрифоковских узловых поверхностей на примерах возбужденных триплетных состояний двухэлектронных атома He (3S) и молекулы Н2 (3u+), а также основных состояний трехэлектронного атома Li (2S) и четырехэлектронной молекулы LiH. Эти системы являются традиционно-представительными в квантовой химии тестовыми объектами, на примере которых апробируются концепции и создаваемый арсенал квантово-химических методов. Показано, что приближение Хартри–Фока, в отличие от метода многоэлектронных волновых функций (МВФ), не способно отразить зависимость узловых поверхностей МВФ от зарядов ядер атомов молекулы и эффектов корреляции в движении электронов с противоположно ориентированными спинами, поскольку такие поверхности предопределены математическими свойствами слэтеровских детерминантов, а не физически наглядными и более практичными алгебраическими произведениями разностей электростатических потенциалов. Безусловно, ГЗЭП нуждается в дальнейшем подтверждении и развитии. Однако в любом случае сама постановка вопроса, отраженного в ГЗЭП, сохранит свою актуальность и его рассмотрение дополнительно обогатит современную квантовую химию полезным опытом поиска принципиально новых путей и подходов, альтернативных приближению Хартри–Фока. Список публикаций 1. 2. 3. Н. Д. Чувылкин, Е. А. Смоленский, Н. С. Зефиров. Недостаточная адекватность узловых поверхностей многоэлектронных волновых функций в приближении Хартри–Фока. Докл. АН. 2010. Т. 434. № 3. С. 339–341. N. D. Chuvylkin, E. A. Smolenskii, M. S. Molchanova, N. S. Zefirov. Geometrical Properties of Nodal Surfaces of Many-Electron Wave Functions. Intern. J. Quant. Chem. 2010. V. 110. P. 1809–1819. Н. Д. Чувылкин, Е. А. Смоленский, И. В. Кузьмин, Н. С. Зефиров. Узловые 3 4. 5. 6. 7. 8. + поверхности волновых функций молекулы водорода в триплетном состоянии u . Изв. АН. Сер. хим. 2010. №10. С. 1955–1958. Н. Д. Чувылкин, Е. А. Смоленский. Априорное определение узловых поверхностей пробных волновых функций атома лития. Изв. АН. Сер. хим. 2012. №3. С. 649–652. Н. Д. Чувылкин, Е. А. Смоленский, И. В. Кузьмин. Априорное определение узловых поверхностей пробных волновых функций молекулы гидрида лития. Изв. АН. Сер. хим. 2013. №11. С. 2547–2550. Н.Д. Чувылкин, Е.А. Смоленский, В.А. Морозов, Н.С. Зефиров. Априорное определение узловых поверхностей многоэлектронных волновых функций. Тез. докл. ХХII Симпозиума «Современная химическая физика». Туапсе. 2010. с 68. Н. Д. Чувылкин, Е. А Смоленский, Н. С. Зефиров Моделирование геометрических свойств узловых поверхностей многоэлектронных волновых функций. Тезисы докладов 7-й Всероссийской конференции «Молекулярное моделирование». Москва. 13–15 апреля 2011. с. 39. Н. Д. Чувылкин, Е. А. Смоленский, В. А. Морозов Недостаточная адекватность узловых поверхностей пробных многоэлектронных волновых функций в приближении Хартри–Фока. Тез. докл. ХХII Симпозиума «Современная химическая физика». Туапсе. 2010. с 68. Лаборатория математической химии и компьютерного синтеза № 44 ФОРМАЛЬНАЯ ХИМИЧЕСКАЯ КИНЕТИКА И ПРИНЦИП ДЕТАЛЬНОГО РАВНОВЕСИЯ Е.А. Смоленский АННОТАЦИЯ В данной работе впервые найдено необходимое и достаточное условие химического равновесия. Показана его эквивалентность принципу детального равновесия для систем, в которых отсутствуют циклические превращения типа. Проведён анализ определений химического равновесия, используемых в современной химической науке. Методами формальной кинетики доказано, что в системах с циклическими превращениями принцип детального равновесия не является необходимым условием химического равновесия с точки зрения формальной кинетики, т.е. в состоянии равновесия не обязательно выполняется равенство скоростей прямой и обратной реакции для каждой отдельной стадии химического процесса. Приведены примеры систем, применение к которым принципа детального равновесия не является оправданным. Сформулировано правило циклов: если в системе реакций присутствуют циклические превращения, то для этой системы принцип детального равновесия нельзя считать заведомо справедливым. Лаборатория каталитических реакций окислов углерода № 40 Лаборатория математической химии и компьютерного синтеза № 44 ПРОГНОЗИРОВАНИЕ ЭНТАЛЬПИЙ ОБРАЗОВАНИЯ АЛКАНОВ С ПОМОЩЬЮ ОПТИМАЛЬНЫХ ТОПОЛОГИЧЕСКИХ ИНДЕКСОВ А.Н. Рыжов, И.В. Чуваева АННОТАЦИЯ В данной работе предложен новый способ расчёта стандартных энтальпий образования алканов (далее – энтальпий) на основе метода оптимальных топологических индексов (ОТИ). Выведены формулы для расчёта энтальпий по структурным параметрам молекул алканов, обладающие оптимальными для прогноза статистическими характеристиками и значительно превосходящие по точности известные ранее схемы. Показано, что с ростом числа атомов углерода в гомологических рядах алканов наблюдается снижение удельной молярной и увеличение удельной массовой энтальпии. Доказано, что среди же изомеров наименьшим значением энтальпии обладает алкан с наибольшим числом метильных групп, а наибольшим – алкан нормального строения. Доказано, что среди алканов, являющихся жидкостями в стандартных условиях, наименьшей удельной массовой энтальпией в расчёте на единицу массы обладает метилбутан (-0,595 кДж/г) и только он, т.е. существование жидкого в стандартных условиях алкана, обладающего ещё более низким значением данной величины, невозможно. Сформулирована и доказана теорема о линейности моделей, определяющая границы достоверности прогноза методом ОТИ. Высокая эффективность предложенного метода построения расчётных моделей для решения задач «структура – свойство» позволяет предположить возможность его применения для построения моделей других физико-химических свойств не только алканов, но и широкого круга различных органических соединений. Результаты работы могут быть использованы для прогноза стандартных энтальпий образования алканов с высокой степенью достоверности.